1. Cancer de l’œsophage et de la jonction œso-gastrique
(Dernière mise à jour le : )Groupe de travail et relecteurs
Groupe de travail :
G Piessen, coordonnateur (Lille), JL Raoul (Nantes), F El Hajbi (Lille), V Lepilliez (Lyon), P Lesueur (Caen- Le Havre), P Maingon (Paris), D Pannier (Lille), AA Serre (Lyon), M Vermersch (Lille), E Vaillant (Marcq-en-Barœul), L Quero (Paris), T Voron (Paris), M Barret (Paris), F Renaud (Lille), D Tougeron (Poitiers), J Veziant (Lille)
Relecteurs :
T Aparicio (Paris), A Adenis (Montpellier), O Bouché (Reims), N Carrere (Toulouse), T Conroy (Nancy), G Crehange (Paris), PL Etienne (Plerin), R Flamein (Montpellier), C de la Fouchardière (Lyon), MP Galais (Caen), S Gaujoux (Paris), P Guillet (Toulon), F Huguet (Paris), J Jézéquel (Brest), P Mariani (Paris), J Quénéhervé (Brest)
Comment citer ce chapitre :
Veziant J, Bouché O, Aparicio T, Barret M, El Hajbi F, Lepilliez V, Lesueur P, Maingon P, Pannier D, Quero L, Raoul JL, Renaud F, Seitz JF, Serre AA, Vaillant E, Vermersch M, Voron T, Tougeron D, Piessen G. Esophageal cancer - French Intergroup Clinical Practice Guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, SFP, RENAPE, SNFCP, AFEF, SFR). Dig Liver Dis. 2023 Aug 25:S1590-8658(23)00767-3. doi: 10.1016/j.dld.2023.07.015. Epub ahead of print. PMID: 37635055.
Méthodologie de la recherche bibliographique :
Ce travail porte sur les tumeurs de l'œsophage et de la jonction œso-gastrique (JOG) dont l'épicentre est situé à moins de 2 cm de la limite proximale gastrique (UICC 8ème édition, Rice et al, 2017a. Concernant les tumeurs de la JOG dont l’épicentre est à plus de 2 cm de la limite proximale gastrique, elles sont à traiter comme un cancer gastrique et sont détaillées dans le chapitre 2 du TNCD (Zaanan et al, 2018). Ce travail est fondé sur les versions précédentes du thésaurus, les recommandations de l’Institut national du cancer, la recherche des données récentes à partir de la base Medline interrogée de septembre 2016 à avril 2022 par le moteur de recherche PubMed en utilisant les mots-clés « esophageal cancer », "esogastric junction cancer" « esophageal cancer incidence », « early esophageal cancer », « esophageal cancer chemotherapy», "esophageal cancer and radiotherapy" « esophageal cancer surgical treatment ». Ont été intégrés les résultats des études non encore publiées mais présentées en communication orale à l’« American Society of Clinical Oncology, Annual Meeting », l’« American Society of Clinical Oncology, GI symposium », ou l’« European Society of Medical Oncology ».
1.1. Epidémiologie et pronostic
A l’échelle mondiale, le nombre de nouveaux cas en 2020 était de de 604 100 cas dont 418 400 chez l’homme et 185 800 chez la femme ce qui correspond au 7ème cancer en termes d’incidence (Ferlay et al, 2021), alors qu’en France le cancer de l’œsophage touche chaque année près de 5445 personnes (données 2018).
Le cancer de l’œsophage est responsable de 509 000 décès par an dans le monde (6ème rang des décès par cancer).
- Le carcinome épidermoïde est lié à l’alcool et au tabac ou à la consommation régulière de boissons ou d’aliments chauds (Chen et al, 2015). En France, son incidence a été divisée par trois entre 1990 et 2018 mais il reste prédominant (3224 cas dont 72% chez l’homme) malgré une augmentation de l’incidence des adénocarcinomes (2074 cas dont 87 % chez l’homme) dans les deux sexes sur la même période (Abnet et al, 2018; Defossez et al, 2021).
- L’adénocarcinome est développé au niveau du bas œsophage sur une muqueuse métaplasique de type glandulaire (Paris Workshop on Columnar Metaplasia in the Esophagus and the Esophagogastric Junction, Paris, France, December 11-12 2004, 2005; Lambert & Hainaut, 2007) et est lié au reflux gastro-œsophagien, à l’excès alimentaire, aux calories d’origine animale (viande) et à l’insuffisance d’activité physique, d’où la relation avec l’excès de poids et l’obésité (Whiteman et al, 2008). Plus de 95% des adénocarcinomes du bas œsophage sont associés à un endobrachyoesophage (muqueuse métaplasique au-dessus de la ligne Z). Toutes ces caractéristiques expliquent que l’incidence de l’adénocarcinome est en constante évolution dans les pays développés et dépasse celle du carcinome épidermoïde notamment aux Etats-Unis, en Suède ou aux Pays-Bas (Coleman et al, 2018).
Le pronostic de ce cancer est sombre du fait d’un diagnostic tardif et du terrain souvent défavorable, avec dans 12 à 17% des cas, un cancer ORL associé. Selon les données de l’Institut National du Cancer issues de patients diagnostiqués entre 2010 et 2015 (Defossez G, Le Guyader-Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Synthèse. Saint-Maurice : Santé publique France, 2019.), la survie nette standardisée à 5 ans (survie que l’on observerait si le cancer était la seule cause de décès) est de 16 % chez l’homme et de 20 % chez la femme. Cette survie nette à 5 ans, même si elle reste basse, s’est améliorée puisqu’elle a doublé entre 1990 et 2015, passant de 9 à 18%. La survie observée et la survie nette à 5 ans sont très proches (respectivement 14 et 16%) suggérant que les personnes atteintes d’un cancer de l’œsophage décèdent essentiellement de leur cancer dans les 5 ans après leur diagnostic.
1.2. Explorations préthérapeutiques
1.2.1. Diagnostic
Endoscopie œsogastroduodénale avec biopsies :
- Afin de préciser la localisation tumorale : mesure de la distance (en cm) du pôle inférieur et supérieur de la tumeur par rapport aux arcades dentaires et, par rapport à la bouche de Killian (important pour les tumeurs du tiers supérieur afin de pouvoir discuter des possibilités de chirurgie).
- Afin de décrire précisément l’extension circonférentielle (en pourcentage), la position et la morphologie de la lésion (Classification de Paris).
En cas d’adénocarcinome œsophagien ou de la jonction œsogastrique, une rétrovision est nécessaire afin d’évaluer le débord gastrique de la lésion et de préciser la position de la tumeur par rapport à la jonction œsogastrique en vision directe et à l’angle de His en rétrovision (cf. Classification de Siewert chapitre 3.1). L’évaluation du débord œsophagien et gastrique en centimètres est importante afin de pouvoir guider le geste chirurgical dans les tumeurs classées Siewert II. La 8ème édition de la classification TNM/UICC est plus simple en séparant œsophage et estomac par l’épicentre tumoral (Rice et al, 2017a).
- De plus, l’existence d’un œsophage de Barrett (endobrachyœsophage), la hauteur de l’atteinte circonférentielle (C) et la hauteur maximale de l’atteinte (M) par rapport à la jonction œsogastrique doivent être précisées (Classification de Prague). L’existence d’une hernie hiatale et ses mesures doivent enfin être précisées.
- La réalisation de biopsies dépendra de l’analyse endoscopique de la lésion (Pouw et al, 2021) :
- en cas de lésion potentiellement accessible à une résection endoscopique (lésion de type 0-I ou 0-II de la classification de Paris), 1 à 2 biopsies seulement seront réalisées pour ne pas compromettre la résection ultérieure.
- en cas de lésion non accessible à une résection (lésion ulcérée ou sténosante), au moins 6 biopsies seront réalisées.
Chromoendoscopie virtuelle.
La chromoendoscopie virtuelle (NBI, BLI, FICE, i-scan) est recommandée pour la détection, la caractérisation et le bilan d’extension des cancers de l’œsophage superficiels :
- dans le cas du carcinome épidermoïde, elle est aussi sensible et plus spécifique que la coloration par lugol (Iwatsubo et al, 2020) ;
- dans l’analyse d’un œsophage de Barrett, elle permet par l’analyse des motifs des cryptes et des vaisseaux (pit pattern et vascular pattern) de détecter plus de lésions dysplasiques ou néoplasiques qu’une analyse en lumière blanche avec le protocole de Seattle, tout en réalisant des biopsies ciblées moins nombreuses (Sharma et al, 2013).
Recherche de la surexpression d’HER 2 et du statut MMR tumoral pour les adénocarcinomes œso-gastriques.
- Il est recommandé d’évaluer systématiquement le statut MMR tumoral pour tous les adénocarcinomes œso-gastriques, dès le diagnostic, quels que soient le stade, l’âge et le contexte familial et personnel du patient (Évaluation du statut MMR tumoral/synthèse, Collection Recommandations et référentiels, novembre 2021), à visée thérapeutique essentiellement et oncogénétique également. La détermination du statut MMR est faite préférentiellement en immunohistochimie des 4 protéines MMR en même temps que la détermination du statut HER2. En cas de statut dMMR ou de statut MMR indéterminé le test MSI doit être réalisé pour confirmer l’instabilité microsatellitaire. Avant toute mise sous immunothérapie dans l’indication d’une tumeur MSI non résécable, un statut dMMR et MSI concordant doit être confirmé, en cas de discordance (pMMR/MSI ou dMMR/MSS) un avis de centre expert doit être demandé.
- La détermination du statut HER2 chez les patients dont le cancer de l’œsophage ou de la JOG est résécable chirurgicalement n’est pas recommandée. Cependant, pour les patients atteints d’un cancer de l’œsophage ou de la JOG avancé, dont l’état général est compatible avec un traitement systémique incluant le trastuzumab, la recherche du statut HER2 doit être effectuée et les patients doivent se voir proposer le trastuzumab en cas de surexpression de HER2 (Bartley et al, 2017).
Expression de PD-L1 (score CPS et TPS)
- Compte-tenu de son impact thérapeutique et de la possibilité d’utiliser une immunothérapie, la détermination du score CPS (combined positive score) doit être effectuée pour toutes les tumeurs oeso-gastriques non résécables. Le CPS est l’expression de PD-L1 au niveau des cellules tumorales et des cellules immunitaires intra-tumorales (nombre de cellules tumorales PD-L1+ et des cellules immunes PD-L1+ divisé par le nombre total de cellules tumorales viables).
- Le score TPS (tumor proportion score) doit être déterminé pour les carcinomes épidermoïdes pour l’indication d’une immunothérapie par nivolumab. Le TPS est l’expression de PD-L1 au niveau des cellules tumorales (% de cellules tumorales PD-L1+ divisé par le nombre total de cellules tumorales viables)
1.2.2. Bilan d'extension
Le délai entre la fin du bilan d’extension et la mise en œuvre du traitement doit être inférieur à 1 mois.
BILAN DE RÉFÉRENCE (accord d’experts)
- Interrogatoire : état général OMS, degré de dysphagie avec date de début, ATCD personnel de reflux gastro-œsophagien ou autre, consommation d’alcool (g/j) et de tabac (paquet-année)
- Examen clinique complet (notamment aires ganglionnaires cervicales, axillaires et sus-claviculaires, signes de cirrhose)
- Évaluation de l’état nutritionnel et de la sévérité de la dénutrition (cf. Chapitre 17 TNCD Nutrition et activité physique (07/11/22)) :
- Clinique : poids actuel et habituel, indice de masse corporelle (IMC), estimation du pourcentage de perte de poids sur les 1 et 6 derniers mois
- Biologique : albuminémie, pré-albuminémie
- Évaluation de l’état nutritionnel et de la sévérité de la dénutrition (cf. Chapitre 17 TNCD Nutrition et activité physique (07/11/22)) :
- Scanner thoraco-abdomino-pelvien spiralé, multibarettes, avec injection de produit de contraste iodé et opacification digestive haute
- Temps artériel tardif à l’étage thoracique (35 sec après le rehaussement de l’aorte descendante > 200UH) car temps d’acquisition correspondant au contraste le plus important entre la tumeur et l’œsophage sain (Umeoka et al, 2006)
- Distension de l’œsophage pour une meilleure visibilité des parois : produit de contraste positif ou air en l’absence de troubles de la déglutition
- Evaluation du diamètre tumoral transversal maximal et du stade ctTNM par la classification tomodensitométrique de Wurtz, modifiée par Bosset et al. (Wurtz & Chastanet, 1988; Bosset et al, 1997) (cf. ANNEXE 1).
- Evaluation des adénopathies sus et sous diaphragmatiques
- Evaluation des lésions à distance (métastases viscérales : hépatiques et pulmonaires) et de l’atteinte des organes médiastinaux contigus (aorte, arbre trachéobronchique, plèvre, péricarde…)
- Recherche des cancers épidémiologiquement associés notamment chez les patients fumeurs
- Pour une lésion du tiers supérieur : rajouter un scanner cervico-médiastinal (type ORL) avec scanner cervical en injection biphasique
Échoendoscopie œsophagienne +/- biopsie des adénopathies suspectes : cet examen, réalisé classiquement à l’aide d’un échoendoscope radial, doit préciser le stade T selon la classification TNM 8eme édition (Rice et al, 2017b) : les lésions T1 peuvent être séparées en T1a et T1b en fonction de l’invasion de la sous muqueuse ; l’atteinte de la musculeuse définit le stade T2 et contre-indique une résection endoscopique ; le stade T3 correspond à une extension tumorale au-delà de la musculeuse, et le stade T4 une extension aux organes de voisinage. Le stade N sera rapporté en précisant les aires ganglionnaires concernées, selon l’écho-anatomie médiastinale et abdominale (D’Journo, 2018). Enfin, une échoendoscopie avec ponction à l’aide d’un échoendoscope linéaire pourra être réalisée pour affirmer l’atteinte ganglionnaire si elle est techniquement possible, et cliniquement pertinente. La présence d’une sténose œsophagienne tumorale est une limite notable de l’examen échoendoscopique: en effet, si la tumeur est non franchissable, la dilatation endoscopique de la tumeur est à la fois contre-indiquée du fait du risque de perforation tumorale, et peu utile car une sténose tumorale témoigne dans 80 à 100 % des cas, d’une lésion localement avancée cT3N+ (Mariette et al, 2003; Noiret et al, 2021). Enfin, en cas de lésion métastatique l’échoendoscopie, avec ou sans ponction, n’est pas indiquée.
Dans le cas particulier des lésions superficielles (lésions Paris 0-II correspondant à des lésions Tis-T1), c’est l’exérèse endoscopique endoscopique qui réalise le meilleur staging, rendant le bilan d’extension (TDM, écho-endoscopie) superflu. (accord d’experts)
- Fibroscopie trachéo-bronchique :
- Pour tous les carcinomes épidermoïdes
- Pour éliminer une extension muqueuse trachéo-bronchique pour les cancers (peu importe le type histologique) des tiers supérieurs ou moyen
- Elle n’est pas indiquée chez les patients porteurs d’un adénocarcinome du 1/3 inférieur, non-fumeurs
- Examen ORL avec nasofibroscopie systématique sauf pour les adénocarcinomes chez les patients non-fumeurs
- Panendoscopie des voies aérodigestives supérieures pour tous les carcinomes épidermoïdes (visualisation du bas des sinus piriformes pour compléter la recherche de tumeurs synchrones et évaluation de la distance entre le pôle supérieur de la tumeur et la bouche de Killian pour les tumeurs du tiers supérieur).
- TEP-TDM au 18-FDG recommandé avant radio-chimiothérapie ou en cas de projet de traitement chirurgical (Salaün et al, 2019). Il doit également être réalisé en cas de doute sur une lésion secondaire au scanner TAP. Les modifications de la stratégie thérapeutique induite par la TEP au FDG concernent environ 30% des patients (Barber et al, 2012). Il permet ainsi de :
- Détecter des atteintes ganglionnaires régionales (rétro et para-trachéale, para-œsophagienne, espace gastro-hépatique) pour ne pas omettre une indication de traitement néoadjuvant en cas de tumeur limitée ;
- Détecter des atteintes métastatiques ganglionnaire (lombo-aortique, sus claviculaire) ou à distance (péritonéales, hépatiques et pulmonaires) qui contre indiquerait une résection chirurgicale ;
- Réaliser un ciblage précis des sites atteints (notamment ganglionnaires) avant une radiothérapie programmée (Lazarescu et al, 2013)
BILAN OPTIONNEL (avis d’experts)
- Scintigraphie osseuse, scanner cérébral, en cas de signes d’appel
- TOGD dans les tumeurs non franchissables, pour préciser l’état de l’estomac
- Échographie cervicale et des creux sus-claviculaires +/- ponction, en cas de doute sur des adénopathies
- Laparoscopie exploratrice, elle reste une option pour éliminer une carcinose péritonéale ou détecter de petites métastases hépatiques périphériques notamment en cas d’adénocarcinome volumineux (T4), de tumeur peu différenciée et/ou avec un contingent de cellules isolées. Elle permet également d’évaluer le débord gastrique d’une tumeur évoluée de la jonction œsogastrique. La présence d’ascite et/ou d’un doute sur un nodule péritonéal au scanner et d’une altération importante de l’état général doit faire proposer une laparoscopie exploratrice avant tout traitement (Simon et al, 2016)
- IRM hépatique : non indiquée dans le bilan d’extension loco-régional mais peut être utile en cas de lésion hépatique non caractérisable au scanner.
1.2.3. Bilan de l'état général et des pathologies associées
- Recherche de cancers épidémiologiquement liés
- État général (OMS ou Karnofsky, score ASA)
- Pour les patients de plus de 75 ans : Score G8 (ONCODAGE) et consultation onco-gériatrie si score G8 ≤ 14/17 (Soubeyran et al, 2014)
- Degré de dysphagie
- Pulmonaire : EFR, gazométrie
- Cardiologique : ECG, Echographie transthoracique ou scintigraphie cardiaque (préopératoire et/ou si une chimiothérapie cardiotoxique est envisagée)
- Rénale : urée, créatininémie et clairance de la créatinine
- Hépatique (hypertension portale, cirrhose, bilan biologique hépatique)
- Neurologique : neuropathie
- Consultation d’aide au sevrage tabagique et alcoolique
1.2.4. Bilan de réévaluation de la réponse thérapeutique après traitement néoadjuvant
Une réévaluation clinique et morphologique est nécessaire après le traitement néoadjuvant afin de confirmer l’indication chirurgicale 2-4 semaines après la fin du traitement ; Le but est essentiellement d’éliminer une progression métastatique ou loco-régionale qui modifierait l’indication.
En cas d’évaluation pour discuter d’une préservation d’organe celle-ci est à réaliser au minimum 4-6 semaines après la fin du traitement par chimioradiothérapie.
1.2.4.1. Réévaluation clinique
- Evolution de la dysphagie : la régression tumorale se traduit par une amélioration voire une disparition de la dysphagie
- Evaluation de la reprise pondérale
1.2.4.2 Réévaluation par scanner thoraco-abdomino-pelvien spiralé multibarettes injecté et ingéré : systématique
Une TDM doit être réalisé afin d’évaluer la réponse tumorale locale et à distance.
- Même protocole que la TDM réalisée lors du bilan initial
- Mais mauvaise corrélation avec la pathologie pour le restaging local de l’œsophage (T, N et TRG) (Konieczny et al, 2013).
- Souvent sous-estimation de la réponse thérapeutique car la persistance d’un épaississement après chimioradiothérapie d’origine inflammatoire peut être confondu avec un reliquat tumoral
- Nombreux faux positifs et faux négatifs pour le staging ganglionnaire
1.2.4.3 Réévaluation par endoscopie : optionnelle
- Pour préciser la localisation tumorale résiduelle et le débord gastrique notamment en cas de lésion non franchissable initialement pour des tumeurs de la jonction oeso-gastrique.
- Indispensable avec réalisations de biopsies en cas de discussion d’une stratégie de préservation d’organe.
1.2.4.4 Réévaluation TEP TDM
La TEP au FDG peut être proposée pour l'évaluation de la réponse à la chimioradiothérapie ou à la chimiothérapie néoadjuvante du cancer de l'œsophage (Salaün et al, 2019).
Sa valeur en tant que marqueur précoce de réponse à une chimiothérapie néoadjuvante a été largement étudiée (étude MUNICON) (Lordick et al, 2007). En l’absence de validation et de définition de seuil universel de SUV, le choix du traitement guidé par la TEP n’est pas recommandé à ce jour.
En revanche, elle aide à identifier les patients à très bon pronostic après traitement néoadjuvant, quelques travaux suggérant une modification de la stratégie de traitement (absence de chirurgie) en cas de réponse métabolique complète (SUV≤3) (Monjazeb et al, 2010). Néanmoins ces résultats préliminaires nécessitent d’être validés avant d’être mis en pratique. Mais la TEP ne peut définir à elle seule la réponse complète (Vallböhmer et al, 2009; van Heijl et al, 2011).
Après chimioradiothérapie, son intérêt pour prédire une réponse histologique est décevante (Vallböhmer et al, 2009; Piessen et al, 2013). En revanche elle permettait dans l’étude preSANO de détecter des métastases à distance intervallaires dans 9% des cas chez des patients ayant tous eu une TEP initiale suggérant l’intérêt de la répéter notamment avant chirurgie (Noordman et al, 2018a; Valkema et al, 2019).
Pour le diagnostic de récidive, la TEP apparait sensible (très peu de faux négatifs) mais peu spécifique si bien qu’une preuve histologique ou une confirmation morphologique sont nécessaires pour affirmer la récidive (Goense et al, 2015).
1.3. Classifications
1.3.1. Anatomique
- Les distances anatomiques peuvent varier en fonction des individus et doivent être confrontées aux données du scanner et TEP-scanner afin de localiser précisément la tumeur et de pouvoir adapter le traitement
- Œsophage cervical : du bord inférieur de l’hypopharynx, au bord inférieur du cartilage cricoïde (15 cm des arcades dentaires), à l’entrée dans le thorax (20 cm des arcades dentaires).
- Œsophage thoracique :
- tiers supérieur : de l’orifice supérieur du thorax (20 cm des arcades dentaires) à la bifurcation trachéale (25 cm des arcades dentaires)
- tiers moyen : sous la bifurcation trachéale (25 cm des arcades dentaires), jusqu’au bord inférieur des veines pulmonaires (30 cm des arcades dentaires)
- tiers inférieur : du bord inférieur des veines pulmonaires (30 cm des arcades dentaires) à la jonction oeso-gastrique incluant l’œsophage abdominal (40 cm des arcades dentaires)
- Jonction œsogastrique (JOG) :
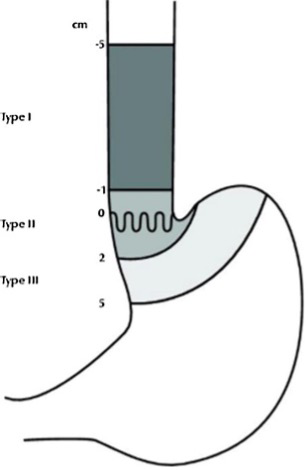
La classification de Siewert divise les tumeurs de la JOG en trois types en fonction de la localisation de l’épicentre de la tumeur par rapport à la jonction œsogastrique anatomique (Siewert et al, 1987, 2005; Siewert & Stein, 1998).
- Type I : Le centre de la tumeur se situe entre 1 et 5 cm au-dessus de la jonction œsogastrique. Cette entité correspond aux adénocarcinomes du bas œsophage, habituellement développée sur un œsophage de Barrett.
- Type II : Le centre de la tumeur est situé entre 1 cm au-dessus et 2 cm au-dessous de la jonction œsogastrique.
- Type III : Le centre de la tumeur se situe entre 2 cm et 5 cm au-dessous de la jonction œsogastrique. Cette entité correspond au cancer sous-cardial de l’estomac et est abordée spécifiquement dans le chapitre 2 Cancer de l'estomac du TNCD.
Dans la 8ème édition de la classification TNM/UICC, la localisation anatomique est plus simple en séparant œsophage et estomac par l’épicentre tumoral (Rice et al, 2017a).
1.3.2. Pré-thérapeutique
La référence pour l’évaluation du clinical T et N est l’examen échoendoscopique (D’Journo, 2018). Elle peut être complétée par la classification tomodensitométrique de Wurtz, modifiée par Bosset et al. (ctTNM) (Wurtz & Chastanet, 1988 ; Bosset et al, 1997), notamment en cas de tumeur non franchissable en échoendoscopie et pour éliminer une maladie métastatique. Toute tumeur doit être classée en préthérapeutique en cTNM (clinical TNM) faisant ainsi la synthèse des données échoendoscopiques et tomodensitométriques.
1.3.3. Classification UICC 2017 (UICC, 8ème édition)
Dans la 8ème édition de la classification UICC des cancers de l'œsophage et de la JOG, révisée en 2017, il existe des classifications distinctes pour le stade clinique préthérapeutique (cTNM), le stade pathologique (pTNM) c’est-à-dire après œsophagectomie seule et le stade pathologique après traitement néoadjuvant (ypTNM) (Rice et al, 2017a).
Les classifications cliniques (cTNM) et pathologiques (pTNM) sont distinctes pour le carcinome épidermoïde et l'adénocarcinome mais pas pour les classifications pathologiques après traitement néoadjuvant (ypTNM).
À l'exception de l'ajout du critère d’invasion péritonéale pour T4a, les catégories et sous-catégories T, N et M restent inchangées pour la 8ème édition.
Les cancers avec un épicentre (i) à 2 cm ou moins de la jonction œso-gastrique, qui s’étendent à l’œsophage ou (ii) à une distance proximale de moins de 2 cm du cardia (Siewert I/II) sont classés comme des cancers de l’œsophage. Les cancers dont l’épicentre se trouve en dessous de la distance proximale de 2 cm du cardia anatomique sont classés comme des cancers de l’estomac (cf. TNCD chapitre 2 Cancer de l'estomac).
Le sous-groupe pT1N0M0 est subdivisé en pT1a et pT1b.
De plus, le degré de différenciation tumoral (G*) est nécessaire pour la stadification pathologique des cancers pT1-T2N0M0. Le degré de différenciation (G) et la localisation tumorale (L) sont également nécessaires pour la stadification pathologique des carcinomes épidermoïdes pT3N0M0.
* Degré de différenciation tumorale (G) :
G1 : Bien différencié
G2 : Moyennement différencié
G3 : Peu différencié
Gx : pas évaluable
Non applicable
Fiche standardisée INCa - Compte rendu anatomo-pathologie : Tumeur primitive de l’œsophage (cf. ANNEXE 2).
CLASSIFICATION TNM 8ème édition de la classification AJCC (2017)
T - Tumeur primitive
Tx Tumeur non évaluable
T0 Pas de signe de tumeur primitive
Tis Carcinome in situ
T1 Tumeur envahissant la muqueuse ou la sous-muqueuse
T1a tumeur envahissant la muqueuse ou la musculaire muqueuse
T1b tumeur envahissant la sous-muqueuse
T2 Tumeur envahissant la musculeuse
T3 Tumeur envahissant l'adventice
T4 Tumeur envahissant les structures adjacentes
T4a Tumeur résécable envahissant la plèvre, le péricarde, la veine
azygos, le diaphragme ou le péritoine
T4b Tumeur non résécable envahissant les autres structures de
voisinage telles que l’aorte, les corps vertébraux, la trachée
N - Adénopathies régionales
Nx : ganglions non évalués
N0 : pas de signe d'atteinte des ganglions lymphatiques régionaux
N1 : 1 ou 2 adénopathies envahies
N2 : 3 à 6 adénopathies envahies
N3 : 7 adénopathies ou plus envahies
Les adénopathies cervicales paraœsophagiennes, thoraciques et abdominales supérieures y compris cœliaques ne sont plus considérées comme métastatique depuis 2009 et sont considérées comme régionales. Seules les adénopathies sus-claviculaires et les adénopathies lombo-aortiques sont considérées comme métastatiques.
M - Métastases à distance
M0 Pas de métastase à distance
M1 Présence de métastase(s) à distance
STADIFICATION TNM 8ème édition AJCC (2017)
Stades CTNM
Adénocarcinome
| N0 (M0) | N2 (M0) | N2 (M0) | N3 (M0) | M1 (tout N) | |
| Tis | 0 | ||||
| T1 | I | IIA | IVA | IVA | IVB |
| T2 | IIB | III | IVA | IVA | IVB |
| T3 | III | III | IVA | IVA | IVB |
| T4a | III | III | IVA | IVA | IVB |
| T4b | IVA | IVA | IVA | IVA | IVB |
Carcinome épidermoïde
| N0 (M0) | N1 (M0) | N2 (M0) | N3 (M0) | M1 (tout N) | |
| Tis | 0 | ||||
| T1 | I | I | III | IVA | IVB |
| T2 | II | II | III | IVA | IVB |
| T3 | II | III | III | IVA | IVB |
| T4a | IVA | IVA | IVA | IVA | IVB |
| T4b | IVA | IVA | IVA | IVA | IVB |
Stades pTNM
Adénocarcinomes
| pT | pN | pM | pG | |
| 0 | Tis | N0 | M0 | NA |
| IA | T1a | N0 | M0 | G1, X |
| IB | T1a T1b | N0 N0 | M0 M0 | G2, X G1-2, X |
| IC | T1 T2 | N0 N0 | M0 M0 | G3 G1-2 |
| IIA | T2 | N0 | M0 | G3, X |
| IIB | T1 T3 | N1 N0 | M0 M0 | Tout Tout |
| IIIA | T1 T2 | N2 N1 | M0 M0 | Tout Tout |
| IIIB | T4a T3 T2-3 | N0-1 N1 N2 | M0 M0 M0 | Tout Tout Tout |
| IVA | T4a T4b T1-4 | N2 N0-2 N3 | M0 M0 M0 | Tout Tout Tout |
| IVB | T1-4 | N0-3 | M1 | Tout |
Carcinome épidermoïde
| pT | pN | pM | pG | pL | |
| 0 | Tis | N0 | M0 | NA | Tout |
| IA | T1a | N0 | M0 | G1, X | Tout |
| IB | T1b T1 T2 | N0 N0 N0 | M0 M0 M0 | G1, X G2-3 G1 | Tout Tout Tout |
| IIA | T2 T3 T3 | N0 N0 N0 | M0 M0 M0 | G2-3, X Tout G1 | Tout Inférieur Sup. / moyen |
| IIB | T3 T3 T3 T1 | N0 N0 N0 N1 | M0 M0 M0 M0 | G2-3 X Tout Tout | Sup. / moyen Tout X Tout |
| IIIA | T1 T2 | N2 N1 | M0 M0 | Tout Tout | Tout Tout |
| IIIB | T4a T3 T2-3 | N0-1 N1 N2 | M0 M0 M0 | Tout Tout Tout | Tout Tout Tout |
| IVA | T4a T4b T1-4 | N2 N0-2 N3 | M0 M0 M0 | Tout Tout Tout | Tout Tout Tout |
| IVB | T1-4 | N0-3 | M1 | Tout | Tout |
Stades ypTNM (adénocaricinome et carcinome épidermoïde)
| N0 (m0) | N1 (M0) | N2 (M0) | N3 (M0) | M1 (M0) | |
| T0 | I | IIIA | IIIB | IVA | IVB |
| T1 | I | IIIA | IIIB | IVA | IVB |
| T2 | I | IIIA | IIIB | IVA | IVB |
| T3 | II | IIIB | IIIB | IVA | IVB |
| T4a | IIIB | IVA | IVA | IVA | IVB |
| T4b | IVA | IVA | IVA | IVA | IVB |
1.3.4. Classification des cancers superficiels de l’œsophage (in situ ou T1)
1.3.4.1. La classification de Paris
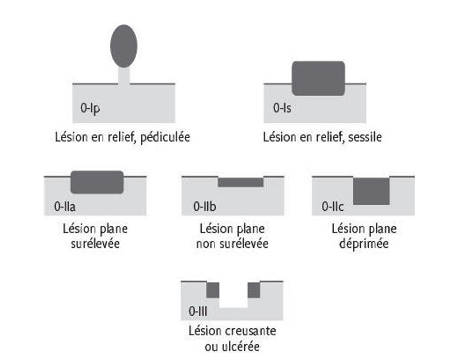
Les cancers superficiels et autres lésions néoplasiques du tube digestif sont usuellement décrites dans les comptes rendus d’endoscopie selon la classification de Paris (Endoscopic Classification Review Group, 2005). Son intérêt, outre la standardisation de la description, est également la prédiction de la résécabilité endoscopique et du risque d’envahissement ganglionnaire associé à la lésion dès l’évaluation macroscopique endoscopique.
La classification de Paris décrit ainsi :
- 0-Ip : lésions polyploïdes ;
- 0-Is : lésions sessiles ;
- 0-IIa : lésions discrètement surélevées ;
- 0-IIb : lésions planes ;
- 0-IIc : lésions discrètement déprimées ;
- 0-III : lésions ulcérées.
1.3.4.2. La classification TNM
Les cancers superficiels, regroupent les cancers classés Tis (dysplasie de haut grade) strictement intraépithéliales, les cancers T1a (intramuqueux) atteignant le chorion ou la musculaire muqueuse, et les cancers T1b (sous muqueux) infiltrant la sous-muqueuse sans atteindre la musculeuse œsophagienne. Les cancers superficiels de stade précoce correspondent au stade 0 (Tis N0 M0) ou stade IA (T1 N0 M0). Leur importance clinique tient au faible risque d’envahissement ganglionnaire à leur bon pronostic global, et à la possibilité d’un traitement local par une résection endoscopique préservant l’organe œsophagien, à faible morbidité, et curative dans une majorité des cas.
Ainsi, parmi les cancers superficiels T1 on distingue plusieurs sous-types, dont l’intérêt est de pouvoir estimer le risque d’envahissement ganglionnaire :
Les cancers de stade T1a, intramuqueux
- m1 = in situ ou dysplasie de haut grade
- m2 = avec envahissement du chorion (ou lamina propria)
- m3 = envahissant la musculaire muqueuse
Les cancers de stade T1b, sous-muqueux
- sm1 : partie superficielle de la sous-muqueuse à partir de la musculaire muqueuse (≤ 200µm pour les cancers épidermoïdes et ≤ 500µm pour les adénocarcinomes de l’œsophage)
- sm2 : partie moyenne
- sm3 : partie profonde de la sous muqueuse
L’estimation du risque d’envahissement ganglionnaire ou de récidive à distance (ganglionnaire ou métastatique) d’une tumeur superficielle de l’œsophage est complexe, car elle dépend de multiples facteurs histologiques, parmi lesquels la profondeur d’infiltration pariétale, la présence d’emboles veineux ou lymphatiques, et le grade de différenciation tumorale. L’association fréquente de plusieurs facteurs histologiques péjoratifs a vraisemblablement conduit à surestimer le risque d’envahissement ganglionnaire des cancers T1b, comme en témoignent les résultats les plus récents des séries endoscopiques. La détermination du poids respectif de chaque facteur nécessiterait des larges séries de patients opérés de tumeurs T1, avec une analyse précise de chaque facteur histopronostique, et un suivi prolongé. Ces données font défaut, et le recours actuel majoritaire aux résections endoscopiques pour les cancers T1 de l’œsophage rend leur publication dans un proche avenir improbable.
1.4. Traitements
1.4.1. Prise en charge nutritionnelle
La prise en charge nutritionnelle fait partie intégrante de la prise en charge du patient atteint d’un cancer de l’œsophage en situation curative ou palliative (cf. chapitre TNCD 17 « Nutrition et Activité Physique » du 07/11/2022)).
Une gastrostomie percutanée endoscopique ou radiologique ne contre indique pas l’utilisation de l’estomac pour la reconstruction, en prenant soin de ne pas blesser les vaisseaux gastroépiploïques droits.
1.4.2. Chirurgie
1.4.2.1. Critères de non-opérabilité
Contre-indications relatives
- L’âge en lui-même n’est plus une contre-indication, mais des comorbidités peuvent limiter les indications opératoires. L’âge est notamment associé à une majoration du risque de complications médicales cardiovasculaires et pulmonaires (Mantziari et al, 2021). L’avis d’un oncogériatre est souhaitable en cas de score G8 < 14/17.
- Etat général OMS 2
- Perte de poids > 15%, non récupéré après prise en charge nutritionnelle
- Artériopathie oblitérante des membres inférieurs sévère non corrigée (stade ≥ III)
- Cirrhose sans antécédent de décompensation (ascite, ictère, insuffisance hépatocellulaire, encéphalopathie) et sans hypertension portale (Hobeika et al, 2020).Elle reste associée à une augmentation des risques de complications médicales et chirurgicales et de décès postopératoire (x3). Le pronostic à long terme est proche de celui des patients non cirrhotiques (Schizas et al, 2020).
Contre-indications absolues
- Insuffisance respiratoire sévère (VEMS < 1 L)
- Cirrhose décompensée ou avec présence d’hypertension portale,
- Insuffisance rénale chronique (créatininémie > 1,25 N)
- Infarctus du myocarde datant de moins de 6 mois ou cardiopathie évolutive.
- État général OMS > 2
- Perte de poids > 20% non récupérée après prise en charge nutritionnelle
1.4.2.2. Critères de non-résécabilité
- Tumeur T4 envahissant les structures médiastinales suivantes : arbre trachéo-bronchique, cœur, troncs supra-aortiques ou aorte sur plus de 90°de sa circonférence, corps vertébral. Les atteintes isolées de la plèvre, du péricarde, de la veine azygos, du diaphragme du péritoine (pT4a) ou du poumon résécable par résection atypique ne sont pas des contre-indications opératoires (Mariette & Triboulet, 2006).
- Métastases viscérales ou ganglionnaires (adénopathies sus-claviculaires et lombo-aortiques).
1.4.2.3. Technique chirurgicale
- La SFCD et l’ACHBT ont émis des recommandations sur la prise en charge chirurgicale des cancers œsogastriques, disponibles sur le site (Slim & Martin, 2009).
REFERENCES
L’œsophagectomie transthoracique subtotale avec curage ganglionnaire deux champs (médiastinal et abdominal) et médiastinectomie postérieure monobloc (technique de Lewis Santy) est le traitement de référence pour les tumeurs des tiers moyen et inférieur et de la jonction œso-gastrique Siewert I.
- Un curage deux champs étendu aux ganglions du thorax supérieur est probablement utile (niveau de preuve plus faible). L’utilité du curage cervical n’est pas démontrée pour les cancers sous-carénaires (Nishihira et al, 1998). Il doit en revanche être réalisé pour les cancers thoracique supérieur et cervical, et en cas d’envahissement suspecté sur les examens préopératoires quelle que soit la localisation du cancer.
- L’œsophagectomie chirurgicale mini-invasive hybride (HMIE) avec temps abdominal par coelioscopie est recommandée (recommandation de grade A). L’essai contrôlé randomisé français MIRO a montré une diminition significative des complications postopératoires majeures à 30 jours (36% vs 64%) et particulièrement des complications pulmonaires majeures (18% vs 30%) en faveur de l’approche hybride par rapport à la voie ouverte par laparotomie (Mariette et al, 2019). Les résultats à 5 ans de cette étude ont également montré que la technique hybride n’altérait pas les résultats oncologiques à long terme. La survenue de complications pulmonaires majeures ou de complications postopératoire majeures étaient associées de façon indépendantes à une altération de la survie globale (Nuytens et al, 2021).
- Concernant l’œsophagectomie totalement mini-invasive (TMIE), celle-ci reste minoritaire en France (6.5% selon une analyse récente du PMSI) (Nuytens et al, 2022). Le bénéfice de cette approche par rapport à la voie ouverte est démontré sur les complications pulmonaires dans un essai randomisé ayant évalué la voie coelioscopique conventionnelle (Biere et al, 2012) et sur les complications globales et pulmonaires dans un essai randomisé ayant évalué l’approche robotique (van der Sluis et al, 2019). Dans ces deux essais la grande majorité des patients avaient une anastomose cervicale. Certaines études comparatives TMIE vs. HMIE rapportent un bénéfice de la TMIE sur les complications pulmonaires (Souche et al, 2020; Nuytens et al, 2022) mais un risque augmenté de fistule anastomotique et de reprise chirurgicale avec la voie TMIE (Markar et al, 2020; Souche et al, 2020; van Workum et al, 2020). Cette technique doit être réalisée en centres experts, par des chirurgiens expérimentés. L’approche robotique (RAMIE) est en cours d’évaluation (Tagkalos et al, 2021; Yang et al, 2021b).
- La réalisation d’une anastomose intra-thoracique doit dans tous les cas être préférée à une anastomose cervicale pour un cancer du tiers moyen ou inférieur de l’œsophage ou de la JOG lorsque les marges carcinologiques le permettent (Degisors et al, 2017; van Workum et al, 2021).
- Le pronostic étant corrélé au nombre de ganglions analysés, il est recommandé de prélever au moins 23 ganglions (abdomen et thorax) (Altorki et al, 2008; Mariette et al, 2008; Peyre et al, 2008). Cependant la RCT néoadjuvante diminue le nombre de ganglions analysés (Robb et al, 2015; Talsma et al, 2017).
- En termes de reconstruction, la plastie gastrique est la référence (Messager et al, 2015). L’interposition d’intestin grêle (anse en Y intrathoracique) ou de colon doit être réservée aux patients avec un antécédent de chirurgie gastrique ou d’autres procédures qui auraient pu dévasculariser l’estomac ou à des situations carcinologiques particulières (cancer de la JOG Siewert II avec large débord gastrique ne permettant pas la conservation de l’estomac) (Klink et al, 2010).
- Une gastrostomie percutanée endoscopique ou radiologique ne contre indique pas l’utilisation de l’estomac pour la reconstruction, en prenant soin de ne pas blesser les vaisseaux gastroépiploïques droits (Margolis et al, 2003; Tessier et al, 2013).
- La préparation à l’intervention est fondamentale notamment sur les plans nutritionnels (cf chapitre 17 TNCD « Nutrition et Activité Physique » 2020) et respiratoire (kinésithérapie d’entrainement des muscles inspiratoires) (van Adrichem et al, 2014; Valkenet et al, 2018; Tukanova et al, 2021). La réhabilitation améliorée après œsophagectomie a montré sa faisabilité et ses avantages en terme de réduction de la durée de séjour et des coûts hospitalier et de diminution de la morbidité postopératoire (Chen et al, 2016; Pisarska et al, 2017; Jamel et al, 2019). En raison de la complexité de cette intervention, il existe une grande variabilité dans les protocoles utilisés. Néanmoins, la société ERAS (Enhanced Recovery After Surgery) a établi des recommandations pour la prise en charge standardisée après œsophagectomie permettant une évaluation standardisée de cette prise en charge dans les prochains essais (Low et al, 2019). La préhabilitation, conditionnement préopératoire du patient (physique, nutritionnel et psychologique) est en cours d’évaluation dans les cancers de l’œsophage (Le Roy et al, 2016; Allen et al, 2018; Minnella et al, 2018; Sheill et al, 2020).
CAS PARTICULIERS
- Pour les cancers de l’œsophage thoracique supérieur, une anastomose cervicale avec curage cervical bilatéral des compartiments externes est recommandée (Slim et al, 2009).
- Pour les tumeurs de la jonction œsogastrique Siewert II, 2 principales options sont possibles : (i) une oesophagectomie transthoracique subtotale avec curage ganglionnaire deux champs (médiastinal et abdominal) et médiastinectomie postérieure monobloc (technique de Lewis Santy), et (ii) une gastrectomie totale élargie à l’œsophage (œsogastrectomie totale) avec anastomose œsojéjunale par voie transhiatale. Ces deux options font l’objet d’un essai européen en cours (essai CARDIA).
- Œsophagectomie sans thoracotomie avec anastomose cervicale en cas de contre-indication (notamment respiratoire) à la thoracotomie ou chez les patients porteurs d’une tumeur de la jonction œsogastrique de type II de Siewert. Dans tous les cas il faut faire un curage médiastinal inférieur en bloc par voie transhiatale.
- Œsophagectomie totale avec pharyngo-laryngectomie totale circulaire, réalisée dans un centre expert, pour les lésions atteignant la bouche œsophagienne, quand la radio-chimiothérapie ne peut être proposée, ou en rattrapage en cas de persistance tumorale après radio-chimiothérapie (accord d’experts).
1.4.2.4. Mortalité, morbité
- Mortalité hospitalière : inférieure à 10% en population générale, < 5 % dans les centres experts (Oesophago-Gastric Anastomosis Study Group on behalf of the West Midlands Research Collaborative, 2021). A noter que la mortalité opératoire était identique avec ou sans traitement néo-adjuvant dans l’essai CROSS (4% dans les deux bras) (van Hagen et al, 2012), mais plus importante en cas de radio-chimiothérapie préalable dans l’essai FFCD 9901 : 11% vs 3 % (Mariette et al, 2014).
- Les complications de l’œsophagectomie dont les définitions ont été standardisées au niveau international (Low et al, 2015) sont d' environ 60 % dans les essais et sont liées au terrain, à l’intervention chirurgicale, complexe, longue et nécessitant plusieurs voies d’abord, au stade évolutif de la tumeur et, selon les études, à une CRT néoadjuvante, notamment si elle a entrainé une toxicité de grade III ou IV (Robb et al, 2015). Les complications sont essentiellement pulmonaires (10 à 35% de pneumopathies et 4% de syndromes de détresse respiratoire aiguë), responsables de 50% des décès postopératoires. Les autres complications sont les fistules anastomotiques (5 à 20%), le chylothorax (1 à 2%), la paralysie des cordes vocales après un abord cervical (4%). Les complications cardiaques (troubles du rythme), rarement létales, sont plus fréquentes en cas d’antécédent cardio-vasculaire (Oesophago-Gastric Anastomosis Study Group on behalf of the West Midlands Research Collaborative, 2021).
- Les suites opératoires (morbidité chirurgicale, mortalité postopératoire) et les résultats oncologiques se sont révélés significativement meilleurs dans les centres experts (Wouters et al, 2009) ou à haut volume (Birkmeyer et al, 2002; Markar et al, 2015a; Pasquer et al, 2016). La centralisation de l’œsophagectomie pour cancer permet de fournir une meilleure infrastructure afin de traiter précocement les complications postopératoires évitant ainsi une augmentation de la mortalité postopératoire. Les taux de « failure to rescue » ou échec de sauvetage après œsophagectomie, défini par le taux de mortalité après une complication majeure, sont de 21,2 % dans les centres à faible volume, contre 13,4 % dans les centres à fort volume selon les données de l’Agency for Healthcare Research and Quality Nationwide Readmission Database (Abdelsattar et al, 2020; Oesophago-Gastric Anastomotic Audit (OGAA) Collaborative: Writing Committee et al, 2021).
- En France le seuil de 5 résections d’œsophage par an associé à la garantie, en outre, d’un l’accès sur le site ou dans des bâtiments voisins, à une unité de soins intensifs en capacité de prendre en charge les syndromes respiratoires aigus ou bien à une unité de réanimation est en train d’être mis en place par l’INCa pour la chirurgie oncologique de l’œsophage et de la jonction œso-gastrique. Ce seuil est très inférieur au seuil habituellement retenu dans la littérature qui varie entre 20 à 50 résections (Voeten et al, 2021). Néanmoins une étude récente issue de l’analyse du PMSI retrouvait ce seuil de 5 comme pertinent pour prédire la mortalité à 90 jours (Nuytens et al, 2022).
1.4.2.5. Résultats
Après résection R0, la survie à cinq ans est de 30 % dans les registres de population et les séries multicentriques (Bouvier et al, 2006; Markar et al, 2015b), de 40 à 50% dans les services spécialisés (Mariette et al, 2004). Les taux de survie à 5 ans sont de 83% pour les pTis, 67% pour les pT1, 49% pour les pT2, 30% pour les pT3, et de 63% pour les pN0 et 30% pour les pN+ (Mariette et al, 2004; Brac et al, 2021). La survie est liée au nombre de ganglions envahis, avec 53% de survie à 5 ans si ≤ 4 ganglions sont envahis contre 8% si > 4 ganglions sont envahis (Mariette et al, 2008; Rice et al, 2017b). La survenue d’une fistule anastomotique grave réduit la survie (Markar et al, 2015b). Une résection R1 est le reflet d’une biologie tumorale plus agressive (N+, TRG 4-5, stade III) et est associée à une diminution de la survie globale et une augmentation des taux de récidive locorégionale ou métastatique (Markar et al, 2016a). La définition de la résection R1 est différente en fonction des publications car plusieurs classifications existent ; celle de L’American College of Pathology défini la résection R1 en cas tumeur arrivant au contact de la zone de section (0 mm) et celle du Royal College of Pathology définit la résection R1 en cas de tumeur arrivent à < 1 mm de la zone de section. Les deux ont été montrées comme étant prédictive d’un pronostic péjoratif (Brac et al, 2021; St-Amour et al, 2021).
1.4.3. Chimioradiothérapie (CRT) exclusive
REFERENCES
En cas de cancers de l’œsophage localisés non résécables et / ou non opérables, la chimio-radiothérapie concomitante exclusive est le traitement de référence sauf contre-indication, (grade A) (Herskovic et al, 1992; Cooper et al, 1999).
1.4.3.1. Technique de radiothérapie
- Une radiothérapie avec un étalement et un fractionnement classique, doit être préférée à la radiothérapie en split course car plus efficace (grade B) (Crehange et al, 2007).
- En cas de chimio-radiothérapie concomitante, la dose de radiothérapie doit être limitée à 50 Gy (ou 50,4 Gy) hors essai (grade B) (Minsky et al, 2002; Hulshof et al, 2021; Créhange et al, 2022) et être délivrée par accélérateur linéaire, et selon une technique conformationnelle 3D avec étude scanographique dosimétrique, chaque champ étant traité chaque jour. Après les résultats négatifs d’un premier essai randomisé ancien d’escalade de dose (Minsky et al, 2002), deux essais récents se sont également avérés négatifs. En effet, l’essai ARTDECO comparant 50,4 Gy vs. 61,6 Gy, n’a montré aucune différence avec une survie sans progression locale à 3 ans similaire entre les deux doses (70% vs 73%), y compris pour les carcinomes épidermoïdes (Hulshof et al, 2021). L’essai CONCORDE, qui a testé l’intérêt d’une augmentation de dose à 66 Gy par rapport à une dose standard de 50 Gy, n’a montré aucun intérêt en termes de survie globale ou de contrôle loco-régional de la maladie (Crehange et al, 2021).
- La radiothérapie en modulation d’intensité (IMRT) reste une option et peut être réalisée selon les techniques disponibles dans chaque centre. Elle diminue de façon significative l’irradiation des poumons et du cœur et pourrait réduire le risque de complications notamment en cas d’association avec la chirurgie. (Créhange et al, 2022).
- Un envahissement de la muqueuse trachéo-bronchique n’est pas une contre-indication absolue à la CRT, mais la radiothérapie doit être étalée et précédée d’une chimiothérapie (CT) (accord d’experts). La pose d’une prothèse endotrachéale est à discuter en fonction du degré d’obstruction.
1.4.3.2. Chimiothérapie associée
OPTION
Longtemps associée avec le 5FU-cisplatine (Herskovic et al, 1992), la radiothérapie peut désormais être associée avec le FOLFOX (Conroy et al, 2014) ou en alternative avec le paclitaxel-carboplatine hebdomadaire (Hulshof et al, 2021).
L’étude Prodige 5 / Accord 17 a cherché à montrer la supériorité d’une CRT exclusive avec FOLFOX sur une CRT avec 5FU-cisplatine dans une étude randomisée de phase II / III (Conroy et al, 2014) chez des patients porteurs d’un cancer de l’œsophage non résécable ou non opérable. Aucune différence de survie globale, ni même de qualité de vie n’a été mise en évidence entre les 2 bras de traitement. En revanche, il y avait moins de décès toxiques (2,2 % vs. 9,6 %) chez les patients traités par CRT-FOLFOX et le profil de toxicité était en faveur de l’association CRT-FOLFOX avec moins de mucites sévères et de perturbations sévères de la fonction rénale ainsi qu’un schéma d’administration plus simple réalisable en hôpital de jour, sans hyper-hydratation.
L’essai de phase III d’escalade de dose ARTDECO a utilisé une CRT avec paclitaxel-carboplatine hebdomadaire concomitant, dans le cadre du traitement exclusif de cancers de l’œsophage (épidermoïde (61%), adénocarcinome (39%)). La survie sans progression à 3 ans était de 33,1% dans le bras standard délivrant 50,4 Gy (Hulshof et al, 2021). Pour rappel, la survie sans progression à 3 ans était de 18,2% et de 17,4% dans l’essai Prodige 5 / Accord 17 dans les bras FOLFOX et 5FU-cisplatine respectivement (Conroy et al, 2014). Dans l’essai ARTDECO, la compliance à la radiothérapie était de 96% et le taux de décès toxique (grade 5) était de 3% dans le bras radiothérapie standard.
Le taux de réponse histologique complète (pCR) de 29% sur pièce opératoire après traitement néoadjuvant par 5 cures de carboplatine (AUC 2) – paclitaxel (50 mg/m²) et radiothérapie (41.4 Gy) (van Hagen et al, 2012), retrouvé à 28% en regroupant les patients de la phase 2 (51 patients), de la phase 3 (157 patients) et de 117 patients traités ensuite hors essai (Shapiro et al, 2014) a amené de nombreux auteurs à s’interroger sur la possibilité d’associer en exclusif à ce schéma de chimiothérapie une irradiation « plus classique » de 50,4 Gy. Notons cependant que, « dans la vraie vie », une étude multicentrique hollandaise utilisant les critères d’inclusion du CROSS ou des critères plus larges (eCROSS) obtenait un pCR, de respectivement 23.2% et 20,4% dans les groupes CROSS et eCROSS (Wang et al, 2021). Une analyse rétrospective de 130 patients (62% adénocarcinomes, 38% carcinomes épidermoïdes) traités en exclusif (mais dose d’irradiation allant de 44.7 à 71,4 Gy) constate des médianes de survie et de survie sans récidive très intéressantes à 22,9 – 10,7 mois et 25,7 – 20,2 mois pour respectivement les carcinomes épidermoïdes et adénocarcinomes. (Dreyfuss et al, 2021). Enfin il est important de noter que l’efficacité (en pCR, DFS et OS) était, dans toutes les études, plus faible pour les adénocarcinomes que pour les carcinomes épidermoïdes.
1.4.3.3. Thérapie ciblée/immunothérapie
L’ajout de cetuximab à un schéma de CRT exclusive a été testé dans l’essai RTOG 0436 et n’apporte aucun bénéfice en termes de réponse tumorale, de contrôle loco-régional ou de survie globale en population non sélectionnée (Suntharalingam et al, 2017).
L’ajout d’une immunothérapie pendant ou après la CRT exclusive est en cours d’étude dans des essais de phase II randomisé/III :
- Essai ARION (PRODIGE67) : ajout de durvalumab en concomitant et en entretien à un schéma de CRT exclusive (50,4 Gy + Folfox). Coordonnateurs : L Quero (APHP), A Modesto (Toulouse)
https://clinicaltrials.gov/ct2/show/NCT03777813
1.4.3.4. Arguments pour une CRT exclusive dans les formes avancées résécables (T3, T4, N0 ou N1)
- Deux essais randomisés ont remis en question la chirurgie systématique après RCT principalement pour les carcinomes épidermoïdes. Les schémas comparaient une CRT exclusive à une CRT suivie de chirurgie.
- L’essai FFCD 9102 (épidermoïdes 90%) (Bedenne et al, 2007) randomisait les patients répondeurs après une CRT d'induction entre poursuite de la CRT ou la chirurgie. Il n'existait pas de différence de survie globale à 2 ans avec chez les opérés mais une mortalité précoce significativement plus importante (9,3% vs. 0,8%) et une hospitalisation plus longue (68 jours vs. 58 jours). En revanche, le contrôle loco-régional de la maladie à 2 ans était significativement plus important chez les patients opérés (66,4% vs. 57%, p=0,03).
- L’essai de Stahl randomisait une chimiothérapie d’induction suivie d’une CRT +/- chirurgie chez des patients atteints uniquement de carcinomes épidermoïdes du tiers supérieur ou moyen de l'oesophage (Stahl et al, 2005). Cet essai n’a également pas montré de bénéfice de l’association CRT-chirurgie en terme de survie globale mais une augmentation significative de la mortalité due au traitement dans le bras associant la chirurgie (12,8% vs 3,5%). Comme l’essai FFCD 9102, les patients opérés avaient une meilleure survie sans progression loco-régionale à 2 ans (64,3% vs 40,7%, p=0,003).
- Ceci a été confirmé dans une revue systématique de la Cochrane (Best et al, 2016) qui a montré, malgré une analyse d’études jugée à faible niveau de preuve, que la CRT exclusive semble être au moins équivalente à la chirurgie en termes de survie à court et à long terme chez les personnes atteintes d'un cancer de l'œsophage (type carcinome épidermoïde), répondeurs à la CRT.
- Cas particulier du carcinome épidermoïde de l’œsophage cervical : Les différentes séries rétrospectives rapportent une survie comparable quel que soit le traitement réalisé (chirurgie à type d’œso-pharyngo-laryngectomie totale ou CRT exclusive), mais seule la CRT exclusive permet aux patients de conserver leur phonation (Gkika et al, 2014; Zhang et al, 2015; McDowell et al, 2017). Zenda et al. ont rapporté, dans leur étude de phase II, les résultats d’une CRT exclusive avec 5FU-cisplatine chez des patients opérables porteurs d’un cancer localisé de l’œsophage cervical. La survie à 3 ans était de 66,5 % et la survie à 3 ans, larynx en place, était de 52,5 % (Zenda et al, 2016).
1.4.3.5. Arguments pour une CRT exclusive dans les formes localisées résécables (carcinome épidermoïde cT1b, cN0)
Une étude prospective non randomisée a récemment été publiée. Elle incluait des patients porteurs d’un carcinome épidermoïdes cT1bN0 et comparait une chirurgie première suivie d’une CRT à une CRT exclusive (60 Gy avec 5FU-cisplatine) (Kato et al, 2021). Devant l’échec de la randomisation, cette étude a été réalisée en prospectif avec ajustement sur un score de propension et calcul d’effectif en vue de démontrer la non infériorité de la CRT exclusive en termes de survie globale. Le taux de survie globale à 5 ans était de 86,5% dans le groupe chirurgie et de 85,5% dans le groupe RCT exclusive (rapport de risque ajusté, 1,05 ; intervalle de confiance à 95%, 0,67-1,64 [<1,78]). Le taux de réponse complète dans le bras CRT exclusive était de 87,3% (intervalle de confiance à 95%, 81,1-92,1). Le taux de survie sans progression à 5 ans était de 81,7 % dans le groupe chirurgie et de 71,6% dans le groupe CRT exclusive. Des décès liés au traitement sont survenus chez 2 patients dans le groupe chirurgie et aucun dans le groupe CRT exclusive. A 5 ans 80,4% des patients étaient vivants sans oesophagectomie dans le groupe RT exclusive. Le traitement de rattrapage pouvait comporter une résection endoscopique, une oesophagectomie ou une chirurgie ganglionnaire. Les auteurs concluaient à la non infériorité de la CRT exclusive pour les tumeurs cT1BN0 de type épidermoïde. Une méta-analyse Cochrane considère également la CRT exclusive comme un traitement valide des cancers épidermoïdes résécables.
OPTIONS :
- La radiothérapie exclusive (60 à 66 Gy en 32 fractions) est une alternative seulement en cas de contre-indication à la chimiothérapie concomitante (accord d’experts).
- La CRT en split course (2 séries de 20 Gy en 5 fractions ou 3 séries de 15 Gy en 5 fractions) (Seitz et al, 2000) ne peut être utilisée qu’en situation palliative, notamment chez les patients métastatiques (grade B).
1.4.4. CRT néo-adjuvante
1.4.4.1. L'utilité de la chimio-radiothérapie néo-adjuvante
est reconnue (grade A) à la suite de plusieurs méta-analyses concordantes, concluant à une diminution du risque de décès de 23% avec la CRT concomitante néo-adjuvante dans les cancers épidermoïdes mais aussi dans les adénocarcinomes (Sjoquist et al, 2011).
Deux essais inclus dans la méta-analyse de Sjoquist et al., comparant la CRT néo-adjuvante suivie de chirurgie par rapport à la chirurgie seule, permettent d'affiner les indications thérapeutiques en fonction des stades tumoraux :
- L’essai CROSS, le plus grand essai randomisé réalisé associant une irradiation de 41,4Gy avec des cures hebdomadaires de paclitaxel – carboplatine (AUC 2), a conforté l’intérêt de la CRT néoadjuvante tant pour les adénocarcinomes que les carcinomes épidermoïdes). Pouvaient être inclus les stades cliniques cT1N1 et cT2-3N0-1, tous M0, ayant une tumeur de moins de 8 cm de hauteur et de moins de 5 cm d’épaisseur, chez des patients PS 0-2 ayant perdu moins de 10% de poids corporel.) Il n’y avait pas d’augmentation de la morbi-mortalité opératoire. Les médianes de survie globale étaient de 49,4 mois après CRT puis chirurgie (RT 41,4 Gy avec paclitaxel-carboplatine hebdomadaire) contre 24 mois après chirurgie seule (HR 0,68 ; p=0,003). Le bénéfice était majeur pour les carcinomes épidermoïdes. Les SG étaient de 82 vs 21 mois (HR 0,48 ; p=0,009), important pour les carcinomes épidermoïdes de 43 vs 27 mois (HR 0,73 ; p=0,04) (van Hagen et al, 2012; Shapiro et al, 2014). L’écart de survie était plus important pour les cancers épidermoïdes à 5 ans, 60 % vs. 30 % (p=0,008). Les résultats à 10 ans de l’essai CROSS confirment le bénéfice absolu en survie globale du bras CRT préopératoire de 13% (38% vs. 25%) (Eyck et al, 2021a). Cependant l’intérêt de la CRT néoadjuvante pour les petites tumeurs (cT1/T2-N0), minoritaires, n’est pas établi par ce travail, qui avait inclus exclusivement des tumeurs de stade cT1N1 ou cT2-T3N0-1.
- L’essai FFCD 9901 concernait en revanche des cancers de l’œsophage de stades I et II et comparait chirurgie seule +/- précédée d’une CRT (45 Gy avec 5FU-cisplatine). Le traitement néoadjuvant n’a ici apporté aucun avantage en survie mais une majoration de la mortalité post-opératoire (11% vs. 3%) (Mariette et al, 2014). Cependant, dans le bras CRT il y avait 36% de tumeurs pT0N0M0 et le taux de récidives locorégionales y était deux fois plus faible (15% vs. 29%). A long terme, les taux de récidives loco-régionales étaient toujours en faveur du bras CRT (17% vs 30%) sans différence sur le taux de récidive métastatique (23% vs. 31%) (Robb et al, 2016). Il faut noter aussi qu’il y avait 40% de patients ayant un stade III dans le bras chirurgie seule, qui ont donc été traités de façon sub-optimale. Enfin, les stades II sont hétérogènes et comprennent des tumeurs T3N0, qui sont maintenant plus considérées comme des tumeurs localement avancées (Lordick et al, 2016; Mantziari et al, 2017). Il en est de même pour les tumeurs cN+ (Lordick et al, 2016).
- Enfin, concernant les tumeurs cT2N0 il existe une controverse sur la possibilité ou non de proposer une chirurgie première. Une métanalyse récente relevait , en cas de stade cT2N0, une précision de la stadification T de seulement 29% (IC 95%, 24-35) et le pourcentage de patients avec une stadification N + de 34% (IC 95%, 30-39) (Wolfson et al, 2021). Les résultats d’une étude rétrospective multicentrique européenne suggèrent que la chirurgie seule devrait être recommandée pour ces tumeurs du fait d’une survie globale équivalente, même si 50% des patients présentaient en fait une atteinte ganglionnaire au moment de la chirurgie (pN+) (Markar et al, 2016b). De façon concordante, une métanalyse récente retrouvait un meilleur taux de résection complète après traitement néoadjuvant (rapport de risque, 0,67 ; intervalle de confiance à 95%, 0,55 à 0,81 ; P < 0,001) mais Il n'y avait pas de différence en survie globale ou en survie sans récidive à 5 ans (Kidane et al, 2019). Il n'y a actuellement pas assez de preuves pour faire des recommandations fermes concernant l'utilisation du traitement préopératoire dans les tumeurs cT2N0. Chaque cas doit être discuté par l'équipe multidisciplinaire en prenant soigneusement en compte les risques et les bénéfices potentiels. Les recommandations du NCCN évoquent la réalisation d’un traitement préopératoire : CRT en cas de carcinome épidermoide, chimiothérapie ou CRT en cas d’adénocarcinome ou de facteurs de mauvais pronostic (tumeur peu différenciée, diamètre > 3 cm, LVI) (NCCN 2022, www.NCCN.org/patients).
Depuis, l’essai de phase III NEOCRTEC 5010, dédié exclusivement aux carcinomes épidermoïdes localement avancés (84% de T3/T4 et 87% de N+), le bénéfice de la CRT préopératoire par rapport à une chirurgie seule a été confirmé avec un bénéfice significatif en termes de survie globale et de survie sans récidive à court et long terme (Yang et al, 2018, 2021a). Une diminution de la récidive locorégionale et à distance était également observée dans le bras CRT préopératoire (Liu et al, 2020b).
REFERENCE
Ces travaux permettent d’affiner les indications thérapeutiques en fonction du stade initial, en réservant la chirurgie seule aux tumeurs de stade précoces cT1-T2 cN0 après un bilan complet (grade B) et le traitement combiné (CRT néoadjuvante pour tous les types histologiques ou chimiothérapie néoadjuvante pour les adénocarcinomes cf. chapitre 4 .7 .2) aux tumeurs plus avancées opérables et résécables (grade A).
1.4.4.2. Technique de radiothérapie
- Une radiothérapie avec un étalement et un fractionnement classique, doit être préférée à la radiothérapie en split course car plus efficace (grade B) (Crehange et al, 2007).
- En situation de chirurgie programmée, les doses délivrées, comme dans l’étude CROSS, sont limitées à 41,4 Gy en 23 fractions ou 45 Gy comme dans l’étude FFCD 9901.
- En situation de tumeur volumineuse et si la chirurgie peut être discutée en fonction de la réponse, une dose de 50 Gy est recommandée (dose utilisée dans l’étude NEEDS).
- La radiothérapie en modulation d’intensité (IMRT) doit être privilégiée et peut être réalisée selon les techniques disponibles dans chaque centre. Elle diminue de façon significative l’irradiation des poumons et du cœur et pourrait réduire le risque de complications notamment en cas d’association avec la chirurgie (Créhange et al, 2022).
1.4.4.3. Chimiothérapie associée
Avant l’avènement du schéma CROSS associant une radiothérapie à la dose de 41,4 Gy en 23 fractions, 5 jours par semaine à une chimiothérapie concomitante par paclitaxel-carboplatine hebdomadaire (van Hagen et al, 2012), les schémas de RCT néoadjuvante associaient plutôt une irradiation à la dose de 45 Gy et une chimiothérapie par 5FU-cisplatine (2 cures espacées de 21 jours), protocole de chimiothérapie qui avait ensuite été progressivement remplacé par du FOLFOX en extrapolant les résultats obtenus de la CRT exclusive dans l’essai Français PRODIGE 5/ ACCORD 17 (Conroy et al, 2014).
Les résultats de l’essai randomisé PROTECT ayant comparé une chimiothérapie par FOLFOX vs. Carboplatine+Paclitaxel en association à une irradiation à 41,4 Gy (Messager et al, 2016) rapportent une efficacité similaire des 2 stratégies en terme de résection R0 et de réponse histologique. Une tendance (non significative) à une augmentation des complications per/postopératoires sévères a été observés dans le bras Carboplatine+Paclitaxel (47,9% vs. 30,2%) mais ces résultats doivent être interprétés avec précaution au vu de l’effectif limité de cette phase 2 et de l’absence de données détaillées sur les modalités de radiothérapie (IMRT, 3D) dans chaque groupe (Adenis et al, 2022).
Après chimiothérapie d’induction par 2 cures de Xelox, l’essai randomisé NeoScope (Mukherjee et al, 2017, 2021) comparant une CRT 45 Gy avec Carboplatine+paclitaxel vs. Xelox était en faveur du bras Carboplatine+paclitaxel en termes de réponse histologique complète (29,3% vs. 11,1%), de taux de résection curative (85,7% vs.72,2%), de survie sans progression (p=0,053) et de survie globale (p=0,035).
1.4.4.4. Thérapie ciblée/immunothérapie
- L’ajout de cetuximab à un schéma de CRT néoadjuvante a été testé dans l’essai SAKK 75/08. Le cetuximab améliorait de manière significative le contrôle loco-régional mais n’apportait pas de gain significatif en termes de survie globale et de survie sans progression et n’est donc pas recommandé (Ruhstaller et al, 2018).
- L’ajout de trastuzumab en cas d’adénocarcinome HER2 positif a été récemment rapporté (Safran et al, 2022). Aucun gain significatif en termes de survie sans récidive n’a été noté (p=0,97). L’ajout de l’association trastuzumab+pertuzumab a également été explorée dans l’essai phase II (Hofheinz et al, 2022)
- L’essai Checkmate 577 a testé l’intérêt d’une immunothérapie adjuvante post-opératoire par nivolumab (anti-PD-L1) vs. placebo chez des patients en résection R0 d’un cancer de l’œsophage ou de la jonction oeso-gastrique (adénocarcinomes et épidermoïdes) de stades II/III après CRT néoadjuvante sans réponse histologique complète sur la pièce opératoire. Les patients ont été randomisés (2:1) pour recevoir du nivolumab à la dose de 240mg ou placebo toutes les 2 semaines pendant 16 semaines, puis du nivolumab à la dose de 480mg ou placebo toutes les 4 semaines pour une durée totale d’un an. Une majorité de patients avaient une tumeur de stade III (65%), localisée au niveau de l’œsophage (60%), de type adénocarcinome (71%) avec un statut PD-L1 <1% (72%). Il existait une amélioration statistiquement significative et cliniquement pertinente de la survie sans maladie (objectif principal) en faveur du nivolumab (31%, médiane=22,4 vs 11,0 mois; HR=0,69; 96,4% IC [0,56-0,86]; P=0,0003). Le nivolumab était bien toléré avec un profil de sécurité « habituel » et acceptable par rapport au placebo. Le gain en survie sans maladie était observé dans les différents sous-groupes, y compris les histologies épidermoïde et adénocarcinomateuse, les tumeurs ypN+ et les tumeurs PD-L1<1% (Kelly et al, 2021). Le nivolumab a obtenu l’autorisation de mise sur le marché aux Etats-Unis et en Europe. En France, le nivolumab adjuvant est remboursé selon l’indication suivante :
en monothérapie dans le traitement adjuvant des patients adultes atteints d’un cancer de l’œsophage ou de la jonction œso-gastrique et qui ont une maladie résiduelle après une radiochimiothérapie néoadjuvante antérieure et une résection complète (R0 post-chirurgie) dans les 4 à 16 semaines.
REFERENCE
L’immunothérapie adjuvante par nivolumab est recommandée en cas de chirurgie R0 d’un cancer œsophagien ou de JOG après CRT néoadjuvante et en l’absence de réponse histologique complète sur la pièce opératoire (grade B).
La discussion du choix entre ce schéma (CRT néoadjuvante puis immunothérapie adjuvante) et la chimiothérapie périopératoire pour les adénocarcinomes est abordée au chapitre 4.7.3.
1.4.5. Attitudes à proposer après CRT en fonction du résultat obtenu
1.4.5.1. Concept d’évaluation de la réponse à la CRT
Le concept d’évaluation de la réponse après CRT est devenu une problématique majeure dans la prise en charge du cancer de l'œsophage. En cas de CRT exclusive sans réponse clinique complète chez un patient opérable, peut se poser la question d’une œsophagectomie de rattrapage pour persistance tumorale. A contrario, en cas de CRT néoadjuvante une réponse clinique complète peut amener à se poser la question d’une préservation d’organe même s’il ne s’agit pas d’une stratégie recommandée à l’heure actuelle. En cas de préservation d’organe après CRT exclusive ou CRT néoadjuvante peut se poser la question, en cas de récidive loco-régionale isolée, d’une chirurgie de rattrapage pour récidive tumorale.
1.4.5.2. Timing du bilan d’évaluation après CRT
L’intervalle entre la fin de la CRT et la chirurgie est habituellement défini entre 4 et 6 semaines en cas de discussion d’une préservation d’organe (Burmeister et al, 2005; van Hagen et al, 2012; Klevebro et al, 2016) (voir chapitre 2.4).
Plusieurs études rétrospectives ont analysé l’effet d’allonger le délai entre la fin de la CRT et la chirurgie sur la réponse histologique et les suites post-opératoires avec des résultats contradictoires (Shapiro et al, 2014; Tessier et al, 2014; Qin et al, 2018). Une méta-analyse publiée en 2018 portant sur 13 études et 15068 patients suggérait qu’un allongement du délai à plus de 7-8 semaines était significativement associé à un meilleur taux de réponse histologique complète (pCR) (RR, 1,13 ; intervalle de confiance [IC] à 95 %, 1,05-1,21 ; p=0,001). Cependant, ceci s’associait à une mortalité chirurgicale plus élevée à 30 jours (RR, 1,51 ; IC à 95 %, 1,19-1,92 ; p=0,0006) essentiellement en cas d’adénocarcinome. En outre, un intervalle prolongé entrainait une diminution de la SG à 2 ans (RR, 0,94 ; IC à 95 %, 0,90-0,98 ; P = 0,002) et à 5 ans (RR, 0,88 ; IC à 95 %, 0,82-0,95 ; p=0,0009). Aucune association avec le taux de résection R0 ou une complication anastomotique n’était relevé. Les résultats d’une étude de cohorte suédoise (643 patients) suggéraient la faisabilité d’opérer les patients 7 à 10 semaines après la fin de la CRT sans effet significatif sur le taux de pCR, les complications postopératoires et la survie globale, par rapport au délai standard de 4 à 6 semaines (Klevebro et al, 2020). Un seul essai randomisé a comparé la stratégie de chirurgie 4 à 6 semaines vs. 10 à 12 semaines après CRT néoadjuvante (NEORES 2, NCT02415101). Aucun effet délétère en terme de morbi-mortalité postopératoire n’a été rapporté (Nilsson et al, 2020). L’analyse du critère principal sur la réponse histologique n’a pas encore été publiée.
En pratique une réévaluation au moins 4 à 6 semaines après la fin de la CRT reste recommandée (avis d’experts).
La réponse complète peut être retardée à 3 mois. Dans l’étude SANO, dont les résultats ne sont pas encore connus, il a été proposé une première évaluation 4-6 semaines après la fin de la CRT par endoscopie oesogastroduodénale avec réalisation de biopsies « bite on bite » (biopsies répétées sur le même site afin d’obtenir des prélèvements profonds) suivi 4 à 6 semaines après d’une réévaluation par endoscopie, TEP-TDM et écho-endoscopie avec ponction des adénopathies suspectes.
1.4.5.3. Non répondeurs et répondeurs partiels à la CRT exclusive
REFERENCE
En l’absence de réponse ou en cas de réponse incomplète à une CRT exclusive initiale, la résection chirurgicale doit être envisagée, de préférence dans un centre expert (grade B).
Il s’agit de l’attitude de référence en cas de CRT néoadjuvante. Il n’existe pas d’essai randomisé spécifique validant cette conduite, mais plusieurs études sont en faveur d’une chirurgie secondaire en cas de non réponse complète à une CRT exclusive (Stahl et al, 2005; Piessen et al, 2007; Markar et al, 2015c; Vincent et al, 2015). Le plus fort niveau de preuve vient de l’analyse des patients inclus dans l’essai FFCD 9102 qui n’ont pas été randomisés car non répondeurs et qui ont été analysés secondairement. Ces patients tiraient bénéfice d’une chirurgie à visée curative en termes de survie par rapport à tout autre attitude thérapeutique avec des courbes de survie qui rattrapaient celle des répondeurs (Vincent et al, 2015). La résection R0 a été rapportée comme paramètre associé à la survie chez les patients ayant un cancer de l’œsophage sous-carinaire opéré et non répondeur à la CRT, avec une survie médiane de 18,4 mois en cas de résection R0 vs. 8,6 mois en cas de résection R1-R2 (p < 0,001) (Piessen et al, 2007).
Dans cette situation, l’étude PreSANO a rapporté que la réalisation d’un TEP-TDM au 18F-FDG permettait de détecter des métastases chez 10% des patients, avec comme intérêt, d’éviter à ces patients une chirurgie inutile (Noordman et al, 2018a).
1.4.5.4 Répondeurs complets à la CRT néo-adjuvante
Après une CRT néoadjuvante pour un cancer de l'œsophage, environ la moitié (49%) des patients atteints de carcinome épidermoïde et un quart (23%) de ceux atteints d'adénocarcinome présentent une réponse histologique complète sur la tumeur primitive et les aires ganglionnaires sur la pièce opératoire (van Hagen et al, 2012). Tout l’enjeu est d’essayer de prédire au mieux cette réponse histologique à partir de la réponse clinique.
La définition de la réponse clinique complète n’est pas consensuelle et rend donc difficile l’analyse de la littérature. Elle comprend au minimum :
- en endoscopie : disparition ou quasi-disparition de toute la tumeur endoluminale, avec biopsies profondes sur le site tumoral (>4) négatives. En cas de tumeur non franchissable du fait d’une sténose, le patient ne peut être considéré en réponse complète ;
- et en TDM thoraco-abdomino-pelvienne : pas de progression de l’épaississement de la paroi œsophagienne et des cibles ganglionnaires ainsi qu’absence d’apparition de métastases à distance.
Certaines publications suggèrent d’y adjoindre le TEP-TDM: absence de fixation significative de la tumeur primitive ou des ganglions (mais le cut-off reste à fixer : SUVmax ≤ 3 ou SULmax ≤ 2.93) (Monjazeb et al, 2010; Valkema et al, 2019). Un TEP-TDM trop précoce après la fin de la CRT peut conclure à tort à un reliquat tumoral en raison de l’oesophagite post-thérapeutique.
L’étude de phase II preSANO (Noordman et al, 2018a) a démontré l’efficacité d’un protocole en 2 étapes, dans l’évaluation de la réponse clinique après CRT néoadjuvante pour un cancer de l’œsophage (adénocarcinome ou carcinome épidermoïde) avec une première évaluation réalisée 4-6 semaines après la CRT (évaluation 1), et en cas d’aspect de réponse clinique complète, une seconde évaluation réalisée 12-14 semaines après la CRT (évaluation 2).
- évaluation 1 : EOGD + biopsies “bite on bite” (>4) suivi d’un TEP-TDM au 18-FDG uniquement pour les non répondeurs complets (pour éliminer des métastases à distance).
- évaluation 2 (si réponse complète lors de l’évaluation 1) : TEP-TDM au 18-FDG en premier suivi d’une EOGD + biopsies “bite on bite” et échoendoscopie de la lésion primitive (épaississement < ou > 6 mm) + biopsie/aspiration à l’aiguille fine des adénopathies suspectes ou visibles au TEP-TDM.
Le risque de faux négatif variait de 11% à 31% en fonction de l’examen réalisé, la meilleure performance étant obtenue avec la combinaison des 8 biopsies dont 4 biopsies « bite on bite » + biopsie/aspiration à l’aiguille fine des adénopathies suspectes ou visibles en TEP-TDM. Le risque de faux négatif restait malgré tout de 11% (IC 95% : 1-20%).
La stratégie chez ces répondeurs cliniques complets consiste à discuter au cas par cas en RCP entre deux attitudes :
- Chirurgie d’exérèse comme planifiée qui reste la référence à l’heure actuelle.
- Surveillance active avec chirurgie de rattrapage en cas de récidive opérable.
En faveur de cette dernière option, une revue systématique récente avec méta-analyse et retour aux données individuelles compile les résultats de 7 études comparatives de patients estimés en réponse complète ayant eu une surveillance active versus une oesophagectomie systématique (PROSPERO: CRD42020167070). Le taux de récidive locorégionale pendant la surveillance active était de 34% à 2 ans (IC à 95%21%-50%) et 40 % (IC à 95 % : 26 % à 59 %) à 5 ans. 95 % des patients en surveillance active opérés d‘une oesophagectomie de rattrapage pour récidive locorégionale ont eu une résection radicale R0. Le risque de décès toutes causes confondues était similaire entre les 2 groupes (p=0,75) (van der Wilk et al, 2022).
En cas de surveillance active, les examens doivent être répétés tous les 3 mois pendant 2 ans puis tous les 6 mois pendant 3 ans afin de ne pas passer à côté de ce risque de ré-évolution locale accessible à une chirurgie (Lordick et al, 2016).
Cette stratégie thérapeutique est actuellement en cours d’évaluation, et pourra peut-être permettre à l’avenir d’envisager une stratégie de préservation d’organe avec un plus haut niveau de preuve:
- Dans l’étude de phase III SANO (NCT04886635), les patients après CRT néoadjuvante ayant obtenus des résultats négatifs à la première et à la deuxième évaluation clinique (protocole de l’étude preSANO) seront considérés comme répondeurs cliniques complets et seront randomisés entre une surveillance active (chirurgie de rattrapage en cas de récidive) ou une chirurgie systématique (Noordman et al, 2018b; Eyck et al, 2021b).
- La même étude est également en cours spécifiquement pour les carcinomes épidermoïdes (NCT03937362) : étude preSINO (Zhang et al, 2020) et donnera lieu à l’étude de phase III (SINO) en cas de résultats concluants.
- Une étude randomisée française (étude ESOSTRATE-PRODIGE 32-FFCD 1104, https://clinicaltrials.gov/ct2/show/NCT02551458) a comparé CRT (schéma néoadjuvant ou exclusif) suivie d’une surveillance active (chirurgie de rattrapage en cas de récidive) à CRT suivie de chirurgie systématique chez les patients considérés en réponse complète (clinique+ EOGD+ tomodensitométrie +TEP-TDM au 18-FDG). L’étude a été arrêtée en 2021 pour défaut d’inclusion. Les résultats de cette étude sont en attente.
- Enfin l’étude NEEDS (https://clinicaltrials.gov/ct2/show/NCT04460352) est une étude de phase III internationale qui vient d’être lancée en 2021 et qui vise à comparer en intention de traiter, une CRT néoadjuvante (41,4 Gy avec paclitaxel-carboplatine hebdomadaire) suivie d’une chirurgie systématique vs. une CRT exclusive (50 Gy ou 50,4 Gy avec 5FU-cisplatine ou FOLFOX ou paclitaxel-carboplatine hebdomadaire) suivie d’une chirurgie en cas de tumeur résiduelle ou de récidive loco-régionale chez les patients ayant un carcinome épidermoïde avancé de l’œsophage, opérable. Elle n’est pour l’instant pas ouverte en France.
1.4.5.5. Récidives locorégionales après CRT
La récidive locorégionale après CRT est définie par la présence de cellules tumorales au niveau de la tumeur primitive ou la présence de ganglions loco-régionaux (N+), ou une forte suspicion de ré-évolution sur des examens morphologiques ou métaboliques ceci au minimum 3 mois après la fin de la CRT.
Fréquentes, touchant environ 40 % des patients après CRT et souvent avant 12 mois post-CRT (Dresner & Griffin, 2000; Mariette et al, 2003; Bedenne et al, 2007), elles feront appel à :
- Une chirurgie de rattrapage sera à envisager en première intention, en cas de résection R0 raisonnablement prévisible (à savoir tumeur < T4, contact de moins de 90 degrés avec l’aorte et tumeur de moins de 10 cm de hauteur) (Piessen et al, 2007). D’après des études rétrospectives, les taux de résection R0 sont de 50 à 88 %, et la survie à 5 ans de 20 à 42 %. La mortalité post-opératoire était élevée dans les séries anciennes entre 13 et 25 % (Swisher et al, 2002; Gardner-Thorpe et al, 2007; D’Journo et al, 2008; Tachimori et al, 2009). Des séries plus récentes retrouvent une mortalité post-opératoire entre 0% et 4% (Yoo et al, 2012; Markar et al, 2015c) et un taux de complications, notamment en termes d’infection de site opératoire, augmentées (Markar et al, 2015c). Les risques de complications et de décès sont minimisés si la dose de RT n’a pas dépassé 50 Gy et en cas de réalisation de la chirurgie dans un centre à haut volume (D’Journo et al, 2008; Markar et al, 2015c; Cohen, 2018).
Une étude rétrospective a suggéré, sur un faible nombre de malades, l’intérêt d’une chirurgie par rapport aux autres stratégies, en termes de survie globale (Yoo et al, 2012). - Une CRT itérative peut être envisagée lorsque la zone de récidive est réirradiable.
- Une curiethérapie endoluminale lorsque la tumeur mesure moins de 10 cm de longueur, est limitée à la paroi œsophagienne sans adénopathie associée (T1-T2, N0) et qu’elle est localisée au niveau du 1/3 moyen ou 1/3 inférieur (Gaspar et al, 1997). La récidive au niveau de l’œsophage cervical ou thoracique supérieure étant proche de la moelle épinière, une ré-irradiation à ce niveau ne permet pas de délivrer une dose efficace compte-tenu des contraintes de dose à la moelle.
- Une CT de deuxième ligne pour les patients non opérables et non irradiables pour des raisons médicales ou chirurgicales.
1.4.6. Radio(chimio)thérapie adjuvante (post-opératoire)
La littérature disponible repose principalement sur les données de patients atteints de carcinomes épidermoïdes traités par chirurgie première dans des pays asiatiques, ce qui est donc très éloigné des pratiques européennes.
Deux essais randomisés de phase III récents viennent d’être publiés, dont un avec des résultats seulement intermédiaires (Deng et al, 2020; Ni et al, 2021) :
- La première étude a comparé un traitement par RT adjuvante (54 Gy) vs. CRT adjuvante (50,4 Gy avec paclitaxel-cisplatine ou nedaplatine, 2 cures espacées de 28 jours) vs. chirurgie seule chez des patients porteurs d’un carcinome épidermoïde de l’œsophage de stade IIB et IIIA en résection R0. Les auteurs rapportaient une amélioration de la SG et de la SSR à 3 ans dans les groupes RT adjuvante et CRT adjuvante avec un avantage à la CRT adjuvante. La survie globale à 3 ans était de 48% dans le bras chirurgie seule, de 60,8% dans le bras RT et de 66,5% dans le bras CRT (p = 0,048) (Ni et al, 2021).
- La seconde étude a comparé un traitement par RT adjuvante vs. chirurgie seule chez des patients porteurs d’un carcinome épidermoïde de l’œsophage thoracique classé pT2/T3N0M0 en résection R0. Les résultats intermédiaires étaient en faveur du bras RT adjuvante qui délivrait une dose de 50,4 Gy au niveau ganglionnaire sus-claviculaire et 56 Gy au niveau médiastinal, avec une amélioration significative de la SSR et une diminution du risque de récidive loco-régionale (Deng et al, 2020).
Enfin, dans une méta-analyse/revue systématique sur données publiées portant sur 5640 patients traités par chirurgie seule (3866 patients) vs. radiothérapie adjuvante (1774 patients) pour un carcinome épidermoïde de l’œsophage, inclus dans 3 essais randomisés et 7 études rétrospectives, Lin et al. ont rapporté un bénéfice significatif de la radiothérapie adjuvante en termes de survie globale (HR 0,86, 95%CI 0,79–0,93, p=0,0004) et de survie sans récidive (HR 0,74, 95%CI 0,63–0,87, p=0,004). La radiothérapie post-opératoire améliorait significativement la survie globale chez les patients ayant une tumeur T3, N+ ou en résection R0 (Lin et al, 2020).
Chez des patients opérés d’emblée, une radio(chimio)thérapie post-opératoire est une option non validée en population occidentale.
1.4.7. Chimiothérapie
1.4.7.1. La chimiothérapie néoadjuvante
Plusieurs essais randomisés ont évalué l’intérêt d’une chimiothérapie néoadjuvante versus chirurgie première dans les cancers de l’oesophage et de la jonction oeso-gastrique. La méta-analyse la plus récente avec retour aux données individuelles a été publiée en 2021. Seize essais étaient considérés comme éligibles. La chimiothérapie était associée à une amélioration de la survie globale par rapport à la chirurgie seule avec un hazard ratio à 0,83 [0,72-0,96] (p < 0,0001), se traduisant par un bénéfice absolu de 5,7 % à 5 ans. Les effets du traitement étaient significatifs pour l'adénocarcinome (HR = 0,73 [0,62-0,87]) mais pas pour le carcinome épidermoïde (HR = 0,91 [0,76-1,08], interaction p = 0,26). Un effet un peu plus prononcé a été observé dans les tumeurs de la jonction œso-gastrique (HR = 0,68 [0,50-0,93]) versus celles de l’œsophage thoracique (HR = 0,87 [0,75-1,00], interaction p=0,07) (Faron et al, 2021). Ces différents travaux ont surtout testé des combinaisons de cisplatine et de 5FU. La CT néoadjuvante n’augmentait pas la mortalité post-opératoire. La réponse complète histologique est rare (2 à 5 %), à la différence de ce que l’on observe après CRT, ne permettant pas d’éviter une intervention. Un grand essai Britannique (897 patients) a comparé, en préopératoire d’adénocarcinomes de l’œsophage et de la jonction, le standard 5FU – cisplatine (2 cycles) à 4 cycles du schéma ECX (epirubicine, cisplatine, capecitabine), sans démontrer de bénéfice à l’adjonction d’épirubicine sur la survie ou la toxicité (Alderson et al, 2017) .
OPTION
Une CT néoadjuvante par 5FU-cisplatine ou FOLFOX est une option pour les adénocarcinomes comme pour les cancers épidermoïdes de l’œsophage (grade B) en cas de CI aux autres schémas recommandés (CRT pour les 2 types histologiques et chimiothérapie péri-opératoire par FLOT pour les adénocarcinomes (voir chapitre 4.7.2)).
1.4.7.2. La chimiothérapie périopératoire
La CT périopératoire à base de 5 FU-cisplatine a démontré un avantage significatif en survie globale dans les adénocarcinomes du bas œsophage, de la jonction œso-gastrique (et de l’estomac) dans l’essai randomisé FFCD-FNCLCC 9703 par rapport à la chirurgie seules (Ychou et al, 2011). Cet avantage est du même ordre que celui de l’essai MAGIC avec le schéma ECF et qui comprenait environ un tiers de tumeurs de la jonction œsogastrique et de l’œsophage (Cunningham et al, 2006).
Le schéma FLOT (5FU, leucovorine, oxaliplatine et docetaxel) a été démontré comme plus efficace que le schéma ECF / ECX dans les adénocarcinomes gastriques et de la jonction (essai FLOT4, 716 patients) : amélioration de la survie globale avec une médiane passant de 35 à 50 mois, sans majoration des toxicités y compris post-opératoires ; le bénéfice en survie est semblable que la tumeur soit gastrique, au niveau de la jonction œsogastrique ou de l’œsophage (56% des cas). Le taux de pCR était de 16% dans le groupe FLOT (Al-Batran et al, 2019). Ce schéma FLOT s’est imposé comme le schéma de référence en préopératoire des adénocarcinomes gastriques, de la jonction œsogastrique et du bas œsophage. Une étude observationnelle dédiées aux adénocarcinomes de l’œsophage et de la jonction oeso-gastrique a confirmé l’efficacité du FLOT en périopératoire dans cette indication (Donlon et al, 2021).
REFERENCE
Une CT péri-opératoire par un schéma FLOT est une des références en cas d’adénocarcinome de l’œsophage ou de la jonction œso-gastrique (grade A).
1.4.7.3 Chimiothérapie néo-adjuvante/périopératoire versus CRT néo-adjuvante
Dans la métanalyse de 2011, les bénéfices obtenus en termes de survie tendaient à être plus importants après RCT qu’après CT (p=0,07) sur la base de 2 essais anciens avec des schémas de chimiothérapie de type 5FU cisplatine (Sjoquist et al, 2011). Les résultats à court et long terme de l’étude NeoRES I récemment publiés comparant 3 cycles de 5FU cisplatine avec ou sans radiothérapie (40 gy) retrouvaient un taux de pCR de 28% vs. 9% (p = 0,002), un risque d’envahissement ganglionnaire de 35% vs. 62% (p = 0,001) et un taux de résection R0 de 87 % vs. 74 % (p=0,04). Malgré cela la survie globale et sans progression à 5 ans était similaire entre les 2 groupes (p=0,60 et p=0,92). Il n'y avait aucune différence de mode de récidive entre les groupes de traitement (Klevebro et al, 2016; von Döbeln et al, 2019). Les résultats préliminaires de l’essai NEOAEGIS présentés en plénière à l’ASCO en 2021 ont rapporté la comparaison d’une CRT de type CROSS à une chimiothérapie péri-opératoire de type MAGIC ou FLOT suite à un amendement en cours d’essai. La grande majorité des patients avaient reçu un schéma de type MAGIC. De façon homogène les taux de pCR (20% vs. 5%), d’envahissement ganglionnaire (40% vs. 55,5%) et de résection R0 (95% vs. 82%) étaient meilleurs dans le bras RCT alors que les taux de survie à 3 ans était semblables (56% vs. 57%, HR 1,02 (IC95% 0,74-1,82) amenant les auteurs à stopper les inclusions pour futilité et à conclure à la non infériorité de la chimiothérapie versus la CRT. Notons que la tolérance du FLOT était significativement moins bonne sur le plan hématologique et digestive tandis que le risque de détresse respiratoire aiguë en post-opératoire tendait à être plus fréquent dans le bras CROSS (p=0,073) sans que les taux de mortalité post-opératoire et de morbidité post-opératoire ne différent de façon significative. Seul l’essai Allemand ESOPEC (NCT02509286) a été désigné pour permettre la comparaison entre la chimiothérapie péri-opératoire par FLOT et la chimioradiothérapie néoadjuvante de type CROSS. Les inclusions sont terminées et on attend prochainement la publication des résultats. L’hypothèse des auteurs est en faveur d’une supériorité du bras FLOT en termes de survie. Une étude rétrospective multicentrique récente a comparé ces 2 stratégies à partir d’un audit international. La mortalité à 90 jours était plus élevée après CROSS qu'après FLOT (5% vs 1%, p = 0,005), même sur des analyses ajustées (odds ratio (OR) : 3,97, IC95% : 1,34 - 13,67). La mortalité postopératoire avec le schéma CROSS était liée à des complications pulmonaires (74 % contre 60 %) et cardiaques (42 % contre 20 %) plus élevées que dans FLOT. Le schéma CROSS était associé à des taux de pCR (18 % contre 10 %, p = 0,004) et des taux de R0 (93 % contre 76 %, p < 0,001) plus élevès par rapport au FLOT. Ces résultats en faveur du schéma CROSS sont confirmés après ajustement : taux de pCR (OR : 2,05, IC95 % : 1,26 - 3,34) et taux de résection R0 plus élevés (OR : 4,55, IC95 % : 2,70 - 7,69) par rapport au FLOT (Kamarajah et al, 2022).
Etant donné les résultats très prometteurs du nivolumab en adjuvant après CRT néoadjuvante suivi de chirurgie pour les patients en persistance tumorale sur pièce opératoire on attend maintenant les résultats des essais évaluant la chimiothérapie périopératoire associé à l’immunothérapie (phase III : essai MK-585 (NCT03221426 (Bang et al, 2019), essai MATTERHORN (Janjigian et al, 2022) (NCT04592913), essai Dante (NCT NCT03421288), ou phase II : essai GASPAR (Dos Santos et al, 2022), NCT04736485) dans les adénocarcinomes de l’estomac et de la jonction oeso-gastrique. Les résultats de tolérance de la combinaison FLOT et immunothérapie par atézolizumab sur les 40 premiers patients inclus dans l’essai DANTE ont été rapportés à l’ASCO 2020 et la tolérance de la combinaison a été considérée comme acceptable (Homann et al, 2020). Bien que les résultats détaillés ne soient pas connus, l’essai MK-585 est négatif dans le press release de juin 2023. Chez les patients mauvais répondeurs au FLOT se pose la question de changer de type de chimiothérapie. Il reste à l’heure actuelle recommandé de poursuivre la même chimiothérapie en postopératoire. L’essai VESTIGE de l’EORTC randomise les patients R1 ou pN+ entre la poursuite du FLOT et une immunothérapie par nivolumab+ipilimumab (https://clinicaltrials.gov/ct2/show/NCT03443856).
1.4.7.4. La chimiothérapie postopératoire
Les résultats d’une étude randomisée ancienne Japonaise sur des carcinomes épidermoïdes avait suggéré un gain significatif en termes de survie sans récidive (p=0,037) et non significatif en termes de survie globale (p=0,13) chez des patients opérés en chirurgie première. Le bénéfice était particulièrement net chez les patients pN+ (Ando, 2003). Ce bénefice n’était pas retrouvé dans une étude retrospective Européenne plus récente (Pasquer, 2015). L’étude randomisée JCOG9907 publiée en 2012 suggérait que dans les carcinomes épidermoïdes de stade II/III une chimiothérapie préopératoire améliorait la survie par rapport à une chimiothérapie post-opératoire administrée chez les patients pN+ (Ando et al, 2012).
En cas de résection R1, la survie globale semble améliorée par une chimiothérapie adjuvante selon les données d’une large série européenne (Markar et al, 2016a).
Après CRT néoadjuvante, une étude basée sur un score de propension à partir de 10.086 cas dont 814 ont eu une CT post-opératoire, laissait penser qu’une CT adjuvante pourrait améliorer la survie médiane (40 vs 34 mois) (Mokdad et al, 2018) . Aucun bénéfice en survie n’a été trouvé dans une seconde étude avec score de propension sur la population de FREGAT (Lintis, AFC 2021). On préférera dans cette situation l’immunothérapie (cf chapitre 4.4.4).
OPTION
Chez des patients opérés d’emblée une chimiothérapie post-opératoire est une option à discuter en RCP, notamment en cas de résection R1 ou de lésion N+ (grade C).
1.4.7.5. Thérapie ciblée/immunothérapie en périopératoire
En cas de tumeur HER+, l’addition de trastuzumab+pertuzumab au FLOT dans les adénocarcinomes œsogastriques a été rapportée dans l’étude de phase II PETRARCA à l’ESMO 2020 (Al-Batran et al, 2020). Le taux de pCR était significativement majoré dans le bras expérimental (35 % vs. 12% ; p = 0,02), de même que le taux de pN0 (68% vs. 39%). Les taux de survie sans maladie et de survie globale à 24 mois étaient de 54 % [38-71 %] et 77 % [63-90 %] dans le bras FLOT et de 70 % [55-85 %] et 84 % [72-96 %] dans le bras expérimental. Plus d'événements indésirables de grade ≥ 3 ont été rapportés au traitement expérimental (diarrhée (5 % contre 41 %) et leucopénie (13 % contre 23 %)). L’étude n’ira pas en phase III. Les résultats de l’essai randomisé phase II de l’EORTC INNOVATION ayant comparé le schéma FLOT vs. FLOT trastuzumab vs. FLOT trastuzumab pertuzumab dans les adénocarcinomes œsogastrique (NCT02205047) ) sont également négatifs (Wagner et al, 2023).
En dehors de la situation adjuvante après CRT néoadjuvante et chirurgie R0 avec persistance tumorale développée au chapitre 4.4.4, l’utilisation d’une immunothérapie dans les cancers de l’œsophage et de la jonction n’est pas recommandée hors essai. Les essais en cours en situation de chimiothérapie périopératoire sont détaillés dans le chapitre 4.7.3.
Les résultats des patients inclus dans l’essai DANTE (FLOT +/- Atézolizumab) ont été rapportés à l’ASCO 2022 (phase 2). Les taux de réponses histologiques complètes étaient de 14% dans le bras FLOT et 23% dans le bras FLOT+Atézolizumab (Al-Batran et al, 2022).
En cas de statut dMMR et/ou MSI, l’étude de phase II monobras rapportée à l’ASCO GI 2022 NEONIPIGA a montré des résultats prometteurs d’une combinaison en néo-adjuvant de nivolumab plus ipilimumab avec des taux de pCR de 58% et un profil de tolérance acceptable dans les adénocarcinomes de l’estomac et de la jonction oesogastrique (Andre et al, 2022). Les résultats de ce sous-groupe de patients (dMMR/MSI) inclus dans l’essai DANTE (FLOT +/- Atézolizumab) ont été rapportés à l’ESMO 2021. Les taux de réponses histologiques complètes étaient de 38,5% dans le bras FLOT et 60% dans le bras FLOT+Atézolizumab (Annals of Oncology (2021) 32 (suppl_5): S1040-S1075. 10.1016/annonc/annonc708). Un essai de phase 2 est en cours en France pour évaluer les résultats d’une monothérapie par une seule cure de pembrolizumab pour les patients porteurs d’un adénocarcinome œsogastrique dMMR ou MSI ou EBV+ (IMHOTEP NCT04795661). Cette option est à privilégier au maximum. Hors essai la réalisation d’une chimiothérapie périopératoire de type FLOT reste recommandée dans les adénocarcinomes de l’œsophage et de la jonction oesogastriques dMMR/MSI. On ne dispose pas de séries ayant évalué les résultats de la CRT néo-adjuvante dans ce sous-groupe de patients.
1.4.7.6. Chimiothérapie et immunothérapie palliatives des cancers métastatiques
Un traitement systémique ne s’envisage que chez les patients en bon état général. Aucune différence significative de chimiosensibilité entre les deux types histologiques n’est avérée mais les données concernant les adénocarcinomes du bas œsophage et de la jonction oeso-gastriques sont plus fournies, ces lésions étant usuellement regroupées avec les adénocarcinomes gastriques dans les essais thérapeutiques. L’arrivée de l’immunothérapie dans les cancers oeso-gastriques avancés a modifié la prise en charge de ces tumeurs avec plusieurs AMM récentes.
1.4.7.6.1. Résultats concernant la chimiothérapie et les thérapies ciblées
Pour les carcinomes épidermoïdes :
Même si l’efficacité d’une CT systémique en première ligne des carcinomes épidermoïdes de l’œsophage métastatiques reste discutable car aucune étude randomisée de phase III a comparé la chimiothérapie par rapport aux soins de support exclusif, celle-ci est très largement utilisée.
L’association cisplatine plus 5-fluorouracile (5FU) est recommandé par toutes les sociétés savantes, basées sur des essais de phase II. Le 5FU plus cisplatine ou le LV5FU2 plus cisplatine sont les protocoles les plus fréquemment utilisés (Bleiberg et al, 1997; Mitry et al, 2004). Les patients présentant un carcinome épidermoïde de l’œsophage avancé traités par cisplatine (100 mg/m2) combiné au 5FU (1 000 mg/m2 en perfusion continue entre les jours 1 et 5) toutes les 3 semaines présentent un taux de réponse tumorale de 35%, une durée médiane de survie de 33 semaines et une survie à 1 an de 34%.
L’efficacité du 5FU plus cisplatine et du 5FU plus oxaliplatine est souvent considérée comme similaire dans le cancer œsogastrique, bien qu’il n’ait pas été conduit d’essai randomisé comparant ces deux traitements dans le cancer de l’œsophage. L’augmentation du taux de réponse obtenu en ajoutant, dans une phase II randomisée, du 5FU au cisplatine vs Cisplatine seul (Bleiberg et al, 1997) ne s’est pas traduite par un gain en survie (médianes de 28 et 33 semaines), du fait d’une surmortalité; mais ces schémas utilisaient de fortes doses de 5FU et de cisplatine, non utilisées actuellement.
Les schémas associant 5FU à un sel de platine (cisplatine, oxaliplatine) étaient la référence avant l’arrivée de l’immunothérapie (Mitry et al, 2004; Al-Batran et al, 2008; Cunningham et al, 2008).
La vinorelbine (Bidoli et al, 2001), le paclitaxel, le docetaxel (Shirakawa et al, 2014), l’irinotecan (Liu et al, 2020a), la gemcitabine et le carboplatine sont également utilisables selon différents schémas (FOLFIRI, Irinotecan-cisplatine (Kim et al, 2017), cisplatine-vinorelbine, cisplatine-paclitaxel ou carboplatine-paclitaxel) essentiellement étudiés dans des essais de phase II monobras de faible effectif.
Un score (basé sur le BMI, les métastases osseuses et l’albuminémie) a été développé prédisant le contrôle tumoral en première ligne de chimiothérapie systémique et permettant de reconnaitre les patients chez qui une chimiothérapie de première ligne métastatique est peu efficace (Kotecki et al, 2016).
Une phase II randomisée française, l’essai E-DIS (Adenis et al, 2019), chez des patients ayant des métastases de carcinome épidermoïde, avec un indice de performance 0-2, stables après 6 semaines d’une association 5FU – platine (schéma LV5FU2- cisplatine ou FOLFOX), a comparé pause et reprise de la chimiothérapie à la progression versus la poursuite du même schéma. Malgré une différence en survie sans progression il n’y avait aucun bénéfice en survie globale en faveur de la poursuite du traitement (survie médiane : 8,5 vs 8,8 mois).
Aucune thérapie ciblée n’a montré son intérêt dans les carcinomes épidermoïdes de l’œsophage métastatique.
REFERENCE
Le schéma FOLFOX peut donc se substituer aux schémas à base de 5FU-cisplatine dans le traitement des carcinomes épidermoïdes métastatiques ou avancés non éligibles à un traitement par immunothérapie (grade B).
Au-delà de la première ligne les données sont encore plus fragmentaires. Il n’existe pas actuellement de traitement de deuxième ligne de référence dans les carcinomes épidermoïdes de l’œsophage métastatiques et/ou inopérables et l’approche thérapeutique est différente selon le pays et le centre. Ainsi une inclusion dans les essais thérapeutiques doit être privilégiés. Certaines chimiothérapies ont été évaluées dans des études rétrospectives : irinotécan, docétaxel et paclitaxel (Lordick et al, 2003; Yun et al, 2011). L’irinotécan (55 mg/m2) plus docétaxel (25 mg/m2) aux jours 1, 8 et 15 (cycle de 28 jours) dans le cancer de l’œsophage prétraité par cisplatine est peu efficace et toxique. Le taux de réponse était de 12,5%, la survie sans progression médiane de 9 semaines et le temps médian de survie de 26 semaines (Lordick et al, 2003). En France, pays ayant une incidence élevée de carcinomes épidermoïdes de l’œsophage métastatique, les protocoles les plus fréquemment employés en deuxième ligne sont le 5FU plus irinotécan (FOLFIRI) et le paclitaxel en monothérapie (Yun T et al, 2011 ; Auzolle C et al, JFHOD 2015). Le paclitaxel (80 mg/m2 aux jours 1 et 8) plus capécitabine (900 mg/m2 par voie orale deux fois par jour aux jours 1 à 14) toutes les 3 semaines, jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable, a été évalué chez 32 patients (Yun et al, 2011). La survie sans progression médiane était de 5,2 mois (IC à 95%, 4,0-6,4) et la survie globale médiane de 8,4 mois (IC à 95%, 6,6-10,1). Dans une étude rétrospective française, 78 patients ayant reçu une chimiothérapie de deuxième ligne pour un carcinome épidermoïde de l’œsophage métastatique ont été analysés. La survie globale était de 7,5 mois (IC à 95% 3,8-8,8) pour le paclitaxel (n=22) et de 8,7 mois (IC à 95% 6,8-14,5) pour FOLFIRI (n=29). Les taux d’effets indésirables sévères de grade 3-4 étaient similaires pour le FOLFIRI et le paclitaxel (Auzolle C et al, JFHOD 2015). Il y a actuellement en France un essai de phase II randomisé comparant en 2ème ligne des carcinomes épidermoïdes de l’œsophage métastatique, progressif après une première ligne à base de sels de platine, le paclitaxel versus le 5FU NALIRI (irinotécan nanoliposomal) (essai OESIRI) (Randrian et al, 2020).
OPTION
Il n’y a pas de standard de traitement des carcinomes épidermoïdes métastatiques ou avancés en 2ème ligne, hors essai, l’irinotécan seul ou combiné au 5FU et le paclitaxel peuvent être proposés (avis d’expert).
Pour les adénocarcinomes :
Les schémas de chimiothérapie sont différents et identiques à ceux des adénocarcinomes de l’estomac métastatiques/non résécables détaillée dans le chapitre 2 du TNCD cancer gastrique (Zaanan et al, 2018).
- Les adénocarcinomes de la jonction œsogastrique sont plus souvent Her2 positifs que les adénocarcinomes gastriques (30,5% vs 19,8%). Ces cancers représentaient 20% des cas de la série TOGA et l’addition de trastuzumab était aussi efficace dans les cancers gastriques que dans ceux de la jonction (Bang et al, 2010). Le statut Her2 est donc à demander systématiquement devant tout adénocarcinome de l’œsophage ou de la jonction œsogastrique métastatique.
1.4.7.6.2. Résultats concernant l’immunothérapie des cancers de l’œsophage avancés non éligibles à un traitement local et métastatiques
Les principales immunothérapies utilisées sont les ICI bloquant l’interaction Programmed death-1/Programmed death-ligand 1 (PD1/PD-L1) et Cytotoxic T-lymphocyte associated protein 4/B7 (CTLA4/B7).
Les ICI sont très efficaces sont très efficaces dans les tumeurs dMMR/MSI, notamment les adénocarcinomes oeso-gastriques dMMR/MSI métastatiques (cf. chapitre 2 TNCD « cancer gastrique »).
L’essai de phase III KEYNOTE-590, randomisé, contrôlé contre placebo, évaluait le pembrolizumab (200 mg toutes les 3 semaines pour 35 cycles maximum) en association à la chimiothérapie (5-FU et cisplatine) versus la chimiothérapie seule en traitement de 1ère ligne des cancers avancés de l’œsophage (27% d’adénocarcinome). Dans le groupe CPS ≥10 la SG passait de 8,8 mois avec la chimiothérapie à 13,9 mois avec la combinaison chimiothérapie plus pembrolizumab (Sun et al, 2021). Comme dans la plupart des études, les survies étaient significativement supérieures pour les sous-groupes avec un CPS élevé sans qu’un seuil consensuel d’expression de PD-L1 soit défini. Le pembrolizumab a obtenu une AMM européenne, en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine, dans le traitement de 1ère ligne des patients atteints d’un cancer de l’œsophage ou de la jonction oeso-gastrique HER2 négatif, localement avancé non résécable ou métastatique, avec un CPS ≥10. Le pembrolizumab est maintenant remboursé dans l'indication :
« en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine, dans le traitement de première ligne des patients adultes atteints d'un cancer de l'œsophage ou d'un adénocarcinome de la jonction gastro-œsophagienne HER-2 négatif uniquement de type I (classification Siewert), localement avancés non résécables ou métastatiques, dont les tumeurs expriment PD-L1 avec un CPS ≥ 10."
Les essais ESCORT 1, ORIENT 15, JUPITER 06, RATIONALE 306 ont également démontré la supériorité de la chimiothérapie plus immunothérapie par rapport à la chimiothérapie seule dans les cancers épidermoïdes de l’œsophage localement avancé non résécable ou métastatique avec d’autres anti-PD1/PD-L1 dans des populations exclusivement asiatiques. L’essai CheckMate 648 dans une population essentiellement asiatique avec un cancer épidermoïdes de l’œsophage avec un TPS ≥1% a évalué le nivolumab (240 mg toutes les 2 semaines) + CT versus CT et le nivolumab (3 mg/kg toutes les 2 semaines) plus ipilimumab (1 mg/kg toutes les 6 semaines) vs CT (Doki et al, 2022). Il existait un gain en SG avec le nivolumab + CT (médiane, 15,4 vs. 9,1 mois; hazard ratio=0,54; 99.5% IC 0,37-0,80; p<0,001) et le nivolumab + ipilimumab (médiane, 13,7 vs. 9,1 mois; hazard ratio=0,64; 99.5% IC 0,46-0,90; p=0,001) versus CT dans la population avec un TPS ≥1%. Cependant, l’association nivolumab + ipilimumab ne permet pas d’améliorer la SSP comparée à la chimiothérapie seule alors que dans le bras nivolumab + CT il y avait un gain en SSP (hazard ratio=0,65; 99.5% IC 0,46-0,92; p=0,002). Dans l’essai CheckMate-648, il était rapporté 47 % d’effets indésirables liés au traitement de grade ≥ 3 dans le bras chimiothérapie + nivolumab, 32% dans le bras nivolumab + ipilimumab et 36% dans le bras chimiothérapie. Dans tous ces essais la proportion de longs survivants, au-delà de 1 an, est plus importante dans les bras traités avec ICI, de l’ordre de 30 % des patients, alors qu’elle est le plus souvent inférieure à 20 % en l’absence de traitement par ICI. De plus, le taux d’effets secondaires de grade ≥ 3 étaient similaires entre les bras chimiothérapie et les bras chimiothérapie plus immunothérapie.
Le nivolumab et l’ipilimumab ont obtenu une AMM européenne (non remboursé en France). Le nivolumab en association à l'ipilimumab est indiqué dans le traitement de première intention des patients adultes atteints d'un carcinome épidermoïde de l'œsophage avancé, récidivant ou métastatique, non résécable, avec une expression des cellules tumorales PD-L1 (TPS) ≥ 1%. Le nivolumab en association avec une chimiothérapie à base de fluoropyrimidine et de platine est indiqué et remboursé pour le traitement de première intention des patients adultes atteints d'un carcinome épidermoïde de l'œsophage avancé, récidivant ou métastatique, non résécable, avec une expression des cellules tumorales PD-L1 (TPS) ≥ 1%.
REFERENCE
La combinaison chimiothérapie à base de sels de platine et pembrolizumab est un standard de traitement de 1ère ligne des patients atteints d'un cancer de l'œsophage ou de la jonction oeso-gastrique (Siewert 1, HER2 négatif si adénocarcinome), localement avancé non résécable ou métastatique, avec un CPS ≥10.
La combinaison chimiothérapie à base de fluoropyrimidine et de platine et Nivolumab en association avec une chimiothérapie est un standard de traitement de 1ère ligne des patients atteints d'un carcinome épidermoïde de l'œsophage avancé, récidivant ou métastatique, non résécable, avec une expression des cellules tumorales PD-L1 (TPS) ≥ 1 %.
Au-delà de la première ligne, les premières études publiées d’immunothérapie versus placebo chez les patients avec des tumeurs chimio-résistantes montraient des signaux d’efficacité encourageants. L’étude de phase III Keynote-181, qui a inclus des carcinomes épidermoïdes et des adénocarcinomes de l’oesophage, a comparé le pembrolizumab en monothérapie aux schémas classiques de chimiothérapie de 2ème ligne par taxane ou irinotécan (Kojima et al, 2020). Les objectifs principaux étaient la SG chez les patients avec une tumeur avec un CPS ≥10, avec un carcinome épidermoïde et dans la population globale. Il existait un gain de SG avec le pembrolizumab dans les tumeurs avec un CPS ≥10 (9,3 versus 6,7 mois ; HR=0,69 ; p=0,0074), avec un carcinome épidermoïde (8,2 versus 7,1 mois ; HR=0,78 ; p=0,0095) mais pas dans la population globale (7,1 versus 7,1 mois ; HR=0,89 ; p=0,0560). Dans la population globale, il existait un effet délétère de l’immunothérapie en SSP (2,1 mois versus 3,4 mois) suggérant que l’immunothérapie seule n’est pas opportune dans les adénocarcinomes de l’oesophage et les tumeurs avec un CPS<10. En revanche, dans les carcinomes épidermoïdes, les études de phase III avec le nivolumab, camrelizumab et tislelizumab ont montré une amélioration significative de la SG par rapport à la chimiothérapie de 2ème ligne (Kato et al, 2019; Huang et al, 2020). Le gain de SG médiane n’est que d’environ 2 mois mais il existe des longs survivants, au-delà de 2 ans, dans les bras traités par ICI, cependant la proportion reste faible aux environ de 20 %. En ce qui concerne la survie sans progression (SSP), la supériorité des ICI sur la chimiothérapie n’existe que pour environ la moitié des patients ce qui se traduit par des SSP médiane peu différentes entre les bras de patients traités par ICI ou chimiothérapie. L’étude ATTRACTION 3 a montré un gain en SG (10,9 mois versus 8,4 mois) mais un effet délétère en SSP (1,7 mois versus 3,4 mois) du nivolumab versus un taxane (Kato et al, 2019). Le pourcentage de survivants à 18 mois (31% vs 21%) était en faveur du nivolumab (240 mg toutes les 3 sem) vs des taxanes (paclitaxel ou docetaxel), avec un meilleur profil de toxicité et ce sans impact du niveau d’expression de PD-L1. Le nivolumab a obtenu une AMM européenne en monothérapie dans le traitement des patients atteints d’un carcinome épidermoïde, avancé non résécable, récurrent ou métastatique, après une chimiothérapie combinée antérieure à base de fluoropyrimidine et de sels de platine. Il n’y a pas de remboursement en France compte tenu du service médical rendu jugé insuffisant d’autant plus qu’il s’agit d’une population exclusivement asiatique.
L’immunothérapie seule est inefficace dans les adénocarcinomes de l’œsophage et a une efficacité modérée dans les carcinomes épidermoïdes en 2ème ligne de traitement et n’a pas de remboursement en France.
Concernant les adénocarcinomes de l’œsophage et de la jonction œso-gastrique, il n’y a pas d’essai dédié d’immunothérapie, ceux-ci étant inclus soient dans les essais « œsophage » soit dans les essais « estomac ». Seul l’essai KEYNOTE 590 a inclus des adénocarcinomes (27%) et le gain en SG était à la limite de la significativité contrairement aux carcinomes épidermoïdes et les données du sous-groupe des adénocarcinomes avec un CPS ≥10 ne sont pas connues. Toutes les autres études d’immunothérapie incluaient des adénocarcinomes de la jonction œso-gastriques et des adénocarcinomes de l’estomac (cf. chapitre « estomac »). Le premier essai en 1ère ligne est l’étude Keynote-062 qui testait le pembrolizumab en monothérapie ou en combinaison avec la chimiothérapie, comparé à la chimiothérapie seule (Shitara et al, 2020). L’étude est globalement négative pour les deux schémas expérimentaux (pembrolizumab +/- chimiothérapie) qui n’étaient pas supérieurs à la chimiothérapie standard en termes de SG et SSP. En revanche l’étude de phase III CheckMate-649, qui comparait en 1ère ligne de traitement le nivolumab plus une chimiothérapie de type FOLFOX/XELOX à la chimiothérapie seule est positive (Janjigian et al, 2021b). La médiane de SG augmentait de 11,1 mois à 14,4 mois chez les patients avec une tumeur avec un CPS ≥ 5 (p<0,0001) mais pas dans les populations avec un CPS < 5.
L’étude ATTRACTION 4 montre des résultats identiques dans une population exclusivement asiatique.
L’essai de phase III Keynote-859 a comparé dans les adénocarcinomes œso-gastriques HER2 négatif non résécables la combinaison pembrolizumab plus chimiothérapie (5FU plus cisplatine ou CapOx) versus chimiothérapie plus placebo (Rha et al, 2023). Dans la population PD-L1 CPS ≥1, la médiane de SG était de 13,0 mois (95% CI 11.6-14.2) pour le pembrolizumab plus chimiothérapie versus 11,4 mois (95% CI 10.5-12.0) pour le placebo plus chimiothérapie (HR 0.74, 95% CI 0.65-0.84; P < 0.0001) et la médiane de SSP de 6,9 mois (95% CI 6.0-7.2) versus 5,6 mo (95% CI 5.4-5.7) (HR 0.72, 95% CI 0.63-0.82; P < 0.0001). La différence en survie était plus importante de la population PD-L1 CPS ≥10 médiane SG de 15,7 mois (95% CI 13.8-19.3) versus 11,8 mois (95% CI 10.3-12.7) (HR 0.65, 95% CI 0.53-0.79; P < 0.0001) et médiane de SSP de 8,1 mois (95% CI 6.8-8.5) versus 5,6 mois (95% CI 5.4-6.7) (HR 0.62, 95% CI 0.51-0.76; P < 0.0001). En l’absence de données détaillées pour les populations avec un CPS entre 1 et 5 et 5 et 10, il est difficile de conclure sur les données d’efficacité.
L’essai de phase III Keynote-811 a comparé dans les adénocarcinomes oeso-gastriques HER2+ la combinaison pembrolizumab + trastuzumab et chimiothérapie (5FU plus cisplatine ou CapOx) au standard trastuzumab et chimiothérapie (Janjigian et al, 2021a). Seule l’analyse intermédiaire pré-spécifiée sur le taux de réponse est disponible et montre une augmentation du taux de réponse de 51,9% à 74,4% (p=0,00006).
Le nivolumab a obtenu une AMM européenne dans le traitement des patients atteints d’un AOG avec un CPS ≥ 5 avancé, non résécable ou métastatique, en combinaison à une chimiothérapie par fluoropyrimidine et sels de platine. Le nivolumab est maintenant remboursé dans l'indication :
« en association à une chimiothérapie combinée à base de fluoropyrimidine et de sels de platine, en première ligne de traitement, dans le traitement des patients adultes atteints d’un adénocarcinome gastrique, de la jonction œso-gastrique ou de l’œsophage avancé ou métastatique, HER-2 négatif, dont les tumeurs expriment PD-L1 avec un score positif combiné (Combined Positive Score : CPS) ≥ 5.»
REFERENCE
La combinaison nivolumab plus chimiothérapie (FOLFOX/XELOX) est le un standard de 1ère de ligne des adénocarcinomes oeso-gastriques métastatiques (HER2 négatif) avec un score CPS ≥ 5
En deuxième ligne et plus, le nivolumab et le pembrolizumab, ont été testés d’abord versus placebo dans les adénocarcinomes oeso-gastriques avec des résultats encourageant mais les essais de phase III en 2ème et 3ème ligne versus chimiothérapie, Keynote-061 et Javelin Gastric 300, sont tous les deux négatifs (Bang et al, 2018; Shitara et al, 2018).
1.4.8. Les traitements endoscopiques
1.4.8.1. A visée curative
La résection muqueuse par voie endoscopique est le traitement de référence des néoplasies superficielles ou à faible risque d’envahissement ganglionnaire ((Pimentel-Nunes et al, 2015). Le risque d’envahissement ganglionnaire, mais aussi de récidive néoplasique ganglionnaire ou métastatique dépend du type histologique mais également de la profondeur d’infiltration tumorale, du degré de différentiation et de la présence ou non d’embole lymphatique ou vasculaire (Pimentel-Nunes et al, 2015).
On peut estimer pour les carcinomes épidermoïdes, en l’absence d’un autre facteur histopronostique péjoratif, un risque ganglionnaire nul pour les lésions T1a m1 et T1a m2, atteignant 4% dans les rares études prospectives de gros volume disponible (Oda et al, 2020; Sato et al, 2022), et 0-8%, voire 16% dans les tumeurs T1b sm1 (Tajima et al, 2000; Akutsu et al, 2013; Yamashina et al, 2013). Enfin, pour les tumeurs envahissant la sous muqueuse profonde, le risque d’envahissement ganglionnaire ou de récidive à distance dépasse 30% dans la plupart des séries chirurgicales (Pimentel-Nunes et al, 2022). Ceci conduit à considérer une résection endoscopique monobloc et histologiquement complète comme curative lorsqu’elle intéresse une lésion T1a ou sous muqueuse sm1, en l’absence de tout autre facteur histopronostique défavorable. Dans le cas contraire, le traitement endoscopique est considéré comme non curatif, et un traitement complémentaire chirurgical est indiqué. En présence d’une contre-indication opératoire, un traitement par radiochimiothérapie ou une surveillance rapprochée peuvent être discutés (Minashi et al, 2019).
Pour les adénocarcinomes, en l’absence d’un autre facteur histopronostique péjoratif, le risque ganglionnaire est négligeable pour les tumeurs T1a, varie de 1,5 à 6% pour les tumeurs T1b sm1 (Manner et al, 2008; Gotink et al, 2022), et de 7 à 35% pour les lésions atteignant la sous muqueuse profonde (Gotink et al, 2022; Nieuwenhuis et al, 2022). Ceci conduit à considérer une résection endoscopique monobloc et histologiquement complète comme curative lorsqu’elle intéresse une lésion T1a ou sous muqueuse sm1, en l’absence de tout autre facteur histopronostique défavorable. Dans le cas contraire, le traitement endoscopique est considéré comme non curatif, et un traitement complémentaire chirurgical est indiqué. En présence d’une contre-indication opératoire, une surveillance rapprochée peut être discutée (Künzli et al, 2018).
1.4.8.1.2. Aspects techniques
La qualité de la résection est essentielle pour un traitement curatif. Elle doit être monobloc avec des marges latérales et profondes saines. La mucosectomie n’assure cette qualité que pour les lésions inférieures à 10 mm. Pour les lésions de plus de 10 mm, la dissection sous muqueuse constitue la technique recommandée depuis 2015 pour les carcinomes épidermoïdes. Sa place relative à la mucosectomie pour les adénocarcinomes reste discutée, et à ce jour limitée aux lésions à forte probabilité d’envahissement sous muqueux (lésion ulcérée ou déprimée) (Pimentel-Nunes et al, 2022) et à ce jour limitée « au niveau européen ». Compte tenu de sa bonne accessibilité en France, le choix de la technique doit être laissé à l’endoscopiste.
1.4.8.2. A visée palliative
Si la palliation de la dysphagie par des dilatations œsophagiennes en cas de sténose bénigne cicatricielle (post radique ou anastomotique) est possible, la dilatation d’une sténose oesophagienne tumorale est contre-indiquée du fait de son inefficacité et du risque de perforation tumorale. La dysphagie sera traitée au mieux par la mise en place d’un stent (ou endoprothèse) oesophagien, métallique couverte autoexpansible, par voie endoscopique et sous guidage fluoroscopique (Spaander et al, 2016). Il n’existe pas d’intérêt à ajouter systématiquement un traitement par radiothérapie externe en plus d’un stent. La radiothérapie peut néanmoins être utile en cas de lésion à risque hémorragique (Adamson et al, 2021). Celle-ci permet d’éviter le support nutritionnel par gastrostomie endoscopique ou radiologique dans une vaste majorité de cas. Les techniques endoscopiques de destruction tumorale locale (laser, plasma argon) sont actuellement abandonnées.
La curiethérapie endoluminale, lorsque la technique est disponible, permet un contrôle local de la maladie récidivante en territoire irradié, de plus de 10 mois, ce d’autant qu’il existe un état général conservé et un amaigrissement peu important. Il a été rapporté un taux de survie de plus de 15% à 2 ans après ré-irradiation par curiethérapie (Wong Hee Kam et al, 2015; Kissel et al, 2020). Sous réserve du respect des contraintes de dose aux organes à risque, il est délivré en général une dose de 30 Gy à raison d’une séance hebdomadaire de 5 Gy par curiethérapie HDR.
1.5. Indications thérapeutiques
1.5.1. Cancers superficiels (in situ ou T1)
REFERENCES
Compte tenu de leurs particularités, les dossiers de tumeurs œsophagiennes superficielles doivent être discutés en présence d’un pathologiste, d’un gastroentérologue endoscopiste interventionnel et d’un chirurgien, dans l’idéal au cours d’une RCP dédiées.
- Pour le carcinome épidermoïde :
- La dissection sous muqueuse (DSM) doit être préférée à la mucosectomie. La mucosectomie reste une option pour les lésions < 10 mm.
- Une résection endoscopique monobloc R0 d’une lésion superficielle m1 ou m2, sans envahissement lympho-vasculaire est considérée comme curative.
- Une résection endoscopique monobloc R0 d’une lésion superficielle bien ou moyennement différenciée, m3/sm1 (≤ 200 µm), sans invasion lympho-vasculaire, est à faible risque d’envahissement ganglionnaire et est curative dans la grande majorité des cas. La réalisation d’un traitement complémentaire doit être discuté en RCP et mis en balance avec l’état général du patient, ses comorbidités, le risque des traitements complémentaires.
- Après résection endoscopique, un traitement complémentaire (radio-chimiothérapie et / ou chirurgie selon l’état général du patient) est recommandé :
- Pour les lésions présentant un envahissement sous muqueux de plus de 200 µm (T1b sm2-sm3) ou en cas de marge profonde positive
- En cas de faible grade de différenciation tumorale
- En cas d’emboles veino-lymphatiques
- En cas de marge latérale positive sans autre critère péjoratif, une surveillance endoscopique ou un retraitement endoscopique peuvent être proposés.
- Pour l’adénocarcinome :
- La résection endoscopique de toute lésion visible au sein d’un œsophage de Barrett est recommandée afin d’avoir un staging précis.
- La dissection sous-muqueuse n'a pas montrée sa supériorité par rapport à la mucosectomie, mais elle doit être préférée dans des cas sélectionnés : lésions > 15mm, lésions avec un faible soulèvement et en cas de suspicion d'invasion sous muqueuse (ulcération, dépression). Dans les autres cas, le choix de la technique (mucosectomie ou dissection) est laissé à l’endoscopiste. (accord d’experts)
- L’analyse histologique de la pièce de résection endoscopique permettra d’adapter l’attitude thérapeutique :
- La résection monobloc R0 d'une lésion superficielle avec adénocarcinome muqueux (m1, m2, m3) est suffisante.
- La résection monobloc R0 d'une lésion sm1 (≤ 500 μm) avec des critères favorables (bien ou moyennement différenciée, sans invasion lympho-vasculaire) est potentiellement curative. La discussion d’une chirurgie complémentaire en RCP doit mettre en balance le faible risque d’envahissement ganglionnaire avec le risque opératoire du patient.
- La chirurgie est en revanche recommandée en cas d’invasion lympho-vasculaire, de lésion peu différenciée, d’invasion profonde > 500μm, et/ou de marge profonde positive.
- En cas de marge latérale positive ou de résection en fragments sans autre critère péjoratif la surveillance ou le retraitement endoscopique est préféré à la chirurgie.
- Après une résection endoscopique curative d’un cancer superficiel sur muqueuse de Barrett, une éradication du Barrett résiduel est nécessaire afin de prévenir la survenue de lésions métachrones. La radiofréquence oesophagienne est la technique ablative la plus employée dans cette indication, notamment en cas de surface importante, afin d’éviter les sténoses œsophagiennes cicatricielles.
OPTIONS
Si le traitement endoscopique est impossible ou incomplet :
- - Œsophagectomie chez les patients opérables qui constitue le traitement de référence,
- - CRT à visée exclusive en seconde intention chez les patients non opérables.
ESSAI CLINIQUE
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
1.5.2. Cancers invasifs opérables
1.5.2.1 Stades précoces (cT2 cN0 M0)
RÉFÉRENCE
- Chirurgie seule (œsophagectomie) (grade A)
OPTIONS
- CRT exclusive : RT sans dépasser 50,4 Gy (1,8 à 2 Gy/fraction en 25 à 30 fractions) avec chimiothérapie par 6 cures de FOLFOX ou 4 cures de 5FU-cisplatine (grade B) (contre-indication ou refus de la chirurgie) ou carboplatine paclitaxel (avis d’experts)
- Chimiothérapie adjuvante post-opératoire, si N+ ou si résection R1 (grade C)
- Traitement préopératoire en cas de lésion volumineuse CT2 ou peu différenciée ou avec LVI (même indication qu’en cas de stade localement avancé) (avis d’experts).
ESSAI CLINIQUE
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
1.5.2.2. Stades localement avancés (cT3-T4a ou cN1-3 M0)
Cancers épidermoïdes
RÉFÉRENCES
- Soit chimio-radiothérapie néoadjuvante (schéma CROSS 41 Gy + Carboplatine pacltaxel hebdomadaire ou 45 Gy + 2 cures de 5FU-cisplatine) suivie d’une chirurgie dans un centre expert (grade B) suivi d’une immunothérapie adjuvante par nivolumab en cas de persistance tumorale prouvée (grade B)
- Soit chimio-radiothérapie exclusive : RT sans dépasser 50,4 Gy (1,8 à 2 Gy/fraction en 25 à 30 fractions) avec chimiothérapie par 6 cures de FOLFOX ou 4 cures de 5FU-cisplatine (grade B)
- Si persistance tumorale prouvée après la fin de la chimio-radiothérapie ou récidive locorégionale après une réponse clinique complète : chirurgie de rattrapage dans un centre expert (grade B)
OPTIONS
- Chimio-radiothérapie néoadjuvante : RT 45 Gy+ 4 cures de FOLFOX (avis d’experts)
- Chimio-radiothérapie exclusive : RT sans dépasser 50,4 Gy (1,8 à 2 Gy/fraction en 25 à 30 fractions) avec chimiothérapie carboplatine + paclitaxel hebdomadaire (avis d’experts)
ESSAIS CLINIQUES
- ARION (PRODIGE 67) : ajout de Durvalumab en concomitant et en entretien à un schéma de CRT exclusive (50,4 Gy + Folfox). Coordonnateurs : L Quero (APHP), A Modesto (Toulouse)
https://clinicaltrials.gov/ct2/show/NCT03777813 - FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
Adénocarcinomes
RÉFÉRENCES
- Soit chirurgie encadrée d’une chimiothérapie périopératoire de type FLOT (grade A).
- Soit chimio-radiothérapie néoadjuvante (schéma CROSS 41 Gy + Carbo-paclitaxel ou 45 Gy+ 2 cures de 5FU-cisplatine) suivie d’une chirurgie dans un centre expert suivi d’une immunothérapie adjuvante par nivolumab en cas de persistance tumorale prouvée (grade B)
OPTIONS
- Chimio-radiothérapie néoadjuvante : RT 45 Gy + 4 cures de FOLFOX (avis d’experts)
- Chimio-radiothérapie exclusive : RT sans dépasser 50,4 Gy (1,8 à 2 Gy/fraction en 25 à 30 fractions) + FOLFOX ou 5FU-cisplatine (accord d’experts) (contre-indication ou refus de la chirurgie) ou + carboplatine paclitaxel (avis d’experts)
- Avec chirurgie de rattrapage (si patient opérable) dans un centre expert si persistance tumorale prouvée après la fin de la radio-chimiothérapie ou récidive locorégionale après une réponse clinique complète (grade B).
ESSAIS CLINIQUES
- IMHOTEP : Si tumeur MSI/dMMR ou EBV+ : Etude de phase 2 de monothérapie par pembrolizumab pour les patients porteurs d’un adénocarcinome oesogastrique dMMR/MSI ou EBV+. Coordonnateur : Dr De La Fouchardière (Lyon)
https://clinicaltrials.gov/ct2/show/ NCT04795661 - VESTIGE EORTC-1707-GITCG : étude de phase III randomisée chez les patients avec une résection R1 ou pN+ après chimiothérapie néoadjuvante par FLOT comparant la poursuite du FLOT versus une immunothérapie par nivolumab+ipilumab. Coordonnateur : F Lordick (Mainz, Allemagne)
https://clinicaltrials.gov/ct2/show/NCT03443856 - FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
1.5.3. Cancers de l'œsophage cervical
RÉFÉRENCE
CRT exclusive (accord d'experts)
En général chimio-radiothérapie concomitante exclusive de première intention, surtout lorsqu’une pharyngo-laryngectomie totale serait nécessaire.
Chirurgie de rattrapage dans un centre expert en l’absence de réponse complète, si résection R0 a priori possible (accord d’experts).
1.5.4. Cancers inopérables non métastatiques cT4b
1.5.4.1. CE : En l'absence d'envahissement trachéo-bronchique muqueux
RÉFÉRENCE
Chimio-radiothérapie exclusive :
RT 50,4 Gy en 5 semaines (1,8 à 2 Gy/fr, en 25 à 30 fractions) avec chimiothérapie FOLFOX ou 5FU-cisplatine (grade A).
ESSAIS CLINIQUES
- ARION (PRODIGE 67) : ajout de Durvalumab en concomitant et en entretien à un schéma de CRT exclusive (50,4 Gy + Folfox). Coordonnateurs : L Quero (APHP), A Modesto (Toulouse)
https://clinicaltrials.gov/ct2/show/NCT03777813 - OSAGE 01 : association de chimio-radiothérapie composée de carboplatine et de paclitaxel chez des patients âgés (plus de 75 ans) ayant un cancer de l’œsophage. Coordonnateur : J Boustani (Besançon)
- Essai clinique cancer Appareil digestif (autre que côlon et rectum)/Œsophage ouvert aux inclusions (e-cancer.fr)
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
1.5.4.2. CE : Avec envahissement trachéo-bronchique muqueux sans fistule
OPTION
- chimiothérapie première, suivie de chimio-radiothérapie exclusive en cas de disparition de l’envahissement trachéo-bronchique (accord d’experts) avec fractionnement normal (1,8 à 2 Gy/fraction)
- traitement endoscopique exclusif (de l’obstruction œsophagienne et/ou trachéo-bronchique) si le patient n’est pas apte à recevoir une chimiothérapie (accord d’experts).
ESSAI CLINIQUE
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
1.5.4.3. En cas de fistule
RÉFÉRENCE :
- prothèse œsophagienne expansive couverte plus ou moins prothèse trachéo-bronchique si l’envahissement trachéal est très obstructif puis chimiothérapie première, suivie de chimio-radiothérapie exclusive en cas de disparition de l’envahissement trachéo-bronchique (avis d’experts).
OPTION
- jéjunostomie, préférable à la gastrostomie (du fait du risque de reflux gastro-œsophagien), alimentation parentérale (comme solution d’attente) et soins de support exclusif si une prothèse est impossible à poser ou inefficace (accord d’experts).
ESSAI CLINIQUE
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
1.5.4.4. Adénocarcinome œsophagien ou de la jonction gastro-œsophagienne
OPTIONS (accord d’experts)
- Chimiothérapie systémique (FLOT) première
- Chimiothérapie à base de sels de platine et de fluoropyrimidine associée à du nivolumab en cas de lésion HER-2 négatif avec CPS PD-L1 ≥ 5 ou associé à du pembrolizumab si CPS PD-L1 ≥ 10
ou de trastuzumab en cas de lésion HER2 positive - CRT exclusive (RT 50 Gy en 5 semaines (1,8 à 2 Gy/fr, en 25 à 30 fractions) avec chimiothérapie FOLFOX ou 5FU-cisplatine peuvent se discuter avec discussion d’une chirurgie secondaire en cas de lésion devenant résécable.
ESSAI CLINIQUE
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
1.5.5. Cancers métastatiques
1.5.5.1. État général conservé (OMS 0, 1 ou 2)
Traitement de 1ère ligne
RÉFÉRENCE
a) Dysphagie importante :
- Traitement endoscopique de la dysphagie ou chimiothérapie première avec nutrition entérale (SNG ou GPE/GPR) et traitement endoscopique de la dysphagie en l’absence d’amélioration
puis chimiothérapie
- En cas de carcinome épidermoïde ou d’adénocarcinome HER-2 négatif (Siewert 1) avec CPS PD-L1 ≥ 10 : pembrolizumab en association à chimiothérapie à base de sels de platine et de fluoropyrimidine (grade B)
- En cas d’adénocarcinome HER-2 négatif avec CPS PD-L1 ≥ 5 : nivolumab en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine (grade B)
- En cas de carcinome épidermoïde avec une expression de PD-L1 dans les cellules tumorales (TPS) ≥ 1% : chimiothérapie à base de fluoropyrimidine et de platine et nivolumab (grade B)
- En cas de carcinome épidermoïde avec un TPS <1% ou d’adénocarcinome HER-2 négatif avec un CPS < 5 : chimiothérapie à base de sels de platine et de fluoropyrimidine (grade B)
- En cas d’adénocarcinome HER-2 positif : chimiothérapie à base de sels de platine et de fluoropyrimidine et trastuzumab (grade B)
- En cas d’adénocarcinome dMMR/MSI ou POLE muté : immunothérapie (pembrolizumab) (grade B) (pas de remboursement en France)
b) Dysphagie absente ou peu importante :
- Chimiothérapie +/- immunothérapie première (cf chapitre ci-dessus)
- et si la dysphagie s’aggrave, traitement symptomatique
OPTION
En cas de carcinome épidermoïde avec une expression des cellules tumorales PD-L1 (TPS) ≥ 1 % et en cas de contre-indication à une chimiothérapie cytotoxique: nivolumab (240 mg toutes les 2 semaines) plus ipilimumab (1 mg/kg toutes les 6 semaines) (avis d’experts) (pas de remboursement en France)
ESSAIS CLINIQUES
- EPIC-1511 : Impact de la survie globale d’une prise en charge palliative précoce dans les cancers métastatiques du haut appareil digestif traités par une chimiothérapie de première ligne : étude randomisée phase III. Coordonnateur : A Da Silva (Lille)
https://www.clinicaltrials.gov/ct2/show/NCT02853474 - FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
www.fregat-database.org
Traitement de 2ème ligne
RÉFÉRENCE
Pas de traitement de référence.
OPTIONS (accord d’experts)
- En cas de carcinome épidermoïde: chimiothérapie à base de taxane (paclitaxel ou docétaxel) ou irinotécan (FOLFIRI)
- En cas d’adénocarcinome HER-2 négatif: chimiothérapie à base de taxane (paclitaxel ou docétaxel) ou paclitaxel plus ramucirumab ou irinotécan (irinotécan seul ou FOLFIRI) (cf TNCD chapitre 2 Cancer de l’estomac)
- En cas d’adénocarcinome HER-2 positif : chimiothérapie à base de taxane (paclitaxel ou docétaxel) ou paclitaxel plus ramucirumab ou irinotécan (irinotécan seul ou FOLFIRI) ou trastuzumab déruxtécan (si disponible) (cf TNCD chapitre 2 Cancer de l’estomac)
- En cas d’adénocarcinome dMMR/MSI ou POLE muté : immunothérapie (pembrolizumab) (cf TNCD chapitre 2 cancer de l’estomac)
ESSAIS CLINIQUES non
1.5.5.2. État général altéré (OMS 3 ou 4)
RÉFÉRENCE
Si nécessaire traitement endoscopique de la dysphagie et soins de support exclusifs (accord d’experts).
1.6. Surveillance après traitement curatif
RÉFÉRENCE
Pas de surveillance de référence.
OPTIONS (accord ou avis d’expert)
1.6.1. Surveillance après résection endoscopique d’une tumeur superficielle
Le schéma de surveillance optimal après résection endoscopique d’un cancer de l’œsophage superficiel n’est pas clairement défini dans la littérature.
Adénocarcinome
La surveillance endoscopique est justifiée du fait du risque de lésion métachrone, même en cas d’éradication complète de l’œsophage de Barrett.
Endoscopie œsogastroduodénale avec chromoendoscopie virtuelle à 3, 6, 12 mois, puis annuellement à vie, avec biopsies ciblée de toute lésion visible, et biopsies systématiques en quadrant de la néo-ligne Z et du neo-épithélium malpighien (Noordzij et al, 2019).
Carcinome épidermoïde
Bien que la dissection sous muqueuse permette un taux de résection monobloc de plus de 95% avec des taux de récidives locale entre 0 et 2,6%, la recherche de lésion métachrone justifie la surveillance de l’œsophage.
- Endoscopie œsogastroduodénale à 3 mois puis annuelle (endoscope haute résolution) + chromoendoscopie virtuelle, avec biopsies ciblées.
En cas de lésion pT1bN0 réséquée endoscopiquement (sans facteur de mauvais pronostique ou en cas de patient non candidat à une chirurgie complémentaire) : Surveillance endoscopique comme indiquée ci-dessus et scanner TAP tous les ans pendant 3 ans, puis selon la symptomatologie clinique (avis d’experts).
1.6.2. Surveillance après résection chirurgicale curative
Les recommandations sur la surveillance des cancers de l’œsophage sont limitées par un faible niveau de preuves, avec uniquement des études de cohorte et observationnelles. Les modalités de la surveillance varient considérablement d’un pays à l’autre et d’un continent à l’autre allant de la réalisation d’examens uniquement en cas de symptômes (recommandations Européennes de l’ESMO 2017 ou recommandations du NICE en Grande Bretagne), à des examens périodiques systématiques (recommandations du NCCN aux Etats-Unis : TDM après traitements de tumeurs cT2-T4). La surveillance est associée à une majoration de l’anxiété pour les patients avec un impact potentiel sur sa qualité de vie. Si la majorité des récidives surviennent dans les 3 ans (90%), des études de suivi à long terme relèvent également des récidives tardives potentiellement guérissable pouvant survenir au-delà de 5 ans dans 6-8% des patients vivant sans récidive à 5 ans et également le risque de second cancer notamment en cas de carcinome épidermoïde (Depypere et al, 2017; Eyck et al, 2021a). Enfin en France une surveillance tous les 6 mois pendant 5 ans était préconisée en 2016 avec un niveau de preuve accord d’expert (G. Lledo, C. Mariette, J.-L. Raoul, L. Dahan, B. Landi, T. Conroy, G. Piessen, D. Tougeron, G. Créhange, V. Lepillez, P. Artru, A. Drouillard, J.-F. Bosset. «Cancer de l’œsophage». Thésaurus National de Cancérologie Digestive, 09-2016, [En ligne] http://www.tncd.org).
Les résultats récents de l’étude internationale ENSURE (20 centres, 4682 patients) (NCT03461341) montrent qu’une surveillance intensive (définie dans cette étude par un TDM thoraco-abdominal annuel pendant au moins 3 ans) permet une amélioration de la survie globale pour les patients traités par chirurgie première et pour les tumeurs localisées avec un pronostic histologique favorable après traitement néoadjuvant (y)pTis-2 (Elliott et al, 2022).
Dans l’essai adjuvant Checkmate 577 la surveillance suivante était proposée : TDM TAP toutes les 12 semaines pendant la 1ère et 2ème année, puis tous les 6 à 12 mois de la 3ème à la 5ème année.
Le schéma Français n’a pas été spécifiquement évalué et dans le contexte des évolutions récentes des modalités thérapeutiques avec l’avènement récente de l’immunothérapie qui n’a été pris en compte dans aucune étude à l’heure actuelle, nous proposons un schéma de surveillance après œsophagectomie :
La surveillance n’a d’intérêt que si les patients restent éligibles à un traitement spécifique d’une éventuelle récidive.
- Lésion pTis, T1a : en cas de résection incomplète de la muqueuse de Barrett, réaliser une technique d’ablation de l’EBO résiduel (radiofréquence) puis surveillance endoscopique comme indiqué en section 6.1. La surveillance par imagerie n’est pas recommandée en dehors de signes cliniques.
- Lésion pT1b (tout N) :
- Examen clinique et scanner TAP /6-12 mois pendant au moins 3 ans (et 5 ans maximum) et/ou en cas de signes clinique puis en cas de symptomatologie clinique si le patient est susceptible de tolérer un traitement complémentaire à visée curative/palliative en cas de récidive.
- Endoscopie œsogastrique tous les 2-3 ans ou en cas de signes cliniques (dysphagie, blocage alimentaire) ou anomalie à l’imagerie.
- Lésion pT2-T4,N0-N+,T4b : La littérature suggère que 90% des récidives surviennent dans les 36 mois après la chirurgie.
- Examen clinique et scanner TAP tous les 6 mois pendant 3 ans puis tous les 6-12 mois pendant 2 ans et/ou en cas de signes cliniques si le patient est susceptible de tolérer un traitement complémentaire à visée curative en cas de récidive.
Endoscopie œsogastrique tous les 2-3 ans ou en cas de signes cliniques (dysphagie, blocage alimentaire) ou anomalie à l’imagerie.
Dans tous les cas :
- Informer le patient de la possibilité de récidive au-delà de 5 ans et de consulter en cas de symptômes nouveaux
- Une aide au sevrage de l’alcool et du tabac doit être proposée
- Examen ORL annuel pour les cancers épidermoïdes
- Pas de fibroscopie bronchique systématique
- Scintigraphie osseuse, imagerie cérébrale en fonction des signes cliniques d’appel
- TEP-scanner en cas de suspicion de récidive au TDM
1.6.3. Surveillance après CRT exclusive en réponse complète
La majorité des récidives surviennent dans les 24 premiers mois (95%). Il est donc recommandé une surveillance tous les 3 mois pendant 2 ans puis une surveillance tous les 6 mois pendant 5 ans.
- Chez les patients opérables pour lesquels une chirurgie de rattrapage peut être proposée (si non, en fonction des symptômes).
- Examen clinique avec endoscopie œsogastrique (+ biopsies) et scanner TAP.
- TEP scanner en cas de suspicion de récidive ou afin d’éliminer une maladie métastatique qui contre indiquerait une éventuelle chirurgie de rattrapage.
1.7. Protocoles thérapeutiques
5 FU-Cisplatine
5FU 800 mg/m2 en perfusion continue de J1 à J5 sur diffuseur portable
Cisplatine 100 mg/m2 en 1h à J2
Hydratation obligatoire avant et après le cisplatine
- pré-hydratation : 2 litres de glucosé à 5 % + 4g NaCl / L + 2g KCl/litre + 1g sulfate de magnésium/litre à passer en 4 heures
- post-hydratation : 2 litres de glucosé à 5 % + 4g NaCl / litre + 2g KCl/litre+ 1 ampoule de gluconate de calcium/litre à passer en 4 heures
Traitement reproduit tous les 28 jours.
LV5FU2-cisplatine
Cisplatine 50 mg/m2 à J1 en 30 minutes dans 250 ml de chlorure de sodium à 0,9%.
Hydratation obligatoire avant et après le cisplatine
- pré-hydratation : 1 litre de glucosé à 5% + 4g NaCl + 2g KCl + 1g sulfate de magnésium à passer en 3 heures
- post-hydratation : 1 litre de glucosé à 5% + 4g NaCl + 2g KCl + 1 ampoule de gluconate de calcium à passer en 3 heures
Acide folinique 200 mg/m2 (ou acide l-folinique 100 mg/m2) en 2 heures dans 250 ml de G5% à J1.
Rincer puis 5FU 400 mg/m2 en 10 minutes dans 100 ml de G5% à J1.
5FU 1200 mg/m2 en perfusion continue de 44 heures sur diffuseur portable.
A J2, clamper le diffuseur de H24 à H26 pour passer l’acide folinique et le 5FU comme à J1.
Traitement reproduit tous les 14 jours.
LV5FU simplifié-cisplatine
Même schéma mais utilisant le schéma LV5FU simplifié.
FOLFOX 4 simplifié (ou FOLFOX 6 modifié)
Oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G 5% en Y de l'acide folinique à J1 + LV5FU2 simplifié
Traitement reproduit tous les 14 jours.
FOLFOX en cours de chimio-radiothérapie exclusive (Conroy T, 2014)
Oxaliplatine : 85 mg/m2 en 2 h dans 250 ml de G 5% en Y de l'acide folinique à J1
5FU : 400 mg/m² en bolus (10 min) à J1
1600 mg/m²/48h en perfusion continue.
FOLFIRI
Irinotécan : 180 mg/m2 en perfusion de 90 min dans 250 ml de G5% en Y de l'acide folinique à J1 + LV5FU2 simplifié
Traitement reproduit tous les 14 jours.
Carboplatine-paclitaxel + radiothérapie 41,4Gy en 23 fractions (5j/semaine)
Carboplatine : AUC 2mg/ml
Paclitaxel : 50mg/m2
Traitement reproduit tous les semaines (5 cycles à J1 J8 J15 J22 J29)
FLOT
Oxaliplatine : 85 mg/m2 en 2 h dans 250 ml de G 5% en Y de la leucovorine 200mg/m² à J1
Docetaxel : 50 mg/m² à J1
5 FU : 2600 mg/m²/24h à J1
Traitement reproduit tous les 14 jours.
Taxanes
Paclitaxel : 100 mg/m² sur 1 heure une fois par semaine 6 semaines sur 7
Docetaxel : 75 mg/m² sur 1 heure tous les 21 jours ; jusqu’à 6 cycles
Nivolumab en situation adjuvante
Nivolumab 240 mg sur 30 minutes toutes les 2 semaines pendant 16 semaines, puis 480mg 30 minutes toutes les 4 semaines pour une durée totale d’un an
FOLFOX Nivolumab
Oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G 5% en Y de l'acide folinique à J1 + LV5FU2 toutes les 2 semaines
Nivolumab 240 mg sur 30 minutes toutes les 2 semaines
Le traitement par nivolumab est recommandé jusqu'à progression de la maladie, toxicité inacceptable ou jusqu'à 24 mois sans progression de la maladie.
Nivolumab plus ipilimumab
Nivolumab 3 mg/kg sur 30 minutes toutes les 2 semaines,
Ipilimumab 1 mg/kg administré par voie intraveineuse pendant 30 minutes toutes les 6 semaines.
Le traitement est recommandé jusqu'à progression de la maladie, toxicité inacceptable ou jusqu'à 24 mois chez les patients sans progression de la maladie.
5FU cisplatine nivolumab
Nivolumab 240 mg sur 30 minutes toutes les 2 semaines
5-fluorouracil 800 mg/m² du J1 au J5 plus cisplatin 80 mg/m² au J1 toutes les 4 semaines
Le traitement est recommandé jusqu'à progression de la maladie, toxicité inacceptable ou jusqu'à 24 mois chez les patients sans progression de la maladie.
5FU cisplatine pembrolizumab
Pembrolizumab 200 mg sur 30 minutes toutes les 3 semaines
(ou 400 mg toutes les 6 semaines (avis d’experts))
5-fluorouracil 800 mg/m² du J1 au J5 plus cisplatine 80 mg/m² au J1 toutes les 3 semaines
Le Pembrolizumab est recommandé jusqu'à progression de la maladie, toxicité inacceptable ou jusqu'à 35 cycles chez les patients sans progression de la maladie.
FOLFOX pembrolizumab (avis d’experts)
Oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G 5% en Y de l'acide folinique à J1 + LV5FU2 toutes les 2 semaines
Pembrolizumab 200 mg sur 30 minutes toutes les 3 semaines
(ou 400 mg toutes les 6 semaines (avis d’experts))
Le pembrolizumab est recommandé jusqu'à progression de la maladie, toxicité inacceptable ou jusqu'à 35 cycles chez les patients sans progression de la maladie.
1.8. Arbres décisionnels
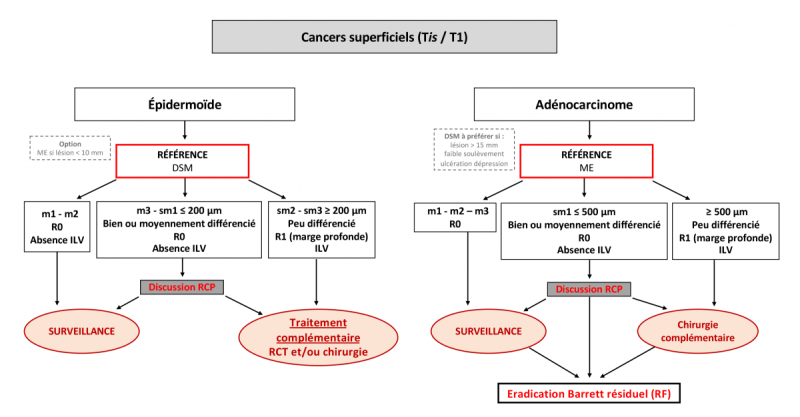
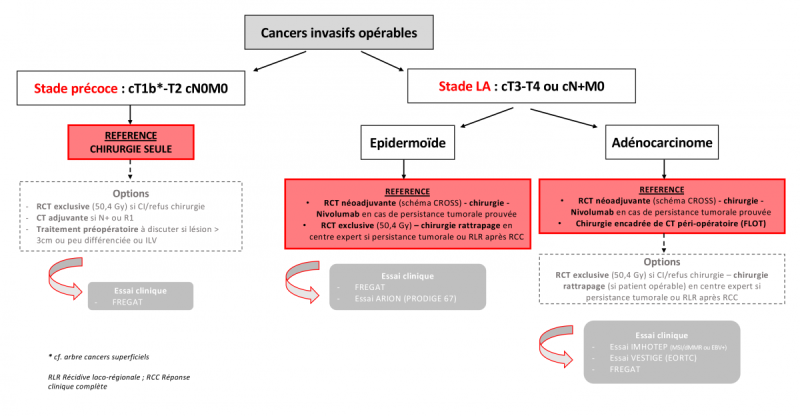
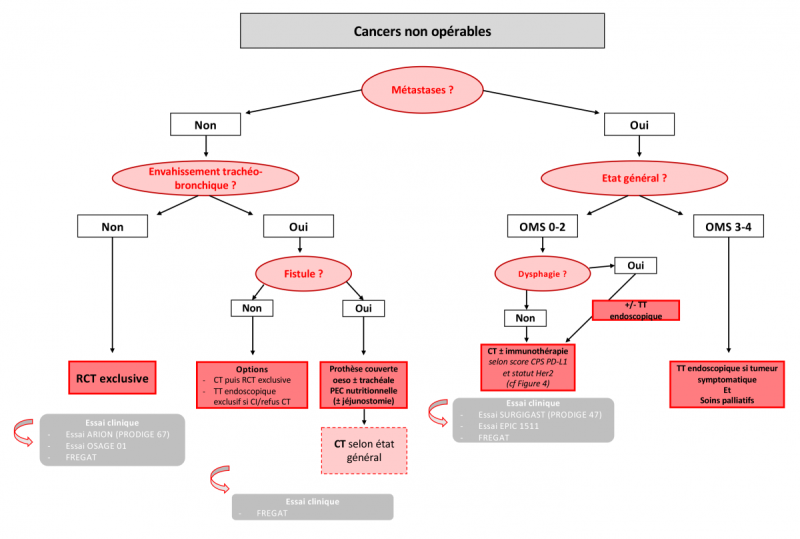
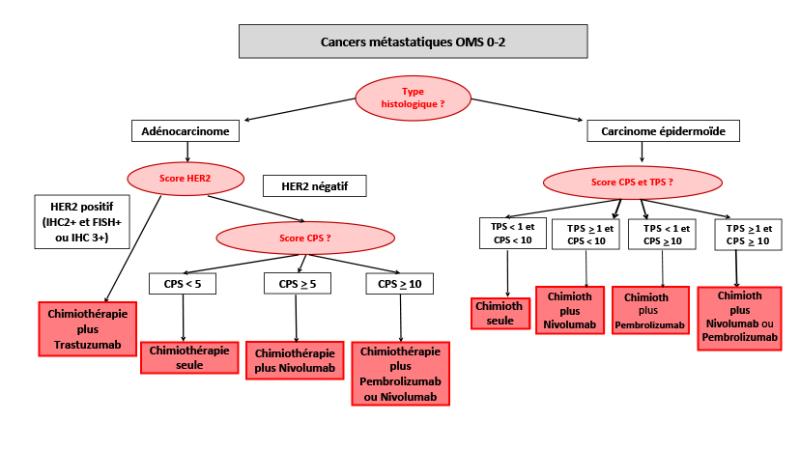
1.9. Bibliographie
- © Évaluation du statut MMR tumoral/synthèse, Collection Recommandations et référentiels, novembre 2021.
- Abdelsattar ZM, Habermann E, Borah BJ, Moriarty JP, Rojas RL, Blackmon SH (2020) Understanding Failure to Rescue After Esophagectomy in the United States. Ann Thorac Surg 109: 865–871, doi:10.1016/j.athoracsur.2019.09.044.
- Abnet CC, Arnold M, Wei W-Q (2018) Epidemiology of Esophageal Squamous Cell Carcinoma. Gastroenterology 154: 360–373, doi:10.1053/j.gastro.2017.08.023.
- Adamson D, Byrne A, Porter C, Blazeby J, Griffiths G, Nelson A, Sewell B, Jones M, Svobodova M, Fitzsimmons D, Nixon L, Fitzgibbon J, Thomas S, Millin A, Crosby T, Staffurth J, Hurt C (2021) Palliative radiotherapy after oesophageal cancer stenting (ROCS): a multicentre, open-label, phase 3 randomised controlled trial. Lancet Gastroenterol Hepatol 6: 292–303, doi:10.1016/S2468-1253(21)00004-2.
- Adenis A, Bennouna J, Etienne PL, Bogart E, Francois E, Galais MP, Ben Abdelghani M, Michel P, Metges JP, Dahan L, Conroy T, Ghiringhelli F, Drouillard A, El Hajbi F, Samalin E, Hiret S, Delaine-Clisant S, Mariette C, Penel N, Piessen G, Le Deley MC (2019) Continuation versus discontinuation of first-line chemotherapy in patients with metastatic squamous cell oesophageal cancer: A randomised phase II trial (E-DIS). Eur J Cancer 111: 12–20, doi:10.1016/j.ejca.2019.01.016.
- Adenis A, Le Sourd S, Mirabel X, Paumier A, Bogart E, Vendrely V, Glehen O, Dahan L, Simmet V, Bergeat D, Samalin E, Chauvenet M, d’Journo XB, Hiret S, Gronnier C, Gnep K, Vanseymortier M, El Hajbi F, Le Deley M-C, Piessen G (2022) Preoperative chemoradiation (CRT) with carboplatin (CBP)/paclitaxel (PCL) (CP) or with 5-fluorouracil (FU)/oxaliplatin (OX) (Fx) for esophageal or junctional cancer: A randomized phase 2 trial. JCO 40: 4015–4015, doi:10.1200/JCO.2022.40.16_suppl.4015.
- van Adrichem EJ, Meulenbroek RL, Plukker JTM, Groen H, van Weert E (2014) Comparison of two preoperative inspiratory muscle training programs to prevent pulmonary complications in patients undergoing esophagectomy: a randomized controlled pilot study. Ann Surg Oncol 21: 2353–2360, doi:10.1245/s10434-014-3612-y.
- Akutsu Y, Uesato M, Shuto K, Kono T, Hoshino I, Horibe D, Sazuka T, Takeshita N, Maruyama T, Isozaki Y, Akanuma N, Matsubara H (2013) The overall prevalence of metastasis in T1 esophageal squamous cell carcinoma: a retrospective analysis of 295 patients. Ann Surg 257: 1032–1038, doi:10.1097/SLA.0b013e31827017fc.
- Al-Batran S-E, Haag GM, Ettrich TJ, Borchert K, Kretzschmar A, Teschendorf C, Siegler GM, Ebert M, Goekkurt E, Welslau MK, Mahlberg RJC, Homann N, Pink D, Bechstein WO, Reichardt P, Gaiser T, Sookthai D, Pauligk C, Goetze TO, Hofheinz RD (2020) 1421MO Final results and subgroup analysis of the PETRARCA randomized phase II AIO trial: Perioperative trastuzumab and pertuzumab in combination with FLOT versus FLOT alone for HER2 positive resectable esophagogastric adenocarcinoma. Annals of Oncology 31: S899, doi:10.1016/j.annonc.2020.08.1927.
- Al-Batran S-E, Hartmann JT, Probst S, Schmalenberg H, Hollerbach S, Hofheinz R, Rethwisch V, Seipelt G, Homann N, Wilhelm G, Schuch G, Stoehlmacher J, Derigs HG, Hegewisch-Becker S, Grossmann J, Pauligk C, Atmaca A, Bokemeyer C, Knuth A, Jäger E, Arbeitsgemeinschaft Internistische Onkologie (2008) Phase III trial in metastatic gastroesophageal adenocarcinoma with fluorouracil, leucovorin plus either oxaliplatin or cisplatin: a study of the Arbeitsgemeinschaft Internistische Onkologie. J Clin Oncol 26: 1435–1442, doi:10.1200/JCO.2007.13.9378.
- Al-Batran S-E, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, Kopp H-G, Mayer F, Haag GM, Luley K, Lindig U, Schmiegel W, Pohl M, Stoehlmacher J, Folprecht G, Probst S, Prasnikar N, Fischbach W, Mahlberg R, Trojan J, Koenigsmann M, Martens UM, Thuss-Patience P, Egger M, Block A, Heinemann V, Illerhaus G, Moehler M, Schenk M, Kullmann F, Behringer DM, Heike M, Pink D, Teschendorf C, Löhr C, Bernhard H, Schuch G, Rethwisch V, von Weikersthal LF, Hartmann JT, Kneba M, Daum S, Schulmann K, Weniger J, Belle S, Gaiser T, Oduncu FS, Güntner M, Hozaeel W, Reichart A, Jäger E, Kraus T, Mönig S, Bechstein WO, Schuler M, Schmalenberg H, Hofheinz RD, FLOT4-AIO Investigators (2019) Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet 393: 1948–1957, doi:10.1016/S0140-6736(18)32557-1.
- Al-Batran S-E, Lorenzen S, Thuss-Patience PC, Homann N, Schenk M, Lindig U, Heuer V, Kretzschmar A, Goekkurt E, Haag GM, Riera Knorrenschild J, Bolling C, Hofheinz R-D, Angermeier S, Ettrich TJ, Siebenhuener A, Kopp C, Pauligk C, Goetze TO, Gaiser T (2022) Surgical and pathological outcome, and pathological regression, in patients receiving perioperative atezolizumab in combination with FLOT chemotherapy versus FLOT alone for resectable esophagogastric adenocarcinoma: Interim results from DANTE, a randomized, multicenter, phase IIb trial of the FLOT-AIO German Gastric Cancer Group and Swiss SAKK. JCO 40: 4003–4003, doi:10.1200/JCO.2022.40.16_suppl.4003.
- Alderson D, Cunningham D, Nankivell M, Blazeby JM, Griffin SM, Crellin A, Grabsch HI, Langer R, Pritchard S, Okines A, Krysztopik R, Coxon F, Thompson J, Falk S, Robb C, Stenning S, Langley RE (2017) Neoadjuvant cisplatin and fluorouracil versus epirubicin, cisplatin, and capecitabine followed by resection in patients with oesophageal adenocarcinoma (UK MRC OE05): an open-label, randomised phase 3 trial. Lancet Oncol 18: 1249–1260, doi:10.1016/S1470-2045(17)30447-3.
- Allen S, Brown V, Prabhu P, Scott M, Rockall T, Preston S, Sultan J (2018) A randomised controlled trial to assess whether prehabilitation improves fitness in patients undergoing neoadjuvant treatment prior to oesophagogastric cancer surgery: study protocol. BMJ Open 8: e023190, doi:10.1136/bmjopen-2018-023190.
- Altorki NK, Zhou XK, Stiles B, Port JL, Paul S, Lee PC, Mazumdar M (2008) Total number of resected lymph nodes predicts survival in esophageal cancer. Ann Surg 248: 221–226, doi:10.1097/SLA.0b013e31817bbe59.
- Ando N, Kato H, Igaki H, Shinoda M, Ozawa S, Shimizu H, Nakamura T, Yabusaki H, Aoyama N, Kurita A, Ikeda K, Kanda T, Tsujinaka T, Nakamura K, Fukuda H (2012) A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 19: 68–74, doi:10.1245/s10434-011-2049-9.
- Andre T, Tougeron D, Piessen G, De La Fouchardiere C, Louvet C, Adenis A, Jary M, Tournigand C, Aparicio T, Desrame J, Lièvre A, Garcia-Larnicol M-L, Pudlarz T, Henriques J, Cohen R, Lefevre J, Svrcek M (2022) Neoadjuvant nivolumab plus ipilimumab and adjuvant nivolumab in patients (pts) with localized microsatellite instability-high (MSI)/mismatch repair deficient (dMMR) oeso-gastric adenocarcinoma (OGA): The GERCOR NEONIPIGA phase II study. JCO 40: 244–244, doi:10.1200/JCO.2022.40.4_suppl.244.
- Bang Y-J, Ruiz EY, Van Cutsem E, Lee K-W, Wyrwicz L, Schenker M, Alsina M, Ryu M-H, Chung H-C, Evesque L, Al-Batran S-E, Park SH, Lichinitser M, Boku N, Moehler MH, Hong J, Xiong H, Hallwachs R, Conti I, Taieb J (2018) Phase III, randomised trial of avelumab versus physician’s choice of chemotherapy as third-line treatment of patients with advanced gastric or gastro-oesophageal junction cancer: primary analysis of JAVELIN Gastric 300. Ann Oncol 29: 2052–2060, doi:10.1093/annonc/mdy264.
- Bang Y-J, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T, Aprile G, Kulikov E, Hill J, Lehle M, Rüschoff J, Kang Y-K, ToGA Trial Investigators (2010) Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 376: 687–697, doi:10.1016/S0140-6736(10)61121-X.
- Bang Y-J, Van Cutsem E, Fuchs CS, Ohtsu A, Tabernero J, Ilson DH, Hyung WJ, Strong VE, Goetze TO, Yoshikawa T, Tang LH, Hwang PMT, Webb N, Adelberg D, Shitara K (2019) KEYNOTE-585: Phase III study of perioperative chemotherapy with or without pembrolizumab for gastric cancer. Future Oncol 15: 943–952, doi:10.2217/fon-2018-0581.
- Barber TW, Duong CP, Leong T, Bressel M, Drummond EG, Hicks RJ (2012) 18F-FDG PET/CT has a high impact on patient management and provides powerful prognostic stratification in the primary staging of esophageal cancer: a prospective study with mature survival data. J Nucl Med 53: 864–871, doi:10.2967/jnumed.111.101568.
- Bartley AN, Washington MK, Colasacco C, Ventura CB, Ismaila N, Benson AB, Carrato A, Gulley ML, Jain D, Kakar S, Mackay HJ, Streutker C, Tang L, Troxell M, Ajani JA (2017) HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol 35: 446–464, doi:10.1200/JCO.2016.69.4836.
- Bedenne L, Michel P, Bouché O, Milan C, Mariette C, Conroy T, Pezet D, Roullet B, Seitz J-F, Herr J-P, Paillot B, Arveux P, Bonnetain F, Binquet C (2007) Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 25: 1160–1168, doi:10.1200/JCO.2005.04.7118.
- Best LMJ, Mughal M, Gurusamy KS (2016) Non-surgical versus surgical treatment for oesophageal cancer. Cochrane Database Syst Rev 3: CD011498, doi:10.1002/14651858.CD011498.pub2.
- Bidoli P, Stani SC, De Candis D, Cortinovis D, Parra HS, Bajetta E (2001) Single-agent chemotherapy with vinorelbine for pretreated or metastatic squamous cell carcinoma of the esophagus. Tumori 87: 299–302.
- Biere SSAY, van Berge Henegouwen MI, Maas KW, Bonavina L, Rosman C, Garcia JR, Gisbertz SS, Klinkenbijl JHG, Hollmann MW, de Lange ESM, Bonjer HJ, van der Peet DL, Cuesta MA (2012) Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial. Lancet 379: 1887–1892, doi:10.1016/S0140-6736(12)60516-9.
- Birkmeyer JD, Siewers AE, Finlayson EVA, Stukel TA, Lucas FL, Batista I, Welch HG, Wennberg DE (2002) Hospital volume and surgical mortality in the United States. N Engl J Med 346: 1128–1137, doi:10.1056/NEJMsa012337.
- Bleiberg H, Conroy T, Paillot B, Lacave AJ, Blijham G, Jacob JH, Bedenne L, Namer M, De Besi P, Gay F, Collette L, Sahmoud T (1997) Randomised phase II study of cisplatin and 5-fluorouracil (5-FU) versus cisplatin alone in advanced squamous cell oesophageal cancer. Eur J Cancer 33: 1216–1220, doi:10.1016/s0959-8049(97)00088-9.
- Bosset JF, Gignoux M, Triboulet JP, Tiret E, Mantion G, Elias D, Lozach P, Ollier JC, Pavy JJ, Mercier M, Sahmoud T (1997) Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med 337: 161–167, doi:10.1056/NEJM199707173370304.
- Bouvier AM, Binquet C, Gagnaire A, Jouve JL, Faivre J, Bedenne L (2006) Management and prognosis of esophageal cancers: has progress been made? Eur J Cancer 42: 228–233, doi:10.1016/j.ejca.2005.08.038.
- Brac B, Dufour C, Behal H, Vanderbeken M, Labreuche J, Leteurtre E, Mariette C, Eveno C, Piessen G, Renaud F, FREGAT network (2021) Is There an Optimal Definition for a Positive Circumferential Resection Margin in Locally Advanced Esophageal Cancer? Ann Surg Oncol 28: 8337–8346, doi:10.1245/s10434-021-10707-6.
- Burmeister BH, Smithers BM, Gebski V, Fitzgerald L, Simes RJ, Devitt P, Ackland S, Gotley DC, Joseph D, Millar J, North J, Walpole ET, Denham JW, Trans-Tasman Radiation Oncology Group, Australasian Gastro-Intestinal Trials Group (2005) Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus: a randomised controlled phase III trial. Lancet Oncol 6: 659–668, doi:10.1016/S1470-2045(05)70288-6.
- Chen L, Sun L, Lang Y, Wu J, Yao L, Ning J, Zhang J, Xu S (2016) Fast-track surgery improves postoperative clinical recovery and cellular and humoral immunity after esophagectomy for esophageal cancer. BMC Cancer 16: 449, doi:10.1186/s12885-016-2506-8.
- Chen Y, Tong Y, Yang C, Gan Y, Sun H, Bi H, Cao S, Yin X, Lu Z (2015) Consumption of hot beverages and foods and the risk of esophageal cancer: a meta-analysis of observational studies. BMC Cancer 15: 449, doi:10.1186/s12885-015-1185-1.
- Cohen C (2018) ASO Author Reflections: Salvage Surgery for Esophageal Cancer. Ann Surg Oncol 25: 960–961, doi:10.1245/s10434-018-6974-8.
- Coleman HG, Xie S-H, Lagergren J (2018) The Epidemiology of Esophageal Adenocarcinoma. Gastroenterology 154: 390–405, doi:10.1053/j.gastro.2017.07.046.
- Conroy T, Galais M-P, Raoul J-L, Bouché O, Gourgou-Bourgade S, Douillard J-Y, Etienne P-L, Boige V, Martel-Lafay I, Michel P, Llacer-Moscardo C, François E, Créhange G, Abdelghani MB, Juzyna B, Bedenne L, Adenis A, Fédération Francophone de Cancérologie Digestive and UNICANCER-GI Group (2014) Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15: 305–314, doi:10.1016/S1470-2045(14)70028-2.
- Cooper JS, Guo MD, Herskovic A, Macdonald JS, Martenson JA, Al-Sarraf M, Byhardt R, Russell AH, Beitler JJ, Spencer S, Asbell SO, Graham MV, Leichman LL (1999) Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA 281: 1623–1627, doi:10.1001/jama.281.17.1623.
- Crehange G, Maingon P, Peignaux K, N’guyen TD, Mirabel X, Marchal C, Verrelle P, Roullet B, Bonnetain F, Bedenne L, Federation Francophone de Cancerologie Digestive 9102 (2007) Phase III trial of protracted compared with split-course chemoradiation for esophageal carcinoma: Federation Francophone de Cancerologie Digestive 9102. J Clin Oncol 25: 4895–4901, doi:10.1200/JCO.2007.12.3471.
- Créhange G, Modesto A, Vendrely V, Quéro L, Mirabel X, Rétif P, Huguet F (2022) Radiotherapy for cancers of the oesophagus, cardia and stomach. Cancer Radiother 26: 250–258, doi:10.1016/j.canrad.2021.11.022.
1.10. Annexes
Annexe 1
Classification ctTNM pour les cancers de l’œsophage thoracique d’après Wurtz & Chastanet, 1988 modifié par Bosset et al, 1997.
Tumeur primitive (T) : mesure du diamètre transversal maximal de la tumeur œsophagienne
ctT1 non visible ou < 1cm
ctT2 entre 1 et 3 cm
ctT3 > 3cm
ctT4 envahissement des structures médiastinales ou organe de voisinage
Statut ganglionnaire (N)
ctN0 absence d’adénopathie décelable
ctN+ présence d’adénopathie régionales* (médiastinales et/ou péri-gastrique et/ou cœliaque)
* les ganglions lymphatiques sont considérés comme envahis si le diamètre transversal maximal de ces ganglions est > 1cm.
Métastases à distance (M)
ctM0 pas de métastase à distance
ctM1 présence de métastases à distance
Annexe 2



