11. Néoplasies Neuroendocrines Digestives
(Dernière mise à jour le : )Groupe de travail et relecteurs
Groupe de travail :
L. de MESTIER (Clichy), coordonnateur,
G. CADIOT (Reims), J. CROS (Clichy), S. DEGUELTE (Reims), S. GAUJOUX (Paris), J. HADOUX (Villejuif), V. HAUTEFEUILLE (Amiens), A. IMPERIALE (Strasbourg), S. LABOUREAU (Angers), C. LEPAGE (Dijon), L. de MESTIER (Clichy), M. PERRIER (Reims), M. RONOT (Clichy), T. WALTER (Lyon).
Relecteurs :
T APARCIO (Paris), L BENHAIM (Villejuif), O BOUCHE (Reims), H. BRIXI (Reims), R. CORIAT (Paris), A. COUVELARD (Paris), C. DO CAO (Lille), M. FARON (Villejuif), B. GOICHOT (Strasbourg), O. HENTIC (Clichy), C. HOEFFEL (Reims), T LECOMTE (Tours), C. LOMBARD-BOHAS (Lyon), A. SAUVANET (Clichy), D. TAIEB (Marseille).
Comment citer ce chapitre :
Goudet P, Lombard-Bohas C, Poncet G, Smith D, Ruszniewski P, Lecomte T, Bouché O, Walter T, Cadiot G, Thésaurus National de Cancérologie Digestive (TNCD). Digestive Neuroendocrine Neoplasms (NEN): French Intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, GTE, RENATEN, TENPATH, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SFR). Dig Liver Dis 2020; 52:473-492.
Mise à jour 2023
de Mestier L, Walter T, Hadoux S, Cros J, Deguelte S, Gaujoux S, Hautefeuille V, Imperiale A, Laboureau S, Perrier M, Ronot M, Lepage C, Goichot B, Bouché O, Cadiot G. « Néoplasies Neuroendocrines Digestives ». Thésaurus National de Cancérologie Digestive, Novembre 2023, [http://www.tncd.org].
Les associations de patients ont un rôle essentiel dans la diffusion de l’information et l’aide à la prise en charge de ces tumeurs rares.
- APTED, Association Française des Patients porteurs de Tumeurs Endocrines Diverses : https://www.apted.fr/
- AFNEM, Association Française des Néoplasies Endocriniennes Multiples : https://www.afnem.fr/
- VHL France : https://vhlfrance.org/
- INCA, International Neuroendocrine Cancer Alliance : https://incalliance.org/
11.1 Considérations générales et épidémiologie
- Les Néoplasies Neuroendocrines (NNE) primitives peuvent se développer aux dépens de n’importe quel organe du système digestif. Les données épidémiologiques européennes les plus récentes (1995-2018), issues du registre épidémiologique Anglais (NCRAS), montrent que les NNE digestives les plus fréquentes sont celles développées aux dépens de l’intestin grêle (taux d’incidence normalisé selon l’âge d’environ 1,45/100 000/an), du pancréas ou de l’appendice (environ 0,95/100 000/an chacune), puis de l’estomac ou du rectum (environ 0,45/100 000/an chacune) (White et al. 2022). Les autres localisations telles que l’œsophage, le foie ou les voies biliaires, sont exceptionnelles. L’incidence des NNE digestives a connu une augmentation constante lors des deux dernières décennies (x3,7), possiblement en rapport avec de meilleures méthodes diagnostiques, les nouvelles classifications de l’OMS et une meilleure connaissance de ces tumeurs (Hallet et al. 2015; White et al. 2022).
- Les NNE digestives présentent une hétérogénéité marquée, notamment concernant la présence ou non de symptômes (qu’ils soient liés à une sécrétion hormonale ou non), le stade au diagnostic, l’existence ou non d’une prédisposition héréditaire, le statut fonctionnel et l’expression des récepteurs de la somatostatine (SST). Leur pronostic est très variable et est influencé principalement par la différenciation histologique (par définition, les tumeurs neuroendocrines (TNE) sont bien différenciées et les carcinomes neuroendocrines (CNE) sont peu différenciés), mais également par l’index de prolifération Ki-67, le stade tumoral et l’organe d’origine. Il n’existe néanmoins pas de classification pronostique au stade métastatique, hormis la distribution de l’extension métastatique (Bierley et al. 2017).
- La plupart des patients ayant une TNE ont une survie prolongée (> 5-20 ans). Cela doit être pris en compte dans leur prise en charge. Alors que le suivi repose sur la réalisation répétée d’imageries, l’irradiation répétée liée à la scanographie doit être évitée, en particulier chez les patients ayant une TNE non ou faiblement progressive et/ou liée à une prédisposition héréditaire. Des techniques d’imagerie non irradiantes et en particulier l’IRM doivent être privilégiées, en alternance avec la scanographie.
- Les principaux objectifs thérapeutiques doivent être établis au cas par cas et partagés avec le patient à chaque étape de la prise en charge : guérison, augmentation de la durée de vie, contrôle local, contrôle symptomatique, amélioration ou maintien de la qualité de vie, etc.
- La rareté et l’hétérogénéité des NNE rend leur prise en charge difficile et explique le faible nombre d’études randomisées et le faible niveau de preuve associé. Les dossiers de tous les patients doivent impérativement être discutés lors de réunions de concertations pluridisciplinaires (RCP) spécialisées, en France dans le cadre du réseau RENATEN-ENDOCAN (https://www.reseau-gte.org/renaten/). Promouvoir les inclusions des patients dans les essais thérapeutiques doit être une priorité, même dans les situations où il existe des recommandations thérapeutiques. Une liste des études en cours, régulièrement mise à jour, est disponible sur le site du Groupe d’étude des Tumeurs Endocrines (GTE) (https://www.reseau-gte.org/protocoles-du-gte).
11.2 Particularité clinique : les syndromes fonctionnels (ou sécrétoires)
Sauf indication contraire, les recommandations suivantes correspondent à un accord d'experts.
- Environ 20% des patients ayant une TNE présentent un syndrome fonctionnel (symptômes résultant de l’hyper-sécrétion d’hormones et/ou neuropeptides).
- Leurs principaux signes cliniques sont résumés dans le tableau 1. Les explorations biochimiques sont abordées dans le paragraphe 11.3.3. Leur traitement spécifique est abordé dans le paragraphe 11.4.1.
Syndrome carcinoïde
- Il résulte principalement de l’hypersécrétion de sérotonine (mais aussi prostaglandines, histamine, kallikréine, tachykinines, bradykinines…) dans la circulation sanguine systémique, principalement par les TNE métastatiques de l’intestin grêle, mais également par certaines TNE bronchiques, thymiques, coliques, appendiculaires, ovariennes ou gastriques (Grozinsky-Glasberg et al. 2022).
- La diarrhée liée au syndrome carcinoïde est presque toujours associée à une franche augmentation de la concentration d’acide 5-hydroxy-indolacétique (5HIAA) (voir 11.3.3). D’autres causes doivent être cherchées, en particulier chez les patients ayant eu une chirurgie intestinale : transit accéléré par la résection de la valvule de Bauhin, malabsorption des sels biliaires, pullulation microbienne intestinale, ischémie mésentérique chronique ou stéatorrhée liée aux analogues de la SST.
- La principale complication aiguë est la crise carcinoïde (cf. 11.3.1.2). Les principales complications à plus long terme sont la dénutrition, les carences nutritionnelles (A, B3, B12, D, E, PP et K), la fibrose mésentérique et ses complications propres, et la cardiopathie carcinoïde (cf. 11.3.4).
Syndromes fonctionnels liés aux hormones duodéno-pancréatiques (Hofland et al. 2023)
- L’hypoglycémie organique lié aux insulinomes est le syndrome fonctionnel causé par les TNE pancréatiques le plus fréquent. Il s’agit le plus souvent de petites tumeurs de très faible risque évolutif. La principale complication est l’hypoglycémie et ses conséquences, qui doivent être prévenues dès le diagnostic évoqué (Baudin et al. 2013).
- Le syndrome de Zollinger-Ellison (SZE) résulte de l’hypersécrétion gastrique acide secondaire à une hypersécrétion de gastrine. Les gastrinomes sont généralement d’origine duodénale ou pancréatiques, ou peuvent être plus rarement de présentation ganglionnaire sans primitif identifiable, et sont à haut risque de malignité. L’hypersécrétion acide gastrique peut occasionner des complications hydroélectrolytiques du fait de la diarrhée (déshydratation, hypokaliémie) et peptiques (œsophagite sévère, ulcères duodénaux pouvant se compliquer de perforation digestive ou d’hémorragie), potentiellement graves voire mortelles, à prévenir par IPP à doses suffisantes dès le diagnostic évoqué (Chatzipanagiotou et al. 2023).
- Le syndrome sécrétoire lié aux glucagonomes résulte de l’hypersécrétion de glucagon par des TNE pancréatiques à haut risque de malignité, et peut entrainer un hypercatabolisme et des troubles métaboliques parfois sévères (diabète, dermatose de type érythème nécrolytique migrateur, dénutrition, anémie, thromboses veineuses).
- Le syndrome de Verner-Morrison résulte de l’hypersécrétion de peptide vasointestinal (VIP) par des TNE pancréatiques (le plus souvent) à haut risque de malignité. Il se manifeste par une diarrhée sécrétoire très abondante à haut risque de déshydratation et de troubles hydroélectrolytiques sévères et menaçants (Brugel et al. 2021).
- Le terme de somatostatinome désigne généralement des TNE duodénales ou péri-ampullaires surexprimant la somatostatine et associées à un risque relativement élevé de métastases ganglionnaires (cf. 11.4.2.3). Une hypersécrétion de somatostatine est possible mais se traduit très rarement par des symptômes cliniques spécifiques (diarrhée avec stéatorrhée, hyperglycémie, lithiase).
Des syndromes paranéoplasiques rares peuvent être associés aux TNE, comme la sécrétion de PTHrp responsable d’une hypercalcémie parfois maligne, ou d’ACTH responsable d’un syndrome de Cushing (Hofland et al. 2023).
- Un syndrome fonctionnel métachrone ou un changement du profil sécrétoire est rare mais peut survenir lors du suivi des TNE pancréatiques principalement (de Mestier et al. 2015a).
Tableau 1
Principaux syndromes fonctionnels associés aux Tumeurs Neuroendocrines Digestives
| Syndrome | Principaux symptômes | Marqueurs spécifiques |
|---|---|---|
| Carcinoïde |
|
|
| Insulinome |
|
|
| Gastrinome (syndrome de Zollinger-Ellison) |
|
|
| Glucagonome |
|
|
| VIPome (syndrome de Verner-Morrison) |
|
|
11.3 Explorations pré-thérapeutiques
11.3.1. EXPLORATIONS MORPHOLOGIQUES
11.3.1.1. Imagerie conventionnelle en coupes
REFERENCES
- Scanographie (TDM) abdominopelvienne avec injection de produit de contraste, avec des acquisitions au temps artériel tardif (30 secondes) puis au temps veineux portal (70-90 secondes), car certaines TNE fortement vascularisées ne sont visibles qu’à l’une ou l’autre de ces deux phases (Ronot et al. 2017; Sundin et al. 2017).
- TDM thoracique en cas de tumeur métastatique ou à risque de métastases à distance, si la tumeur primitive n’est pas connue, en cas de CNE, ou en cas de néoplasie endocrinienne multiple de type 1 (NEM1).
- IRM abdominale avec injection de chélates de gadolinium et séquences de diffusion, qui est plus sensible que la scanographie pour la détection des métastases hépatiques (Dromain et al. 2005 ; d’Assignies et al. 2013). Une IRM hépatique est recommandée en association à la TDM afin de faire une recherche exhaustive de métastases. L’utilisation des agents de contraste hépato-spécifiques est associée à une meilleure sensibilité de détection, surtout des petites métastases hépatiques. (Hayoz et al. 2020). Si les métastases hépatiques ne peuvent être visualisées qu’en IRM, alors celle-ci peut être utilisée comme principale modalité de suivi (Sundin et al. 2017).
- Une IRM pelvienne est recommandée pour le bilan d’extension de toute TNE rectale présentant des facteurs pronostiques péjoratifs (voir 11.3.2.8) (Rinke et al. 2023).
- Une IRM (ou une scanographie) cérébrale est recommandée en présence de symptômes évocateurs de métastases cérébrales, qui sont néanmoins rares dans les NNE, même en cas de CNE (4% des patients (Sorbye et al. 2013)). La réalisation systématique d’une IRM cérébrale dans le bilan initial des CNE métastatiques n’est pas consensuelle (Garcia-Carbonero et al. 2016).
- Une IRM rachidienne est indiquée chez les patients ayant des métastases osseuses suspectées ou connues, afin d’évaluer le risque de complications locales (épidurite, fractures) et de pouvoir envisager d’éventuels traitements loco-régionaux (cf. 11.4.3.3.3.1).
11.3.1.2. Endoscopie digestive
REFERENCES
- Une endoscopie œso-gastroduodénale est recommandée :
- Chez les patients ayant une TNE gastrique, afin de réaliser de multiples biopsies antrales et fundiques dans le cadre du bilan étiologique (aspect d’atrophie fundique avec hyperplasie des cellules neuroendocrines en cas de maladie de Biermer, arguments pour un SZE, présence d’Helicobacter pylori).
- chez les patients ayant un SZE, à la recherche d’une œsophagite, d’ulcérations duodénales, de gastrinomes duodénaux (localisation préférentielle bulbaire et D2) et de TNE fundiques de type 2 (ECLomes), ainsi que pour vérifier la cicatrisation des ulcérations peptiques. L’abondance du liquide gastrique et l’hypertrophie des plissements du corps gastrique sont des signes évocateurs de l’existence d’un SZE.
- Une iléo-coloscopie est recommandée chez tous les patients ayant une TNE iléale, colique ou rectale, en raison du risque de TNE digestive et/ou d’adénome/adénocarcinome colique ou rectal synchrones (Kamp et al. 2012).
- L’échoendoscopie (EE) est recommandée dans les situations suivantes, en l’absence de métastases :
- TNE gastriques d’allure résécable, à l’exception des petites TNE fundiques de type 1 < 10 mm, afin d’évaluer la taille tumorale, l’invasion pariétale et les ganglions régionaux (Vanoli et al. 2018; Panzuto et al. 2023).
- TNE duodénales ou ampullaires, quelle que soit la taille, d’allure résécable, afin d’évaluer la taille tumorale, l’invasion pariétale et les ganglions régionaux (Vanoli et al. 2017; Panzuto et al. 2023).
- TNE rectales paraissant résécables, afin d’évaluer la taille tumorale, l’invasion pariétale et les ganglions régionaux du mésorectum avant résection ; ou en bilan d’extension après une résection d’emblée, afin d’évaluer les ganglions régionaux et la possibilité de tumeur résiduelle, à l’exception de celles mesurant ≤ 10 mm sans facteur prédictif de métastases (T1, G1, pas d’invasion lymphovasculaire) réséquées en totalité (de Mestier et al. 2019a; Rinke et al. 2023).
- TNE pancréatiques paraissant résécables, si doute diagnostique après imagerie morphologique et TEP/TDM et pour guider la biopsie. La prise de contraste après injection de produit de contraste est un élément utile au diagnostic et à l’évaluation pronostique (Palazzo et al. 2018). L’EE et la biopsie EE-guidée ne sont pas recommandées si leurs résultats ne sont pas susceptibles de faire changer la prise en charge (par ex : si la TNEP est visible en imagerie et si des métastases sont visibles et accessibles à une biopsie ; ou s’il existe une indication chirurgicale en lien avec la taille tumorale, après un bilan d’extension complet).
- Syndrome sécrétoire (mis en évidence par la clinique et la biologie) évoquant une TNE duodéno-pancréatique fonctionnelle, avec une imagerie morphologique normale.
- Chez les patients ayant une NEM1, dans le cadre du bilan initial à la recherche de TNE duodénopancréatiques (notamment de gastrinomes en cas de SZE), si cela peut induire un changement de prise en charge en comparaison à l’imagerie morphologique/nucléaire (qui détecte la grande majorité des lésions significatives).
- La vidéocapsule endoscopique du grêle n’a pas d’indication, en particulier si une TNE de l’intestin grêle est connue et si l’indication d’une chirurgie a déjà été posée : intérêt diagnostique faible et risque de complications (occlusion). La localisation des TNE du grêle repose partiellement sur l’imagerie préopératoire et surtout sur la palpation peropératoire du grêle (fréquence des TNE multiples).
11.3.1.3. Imagerie nucléaire
REFERENCES
- TEP/TDM aux analogues de la somatostatine (SST)
- Une imagerie des récepteurs de la SST par TEP/TDM au 68Ga-DOTA-peptide est recommandée lors du bilan initial chez tous les patients ayant une TNE métastatique ou un risque de métastases régionales ou à distance (niveau de recommandation : grade C) (Gabriel et al. 2007; Sundin et al. 2017).
- Il n’existe pas d’argument fort pour recommander un traceur plutôt qu’un autre (DOTATOC, DOTANOC ou DOTATATE), mais seul le 68Ga-DOTATOC est actuellement disponible en France pour une utilisation clinique de routine.
- Elle est réalisée à la recherche de métastases à distance et pour évaluer l’expression tumorale des récepteurs à la SST afin de pouvoir poser l’indication thérapeutique de radiothérapie interne vectorisée (RIV) utilisant les analogues de la SST (par exemple, 177Lu-DOTATATE) (niveau de recommandation : grade C) (Sundin et al. 2017).
- Une fixation intense en TEP/TDM au 68Ga-DOTATOC est associée à un meilleur pronostic (niveau de recommandation : grade C) (Lee & Kim 2019). Les principaux faux positifs incluent les rates accessoires, les granulomatoses (sarcoïdoses, tuberculose), les cystadénomes séreux et les méningiomes.
- L’imagerie des récepteurs à la SST n’est pas indiquée en routine dans les CNE.
- L’Octréoscan n’a plus sa place étant données ses performances diagnostiques significativement inférieures à la TEP/TDM au 68Ga-DOTATOC (sensibilité 52% vs. 97%) (Gabriel et al. 2007; Sundin et al. 2017).
- TEP/TDM au 18F-Fluorodéoxyglucose (18FDG)
- Une fixation intense du 18FDG est associée à un métabolisme et une agressivité biologique tumoraux élevés, bien que non spécifique des NNE. Dans les NNE, elle est corrélée à un plus haut grade et à un plus mauvais pronostic, indépendamment du grade tumoral et de la positivité de l’imagerie des récepteurs de la SST (Bahri et al. 2014; Binderup et al. 2021).
- La TEP/TDM au 18FDG est recommandée pour le bilan d’extension des CNE, en particulier avant chirurgie dans les formes apparemment résécables, mais ne doit pas retarder l’initiation du traitement (Garcia-Carbonero et al. 2016).
- Elle est recommandée pour le bilan d’extension des TNE dont l’imagerie des récepteurs à la SST est négative.
- TEP à la 18F-Fluorodihydroxyphenylalanine (18FDOPA)
- Une fixation intense en TEP/TDM à la 18FDOPA est spécifique des NNE ayant un fort métabolisme des acides aminés (activité dopa décarboxylase), en particulier les TNE de l’intestin grêle. Sa sensibilité diagnostique est supérieure à celle de l’imagerie morphologique et de la scintigraphie des récepteurs de la somatostatine (Octréoscan), notamment pour la détection des TNE du grêle occultes (Montravers et al. 2006; Imperiale et al. 2014) (niveau de recommandation : grade C).
- La TEP/TDM à la 18FDOPA ne peut pas être utilisée pour sélectionner les patients pour la RIV.
- Chez les patients ayant une TNE de l’intestin grêle, la TEP/TDM à la 18FDOPA permet de diagnostiquer un plus grand nombre de lésions que la TEP/TDM au 68Ga-DOTATOC (95% vs. 82%), bien que ces deux techniques identifient le même nombre d’organes atteints (Ansquer et al. 2021; Ouvrard et al. 2021, 2022; Piccardo et al. 2021). La TEP/TDM à la 18FDOPA peut donc être préférée si l’objectif de l’examen est de réaliser un bilan lésionnel le plus exhaustif possible, notamment dans le cadre du bilan d’imagerie initial et post-opératoire des TNE de l’intestin grêle, ou avant chirurgie lourde (niveau de recommandation : grade C).
OPTIONS
- Une TEP/TDM au 18FDG peut être réalisée pour toute TNE, quels que soient le grade et l’expression des récepteurs à la SST, car la positivité de la TEP/TDM au 18FDG est un marqueur pronostique péjoratif indépendamment de ces facteurs, si le résultat est susceptible d’influencer la prise en charge. Notamment, la présence de lésions positives en TEP/TDM au 18F-FDG est un facteur pronostique indépendant chez les patients traités par RIV (Zhang et al. 2020). L’intérêt de la TEP/TDM au 18FDG est probablement très limité dans les TNE de l’intestin grêle.
- La TEP/TDM au 68Ga-exendin (imagerie des récepteurs du GLP1) peut être utile à la détection des insulinomes non localisés par TDM, EE et TEP/TDM au 68Ga-DOTATOC, ou pour distinguer un insulinome d’autres TNE pancréatiques multiples dans un contexte de NEM1 (Antwi et al. 2018). Son accessibilité sur le territoire national reste ponctuelle (ATU nominative).
ESSAI CLINIQUE
- BRD 11/5-K : Étude de phase III comparant TEP 68Ga-DOTANOC et imagerie conventionnelle (Octréoscan, TDM, IRM) dans le bilan des TNE digestives (coordonnateur : Dr Catherine Ansquer, CHU de Nantes). https://www.reseau-gte.org/protocole/brd-11-5-k
11.3.2. Analyse anatomopathologique
REFERENCES
- Un prélèvement (biopsie, chirurgie) de toute NNE doit être systématique avant tout traitement médical anti-tumoral, mais ne doit pas retarder l’initiation des traitements symptomatiques. Si la quantité de matériel tumoral est insuffisante pour une analyse anatomopathologique optimale, il peut être nécessaire de réaliser un nouveau prélèvement.
- Réaliser un nouveau prélèvement est conseillé en cas d’évolution inhabituelle (récidive inattendue, évolution dissociée, progression anormalement rapide), si le résultat est susceptible d’influencer la prise en charge thérapeutique.
- Le diagnostic des NNE repose sur l’identification d’une morphologie cellulaire neuroendocrine et l’expression, en immunohistochimie, d’au moins deux marqueurs, dont la chromogranine A, la synaptophysine, INSM1 (Insulinoma-associated 1) et plus rarement CD56. Tout cas difficile peut être adressé pour relecture experte, en particulier en cas de profil immunohistochimique incomplet, de CNE ou TNE G3, de lésion mixte (MiNEN) ou en cas de primitif inhabituel. En France, la relecture doit être faite dans le cadre du réseau expert ENDOCAN-PATH (https://www.reseau-gte.org/reseaux-inca/endocanpath).
- Toutes les NNE doivent être classées selon la classification de l’OMS, qui repose sur la différenciation histologique entre TNE (bien différenciées par définition) et CNE (peu différenciés par définition) et le grade tumoral, basé sur l’index de prolifération qui est mesuré par l’index Ki-67 et/ou l’indice mitotique. La catégorie des TNE G3 a été intégrée à la classification des TNE pancréatiques en 2017 et a été étendue à toutes les localisation de l’appareil digestif en 2019 (WHO Classification of Tumours. 2019). La dernière classification de 2022 (Tableau 2) concerne les néoplasies neuroendocrines de tous les organes et ne modifie pas la classification digestive de 2019 (Rindi et al. 2022).
- Toutes les NNE doivent être classées selon la classification TNM (Tableau 3). La version la plus récente (8ème édition) datant de 2017 (Bierley et al. 2017) est proche de celles proposées par l’ENETS en 2006 et 2007, à l’exception des TNE appendiculaires (voir 11.4.2.6). Les CNE doivent être caractérisés selon la classification TNM des cancers exocrines du même organe.
OPTIONS
- L’utilisation de marqueurs additionnels peut aider à la distinction entre CNE et TNE G3, particulièrement dans les NNE G3 pancréatiques (profil anormal de p53, Rb, et TTF1 pour les CNE, et de DAXX, ATRX, et ménine pour les TNE) (Tang et al. 2016; Perren et al. 2017; WHO Classification of Tumours. 2019). Le principal diagnostic différentiel devant une NNE pancréatique inhabituelle est le carcinome à cellules acineuses (qui exprime Bcl-10).
- Chez les patients ayant des métastases inaugurales de TNE sans primitif identifié, les marqueurs suivants peuvent aider à orienter vers une origine, bien que leur sensibilité et spécificité soient imparfaites (Perren et al. 2017) :
- TTF1 pour les TNE pulmonaires (non spécifique en cas de CNE) ;
- CDX2 et sérotonine pour les TNE intestinales et appendiculaires ;
- PDX1, ISL1, DAXX/ATRX (et NESP-55, PAX6/8) pour les TNE pancréatiques (la ménine est peu spécifique, pouvant être aussi anormale dans les TNE pulmonaires) ;
- SATB2 et CK20 pour les TNE coliques et rectales (ces dernières peuvent ne pas exprimer la chromogranine A mais la chromogranine B) ;
- Calcitonine, TTF1 and ACE pour les carcinomes médullaires de la thyroïde ;
- Les pan-cytokératines (non limitées à CK7 et CK20) permettent habituellement d’exclure la possibilité d’un paragangliome ou d’un phéochromocytome en cas de négativité.
Tableau 2
Classification 2022 des Néoplasies Neuroendocrines selon l’OMS.
Adapté et modifié d’après (WHO Classification of Tumours. 2019; Rindi et al. 2022).
| Ki67* | Indice mitotique** | ||
| Grade 1 (G1) | < 3% | < 2 | |
| Grade 2 (G2) | 3% - 20% | 2 - 20 | |
| Grade 3 (G3) | > 20% | > 20 | |
| Grade | Différenciation | ||
| TNE G1 | G1 | Bien différencié | |
| TNE G2 | G2 | Bien différencié | |
| TNE G3 | G3 | Bien différencié | |
| CNE*** | G3 | Peu différencié, à grandes ou petites cellules | |
| MiNEN | Néoplasie mixe neuroendocrine - non neuroendocrine | ||
CNE, carcinome neuroendocrine ; TNE, tumeur neuroendocrine. * L’index de prolifération Ki67 est déterminé par comptage d’au moins 500 cellules dans les régions de plus fort marquage (hot-spots). ** L’indice mitotique doit être exprimé comme le nombre de mitoses par 2 mm² (équivalent à 10 champs à fort grossissement à x40), déterminé par le comptage de 50 champs de 0,2 mm² (soit une aire totale 10 mm²). Le grade final est basé sur celui des deux indices de prolifération classant la lésion dans la catégorie de plus haut grade. *** Les CNE sont considérés comme de haut grade (G3) par définition.
Tableau 3
8ème classification Tumor-Node-Metastases (TNM) des TNE
selon l’UICC (2017). A noter que les CNE doivent être classés comme pour les carcinomes exocrines de localisation identique
| Estomac | Duodénum, ampoule | Pancréas | Intestin grêle | Appendice* | Côlon, rectum | |
|---|---|---|---|---|---|---|
| TX | La tumeur primitive ne peut pas être évaluée | |||||
| T0 | Pas de signe de tumeur primitive | |||||
| T1 | Envahit la lamina propria ou la sous-muqueuse et ≤ 10 mm | Duodénum : Envahit la muqueuse ou la sous-muqueuse et ≤ 10 mm Ampoule : Confinée au sphincter d’Oddi et ≤ 10 mm | Limitée au pancréas et < 20 mm | Envahit la lamina propria ou la sous-muqueuse et ≤ 10 mm | Taille tumorale < 20 mm | Envahit la lamina propria ou la sous-muqueuse T1a : taille < 10 mm T1b : taille 10-20 mm |
| T2 | Envahit la musculeuse ou > 10 mm | Duodénum : Envahit la musculeuse ou > 10 mm Ampoule : Envahit la sous-muqueuse ou la musculeuse duodénale ou > 10 mm | Limitée au pancréas et 20-40 mm | Envahit la musculeuse ou > 10 mm | Taille tumorale 20-40 mm | Envahit la musculeuse ou > 20 mm |
| T3 | Envahit la sous-séreuse sans envahir la séreuse | Envahit le pancréas ou le tissu adipeux péri-pancréatique | Limitée au pancréas et > 40 mm, or envahit le duodénum ou la voie biliaire principale | Envahit la sous-séreuse sans envahir la séreuse | Taille tumorale > 40 mm ou envahit la sous-séreuse ou le méso-appendice | Envahit la sous-séreuse sans envahir la séreuse |
| T4 | Envahit la séreuse ou les organes adjacents | Envahit la séreuse ou les autres organes adjacents | Envahit les organes adjacents ou la paroi des gros vaisseaux (tronc cœliaque, artère mésentérique supérieure) | Envahit la séreuse ou les organes adjacents | Envahit la séreuse ou les organes adjacents (sauf invasion pariétale de la sous-séreuse ou de l’intestin) | Envahit la séreuse ou les organes adjacents |
| NX | Les ganglions régionaux ne peuvent pas être évalués | |||||
| N0 | Pas de signe de métastase ganglionnaire | |||||
| N1 | Métastases ganglionnaires régionales | < 12 métastases ganglionnaires régionales | Métastases ganglionnaires régionales | |||
| N2 | - | - | - | > 12 métastases ganglionnaires régionales ou large masse mésentérique (> 20 mm) | - | - |
| Mx | Les métastases à distance ne peuvent pas être évaluées | |||||
| M0 | Pas de métastase à distance | |||||
| M1 | Métastases à distance M1a : métastases hépatiques uniquement M1b : métastases disséminées à au moins une localisation extra-hépatique M1c : métastases hépatiques et extra-hépatiques | |||||
* Voir la section 11.3.2.6 concernant la classification TNM des TNE de l’appendice
11.3.3. Explorations biologiques
REFERENCES
- Chromogranine A plasmatique
- C’est le marqueur biochimique général ayant les meilleures performances diagnostiques dans les TNE, bien que sa sensibilité diagnostique ne soit satisfaisante que pour les formes métastatiques (70-100%), en comparaison aux formes localisées (10-50%) (Lawrence et al. 2011; Korse et al. 2012; Oberg et al. 2017). Sa valeur ajoutée à l’imagerie morphologique et nucléaire moderne (en particulier TEP/TDM au 68Ga-DOTATOC) n’a néanmoins pas été explorée et est probablement faible.
- Il existe de nombreuses causes de faux positifs, dont toutes les situations d’hyper-gastrinémie (inhibiteurs de la pompe à protons (IPP), atrophie fundique, infection à H. pylori), l’insuffisance cardiaque sévère et l’insuffisance rénale sévère (Vezzosi et al. 2011). Il est conseillé de considérer une élévation de la chromogranine A uniquement en cas de gastrinémie normale (sauf en cas de SZE).
- Les IPP doivent être interrompus au moins 7 jours (préférentiellement 14 jours) avant de doser la chromogranine A, sauf chez les patients ayant un SZE chez qui les IPP ne doivent jamais être arrêtés (Korse et al. 2011; Oberg et al. 2017).
- Par conséquent, le dosage de la chromogranine A ne peut pas être recommandé de manière systématique ni pour le diagnostic des TNE ni pour le suivi des TNE opérées. Son seul intérêt (modeste) reste le suivi des patients ayant une forme métastatique.
- Hormones liées aux TNE duodéno-pancréatiques fonctionnelles (gastrine, insuline, VIP, glucagon…) (Hofland et al. 2023)
- Ces dosages ne doivent pas être réalisés systématiquement, mais en fonction de la suspicion clinique d’un syndrome sécrétoire. Des tests dynamiques sont validés dans certains syndromes fonctionnels (Oberg et al. 2017).
- En cas de suspicion d’insulinome : hypoglycémie (< 0,45 g/L) avec hyperinsulinisme inadapté en l’absence de traitement hypoglycémiant (élévation de l’insuline, proinsuline et peptide C) et/ou test de jeûne à réaliser lors d’une hospitalisation en centre spécialisé.
- Suspicion de syndrome de Cushing : cortisol libre urinaire des 24h, test de freinage à la déxaméthasone faible dose.
- En cas de diarrhée chez un patient ayant une TNE pancréatique (voire duodénale) : gastrinémie, VIP, somatostatine, calcitonine, glucagon.
- Acide 5-hydroxy-indolacétique (5HIAA) urinaire
- Le 5HIAA est le catabolite principale de la sérotonine et est excrété dans les urines. Contrairement au dosage sanguin direct de la sérotonine dont l’interprétation n’est pas fiable (taux élevé de faux positifs), le dosage du 5HIAA urinaire est utile au diagnostic et à la surveillance du syndrome carcinoïde.
- Sa sensibilité (50-70%) et sa spécificité (90-100%) sont relativement élevées pour le diagnostic de TNE de l’intestin grêle et du côlon droit, et sont augmentées en cas de TNE métastatique et/ou fonctionnelle.
- Il ne devrait être mesuré que chez les patients ayant une TNE de l’intestin grêle (ou bronchique, ovarienne qui peuvent sécréter de la sérotonine), dans le cadre de la recherche d’une origine à des métastases isolées de TNE, pour documenter un syndrome carcinoïde, ou pour le suivi des patients avec une concentration initialement élevée (de Mestier et al. 2021).
- Il devrait être mesuré sur des urines collectées pendant 24-48 heures, et idéalement après un régime pauvre en tryptophane et excluant les compléments nutritionnels et certains médicaments sérotoninergiques (Grozinsky-Glasberg et al. 2022).
- Chez les patients avec 5HIAA urinaire élevé et/ou syndrome carcinoïde, le taux de 5HIAA urinaire doit être monitoré tous les 6 à 12 mois. Il s’agit ainsi du seul marqueur biochimique pouvant être dosé systématiquement y compris en l’absence de symptômes.
- Un taux de 5HIAA urinaire élevé (seuil compris entre 210 et 300 μmol/24h selon les études) est corrélé à un risque majoré de survenue et de progression d’une cardiopathie carcinoïde, un risque accru de décès, et doit faire adresser le patient en consultation de cardiologie spécialisée (Bhattacharyya et al. 2011; de Mestier et al. 2021).
- La concentration sanguine de la sérotonine ne doit plus être mesurée en raison d’un très grand nombre de faux positifs.
- Le NT-pro-BNP
- Il est utile au suivi cardiologique des patients ayant une cardiopathie carcinoïde ou à risque d’en développer une (syndrome carcinoïde et/ou élévation 5HIAA urinaires > 210 μmol/24h) et/ou en cas de symptômes de décompensation cardiaque (Grozinsky-Glasberg et al. 2022).
- Sa valeur diagnostique pour la cardiopathie carcinoïde débutante étant insuffisante, le dosage du NT-proBNP n’affranchit pas de la nécessité de réaliser régulièrement une échocardiographie de dépistage par un cardiologue expert (cf 11.3.4).
- Dans le cadre du diagnostic étiologique des TNE gastriques, les TNE gastriques de type 1 (contrairement aux TNE gastriques de type 3) sont associées à une hypergastrinémie (ainsi que celles de type 2), et à la présence fréquente d’anticorps anti-cellules pariétales gastriques et anti-facteur intrinsèque (maladie de Biermer), à une carence en vitamine B12 inconstante et à une carence martiale fréquente.
- Les mêmes méthodes de mesure des peptides, hormones et de la chromogranine A doivent être utilisées au long du suivi. Un syndrome fonctionnel métachrone ou un changement du profil sécrétoire est rare mais peut survenir lors du suivi des TNE pancréatiques principalement (de Mestier et al. 2015a).
OPTIONS
- Le test à la sécrétine qui était utile à confirmer le SZE en cas de doute diagnostique n’est plus réalisable du fait de l’indisponibilité de la sécrétine.
- En cas de suspicion de SZE : test à la sécrétine si disponible, à réaliser en centre expert car même de légères modifications des doses d’IPP exposent à un risque d’hémorragie et de perforation.
- L’énolase neuro-spécifique (NSE) présente des performances diagnostiques acceptables pour les CNE (mais son intérêt est débattu dans les TNE) et dont la concentration est corrélée à la différenciation et au volume tumoral.
- Le dosage plasmatique du 5HIAA est reproductible et corrélé au dosage urinaire. Son taux est associé à l’extension tumorale, au diagnostic de syndrome carcinoïde et de cardiopathie carcinoïde (de Mestier et al. 2021). Sous réserve de sa disponibilité, il pourrait constituer une alternative plus pratique au dosage urinaire sur 24h
11.3.4. Echocardiographie
- La cardiopathie carcinoïde est l’une des principales complications du syndrome carcinoïde. Elle survient chez 30 à 50 % des patients ayant un syndrome carcinoïde et est associée à une augmentation de la morbi-mortalité. Son apparition marque un tournant dans l’histoire naturelle de la maladie. Une concentration élevée de 5HIAA urinaire (cf 11.3.3) et la présence de plus de 3 épisodes de flushs par jour sont associés au développement et à la progression de la cardiopathie carcinoïde (Grozinsky-Glasberg et al. 2022; Delhomme et al. 2023).
- L’atteinte carcinoïde concerne le cœur droit dans plus de 90 % des cas et, dans le cas typique des TNE intestinales, la présence de métastases hépatiques est un prérequis quasi-indispensable à la survenue d’une cardiopathie carcinoïde. La formation de plaques fibreuses endocardiques peut concerner l’ensemble des structures des cavités cardiaques droites, en particulier les valves tricuspides et pulmonaires, dont l’atteinte est à l’origine des manifestations cliniques les plus fréquentes de la cardiopathie carcinoïde (Grozinsky-Glasberg et al. 2022; Delhomme et al. 2023).
REFERENCES
- Une échocardiographie doit être réalisée à la recherche d’une cardiopathie carcinoïde, chez les patients ayant une TNE de l’intestin grêle métastatique fonctionnelle ou non, ou en cas de syndrome carcinoïde, ou de taux élevé du 5HIAA ou de taux élevé de NT-proBNP (cf. 11.5.2.2).
- Elle devrait être réalisée par un cardiologue expérimenté dans le dépistage et la prise en charge de la cardiopathie carcinoïde (Grozinsky-Glasberg et al. 2022; Delhomme et al. 2023).
11.3.5. Recherche d'une prédisposition génétique
- Environ 5 % des TNE duodéno-pancréatiques s’inscrivent dans le cadre d’un syndrome de prédisposition héréditaire.
Néoplasie Endocrinienne Multiple de type 1 (NEM1)
- La NEM1 est le plus fréquent des syndromes de prédisposition génétique aux TNE. Les TNE duodéno-pancréatiques ont une incidence cumulée d’environ 90% (6% à 20 ans et 60% à 50 ans) (Données de la cohorte GTE/AFCE (Gaujoux et al. 2022)).
- Les TNE duodéno-pancréatiques liées à la NEM1 sont fréquemment multiples et fonctionnelles (environ 40% des cas), le plus souvent des gastrinomes ou plus rarement des insulinomes. A l’inverse, la probabilité de NEM1 est d’environ 25% chez un patient présentant un gastrinome, et environ 5-10% chez un patient présentant un insulinome, un VIPome ou un glucagonome.
- Les principales autres atteintes cardinales de la NEM1 incluent, par ordre d’incidence cumulée maximale : l’hyperparathyroïdie primaire (98%), les adénomes antéhypophysaires (50%), les tumeurs surrénaliennes (48%), les TNE bronchiques (17%) et les TNE thymiques (7%) (Al-Salameh et al. 2021).
Maladie de von Hippel-Lindau (VHL)
- Les TNE pancréatiques ont une incidence cumulée d’environ 15% et sont associées à de multiples lésions kystiques bénignes consistant en des kystes simples (80% des patients VHL) et/ou des cystadénomes séreux (25%), parfois microkystiques pseudosolides (Laks et al. 2022).
- Elles sont généralement multiples et presque toujours non fonctionnelles. Elles sont de meilleur pronostic que les TNE pancréatiques sporadiques (de Mestier et al. 2015b).
- Les principales autres atteintes cardinales de la maladie de VHL incluent, par ordre d’incidence cumulée maximale, les hémangioblastomes du cervelet et/ou de la moelle épinière (75%), les hémangioblastomes de la rétine (50%), les kystes et carcinomes à cellules claires (70%) du rein, les phéochromocytomes/paragangliomes (25%) et les tumeurs du sac endolymphatique (5%).
Autres syndromes de prédisposition héréditaire plus rares
- La Neurofibromatose de type 1 (NF1), dont les atteintes les plus fréquentes sont des taches café au lait, des lentigines axillaires/inguinales, des neurofibromes cutanés multiples, des nodules de Lisch (hamartomes de l’iris), des gliomes optiques et des anomalies musculosquelettiques. Des TNE sont possibles chez environ 5% des patients, pancréatiques ou duodéno-ampullaires, généralement non fonctionnelles mais exprimant la somatostatine en immunohistochimie. Des GIST, des phéochromocytomes et des adénomes parathyroïdiens sont également possibles (Lin & Gutmann 2013).
- La sclérose tubéreuse de Bourneville (STB), dont les atteintes les plus fréquentes sont cutanées (taches achromiques, angiofibromes), cérébrales (tubers, astrocytomes, épilepsie), cognitives (retard mental), rénales (angiomyolipomes) et rétiniennes (hamartomes). Des TNE pancréatiques sont possibles dans 5% des cas (Larson et al. 2012).
- Des cas de TNE pancréatiques ont été décrits en association avec des mutations germinales de BRCA2 ou BRCA1.
REFERENCES
- L’étude du gène MEN1 doit être envisagée en cas de TNE duodéno-pancréatique(s) et d’au moins un antécédent personnel ou familial d’autre atteinte cardinale de la NEM1 (cf. supra), en cas de TNE duodéno-pancréatiques multiples et/ou développées avant 40-50 ans, et/ou en cas de SZE.
- Le dépistage des TNE duodéno-pancréatiques de la NEM1 doit être fait en centre expert et repose sur la réalisation d’une IRM tous les 3 ans à partir de l’âge de 12 ans. Le rythme de surveillance des TNE asymptomatiques est initialement annuel. En cas de stabilité sur 2 examens successifs, ce rythme peut être espacé à 3 ans pour les TNE < 10 mm, ou à 2 ans pour celles mesurant 10-20 mm. L’EE a une place limitée chez les patients atteints de NEM1 ; elle ne doit pas être faite de manière systématique (cf. 11.3.1.2). En dehors de la glycémie à jeun annuelle, aucun dosage hormonal spécifique n’est recommandé systématiquement pour l'évaluation de l'atteinte neuroendocrine duodeno-pancréatique. Cependant l’interrogatoire est fondamental pour détecter l’apparition des premiers symptômes d’un syndrome sécrétoire (hypoglycémie, épigastralgies, modifications du transit) qui peuvent être initialement très modestes.
- L’étude du gène VHL doit être envisagée en cas de TNE pancréatique(s) et d’au moins un antécédent personnel ou familial d’autre atteinte cardinale de la maladie de VHL (cf. supra), en cas de TNE pancréatiques multiples et/ou apparues avant 40-50 ans, et/ou associées à des lésions kystiques pancréatiques.
- Le dépistage des TNE pancréatiques de la maladie de VHL doit être fait en centre expert (Réseau PREDIR, https://predir.org) et repose sur la réalisation d’une IRM tous les 2 ans à partir de l’âge de 14 ans.
OPTIONS
- En cas de TNE multiples de l’intestin grêle (30%-50% des patients) : chercher à l’interrogatoire l’existence de cas de TNE de l’intestin grêle dans la famille. En effet, de rares agrégations familiales ont été décrites, bien qu’aucune anomalie moléculaire prédisposante n’ait été identifiée à ce jour (de Mestier et al. 2017a; Keck et al. 2018). Le dépistage chez les apparentés asymptomatiques ne peut être actuellement recommandé en dehors de protocoles de recherche.
ESSAI CLINIQUE
- COHORTE TCF : Caractérisation des tumeurs carcinoïdes familiales de l’intestin grêle et recherche de facteurs génétiques de prédisposition (coordonnateurs : Dr Louis de Mestier et Pr Guillaume Cadiot, CHU de Reims) https://www.reseau-gte.org/protocole/carcinoides-familiaux-de-lintestin-grele
11.3.6. Explorations recommandées dans les TNE métastatiques de primitif inconnu
A l’issue d’un bilan clinique et morphologique complet, comprenant un scanner thoraco-abdomino-pelvien et une TEP/TDM au 68Ga-DOTATOC, la possibilité d’une TNE métastatique de primitif inconnu est devenue faible mais existe (De Dosso et al. 2019).
REFERENCES
- La présence d’un syndrome fonctionnel peut orienter vers une origine duodéno-pancréatique (gastrine, insuline, VIP, glucagon…) ou intestinale/bronchique (syndrome carcinoïde).
- Le profil immunohistochimique peut aider à déterminer le site primitif (cf. 11.2.3).
- En cas d’antécédent de chirurgie (en particulier d’appendicectomie), vérifier l’absence de TNE ou de MINEN sur le compte rendu anatomopathologique.
- En présence d’adénopathies mésentériques, la probabilité d’une TNE de l’intestin grêle est forte et doit être explorée par entéro-scanner, TEP à la 18FDOPA, et/ou iléo-coloscopie.
- La TEP au 18FDG peut avoir un intérêt diagnostique pour les TNE ayant un index Ki-67 > 10%.
- Explorer la possibilité d’une TNE non digestive :
- tumeur carcinoïde pulmonaire ;
- carcinome médullaire de la thyroïde (calcitonine, dont la négativité exclut le diagnostic, antigène carcino-embryonnaire) ;
- paragangliome, phéochromocytome (métanéphrines urinaires ou plasmatiques).
- La laparotomie exploratrice ne doit pas être utilisée pour la recherche d’une TNE primitive du fait de la morbidité et la mortalité associées et de la faible rentabilité de cette procédure lorsque les examens d’imagerie et d’endoscopie n’ont pas permis d’identifier le primitif.
OPTION
- A l’issue d’un bilan d’extension complet et exhaustif relu en RCP RENATEN, la possibilité d’une TNE hépatique primitive peut être évoquée, notamment en présence d’une lésion hépatique principale (De Mestier et al. 2022).
11.4. Traitement des TNE (bien différenciées)
11.4.1. Traitement des symptômes liés aux sécrétions hormonales
11.4.1.1. Généralités sur le traitement des TNE fonctionnelles
REFERENCES
- Le traitement antisécrétoire des TNE fonctionnelles est une priorité et souvent une urgence, car les conséquences cliniques et biologiques de l’hypersécrétion hormonale sont source de morbidité et de mortalité. Le traitement doit être démarré en urgence dès les marqueurs hormonaux sanguins et/ou urinaires prélevés, sauf en cas de SZE où le traitement par IPP doit être démarré immédiatement.
- Le traitement anti-sécrétoire repose habituellement sur l’utilisation de traitements médicamenteux (IPP, analogues de la SST, diazoxide…). Toutefois, en cas de syndrome fonctionnel non contrôlé, il faut rapidement envisager des traitements de réduction du volume tumoral (notamment hépatique) afin de contrôler les symptômes fonctionnels et diminuer le taux d’hormones circulantes, incluant potentiellement toutes les traitements à visée antitumorale disponibles (chimiothérapie, RIV, (chimio)-embolisation intra-artérielle hépatique (CEIAH), chirurgie de réduction tumorale, thérapies ciblées).
- Les analogues de la SST constituent le traitement médicamenteux anti sécrétoire le plus utilisé. Ils sont habituellement bien tolérés mais peuvent occasionner une diarrhée/stéatorrhée par insuffisance pancréatique exocrine, pour laquelle les enzymes pancréatiques sont efficaces (Lamarca et al. 2018), des douleurs abdominales/flatulences, un déséquilibre glycémique. Ils favorisent également la survenue de complications lithiasiques biliaires ou vésiculaires (Brighi et al. 2019). La réalisation d’une cholécystectomie est recommandée systématiquement lors de toute chirurgie (en particulier, de chirurgie initiale) chez les patients susceptibles de recevoir des analogues de la SST.
11.4.1.2. Syndrome carcinoïde
REFERENCES
- Le traitement repose sur les analogues de la SST à longue durée d’action. La dose prescrite est généralement celle utilisée à visée antitumorale (octréotide LAR 30 mg/28j ou lanréotide Autogel 120 mg/28j) (niveau de recommandation : grade B). Les seuils de <3 selles par jour et <3 flushs par jour peuvent constituer un objectif raisonnable, car ils sont associés à une meilleure qualité de vie (Grozinsky-Glasberg et al. 2022).
- La crise carcinoïde est une complication potentiellement mortelle. Elle peut survenir spontanément ou surtout lors d’une intervention diagnostique (biopsie, anesthésie générale) ou thérapeutique (traitement antitumoral, notamment chirurgical ou locorégional). Elle se manifeste par une instabilité tensionnelle ou une dysrythmie, souvent associées à des flushs sévères, une diarrhée aigue, un bronchospasme et pouvant entrainer un collapsus cardiovasculaire potentiellement mortel (Grozinsky-Glasberg et al. 2022). Sa prophylaxie repose sur l'administration d’octréotide à courte durée d'action lors de toute procédure invasive. L’octréotide doit alors être administré par voie SC (100 à 500 µg toutes les 6h à 8h) ou IVSE (1200 µg/24h), en démarrant 12h avant l’intervention et en réduisant progressivement jusqu’à obtention d’une stabilité clinique.
- Une fois une cardiopathie carcinoïde installée, aucun traitement ne permet une régression des lésions fibreuses. Un traitement médical doit être instauré en cas d’insuffisance cardiaque droite (diurétique de l’anse, régime hyposodé, inhibiteur de l’enzyme de conversion). En cas d’atteinte valvulaire sévère, un remplacement valvulaire chirurgical doit être discuté en RCP RENATEN ayant une expertise dans le traitement de la cardiopathie carcinoïde. La chirurgie consiste généralement en un remplacement valvulaire tricuspide ± pulmonaire, éventuellement associé à une fermeture de foramen ovale perméable. Il s’agit d’une chirurgie lourde associé à un risque élevé de mortalité (jusqu’à 20%) et de complications (notamment crise carcinoïde, dysfonction ventriculaire droite post-opératoire, risque hémorragique). Cette chirurgie ne peut s’envisager que chez un patient ayant un syndrome carcinoïde contrôlé et une maladie tumorale stabilisée (Grozinsky-Glasberg et al. 2022; Delhomme et al. 2023).
OPTIONS
- En l’absence d’efficacité suffisante, il peut être envisagé :
- une augmentation de la fréquence des injections des ASST (par exemple, tous les 15 jours) ;
- traitements locorégionaux de réduction tumorale (chirurgie, embolisation intra-artérielle) lorsque le volume tumoral est distribué de façon favorable ;
- traitements systémiques : RIV, évérolimus, interféron α pégylé ;
- le télotristat (inhibiteur oral de la tryptophane hydroxylase) réduit l’intensité de la diarrhée chez des patients ayant un syndrome carcinoïde réfractaire, en association avec les ASST (Kulke et al. 2017), mais n’est pas disponible en France (niveau de recommandation : grade B).
- Toute indication de chirurgie chez un patient ayant un syndrome carcinoïde insuffisamment contrôlé doit être validée en RCP RENATEN, étant donné le surrisque de morbi-mortalité chez ces patients (maladie évoluée, terrain fragile, risque cardiaque, dénutrition).
11.4.1.3. Syndrome de Zollinger-Ellison
REFERENCES
- Le traitement repose sur les IPP à doses adaptées à la réponse clinique et endoscopique. Les doses initiales recommandées sont de 40 à 60 mg deux fois par jour d’équivalent oméprazole (Hofland et al. 2023). Les patients doivent être prévenus de la nécessité d’un traitement au long cours et de ne jamais l’interrompre (niveau de recommandation : grade B).
- Le traitement par IPP au long cours est très bien supporté. Il est très rarement associé à des risques de malabsorption (Fe, Ca, Mg, vitamine B12, à doser annuellement ou en cas de symptômes), d’ostéoporose possiblement fracturaire, d’infection pulmonaire ou digestive notamment liée à Clostridium difficile, d’insuffisance rénale chronique. La balance bénéfices-risques en cas de SZE est toujours en faveur du maintien au très long cours des IPP, sans limitation de dose, l’objectif étant de supprimer les symptômes liés à l’hypersécrétion gastrique acide et de cicatriser complètement les lésions peptiques.
OPTIONS
- En l’absence d’efficacité suffisante ou en cas d’intolérance (ce qui est exceptionnel), il peut être envisagé :
- Les anti-H2, qui sont moins efficace que les IPP, doivent être utilisés à forte dose et sont moins bien tolérés que les IPP ;
- Les analogues de la SST, qui pourraient avoir une action anti sécrétoire (Rossi et al. 2021) ;
- Les traitements de réduction tumorale ;
- Une gastrectomie totale, dont l’indication reste exceptionnelle.
- L'interruption des IPP après chirurgie curative, si envisagée, doit être très progressive, et entamée très à distance de l’intervention, uniquement en l’absence de toute maladie résiduelle.
11.4.1.4. Insulinome
REFERENCES
- Les mesures diététiques (fractionnement de l’alimentation et collations systématiques dans la journée) peuvent suffire en cas de syndrome sécrétoire peu intense. Le patient et son entourage sont informés des symptômes d’hypoglycémie et éduqués aux modalités de surveillance des glycémies capillaires et de resucrage.
- Le diazoxide (sulfamide hyperglycémiant inhibant la libération d'insuline) est efficace dans environ 50% des cas. Son traitement est souvent de courte durée avant résection/destruction de l’insulinome. Il peut entrainer des effets secondaires (rétention hydrosodée nécessitant fréquemment son association à un thiazidique, hypertrichose, thrombocytopénie et insuffisance rénale (Baudin et al. 2013).
- La résection chirurgicale est le traitement de référence des formes résécables. Une chirurgie limitée (sans curage systématique en cas de faible taille tumorale) est alors recommandée (idéalement une énucléation) lorsqu’elle est réalisable, étant donné le faible risque d’extension métastatique.
OPTIONS
- La destruction par radiofréquence guidée par EE des insulinomes a montré une efficacité à court terme significative (>95%) et peut être proposée en alternative à la chirurgie en centre expert (Crinò et al. 2023). Elle pourrait devenir prochainement un traitement de première intention.
- Dans les formes réfractaires (Ito & Jensen 2021) :
- Les analogues de la SST sont efficaces dans 40-50% des cas mais peuvent avoir des effets paradoxaux par inhibition des hormones de contre régulation notamment du glucagon (Vezzosi et al. 2005).
- L’évérolimus peut être utilisé chez les patients ayant un insulinome métastatique et des hypoglycémies persistantes malgré d’autres traitements (Bernard et al. 2013).
- Le pasiréotide est un analogue de la SST ciblant le récepteur SSTR5 (plus forte affinité que le lanréotide et l’octréotide) pouvant avoir une efficacité dans cette indication (hors AMM) (Hendren et al. 2018). Les traitements à visée antitumorale, loco-régionaux (chirurgie de réduction, (chimio)embolisations) ou systémiques comme le sunitinib, la chimiothérapie ou la RIV, peuvent également être envisagés (Veltroni et al. 2020). Ces traitements doivent être discutés au cas par cas en centre expert avec une surveillance initiale hospitalière.
- Les glucocorticoïdes (par ex., prednisone 1 mg/kg/j)., qui augmentent la gluconéogenèse et provoque une résistance à l'insuline, peuvent également aider à stabiliser la glycémie.
11.4.1.5. VIPome
REFERENCES
- Le traitement symptomatique repose sur une hydratation intensive adaptée aux pertes, et un rééquilibrage des désordres hydroélectrolytiques.
- Les analogues de la SST sont le traitement antisécrétoire de première intention et permettent une amélioration rapide du syndrome sécrétoire dans environ 67 % des cas (Brugel et al. 2021).
- La résection chirurgicale est le traitement de référence des formes résécables.
OPTIONS
- Dans les formes réfractaires (Ito & Jensen 2021) :
- Le sunitinib semble associé au plus fort taux de contrôle des symptômes, avec un effet rapide (de Mestier et al. 2015c; Brugel et al. 2021).
- Les autres traitements à visée antitumorale peuvent être discutés au cas par cas en centre expert, notamment la chirurgie de réduction de masse tumorale et la chimiothérapie, voire les traitements locorégionaux hépatiques (Brugel et al. 2021).
11.4.1.6. Glucagonome
REFERENCES
- Le traitement symptomatique repose sur un contrôle de la glycémie et une correction des carences nutritionnelles et micro-nutritionnelles liées aux effets cataboliques du glucagon. En cas de dénutrition et/ou carences sévères, des perfusions d'acides aminés et d’acides gras essentiels peuvent être nécessaire (de Herder & Hofland 2022).
- Les analogues de la SST sont le traitement antisécrétoire de première intention et permettent une amélioration du syndrome sécrétoire dans plus de 60 % des cas.
OPTIONS
- Dans les formes réfractaires, les traitements à visée antitumorale peuvent être discutés au cas par cas en centre expert, notamment la chirurgie de réduction de masse tumorale et la chimiothérapie, voire les traitements locorégionaux hépatiques (Ito & Jensen 2021 ; de Herder & Hofland 2022).
11.4.2. Traitement des digestives TNE non métastatiques
Sauf indication contraire, les recommandations suivantes correspondent à un accord d'experts.
11.4.2.1. Précautions concernant le traitement des TNE digestives non métastasiques
REFERENCES
- Avant toute intervention chirurgicale, toutes les indications et procédures chirurgicales doivent être discutées par une RCP RENATEN.
- La prise en charge dans un centre expert à haut volume est recommandée, même si les seuils de volume et la définition de l’expertise ne sont pas consensuels (Farges et al. 2017; Kalifi et al. 2023) (niveau de recommandation : grade C).
- S'il y a le moindre doute sur l'existence possible d'un phéochromocytome ou paragangliome, mesurer la concentration des métanéphrines plasmatiques ou urinaires, avant toute biopsie ou chirurgie.
- Toute hypersécrétion hormonale et ses conséquences biologiques et cliniques doivent être contrôlées avant la chirurgie (Kaltsas et al. 2017).
- L'anesthésiste (idéalement expérimenté en anesthésie des patients avec TNE, surtout en cas de TNE fonctionnelle) doit inclure un traitement antisécrétoire dans la prise en charge péri-opératoire des TNE fonctionnelles, comme les IPP à haute dose pour le SZE (à ne jamais arrêter en post-opératoire immédiat), les analogues de la SST pour le syndrome carcinoïde (en particulier pour la prévention de la crise carcinoïde), les VIPomes ou les glucagonomes, et le contrôle de la glycémie pour l'insulinome (limiter le jeûne post-opératoire sous couvert d’une perfusion de sérum glucosé).
- Quelle que soit la localisation tumorale, en cas de traitement endoscopique ou chirurgical premier, les résultats anatomo-pathologiques définitifs doivent faire discuter la pertinence ou non d’un traitement complémentaire (par exemple, chirurgie après exérèse endoscopie première), et les modalités de surveillance.
11.4.2.2. Traitement des TNE gastriques non métastatique (cf. algorithme 11.8.1.)
- Il existe 3 types de TNE bien différenciées gastriques (Delle Fave et al. 2016; Vanoli et al. 2018) :
- Les TNE de type 1 (70%-80%), le plus souvent de petite taille (< 10 mm dans 80% des cas), multiples et fundiques, se développent en contexte d’hypergastrinémie par achlorhydrie en raison d’une gastrite atrophique fundique observée principalement en cas de maladie de Biermer ou beaucoup plus rarement secondairement à une gastrite atrophique liée à une infection à H. pylori. Elles sont généralement G1 mais peuvent être G2 et ont un potentiel métastatique très faible avec un pronostic excellent (Tsolakis et al. 2019).
- Les TNE de type 2 (<5%) sont de multiples TNE fundiques développées sous l’influence de l’hypergastrinémie liée à un gastrinome en contexte de NEM1. Elles ont un bon pronostic mais peuvent être associées à des critères d’agressivité tumorale.
- Les TNE de type 3 (15-25%) sont des TNE sporadiques uniques, parfois ulcérées, souvent larges (> 10 mm dans 70% des cas) et non associées à une hypergastrinémie. Elles peuvent se développer aux dépens de l’antre ou du fundus. Elles sont généralement G2 ou G3 et sont associées à un risque élevé de métastases (≥ 50%).
- En pratique, il est très important de faire la distinction entre les TNE de type 1 et de type 3, par des arguments endoscopiques (cf. 11.2.2.2.), anatomo-pathologiques (aspects des muqueuses antrales et fundiques) et biologiques (cf. 11.2.3.) (Panzuto et al. 2023).
- Le bilan pré-thérapeutique devant une TNE gastrique unique > 10 mm d’allure résécable doit inclure au minimum : des biopsies antrales et fundiques multiples, un dosage de la gastrinémie (après arrêt des IPP) et une EE gastrique.
- En cas de TNE de taille > 10 mm et/ou de type 3, une imagerie conventionnelle (scanner ou IRM) abdominale et une TEP/TDM au 68Ga-DOTATOC sont recommandées.
REFERENCES
- Traitement des TNE gastriques de type 1 :
- Lésions ≤ 10 mm et G1 : le risque de métastases est très faible (≤ 1%). Aucun bilan complémentaire ou suivi spécifique (autre que celui de la gastrite chronique pour surveiller le risque de développement de métaplasie intestinale, de dysplasie et d'adénocarcinome) n'est recommandé. Le traitement de référence consiste en une simple surveillance, mais la résection endoscopique des TNE les plus volumineuses peut être réalisée (Vanoli et al. 2018; Panzuto et al. 2023).
- Lésions entre 10 et 20 mm, G1 (ou G2 faible), sans invasion musculaire, ni ganglions lymphatiques suspects périgastriques en EE : mucosectomie endoscopique (EMR) avec aspiration par capuchon ou avec ligature, ou dissection sous-muqueuse endoscopique (Rossi et al. 2022) (niveau de recommandation : grade C). En cas de résection incomplète sans facteur pronostique péjoratif, une résection endoscopique complémentaire peut être discutée en centre expert.
- Lésions ≥ 20 mm, ou en cas de G2 fort/G3, avec invasion musculaire (8-12% des cas), ou ganglions lymphatiques suspects périgastriques (8-20% des cas) en EE : discuter la résection chirurgicale (gastrectomie atypique avec picking ou curage ganglionnaire selon les caractéristiques de la tumeur et du patient). Aucun traitement adjuvant n'est recommandé (Panzuto et al. 2023) (niveau de recommandation : grade C).
- Traitement des TNE gastriques de type 2 :
- Similaire aux TNE gastriques de type 1, sauf en cas d’indication chirurgicale (exceptionnelle) : discuter la gastrectomie totale du fait du SZE associé.
- Traitement des TNE gastriques de type 3 :
- Une chirurgie carcinologique avec curage ganglionnaire est le traitement de référence ; elle doit être similaire à celle réalisée pour les adénocarcinomes (Panzuto et al. 2023). Aucun traitement adjuvant n’est recommandé.
- Le traitement des TNE gastriques de type 3 de taille < 20 mm n'est pas défini. Le risque de métastases est relativement élevé (25%) ce qui fait préconiser une chirurgie radicale comme référence. Des études récentes suggèrent qu'une résection endoscopique (dissection sous-muqueuse) peut être envisagée pour les lésions G1 (ou G2 faible) ≤ 10 mm (seuil non défini, à discuter entre 10 et 20 mm) si un bilan d’extension approprié (cf. supra) est sans particularité, notamment en l’absence de métastases ganglionnaires (Exarchou et al. 2021; Panzuto et al. 2023).
OPTIONS
Les ASST n’ont pas démontré de bénéfice pour le traitement des TNE gastriques de type 1, mais peuvent être envisagés en RCP RENATEN lorsqu’une résection tumorale endoscopique ou chirurgicale est indiquée (cf. supra) mais impossible (Panzuto et al. 2023).
11.4.2.3. Traitement des TNE duodénales ou ampullaires non métastatiques (cf. algorithme 11.8.2.)
- La plupart des TNE duodénales sont trouvées dans le premier et le deuxième duodénum, dont 20% en région ampullaire. Moins de 10% sont fonctionnelles (essentiellement SZE) (Panzuto et al. 2023).
- La réalisation d’une EE haute est recommandée devant toute TNE duodénale afin de planifier la meilleure approche thérapeutique (cf. 11.2.2.2).
- Les facteurs associés à un risque accru de métastases ganglionnaires et à une survie plus courte sont : la localisation ampullaire, la taille tumorale > 10 mm, le grade G2-G3, l'invasion lymphovasculaire, l'invasion pariétale de la musculaire, les gastrinomes et somatostatinomes. Dans ces situations, il est recommandé de réaliser un bilan d’extension complet (scanner thoraco-abdominal, IRM hépatique, TEP/TDM au 68Ga-DOTATOC) (Vanoli et al. 2017; Gay-Chevallier et al. 2021; Panzuto et al. 2023).
REFERENCES
- La chirurgie radicale avec curage ganglionnaire est recommandée pour toute tumeur > 10 mm (voire >15 mm en l’absence d’autre facteur de risque), de localisation ampullaire et/ou en présence de facteur(s) péjoratif(s) (niveau de recommandation : grade C).
- La résection endoscopique est recommandée pour les TNE duodénales non fonctionnelles ≤ 10 mm, sans facteur péjoratif et sans ganglion lymphatique suspect en EE (Gay-Chevallier et al. 2021; Panzuto et al. 2023) (niveau de recommandation : grade C).
- La résection endoscopique des TNE duodénales est associée à une morbidité importante et à des difficultés pour réaliser une résection R0 ; par conséquent, elle doit être faite en centre experts. La polypectomie/EMR standard doit être évitée (50% de R1) et l'EMR avec aspiration par capuchon ou avec ligature doit être préférée. L'ESD peut être supérieure à l'EMR pour améliorer le taux de résection R0, mais avec un taux de morbidité élevé en raison du risque de perforation duodénale (Gincul et al. 2016).
- L’ampullectomie endoscopique n’est pas recommandée en cas de TNE ampullaire.
OPTIONS
- La résection endoscopique semble possible pour les lésions mesurant entre 10 mm et 15 mm sans autre facteur péjoratif notamment sans suspicion de métastase ganglionnaire (Gay-Chevallier et al. 2021; Rossi et al. 2022; Xie et al. 2022).
- Bien que le rôle de la chirurgie d’épargne parenchymateuse soit mal défini dans les TNE duodénales ou péri-ampullaire, une ampullectomie chirurgicale peut être suffisante pour les petites (< 10-15 mm) TNE ampullaires sans métastase ganglionnaire (bilan préopératoire négatif, examen extemporané d’un picking ganglionnaire peropératoire négatif), en particulier chez les patients présentant des comorbidités qui ne sont pas de bons candidats à une duodénopancréatectomie céphalique. Cette chirurgie doit être effectuée dans des centres spécialisés.
- L’indication d’une duodénotomie avec curage ganglionnaire doit être discutée en centre expert pour les gastrinomes duodénaux, en alternative à la duodénopancréatectomie céphalique.
11.4.2.4. Traitement des TNE pancréatiques non métastatiques
- Les indications chirurgicales dépendent de facteurs pronostiques, de la localisation de la lésion, du terrain et de l'existence ou non d’un syndrome de prédisposition héréditaire, qui doit être cherché dans les conditions décrites ci-dessus (cf. 11.3.5.) avant toute discussion chirurgicale.
- La chirurgie des TNE pancréatiques doit être réalisée dans des centres experts, et en particulier en cas de syndrome oncogénétique (NEM1, VHL), afin de pouvoir proposer si nécessaire une chirurgie d’épargne parenchymateuse chez certains patients, un curage ganglionnaire approprié et limiter le risque péri-opératoire (Farges et al. 2017) (niveau de recommandation : grade B).
11.4.2.4.1. TNE pancréatiques sporadiques
REFERENCES
- La résection chirurgicale doit toujours être envisagée, même chez les patients ayant une extension locorégionale, sauf si le risque opératoire est trop élevé (en particulier si une duodénopancréatectomie céphalique doit être envisagée) ou si les conséquences fonctionnelles postopératoires prévisibles sont trop sévères (Kos‐Kudła et al. 2023) (niveau de recommandation : grade C). Aucun traitement adjuvant n’est recommandé.
- Toute résection pancréatique doit être associée à un curage ganglionnaire avec un nombre minimal de 12 ganglions réséqués (Partelli et al. 2018a; Guarneri et al. 2021). Cela ne s'applique pas aux insulinomes typiques qui sont éligibles à une énucléation (niveau de recommandation : grade C).
- Si une chirurgie d’épargne parenchymateuse (dont énucléation) est envisagée pour une TNE pancréatique ayant des caractéristiques pronostiques favorables (taille ≤ 20 mm, G1, asymptomatique), elle doit être associée à la réalisation d’un picking ganglionnaire.
- La réalisation d’une cholécystectomie est recommandée systématiquement lors de toute chirurgie (en particulier, de chirurgie initiale) chez les patients susceptibles de recevoir des analogues de la SST.
- Les petits incidentalomes pancréatiques (< 20 mm) peuvent être surveillés sans résection chirurgicale, à condition que (Gaujoux et al. 2013; Crippa et al. 2014; Sallinen et al. 2018; Kos‐Kudła et al. 2023) (niveau de recommandation : grade C) :
- Ils soient découverts fortuitement et sont donc asymptomatiques et non fonctionnels.
- Leur taille est < 20 mm (stade T1).
- Ils ont des caractéristiques typiques de TNE de bas grade : prise de contraste marquée à la phase artérielle en scanographie ou en IRM ou en EE de contraste, hyperfixation caractéristique en TEP/TDM au 68Ga-DOTATOC.
- Ils correspondent à des TNE bien différenciée G1 (ou G2 bas avec Ki-67 <5%, seuil non défini avec précision) si une preuve histologique a été obtenue (la biopsie sous EE est néanmoins fortement recommandée en cas de taille > 10 mm).
- Il n'y a aucune suspicion de métastase ganglionnaire ou à distance.
- Il n'y a pas de dilatation canalaire pancréatique ou biliaire à l'imagerie.
- Il n'y a pas de progression sur les imageries de suivi.
- Le patient soit compliant au suivi et ait bien compris et consenti à l’option proposée.
- La surveillance des petits incidentalomes pancréatiques non réséqués peut être réalisée par IRM si elle permet la visualisation parfaite de la TNE, ou alternativement par scanographie (en tenant compte du risque à long terme d’irradiation cumulative). Bien qu'il ne soit pas précisément défini, un suivi peut être proposé à 6 mois puis annuellement. La chirurgie doit être envisagée si la taille augmente (seuil non défini).
OPTIONS
- La positivité de la TEP/TDM au 18FDG est associée à un pronostic péjoratif. En cas d’incidentalome pancréatique de taille comprise entre 10 mm et 20 mm présentant une hyperfixation en TEP/TDM au 18FDG mais sans autre facteur péjoratif, une résection chirurgicale peut être discutée au cas par cas mais ne doit pas être proposée systématiquement en l’absence de preuve scientifique formelle.
- Bien que l'ablation par radiofréquence EE-guidée des petites TNE pancréatiques non fonctionnelles semble techniquement faisable (Barthet et al. 2019), elle est toujours en cours d’évaluation et n’est pas recommandée en routine, notamment car elle ne permet pas d’évaluer le risque de métastase ganglionnaire sur lequel repose principalement l’indication thérapeutique.
ESSAIS CLINIQUES
- ASPEN : Étude prospective observationelle de la prise en charge des TNE pancréatiques asymptomatiques non-fonctionnelles sporadiques ≤ 20 cm
https://clinicaltrials.gov/ct2/show/NCT03084770
11.4.2.4.2. Particularités liées à la NEM1
REFERENCES
- Les indications chirurgicales sont identiques à celles des TNE pancréatiques sporadiques, à l'exception des gastrinomes pour lesquels le bénéfice de la chirurgie reste débattu en raison d’un rapport bénéfices/risques qui est défavorable dans certaines situations (Falconi et al. 2016; Triponez et al. 2018) (niveau de recommandation : grade C).
- La procédure chirurgicale doit être définie lors d'une RCP avec un chirurgien ayant une expérience de la prise en charge des patients atteints de NEM1 et tenant compte des autres atteintes de la maladie et de son pronostic (Gaujoux et al. 2022).
- En cas de SZE et si une indication chirurgicale est retenue, une exploration du duodénum par transillumination endoscopique et duodénotomie est nécessaire pour chercher de petits gastrinomes (souvent infracentimétriques et presque toujours multiples), et une échographie pancréatique per-opératoire est également nécessaire.
- Une surveillance est recommandée pour les patients avec une TNE pancréatique asymptomatique non fonctionnelle ≤ 20 mm car associée à un faible risque de mortalité spécifique (Triponez et al. 2018) (niveau de recommandation : grade C).
- Si une chirurgie pour hyperparathyroïdie est indiquée, celle-ci doit être réalisée avant la chirurgie des TNE pancréatiques, en particulier des gastrinomes.
11.4.2.5. Traitement des TNE de l'intestin grêle non métastatiques
REFERENCES
- Le traitement de référence est la résection chirurgicale de la (des) tumeur(s) primitive(s) associée au curage mésentérique supérieur (niveau de recommandation : grade C). La résection endoscopique des TNE du grêle est formellement contre-indiquée. La résection chirurgicale, à visée curative lorsque toute la maladie peut être réséquée (Bangla et al. 2022), doit préserver au maximum la longueur de l’’intestin grêle voire, quand cela est possible, la valvule iléo-caecale afin de limiter les séquelles de la chirurgie.
- La palpation manuelle de tout l’intestin grêle pour détecter les tumeurs primitives multiples (jusqu’à 50% des cas) est un temps indispensable de l’intervention (Keck et al. 2018; Kalifi et al. 2021). Aucun examen préopératoire ne peut remplacer la palpation manuelle réalisée par le chirurgien. La chirurgie est habituellement réalisée par laparotomie mais la laparoscopie peut être une option si l'intestin grêle est extériorisé pour permettre une palpation manuelle entière (niveau de recommandation : grade C).
- Toute la cavité abdominale doit être explorée à la recherche de métastases à distance, en particulier le parenchyme hépatique (palpation +/- échographie hépatique) (Elias et al. 2010) et le péritoine (carcinose péritonéale présente dans 30% des cas) (Wonn et al. 2021) avec exploration des ovaires (Limbach et al. 2020).
- Le curage ganglionnaire mésentérique doit être systématiquement effectué quelle que soit la taille de la tumeur primitive (même si < 10 mm) car des métastases ganglionnaires sont présentes dans près de 80% des cas (Norlén et al. 2012; Landry et al. 2013; Walsh et al. 2016; Motz et al. 2018) (niveau de recommandation : grade B). Il doit permettre l’analyse d’au moins 8 ganglions lymphatiques pour améliorer le pronostic et pour correctement identifier les tumeurs N+ (Chen et al. 2018; Motz et al. 2018; Zaidi et al. 2018; Daskalakis et al. 2022) (niveau de recommandation : grade C).
- Un scanner avec reconstruction coronale et temps artériel précoce de qualité, permettant de visualiser les rapports entre la masse mésentérique et les vaisseaux mésentériques, doit être fait en préopératoire pour classer la masse mésentérique et prédire les difficultés de résection de la masse mésentérique (Lardière-Deguelte et al. 2015; Pasquer et al. 2015).
- Le curage mésentérique est faisable si au moins 3 branches artérielles à visée jéjunale sont libres d’envahissement sur l’imagerie (niveau de recommandation : grade C).
- Si moins de 3 artères à destinée jéjunale sont identifiées comme étant libres sur l’imagerie, la résection de la masse mésentérique sera difficile. Il est recommandé qu’une telle chirurgie soit effectuée en centre expert pour augmenter les chances de résection R0 et limiter les risques de résection extensive de l’intestin grêle (Lardière-Deguelte et al. 2015; Pasquer et al. 2016).
- Le curage mésentérique peut être rendu difficile voire impossible lorsque la masse mésentérique (mésentérite rétractile) envahit la racine du mésentère sans laisser d’artère libre à destinée jéjunale. Si aucune branche à destinée jéjunale n’est libre (LN-Stage IV), la masse n’est pas résécable en totalité. Dans ce cas, il ne faut pas chercher à réséquer la tumeur.
- Une cholécystectomie doit être systématiquement réalisée lors de toute chirurgie (en particulier, de chirurgie initiale) chez les patients atteints de TNE de l’intestin grêle à haut risque de récidive, en raison des risques ultérieurs de lithiase vésiculaire associés aux analogues de la SST et de cholécystite ischémique liée à la CEIAH (Niederle et al. 2016; Brighi et al. 2019).
- En cas de complication aiguë en rapport avec une TNE intestinale primitive ou sa masse mésentérique, nécessitant une intervention chirurgicale en urgence, le geste doit se limiter à la gestion de cette complication (occlusion intestinale, ischémie mésentérique, péritonite) (Le Roux et al. 2011). Dans cette situation, il convient d’envisager une résection seule du segment digestif pathologique avec ou sans rétablissement de la continuité, sans tentative de dissection étendue notamment de la masse mésentérique, et d’adresser le patient en centre expert pour bilan d’extension approprié et chirurgie carcinologique complémentaire si celle-ci est indiquée (Deguelte et al. 2022a).
- Aucun traitement adjuvant n’est recommandé.
OPTIONS
- La pertinence d'un curage le long du tronc de l'artère mésentérique supérieure jusqu'à la zone rétro-pancréatique a été suggérée mais nécessite confirmation et la démonstration d'un rapport bénéfice/risque favorable (Pasquer et al. 2016).
- Si la première chirurgie est considérée comme non optimale (chirurgie réalisée en urgence, <8 ganglions lymphatiques analysés, absence de palpation de tout l’intestin grêle), une réintervention pour palpation de tout l’intestin grêle et curage mésentérique approprié doit être discutée en RCP RENATEN, avec les résultats d'un bilan complet comprenant une TEP/TDM à la 18FDOPA (ou à défaut une TEP/TDM au 68Ga-DOTATOC) et une IRM hépatique, en prenant en compte l'âge, l’état général du patient et le bénéfice attendu (Le Roux et al. 2011; Deguelte et al. 2022).
11.4.2.6. Traitement des TNE de l'appendice non métastatiques (cf. algorithme 11.8.3.)
- La 8ème édition de la classification TNM de l’UICC (cf. 11.3.3. Tableau 3) semble discutable pour les TNE de l’appendice car l'invasion de la sous-séreuse ou du mésoappendice et le seuil de taille de 4 mm n'ont pas été validés. En complément de cette classification, nous proposons d'ajouter le stade TNM selon la classification ENETS 2007 (Rindi et al. 2007), basée sur des seuils cliniquement pertinents :
- T1, tumeur ≤ 10 mm envahissant la sous-muqueuse et la muscularis propria ;
- T2, tumeur ≤ 20 mm envahissant la sous-muqueuse, la muscularis propria et/ou envahissant focalement (jusqu'à 3 mm) la sous-séreuse / le méso-appendice ;
- T3, tumeur > 20 mm et/ou invasion étendue (plus de 3 mm) de la sous-séreuse / du mésoappendice ;
- T4, la tumeur envahit le péritoine ou d'autres organes.
- Les TNE de l’appendice sont généralement découvertes fortuitement sur une pièce d’appendicectomie, habituellement réséquée sans ganglion lymphatique examinable. Le risque de métastases ganglionnaires est extrêmement faible pour les TNE appendiculaire de taille < 10 mm, rare pour les TNE de taille comprise entre 10 et 20 mm, et significatif pour celles de taille > 20 mm (> 20%). La présence de métastases ganglionnaires a un impact pronostique controversé et ne semble pas corrélé à la présence de métastases à distance, qui reste exceptionnelle (Kaltsas et al. 2023).
- La prise en charge des TNE de l’appendice de taille comprise entre 10 et 20 mm n’est pas consensuelle.
- Les recommandations internationales recommandent de discuter une colectomie droite avec curage ganglionnaire complémentaire en présence de facteurs associés à des métastases ganglionnaires (taille tumorale > 15 mm, emboles lymphovasculaires et/ou invasion péri-nerveuse, grade G2/G3 et/ou résection R1) (Pape et al. 2016; Brighi et al. 2018; Rault-Petit et al. 2019). Néanmoins, le bénéfice de cette chirurgie complémentaire n’a jamais été proprement étudié.
- Une large étude européenne récente (Nesti et al. 2023) ayant inclu 278 patients (163 traités par appendicectomie et 115 par colectomie droite, recul de plus de 10 ans) a rapporté que la présence de métastases ganglionnaires (20% dans le groupe colectomie et 13% prédits dans le groupe appendicectomie) n’était pas associée aux facteurs sus-cités (localisation, grade, invasion lymphovasculaire, infiltration du méso-appendice) et n’impactait pas la survie. Le taux de métastases à distance était < 1% et aucune récidive n’était rapportée. La réalisation d’une colectomie et d’un curage complémentaires n’était pas associée à un bénéfice de survie en comparaison à l’appendicectomie, alors qu’elle est associée à une moins bonne qualité de vie (Alexandraki et al. 2020).
REFERENCES
- En cas de TNE de l’appendice ≤ 10 mm, aucune exploration ni traitement complémentaire n'est recommandé en cas de TNE G1 après résection R0 (Brighi et al. 2018; Rault-Petit et al. 2019; Kaltsas et al. 2023) (niveau de recommandation : grade C). La colectomie droite complémentaire n’est pas validée pour les TNE ≤ 10 mm en cas de G2, R1, emboles vasculaires, invasion péri-nerveuse et/ou invasion du mésoappendice, et n’est pas étayée par les données de l’étude européenne récente (Nesti et al. 2023).
- En cas de TNE de l’appendice > 20 mm, d’appendicectomie R1/R2 et/ou d’histologie atypique, il est recommandé de réaliser une colectomie droite avec curage ganglionnaire après bilan d’extension complet (Brighi et al. 2018; Rault-Petit et al. 2019; Kaltsas et al. 2023) (niveau de recommandation : grade C).
- Aucun traitement adjuvant n’est recommandé.
- En cas de TNE de l’appendice de taille comprise entre 10 et 20 mm, une colectomie droite avec curage ganglionnaire ne peut pas être recommandée chez les patients opérés d’une appendicectomie complète (Kaltsas et al. 2023; Nesti et al. 2023). Cependant compte-tenu du recul limité dans les études, ces dossiers doivent être discutés en RCP RENATEN qui statuera sur l’indication de chirurgie complémentaire et/ou de suivi, notamment en cas de G2, R1, emboles vasculaires et/ou invasion péri-nerveuse.
- Les adénocarcinomes à cellules caliciformes (goblet-cell adenocarcinoma) ne sont pas des NNE et sont traités dans le chapitre 14 Tumeurs appendiculaires du TNCD.
11.4.2.7. Traitement des TNE du côlon non métastatiques
REFERENCES
- Les TNE coliques sont rares, avec des données spécifiques très limitées.
- Le traitement recommandé est la chirurgie carcinologique avec curage ganglionnaire, comme pour les adénocarcinomes.
- Les TNE du cæcum peuvent être traitées comme des TNE de l’intestin grêle, incluant une résection intestinale segmentaire (colectomie ou résection iléocæcale) associé à un curage ganglionnaire (Panzuto et al. 2023).
- Aucun traitement adjuvant n’est recommandé.
11.4.2.8. Traitement des TNE du rectum non métastatiques (cf. algorithme 11.8.4.)
- Les principaux facteurs associés au risque de métastases ganglionnaires sont la taille tumorale ≥ 10 mm, l'aspect endoscopique atypique (dépression, ulcération), les ganglions lymphatiques suspects en EE et/ou en IRM pelvienne, l'invasion de la musculeuse propria (T2), le grade G2 et l’invasion lymphovasculaire (Fine et al. 2019; de Mestier et al. 2019a; Rinke et al. 2023).
REFERENCES
- L’identification des TNE rectales lors de l'endoscopie initiale est d'une importance capitale pour pouvoir décider de la prise en charge la plus appropriée (Fine et al. 2019). Si une TNE rectale est suspectée, les techniques de résection avancées (voir ci-dessous) doivent être préférées à la polypectomie à l’anse froide et à la mucosectomie, à éviter en raison du taux élevé de marges de résection positives avec ces techniques (de Mestier et al. 2019a; Rinke et al. 2023) (niveau de recommandation : grade C). Si des techniques avancées de résection ne sont pas disponibles sur place, il est préférable d'effectuer une biopsie superficielle (sauf dans les très petites lésions ≤ 5 mm en raison du risque de résection inappropriée à l'aide de la pince à biopsie et de la difficulté à identifier la lésion par la suite) et d'un bilan approprié, puis orienter le patient vers un centre endoscopique expert plutôt que de tenter une polypectomie ou une mucosectomie standard.
- La coloscopie totale est indispensable chez tous les patients atteints de TNE rectale afin d'exclure un adénome, un adénocarcinome ou une autre TNE colique ou rectale concomitante, qui peuvent survenir jusque dans 8% des cas (cf. 11.2.2.2).
- Aucune exploration supplémentaire n'est requise pour les TNE rectales G1, <10 mm, T1 et R0 après résection initiale (de Mestier et al. 2019a; Rinke et al. 2023).
- Les TNE rectales sans facteur de risque métastatique (et pas de métastase ganglionnaire suspecte en EE ni en IRM pelvienne) sont de bonnes candidates pour la résection locale. Les techniques de résection semblant les plus appropriées sont :
- Pour les lésions < 10 mm: mucosectomie à l'aide d'un capuchon ou avec ligature, ou dissection sous-muqueuse (Pan et al. 2018; de Mestier et al. 2019a) ;
- Pour les lésions de 10 à 15 mm, dissection sous-muqueuse (ou résection transpariétale FTRD) ou microchirurgie endoscopique transanale, selon l'expertise locale et à réserver aux centres experts (Chen et al. 2016; Ortenzi et al. 2016; de Mestier et al. 2019a).
- Une résection locale de sauvetage par dissection sous-muqueuse (ou résection FTRD) ou microchirurgie endoscopique transanale peut être proposée pour les TNE rectales à faible risque de métastases avec résection endoscopique initialement R1 et doit être réservée aux centres experts (de Mestier et al. 2019a; Rinke et al. 2023). Une endoscopie de repérage doit alors être faite au plus vite, car si la cicatrice de résection initiale ne peut être identifiée (tatouage ou idéalement clip suivi d’un scanner), la résection locale de sauvetage ne peut être envisagée ; une surveillance est alors recommandée (cf. 11.6.2.1).
- Une résection chirurgicale radicale avec curage ganglionnaire doit être envisagée pour toute TNE rectale >20 mm et/ou présentant une suspicion d’adénopathies métastatiques ou un/plusieurs facteur(s) de risque de métastases
- Les TNE rectales réséquées en totalité, < 10 mm et sans facteur péjoratif ne nécessitent pas de surveillance. Dans le cas contraire, le suivi repose sur un examen endoscopique régulier et une IRM abdominopelvienne (cf. 11.6.2.1).
11.4.3. Traitement des TNE digestives métastatiques
11.4.3.1. Considérations générales (cf. algorithme 11.8.5.)
REFERENCES
- Tous les cas doivent être discutés en RCP experte dédiée aux NNE (en France, dans le cadre du réseau RENATEN-ENDOCAN).
- Le traitement oncologique des TNE métastatiques est indiqué en cas de (Pavel et al. 2016) :
- métastases avec progression morphologique sur des imageries consécutives (3-12 mois) ;
- ou hypersécrétion hormonale non contrôlée malgré un traitement symptomatique ;
- ou volume tumoral élevé défini par une atteinte métastatique du foie > 50% ou des symptômes liés à la masse tumorale.
- Toute décision thérapeutique doit toujours être discutée et partagée avec le patient, et prise après information appropriée.
- Les éléments additionnels à prendre en compte pour la prise de décision thérapeutique au cas par cas comprennent :
- localisation de la tumeur primitive (duodéno-pancréatique vs autre) ;
- grade et différenciation des tumeurs (en particulier concernant les NNE G3) ;
- intervalle sans maladie et/ou vitesse de croissance tumorale (pente évolutive) ;
- fixation tumorale en TEP/TDM au 68Ga-DOTATOC ;
- fixation tumorale en TEP/TDM au 18FDG si réalisée ;
- volume tumoral, notamment le taux d’envahissement métastatique hépatique, qui peut être classé semi-quantitativement en quatre catégories (0-10, 11-25, 26-50 et > 50%) (Zappa et al.2017) ;
- métastases extra-hépatiques (en particulier os, péritoine) ;
- résécabilité de la tumeur primitive et de la maladie métastatique ;
- caractéristiques des patients (âge, comorbidités, état général) ;
- traitements antérieurs et toxicité cumulative ;
- l'objectif thérapeutique d'un patient donné, y compris la qualité de vie. Ceci est particulièrement important car les patients atteints de TNE peuvent avoir une survie très prolongée (> 5-10 ans), même en cas de métastases.
- En cas d’échec des traitements de référence chez un patient ayant un état général conservé et une espérance de vie attendue > 6 mois, une nouvelle biopsie tumorale avec panel ADN et recours à une RCP moléculaire peut être envisagé.
11.4.3.2. Métastases hépatiques non ou peu progressives, macroscopiquement résécables
REFERENCES
- Bien qu'il n'y ait pas de définition validée, une progression lente peut être arbitrairement définie par une augmentation de la taille de la tumeur ≤ 20% (critères RECIST) en 12 mois.
- La résection et/ou la destruction (percutanée ou peropératoire) de toutes les métastases visibles doit toujours être discutée, dans la mesure du possible (en combinant éventuellement différentes procédures et différentes modalités et en prenant en compte les risques de complications associés) (niveau de recommandation: grade C) (Frilling et al. 2014; Pavel et al. 2016). En effet, cette stratégie semble être associée à la survie la plus prolongée, bien qu'elle n'ait jamais été correctement comparée à d'autres traitements. Néanmoins, la récidive est généralement la règle en raison de tumeurs microscopiques persistantes chez tous les patients (Elias et al. 2010).
- Chez les patients présentant des métastases initialement non résécables qui présentent une réponse objective au traitement antitumoral, la possibilité d'une résection chirurgicale doit être reconsidérée.
- Chez certains patients, une approche chirurgicale en deux étapes peut permettre une résection complète avec une morbidité acceptable (Kianmanesh et al. 2008). L’alternative est une hépatectomie mineure associe à une destruction des métastases des autres segments par radiofréquence peropératoire) (Gudmundsdottir et al. 2023). La morbidité et la mortalité des procédures extensives et le volume hépatique restant anticipé doivent être mises en balance avec le risque presque inévitable de récidive métastatique à long terme (niveau de recommandation : grade C).
- Une cholécystectomie au cours de la chirurgie des métastases est recommandée.
- Aucun traitement adjuvant n’est recommandé.
Sauf indication contraire, les recommandations suivantes correspondent à un accord d'experts.
11.4.3.3. Métastases non résécables
11.4.3.3.1. TNE duodéno-pancréatiques associées à des métastases non-résécables
11.3.3.3.1.1. Exérèse de la TNE pancréatique primitive en cas de métastases non résécables
REFERENCES
- La résection de la TNE pancréatique primitive en cas de métastases non résécables pourrait être associée à un bénéfice de survie qui n'a pas été confirmé prospectivement (Partelli et al. 2018b). Elle ne peut donc pas être systématiquement recommandée, surtout lorsqu'une duodénopancréatectomie céphalique est nécessaire. L'indication chirurgicale, bien que rare, peut être discutée au cas par cas, afin de prévenir d'éventuelles complications locales (hypertension portale) ou d'anticiper une transplantation hépatique.
- Les candidats les plus appropriés pourraient être ceux avec une TNE G1 ou G2 faible, développée principalement aux dépens du corps ou de la queue du pancréas (chirurgie moins invasive, sans contre-indication ultérieure pour les traitements locorégionaux du foie), avec une progression de la maladie nulle ou faible après plusieurs mois de surveillance ou de traitement systémique.
- Dans ce contexte, les indications de duodénopancréatectomie céphalique sont exceptionnelles. L'existence d'une anastomose bilio-digestive est une forte limitation aux futurs traitements locorégionaux (CEIAH, destruction percutanée) (de Mestier et al. 2017b) (niveau de recommandation : grade C).
- Une cholécystectomie doit être systématiquement réalisée lors de toute chirurgie (en particulier, de chirurgie initiale) réalisée chez les patients atteints de TNE pancréatique métastatique, en raison des risques de lithiase vésiculaire associés aux analogues de la SST et de cholécystite ischémique liée à la CEIAH (Brighi et al. 2019).
11.4.3.3.1.2. Traitement des métastases non-résécables (cf. algorithme 11.8.6.)
REFERENCES
- Traitement de première ligne :
- Chez les patients asymptomatiques, ayant un envahissement hépatique < 50%, un Ki-67 < 10% et pas de progression morphologique :
- analogues de la SST : lanréotide Autogel 120 mg/28j (niveau de recommandation : grade A) ou octréotide LP 30 mg/28j (niveau de recommandation : grade B) (Modlin et al. 2010; Caplin et al. 2014) ;
- ou surveillance en cas de maladie minime ou non-mesurable et si le risque évolutif est évalué comme faible.
- En cas de progression et/ou de métastases symptomatiques malgré un traitement bien conduit, et/ou d’envahissement hépatique > 50% et/ou de Ki-67 > 10% (et/ou en cas de métastases osseuses significatives) :
- Chimiothérapie notamment en cas de progression rapide (progression RECIST < 1 an), de TNE G3, et/ou si l'objectif thérapeutique principal est la réduction du volume tumoral (surtout si la chirurgie des métastases pourrait être possible en cas de bonne réponse). Les principaux protocoles de chimiothérapie sont décrits dans le paragraphe 11.6.
- Streptozotocine + 5FU (Moertel et al. 1992; Clewemar Antonodimitrakis et al. 2016) (niveau de recommandation : grade B). Il a été démontré que la néphrotoxicité peut être évitée par une surveillance stricte (Legoux et al. 2021). Les associations à base de doxorubicine présentent une toxicité élevée et ont été supplantées par d'autres schémas de chimiothérapie.
- Témozolomide + capécitabine (Strosberg et al. 2011; de Mestier et al. 2019b; Kunz et al. 2023) (niveau de recommandation : grade B).
- Témozolomide seul : bien que son association à la capécitabine puisse donner un taux de réponse plus élevé que le témozolomide seul, ce dernier peut être utilisé chez des patients plus fragiles, ou si la réponse objective n'est pas l'objectif thérapeutique principal ou en cas de contre-indication au 5FU (de Mestier et al. 2020a; Kunz et al. 2023) (niveau de recommandation : grade C).
- Dacarbazine + LV5FU2 (de Mestier et al. 2019b) (niveau de recommandation : grade C).
- Chimiothérapie notamment en cas de progression rapide (progression RECIST < 1 an), de TNE G3, et/ou si l'objectif thérapeutique principal est la réduction du volume tumoral (surtout si la chirurgie des métastases pourrait être possible en cas de bonne réponse). Les principaux protocoles de chimiothérapie sont décrits dans le paragraphe 11.6.
- Analogues de la SST en cas de progression lente (niveau de recommandation : grade B) (Modlin et al. 2010; Caplin et al. 2014).
- Chez les patients asymptomatiques, ayant un envahissement hépatique < 50%, un Ki-67 < 10% et pas de progression morphologique :
- Traitement de seconde ligne (et au-delà) :
- Chimiothérapie (voir première ligne).
- Sunitinib (37.5 mg/j) (niveau de recommandation : grade A) (Raymond et al. 2011, 2018).
- Évérolimus (10 mg/j) (niveau de recommandation : grade A) (Yao et al. 2011, 2016a).
- RIV au 177Lu-DOTATATE chez les patients ayant une TNE pancréatique métastatique présentant une expression forte des récepteurs de la SST en TEP/TDM au 68Ga-DOTATOC (fixation tumorale ≥ fixation hépatique) (Baudin et al. 2022) (niveau de recommandation : grade B). Son accessibilité est néanmoins actuellement réduite en France dans cette indication en raison de l’absence de remboursement spécifique. L’indication de la RIV doit être évaluée au regard des alternatives thérapeutiques en présence de lésions significatives ne fixant pas intensément en TEP/TDM au 68Ga-DOTATOC (Chan et al. 2023).
- (Chimio)-embolisation intra-artérielle hépatique (CEIAH), si la maladie hépatique est prédominante (niveau de recommandation : grade C) (de Mestier et al. 2017b; Touloupas et al. 2021). En cas de métastases extra-hépatiques (notamment osseuses), la CEIAH n'est pas strictement contre-indiquée. L'indication doit être validée en RCP RENATEN en présence d'un radiologue interventionnel, en raison du risque élevé de morbidité. Pour réduire la morbidité, le volume du foie peut être segmenté en 2-3 zones à traiter successivement avec un délai de 4 à 8 semaines entre chacune. La chimioembolisation semble être plus efficace que l'embolisation seule dans les TNE duodéno-pancréatiques métastatiques (Gupta et al. 2005; de Mestier et al. 2017b). La chimioembolisation utilise généralement la streptozotocine (sous anesthésie générale) ou l'adriamycine. Les contre-indications absolues pour la CEIAH sont l'anastomose bilio-digestive ou l'endoprothèse biliaire, la dilatation des voies biliaires et la thrombose portale complète.
OPTIONS
- L’inclusion dans des essais cliniques, ou à défaut l’enregistrement prospectif, doit toujours être encouragée et priorisée.
- La durée optimale des traitements systémiques n’est pas bien définie. Notamment la durée de traitement par chimiothérapie alkylante, en cas d’obtention d’un contrôle tumoral, pourrait se limiter à 6-12 mois, en raison du risque de toxicité à long terme, avec possibilité de réintroduction à progression (De Rycke et al. 2021).
- Après obtention du contrôle de la maladie avec une modalité de traitement, une surveillance attentive seule peut être envisagée (pause thérapeutique). Un traitement de maintenance par analogue de la SST peut être proposé après un traitement d’induction par chimiothérapie ou thérapie ciblée (Lepage et al. 2022) (niveau de recommandation : grade C).
- Les analogues de la SST à des doses augmentées ou à des intervalles réduits, peuvent être utilisés chez les patients progressant après une stabilisation prolongée sous analogues de la SST en première ligne, notamment en cas d’index Ki-67 < 10% (Pavel et al. 2021) (niveau de recommandation : grade C).
- Le statut MGMT peut être déterminé avant de sélectionner un schéma de chimiothérapie car un statut MGMT-proficient (expression forte en immunohistochimie de la O6-méthylguanine-DNA méthyltransférase ou absence de méthylation du promoteur de MGMT) est prédictive d’une moindre efficacité des agents alkylants (streptozotocine, dacarbazine, témozolomide). Sous réserve d’une standardisation des techniques, cette option pourrait devenir une recommandation (Walter et al. 2015, 2023a; Cros et al. 2016; de Mestier et al. 2020b; Kunz et al. 2023) (niveau de recommandation : grade B).
- La chimiothérapie à base d’oxaliplatine (FOLFOX, GEMOX, XELOX) représente une bonne alternative à la chimiothérapie alkylante, notamment en cas de statut MGMT-proficient (Dussol et al. 2015; Al-Toubah et al. 2021; Girot et al. 2022; Lacombe et al. 2023) (niveau de recommandation : grade C). Une attention particulière doit être portée à la toxicité neurologique qui peut être invalidante chez des patients pouvant avoir une survie prolongée, et peut empêcher une réintroduction ultérieure.
- L’association du bévacizumab à la chimiothérapie à base d’alkylants (Ducreux et al. 2014) ou à base d’oxaliplatine (Lacombe et al. 2023) ou à l’évérolimus (Kulke et al. 2022) a donné des résultats prometteurs et pourrait augmenter le taux de réponse tumorale voire la survie sans progression (niveau de recommandation : grade C).
- L’évérolimus peut être utilisé en première ligne, si la chimiothérapie est contre-indiquée et/ou lorsque la réponse objective n'est pas l'objectif thérapeutique principal (Salazar et al. 2022) (niveau de recommandation : grade B). il s’agit d’une option particulièrement intéressante chez les patients ayant un insulinome malin, car l'évérolimus permet fréquemment de contrôler les hypoglycémies (Bernard et al. 2013).
- Le sunitinib peut être utilisé en première ligne si la chimiothérapie est contre-indiquée et/ou lorsque la réponse objective n'est pas l'objectif thérapeutique principal (Raymond et al. 2011).
- La radio-embolisation à l’90Yttrium (ou radiothérapie intra-artérielle hépatique) a montré un taux de réponse objectif de 50% en moyenne (de Mestier et al. 2017b; Su et al. 2017). Bien qu'elle ait été mal comparée à la CEIAH, la radio-embolisation pourrait avoir une efficacité similaire et une meilleure tolérance à court terme, mais a un coût plus élevé (niveau de recommandation: grade C) (Devcic et al. 2014). Elle expose à des risques de lésions post-radiques à long terme (fibrose, hypertension portale voire insuffisance hépatique), surtout lorsque le traitement a ciblé le foie entier (Tomozawa et al. 2018). Elle peut être envisagée chez des patients très sélectionnés, notamment en cas de contre-indication à la CEIAH (cf. supra).
- La chirurgie de réduction tumorale peut être envisagée dans des situations très sélectionnées, notamment chez les patients atteints d'un syndrome fonctionnel mal contrôlé malgré un traitement antisécrétoire optimal, et si le résidu tumoral anticipable consisterait en des lésions infracentimétriques (niveau de recommandation : accord d’experts).
- La transplantation hépatique peut être envisagée en cas de métastases hépatiques diffuses non résécables, non ou très lentement évolutives, avec un Ki-67 bas (<5-10%, non déterminé précisément), en l'absence de métastases extra-hépatiques, si le patient est jeune (<55-60 ans), sans hépatomégalie, chez qui la tumeur primitive a déjà été réséquée et après un recul évolutif suffisant à partir du diagnostic de la maladie métastatique (niveau de recommandation : grade C) (Fan et al. 2015).
ESSAIS CLINIQUES
- BETTER-2 : Essai de phase II randomisée évaluant l’efficacité sur la survie sans progression de l’association capécitabine témozolomide et 5FU - streptozotocine, et de l’adjonction de bévacizumab dans les TNE pancréatiques avancées en 1ère ligne (coordonnateur Pr Michel Ducreux, IGR, Villejuif). https://www.reseau-gte.org/protocole/better-2
- COMPOSE : A prospective, randomised, Controlled, Open-label, Multicentre study to evaluate efficacy, safety and Patient Reported Outcomes of Peptide Receptor Radionuclide Therapy (PRRT) with 177Lu-Edotreotide compared to best Standard of care in patients with well-differentiated aggressive Grade 2 and Grade 3, somatostatin receptor‑positive (SSTR+), neuroendocrine tumours of gastroEnteric or pancreatic origin (coordonnateur pour la France : Pr Thomas Walter, Lyon).
https://www.reseau-gte.org/protocole/compose/ - MK-6482-015-00 : Étude de phase 2 évaluant l'efficacité et la sécurité d'emploi du Belzutifan (MK-6482, anciennement PT2977) en monothérapie chez des patients atteints d’un phéochromocytome/paragangliome (PPGL) avancé ou d’une tumeur neuroendocrine du pancréas (TNEp) (Coordonnateur Dr Julien Hadoux, Villejuif).
https://www.reseau-gte.org/protocole/mk-6482/ - SORENTO : A randomized, multi-center, open-label, active-controlled Phase 3 trial to assess the efficacy and safety of octreotide subcutaneous depot (CAM2029) versus octreotide LAR or lanreotide ATG in patients with gastroenteropancreatic neuroendocrine tumors.
https://www.reseau-gte.org/protocole/camurus/
11.4.3.3.2. TNE de l’intestin grêle (et autres TNE non-duodéno-pancréatiques) associées à des métastases non-résécables
11.4.3.3.2.1. Exérèse de la TNE grêlique primitive en cas de métastases non résécables
REFERENCES
- L’exérèse de la TNE grêlique primitive et des lésions mésentériques associées doit être systématiquement envisagée en cas de symptômes en rapport avec ces lésions (occlusion, ischémie mésentérique, douleur).
- Une cholécystectomie doit être systématiquement réalisée lors de toute chirurgie (en particulier, de chirurgie initiale) chez les patients atteints de TNE de l’intestin grêle métastatique, en raison des risques de lithiase vésiculaire associés aux analogues de la SST et de cholécystite ischémique liée à la CEIAH (Niederle et al. 2016; Brighi et al. 2019).
OPTIONS
- En l’absence de symptômes en rapport avec la TNE grêlique primitive et/ou la masse mésentérique métastatique et si cette masse est résécable, la résection chirurgicale doit systématiquement être discutée en RCP RENATEN en fonction de l'âge et de l’état général du patient, de la résécabilité de la masse mésentérique, du risque de résection intestinale étendue susceptible de conduire à un syndrome de grêle court, de l’étendue de la maladie et du projet thérapeutique. L'impact de cette stratégie sur la survie reste débattu en l’absence d’étude de bon niveau de preuve, même si les études rétrospectives retrouvent un effet bénéfique sur la survie à la résection (Van Den Heede et al. 2022). La résection ayant notamment pour but de limiter le risque de chirurgie en urgence, elle parait donc particulièrement justifiable en cas masse mésentérique jugée “menaçante” (Deguelte et al. 2022b).
11.4.3.3.2.2. Traitement des métastases non-résécables (cf. algorithme 11.8.6.)
REFERENCES
- Traitement de première ligne :
- Chez les patients asymptomatiques, ayant un envahissement hépatique < 50%, un Ki-67 < 10% et pas de progression morphologique :
- Analogues de la SST : lanréotide Autogel 120 mg/28j ou octréotide LP 30 mg/28j (niveau de recommandation : grade A) (Caplin et al. 2014; Rinke et al. 2016).
- Ou surveillance en cas de maladie minime ou non-mesurable et si le risque évolutif est évalué comme faible.
- En cas de progression et/ou de métastases symptomatiques malgré un traitement bien conduit, et/ou d’envahissement hépatique > 50% et/ou de Ki-67 > 10% (et/ou en cas de métastases osseuses significatives) :
- Analogues de la SST en cas d’envahissement hépatique < 50%, de Ki-67 < 10% et de progression lente (niveau de recommandation: grade B) (Modlin et al. 2010; Caplin et al. 2014; Rinke et al. 2016).
- (Chimio)-embolisation intra-artérielle hépatique (CEIAH), si la maladie hépatique est prédominante (niveau de recommandation : grade C) (de Mestier et al. 2017b; Touloupas et al. 2021). En cas de métastases extra-hépatiques (notamment osseuses), la CEIAH n'est pas strictement contre-indiquée. L'indication doit être validée en RCP RENATEN en présence d'un radiologue interventionnel, en raison du risque élevé de morbidité. Pour réduire la morbidité, le volume du foie peut être segmenté en 2-3 zones à traiter successivement avec un délai de 4 à 8 semaines entre chacune. La chimioembolisation ne semblant pas plus efficace que l'embolisation seule pour les métastases de TNE grêliques, cette dernière peut donc être préférée dans ce contexte (Gupta et al. 2005; Maire et al. 2012; de Mestier et al. 2017b). Les contre-indications absolues pour la CEIAH sont l'anastomose ou l'endoprothèse biliaire, la dilatation des voies biliaires et la thrombose portale complète.
- Traitement de seconde ligne (et au-delà) :
- RIV au 177Lu-DOTATATE chez les patients ayant une TNE intestinale métastatique présentant une expression forte et homogène des récepteurs de la SST en TEP/TDM au 68Ga-DOTATOC (fixation tumorale ≥ fixation hépatique) (Strosberg et al. 2017, 2018) (niveau de recommandation : grade A). Les analogues de la SST à longue durée d’action peuvent être poursuivis en concomitant de la RIV, même pour les TNE non fonctionnelles. L’indication de la RIV doit être évaluée au regard des alternatives thérapeutiques en présence de lésions significatives ne fixant pas intensément en TEP/TDM au 68Ga-DOTATOC (Chan et al. 2023).
- Évérolimus (10 mg/j), en particulier en cas de TNE non fonctionnelle, s’il existe une expression faible des récepteurs à la SST, et une maladie extra-hépatique significative (niveau de recommandation : grade A) (Yao et al. 2016b). L’activité antitumorale de l’évérolimus a également été suggérée dans les TNE intestinales fonctionnelles métastatiques (Pavel et al. 2011).
- CEIAH, comme décrit ci-dessus.
OPTIONS
- L’inclusion dans des essais cliniques, ou à défaut l’enregistrement prospectif, doit toujours être encouragé et priorisé.
- Après l’obtention du contrôle de la maladie avec une modalité de traitement, une surveillance attentive seule peut être envisagée (pause thérapeutique).
- La RIV au 177Lu-DOTATATE peut être envisagée en première ligne, chez les patients ayant une TNE grêlique métastatique présentant une expression forte et homogène des récepteurs de la SST en TEP/TDM au 68Ga-DOTATOC (fixation tumorale ≥ fixation hépatique), en cas de volume tumoral très important (en particulier si extra-hépatique) et/ou de symptômes non contrôlés, en association avec les analogues de la SST (Pusceddu et al. 2022).
- Les analogues de la SST à des doses augmentées ou à des intervalles réduits, peuvent être utilisés chez les patients progressant après une stabilisation prolongée sous analogues de la SST en première ligne, notamment en cas d’index Ki-67 < 10% (Strosberg et al. 2017; Pavel et al. 2021) (niveau de recommandation : grade C).
- La chimiothérapie peut être utilisée en cas de contre-indication ou d'échec des autres modalités de traitement, notamment en cas de progression rapide et d'indice Ki-67 élevé, car les TNE de l’intestin grêle (et les autres TNE non duodéno-pancréatiques) ont une chimio-sensibilité très faible (niveau de recommandation: grade C) (Lamarca et al. 2016). Dans une étude randomisée, l’association 5FU-streptozotocine ne prolongeait pas la survie en comparaison à l'interféron (Dahan et al. 2009). Les associations dacarbazine + LV5FU2 et témozolomide + capécitabine peuvent être utilisées (de Mestier et al. 2019b). Les faibles taux de réponse aux agents alkylants peuvent être expliqués par une expression élevée de la MGMT, qui peut être évaluée avant de décider du type de chimiothérapie. Alternativement, un régime à base d'oxaliplatine peut être utilisé.
- Le bévacizumab a montré des résultats prometteurs en association avec la capécitabine (Mitry et al. 2014) (niveau de recommandation : grade C). Cependant, son bénéfice n'a pas été mis en évidence par d'autres études (y compris une phase III en association avec les ASST (Yao et al. 2017) et demande confirmation.
- L'interféron alfa pégylé peut être utilisé en cas de contre-indication ou d'échec des autres traitements, notamment chez les patients atteints d'un syndrome sécrétoire persistant malgré les ASST. Dans une étude de phase III, la combinaison interféron-octréotide permettait d’atteindre une SSP médiane de 15,4 mois (Yao et al. 2017) (niveau de recommandation : grade C). Dans une autre étude de phase III, l'interféron était associé à un bénéfice non significatif en SSP par rapport à la chimiothérapie par 5FU-streptozotocine (14,1 mois contre 5,5 mois) (Dahan et al. 2009). Les formes pégylées recombinantes n'ont pas d'AMM mais sont mieux tolérées que les formes standard et sont les seules formes disponibles en France actuellement.
- La radio-embolisation à l’90Yttrium (ou radiothérapie intra-artérielle hépatique) a montré un taux de réponse objectif de 50% en moyenne (de Mestier et al. 2017b; Su et al. 2017). Bien qu'elle ait été mal comparée à la CEIAH, la radio-embolisation pourrait avoir une efficacité similaire et une meilleure tolérance à court terme, mais a un coût plus élevé (niveau de recommandation: grade C) (Devcic et al. 2014). Elle expose à des risques de lésions post-radiques à long terme (fibrose, hypertension portale voire insuffisance hépatique), surtout lorsque le traitement a ciblé le foie entier (Tomozawa et al. 2018). Elle peut être envisagée chez des patients très sélectionnés, notamment en cas de contre-indication à la CEIAH (cf. supra).
- La chirurgie de réduction tumorale peut être envisagée dans des situations très sélectionnées, notamment chez les patients atteints d'un syndrome fonctionnel mal contrôlé malgré un traitement antisécrétoire optimal, et si le résidu tumoral anticipable consisterait en des lésions infracentimétriques (niveau de recommandation : accord d’experts).
- La transplantation hépatique peut être envisagée en cas de métastases hépatiques diffuses non résécables, non ou très lentement évolutives, avec un Ki-67 bas (<5-10%, non déterminé précisément), en l'absence de métastases extra-hépatiques, si le patient est jeune (<55-60 ans), sans hépatomégalie, chez qui la tumeur primitive a déjà été réséquée et après un recul évolutif suffisant à partir du diagnostic de la maladie métastatique (niveau de recommandation : grade C) (Fan et al. 2015).
ESSAIS CLINIQUES
- COMPOSE : A prospective, randomised, Controlled, Open-label, Multicentre study to evaluate efficacy, safety and Patient Reported Outcomes of Peptide Receptor Radionuclide Therapy (PRRT) with 177Lu-Edotreotide compared to best Standard of care in patients with well-differentiated aggressive Grade 2 and Grade 3, somatostatin receptor‑positive (SSTR+), neuroendocrine tumours of gastroEnteric or pancreatic origin (coordonnateur pour la France : Pr Thomas Walter, Lyon).
https://www.reseau-gte.org/protocole/compose/ - RELUTH : Étude prospective de phase 2 randomisée évaluant les schémas de retraitement par Lutathera® ([177Lu]Lu-DOTA-TATE) chez les patients présentant une nouvelle progression de leur tumeur neuroendocrine intestinale bien différenciée (coordonateur : Dr Emmanuel Deshaye, Montpellier).
https://www.reseau-gte.org/protocole/reluth/ - SORENTO : A randomized, multi-center, open-label, active-controlled Phase 3 trial to assess the efficacy and safety of octreotide subcutaneous depot (CAM2029) versus octreotide LAR or lanreotide ATG in patients with gastroenteropancreatic neuroendocrine tumors.
11.4.3.3.3. Traitement des localisations métastatiques particulières
11.4.3.3.3.1. Métastases osseuses
- Les métastases osseuses peuvent se développer chez environ 20% des patients atteints de TNE digestive métastatique, sont parfois symptomatiques et pourraient être associées à un pronostic péjoratif (Scharf et al. 2018; Garcia-Torralba et al. 2021). L'incidence des métastases osseuses a augmenté avec l'utilisation croissante de modalités d'imagerie très sensibles (TEP/TDM) et en raison du nombre croissant de patients ayant une survie prolongée. Cependant, la découverte de micro-métastases osseuses (mal défini, <5 métastases infracentimétriques non symptomatiques) n’impacte probablement pas le pronostic ; et son impact sur la prise en charge est incertain (Deleval et al. 2021).
- La scintigraphie osseuse n’est pas indiquée dans les NNE.
- La prise en charge des métastases osseuses repose sur :
- la détection en imagerie en privilégiant les modalités les plus sensibles (IRM, TEP/TDM au 68Ga-DOTATOC et à la 18FDOPA) ;
- l’évaluation du caractère ostéo-lytique ou -condensant et du risque de complications osseuses associée ;
- la surveillance par imagerie conventionnelle (IRM de préférence) ;
- la prévention des évènements osseux (compression médullaire, fractures, douleurs intenses, hypercalcémie), chez des patients qui ont une survie prolongée et donc avec un objectif de contrôle local à long terme.
- La prise en charge médicamenteuse préventive implique l’utilisation d’acide zolédronique en intraveineux ou de dénosumab en sous cutané (Coleman et al. 2020). Compte tenu du risque d’effet rebond sous dénosumab et du traitement au long cours prévisible chez les patients atteints de TNE avec métastases, l’acide zolédronique à posologie adaptée à la fonction rénale (une injection toutes les 12 semaines) est recommandé en cas de maladie osseuse majeure à risque de complications et/ou après survenue d’un premier évènement osseux. La durée du traitement est prolongée et non codifiée. Une surveillance du bilan phosphocalcique et de l’état bucco-dentaire est nécessaire pour prévenir le risque d’ostéonécrose de mâchoire (Coleman et al. 2020; Cives et al. 2021). Cet avis dérive des recommandations européennes pour les cancers plus fréquents, sans données spécifiques concernant la balance bénéfices/risques dans les NNE, notamment en cas d’utilisation prolongée.
- Un traitement loco-régional à visée préventive doit être discuté en cas de métastases osseuses jugées à risque, en particulier les techniques de radiologie interventionnelle (ablation percutanée, ostéosynthèse, cimentoplastie) (Delpla et al. 2019) et de radiothérapie en privilégiant les approches stéréotaxiques avec dose ablative permettant un contrôle local prolongé.
- En cas de symptômes (douleur, compression) et/ou dans un contexte de traitement de complications, les traitements suivants peuvent être envisagés : radiothérapie, chirurgie, ablation percutanée (par radiofréquence, cryoablation, etc).
11.4.3.3.3.2. Métastases péritonéales
REFERENCES
- La résection chirurgicale de la carcinose péritonéale doit être envisagée lorsque celle-ci peut être complète, car elle semble alors être associée à un bénéfice de survie (de Mestier et al. 2015d; Benhaim et al. 2021; Wonn et al. 2021; Hajjar et al. 2022) (niveau de recommandation : grade C).
- L'ajout d'une chimiothérapie intrapéritonéale hyperthermique à une cytoréduction chirurgicale macroscopiquement complète ne semble pas être associé à un avantage de survie mais entraîne une morbidité plus élevée (Elias et al. 2014; Hajjar et al. 2022). Il n’est donc pas recommandé hors essai thérapeutique (niveau de recommandation: grade C).
- En cas de carcinose péritonéale diffuse, une résection chirurgicale initialement prévue ne doit pas être réalisée (sauf en situation d’urgence), afin de pouvoir conserver la possibilité ultérieure d'une chirurgie de la carcinose péritonéale dans un centre expert.
11.5. Traitement des CNE (peu différenciés) digestifs
11.5.1. Généralités concernant les CNE digestifs
- Les CNE représentent moins de 5% des NEN digestives. Ils se caractérisent par une morphologie cellulaire peu différenciée, à petites ou grandes cellules, un index Ki-67 > 20% (généralement > 50%), une forte agressivité biologique et sont principalement diagnostiqués à un stade métastatique, avec des symptômes liés à la tumeur fréquents et une altération de l’état général (Sorbye et al. 2023).
- Une fois le diagnostic de CNE posé, l'initiation d'un traitement antitumoral spécifique constitue une urgence oncologique.
11.5.2. Traitement des CNE digestifs non métastatiques
Sauf indication contraire, les recommandations suivantes correspondent à un accord d'experts.
REFERENCES
- Un traitement multimodal est recommandé chaque fois que l’état général du patient le permet.
- Une résection chirurgicale à visée curative (R0) doit toujours être envisagée s'il n'y a pas de métastases à distance après une évaluation morphologique approfondie incluant une IRM hépatique et une TEP/TDM au 18FDG, et si les risques de morbidité et de mortalité sont acceptables compte tenu du risque élevé de récidive (Dasari et al. 2022; Sorbye et al. 2023) (niveau de recommandation : grade C).
- Une chimiothérapie néoadjuvante est recommandée si une résection chirurgicale est envisagée avec une intention curative. Elle permet de programmer la chirurgie et de sélectionner les patients qui ne présentent pas de progression rapide d’emblée (Alese et al. 2019; Pellat et al. 2020; Sorbye et al. 2023). Cette chimiothérapie peut consister en 3-4 cycles d’étoposide-platine (cisplatine ou carboplatine) (niveau de recommandation : grade C).
- Une association à la radiothérapie externe pour les localisations telles que l'œsophage, le duodénum, l'ampoule, la tête du pancréas, le rectum et le canal anal sera discutée systématiquement (Dasari et al. 2022; Sorbye et al. 2023).
- Une chimiothérapie à visée adjuvante est recommandée si une résection chirurgicale a été faite avec une intention curative (Alese et al. 2019; Pellat et al. 2020; Sorbye et al. 2023). Elle peut consister en 3-4 cycles d’étoposide-platine (cisplatine ou carboplatine) (ou 2-3 cycles si une chimiothérapie néoadjuvante a déjà été administrée) (niveau de recommandation : grade C).
- Aucune irradiation cérébrale prophylactique n’est indiquée dans les CNE digestifs.
- Si la chirurgie ne peut pas être envisagée avec une intention curative, est contre-indiquée ou est considérée à haut risque, une chimiothérapie par étoposide-platine est recommandée.
OPTIONS
- La place de la radiothérapie adjuvante ou néoadjuvante en association ou non à la chimiothérapie chez les patients avec CNE digestif résécable n’est pas définie. Elle peut être discutée au cas par cas en RCP, en particulier pour les CNE du rectum (Modrek et al. 2015).
- Une résection chirurgicale secondaire d’un CNE initialement non résécable peut être exceptionnellement possible, bien que son bénéfice de survie ne soit pas démontré.
ESSAI CLINIQUE
- NEONEC (D19-01) : Étude de phase II d’évaluation de l’efficacité et de la tolérance d’une chimiothérapie néoadjuvante dans les CNE digestifs localisés résécables (coordonnateur : Dr Anna Pellat, Paris) https://www.reseau-gte.org/protocole/neonec
11.5.3. Traitement des CNE digestifs métastatiques
Sauf indication contraire, les recommandations suivantes correspondent à un accord d'experts.
REFERENCES
- Traitement de première ligne :
- Le traitement de référence est la chimiothérapie par étoposide - platine (cisplatine ou carboplatine), qui peut donner des taux de réponse d'environ 40-50% associés à une SSP d'environ 6-9 mois et une survie globale médiane d'environ un an (Moertel et al. 1991; Mitry et al. 1999; Sorbye et al. 2013) (niveau de recommandation : grade B).
- L'efficacité de la chimiothérapie doit être évaluée tous les 2-3 cycles, soit toutes les 6 à 8 semaines.
- La chimiothérapie de première ligne doit être administrée jusqu'à un total de 6 mois, puis une pause thérapeutique peut être instaurée chez les patients n’ayant pas progressé. Aucun traitement d'entretien n'est alors recommandé.
- Un rechallenge par étoposide - platine (cisplatine ou carboplatine) peut être proposé si la progression de la tumeur survient après au moins 3 mois de surveillance sans traitement après la fin de la première ligne (pause thérapeutique), et/ou chez les patients ayant présenté une réponse objective initiale (Hadoux et al. 2022).
- Si la progression tumorale survient au cours des 3 premiers mois de pause, une chimiothérapie de deuxième intention doit être envisagée.
- Traitement de deuxième intention (et au-delà) :
- La chimiothérapie par FOLFIRI peut être considérée comme traitement de seconde ligne de référence dans les CNE métastatiques (Hentic et al. 2012; Walter et al. 2017). L’ajout du bévacizumab n’apporte pas de bénéfice de survie (Walter et al. 2023) (niveau de recommandation : grade B).
- L'inclusion dans les essais cliniques doit être envisagée dans la mesure du possible, sinon l'inscription prospective doit être encouragée.
OPTIONS
- Le FOLFOX donne un taux de réponse objective de 21-29% associé à une SSP médiane de 2,5 à 4,5 mois (Hadoux et al. 2015; Walter et al. 2017).
- Des combinaisons à base d’agents alkylants (témozolomide ou dacarbazine) sont envisageables bien que leur efficacité ait été mal étudiée (Couronne et al. 2020).
- Si disponible, l’administration d’une immunothérapie inhibant les checkpoints immunitaires peut être envisagée chez les patients ayant un CNE avancé réfractaire présentant une instabilité des microsatellites et/ou une charge tumorale élevée. Une double immunothérapie (anti-PD-(L)1 + anti-CTLA-4) semble plus efficace qu’une monothérapie (Girard et al. 2021; Capdevila et al. 2023; Sorbye et al. 2023) (niveau de recommandation : grade C).
ESSAI CLINIQUE
- FOLFIRINEC (PRODIGE 69) : Essai de phase II randomisé du FOLFIRINOX versus platine-étoposide en première ligne de traitement des carcinomes neuroendocrines peu différenciés de grade 3 métastatiques gastro-entéro-pancréatiques et de primitif inconnu associé à l'établissement d'un profil moléculaire (Coordonnateur Dr Julien Hadoux, Villejuif).
https://www.reseau-gte.org/protocole/folfiri-nec/
11.6. Surveillance post-thérapeutique
11.6.1. Situations ne nécessitant pas de surveillance
REFERENCES
- La surveillance est inutile lorsque le risque de récidive locale ou à distance est négligeable :
- TNE de l’appendice pour laquelle il n'existe pas d’indication de colectomie complémentaire (section 11.4.2.6) ;
- TNE de l’appendice < 20 mm ayant un index Ki-67 bas (seuil non défini), qui a été traitée par colectomie avec curage complémentaires sans atteinte ganglionnaire à l’examen anatomo-pathologique définitif ;
- TNE rectale G1, < 10 mm réséquée en totalité (R0), sans invasion musculaire (T1a), sans invasion lymphovasculaire, sans ganglion lymphatique suspect section 11.4.2.8).
11.6.2. Surveillance des TNE digestives
Sauf indication contraire, les recommandations suivantes correspondent à un accord d'experts.
11.6.2.1. Surveillance des TNE digestives non métastatiques
- L’objectif essentiel de la surveillance est de pouvoir proposer un traitement efficace (idéalement curatif) en cas de récidive.
- Dans la mesure où une récidive métastatique peut survenir très tardivement, les patients doivent être informés de la nécessité d'une surveillance prolongée (au moins 20 ans, voire à vie), bien que les intervalles de surveillance soient progressivement allongés.
- Le suivi est clinique, biologique et radiologique (imagerie en coupe). Il peut être endoscopique selon le siège de la tumeur primitive.
REFERENCES
- Pour les TNE qui ont été opérées par chirurgie à visée curative : l'imagerie morphologique et la technique d'imagerie nucléaire initialement positive doivent être réalisées après 3-6 mois (bilan post-opératoire évaluant s’il reste des lésions), puis l'imagerie morphologique doit être réalisée tous les 6-12 mois pendant 5 ans, puis tous les 12-24 mois pendant 15 ans puis tous les 5 ans.
- La scanographie et l'IRM avec des séquences de diffusion (idéalement avec agents de contraste hépato-spécifiques) sont les modalités de surveillance de référence. L'IRM abdominale étant non irradiante et plus sensible pour la détection des petites métastases hépatiques, elle peut être utilisée en alternance avec la scanographie thoraco-abdominale-pelvienne, qui évalue de manière plus appropriée les lésions extra-hépatiques.
- En cas de syndrome héréditaire, une surveillance spécifique appropriée est nécessaire.
- Une imagerie nucléaire (TEP/TDM au 68Ga-DOTATOC ou à la 18FDOPA) doit être réalisée en cas de doute sur une éventuelle récidive. En revanche, l’intérêt de la réalisation d'une imagerie nucléaire régulière, si elle était initialement positive, n'a pas été démontrée, bien qu’elle soit suggérée par l’ENETS pour les TNE bien différenciées (Knigge et al. 2017). La TEP au 18FDG n’a pas sa place dans le suivi des TNE bien différenciées.
- Ces propositions de surveillance, notamment l'intervalle des examens, doivent être modulées en fonction des facteurs pronostiques, notamment la localisation tumorale primitive, le grade tumoral, la taille et le stade, le caractère complet de la résection, l'espérance de vie prévisible, les modalités de la prise en charge chirurgicale initiale, etc. L’idéal est de faire préciser les modalités de surveillance en RCP RENATEN.
- Cas particuliers :
- TNE gastriques de type 1 : endoscopie gastrique annuelle jusqu'à obtention de la résection des lésions > 10 mm (il restera toujours quelques lésions millimétriques) puis tous les 2-3 ans. La réalisation systématique de biopsies fundiques multiples en muqueuse non polypoïde est recommandée pour assurer le dépistage de la dysplasie exocrine (Panzuto et al. 2023).
- Petites TNE pancréatiques surveillées : IRM annuelle.
- TNE appendiculaire opérée, N1 ou N0 mais avec facteurs de haut risque (taille > 20 mm, G2 haut ou G3) : imagerie abdominale (scanner ou IRM) annuelle (Kaltsas et al. 2023).
- TNE rectale réséquée mais facteur(s) de risque (R1, > 15 mm, invasion lymphovasculaire ou G2) : recto-sigmoïdoscopie annuelle, associée à une EE (notamment si R1) ou une IRM pelvienne et hépatique annuelle, pendant au moins 5 ans (Rinke et al. 2023).
OPTIONS
- Aucun marqueur biologique n'a été validé pour la surveillance des TNE. Il est néanmoins recommandé par l’ENETS de mesurer la concentration plasmatique de la chromogranine A (si elle était initialement élevée en l’absence d’élévation de la gastrinémie) et des autres biomarqueurs initialement anormaux, en étant vigilant vis-à-vis des situations de fausse positivité (notamment IPP, insuffisance rénale pour la chromogranine A). Le même kit de test doit être utilisé tout au long du suivi.
11.6.2.2. Surveillance des TNE digestives métastatiques
REFERENCES
Les propositions de surveillance indiquées ci-dessous, notamment l'intervalle des examens, doivent être modulées en fonction des facteurs pronostiques, notamment l’organe d’origine de la tumeur primitive, le grade tumoral, le caractère complet ou non de l’éventuelle résection des métastases, le degré d’envahissement hépatique, l’état général, la perte de poids ou l’aggravation clinique, l'espérance de vie prévisible, etc. L’idéal est de faire préciser les modalités de surveillance par la RCP RENATEN.
- Chez les patients ayant eu une résection chirurgicale de toutes les métastases visibles, une IRM avec séquences de diffusion et idéalement injection d’agents de contraste hépato-spécifiques (ou une scanographie) doit être réalisée à 3 mois puis tous les 3 à 6 mois, ou à des intervalles raccourcis en cas de suspicion clinique et/ou biologique de récidive tumorale. L'imagerie nucléaire initialement positive doit être réalisée dans les 6 à 12 premiers mois, puis en cas de suspicion de récidive tumorale.
- Chez les patients présentant des métastases hépatiques non réséquées, l'imagerie doit être réalisée à 3 mois puis tous les 3-6 mois si la maladie est stable (avec possible allongement de l'intervalle à 6-12 mois).
- L'évaluation de l'évolution tumorale repose sur les critères RECIST 1.1 (Eisenhauer et al. 2009). Elle doit être évaluée en comparant des examens d'imagerie de modalité identique (par exemple, scanographie ou IRM avec le même protocole, notamment d’injection).
- La réponse tumorale à un traitement est évaluée en comparant un examen d'imagerie à celui réalisé initialement (début du traitement +/- 1 mois). Les critères de réponse selon RECIST 1.1 (diminution d’au moins 30% de la somme des diamètres de 2 lésions cibles par organe) sont peu adaptés aux TNE et des critères alternatifs ont été récemment proposés (diminution d’au moins 10% de la somme des diamètres de 3 lésions cibles par organe) (de Mestier et al. 2023).
- La progression tumorale est évaluée en comparant un examen d'imagerie à celui correspondant à la meilleure réponse (nadir). Parce que les TNE ont une croissance souvent lente, la progression tumorale doit parfois être évaluée sur de longues périodes. La masse mésentérique associée aux TNE de l'intestin grêle est principalement fibreuse et ne doit pas être considérée comme une lésion cible.
- La meilleure modalité d'imagerie doit être choisie au cas par cas, en fonction de sa capacité à visualiser et mesurer les lésions cibles. L'IRM offre une meilleure reproductibilité des mesures des métastases hépatiques que la scanographie.
- Une échocardiographie de dépistage/suivi de la cardiopathie carcinoïde doit être réalisée régulièrement (Bhattacharyya et al. 2011; Grozinsky-Glasberg et al. 2022; Delhomme et al. 2023) :
- Tous les 3-6 mois en cas de cardiopathie carcinoïde avérée et/ou en cas de NT-proBNP élevé ;
- Tous les 6-12 mois en présence d’un syndrome carcinoïde ou d’un taux de 5HIAA élevé ;
- Tous les 12-24 mois en cas de TNE de l’intestin grêle non fonctionnelle associée à des métastases hépatiques.
- Les effets secondaires iatrogènes tardifs doivent être dépistés, notamment l'insuffisance rénale (streptozotocine ou RIV), l'insuffisance cardiaque après certains traitements (sunitinib, doxorubicine) et l'atteinte de la moelle osseuse (RIV, agents alkylants).
OPTIONS
- La concentration plasmatique de la chromogranine A (si initialement élevée sans élévation de la gastrinémie) et des autres biomarqueurs initialement anormaux peut être mesurée au même rythme que le suivi clinique et morphologique, bien que le bénéfice de cette attitude n’ait jamais été démontré. Le même kit de test doit être utilisé tout au long du suivi. Une augmentation isolée des marqueurs biologiques n'est pas une indication à changer le traitement s'il n'y a aucun signe de progression mais peut suggérer de raccourcir les intervalles de surveillance.
- La valeur de la réalisation d'une imagerie nucléaire régulière (TEP/TDM au 68Ga-DOTATOC ou à la 18FDOPA), si elle était initialement positive, n'a pas été démontrée. Bien qu’elle soit suggérée par l’ENETS tous les 1-2 ans pour les TNE bien différenciées (Knigge et al. 2017), sa réalisation systématique n'est pas une recommandation consensuelle.
11.6.3. Surveillance des CNE digestifs
11.6.3.1. Surveillance des CNE digestifs non métastatiques
REFERENCES
- Chez les patients traités pour CNE digestif non métastatique à visée curative, une imagerie morphologique (TDM) doit être réalisée tous les 2 mois pendant 6 mois puis tous les 3 mois pendant 1 an puis tous les 6 mois pendant 5 ans.
OPTIONS
- La valeur de la TEP au 18FDG pour la surveillance des CNE non métastatiques n'a pas été démontrée ; son indication doit être décidée au cas par cas.
11.5.3.2. Surveillance des CNE digestifs métastatiques
REFERENCES
- Chez les patients traités pour un CNE métastatique, le suivi doit être effectué à intervalles courts (2 mois).
- La modalité d'imagerie de référence est la scanographie thoraco-abdomino-pelvienne.
OPTIONS
- L’intérêt de la TEP au 18FDG pour la surveillance des CNE métastatiques n'a pas été démontré.
11.7. Résumé des principaux protocoles de chimiothérapie utilisés dans les NNE métastatiques
Capécitabine + bévacizumab (Mitry et al. 2014)
- Capécitabine per os 1000 mg/m² deux fois par jour, J1-J14
- Bévacizumab 7,5 mg/m² sur 30 min dans 250 ml de G5%, J1
- Tous les 21 jours
Dacarbazine + LV5FU2 simplifié sur 2 jours (de Mestier et al. 2019b)
- Dacarbazine 400 mg/m² sur 2h dans 500 ml de NaCl 0,9%, J1-J2
- Puis acide folinique 400 mg/m² sur 30 min dans 250 ml de NaCl 0,9%, J1-J2
- Puis 5FU 400 mg/m² sur 10 min dans 100 ml de NaCl 0,9%, J1-J2
- Puis 5FU 1200 mg/m² en continu sur 22h dans du G5%, dans un diffuseur portable, une pompe portable ou une seringue électrique, J1-J2
- Tous les 21 jours
Alternative : Dacarbazine + LV5FU2 simplifié en un jour
- Dacarbazine 800 mg/m² sur 2h dans 1000 ml de NaCl 0,9%, J1
- Puis acide folinique 400 mg/m² sur 30 min dans 250 ml de NaCl 0,9%, J1
- Puis 5FU 400 mg/m² sur 10 min dans 100 ml de NaCl 0,9%, J1
- Puis 5FU 2400 mg/m² en continu sur 47h dans du G5%, dans un diffuseur portable, une pompe portable ou une seringue électrique, J1 à J3
- Tous les 21 jours
Étoposide (VP16) + carboplatine
- Carboplatine AUCx5 (Calvert) sur 1h dans 500 ml de G5%, J1
- Étoposide 100 mg/m² sur 2h dans 500 ml de NaCl 9%, J1-J3
- Tous les 21 jours
Étoposide (VP16) + cisplatine (Mitry et al. 1999)
- Cisplatine 100 mg/m² sur 2h dans 250 ml de NaCl 9%, J1
- Étoposide 100 mg/m² sur 2h dans 250 ml de G5%, J1-J3
- Tous les 21 jours
FOLFIRI (Brixi-Benmansour et al. 2011)
- Irinotécan 180 mg/m² sur 1h30 min dans 250 ml de NaCl 0,9%, J1
- + acide folinique 400 mg/m² sur 2h min dans 250 ml de NaCl 0,9%, J1
- Puis 5FU 400 mg/m² sur 10 min dans 100 ml de NaCl 0,9%, J1
- Puis 5FU 2400 mg/m² en continu sur 47h dans du G5%, dans un diffuseur portable, une pompe portable ou une seringue électrique, J1 à J3
- Tous les 14 jours
FOLFOX 4 ± bévacizumab (Lacombe et al. 2023)
- ± bévacizumab 5 mg/kg sur 1h30 dans 100 ml de NaCl 0,9%, J1
- Oxaliplatine 85 mg/m² sur 2 h dans 250 ml de G5%, J1
- + acide folinique 400 mg/m² sur 2h min dans 250 ml de NaCl 0,9%, J1
- Puis 5FU 400 mg/m² sur 10 min dans 100 ml de NaCl 0,9%, J1
- Puis 5FU 2400 mg/m² en continu sur 47h dans du G5%, dans un diffuseur portable, une pompe portable ou une seringue électrique, J1 à J3
- Tous les 14 jours
GEMOX (Dussol et al. 2015)
- Gemcitabine 1000 mg/m² sur 1h40 dans 250 ml de NaCl 9%, J1
- Oxaliplatine 100 mg/m² (alternative 85 mg/m2) sur 2h dans 250 ml de G5%, J2 ou J1
- Tous les 14 jours
Interféron pégylé alfa-2a recombinant
- Pegasys® 90-180 µg SC une fois par semaine (Pavel et al. 2006)
Streptozocine + LV5FU2 simplifié ± bévacizumab (BETTER 2 ; https://www.reseau-gte.org/protocole/better-2)
- ± bévacizumab 5 mg/kg sur 1h30 dans 100 ml de NaCl 0,9%, J1
- Streptozocine 800 mg/m² sur 1h dans 500 ml de NaCl 9%, J1
- + 1000 ml de NaCl 0,9% sur 2h30, J1
- Puis acide folinique 400 mg/m² sur 2h min dans 250 ml de NaCl 0,9%, J1
- Puis 5FU 400 mg/m² sur 10 min dans 100 ml de NaCl 0,9%, J1
- Puis 5FU 2400 mg/m² en continu sur 47h dans du G5%, dans un diffuseur portable, une pompe portable ou une seringue électrique, J1 à J3
- Tous les 14 jours
Témozolomide ± capécitabine (de Mestier et al. 2019b)
- Capécitabine 750 mg/m² per os, deux fois par jour, J1-J14
- Témozolomide 150 mg/m² per os, (augmenter à 200 mg/m2 à partir de C2 si bonne tolérance), J10-J14 (à l’heure du coucher) (ou J1-J5 si monothérapie)
- Tous les 28 jours
XELOX (Bajetta et al. 2007)
- Oxaliplatine 130 mg/m² sur 2h dans 500 ml de G5%, J1
- Capécitabine 1000 mg/m², deux fois par jour, J2-J15
- Tous les 21 jours
Chimioembolisation intra-artérielle hépatique (de Mestier et al. 2017b)
- Contre-indications : thrombose portale, insuffisance hépatocellulaire sévère, ictère obstructif, anastomose bilio-digestive (notamment après duodéno-pancréatectomie céphalique), sphinctérotomie, anastomose ou prothèse biliaire, dilatation des voies biliaires, destruction par radiofréquence préalable.
- Habituellement, tous les 8 à 12 semaines jusqu’à stabilisation
- Principaux produits de chimiothérapie :
- Adriamycine (50 mg/m²)
- Streptozotocine (1500 mg/m²), sous anesthésie générale
- Le volume hépatique à traiter devrait être segmenté en 2-3 temps, à traiter successivement avec un délai de 4-8 semaines entre chaque temps, dans le but de réduire l’incidence et la sévérité des effets secondaires, notamment en cas d’envahissement hépatique > 50%.
- En cas de syndrome carcinoïde, la survenue d’une crise carcinoïde doit être prévenue par l’administration d’octréotide à la seringue électrique à démarrer plusieurs heures avant la procédure.
11.8. Algorithmes de prise en charge
11.8.1. Algorithme de prise en charge locale des TNE GASTRIQUEs non métastatiques

11.8.2. Algorithme de prise en charge locale des TNE duodénales ou ampullaires non métastatiques
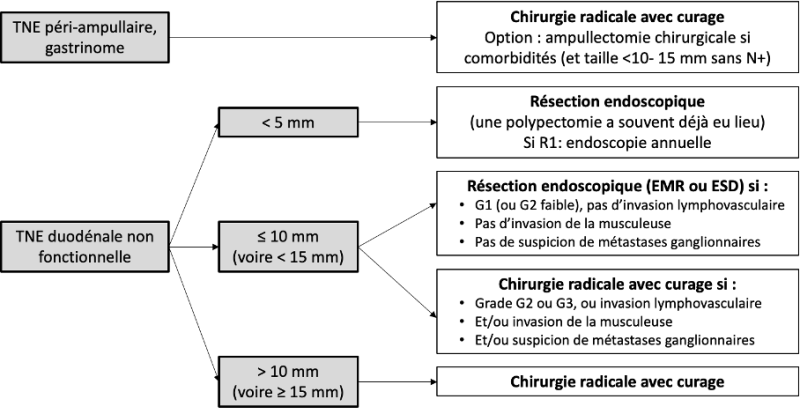
11.8.3. Algorithme de prise en charge des TNE de l’appendice non métastatiques

11.8.4. Algorithme de prise en charge locale des TNE rectales non métastatiques
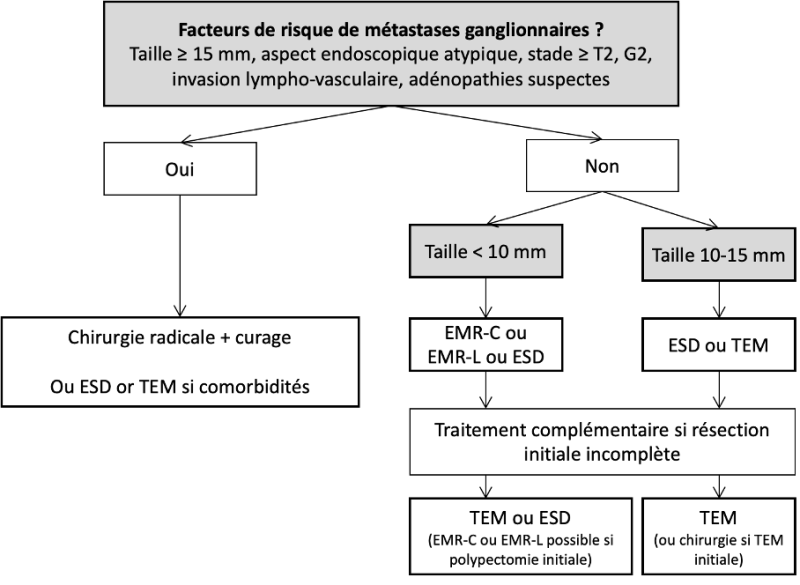
EMR-L, mucosectomie avec ligature ; TEM, microchirurgie endoscopique transanale
11.8.5. Algorithme de prise en charge des NNE digestives métastatiques
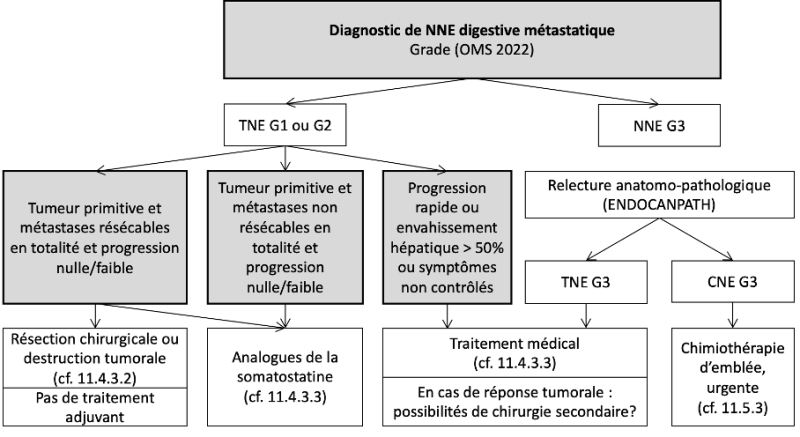
TNE, tumeur neuroendocrine (bien différenciée)
11.8.6. Algorithme de prise en charge des TNE digestives métastatiques non résécables
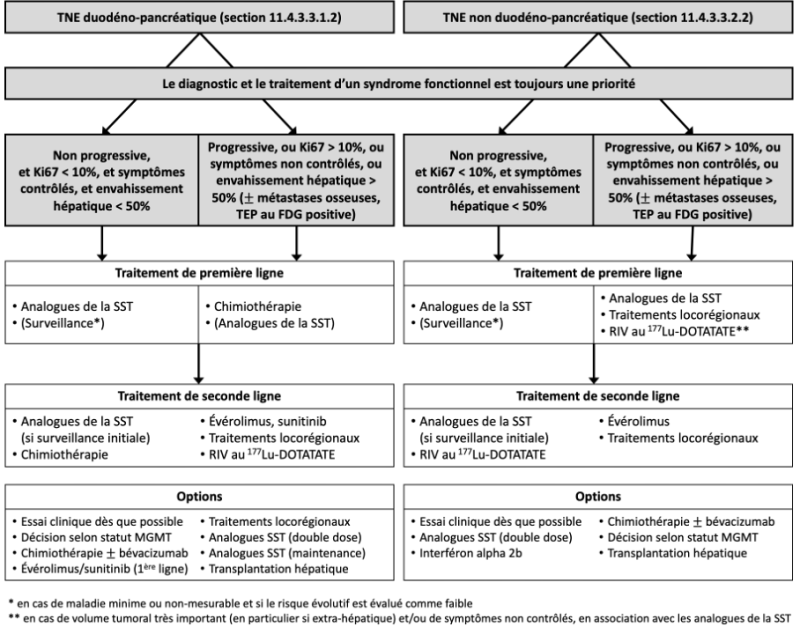
RIV, radiothérapie interne vectorisée ; SST, somatostatine ; TEP, tomographie par émission de positons
11.9. Bibliographie
- Alese OB, Jiang R, Shaib W, Wu C, Akce M, Behera M & El-Rayes BF 2019 High-Grade Gastrointestinal Neuroendocrine Carcinoma Management and Outcomes: A National Cancer Database Study. The Oncologist 24 911–920. (doi:10.1634/theoncologist.2018-0382)
- Alexandraki KI, Kaltsas G, Grozinsky-Glasberg S, Oleinikov K, Kos-Kudła B, Kogut A, Srirajaskanthan R, Pizanias M, Poulia K-A, Ferreira C et al. 2020 The effect of prophylactic surgery in survival and HRQoL in appendiceal NEN. Endocrine 70 178–186. (doi:10.1007/s12020-020-02356-8)
- Al-Salameh A, Cadiot G, Calender A, Goudet P & Chanson P 2021 Clinical aspects of multiple endocrine neoplasia type 1. Nature Reviews Endocrinology 17 207–224. (doi:10.1038/s41574-021-00468-3)
- Al-Toubah T, Morse B, Pelle E & Strosberg J 2021 Efficacy of FOLFOX in Patients with Aggressive Pancreatic Neuroendocrine Tumors After Prior Capecitabine/Temozolomide. The Oncologist 26 115–119. (doi:10.1002/onco.13611)
- Ansquer C, Touchefeu Y, Faivre-Chauvet A, Leux C, Le Bras M, Régenet N, Fleury V, Maucherat B, Senellart H, Guyetant S et al. 2021 Head-to-Head Comparison of 18F-DOPA PET/CT and 68Ga-DOTANOC PET/CT in Patients With Midgut Neuroendocrine Tumors. Clinical Nuclear Medicine 46 181–186. (doi:10.1097/RLU.0000000000003450)
- Antwi K, Fani M, Heye T, Nicolas G, Rottenburger C, Kaul F, Merkle E, Zech CJ, Boll D, Vogt DR et al. 2018 Comparison of glucagon-like peptide-1 receptor (GLP-1R) PET/CT, SPECT/CT and 3T MRI for the localisation of occult insulinomas: evaluation of diagnostic accuracy in a prospective crossover imaging study. European Journal of Nuclear Medicine and Molecular Imaging 45 2318–2327. (doi:10.1007/s00259-018-4101-5)
- d’Assignies G, Fina P, Bruno O, Vullierme MP, Paradis V, Sauvanet A, Ruszniewski P & Vilgrain V 2013 High sensitivity of diffusion-weighted MRI for the detection of liver metastases from neuroendocrine tumors compared with T2-weighted and dynamic gadolinium-enhanced MRI, using histological findings as a standard of reference. Radiology 268 390–399. (doi:10.1148/radiol.13121628)
- Bahri H, Laurence L, Edeline J, Leghzali H, Devillers A, Raoul J-L, Cuggia M, Mesbah H, Clement B, Boucher E et al. 2014 High prognostic value of 18F-FDG PET for metastatic gastroenteropancreatic neuroendocrine tumors: a long-term evaluation. Journal of Nuclear Medicine 55 1786–1790. (doi:10.2967/jnumed.114.144386)
- Bajetta E, Zilembo N, Di Bartolomeo M, Di Leo A, Pilotti S, Bochicchio AM, Castellani R, Buzzoni R, Celio L & Dogliotti L 1993 Treatment of metastatic carcinoids and other neuroendocrine tumors with recombinant interferon-alpha-2a. A study by the Italian Trials in Medical Oncology Group. Cancer 72 3099–3105. (doi:10.1002/1097-0142(19931115)72:10<3099::aid-cncr2820721035>3.0.co;2-4)
- Bajetta E, Catena L, Procopio G, De Dosso S, Bichisao E, Ferrari L, Martinetti A, Platania M, Verzoni E, Formisano B et al. 2007 Are capecitabine and oxaliplatin (XELOX) suitable treatments for progressing low-grade and high-grade neuroendocrine tumours? Cancer Chemotherapy and Pharmacology 59 637–642. (doi:10.1007/s00280-006-0306-6)
- Bangla VG, Wolin EM, Kim MK & Divino CM 2022 Resection Prolongs Overall Survival for Nonmetastatic Midgut Small Bowel Neuroendocrine Tumors: A National Cancer Data Base Study. Pancreas 51 171–176. (doi:10.1097/MPA.0000000000001982)
- Barthet M, Giovannini M, Lesavre N, Boustiere C, Napoleon B, Koch S, Gasmi M, Vanbiervliet G & Gonzalez J-M 2019 Endoscopic ultrasound-guided radiofrequency ablation for pancreatic neuroendocrine tumors and pancreatic cystic neoplasms: a prospective multicenter study. Endoscopy 51 836–842. (doi:10.1055/a-0824-7067)
- Baudin E, Caron P, Lombard-Bohas C, Tabarin A, Mitry E, Reznick Y, Taieb D, Pattou F, Goudet P, Vezzosi D et al. 2013 Malignant insulinoma: recommendations for characterisation and treatment. Annales D’endocrinologie 74 523–533. (doi:10.1016/j.ando.2013.07.001)
- Baudin E, Walter T, Beron A, Smith D, Hadoux J, Lachachi C, Taieb D, Ansquer C, Dierickx L, de Mestier L et al. 2022 First multicentric randomized phase II trial investigating the antitumor efficacy of peptide receptor radionucleide therapy with 177Lutetium-Octreotate (OCLU) in unresectable progressive neuroendocrine pancreatic tumor: Results of the OCLURANDOM trial (887O). Annals of Oncology 33 S410–S416.
- Benhaim L, Faron M, Hadoux J, Gelli M, Sourrouille I, Burtin P, Honoré C, Malka D, Leboulleux S, Ducreux M et al. 2021 Long-Term Results after Surgical Resection of Peritoneal Metastasis from Neuroendocrine Tumors. Neuroendocrinology 111 599–608. (doi:10.1159/000509220)
- Bernard V, Lombard-Bohas C, Taquet M-C, Caroli-Bosc F-X, Ruszniewski P, Niccoli P, Guimbaud R, Chougnet CN, Goichot B, Rohmer V et al. 2013 Efficacy of everolimus in patients with metastatic insulinoma and refractory hypoglycemia. European Journal of Endocrinology 168 665–674. (doi:10.1530/EJE-12-1101)
- Bhattacharyya S, Toumpanakis C, Chilkunda D, Caplin ME & Davar J 2011 Risk Factors for the Development and Progression of Carcinoid Heart Disease. The American Journal of Cardiology 107 1221–1226. (doi:10.1016/j.amjcard.2010.12.025)
- Bierley J, Gospodarowicz MK, Wittekind C, & International Union against Cancer 2017 TNM Classification of Malignant Tumours. Oxford, UK ; Hoboken, NJ: Wiley-Blackwell.
- Binderup T, Knigge U, Johnbeck CB, Loft A, Berthelsen AK, Oturai P, Mortensen J, Federspiel B, Langer SW & Kjaer A 2021 18F-FDG PET is Superior to WHO Grading as a Prognostic Tool in Neuroendocrine Neoplasms and Useful in Guiding PRRT: A Prospective 10-Year Follow-up Study. Journal of Nuclear Medicine 62 808–815. (doi:10.2967/jnumed.120.244798)
- Brabander T, van der Zwan WA, Teunissen JJM, Kam BLR, Feelders RA, de Herder WW, van Eijck CHJ, Franssen GJH, Krenning EP & Kwekkeboom DJ 2017 Long-Term Efficacy, Survival, and Safety of [177Lu-DOTA0,Tyr3]octreotate in Patients with Gastroenteropancreatic and Bronchial Neuroendocrine Tumors. Clinical Cancer Research 23 4617–4624. (doi:10.1158/1078-0432.CCR-16-2743)
- Brighi N, La Rosa S, Rossi G, Grillo F, Pusceddu S, Rinzivillo M, Spada F, Tafuto S, Massironi S, Faggiano A et al. 2018 Morphological Factors Related to Nodal Metastases in Neuroendocrine Tumors of the Appendix: A Multicentric Retrospective Study. Annals of Surgery. (doi:10.1097/SLA.0000000000002939)
- Brighi N, Lamberti G, Maggio I, Manuzzi L, Ricci C, Casadei R, Santini D, Mosconi C, Lisotti A, Ambrosini V et al. 2019 Biliary stone disease in patients receiving somatostatin analogs for neuroendocrine neoplasms. A retrospective observational study. Digestive and Liver Disease 51 689–694. (doi:10.1016/j.dld.2018.09.013)
- Brixi-Benmansour H, Jouve J-L, Mitry E, Bonnetain F, Landi B, Hentic O, Bedenne L & Cadiot G 2011 Phase II study of first-line FOLFIRI for progressive metastatic well-differentiated pancreatic endocrine carcinoma. Digestive and Liver Disease 43 912–916. (doi:10.1016/j.dld.2011.07.001)
- Brugel M, Walter T, Goichot B, Smith D, Lepage C, Do Cao C, Hautefeuille V, Rebours V, Cadiot G, de Mestier L et al. 2021 Efficacy of treatments for VIPoma: A GTE multicentric series. Pancreatology 21 1531–1539. (doi:10.1016/j.pan.2021.08.001)
- Capdevila J, Hernando J, Teule A, Lopez C, Garcia-Carbonero R, Benavent M, Custodio A, Garcia-Alvarez A, Cubillo A, Alonso V et al. 2023 Durvalumab plus tremelimumab for the treatment of advanced neuroendocrine neoplasms of gastroenteropancreatic and lung origin. Nature Communications 14 2973. (doi:10.1038/s41467-023-38611-5)
- Caplin ME, Pavel M, Cwikła JB, Phan AT, Raderer M, Sedláčková E, Cadiot G, Wolin EM, Capdevila J, Wall L et al. 2014 Lanreotide in metastatic enteropancreatic neuroendocrine tumors. The New England Journal of Medicine 371 224–233. (doi:10.1056/NEJMoa1316158)
- Chan DL, Hayes AR, Karfis I, Conner A, Furtado O’Mahony L, Mileva M, Bernard E, Roach P, Marin G, Pavlakis N et al. 2023 Dual [68Ga]DOTATATE and [18F]FDG PET/CT in patients with metastatic gastroenteropancreatic neuroendocrine neoplasms: a multicentre validation of the NETPET score. British Journal of Cancer 128 549–555. (doi:10.1038/s41416-022-02061-5)
- Chatzipanagiotou O, Schizas D, Vailas M, Tsoli M, Sakarellos P, Sotiropoulou M, Papalambros A & Felekouras E 2023 All you need to know about gastrinoma today | Gastrinoma and Zollinger-Ellison syndrome: A thorough update. Journal of Neuroendocrinology 35 e13267. (doi:10.1111/jne.13267)
- Chen T, Yao L-Q, Xu M-D, Zhang Y-Q, Chen W-F, Shi Q, Cai S-L, Chen Y-Y, Xie Y-H, Ji Y et al. 2016 Efficacy and Safety of Endoscopic Submucosal Dissection for Colorectal Carcinoids. Clinical Gastroenterology and Hepatology 14 575–581. (doi:10.1016/j.cgh.2015.07.048)
- Chen L, Song Y, Zhang Y, Chen M & Chen J 2018 Exploration of the Exact Prognostic Significance of Lymphatic Metastasis in Jejunoileal Neuroendocrine Tumors. Annals of Surgical Oncology 25 2067–2074. (doi:10.1245/s10434-018-6511-9)
- Cives M, Pellè E, Rinzivillo M, Prosperi D, Tucci M, Silvestris F & Panzuto F 2021 Bone Metastases in Neuroendocrine Tumors: Molecular Pathogenesis and Implications in Clinical Practice. Neuroendocrinology 111 207–216. (doi:10.1159/000508633)
- Clewemar Antonodimitrakis P, Sundin A, Wassberg C, Granberg D, Skogseid B & Eriksson B 2016 Streptozocin and 5-Fluorouracil for the Treatment of Pancreatic Neuroendocrine Tumors: Efficacy, Prognostic Factors and Toxicity. Neuroendocrinology 103 345–353. (doi:10.1159/000439086)
- Coleman R, Hadji P, Body J-J, Santini D, Chow E, Terpos E, Oudard S, Bruland Ø, Flamen P, Kurth A et al. 2020 Bone health in cancer: ESMO Clinical Practice Guidelines. Annals of Oncology 31 1650–1663. (doi:10.1016/j.annonc.2020.07.019)
- Couronne T, Girot P, Hadoux J, Lecomte T, Durand A, Fine C, Vandevoorde K, Lombard-Bohas C & Walter T 2020 Post first-line dacarbazine or temozolomide in neuroendocrine carcinoma. Endocrine Connections 9 498–505. (doi:10.1530/EC-20-0192)
- Crinò SF, Napoleon B, Facciorusso A, Lakhtakia S, Borbath I, Caillol F, Do-Cong Pham K, Rizzatti G, Forti E, Palazzo L et al. 2023 Endoscopic Ultrasound-guided Radiofrequency Ablation Versus Surgical Resection for Treatment of Pancreatic Insulinoma. Clinical Gastroenterology and Hepatology S1542-3565(23)00165-9. (doi:10.1016/j.cgh.2023.02.022)
- Crippa S, Partelli S, Zamboni G, Scarpa A, Tamburrino D, Bassi C, Pederzoli P & Falconi M 2014 Incidental diagnosis as prognostic factor in different tumor stages of nonfunctioning pancreatic endocrine tumors. Surgery 155 145–153. (doi:10.1016/j.surg.2013.08.002)
- Cros J, Hentic O, Rebours V, Zappa M, Gille N, Theou-Anton N, Vernerey D, Maire F, Lévy P, Bedossa P et al. 2016 MGMT expression predicts response to temozolomide in pancreatic neuroendocrine tumors. Endocrine-Related Cancer 23 625–633. (doi:10.1530/ERC-16-0117)
- Dahan L, Bonnetain F, Rougier P, Raoul J-L, Gamelin E, Etienne P-L, Cadiot G, Mitry E, Smith D, Cvitkovic F et al. 2009 Phase III trial of chemotherapy using 5-fluorouracil and streptozotocin compared with interferon alpha for advanced carcinoid tumors: FNCLCC-FFCD 9710. Endocrine-Related Cancer 16 1351–1361. (doi:10.1677/ERC-09-0104)
- Dasari A, Shen C, Devabhaktuni A, Nighot R & Sorbye H 2022 Survival According to Primary Tumor Location, Stage, and Treatment Patterns in Locoregional Gastroenteropancreatic High-grade Neuroendocrine Carcinomas. The Oncologist 27 299–306. (doi:10.1093/oncolo/oyab039)
- Daskalakis K, Wedin M, Tsoli M, Kogut A, Srirajaskanthan R, Sarras K, Kattiparambil S, Giovos G, Weickert MO, Kos-Kudla B et al. 2022 Association of lymph node metastases, grade and extent of mesenteric lymph node dissection in locoregional small intestinal neuroendocrine tumors with recurrence-free survival. Journal of Neuroendocrinology 34 e13205. (doi:10.1111/jne.13205)
- De Dosso S, Treglia G, Pascale M, Tamburello A, Santhanam P, Kroiss AS, Pereira Mestre R, Saletti P & Giovanella L 2019 Detection rate of unknown primary tumour by using somatostatin receptor PET/CT in patients with metastatic neuroendocrine tumours: a meta-analysis. Endocrine 64 456–468. (doi:10.1007/s12020-019-01934-9)
- De Rycke O, Walter T, Perrier M, Hentic O, Lombard-Bohas C, Coriat R, Cadiot G, Couvelard A, Ruszniewski P, Cros J et al. 2021 Alkylating agent rechallenge in metastatic pancreatic neuroendocrine tumors. Endocrine-Related Cancer 28 457–466. (doi:10.1530/ERC-21-0034)
- Deguelte S, Hammoutene C, Poncet G, Brunaud L, Perrier M, Kianmanesh R & Cadiot G 2022a Concept of reintervention with thorough lymphadenectomy after suboptimal resection of small-intestine neuroendocrine neoplasms: A multicentre preliminary study. Journal of Neuroendocrinology 34 e13117. (doi:10.1111/jne.13117)
- Deguelte S, Metoudi A, Rhaiem R, Hoeffel C, Brixi H, Cadiot G & Kianmanesh R 2022b Small Intestinal Neuroendocrine Neoplasm: Factors Associated with the Development of Local Tumor-Related Symptoms. Neuroendocrinology 112 252–262. (doi:10.1159/000516514)
- Deleval N, Pesque L, Dieudonné A, Viry F, Hentic O, Lebtahi R, Ruszniewski P & de Mestier L 2021 Prognostic impact of bone metastases detected by 18F-DOPA PET in patients with metastatic midgut neuroendocrine tumors. European Radiology 31 4166–4174. (doi:10.1007/s00330-020-07554-6)
- Delhomme C, Walter T, Arangalage D, Suc G, Hentic O, Cachier A, Alkhoder S, François L, Lombard-Bohas C, Iung B et al. 2023 Carcinoid heart disease in patients with midgut neuroendocrine tumours. Journal of Neuroendocrinology 35 e13262. (doi:10.1111/jne.13262)
- Delle Fave G, O’Toole D, Sundin A, Taal B, Ferolla P, Ramage JK, Ferone D, Ito T, Weber W, Zheng-Pei Z et al. 2016 ENETS Consensus Guidelines Update for Gastroduodenal Neuroendocrine Neoplasms. Neuroendocrinology 103 119–124. (doi:10.1159/000443168)
- Delpla A, Tselikas L, De Baere T, Laurent S, Mezaib K, Barat M, Nguimbous O, Prudhomme C, Al-Hamar M, Moulin B et al. 2019 Preventive Vertebroplasty for Long-Term Consolidation of Vertebral Metastases. Cardiovascular and Interventional Radiology 42 1726–1737. (doi:10.1007/s00270-019-02314-6)
- Devcic Z, Rosenberg J, Braat AJA, Techasith T, Banerjee A, Sze DY & Lam MGEH 2014 The Efficacy of Hepatic 90Y Resin Radioembolization for Metastatic Neuroendocrine Tumors: A Meta-Analysis. Journal of Nuclear Medicine 55 1404–1410. (doi:10.2967/jnumed.113.135855)
- Dromain C, de Baere T, Lumbroso J, Caillet H, Laplanche A, Boige V, Ducreux M, Duvillard P, Elias D, Schlumberger M et al. 2005 Detection of liver metastases from endocrine tumors: a prospective comparison of somatostatin receptor scintigraphy, computed tomography, and magnetic resonance imaging. Journal of Clinical Oncology 23 70–78. (doi:10.1200/JCO.2005.01.013)
- Ducreux M, Dahan L, Smith D, O’Toole D, Lepère C, Dromain C, Vilgrain V, Baudin E, Lombard-Bohas C, Scoazec J-Y et al. 2014 Bevacizumab combined with 5-FU/streptozocin in patients with progressive metastatic well-differentiated pancreatic endocrine tumours (BETTER trial) - A phase II non-randomised trial. European Journal of Cancer 50 3098–3106. (doi:10.1016/j.ejca.2014.10.002)
- Dussol A-S, Joly M-O, Vercherat C, Forestier J, Hervieu V, Scoazec J-Y, Lombard-Bohas C & Walter T 2015 Gemcitabine and oxaliplatin or alkylating agents for neuroendocrine tumors: Comparison of efficacy and search for predictive factors guiding treatment choice: GEMOX or Alkylating Agents for NETs? Cancer 121 3428–3434. (doi:10.1002/cncr.29517)
- Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al. 2009 New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). European Journal of Cancer 45 228–247. (doi:10.1016/j.ejca.2008.10.026)
- Elias D, Lefevre JH, Duvillard P, Goéré D, Dromain C, Dumont F & Baudin E 2010 Hepatic metastases from neuroendocrine tumors with a “thin slice” pathological examination: they are many more than you think... Annals of Surgery 251 307–310. (doi:10.1097/SLA.0b013e3181bdf8cf)
- Elias D, David A, Sourrouille I, Honoré C, Goéré D, Dumont F, Stoclin A & Baudin E 2014 Neuroendocrine carcinomas: Optimal surgery of peritoneal metastases (and associated intra-abdominal metastases). Surgery 155 5–12. (doi:10.1016/j.surg.2013.05.030)
- Exarchou K, Kamieniarz L, Tsoli M, Victor A, Oleinikov K, Khan MS, Srirajaskanthan R, Mandair D, Grozinsky-Glasberg S, Kaltsas G et al. 2021 Is local excision sufficient in selected grade 1 or 2 type III gastric neuroendocrine neoplasms? Endocrine 74 421–429. (doi:10.1007/s12020-021-02775-1)
- Falconi M, Eriksson B, Kaltsas G, Bartsch DK, Capdevila J, Caplin M, Kos-Kudla B, Kwekkeboom D, Rindi G, Kl�ppel G et al. 2016 ENETS Consensus Guidelines Update for the Management of Patients with Functional Pancreatic Neuroendocrine Tumors and Non-Functional Pancreatic Neuroendocrine Tumors. Neuroendocrinology 103 153–171. (doi:10.1159/000443171)
- Fan ST, Le Treut YP, Mazzaferro V, Burroughs AK, Olausson M, Breitenstein S & Frilling A 2015 Liver transplantation for neuroendocrine tumour liver metastases. HPB 17. (doi:10.1111/hpb.12308)
- Farges O, Bendersky N, Truant S, Delpero JR, Pruvot FR & Sauvanet A 2017 The Theory and Practice of Pancreatic Surgery in France: Annals of Surgery 266 797–804. (doi:10.1097/SLA.0000000000002399)
- Fine C, Roquin G, Terrebonne E, Lecomte T, Coriat R, Do Cao C, de Mestier L, Coffin E, Cadiot G, Nicolli P et al. 2019 Endoscopic management of 345 small rectal neuroendocrine tumours: A national study from the French group of endocrine tumours (GTE). United European Gastroenterology Journal 7 1102–1112. (doi:10.1177/2050640619861883)
- Frilling A, Modlin IM, Kidd M, Russell C, Breitenstein S, Salem R, Kwekkeboom D, Lau W, Klersy C, Vilgrain V et al. 2014 Recommendations for management of patients with neuroendocrine liver metastases. The Lancet. Oncology 15 e8-21. (doi:10.1016/S1470-2045(13)70362-0)
- Garcia-Carbonero R, Sorbye H, Baudin E, Raymond E, Wiedenmann B, Niederle B, Sedlackova E, Toumpanakis C, Anlauf M, Cwikla JB et al. 2016 ENETS Consensus Guidelines for High-Grade Gastroenteropancreatic Neuroendocrine Tumors and Neuroendocrine Carcinomas. Neuroendocrinology 103 186–194. (doi:10.1159/000443172)
- Garcia-Torralba E, Spada F, Lim KHJ, Jacobs T, Barriuso J, Mansoor W, McNamara MG, Hubner RA, Manoharan P, Fazio N et al. 2021 Knowns and unknowns of bone metastases in patients with neuroendocrine neoplasms: A systematic review and meta-analysis. Cancer Treatment Reviews 94 102168. (doi:10.1016/j.ctrv.2021.102168)
- Gaujoux S, Partelli S, Maire F, D’Onofrio M, Larroque B, Tamburrino D, Sauvanet A, Falconi M & Ruszniewski P 2013 Observational study of natural history of small sporadic nonfunctioning pancreatic neuroendocrine tumors. The Journal of Clinical Endocrinology and Metabolism 98 4784–4789. (doi:10.1210/jc.2013-2604)
- Gaujoux S, Martin GL, Mirallié E, Regenet N, Le Bras M, Pattou F, Carnaille B, Cardot-Bauters C, Groussin L, Faron M et al. 2022 Life expectancy and likelihood of surgery in multiple endocrine neoplasia type 1: AFCE and GTE cohort study. British Journal of Surgery 109 872–879. (doi:10.1093/bjs/znac006)
- Gay-Chevallier S, de Mestier L, Perinel J, Forestier J, Hervieu V, Ruszniewski P, Millot I, Valette P-J, Pioche M, Lombard-Bohas C et al. 2021 Management and Prognosis of Localized Duodenal Neuroendocrine Neoplasms. Neuroendocrinology 111 718–727. (doi:10.1159/000508102)
- Gincul R, Ponchon T, Napoleon B, Scoazec J-Y, Guillaud O, Saurin J-C, Ciocirlan M, Lepilliez V, Pioche M, Lefort C et al. 2016 Endoscopic treatment of sporadic small duodenal and ampullary neuroendocrine tumors. Endoscopy 48 979–986. (doi:10.1055/s-0042-112570)
- Girard N, Mazieres J, Otto J, Lena H, Lepage C, Egenod T, Smith D, Madelaine J, Gérinière L, El Hajbi et al. 2021 Nivolumab (nivo) ± ipilimumab (ipi) in pre-treated patients with advanced, refractory pulmonary or gastroenteropancreatic poorly differentiated neuroendocrine tumors (NECs) (GCO-001 NIPINEC) (LBA41). Annals of Oncology 32 S1283–S1346.
- Girot P, Baudin E, Senellart H, Bouarioua N, Hentic O, Guimbaud R, Walter T, Ferru A, Roquin G, Cadiot G et al. 2022 Oxaliplatin and 5-Fluorouracil in Advanced Well-Differentiated Digestive Neuroendocrine Tumors: A Multicenter National Retrospective Study from the French Group of Endocrine Tumors. Neuroendocrinology 112 537–546. (doi:10.1159/000518650)
- Grozinsky-Glasberg S, Davar J, Hofland J, Dobson R, Prasad V, Pascher A, Denecke T, Tesselaar MET, Panzuto F, Albåge A et al. 2022 European Neuroendocrine Tumor Society (ENETS) 2022 Guidance Paper for Carcinoid Syndrome and Carcinoid Heart Disease. Journal of Neuroendocrinology e13146. (doi:doi.org/10.1111/jne.13146)
- Guarneri G, de Mestier L, Landoni L, Partelli S, Gaujoux S, Andreasi V, Nessi C, Dokmak S, Fontana M, Dousset B et al. 2021 Prognostic Role of Examined and Positive Lymph Nodes after Distal Pancreatectomy for Non-Functioning Neuroendocrine Neoplasms. Neuroendocrinology 111 728–738. (doi:10.1159/000509709)
- Gudmundsdottir H, Habermann EB, Vierkant RA, Starlinger P, Thiels CA, Warner SG, Smoot RL, Truty MJ, Kendrick ML, Halfdanarson TR et al. 2023 Survival and Symptomatic Relief After Cytoreductive Hepatectomy for Neuroendocrine Tumor Liver Metastases: Long-Term Follow-up Evaluation of More Than 500 Patients. Annals of Surgical Oncology 30 4840–4851. (doi:10.1245/s10434-023-13372-z)
- Gupta S, Johnson MM, Murthy R, Ahrar K, Wallace MJ, Madoff DC, McRae SE, Hicks ME, Rao S, Vauthey J-N et al. 2005 Hepatic arterial embolization and chemoembolization for the treatment of patients with metastatic neuroendocrine tumors: variables affecting response rates and survival. Cancer 104 1590–1602. (doi:10.1002/cncr.21389)
- Hadoux J, Malka D, Planchard D, Scoazec JY, Caramella C, Guigay J, Boige V, Leboulleux S, Burtin P, Berdelou A et al. 2015 Post-first-line FOLFOX chemotherapy for grade 3 neuroendocrine carcinoma. Endocrine-Related Cancer 22 289–298. (doi:10.1530/ERC-15-0075)
- Hadoux J, Walter T, Kanaan C, Hescot S, Hautefeuille V, Perrier M, Tauveron I, Laboureau S, Do Cao C, Petorin C et al. 2022 Second-line treatment and prognostic factors in neuroendocrine carcinoma: the RBNEC study. Endocrine-Related Cancer 29 569–580. (doi:10.1530/ERC-22-0102)
- Hajjar R, Mercier F, Passot G, Pasquer A, Gelli M, Levine EA, Villeneuve L, Poncet G, Walter T & Glehen O 2022 Cytoreductive surgery with or without hyperthermic intraperitoneal chemotherapy for small bowel neuroendocrine tumors with peritoneal metastasis. European Journal of Surgical Oncology 48 1626–1630. (doi:10.1016/j.ejso.2022.03.019)
- Hallet J, Law CHL, Cukier M, Saskin R, Liu N & Singh S 2015 Exploring the rising incidence of neuroendocrine tumors: A population-based analysis of epidemiology, metastatic presentation, and outcomes: Neuroendocrine Tumor Epidemiology. Cancer 121 589–597. (doi:10.1002/cncr.29099)
- Hayoz R, Vietti-Violi N, Duran R, Knebel J-F, Ledoux J-B & Dromain C 2020 The combination of hepatobiliary phase with Gd-EOB-DTPA and DWI is highly accurate for the detection and characterization of liver metastases from neuroendocrine tumor. European Radiology 30 6593–6602. (doi:10.1007/s00330-020-06930-6)
- Hendren NS, Panach K, Brown TJ, Peng L, Beg MS, Weissler J & Mirfakhraee S 2018 Pasireotide for the treatment of refractory hypoglycaemia from malignant insulinoma. Clinical Endocrinology 88 341–343. (doi:10.1111/cen.13503)
- Hentic O, Hammel P, Couvelard A, Rebours V, Zappa M, Palazzo M, Maire F, Goujon G, Gillet A, Lévy P et al. 2012 FOLFIRI regimen: an effective second-line chemotherapy after failure of etoposide-platinum combination in patients with neuroendocrine carcinomas grade 3. Endocrine-Related Cancer 19 751–757. (doi:10.1530/ERC-12-0002)
- de Herder WW & Hofland J 2022 Glucagon & Glucagonoma Syndrome. In Endotext. Eds KR Feingold, B Anawalt, MR Blackman, A Boyce, G Chrousos, E Corpas, WW de Herder, K Dhatariya, K Dungan, J Hofland, et al. South Dartmouth (MA): MDText.com, Inc.
- Hicks RJ, Kwekkeboom DJ, Krenning E, Bodei L, Grozinsky-Glasberg S, Arnold R, Borbath I, Cwikla J, Toumpanakis C, Kaltsas G et al. 2017 ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Neoplasia: Peptide Receptor Radionuclide Therapy with Radiolabeled Somatostatin Analogues. Neuroendocrinology 105 295–309. (doi:10.1159/000475526)
- Hofland J, Falconi M, Christ E, Castaño JP, Faggiano A, Lamarca A, Perren A, Petrucci S, Prasad V, Ruszniewski P et al. 2023 European Neuroendocrine Tumor Society 2023 guidance paper for functioning pancreatic neuroendocrine tumour syndromes. Journal of Neuroendocrinology 35 e13318. (doi:10.1111/jne.13318)
- Imperiale A, Rust E, Gabriel S, Detour J, Goichot B, Duclos B, Kurtz J-E, Bachellier P, Namer I-J & Taïeb D 2014 18F-Fluorodihydroxyphenylalanine PET/CT in Patients with Neuroendocrine Tumors of Unknown Origin: Relation to Tumor Origin and Differentiation. Journal of Nuclear Medicine 55 367–372. (doi:10.2967/jnumed.113.126896)
- Ito T & Jensen RT 2021 Perspectives on the current pharmacotherapeutic strategies for management of functional neuroendocrine tumor syndromes. Expert Opinion on Pharmacotherapy 22 685–693. (doi:10.1080/14656566.2020.1845651)
- Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, Scoazec J-Y, Salazar R, Sauvanet A & Kianmanesh R 2012 ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendocrinology 95 98–119. (doi:10.1159/000335591)
- Kalifi M, Walter T, Milot L, Hervieu V, Millot I, Gibert B, Roche C, Forestier J, Lombard-Bohas C, Pasquer A et al. 2021 Unifocal versus Multiple Ileal Neuroendocrine Tumors Location: An Embryological Origin. Neuroendocrinology 111 786–793. (doi:10.1159/000511849)
- Kalifi M, Deguelte S, Faron M, Afchain P, De Mestier L, Lecomte T, Pasquer A, Subtil F, Alghamdi K, Poncet G et al. 2023 The Need for Centralization for Small Intestinal Neuroendocrine Tumor Surgery: A Cohort Study from the GTE-Endocan-RENATEN Network, the CentralChirSINET Study. Annals of Surgical Oncology. (doi:10.1245/s10434-023-14276-8)
- Kaltsas G, Caplin M, Davies P, Ferone D, Garcia-Carbonero R, Grozinsky-Glasberg S, Hörsch D, Tiensuu Janson E, Kianmanesh R, Kos-Kudla B et al. 2017 ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Pre- and Perioperative Therapy in Patients with Neuroendocrine Tumors. Neuroendocrinology 105 245–254. (doi:10.1159/000461583)
- Kaltsas G, Walter T, Knigge U, Toumpanakis C, Santos AP, Begum N, Pape UF, Volante M, Frilling A & Couvelard A 2023 European Neuroendocrine Tumor Society (ENETS) 2023 guidance paper for appendiceal neuroendocrine tumours (aNET). Journal of Neuroendocrinology. (doi:10.1111/jne.13332)
- Kamp K, Damhuis RAM, Feelders RA & de Herder WW 2012 Occurrence of second primary malignancies in patients with neuroendocrine tumors of the digestive tract and pancreas. Endocrine-Related Cancer 19 95–99. (doi:10.1530/ERC-11-0315)
- Keck KJ, Maxwell JE, Utria AF, Bellizzi AM, Dillon JS, O’Dorisio TM & Howe JR 2018 The Distal Predilection of Small Bowel Neuroendocrine Tumors. Annals of Surgical Oncology 25 3207–3213. (doi:10.1245/s10434-018-6676-2)
- Keutgen XM, Hammel P, Choyke PL, Libutti SK, Jonasch E & Kebebew E 2016 Evaluation and management of pancreatic lesions in patients with von Hippel-Lindau disease. Nature Reviews. Clinical Oncology. (doi:10.1038/nrclinonc.2016.37)
- Kianmanesh R, Sauvanet A, Hentic O, Couvelard A, Lévy P, Vilgrain V, Ruszniewski P & Belghiti J 2008 Two-step surgery for synchronous bilobar liver metastases from digestive endocrine tumors: a safe approach for radical resection. Annals of Surgery 247 659–665. (doi:10.1097/SLA.0b013e31816a7061)
- Kianmanesh R, Ruszniewski P, Rindi G, Kwekkeboom D, Pape U-F, Kulke M, Sevilla Garcia I, Scoazec J-Y, Nilsson O, Fazio N et al. 2010 ENETS consensus guidelines for the management of peritoneal carcinomatosis from neuroendocrine tumors. Neuroendocrinology 91 333–340. (doi:10.1159/000286700)
- Knigge U, Capdevila J, Bartsch DK, Baudin E, Falkerby J, Kianmanesh R, Kos-Kudla B, Niederle B, Nieveen van Dijkum E, O’Toole D et al. 2017 ENETS Consensus Recommendations for the Standards of Care in Neuroendocrine Neoplasms: Follow-Up and Documentation. Neuroendocrinology 105 310–319. (doi:10.1159/000458155)
- Korse CM, Muller M & Taal BG 2011 Discontinuation of proton pump inhibitors during assessment of chromogranin A levels in patients with neuroendocrine tumours. British Journal of Cancer 105 1173–1175. (doi:10.1038/bjc.2011.380)
- Korse CM, Taal BG, Vincent A, van Velthuysen M-LF, Baas P, Buning-Kager JCGM, Linders TC & Bonfrer JMG 2012 Choice of tumour markers in patients with neuroendocrine tumours is dependent on the histological grade. A marker study of Chromogranin A, Neuron specific enolase, Progastrin-releasing peptide and cytokeratin fragments. European Journal of Cancer 48 662–671. (doi:10.1016/j.ejca.2011.08.012)
- Kos‐Kudła B, Castaño JP, Denecke T, Grande E, Kjaer A, Koumarianou A, De Mestier L, Partelli S, Perren A, Stättner S et al. 2023 European Neuroendocrine Tumor Society 2023 Guidance Paper for Non‐functioning Pancreatic Neuroendocrine Tumours. Journal of Neuroendocrinology e13343. (doi:10.1111/jne.13343)
- Kulke MH, Hörsch D, Caplin ME, Anthony LB, Bergsland E, Öberg K, Welin S, Warner RRP, Lombard-Bohas C, Kunz PL et al. 2017 Telotristat Ethyl, a Tryptophan Hydroxylase Inhibitor for the Treatment of Carcinoid Syndrome. Journal of Clinical Oncology 35 14–23. (doi:10.1200/JCO.2016.69.2780)
- Kulke MH, Ou F-S, Niedzwiecki D, Huebner L, Kunz P, Kennecke HF, Wolin EM, Chan JA, O’Reilly EM, Meyerhardt JA et al. 2022 Everolimus with or without bevacizumab in advanced pNET: CALGB 80701 (Alliance). Endocrine-Related Cancer 29 335–344. (doi:10.1530/ERC-21-0239)
- Kunz PL, Graham NT, Catalano PJ, Nimeiri HS, Fisher GA, Longacre TA, Suarez CJ, Martin BA, Yao JC, Kulke MH et al. 2023 Randomized Study of Temozolomide or Temozolomide and Capecitabine in Patients With Advanced Pancreatic Neuroendocrine Tumors (ECOG-ACRIN E2211). Journal of Clinical Oncology 41 1359–1369. (doi:10.1200/JCO.22.01013)
- Lacombe C, Perrier M, Hentic O, Brixi H, De Rycke O, Cros J, Rebours V, Cadiot G, Ruszniewski P & de Mestier L 2023 FOLFOX-bevacizumab chemotherapy in patients with metastatic neuroendocrine tumors. Journal of Neuroendocrinology 35 e13227. (doi:10.1111/jne.13227)
- Laks S, von Leeuwaarde R, Patel D, Keutgen XM, Hammel P, Nilubol N, Links TP, Halfdanarson TR, Daniels AB, Tirosh A et al. 2022 Management recommendations for pancreatic manifestations of von Hippel–Lindau disease. Cancer 128 435–446. (doi:10.1002/cncr.33978)
- Lamarca A, Elliott E, Barriuso J, Backen A, McNamara MG, Hubner R & Valle JW 2016 Chemotherapy for advanced non-pancreatic well-differentiated neuroendocrine tumours of the gastrointestinal tract, a systematic review and meta-analysis: A lost cause? Cancer Treatment Reviews 44 26–41. (doi:10.1016/j.ctrv.2016.01.005)
- Lamarca A, McCallum L, Nuttall C, Barriuso J, Backen A, Frizziero M, Leon R, Mansoor W, McNamara MG, Hubner RA et al. 2018 Somatostatin analogue-induced pancreatic exocrine insufficiency in patients with neuroendocrine tumors: results of a prospective observational study. Expert Review of Gastroenterology & Hepatology 12 723–731. (doi:10.1080/17474124.2018.1489232)
- Landry CS, Lin HY, Phan A, Charnsangavej C, Abdalla EK, Aloia T, Nicolas Vauthey J, Katz MHG, Yao JC & Fleming JB 2013 Resection of at-risk mesenteric lymph nodes is associated with improved survival in patients with small bowel neuroendocrine tumors. World Journal of Surgery 37 1695–1700. (doi:10.1007/s00268-013-1918-8)
- Lardière-Deguelte S, de Mestier L, Appéré F, Vullierme M-P, Zappa M, Hoeffel C, Noaves M, Brixi H, Hentic O, Ruszniewski P et al. 2015 Toward Preoperative Classification of Lymph-Node Metastases in Patients with Small Intestine Neuroendocrine Tumours in the Era of Intestinal-Sparing Surgery. Neuroendocrinology. (doi:10.1159/000441423)
- Larson A, Hedgire S, Deshpande V, Stemmer-Rachamimov A, Harisinghani M, Ferrone C, Shah U & Thiele E 2012 Pancreatic neuroendocrine tumors in patients with tuberous sclerosis complex. Clinical Genetics 82 558–563. (doi:10.1111/j.1399-0004.2011.01805.x)
- Lawrence B, Gustafsson BI, Kidd M, Pavel M, Svejda B & Modlin IM 2011 The Clinical Relevance of Chromogranin A as a Biomarker for Gastroenteropancreatic Neuroendocrine Tumors. Endocrinology and Metabolism Clinics of North America 40 111–134. (doi:10.1016/j.ecl.2010.12.001)
- Le Roux C, Lombard-Bohas C, Delmas C, Dominguez-Tinajero S, Ruszniewski P, Samalin E, Raoul J-L, Renard P, Baudin E, Robaskiewicz M et al. 2011 Relapse factors for ileal neuroendocrine tumours after curative surgery: a retrospective French multicentre study. Digestive and Liver Disease 43 828–833. (doi:10.1016/j.dld.2011.04.021)
- Lee DY & Kim Y 2019 Prognostic Value of Maximum Standardized Uptake Value in 68Ga-Somatostatin Receptor Positron Emission Tomography for Neuroendocrine Tumors: A Systematic Review and Meta-analysis. Clinical Nuclear Medicine 44 777–783. (doi:10.1097/RLU.0000000000002694)
- Legoux J-L, Lombard-Bohas C, Brixi H, Le Malicot K, Lecomte T, Dahan L, Ruszniewski P, Mahamat-Abakar A, Etienne P-L, Caroli-Bosc F-X et al. 2021 Renal function in patients receiving streptozocin for locally advanced or metastatic digestive neuroendocrine tumours: results of the Streptotox-FFCD 0906 study. Clinics and Research in Hepatology and Gastroenterology 45 101572. (doi:10.1016/j.clinre.2020.10.014)
- Lepage C, Phelip J-M, Lievre A, Le-Malicot K, Dahan L, Tougeron D, Toumpanakis C, Di-Fiore F, Lombard-Bohas C, Borbath I et al. 2022 Lanreotide as maintenance therapy after first-line treatment in patients with non-resectable duodeno-pancreatic neuroendocrine tumours: An international double-blind, placebo-controlled randomised phase II trial - Prodige 31 REMINET: An FFCD study. European Journal of Cancer 175 31–40. (doi:10.1016/j.ejca.2022.07.033)
- Limbach KE, Pommier SJ, Dewey E, Leon E & Pommier RF 2020 Neuroendocrine metastases to the ovaries are significantly associated with small bowel neuroendocrine tumors and carcinomatosis. American Journal of Surgery 219 795–799. (doi:10.1016/j.amjsurg.2020.02.040)
- Lin AL & Gutmann DH 2013 Advances in the treatment of neurofibromatosis-associated tumours. Nature Reviews. Clinical Oncology 10 616–624. (doi:10.1038/nrclinonc.2013.144)
- Maire F, Lombard-Bohas C, O’Toole D, Vullierme M-P, Rebours V, Couvelard A, Pelletier AL, Zappa M, Pilleul F, Hentic O et al. 2012 Hepatic arterial embolization versus chemoembolization in the treatment of liver metastases from well-differentiated midgut endocrine tumors: a prospective randomized study. Neuroendocrinology 96 294–300. (doi:10.1159/000336941)
- de Mestier L, Hentic O, Cros J, Walter T, Roquin G, Brixi H, Lombard-Bohas C, Hammel P, Diebold M-D, Couvelard A et al. 2015a Metachronous Hormonal Syndromes in Patients With Pancreatic Neuroendocrine Tumors: A Case-Series Study. Annals of Internal Medicine 162 682. (doi:10.7326/M14-2132)
- de Mestier L, Gaujoux S, Cros J, Hentic O, Vullierme M-P, Couvelard A, Cadiot G, Sauvanet A, Ruszniewski P, Richard S et al. 2015b Long-term Prognosis of Resected Pancreatic Neuroendocrine Tumors in von Hippel-Lindau Disease Is Favorable and Not Influenced by Small Tumors Left in Place. Annals of Surgery 262 384–388. (doi:10.1097/SLA.0000000000000856)
- de Mestier L, Walter T, Brixi H, Lombard-Bohas C & Cadiot G 2015c Sunitinib achieved fast and sustained control of VIPoma symptoms. European Journal of Endocrinology 172 K1-3. (doi:10.1530/EJE-14-0682)
- de Mestier L, Lardière-Deguelte S, Brixi H, O’Toole D, Ruszniewski P, Cadiot G & Kianmanesh R 2015d Updating the surgical management of peritoneal carcinomatosis in patients with neuroendocrine tumors. Neuroendocrinology 101 105–111. (doi:10.1159/000371817)
- de Mestier L, Pasmant E, Fleury C, Brixi H, Sohier P, Féron T, Diebold M-D, Clauser E, Cadiot G, & Groupe d’Étude des Tumeurs Endocrines 2017a Familial small-intestine carcinoids: Chromosomal alterations and germline inositol polyphosphate multikinase sequencing. Digestive and Liver Disease 49 98–102. (doi:10.1016/j.dld.2016.10.007)
- de Mestier L, Zappa M, Hentic O, Vilgrain V & Ruszniewski P 2017b Liver transarterial embolizations in metastatic neuroendocrine tumors. Reviews in Endocrine & Metabolic Disorders 18 459–471. (doi:10.1007/s11154-017-9431-2)
- de Mestier L, Lorenzo D, Fine C, Cros J, Hentic O, Walter T, Panis Y, Couvelard A, Cadiot G & Ruszniewski P 2019a Endoscopic, transanal, laparoscopic, and transabdominal management of rectal neuroendocrine tumors. Best Practice & Research. Clinical Endocrinology & Metabolism 101293. (doi:10.1016/j.beem.2019.101293)
- de Mestier L, Walter T, Brixi H, Evrard C, Legoux J-L, de Boissieu P, Hentic O, Cros J, Hammel P, Tougeron D et al. 2019b Comparison of Temozolomide-Capecitabine to 5-Fluorouracile-Dacarbazine in 247 Patients with Advanced Digestive Neuroendocrine Tumors Using Propensity Score Analyses. Neuroendocrinology 108 343–353. (doi:10.1159/000498887)
- de Mestier L, Walter T, Evrard C, de Boissieu P, Hentic O, Cros J, Tougeron D, Lombard-Bohas C, Rebours V, Hammel P et al. 2020a Temozolomide Alone or Combined with Capecitabine for the Treatment of Advanced Pancreatic Neuroendocrine Tumor. Neuroendocrinology 110 83–91. (doi:10.1159/000500862)
- de Mestier L, Couvelard A, Blazevic A, Hentic O, de Herder WW, Rebours V, Paradis V, Ruszniewski P, Hofland LJ & Cros J 2020b Critical appraisal of MGMT in digestive NET treated with alkylating agents. Endocrine-Related Cancer 27 R391–R405. (doi:10.1530/ERC-20-0227)
- de Mestier L, Savagner F, Brixi H, Do Cao C, Dominguez-Tinajero S, Roquin G, Goichot B, Hentic O, Dubreuil O, Hautefeuille V et al. 2021 Plasmatic and Urinary 5-Hydroxyindolacetic Acid Measurements in Patients With Midgut Neuroendocrine Tumors: A GTE Study. The Journal of Clinical Endocrinology & Metabolism 106 e1673–e1682. (doi:10.1210/clinem/dgaa924)
- de Mestier L, Nicolle R, Poté N, Rebours V, Cauchy F, Hentic O, Maire F, Ronot M, Lebtahi R, Sauvanet A et al. 2022 Molecular deciphering of primary liver neuroendocrine neoplasms confirms their distinct existence with foregut‐like profile. The Journal of Pathology 258 58–68. (doi:10.1002/path.5977)
- de Mestier L, Resche-Rigon M, Dromain C, Lamarca A, La Salvia A, de Baker L, Fehrenbach U, Pusceddu S, Colao A, Borbath I et al. 2023 Proposal of early CT morphological criteria for response of liver metastases to systemic treatments in gastroenteropancreatic neuroendocrine tumors: Alternatives to RECIST. Journal of Neuroendocrinology 35 e13311. (doi:10.1111/jne.13311)
- Mitry E, Baudin E, Ducreux M, Sabourin J-C, Rufié P, Aparicio T, Lasser P, Elias D, Duvillard P, Schlumberger M et al. 1999 Treatment of poorly differentiated neuroendocrine tumours with etoposide and cisplatin. British Journal of Cancer 81 1351. (doi:10.1038/sj.bjc.6690325)
- Mitry E, Walter T, Baudin E, Kurtz J-E, Ruszniewski P, Dominguez-Tinajero S, Bengrine-Lefevre L, Cadiot G, Dromain C, Farace F et al. 2014 Bevacizumab plus capecitabine in patients with progressive advanced well-differentiated neuroendocrine tumors of the gastro-intestinal (GI-NETs) tract (BETTER trial) - A phase II non-randomised trial. European Journal of Cancer 50 3107–3115. (doi:10.1016/j.ejca.2014.10.001)
- Modlin IM, Pavel M, Kidd M & Gustafsson BI 2010 Review article: somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine (carcinoid) tumours. Alimentary Pharmacology & Therapeutics 31 169–188. (doi:10.1111/j.1365-2036.2009.04174.x)
- Modrek AS, Hsu HC, Leichman CG & Du KL 2015 Radiation therapy improves survival in rectal small cell cancer - Analysis of Surveillance Epidemiology and End Results (SEER) data. Radiation Oncology 10 101. (doi:10.1186/s13014-015-0411-y)
- Moertel CG, Kvols LK, O’Connell MJ & Rubin J 1991 Treatment of neuroendocrine carcinomas with combined etoposide and cisplatin. Evidence of major therapeutic activity in the anaplastic variants of these neoplasms. Cancer 68 227–232. (doi:10.1002/1097-0142(19910715)68:2<227::aid-cncr2820680202>3.0.co;2-i)
- Moertel CG, Lefkopoulo M, Lipsitz S, Hahn RG & Klaassen D 1992 Streptozocin-doxorubicin, streptozocin-fluorouracil or chlorozotocin in the treatment of advanced islet-cell carcinoma. The New England Journal of Medicine 326 519–523. (doi:10.1056/NEJM199202203260804)
- Montravers F, Grahek D, Kerrou K, Ruszniewski P, de Beco V, Aide N, Gutman F, Grangé J-D, Lotz J-P & Talbot J-N 2006 Can fluorodihydroxyphenylalanine PET replace somatostatin receptor scintigraphy in patients with digestive endocrine tumors? Journal of Nuclear Medicine 47 1455–1462.
- Motz BM, Lorimer PD, Boselli D, Hill JS & Salo JC 2018 Optimal Lymphadenectomy in Small Bowel Neuroendocrine Tumors: Analysis of the NCDB. Journal of Gastrointestinal Surgery 22 117–123. (doi:10.1007/s11605-017-3524-9)
- Nesti C, Bräutigam K, Benavent M, Bernal L, Boharoon H, Botling J, Bouroumeau A, Brcic I, Brunner M, Cadiot G et al. 2023 Hemicolectomy versus appendectomy for patients with appendiceal neuroendocrine tumours 1-2 cm in size: a retrospective, Europe-wide, pooled cohort study. The Lancet. Oncology 24 187–194. (doi:10.1016/S1470-2045(22)00750-1)
- Niederle B, Pape U-F, Costa F, Gross D, Kelestimur F, Knigge U, �berg K, Pavel M, Perren A, Toumpanakis C et al. 2016 ENETS Consensus Guidelines Update for Neuroendocrine Neoplasms of the Jejunum and Ileum. Neuroendocrinology 103 125–138. (doi:10.1159/000443170)
- Norlén O, Stålberg P, Öberg K, Eriksson J, Hedberg J, Hessman O, Janson ET, Hellman P & Åkerström G 2012 Long-term results of surgery for small intestinal neuroendocrine tumors at a tertiary referral center. World Journal of Surgery 36 1419–1431. (doi:10.1007/s00268-011-1296-z)
- Oberg K, Couvelard A, Delle Fave G, Gross D, Grossman A, Jensen RT, Pape U-F, Perren A, Rindi G, Ruszniewski P et al. 2017 ENETS Consensus Guidelines for Standard of Care in Neuroendocrine Tumours: Biochemical Markers. Neuroendocrinology 105 201–211. (doi:10.1159/000472254)
- Ortenzi M, Ghiselli R, Trombettoni MMC, Cardinali L & Guerrieri M 2016 Transanal endoscopic microsurgery as optimal option in treatment of rare rectal lesions: A single centre experience. World Journal of Gastrointestinal Endoscopy 8 623–627. (doi:10.4253/wjge.v8.i17.623)
- Ouvrard E, Chevalier E, Addeo P, Sahakian N, Detour J, Goichot B, Bachellier P, Karcher G, Taïeb D & Imperiale A 2021 Intraindividual comparison of 18 F-FDOPA and 68 Ga-DOTATOC PET/CT detection rate for metastatic assessment in patients with ileal neuroendocrine tumours. Clinical Endocrinology 94 66–73. (doi:10.1111/cen.14312)
- Ouvrard E, Mestier LD, Boursier C, Lachachi B, Sahakian N, Chevalier E, Mikail N, Carullo J, Bando-Delaunay A, Walter T et al. 2022 18F-DOPA PET/CT at the Forefront of Initial or Presurgical Evaluation of Small-Intestine Neuroendocrine Tumors. Journal of Nuclear Medicine 63 1865–1870. (doi:10.2967/jnumed.122.263984)
- Palazzo M, Napoléon B, Gincul R, Pioche M, Pujol B, Lefort C, Fumex F, Hautefeuille V, Fabre M, Cros J et al. 2018 Contrast harmonic EUS for the prediction of pancreatic neuroendocrine tumor aggressiveness (with videos). Gastrointestinal Endoscopy 87 1481–1488. (doi:10.1016/j.gie.2017.12.033)
- Pan J, Zhang X, Shi Y & Pei Q 2018 Endoscopic mucosal resection with suction vs. endoscopic submucosal dissection for small rectal neuroendocrine tumors: a meta-analysis. Scandinavian Journal of Gastroenterology 53 1139–1145. (doi:10.1080/00365521.2018.1498120)
- Panzuto F, Ramage J, Pritchard DM, van Velthuysen M-LF, Schrader J, Begum N, Sundin A, Falconi M & O’Toole D 2023 European Neuroendocrine Tumor Society (ENETS) 2023 guidance paper for gastroduodenal neuroendocrine tumours (NETs) G1-G3. Journal of Neuroendocrinology e13306. (doi:10.1111/jne.13306)
- Pape U-F, Niederle B, Costa F, Gross D, Kelestimur F, Kianmanesh R, Knigge U, �berg K, Pavel M, Perren A et al. 2016 ENETS Consensus Guidelines for Neuroendocrine Neoplasms of the Appendix (Excluding Goblet Cell Carcinomas). Neuroendocrinology 103 144–152. (doi:10.1159/000443165)
- Partelli S, Javed AA, Andreasi V, He J, Muffatti F, Weiss MJ, Sessa F, La Rosa S, Doglioni C, Zamboni G et al. 2018a The number of positive nodes accurately predicts recurrence after pancreaticoduodenectomy for nonfunctioning neuroendocrine neoplasms. European Journal of Surgical Oncology 44 778–783. (doi:10.1016/j.ejso.2018.03.005)
- Partelli S, Cirocchi R, Rancoita PMV, Muffatti F, Andreasi V, Crippa S, Tamburrino D & Falconi M 2018b A Systematic review and meta-analysis on the role of palliative primary resection for pancreatic neuroendocrine neoplasm with liver metastases. HPB 20 197–203. (doi:10.1016/j.hpb.2017.10.014)
- Pasquer A, Walter T, Hervieu V, Forestier J, Scoazec J-Y, Lombard-Bohas C & Poncet G 2015 Surgical Management of Small Bowel Neuroendocrine Tumors: Specific Requirements and Their Impact on Staging and Prognosis. Annals of Surgical Oncology 22 Suppl 3 S742-749. (doi:10.1245/s10434-015-4620-2)
- Pasquer A, Walter T, Rousset P, Hervieu V, Forestier J, Lombard-Bohas C & Poncet G 2016 Lymphadenectomy during Small Bowel Neuroendocrine Tumor Surgery: The Concept of Skip Metastases. Annals of Surgical Oncology 23 804–808. (doi:10.1245/s10434-016-5574-8)
- Pavel ME, Baum U, Hahn EG, Schuppan D & Lohmann T 2006 Efficacy and tolerability of pegylated IFN-alpha in patients with neuroendocrine gastroenteropancreatic carcinomas. Journal of Interferon & Cytokine Research 26 8–13. (doi:10.1089/jir.2006.26.8)
- Pavel ME, Hainsworth JD, Baudin E, Peeters M, Hörsch D, Winkler RE, Klimovsky J, Lebwohl D, Jehl V, Wolin EM et al. 2011 Everolimus plus octreotide long-acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (RADIANT-2): a randomised, placebo-controlled, phase 3 study. The Lancet 378 2005–2012. (doi:10.1016/S0140-6736(11)61742-X)
- Pavel M, O’Toole D, Costa F, Capdevila J, Gross D, Kianmanesh R, Krenning E, Knigge U, Salazar R, Pape U-F et al. 2016 ENETS Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal, Pancreatic, Bronchial Neuroendocrine Neoplasms (NEN) and NEN of Unknown Primary Site. Neuroendocrinology 103 172–185. (doi:10.1159/000443167)
- Pavel M, Ćwikła JB, Lombard-Bohas C, Borbath I, Shah T, Pape UF, Capdevila J, Panzuto F, Truong Thanh X-M, Houchard A et al. 2021 Efficacy and safety of high-dose lanreotide autogel in patients with progressive pancreatic or midgut neuroendocrine tumours: CLARINET FORTE phase 2 study results. European Journal of Cancer 157 403–414. (doi:10.1016/j.ejca.2021.06.056)
- Pellat A, Walter T, Augustin J, Hautefeuille V, Hentic O, Do Cao C, Lievre A, Coriat R, Hammel P, Dubreuil O et al. 2020 Chemotherapy in Resected Neuroendocrine Carcinomas of the Digestive Tract: A National Study from the French Group of Endocrine Tumours. Neuroendocrinology 110 404–412. (doi:10.1159/000502825)
- Perren A, Couvelard A, Scoazec J-Y, Costa F, Borbath I, Delle Fave G, Gorbounova V, Gross D, Grossma A, Jense RT et al. 2017 ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Pathology: Diagnosis and Prognostic Stratification. Neuroendocrinology 105 196–200. (doi:10.1159/000457956)
- Piccardo A, Fiz F, Bottoni G, Ugolini M, Noordzij W & Trimboli P 2021 Head-to-head comparison between 18 F-DOPA PET/CT and 68 Ga-DOTA peptides PET/CT in detecting intestinal neuroendocrine tumours: A systematic review and meta-analysis. Clinical Endocrinology 95 595–605. (doi:10.1111/cen.14527)
- Pusceddu S, Prinzi N, Tafuto S, Ibrahim T, Filice A, Brizzi MP, Panzuto F, Baldari S, Grana CM, Campana D et al. 2022 Association of Upfront Peptide Receptor Radionuclide Therapy With Progression-Free Survival Among Patients With Enteropancreatic Neuroendocrine Tumors. JAMA Network Open 5 e220290. (doi:10.1001/jamanetworkopen.2022.0290)
- Rault-Petit B, Do Cao C, Guyétant S, Guimbaud R, Rohmer V, Julié C, Baudin E, Goichot B, Coriat R, Tabarin A et al. 2019 Current Management and Predictive Factors of Lymph Node Metastasis of Appendix Neuroendocrine Tumors: A National Study from the French Group of Endocrine Tumors (GTE). Annals of Surgery 270 165–171. (doi:10.1097/SLA.0000000000002736)
- Raymond E, Dahan L, Raoul J-L, Bang Y-J, Borbath I, Lombard-Bohas C, Valle J, Metrakos P, Smith D, Vinik A et al. 2011 Sunitinib Malate for the Treatment of Pancreatic Neuroendocrine Tumors. New England Journal of Medicine 364 501–513. (doi:10.1056/NEJMoa1003825)
- Raymond E, Kulke MH, Qin S, Yu X, Schenker M, Cubillo A, Lou W, Tomasek J, Thiis-Evensen E, Xu J-M et al. 2018 Efficacy and Safety of Sunitinib in Patients with Well-Differentiated Pancreatic Neuroendocrine Tumours. Neuroendocrinology 107 237–245. (doi:10.1159/000491999)
- Rindi G, Klöppel G, Couvelard A, Komminoth P, Körner M, Lopes JM, McNicol A-M, Nilsson O, Perren A, Scarpa A et al. 2007 TNM staging of midgut and hindgut (neuro) endocrine tumors: a consensus proposal including a grading system. Virchows Archiv 451 757–762. (doi:10.1007/s00428-007-0452-1)
- Rindi G, Mete O, Uccella S, Basturk O, La Rosa S, Brosens LAA, Ezzat S, de Herder WW, Klimstra DS, Papotti M et al. 2022 Overview of the 2022 WHO Classification of Neuroendocrine Neoplasms. Endocrine Pathology 33 115–154. (doi:10.1007/s12022-022-09708-2)
- Rinke A, Wittenberg M, Schade-Brittinger C, Aminossadati B, Ronicke E, Gress TM, Müller H-H, Arnold R & Group for the PS 2016 Placebo-Controlled, Double-Blind, Prospective, Randomized Study on the Effect of Octreotide LAR in the Control of Tumor Growth in Patients with Metastatic Neuroendocrine Midgut Tumors (PROMID): Results of Long-Term Survival. Neuroendocrinology 104 26–32. (doi:10.1159/000443612)
- Rinke A, Ambrosini V, Dromain C, Garcia-Carbonero R, Haji A, Koumarianou A, van Dijkum EN, O’Toole D, Rindi G, Scoazec J-Y et al. 2023 European Neuroendocrine Tumor Society (ENETS) 2023 guidance paper for colorectal neuroendocrine tumours. Journal of Neuroendocrinology 35 e13309. (doi:10.1111/jne.13309)
- Ronot M, Cuccioli F, Dioguardi Burgio M, Vullierme M-P, Hentic O, Ruszniewski P, d’Assignies G & Vilgrain V 2017 Neuroendocrine liver metastases: Vascular patterns on triple-phase MDCT are indicative of primary tumour location. European Journal of Radiology 89 156–162. (doi:10.1016/j.ejrad.2017.02.007)
- Rossi RE, Elvevi A, Citterio D, Coppa J, Invernizzi P, Mazzaferro V & Massironi S 2021 Gastrinoma and Zollinger Ellison syndrome: A roadmap for the management between new and old therapies. World Journal of Gastroenterology 27 5890–5907. (doi:10.3748/wjg.v27.i35.5890)
- Rossi RE, Elvevi A, Gallo C, Palermo A, Invernizzi P & Massironi S 2022 Endoscopic techniques for diagnosis and treatment of gastro-entero-pancreatic neuroendocrine neoplasms: Where we are. World Journal of Gastroenterology 28 3258–3273. (doi:10.3748/wjg.v28.i26.3258)
- Salazar R, Tafuto S, Krogh M, Teule A, Garcia-Carbonero R, Klumpen H, Cremer B, Sevilla I, Eriksson B, Tabaksblat E et al. 2022 Randomized open label phase III study comparing the efficacy and safety of everolimus followed by chemotherapy (CT) with streptozotocin (STZ)-5FU upon progression or the reverse sequence, in advanced progressive panNETs: The SEQTOR study (GETNE 1206) (LBA45). Annals of Oncology 33 S808–S869.
- Sallinen VJ, Le Large TYS, Tieftrunk E, Galeev S, Kovalenko Z, Haugvik S-P, Antila A, Franklin O, Martinez-Moneo E, Robinson SM et al. 2018 Prognosis of sporadic resected small (≤2 cm) nonfunctional pancreatic neuroendocrine tumors - a multi-institutional study. HPB 20 251–259. (doi:10.1016/j.hpb.2017.08.034)
- Scharf M, Petry V, Daniel H, Rinke A & Gress TM 2018 Bone Metastases in Patients with Neuroendocrine Neoplasm: Frequency and Clinical, Therapeutic, and Prognostic Relevance. Neuroendocrinology 106 30–37. (doi:10.1159/000457954)
- Sorbye H, Welin S, Langer SW, Vestermark LW, Holt N, Osterlund P, Dueland S, Hofsli E, Guren MG, Ohrling K et al. 2013 Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): The NORDIC NEC study. Annals of Oncology 24 152–160. (doi:10.1093/annonc/mds276)
- Sorbye H, Grande E, Pavel M, Tesselaar M, Fazio N, Reed NS, Knigge U, Christ E, Ambrosini V, Couvelard A et al. 2023 European Neuroendocrine Tumor Society (ENETS) 2023 guidance paper for digestive neuroendocrine carcinoma. Journal of Neuroendocrinology 35 e13249. (doi:10.1111/jne.13249)
- Strosberg JR, Fine RL, Choi J, Nasir A, Coppola D, Chen D-T, Helm J & Kvols L 2011 First-line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas. Cancer 117 268–275. (doi:10.1002/cncr.25425)
- Strosberg JR, Weber JM, Feldman M, Coppola D, Meredith K & Kvols LK 2013 Prognostic Validity of the American Joint Committee on Cancer Staging Classification for Midgut Neuroendocrine Tumors. Journal of Clinical Oncology 31 420–425. (doi:10.1200/JCO.2012.44.5924)
- Strosberg J, El-Haddad G, Wolin E, Hendifar A, Yao J, Chasen B, Mittra E, Kunz PL, Kulke MH, Jacene H et al. 2017 Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. The New England Journal of Medicine 376 125–135. (doi:10.1056/NEJMoa1607427)
- Strosberg J, Wolin E, Chasen B, Kulke M, Bushnell D, Caplin M, Baum RP, Kunz P, Hobday T, Hendifar A et al. 2018 Health-Related Quality of Life in Patients With Progressive Midgut Neuroendocrine Tumors Treated With 177 Lu-Dotatate in the Phase III NETTER-1 Trial. Journal of Clinical Oncology 36 2578–2584. (doi:10.1200/JCO.2018.78.5865)
- Su Y-K, Mackey RV, Riaz A, Gates VL, Benson AB, Miller FH, Yaghmai V, Gabr A, Salem R & Lewandowski RJ 2017 Long-Term Hepatotoxicity of Yttrium-90 Radioembolization as Treatment of Metastatic Neuroendocrine Tumor to the Liver. Journal of Vascular and Interventional Radiology 28 1520–1526. (doi:10.1016/j.jvir.2017.05.011)
- Sundin A, Arnold R, Baudin E, Cwikla JB, Eriksson B, Fanti S, Fazio N, Giammarile F, Hicks RJ, Kjaer A et al. 2017 ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Radiological, Nuclear Medicine and Hybrid Imaging. Neuroendocrinology 105 212–244. (doi:10.1159/000471879)
- Tang LH, Basturk O, Sue JJ & Klimstra DS 2016 A Practical Approach to the Classification of WHO Grade 3 (G3) Well-differentiated Neuroendocrine Tumor (WD-NET) and Poorly Differentiated Neuroendocrine Carcinoma (PD-NEC) of the Pancreas. The American Journal of Surgical Pathology 40 1192–1202. (doi:10.1097/PAS.0000000000000662)
- Thakker RV, Newey PJ, Walls GV, Bilezikian J, Dralle H, Ebeling PR, Melmed S, Sakurai A, Tonelli F & Brandi ML 2012 Clinical Practice Guidelines for Multiple Endocrine Neoplasia Type 1 (MEN1). The Journal of Clinical Endocrinology & Metabolism 97 2990–3011. (doi:10.1210/jc.2012-1230)
- Tomozawa Y, Jahangiri Y, Pathak P, Kolbeck KJ, Schenning RC, Kaufman JA & Farsad K 2018 Long-Term Toxicity after Transarterial Radioembolization with Yttrium-90 Using Resin Microspheres for Neuroendocrine Tumor Liver Metastases. Journal of Vascular and Interventional Radiology: JVIR 29 858–865. (doi:10.1016/j.jvir.2018.02.002)
- Touloupas C, Faron M, Hadoux J, Deschamps F, Roux C, Ronot M, Yevich S, Joskin J, Gelli M, Barbé R et al. 2021 Long Term Efficacy and Assessment of Tumor Response of Transarterial Chemoembolization in Neuroendocrine Liver Metastases: A 15-Year Monocentric Experience. Cancers 13 5366. (doi:10.3390/cancers13215366)
- Triponez F, Sadowski SM, Pattou F, Cardot-Bauters C, Mirallié E, Le Bras M, Sebag F, Niccoli P, Deguelte S, Cadiot G et al. 2018 Long-term Follow-up of MEN1 Patients Who Do Not Have Initial Surgery for Small ≤2 cm Nonfunctioning Pancreatic Neuroendocrine Tumors, an AFCE and GTE Study: Association Francophone de Chirurgie Endocrinienne & Groupe d’Etude des Tumeurs Endocrines. Annals of Surgery 268 158–164. (doi:10.1097/SLA.0000000000002191)
- Tsolakis AV, Ragkousi A, Vujasinovic M, Kaltsas G & Daskalakis K 2019 Gastric neuroendocrine neoplasms type 1: A systematic review and meta-analysis. World Journal of Gastroenterology 25 5376–5387. (doi:10.3748/wjg.v25.i35.5376)
- Van Den Heede K, Chidambaram S, Van Slycke S, Brusselaers N, Warfvinge CF, Ohlsson H, Nordenström E & Almquist M 2022 Effect of primary tumour resection without curative intent in patients with metastatic neuroendocrine tumours of the small intestine and right colon: meta-analysis. The British Journal of Surgery 109 191–199. (doi:10.1093/bjs/znab413)
- Vanoli A, La Rosa S, Klersy C, Grillo F, Albarello L, Inzani F, Maragliano R, Manca R, Luinetti O, Milione M et al. 2017 Four Neuroendocrine Tumor Types and Neuroendocrine Carcinoma of the Duodenum: Analysis of 203 Cases. Neuroendocrinology 104 112–125. (doi:10.1159/000444803)
- Vanoli A, La Rosa S, Miceli E, Klersy C, Maragliano R, Capuano F, Persichella A, Martino M, Inzani F, Luinetti O et al. 2018 Prognostic Evaluations Tailored to Specific Gastric Neuroendocrine Neoplasms: Analysis Of 200 Cases with Extended Follow-Up. Neuroendocrinology 107 114–126. (doi:10.1159/000489902)
- Vanoli A, Grami O, Klersy C, Milanetto AC, Albarello L, Fassan M, Luchini C, Grillo F, Spaggiari P, Inzani F et al. 2022 Ampullary Neuroendocrine Neoplasms: Identification of Prognostic Factors in a Multicentric Series of 119 Cases. Endocrine Pathology 33 274–288. (doi:10.1007/s12022-022-09720-6)
- Veltroni A, Cosaro E, Spada F, Fazio N, Faggiano A, Colao A, Pusceddu S, Zatelli MC, Campana D, Piovesan A et al. 2020 Clinico-pathological features, treatments and survival of malignant insulinomas: a multicenter study. European Journal of Endocrinology 182 439–446. (doi:10.1530/EJE-19-0989)
- Vezzosi D, Bennet A, Rochaix P, Courbon F, Selves J, Pradere B, Buscail L, Susini C & Caron P 2005 Octreotide in insulinoma patients: efficacy on hypoglycemia, relationships with Octreoscan scintigraphy and immunostaining with anti-sst2A and anti-sst5 antibodies. European Journal of Endocrinology 152 757–767. (doi:10.1530/eje.1.01901)
- Vezzosi D, Walter T, Laplanche A, Raoul JL, Dromain C, Ruszniewski P, d’Herbomez M, Guigay J, Mitry E, Cadiot G et al. 2011 Chromogranin A measurement in metastatic well-differentiated gastroenteropancreatic neuroendocrine carcinoma: screening for false positives and a prospective follow-up study. The International Journal of Biological Markers 26 94–101. (doi:10.5301/JBM.2011.8327)
- Walsh JC, Schaeffer DF, Kirsch R, Pollett A, Manzoni M, Riddell RH & Albarello L 2016 Ileal “carcinoid” tumors-small size belies deadly intent: high rate of nodal metastasis in tumors ≤1 cm in size. Human Pathology 56 123–127. (doi:10.1016/j.humpath.2016.05.023)
- Walter T, van Brakel B, Vercherat C, Hervieu V, Forestier J, Chayvialle J-A, Molin Y, Lombard-Bohas C, Joly M-O & Scoazec J-Y 2015 O6-Methylguanine-DNA methyltransferase status in neuroendocrine tumours: prognostic relevance and association with response to alkylating agents. British Journal of Cancer 112 523–531. (doi:10.1038/bjc.2014.660)
- Walter T, Tougeron D, Baudin E, Le Malicot K, Lecomte T, Malka D, Hentic O, Manfredi S, Bonnet I, Guimbaud R et al. 2017 Poorly differentiated gastro-entero-pancreatic neuroendocrine carcinomas: Are they really heterogeneous? Insights from the FFCD-GTE national cohort. European Journal of Cancer (Oxford, England: 1990) 79 158–165. (doi:10.1016/j.ejca.2017.04.009)
- Walter T, Lecomte T, Hadoux J, Niccoli P, Saban-Roche L, Gaye E, Guimbaud R, Baconnier M, Hautefeuille V, Cao CD et al. 2023a Alkylating agent-based vs oxaliplatin-based chemotherapy in neuroendocrine tumours according to the O6-methylguanine-DNA methyltransferase (MGMT) status: A randomized phase II study (MGMT-NET) on behalf of the French Group of Endocrine Tumors (GTE) and ENDOCAN-RENATEN network (LBA54). Annals of Oncology 34 S1292–S1293. (doi:10.1016/j.annonc.2023.10.048)
- Walter T, Lievre A, Coriat R, Malka D, Elhajbi F, Di Fiore F, Hentic O, Smith D, Hautefeuille V, Roquin G et al. 2023b Bevacizumab plus FOLFIRI after failure of platinum-etoposide first-line chemotherapy in patients with advanced neuroendocrine carcinoma (PRODIGE 41-BEVANEC): a randomised, multicentre, non-comparative, open-label, phase 2 trial. The Lancet. Oncology 24 297–306. (doi:10.1016/S1470-2045(23)00001-3)
- White BE, Rous B, Chandrakumaran K, Wong K, Bouvier C, Van Hemelrijck M, George G, Russell B, Srirajaskanthan R & Ramage JK 2022 Incidence and survival of neuroendocrine neoplasia in England 1995–2018: A retrospective, population-based study. The Lancet Regional Health - Europe 23 100510. (doi:10.1016/j.lanepe.2022.100510)
- WHO Classification of Tumours. 2019 Digestive System Tumours. IARC, Lyon.
- Wonn SM, Limbach KE, Pommier SJ, Ratzlaff AN, Leon EJ, McCully BH & Pommier RF 2021 Outcomes of cytoreductive operations for peritoneal carcinomatosis with or without liver cytoreduction in patients with small bowel neuroendocrine tumors. Surgery 169 168–174. (doi:10.1016/j.surg.2020.03.030)
- Xie J, Zhang Y, He M, Liu X, Xie P & Pang Y 2022 Survival comparison between endoscopic and surgical resection for non-ampullary duodenal neuroendocrine tumor (1-2 cm). Scientific Reports 12 15339. (doi:10.1038/s41598-022-19725-0)
- Yao JC, Shah MH, Ito T, Bohas CL, Wolin EM, Van Cutsem E, Hobday TJ, Okusaka T, Capdevila J, de Vries EGE et al. 2011 Everolimus for advanced pancreatic neuroendocrine tumors. The New England Journal of Medicine 364 514–523. (doi:10.1056/NEJMoa1009290)
- Yao JC, Pavel M, Lombard-Bohas C, Van Cutsem E, Voi M, Brandt U, He W, Chen D, Capdevila J, de Vries EGE et al. 2016a Everolimus for the Treatment of Advanced Pancreatic Neuroendocrine Tumors: Overall Survival and Circulating Biomarkers From the Randomized, Phase III RADIANT-3 Study. Journal of Clinical Oncology 34 3906–3913. (doi:10.1200/JCO.2016.68.0702)
- Yao JC, Fazio N, Singh S, Buzzoni R, Carnaghi C, Wolin E, Tomasek J, Raderer M, Lahner H, Voi M et al. 2016b Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet 387 968–977. (doi:10.1016/S0140-6736(15)00817-X)
- Yao JC, Guthrie KA, Moran C, Strosberg JR, Kulke MH, Chan JA, LoConte N, McWilliams RR, Wolin EM, Mattar B et al. 2017 Phase III Prospective Randomized Comparison Trial of Depot Octreotide Plus Interferon Alfa-2b Versus Depot Octreotide Plus Bevacizumab in Patients With Advanced Carcinoid Tumors: SWOG S0518. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology 35 1695–1703. (doi:10.1200/JCO.2016.70.4072)
- Zaidi MY, Lopez-Aguiar AG, Dillhoff M, Beal E, Poultsides G, Makris E, Rocha F, Crown A, Idrees K, Marincola Smith P et al. 2018 Prognostic Role of Lymph Node Positivity and Number of Lymph Nodes Needed for Accurately Staging Small Bowel Neuroendocrine Tumors. JAMA Surgery. (doi:10.1001/jamasurg.2018.3865)
- Zhang J, Liu Q, Singh A, Schuchardt C, Kulkarni HR & Baum RP 2020 Prognostic Value of 18F-FDG PET/CT in a Large Cohort of Patients with Advanced Metastatic Neuroendocrine Neoplasms Treated with Peptide Receptor Radionuclide Therapy. Journal of Nuclear Medicine 61 1560–1569. (doi:10.2967/jnumed.119.241414)

