Avec près de 45 000 nouveaux cas et 18 000 décès par an, le cancer colorectal se place au troisième rang des cancers les plus fréquents et reste le second le plus meurtrier en France. Un paradoxe pour un cancer qui dispose d’un dépistage particulièrement efficace, avec la guérison de neuf cancers sur dix lorsqu’ils sont détectés à un stade précoce. Depuis l’introduction des nouveaux tests dits immunologiques en 2015, ce dépistage est aussi devenu très efficace pour la détection des lésions précancéreuses, les adénomes ou polypes, dont l’ablation au cours d’une coloscopie permet d’éviter l’apparition du cancer.
Le cancer colorectal se développe sur plusieurs années, en grande majorité à partir de polypes (tumeurs bénignes) se développant sur la paroi intérieure du côlon et du rectum. Les cellules épithéliales (les glandes de la muqueuse colique) se multiplient de façon anormale et forment un polype. Enlever un polype bénin permet d'éviter un cancer du côlon potentiel.
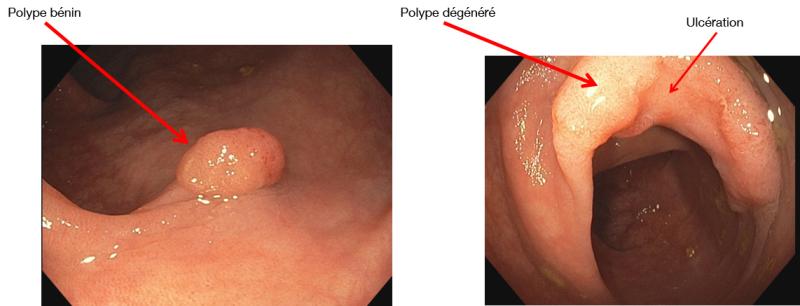
Image : © Dr Edouard Chabrun (CHU de Bordeaux)
Le cancer colorectal peut aussi survenir sur un terrain inflammatoire comme dans les maladies chroniques inflammatoires de l’intestin (MICI). A l’instar de la maladie de Crohn, le risque de cancer du côlon dans la rectocolite hémorragique est lié à l’inflammation chronique de la muqueuse intestinale et d’autant plus important que la maladie est étendue et ancienne.
Rare avant 50 ans, la fréquence du cancer colorectal augmente par la suite. Cependant, des études confirment l’accroissement de la fréquence des cancers colorectaux ces dernières décennies, y compris chez les moins de 50 ans. L’Europe occidentale est particulièrement touchée, comme les Etats-Unis. A l’inverse, les pays asiatiques, d’Amérique Latine et africains ont des fréquences de cancer colorectal nettement inférieures.
L’hérédité, l’hygiène de vie (alimentation, sédentarité), l’exposition à des substances cancérigènes, la présence d’une maladie inflammatoire de l’intestin, seraient des facteurs favorisants.
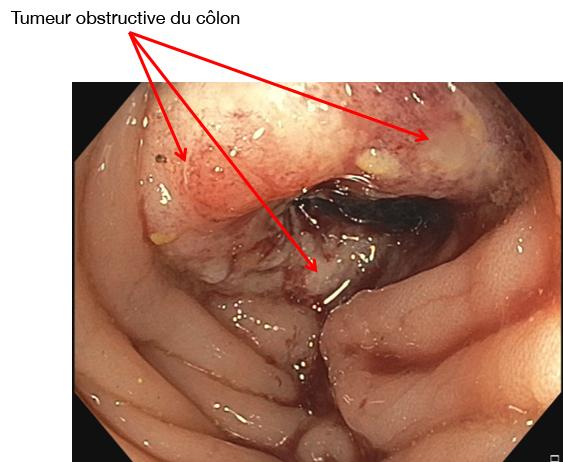
Image : © Dr Edouard Chabrun (CHU de Bordeaux)
Qui présente un risque ?
Risque moyen, risque élevé et très élevé de cancer colorectal
Trois niveaux de risque de développer un cancer colorectal existent : moyen, élevé ou très élevé. Avant l’âge de 50 ans, le risque étant faible, il n’est pas question de dépistage. Passé cet âge, le risque est soit "moyen" soit "élevé".
Sans symptôme ni antécédent personnel ou familial de cancer colorectal ou d’adénome colique avancé (polype > 1 cm) ni de maladie inflammatoire du côlon, le risque est qualifié de « moyen », c’est-à-dire un risque de 4 % de développer ce type de cancer. Globalement, 75-80 % des cancers du côlon surviennent chez ces personnes à risque « moyen ».
Environ 15 à 20 % des cancers colorectaux surviennent chez des personnes à risque « élevé » et 5 % chez celles à risque « très élevé ». Le risque est qualifié d’« élevé » en cas d’antécédents familiaux avant l’âge de 65 ans et/ou personnels de polype ou de cancer colorectal. En cas d’antécédents familiaux de cancer colorectal, le risque individuel augmente avec le nombre de cas et leur proximité (parents au premier degré). Les personnes à « haut risque » ont 8 à 15 % de risque de cancer colorectal.
Certaines personnes sont même classées à « très haut risque » ; elles ont jusqu’à 100 % de risque de cancer colorectal dans la polypose adénomateuse familiale (affection héréditaire causée par une mutation génétique sur les gènes APC et MYH) et 80 % dans le syndrome de Lynch (hereditary non polyposis colorectal cancer ou HNPCC).
Les examens
Test de dépistage ou coloscopie ?
Le dépistage est le maître-mot dans le cancer colorectal. 16,5 millions d’hommes et de femmes, assurés de 50 à 74 ans sont conviés tous les deux ans au dépistage du cancer colorectal. Chaque intéressé reçoit par courrier une invitation au dépistage, pris en charge à 100 % par l'Assurance Maladie. Malgré cela, seul un Français concerné sur trois se fait dépister et la situation ne semble pas s’améliorer. Avec un taux de 33,5 % sur la période 2016/2017, on est encore loin du seuil minimum de 45 % et du taux de 60 % "recommandé" en Europe. Conséquence : 50% des cancers diagnostiqués le sont au stade métastatique, c’est-à-dire que des cellules cancéreuses s’échappent de la tumeur primitive et vont coloniser une autre région du corps (ganglions lymphatiques et/ou organes vitaux comme le foie).
Au-delà de 75 ans, le dépistage est toujours envisageable si le médecin le juge utile pour ses patients.
La méthode de dépistage proposée est fonction du niveau de risque :
- Les sujets à risque élevé ou très élevé doivent avoir une coloscopie. Cet examen visuel du côlon par l'intermédiaire d’un endoscope introduit par l’anus est l’examen de référence pour le diagnostic des polypes et des cancers du côlon. Au cours de la coloscopie, le gastroentérologue peut effectuer un prélèvement (ablation ou simple biopsie suivie d’un examen anatomopathologique) afin de vérifier la nature bénigne ou maligne de la lésion et de définir son stade.
- Les sujets à risque moyen se voient proposer une recherche de sang microscopique dans les selles, et une coloscopie si cette recherche est positive. Avec la première génération de tests fécaux (Hemoccult®), il a été montré que le dépistage organisé réduisait la mortalité par cancer colorectal. Une nouvelle génération de tests, est disponible en France depuis avril 2015 : le test immunologique fécal est beaucoup plus performant, permettant de détecter 2,5 fois plus de cancers (le plus souvent au stade 1, facilement curable) et 4 fois plus d’adénomes avancés, ces lésions précancéreuses bénignes dont l’ablation prévient l’apparition du cancer.
Le test immunologique fécal (FIT)

Il est simple à réaliser et consiste à prélever chez soi un seul échantillon de selles au moyen d’un kit de prélèvement et à l'envoyer dans les cinq jours au laboratoire de biologie médicale indiqué. Les résultats sont obtenus dans les quinze jours. Lorsque le test est positif (environ 4 % des cas), la réalisation d’une coloscopie est impérative car elle va retrouver 1 fois sur 10 un cancer (le plus souvent au stade 1), et 4 fois sur 10 un adénome ou polype qui sera enlevé au cours de l’examen.
La coloscopie
Elle est donc réservée aux personnes « à risque élevé » ou « à risque très élevé » et aux 4 % des personnes à risque moyen mais ayant un test de dépistage FIT positif. Elle est bien sûr indiquée chez les patients ayant des symptômes évocateurs d’une tumeur colorectale (voir signes d’alarme). A noter, une coloscopie dite « de prévention » est également possible à partir de l’âge de 50 ans pour tout individu, même sans facteur de risque, qui en fait la demande, après avoir été informé des risques et bénéfices éventuels.
Chez les patients chez lesquels un cancer colorectal a été diagnostiqué, le scanner (tomodensitométrie) au niveau du thorax, de l’abdomen et de la région pelvienne est utile afin d’évaluer l’étendue du cancer dans le cadre du bilan d’extension pré-thérapeutique, en vue d’élaborer un plan de traitement adapté.
Lorsque la tumeur est localisée au rectum, une Imagerie par résonnance magnétique (IRM) voire, dans certains cas, une échographie endorectale déterminent si la tumeur s’est propagée aux organes de voisinage (vessie, prostate, utérus) et détecte également si les ganglions lymphatiques (situés dans la graisse qui entoure le côlon ou le rectum) sont touchés par des cellules cancéreuses, ce qui favoriserait leur dissémination.
Les traitements
L’exérèse tumorale, principalement
Palliatif ou curatif, le traitement dépend du stade de la tumeur colorectale.
Le traitement curatif consiste en l’ablation au moyen de l’endoscope (exérèse endoscopique) des tumeurs : ces techniques sont possibles si leur taille est limitée (diamètre est inférieur à 2-3 cm) et si elles restent superficielles (au niveau de la muqueuse du côlon et du rectum).
Lorsqu’il est détecté à un stade précoce, ce cancer de bon pronostic atteint 90 % de taux de survie globale à 5 ans ; ce taux est de 13 % lorsqu’il est détecté à un stade métastatique.
Si le polype est trop volumineux, on procède à la résection chirurgicale de la partie du côlon où siège la tumeur. Selon l’analyse de la pièce opératoire et en l’occurrence si les ganglions sont touchés, une chimiothérapie adjuvante (postopératoire) est proposée. La chimiothérapie détruit ou empêche la multiplication de toutes les cellules du corps qui se divisent rapidement, comme c’est le cas des cellules cancéreuses.
Dans le cas spécifique de la localisation rectale de la tumeur, lorsque celles-ci sont situées près de l’anus et donc difficile à enlever, une radio-chimiothérapie avant l’exérèse (dite néoadjuvante) est la règle. Vu le haut risque de récidive, la chirurgie du rectum doit être réalisée dans des centres experts à gros volume d’activité. L’amputation du rectum et une partie de l’anus (colostomie) est parfois justifiée par la proximité de la tumeur avec l’anus.
Certaines métastases, en particulier hépatiques et pulmonaires, peuvent être traitées de manière curative par exérèse chirurgicale sous certaines conditions (nombre, taille, localisation), avec ou sans chimiothérapie. Lorsque c’est impossible, le traitement devient palliatif. Sa finalité est de faire régresser voire disparaître les métastases, sans pour autant envisager la guérison et d’améliorer le confort de survie et l’espérance de vie. Les thérapeutiques à disposition sont les chimiothérapies souvent associées aux thérapies dites ciblées car concentrées sur les cellules cancéreuses. Ces anticorps monoclonaux « anti-cancer » sont principalement le bevacizumab, le cetuximab, le panitumumab, chacun étant spécifique d’un mécanisme précis. Certains ralentissent la croissance tumorale en s’attaquant aux substances dont la tumeur a besoin pour fabriquer ses propres vaisseaux sanguins (les agents angiogéniques) ou sur les mécanismes qui stimulent la division des cellules et de ce fait leur multiplication (les facteurs de croissance).
L’intérêt d’enlever la tumeur primitive est discuté, sauf lorsqu’elle occasionne des symptômes (occlusion intestinale, saignements).
Si des récidives surviennent, c’est avant deux ans, dans la grande majorité des cas.
- Vidéo "Cancers digestifs, mieux prévenir pour sauver des vies"(source SNFGE)
- Cancer colorectal(source Livre Blanc de l'Hépato-Gastroentérologie)
- Fiche d’information du patient avant une coloscopie(source SFED, SNFGE et SNFCP)
- Le cancer du côlon : points clés (source INCa)
La diminution du risque de cancer colorectal grâce aux produits laitiers, elle est « probable » selon l’INCa.
Concernant les facteurs nutritionnels augmentant le risque de cancer, le rôle délétère de la viande rouge et les charcuteries est consolidé selon l’INCa, avec un quart de la population exposée au risque de cancer colorectal qualifié de "convaincant" (≥ 500g de viande rouge/semaine et/ou ≥ 50g de charcuterie/jour).
La sédentarité constitue ainsi des facteurs de risque du cancer colorectal. L’activité physique semble, en revanche, un facteur protecteur.
Une stomie est un orifice créé de toutes pièces afin d’évacuer les selles lorsque ça n’est plus possible par les voies naturelles. L’intestin est alors relié au ventre, les selles étant recueillies dans une poche collée autour de la stomie. La colostomie suite à l’amputation du rectum et une partie de l’anus est loin d’être systématique et le plus souvent temporaire. Cela concerne essentiellement les cancers du rectum trop proches de l’anus pour pouvoir rétablir la continuité du transit. Des colostomies sont aussi mises en place de façon temporaire à l’occasion de perforations ou d’abcès de l’intestin dans l’intention de protéger les sutures. Elles sont enlevées après 3 mois.
Certaines maladies génétiques (polyposes adénomateuses familiales) qui entraînent un risque considérable de cancer (porteurs du gène muté). En dehors de ce cas particulier, on a un risque plus élevé lorsqu’un parent 1er degré et moins âge de 65 ans a été touché.

