26. Bilan pré-thérapeutique et surveillance des immunothérapies en oncologie digestive (chapitre en cours de mise en ligne)
(Dernière mise à jour le : )Groupe de travail et relecteurs
Groupe de travail :
Marine Jary, (Clermont-Ferrand), Clélia Coutzac (Lyon), Delphine Bonnet (Toulouse), coordonnatrices
Thomas Aparicio (Paris), Juliette Abeillon (Lyon), Souad Assaad (Lyon), Virginie Avrillon (Lyon), Mathilde Baudet (Paris), Julie Belliere (Toulouse), Franck Carbonnel (Paris), Claire Carlier (Reims), Raphaël Colle (Paris), Nicolas Collongues (Strasbourg), Kevin Didier (Reims), Brigitte Dreno (Nantes), Iphigénie Korakis (Toulouse), Olivier Lambotte (Paris), Ariane Laparra (Paris), Lucy Meunier (Montpellier), Audrey Rabeau (Toulouse), Valérian Rivet (Toulouse), Romain Tresorier (Clermont-Ferrand)
Relecteurs :
Léonor Benhaim (Villejuif), Olivier Bouché (Reims), Dominique Breilh (Bordeaux), Sidonie Callon (Reims), Bruno Chauffert (Saint-Quentin), Sébastien Gaujoux (Paris), Alexandra Heurgué (Reims), Nadia Kaboul (Verdun), Thierry Lecomte (Tours), Côme Lepage (Dijon), Guillaume Marie (Boulogne-sur-Mer), Jonathan Olesinski (Villefranche-sur-Saône), Florence Osaer (Clermont-Ferrand), Violaine Randrian (Poitiers), Anthony Turpin (Lille)
Comment citer ce chapitre du TNCD ?
Jary M, Coutzac C, Bonnet D, Abeillon J, Assaad S, Avrillon V, Baudet M, Belliere J, Franck Carbonnel F, Carlier C, Colle R, Collongues N, Didier K, Dreno B, Korakis I, Lambotte O, Laparra A, Meunier L, Rabeau A, Rivet V,Tresorier R, Aparicio T, Bouché O. « Bilan pré-thérapeutique et surveillance des immunothérapies en oncologie digestive ». Thésaurus National de Cancérologie Digestive, novembre 2025, en ligne [http://www.tncd.org].
26.1. Méthodologie, Recherche bibliographique
La séquence diagnostique et thérapeutique pour reconnaitre et soigner les EI immunomédiés, la conduite à tenir dans les populations particulières notamment les patients fragiles, âgés, comorbides ou atteints de maladies auto-immunes (MAI), ont fait l’objet de nombreuses publications et de plusieurs recommandations de sociétés savantes, avec un niveau de preuve limité, s’appuyant le plus souvent sur des séries rétrospectives ou des avis d’experts. La plupart de ces données sont issues de patients traités pour mélanomes ou cancers bronchiques.
Ce travail a impliqué des spécialistes d'organes impliqués dans la prise en charge des immunothérapies, et des oncologues digestifs, qui ont analysé la littérature dans leurs domaines respectifs. Ce travail est fondé sur les recommandations de l’Institut National du Cancer (Institut national du cancer, 2024), ainsi que celles de sociétés savantes françaises ou européennes (European Society for medical Oncology (ESMO), European Society of Cardiology (ESC), Société Française de Cardiologie (SFC), Société française d’immunothérapie du Cancer (FITC), Société française d’endocrinologie (SFE)), ainsi que la recherche des données récentes à partir de la base Medline interrogée jusqu’en décembre 2024 sur le moteur de recherche PubMed en utilisant les mots-clés : « immune-related adverse event », and « immune-toxicity ». Les études pivots ayant validé les standards d’immunothérapie cités dans les autres chapitres du Thésaurus National de Cancérologie Digestive (TNCD) ont également été analysées, ainsi que les Résumés des Caractéristiques des Produits.
Une relecture par l'ensemble du groupe de rédaction puis par le groupe de relecture a ensuite été effectuée, selon la méthodologie habituelle du TNCD.
Les grades de niveaux de preuves habituels sont difficiles à appliquer à ces recommandations car il n'y pas d'études prospectives spécifiques dédiées à la gestion des toxicités.
Les présentes recommandations ont été gradées selon le niveau des preuves disponibles dans la littérature, ou en cas de preuves insuffisantes selon l'accord ou avis d'experts. Les grades des recommandations suivent les critères de l’HAS pour les niveaux de preuve scientifique fournis par la littérature (source : www.has-sante.fr - avril 2013) :
A : Preuve scientifique établie Niveau 1 : |
B : Présomption scientifique Niveau 2 :
|
C : Faible niveau de preuve scientifique Niveau 4 |
Accord d’experts Approbation d’au moins 80 % des membres du groupe de travail. |
Avis d’experts Les recommandations non gradées sont implicitement des avis d’experts ou des accords professionnels. |
26.2. Introduction et description des effets indésirables
26.2.1. Introduction
L’immunothérapie par Inhibiteurs de points de Contrôle Immunitaire (ICI) a fait son entrée en oncologie digestive avec des indications de plus en plus nombreuses, en monothérapie (le plus souvent anti-PD(L)1) ou en association thérapeutique (bi-immunothérapie, en association avec une thérapie ciblée, ou une chimiothérapie…). Son profil de tolérance est meilleur que celui de la majorité des chimiothérapies conventionnelles ou des inhibiteurs de tyrosine kinase, mais elle expose les patients à des toxicités immuno-induites (EI immunomédiés), en lien direct avec son mode d’action. Ces effets indésirables peuvent toucher l’ensemble des organes et parfois mettre en jeu le pronostic vital des patients. Ils relèvent d’une prise en charge spécifique et diffèrent de ceux rencontrés jusqu’à présent en oncologie. Ils nécessitent, pour les plus graves ou les plus rares, une approche pluridisciplinaire avec des spécialistes d’organes.
26.2.1.1. Définition et mécanismes d’action des Inhibiteurs de checkpoint immunitaires
Les « points de contrôle immunitaires » font partie d’un système physiologique d’interaction entre les différents acteurs du système immunitaire adaptatif et les autres cellules de l’organisme, permettant une immunotolérance vis-à-vis du « soi ». Leur expression à la surface des cellules immunitaires et non immunitaires est indispensable pour éviter le développement de maladies dysimmunitaires (Postow et al, 2018; Carlino et al, 2021). En situation tumorale, les cellules cancéreuses développent des propriétés immunosuppressives qui inhibent la réponse anti-cancéreuse conduisant à un échappement tumoral (Ikeda et al, 2002; Willimsky & Blankenstein, 2005; Vesely et al, 2011).
L’immunothérapie anti-tumorale est définie comme un outil thérapeutique ayant pour but la stimulation des cellules effectrices de la réponse innée et adaptative contre les cellules tumorales, tout en neutralisant les mécanismes immunosuppresseurs.(Mellman et al, 2011) Les immunothérapies anticancéreuses utilisées en oncologie digestive comprennent majoritairement les Inhibiteurs de points de contrôle immunitaire (ICI). Il s’agit d’anticorps monoclonaux (« -mabs ») administrés par voie intraveineuse, qui ciblent des antigènes cellulaires de surface (principalement Programmed-Death-1 et son ligand PD-L1, Cytotoxic-T-Lymphocyte-Antigen 4 protein) bloquant ainsi les voies inhibitrices des lymphocytes T.
Deux points de contrôle immunitaires sont particulièrement ciblés par ces thérapeutiques en oncologie digestive :
- la voie « PD-1/PD-L1 » fait interagir le lymphocyte T et la cellule tumorale, dans le microenvironnement tumoral. Les lymphocytes T qui ont été activés par un antigène (notamment tumoral) expriment le récepteur PD-1. L’interaction entre le récepteur PD-1 du lymphocyte T activé et son ligand PD-L1 (exprimé par les cellules tumorales notamment) bloque l’action cytotoxique du lymphocyte. Cette inhibition est levée par les anticorps monoclonaux dirigés soit contre PD-1 (exemples : nivolumab, pembrolizumab), soit contre PD-L1 (exemples : atézolizumab, durvalumab).
- la voie « CTLA-4/CD28 », situé à la membrane des lymphocytes T : celui-ci fait interagir le lymphocyte T naïf et la cellule présentatrice d’antigène au sein des ganglions lymphatiques, à distance du site tumoral. Lors de la présentation d’antigènes prolongée (par exemple tumoraux) par la cellule dendritique au lymphocyte T, l’activation de l’axe CTLA-4-CD28 inhibe l’activation lymphocytaire. Cette inhibition est levée par les anticorps monoclonaux anti-CTLA-4 (exemples : ipilimumab, trémélimumab), permettant l’activation du lymphocyte T spécifique de l’antigène tumoral.
Ces deux ICI ont des mécanismes d’action indépendants, si bien que la combinaison thérapeutique entre anticorps anti-PD(L)-1 et anti-CTLA-4 est plus efficace.
26.2.1.2. Type de schémas thérapeutiques possibles
En oncologie digestive, les avis favorables au remboursement des ICI ont été émis par l’HAS, notamment pour le nivolumab, le pembrolizumab, le durvalumab, l’atézolizumab, l’ipilimumab, et le trémélimumab, etc. dans leurs indications respectives (voir les chapitres du TNCD dédiés).
26.2.2. Fréquence des EI immunomédiés
Les effets indésirables des ICI sont la conséquence directe de leur effet thérapeutique, c’est-à-dire l’activation du système immunitaire qui cible à la fois les antigènes de la tumeur et des tissus sains. En effet, en dehors d’effets indésirables tels que l’asthénie ou les réactions d’hypersensibilité aigue, les effets indésirables propres aux ICI sont des manifestations de type auto-immunes ou inflammatoires, qualifiées d’évènements indésirables immuno-induits (EI immunomédiés dans le texte).
Les EI immunomédiés peuvent atteindre tous les organes et ressemblent, pour la plupart, aux poussées de maladies auto-immunes ou inflammatoires. Les mécanismes d’EI immunomédiés sont divers :
- Réaction croisée des lymphocytes T activés, entre antigène tumoral et antigène du « soi » : ce mécanisme expliquerait notamment la fréquence plus élevée de vitiligo chez les patients traités pour mélanome, ou de pneumopathies immuno-induites chez les patients traités pour cancer bronchique ou présentant une BPCO.
- Stimulation de l’immunité humorale, en particulier par le blocage de PD-1 favorisant la production d’anticorps auto-réactifs préexistants, générant des maladies auto-immunes avec auto-anticorps comme la maladie de Basedow ou la pemphigoïde bulleuse.
- Blocage de checkpoints immunitaires physiologiquement actifs dans des tissus sains (ex : hypophyse…)
- Réaction immunitaire dirigée contre le microbiome intestinal et production de cytokines pro-inflammatoires (IL-17, inflammasome, TNFa…) dans les colites immuno-induites.
Un impact positif de la survenue d’un EI immunomédié sous ICI sur la survie (ou au minimum l’absence d’impact négatif) a été suggéré par plusieurs études et dans plusieurs localisations tumorales, suggérant que cet EI puisse être corrélé à l’efficacité du traitement.(Dupont et al, 2020; Eggermont et al, 2020; Pinato et al, 2021; Nukaya et al, 2024) Certaines études suggèrent toutefois que cet avantage de survie pourrait être un artéfact lié à un biais d’immortalité (Kfoury et al, 2022).
La fréquence et la gravité des EI immunomédiés dépend de la classe thérapeutique, de son association éventuelle (bi-immunothérapie, ICI + traitement anticancéreux), du schéma et de la posologie d’ICI (pour les anti-CTLA4), du terrain du patient et de la tumeur primitive.
L’incidence des EI de grade 3-4 sous ICI a notamment été calculée dans une méta-analyse portant sur plus de 15 000 patients traités par ICI pour mélanome ou cancer bronchique, inclus dans des essais randomisés de phase II ou III, avec plusieurs groupes dont l’un porté sur les patients exclusivement traités en monothérapie (Xu et al, 2018). Celle-ci était estimée à :
- 15 % pour le nivolumab et l’atézolizumab ;
- 20 % pour le pembrolizumab ;
- 30 % pour l’ipilimumab.
D’autres études montrent que les EI significativement surreprésentés sous traitement par ICI sont la colite (risque relatif à 7,7), l’hépatite (RR 1,8), le rash cutané (RR 2,5), l'hypothyroïdie (RR 6,8) et la pneumopathie (RR 4,4) (de Velasco et al, 2017).
Les EI immuno-induits les plus fréquents (cf. infra 6-1. ANNEXES : Tableau S1), quel que soit le schéma d’ICI employé, sont, par ordre de fréquence décroissante et tous grades confondus : cutanés, gastro-intestinaux, hépatiques, endocriniens, et pulmonaires (de Velasco et al, 2017).
26.2.3. Types d’effets indésirables
Les anti-PD(L)1 ont un spectre d’effets indésirables sans effet-dose mais plus étendu ; les hypothyroïdies sont particulièrement fréquentes (OR : 4,3, IC95% : 2,9-6,3), ainsi que les toxicités pulmonaires (OR : 6,4, IC95% : 3,2-12 ,7), rhumatismales à type d’arthralgies (OR : 3,5, IC95% : 2,6-4,8), ou cutanée à type de vitiligo (OR : 3,5, IC95% : 2,3-5,3) (de Velasco et al, 2017; Khoja et al, 2017).
Les anti-CTLA-4 ont une toxicité dose-dépendante, plus fréquemment digestive (OR : 8,7, IC95% : 5,8-12 ,9), hypophysaire (OR : 6,5, IC95% : 3,0-14,3), ou cutanée à type de rash (OR : 2,0, IC95% : 1,8-2 ,3) (de Velasco et al, 2017; Khoja et al, 2017).
Le type d’EI peut varier selon la tumeur primitive traitée : les toxicités cutanées et gastro-intestinales sont surreprésentées chez les patients traités pour mélanome, tandis que les toxicités pulmonaires sont plus fréquentes en cas de cancer bronchique (Khoja et al, 2017).
Des EI peuvent mettre en jeu le pronostic vital, comme les entérocolites, hépatites, pneumopathies immuno-induites, toxicités cardiaques, neuromusculaires et hématologiques. Les atteintes cutanées et endocriniennes, très fréquentes, n’engagent que rarement le pronostic vital, si elles sont correctement reconnues et prises en charge.
L’incidence et la nature des décès toxiques (EI immunomédiés de grade 5) ont été décrites dans une méta-analyse (Wang et al, 2018a) et dans l’étude REISAMIC (Ruste et al, 2021) et sont résumées dans le tableau S2. Ces études portaient sur des patients majoritairement traités pour des mélanomes, et dans une moindre mesure pour des cancers bronchiques ou des cancers urogénitaux. Elles confirment que les décès toxiques liés aux ICI sont moins fréquents qu’avec d’autres thérapeutiques anticancéreuses (chimiothérapies, TKI), avec un pourcentage d’EI immunomédiés létaux de l’ordre de 1 %, variable selon le schéma thérapeutique : 0,4% sous anti-PD(L)1, 1% sous anti-CTLA-4 (majoritairement ipilimumab, avec un effet-dose) et 1,2% sous combothérapie anti-PD(L)-1 + anti-CTLA-4.(de Velasco et al, 2017; Wang et al, 2018a; Ruste et al, 2021)
La cause du décès est différente selon le schéma thérapeutique (infra 6-1. ANNEXES : Tableau S2) :
- Sous anti-CTLA-4, les colites causent 50 à 75% des décès toxiques, suivies des toxicités hépatiques, cardiaques, et pulmonaires.
- Sous anti-PD(L)-1, les pneumopathies immuno-induites sont la 1ère cause de décès toxiques (15-25 % de létalité), suivies des toxicités hépatiques, coliques, cardiaques, neurologiques (encéphalite et myasthénie), et plus rarement hématologiques.
Les myocardites sont l’EI immunomédié de plus mauvais pronostic avec une mortalité de l’ordre de 50 %, probablement réduite depuis l’identification et le traitement plus précoce de cet EI (Coustal et al, 2023).
26.2.4. Chronologie des EI immunomédiés
- Les EI immunomédiés les plus précoces sont cutanés et digestifs (souvent dès les premières semaines), puis hépatiques, les atteintes pulmonaires et rénales étant plus tardives.
- Les atteintes endocriniennes et cutanées peuvent survenir à tout moment.
- Les EI immunomédiés apparaissent plus tôt sous anti-CTLA4, et d’autant plus en cas de bi-immunothérapie.(Martins et al, 2019)
Il faut toutefois garder à l’esprit la grande hétérogénéité des délais de survenue des EI immunomédiés, qui peuvent parfois être très tardifs, plus d’un an après l’initiation de l’immunothérapie, ou après son arrêt (Martins et al, 2019).
La survenue des EI immunomédiés semble d’autant plus précoce qu’ils sont graves. Effectivement les délais de survenue des EI immunomédiés létaux sont extrêmement brefs : la médiane de survenue des EI immunomédiés létaux est de 15 jours après l’initiation d’une bi-immunothérapie par anti-PD-1 + anti-CTLA-4, et de 40 jours sous monothérapie quelle qu’elle soit. 80% des myocardites surviennent dans les 3 premiers mois de traitement (Dubey et al, 2025). Les décès toxiques surviennent ainsi majoritairement dans les 2 mois suivant l’initiation du traitement (Wang et al, 2018a; Ruste et al, 2021).
La précocité de l’EI immunomédié est prédictive du risque de récidive en cas de réintroduction de l’immunothérapie (Simonaggio et al, 2019). La vigilance du clinicien doit donc être maximale lors des premières perfusions.
26.3. Bilan pré-immunothérapie
26.3.1. Contre-indications relatives et absolues
La prise en charge initiale d’un patient sous immunothérapie repose sur la prévention et l’information, ainsi que sur l’anticipation des toxicités, par un bilan de référence et un suivi pendant et après traitement.
Les contre-indications à l’immunothérapie sont rares.
Les variables cliniques et biologiques (sexe, âge, mais aussi indice de masse corporelle, comorbidités, formule leucocytaire et en particulier balance neutrophiles/lymphocytes) n’influencent pas suffisamment le risque d’EI immunomédié pour être prises en considération dans la décision thérapeutique (Jing et al, 2021; Chennamadhavuni et al, 2022).
Le génotype HLA, le profil cytokinique et la composition du microbiote intestinal ont été associés au risque de toxicité immunoinduite mais sont actuellement inutilisables en pratique clinique.
Cependant, certaines situations cliniques ou sous-groupes de patients (généralement exclus des essais thérapeutiques) peuvent impacter la décision d’initier ou non un traitement par ICI et doivent être prises en compte en pré-thérapeutique (Tableau 1).
Les recommandations des sociétés savantes permettent de clarifier certaines situations cliniques, comme par exemple l’absence de contre-indication en cas de sclérose en plaque, même si un avis neurologique est obligatoire avant l’introduction (Collongues et al, 2024).
Les ICI étant des anticorps monoclonaux, ils n’ont pas d’interaction médicamenteuse d’ordre pharmacocinétique. En revanche, certains médicaments sont susceptibles de majorer le risque de toxicité de l’immunothérapie, ou d’en réduire l’efficacité : l’initiation d’un traitement par ICI doit donc être l’occasion d’épurer l’ordonnance, de sensibiliser le patient aux risques d’automédication, et les prescripteurs à limiter les prescriptions médicales au strictement indispensable.
Il n'y a pas de donnée publiée sur l’utilisation de vaccins vivants, et la vaccination est à réaliser en fonction du risque attendu du pathogène.
Les inhibiteurs de pompe à protons (IPP) sont significativement associés à un sur-risque de toxicité rénale des ICI (environ x 3) (Stein et al, 2021; Gérard et al, 2022; Chen et al, 2023).
Les anti-inflammatoires non stéroïdiens (AINS) majorent le risque de toxicité digestive et rénale (Marthey et al, 2016; Gérard et al, 2022; Chen et al, 2023).
La primo-prescription d’ICI doit donc s’accompagner d’une revue minutieuse des médicaments co-prescrits. Si l’IPP n’est pas indiqué, il convient de l’arrêter définitivement. S’il est indispensable sur le long terme, il peut être poursuivi uniquement en absence d’alternative, même en cas de prescription d’une corticothérapie pour une toxicité immuno-médiée.
D’autres médicaments prescrits avant l’initiation de l’ICI sont susceptibles d’altérer la réponse thérapeutique, tels que les antibiotiques, glucocorticoïdes > 10 mg/j d’équivalent-prednisone, psychotropes.(Cortellini et al, 2021; Kostine et al, 2021).
Les antibiotiques sont associés à une diminution de l’efficacité des ICI lorsqu’ils sont prescrits dans le mois qui précède ou qui suit leur introduction (Kostine et al, 2021; Crespin et al, 2023).
Concernant la corticothérapie il est nécessaire de considérer deux situations :
- Corticothérapie au long cours : en discuter l’indication et chercher à en diminuer la dose avant l’introduction de l’ICI (< 10 mg/jour de glucocorticoïdes).
- Prise épisodique de corticothérapie (par exemple à visée anti nauséeuse lors d’une chimiothérapie concomitante) : absence d’effet délétère reconnu.
- En cas d’insuffisance rénale chronique, si un traitement par ICI doit être introduit, les IPP doivent être suspendus s'ils ne sont pas indispensables, afin de réduire le risque de néphrite immuno-induite (accord d’experts).
- De façon générale, toute prescription d’IPP à l’introduction des ICI doit être suspendue sauf en l’absence d’alternative (accord d’experts).
- La prescription de corticothérapie au long cours doit être réévaluée, et le dosage doit être le plus faible possible avant l’introduction de l’ICI (<10 mg/jour), afin d’assurer une meilleure efficacité anti-tumorale (accord d’experts).
Le tableau 1 ci-dessous résume les contre-indications absolues et relatives retenues par le groupe de travail.
| Contre-Indications absolues | Contre-Indications relatives |
|---|---|
| ECOG PS ≥2 si double ICI | |
| Fragilité gériatrique si double ICI ou si traitement anticancéreux + ICI | |
| Grossesse - Allaitement | |
| Toute maladie auto-immune active non contrôlée pouvant engager le pronostic vital, sans possibilité de décroître la corticothérapie et/ou les immunosuppresseurs | Maladie auto-immune pouvant potentiellement mettre en jeu le pronostic vital en cas de poussée (indication du traitement par ICI à discuter au cas par cas) |
| Antécédent de Thymome et AC anti RACh positifs | Antécédent de Thymome et AC anti RACh négatifs |
| Transplantation d’organe solide (en dehors du rein et du foie) | Transplantation rénale et hépatique |
| Infection virale chronique VHB avec charge virale positive et sans traitement anti viral | |
| Cirrhose décompensée | |
| Insuffisance rénale chronique sévère + IPP | |
| Maladie respiratoire chronique (pneumopathie interstitielle, BPCO, asthme) | |
| Cardiopathie instable* si double ICI ou si traitement anticancéreux cardiotoxique + ICI | Cardiopathie instable* |
| AINS, IPP |
* La décision doit être prise avec le cardiologue référent, en considérant la gravité de la maladie tumorale, le bénéfice attendu de l’immunothérapie, ses alternatives, mais aussi le type de cardiopathie instable, sa sévérité, la possibilité de poursuivre ou d’introduire un traitement spécifique de celle-ci sans nuire à l’efficacité de l’immunothérapie.
Tableau 1. Contre-indications absolues et relatives à l’utilisation des ICI
26.3.2. Age et état général
Les patients fragiles représentent une situation clinique complexe.
- On peut redouter que la survenue d’un EI immunomédié grave impacte fortement leur pronostic et leur qualité de vie.
- On peut également craindre une moindre efficacité des ICI, du fait de la modification de la réponse immune avec l’âge (immuno-sénescence) ou en cas d’état nutritionnel dégradé.
Les études de phase II-III portant sur des ICI ne mettent pour la plupart aucune limite d’âge à l’inclusion mais les patients y sont sélectionnés, avec un Performance Status (PS) ECOG 0 ou 1. Les patients âgés y sont sous-représentés : l’âge moyen des patients inclus dans les études pivot d’immunothérapie dans les cancers bronchiques était de 10 ans inférieur à l’âge moyen de survenue dans la population occidentale (Gomes et al, 2021).
L’état général, Performance status
La cohorte REISAMIC apporte des données « de vie réelle » particulièrement intéressantes sur les facteurs associés plus spécifiquement au risque d’EI immunomédié grave ou de décès toxique (Ruste et al, 2021). Cette cohorte monocentrique a inclus de façon prospective tous les patients traités par anti-PD(L)-1 - majoritairement en monothérapie - à l’Institut Gustave Roussy, soit 1 187 patients (environ 2/3 de mélanomes et 1/3 de cancers bronchiques, < 10 % d’autres cancers). Elle s’est intéressée à l’identification des facteurs associés au risque de survenue d’un EI immunomédié de grade 4 (très sévère) ou 5 (décès toxique), par rapport au risque d’EI immunomédié de grade 1 à 3. L’origine toxique des décès était évaluée au cas par cas après enquête de pharmacovigilance.
- Un PS ECOG ≥ 2 apparaissait particulièrement corrélé au risque de toxicité grave : 29 % des patients présentant un EI immunomédié de grade 4-5 avaient un PS≥ 2, contre 5,8 % des patients présentant un EI immunomédié de grade 1 à 3 (p=0,0004).
- Une hypo-albuminémie < 35 g/L était également associée à une fréquence plus élevée d’EI immunomédié très grave.
Une méta-analyse a comparé la survie, la réponse tumorale et les effets indésirables chez 26 442 patients traités par ICI dans des études interventionnelles ou (majoritairement) observationnelles pour un cancer bronchique, en fonction de leur PS ECOG ≤ 1 ou ≥ 2 (ces derniers représentant 15 % des patients de la méta-analyse) (Tomasik et al, 2021). Contrairement à REISAMIC, la toxicité (disponible pour 7 300 patients) n’était pas différente en fonction du PS (toutefois, le grade des EI immunomédié n’était pas détaillé).
- Le taux de réponse tumorale objective n’était pas impacté par le PS, en revanche le taux de contrôle tumoral, la survie sans progression et la survie globale étaient nettement réduits en cas de PS ECOG ≥ 2.
La divergence des résultats concernant le risque de toxicité pourrait être expliquée par l’hétérogénéité des causes conduisant à une altération du PS ≥ 2 : patients altérés du fait de la maladie tumorale, ou de leurs comorbidités ou de leur âge.
Un PS ECOG ≥ 2 est associé dans certaines études à une sur-toxicité de l’immunothérapie et en particulier à une majoration du risque d’EI immunomédié très graves, mais les revues plus récentes nuancent cela, justifiant une poursuite des efforts d’analyses prospectives (Guven et al, 2024).
- Au total, les données de la littérature suggèrent que l’ECOG PS ≥ 2 puisse être associé à une surtoxicité aux ICI mais cela ne représente pas une contre-indication absolue à sa prescription.
- Le bénéfice/risque doit être évalué au cas par cas chez les patients fragiles (accord d’experts).
L’âge
Les données sur l’utilisation des ICI chez les sujets âgés sont également limitées. Les analyses en sous-groupe en fonction de l’âge dans les études pivot manquent de puissance pour être informatives. Les séries décrivant plus spécifiquement le devenir sous ICI des patients âgés sont majoritairement des séries rétrospectives ne permettant pas de les comparer aux sujets plus jeunes.
- Une étude multicentrique rétrospective européenne et américaine a décrit 928 patients de plus de 80 ans (âge médian 83 ans) traités par ICI en monothérapie (85 % par anti-PD1 ; 1/3 pour mélanome, 1/3 pour cancer bronchique, 1/3 pour autre cancer).(Nebhan et al, 2021) Le devenir oncologique, stratifié en fonction du type de cancer traité, n’était pas différent entre les patients de 80-85 ans et ceux > 85 ans. 40 % des patients présentaient au moins un EI immunomédié de grade ≥1, et 12 % au moins un EI immunomédié de grade ≥ 3, avec 16 % d’arrêt de traitement pour ce motif. La fréquence des EI immunomédié et leur gravité étaient similaire quel que soit la tranche d’âge des patients, mais conduisait plus fréquemment à un arrêt thérapeutique chez les plus de 90 ans.
- L’étude prospective observationnelle ELDERS conforte cette observation (Gomes et al, 2021). Cette étude a comparé le devenir de 2 groupes de 70 patients, d’âge < ou > à 70 ans, traités par ICI (monothérapie, > 90 % par pembrolizumab) pour un cancer bronchique ou un mélanome. L’objectif principal était la survenue d’EI immunomédié de grade ≥ 3. La moitié des patients de la cohorte > 70 ans présentaient une fragilité gériatrique détectée par le questionnaire G8, avec en particulier plus de comorbidités et de poly-médication. Néanmoins le risque d’EI immunomédié de grade ≥ 3 n’était pas significativement différent entre les 2 cohortes. En revanche, le score G8 était prédictif du risque d’hospitalisation et de mortalité.
Le profil de tolérance des ICI en monothérapie chez les sujets âgés semble similaire à celui des sujets plus jeunes. Un sur-risque de toxicité chez les sujets âgés est en revanche décrit en cas d’association ICI + chimiothérapie, notamment pour les cancers broncho-pulmonaires (Gomes et al, 2021). Pour les cancers oeso-gastriques, les études ayant évalué l’association ICI + chimiothérapie (Keynote-590; Checkmate-648 et 649) montrent un âge médian des patients de 63-64 ans, avec 40 % > 65 ans (précisé dans Keynote-590 et Checkmate-649). Le devenir plus spécifique du sous-groupe des patients > 65 ans n’y est pas détaillé.
Concernant les cancers digestifs, et notamment les carcinomes épidermoïdes de l’œsophage, l’étude RAMONA a permis d’avoir des éléments de réponse sur la tolérance de la mono ou de la bi-immunothérapie chez les patients âgés de plus de 65 ans (Ebert et al, 2022). Les auteurs concluent à l’absence de limite sur le plan des toxicités, à confirmer par d’autres études prospectives. Les données chez le sujet âgé dans les cancers digestifs en général sont plus rares.
- Les données disponibles chez les sujets très âgés ne font pas de l’âge une contre-indication a priori à la prescription de l’immunothérapie, mais la fragilité gériatrique doit être prise en considération.
- Une prudence particulière s’impose en cas de combinaison ICI + traitement anticancéreux compte tenu du manque de données chez les sujets âgés et de la toxicité possible de ces schémas (accord d’experts).
26.3.3. Antécédents personnels
26.3.3.1. Terrain auto immun
Les patients ayant une MAI ou inflammatoire préexistante à l’initiation de l’ICI sont généralement exclus des essais et on ne dispose que de données rétrospectives portant sur des effectifs limités de patients, et de quelques études cas-contrôles et méta-analyses (Abdel-Wahab et al, 2018; Danlos et al, 2018; Tison et al, 2019; Haanen et al, 2020; Hoa et al, 2021; Ruste et al, 2021; Yamaguchi et al, 2021; Higgins et al, 2022; Pizuorno Machado et al, 2023).
Ces études décrivent un risque augmenté de poussée de la MAI sous ICI ainsi qu’un risque aggravé d’EI immunomédié chez les patients avec MAI.
Le risque de poussée de MAI sous ICI varie entre 15 et 50 % (le plus souvent 20-30 %). Ces patients étaient traités par monothérapie, surtout anti-PD(L)-1, pour quelques petites séries par anti-CTLA-4, plus rarement par bithérapie, ou par association ICI + autre traitement anti-tumoral. Ces études ont concerné de façon quasi-exclusive des patients traités pour mélanome, ou cancer bronchique. Le type de cancer étant susceptible de modifier le risque d’EI immunomédié, il est possible que celui-ci puisse également modifier, dans un sens ou dans l’autre, le risque de poussée de MAI sous ICI.
Dans la majorité des cas, ces poussées étaient décrites comme « peu sévères » et « facilement contrôlables » par les traitements usuels.
Ces observations plutôt rassurantes des auteurs doivent être nuancées.
- Tout d’abord, ces patients avaient une MAI « contrôlée » lors de l’initiation de l’ICI, et probablement peu sévère - parfois éteinte - comme en témoigne la faible proportion de patients sous traitement de fond immunosuppresseur (ou sous corticostéroïdes) à l’initiation de l’ICI (20 à 40 % seulement des patients dans la majorité de ces séries) (Haanen et al, 2020).
- Ces études étant des séries rétrospectives, il s’agissait de patients ayant une MAI suffisamment peu sévère pour que l’oncologue ait pris le risque de les traiter par ICI. Or, l’intuition selon laquelle la sévérité préalable de la MAI augmente le risque de poussée sous ICI parait confirmée (Abu-Sbeih et al, 2020; Hoa et al, 2021).
- La présence d’un traitement spécifique de la MAI à l’initiation de l’ICI ne permet pas de prévenir la survenue d’une poussée, ce qui peut traduire le fait que le risque de poussée est important chez les patients dont la MAI est suffisamment active pour nécessiter un traitement de fond (Hoa et al, 2021; Plaçais et al, 2022).
- La grande majorité de ces patients présentait une MAI dermatologique, rhumatologique ou endocrinologique, avec un risque quasi négligeable d’engager le pronostic vital en cas de poussée : psoriasis, rhumatisme inflammatoire, dysthyroïdie auto-immune.
- Les patients avec maladie inflammatoire chronique intestinale (MICI) ont un risque de 35-40 % de poussée digestive / entérocolite toxique, nettement plus élevé que chez les malades sans MICI. La moitié des entérocolites sont de grade 3-4 et conduisent à une hospitalisation ; les perforations coliques sont possibles (Abu-Sbeih et al, 2020; Pizuorno Machado et al, 2023).
- Le lupus érythémateux systémique représentait au plus 5-10 % de ces séries.
- L’hétérogénéité de ces maladies rend complexe ces analyses descriptives.
- Enfin, les MAI rares et potentiellement graves (telles que vascularites, myosites, myasthénie, sclérose en plaques, cytopénies auto-immunes, hépatite auto-immune, pneumopathies interstitielles diffuses…) ne représentaient chacune que quelques pourcentages des patients de chacune de ces séries, ou étaient totalement absentes.
La poussée de la maladie ou les toxicités du traitement conduisent à un taux d’arrêt du traitement de l’ordre de 15-20 % dans cette population (Haanen et al, 2020; Hoa et al, 2021).
- Le risque global d’EI immunomédié est significativement aggravé par un terrain dysimmunitaire (Tully et al, 2021; Yamaguchi et al, 2021; Higgins et al, 2022; Plaçais et al, 2022).
- Dans les séries cas-contrôle, appariant patients porteurs de MAI et patients indemnes, traités par ICI, le risque de survenue d’un EI immunomédié est multiplié par un facteur 1,5 à 4. Ces patients ont un risque plus élevé de multitoxicité et la survenue des EI immunomédiés peut être plus précoce.
- Néanmoins, la majorité de ces EI immunomédié paraissent de Grade I-II.
- Le taux d’arrêt de l’ICI et la mortalité des patients avec MAI n’est pas significativement différente de celle des patients contrôles dans une étude française rétrospective ayant apparié 110 patients avec MAI à 330 contrôles (Plaçais et al, 2022).
Les données sont donc assez rassurantes pour les MAI les plus fréquentes et potentiellement les moins graves (rhumatologiques, dermatologiques, endocriniennes). Il convient d’être plus prudent chez les patients ayant une MAI mal contrôlée, ou antérieurement grave, nécessitant un traitement immunosuppresseur au long cours, ou susceptible de mettre en jeu le pronostic vital ou d’altérer sévèrement la qualité de vie en cas de poussée (MICI, MAI plus rares et plus graves pour lesquelles les données sous ICI sont très peu nombreuses).
Sous ICI, les patients porteurs d’une MAI doivent être suivis de façon rapprochée. Une stratégie de mise en place, préalablement à l’initiation de l’immunothérapie, d’une biothérapie la plus spécifique possible de la MAI est défendue par Haanen et al. en raison notamment des données suggérant une altération du pronostic global en cas de traitement préalable à l’ICI par corticostéroïdes > 10 mg/j, ou par immunosuppresseurs conventionnels (Tison et al, 2019; Haanen et al, 2020). Cette stratégie doit être validée par des études prospectives.
Les données concernant les patients suivis pour un mélanome sur une étude de cohorte portant sur 4 367 patients dont 415 ayant une MAI ne montrent pas de différence en termes de taux de réponse ou de survie globale. L’incidence des EI immunomédié de grade ≥ 3 est également similaire (30 %). En revanche les patients ayant une MICI sont plus à risque de développer une colite (van der Kooij et al, 2021).
Les MAI suivantes justifient obligatoirement une évaluation préalable à l’introduction de l’ICI, par un spécialiste de la MAI, ainsi qu’une présentation en RCP dédiée aux toxicités immuno-induites (accord d’experts) :
- Myosites auto-immunes
- Myasthénie auto-immune
- Connectivites (sclérodermie, lupus…)
- Vascularites
- Sarcoïdose
- Sclérose en plaques
- MICI (RCH, maladie de Crohn)
- Hépatite auto-immune
- Thymome : en cas d’antécédent de thymome, et de positivité des anticorps anti récepteurs de l’acétylcholine (AC anti RACh) l’utilisation des ICI est formellement contre-indiquée.
En dehors des situations des MAI connue, l’impact clinique de la présence de marqueurs biologiques d’auto-immunité (tels que Facteurs antinucléaires, Facteurs rhumatoïdes, Anticorps anti-thyroglobuline ou anti-peroxydase) chez des patients asymptomatiques, avant initiation d’un traitement par ICI, est controversé.
- Cet élément est parfois associé à une augmentation du risque d’EI immunomédié, en particulier cutanés et thyroïdiens, et potentiellement associé à un meilleur pronostic oncologique sous ICI (Toi et al, 2019; Barth et al, 2022).
- Il n’apparait pas associé à un sur-risque d’EI immunomédié graves. Par conséquent le dosage de ces marqueurs n’apparait pas utile en pratique clinique puisqu’il ne modifie pas la prise en charge et ne doit pas contre-indiquer la prescription d’ICI.
En synthèse, les patients porteurs de MAI ne doivent pas être exclus des traitements par immunothérapie. De façon globale l’objectif est d’avoir la dose d’immunosuppresseur et/ou de corticoïdes la plus faible possible avant l’initiation d’une ICI, car leur utilisation avant l’initiation d’une immunothérapie est associée à une survie sans progression plus brève et une survie globale similaire. La décision de débuter une ICI doit être prise en considérant la gravité de la maladie tumorale, le bénéfice attendu de l’immunothérapie, ses alternatives, mais aussi l’histoire de la MAI, sa sévérité, son caractère contrôlé ou non, la possibilité de poursuivre ou d’introduire un traitement spécifique de celle-ci sans nuire à l’efficacité de l’immunothérapie.
- Une maladie dysimmunitaire endocrinienne, dermatologique ou rhumatologique, lorsqu’elle est bien contrôlée, n’est pas une CI aux ICI (accord d’experts).
- Pour les autres maladies dysimmunitaires pouvant potentiellement mettre en jeu le pronostic vital en cas de poussée, l’indication du traitement par ICI sera discutée au cas par cas. Ces patients sont exposés à un risque majoré d’EI immunomédié, pour la majorité non grave, et donc gérable selon les algorithmes usuels.
- Le bénéfice/risque de l’initiation d’un ICI doit être apprécié au cas par cas dans le cadre d’une réflexion multidisciplinaire (RCP dédiées aux toxicités immuno-induites).
- Une évaluation préalable par le spécialiste de la MAI est recommandée (accord d’experts).
26.3.3.2. Comorbidités / Fonctions d’organe
Les ICI étant des anticorps monoclonaux, leur clairance n’est ni hépatique, ni rénale. Une modification de la pharmacocinétique par une insuffisance rénale ou hépatique chronique n’est donc pas attendue. En revanche on peut se poser la question d’un éventuel risque de sur-toxicité chez les patients présentant une comorbidité d’organe majeure.
Les patients atteints de maladie respiratoire chronique (pneumopathie interstitielle, BPCO, asthme), fumeurs actifs ou ayant une histoire de tabagisme important, ont un risque augmenté de pneumopathie immuno-induite sous anti-PD(L)1 (Atchley et al, 2021; Yamaguchi et al, 2021; Chennamadhavuni et al, 2022). Ces résultats proviennent majoritairement d’études consacrées au cancer bronchique, situation exposant à un sur-risque de toxicité pulmonaire. Il n’est pas sûr qu’ils puissent être extrapolés aux patients traités pour d’autres types de cancers.
- Il est recommandé de réaliser une consultation avec un pneumologue expert, préalablement à l’introduction de l’ICI, en cas de maladie respiratoire chronique. Une surveillance sera alors mise en place plus précocement après l’introduction de l’ICI.
Les facteurs de risques cardiovasculaires et les cardiopathies (notamment ischémiques) sont rapportées comme susceptibles de majorer le risque d’EI immunomédié cardiaque (Tocchetti et al, 2024). Le sur-risque des EI rénaux lié à l’insuffisance rénale chronique est clairement établi, avec un effet dose (plus le DFG est bas, plus le risque augmente) (Herrmann et al, 2025).
- En l’absence d’antécédent cardiaque connu, un bilan des facteurs de risque cardiovasculaires devra être mené avant l’introduction des ICI.
L’existence d’une cardiopathie sous-jacente est retenue comme un facteur à haut risque de cardio-toxicité dans les recommandations de l’European Society of Cardiology (ESC) 2022. Cependant il semble qu’une cardiopathie préexistante soit plutôt associée à la survenue d’insuffisance cardiaque au cours du traitement plus que d’EI immunomédiés (Laenens et al, 2022; Tocchetti et al, 2024).
- Il est important que tout patient avec une cardiopathie connue soit évalué en cardiologie avec la réalisation d’une échographie cardiaque avant la mise sous traitement afin de s’assurer de la stabilité de sa maladie cardiaque et, le cas échéant, d’optimiser le traitement.
- L’échocardiographie doit également être réalisée en cas de double immunothérapie, ou combinaison ICI + molécule cardiotoxique.
Un antécédent de thymome et de positivité des AC anti récepteurs de l’Acétylcholine, (AC anti RACh) est associé à la survenue de myocardite immunomédiée, plus fréquente et plus grave (Fenioux et al, 2023).
En cas d’antécédent de thymome, et de positivité des AC anti récepteurs de l’Acétylcholine, (AC anti RACh) l’utilisation des ICI est formellement contre-indiquée (accord d’experts).
Chez les patients cirrhotiques traités pour un hépatocarcinome, la cirrhose doit être parfaitement compensée. Dans l’étude de phase III IMBrave 150 (atézolizumab+bévacizumab vs. sorafénib), comme dans l’étude Himalaya (durvalumab+trémélimumab vs. sorafénib) tous les patients étaient Child-Pugh A, et les 3/4 étaient A5. Quelques études (phase I/II pour le Nivolumab, et des séries rétrospectives) ont inclus de petits effectifs (< 50 patients) de patients Child-Pugh B, traités par mono-immunothérapie (nivolumab, pembrolizumab, ou atézolizumab + bévacizumab) (Scheiner et al, 2019; Kudo et al, 2021; D’Alessio et al, 2022; Roth et al, 2023). Le profil de tolérance paraissait similaire à celui des patients Child-Pugh A, en revanche la survie globale était fortement altérée chez les patients Child-Pugh B, en moyenne réduite de moitié. Le pronostic de ces patients est donc dominé par la sévérité de la maladie hépatique.
- La présence d’une maladie chronique respiratoire, cardiaque, rénale, hépatique, doit engager à la prudence avec un bilan pré-thérapeutique adapté ainsi qu’une surveillance rapprochée.
- Le risque de décompensation est plus sévère en cas d’EI immunomédié touchant ces organes, mais ces comorbidités ne constituent pas une contre-indication systématique à l’immunothérapie. (accord d’experts).
26.3.3.3. Cas particuliers
26.3.3.3.1. VIH, VHB, VHC
Les données concernant l’utilisation des ICI chez les patients présentant une infection virale chronique (VIH, VHB ou VHC) sont rassurantes en termes d’évolution de l’infection virale, d’effet indésirable du traitement, et d’efficacité de celui-ci (Assoumou et al, 2024).
Les patients présentant un statut VIH positif étaient exclus des essais cliniques évaluant les ICI en oncologie, en-dehors de petites études de phase I dédiées à cette population.
La cohorte prospective OncoVIHAC française et plusieurs séries rétrospectives apportent des données rassurantes (Sorotsky et al, 2019; Aguilar-Company et al, 2022; Assoumou et al, 2024).
(1) Les ICI n’impactent pas significativement l’infection par le VIH, en particulier en terme de charge virale et de taux de lymphocytes T CD4 (Abbar et al, 2020; Assoumou et al, 2024)
(2) L’infection VIH ne parait pas modifier significativement le risque de survenue d’un EI immuno-induit ni l’efficacité de l’ICI (dans la limite d’absence d’étude bras-contrôle), et les taux de réponse thérapeutique paraissent similaires à ceux chez les patients non infectés, y compris en cas de taux de lymphocyte T CD4 bas (Assoumou et al, 2024).
Plusieurs séries rétrospectives ont relaté le devenir des patients affectés, ou antérieurement affectés, d’une hépatite chronique B ou C (Shah et al, 2019; Pertejo-Fernandez et al, 2020; Nakabori et al, 2022; Nardo et al, 2023).
La présence d’une hépatite B ou C, active ou guérie, ne modifiait pas le risque d’EI immunomédié hépatique de grade 3 ou 4. Chez les patients guéris d’une hépatite B, ou en cours de traitement antiviral B ou C, il n’était pas décrit de réactivation ou d’aggravation de l’infection virale. Les deux grandes études de phase III ayant évaluée l’immunothérapie dans le carcinome hépatocellulaire ont inclus 20 à 50 % de patients infectés par le VHB ou le VHC (études IMBrave150 et Himalaya ; les patients co-infectés étaient exclus).
Les données concernant les patients infectés de l’étude IMBrave150 (atézolizumab-bévacizumab) ont fait l’objet d’une analyse post-hoc :
- la sécurité d’emploi globale du traitement ne semblait pas différente chez ces patients par rapport à l’ensemble de la cohorte.(Hsu et al, 2023) ;
- le risque de survenue d’un effet indésirable hépatique quel qu’il soit paraissait également similaire quel que soit le statut virologique du patient (de l’ordre de 15 % tous grades confondus dont 7 % d’hépatites immuno-induites traitées par corticothérapie) ;
- le risque de réactivation virale (re-positivation, ou majoration significative de la charge virale) était faible et sans aucune poussée cytolytique.
Par ailleurs, dans le carcinome hépatocellulaire, l’étiologie virale de la cirrhose et en particulier l’hépatite B apparait favorable à la réponse thérapeutique aux ICI (Pfister et al, 2021; Cheng et al, 2022).
- L’utilisation des ICI n’est pas recommandée au cours de la grossesse ou de l’allaitement (accord d’experts).
- Chez les patientes en âge de procréer, une contraception efficace est nécessaire pendant toute la durée du traitement et jusqu’à un à cinq mois après la dernière injection.
26.3.3.3.3. Transplantés
Les patients transplantés d’organes solides traités par ICI ont un risque élevé de perte de leur greffon, avec survenue d’un rejet dans 40-50 % des cas (d’Izarny-Gargas et al, 2020), même si ce risque semble atténué par l’adaptation du traitement anti-rejet, notamment chez les receveurs d’allogreffe rénale (Carroll et al, 2022; Venkataraman et al, 2024).
- Les transplantés rénaux ont la possibilité de revenir en dialyse : ainsi la contre-indication est relative pour les patients porteurs de greffons rénaux. La discussion est menée en fonction du pronostic oncologique, de la date de la greffe et du type d’ICI envisagé pour le patient (monothérapie, combinaisons…).
- Les autres patients transplantés d’organes sont en règle générale contre-indiqués à l’immunothérapie, mais les données sont rares pour les patients transplantés cardiaques ou pulmonaires (Kawashima et al, 2022).
- La transplantation hépatique est une contre-indication relative.
- Concernant les patients ayant reçu une greffe allogénique de cellules souches hématopoïétiques, la discussion entre le patient, l’oncologue et le médecin responsable de la greffe doit impérativement être menée avant introduction de l’ICI (Institut national du cancer, 2024).
Une cohorte française en cours de publication, sur une série de patients traités par ICI post transplantation, nous apportera plus d’éléments de réflexion, et confortera probablement la transplantation hépatique en contre-indication relative, surtout quand le patient est greffé depuis plusieurs années.
26.3.4. Examens complémentaires pré ICI
Le tableau 2 résume le bilan biologique pré-thérapeutique recommandé, à réaliser dans les 10 à 15 jours avant l’initiation d’un ICI.
- Bien que cela soit couramment pratiqué et stipulé dans certaines recommandations, il n’est pas utile de rechercher à titre systématique des signes biologiques d’auto-immunité (anticorps antinucléaires…) car, en l’absence de symptômes, leur présence n’est pas prédictive de la survenue d’une toxicité (Barth et al, 2022).
- De même, les valeurs pré thérapeutiques de la lipasémie n’ont pas de valeur prédictive d’une toxicité pancréatique chez les patients asymptomatiques (Michot et al, 2018; Abu-Sbeih et al, 2019b; Grimmelmann et al, 2021). En revanche, la lipasémie est recommandée par l’INCA au moment du prélèvement pré ICI afin d’avoir une valeur de référence en cas d’évènement ultérieur. Le groupe de travail ne recommande pas sa mesure systématique en pré-thérapeutique (avis d’experts).
Le groupe de travail recommande donc de réaliser systématiquement :
- Sur le plan général : Ionogramme sanguin, créatininémie avec DFG, bilan hépatique complet, hémogramme, Beta HCG si patiente en âge de procréer
- Endocrinien : HbA1c, TSHus, T4L si TSH anormale, Glycémie veineuse (à jeun), Cortisolémie à 8h
- Cardiaque : Troponine, ECG, Bilan lipidique complet, Peptides natriurétiques (PN=BNP ou Nt-pro BNP), CPK de référence
- Rénal : Protéinurie / créatininurie sur échantillon urinaire, ECBU
- Pulmonaire : Imagerie pulmonaire (scanner > RP), Mesure de la SaO2
- Viral : Sérologies VIH, VHC, VHB
Organe à risque
| REFERENCE Bilan pré-thérapeutique | OPTION Bilan optionnel |
|---|---|---|
| Bilan biologique général | Hémogramme, Ionogramme sanguin Créatininémie avec DFG Bilan hépatique complet Beta HCG si patiente en âge de procréer | |
| Endocrinien | HbA1c TSHus, T4L si TSH anormale Glycémie veineuse (à jeun) Cortisolémie à 8h | |
| Cardiaque | Troponine ECG Bilan lipidique complet Peptides natriurétiques (PN=BNP ou Nt-pro BNP) CPK | Si cardiopathie connue, ou si double immunothérapie, combinaison ICI + molécule cardiotoxique Echocardiographie cardiaque trans-thoracique |
| Pancréatique | Lipasémie | |
| Rénal | Protéinurie/créatininurie sur échantillon urinaire ECBU | |
| Pulmonaire | Imagerie pulmonaire (scanner > RP) Mesure de la SaO2 | Consultation pneumologique |
| Viral | Sérologies VIH, VHC, VHB | Quantiféron si anti CTLA4 en monothérapie ou si bi-immunothérapie (ou combinaison avec un TKI) |
Tableau 2 : Bilan biologique morphologique et fonctionnel pré-thérapeutique recommandé et optionnel avant l’initiation d’un ICI
26.3.5. Références et options de bilan pré-thérapeutique
REFERENCES :
Le bilan pré-thérapeutique doit être réalisé avant toute introduction d’ICI : recueillir dans le dossier médical les éléments suivants (accord d’experts) :
- Cliniques (pour le dépistage des complications et pour l’interprétation des examens ultérieurs) : âge, antécédents médicaux (en particulier de maladie auto-immune, les comorbidités cardiaques, respiratoires, rénales, hépatiques, endocriniennes, les facteurs de risque cardiovasculaires, les antécédents thromboemboliques), traitements habituels ou ponctuels. L’état cutané et le transit intestinal du patient sont évalués avant l’initiation du traitement.
- Paraclinique : Il diffère d’une société savante à une autre mais le groupe propose :
- Un bilan biologique : hémogramme, ionogramme sanguin, créatininémie avec DFG, bilan hépatique complet, protéinurie-créatininurie sur échantillon urinaire, ECBU, Troponine, CPK, Bilan lipidique complet, HbA1c, Glycémie veineuse (à jeun), TSHus, T4L si TSH anormale, Cortisolémie à 8h, Sérologies VIH, VHC, VHB, Beta HCG (si patiente en âge de procréer), Peptides natriurétiques.
- Une imagerie thoracique (radiographie thoracique au minimum, mais le scanner est le plus souvent disponible dans le bilan d’extension) associée à la mesure de la SaO2.
- Une vigilance particulière quant au risque de toxicité cardiaque, qui peut se manifester de façon fruste avant d’engager le pronostic vital.
o ECG pré-thérapeutique : bilan de référence minimal.
o Le tracé ECG de référence est conservé dans le dossier du patient, et un exemplaire lui est remis qu’il doit avoir sur lui, afin de pouvoir servir à tout moment de comparateur.
o Dosage de la troponine est également nécessaire comme valeur de référence. Ce dosage devra être réalisé au cours du suivi dans le même laboratoire afin d’assurer son interprétabilité.
o La réalisation systématique d’une échocardiographie cardiaque trans-thoracique apparaît indispensable dans les situations les plus à risque : double immunothérapie, combinaison ICI + molécule cardiotoxique. - Une évaluation préalable par le spécialiste d’organe en cas de MAI ou de comorbidité cardiaque ou pulmonaire est recommandée.
OPTIONS :
- Dépistage d’une infection tuberculeuse latente par une IDR à la Tuberculine ou un Quantiferon est optionnel, dans l’hypothèse d’un traitement anti-TNF (avis d’experts). Cette attitude est conseillée notamment avant initiation d’un traitement par anti CTLA4 en monothérapie, ou de double immunothérapie (ou lors de l’association immunothérapie/TKI), schéma le plus à risque de toxicité digestive.
- Dosage de la lipasémie optionnel (avis d’experts).
26.4. Surveillance pendant le traitement
Il est important pour l’oncologue de constituer son réseau de prise en charge des immuno-toxicités, avec un spécialiste identifié pour chaque organe « à risque » de toxicité, afin de disposer rapidement d’un interlocuteur sensibilisé à cette « néo-pathologie » en cas de nécessité d’une expertise diagnostique et thérapeutique. L’existence de RCP dédiées aux toxicités immunomédiées permet l’accès à ces expertises, ainsi qu’à la déclaration des EI immunomédiés de grade ≥ 3.
La distribution de ces RCP en France est disponible sur le lien suivant permettant l’accès aux RCP régionales : https://adiresca.fr/les-dispositifs-specifiques-regionaux-du-cancer
Pour le spécialiste correspondant, l’apprentissage de la gestion de ces toxicités s’avère similaire aux maladies inflammatoires rencontrées dans chacune des spécialités, même s’il existe quelques spécificités. Malgré la connaissance accumulée concernant les formes les plus fréquentes d’EI immunomédiés, des toxicités rares et inattendues peuvent survenir.
- Le patient doit être informé de la nécessité de contacter son équipe soignante lors de tout nouveau signe ou symptôme, détaillés ci-après.
- Une contraception efficace doit être menée pendant le traitement et 1 à 5 mois après la fin de l’ICI.
26.4.1. Définition des grades de toxicité
La toxicité doit être gradée en utilisant les échelles du NCCN (de 1 : effet indésirable bénin, à 4 : effet indésirable engageant le pronostic vital, 5 étant le décès toxique) car ces échelles sont à la base de toutes les recommandations de prise en charge et permettent un dialogue facile entre l’oncologue et le spécialiste d’organe.
Les toxicités de grade 2 représentent souvent une situation charnière nécessitant une évaluation précise et régulière afin de détecter une évolution rapide vers un grade plus élevé, en particulier en cas de bi-immunothérapie.
Dans la reconnaissance précoce de l’EI immunomédié, l’éducation du patient est primordiale.
• Les patients doivent être sensibilisés à la nécessité de signaler tout symptôme nouveau même léger en particulier asthénie, dyspnée, douleurs ou faiblesse musculaire, douleur thoracique… afin d’orienter les examens complémentaires.
• Cette éducation est d’autant plus nécessaire en cas de combinaison d’immunothérapie. Dans tous les cas il est indispensable de fournir au patient les numéros de téléphone à composer pour joindre le service responsable de sa prise en charge.
26.4.2. Surveillance clinico-biologique
Sous traitement, à chaque cycle, le patient doit être précisément interrogé sur les symptômes éventuels avec une vigilance particulière sur l’asthénie, la dyspnée, la douleur thoracique, les palpitations, le nombre et la consistance des selles…
26.4.2.1. Dépistage des toxicités très fréquentes
26.4.2.1.1. Surveillance dermatologique
La toxicité cutanée est la plus fréquente des ICI (survenant chez >70 % des patients et représentant >50 % des EI immunomédiés tous grades confondus dans les études dédiées au mélanome et aux cancers bronchiques) et souvent la plus précoce (6 premières semaines de traitement).
- Elle est le plus souvent bénigne et ne nécessite que rarement une interruption du traitement (3 % des EI immunomédiés cutanés sont de grade 3-4).
- Les manifestations les plus fréquentes sont un prurit ou un rash maculo-papuleux aspécifique (cf. infra 7-1. ANNEXES : Tableau S3, Grades des toxicités cutanées).
- Des lésions cutanées plus évocatrices d’un mécanisme immunologique peuvent également survenir (dermatose bulleuse, lésions lupiques, éruption lichénoïde, psoriasis, lésions cutanées de sarcoidose associées à une atteinte ganglionnaire et/ou viscérale, dermatoses neutrophiliques de type syndrome de Sweet ou pyoderma gangrenosum, etc.).
- Le vitiligo se manifeste surtout chez les patients traités par ICI pour mélanome.
- Il faut néanmoins savoir identifier les exceptionnelles formes graves de toxicité cutanée qui sont similaires aux autres toxidermies : syndrome de Lyell, syndrome de Stevens-Johnson, DRESS (drug reaction with eosinophilia and systemic syndrome), exanthème pustuleux aigu généralisé (PEAG) et les vascularites à expression cutanée.
- L’évaluation de la gravité repose sur l’extension cutanée (> 30% de la surface du corps = grade 3 – Figure 1), la présence de décollements cutanés ou de signes généraux (fièvre, altération de l’état général), ou d’une hyper éosinophilie.
- Certaines de ces manifestations cliniques graves sont le reflet d’une hypersensibilité et doivent être bilantées par les spécialistes dermatologues et/ou allergologues (cf. TNCD hypersensibilité aux anticancéreux).
Au cours du traitement par ICI, un examen cutané et des muqueuses est donc recommandé.
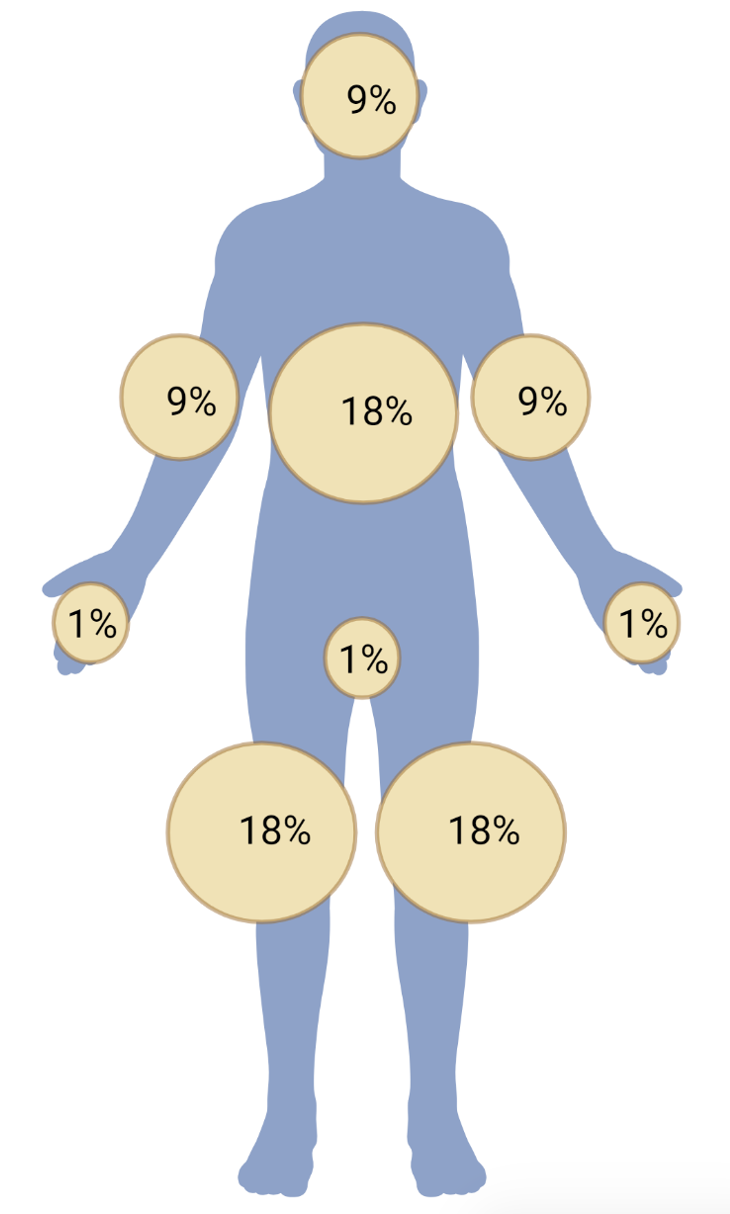
Figure 1. La règles des 9 de Wallace pour calculer la surface corporelle atteinte par les lésions cutanées induites par les ICI.
26.4.2.1.2. Surveillance endocrinienne
Les EI immunomédiés endocriniens surviennent chez approximativement 10 % des patients sous ICI, à tout moment du traitement (Barroso-Sousa et al, 2018 ; Husebye et al, 2022).
- Ils sont dominés par les hypothyroïdies notamment sous anti-PD(L)1, suivies des hyperthyroïdies (le plus souvent transitoires, précédant l’hypothyroïdie).
- Les autres manifestations, beaucoup plus rares, sont l’hypophysite (avec insuffisance antéhypophysaire, surtout sous anti-CTLA-4), l’insuffisance surrénalienne périphérique (de type maladie d’Addison) et le diabète sucré (cf. infra 7-1. ANNEXES : Tableau S4, Grades des toxicités endocriniennes).
- Les symptômes sont ceux habituellement rencontrés dans ces affections, souvent initialement aspécifiques (asthénie, amaigrissement, troubles digestifs…). Des manifestations inflammatoires peuvent se surajouter (troubles visuels, céphalées en cas d’hypophysite, goitre thyroïdien douloureux).
La survenue brutale de l’endocrinopathie, si elle n’est pas correctement dépistée, peut entraîner des tableaux cliniques sévères (insuffisance surrénalienne, acidocétose diabétique…), ce qui motive les dosages biologiques systématiques au cours du suivi.
26.4.2.1.3 Surveillance digestive (colique)
L’EI immunomédié digestif le plus fréquent est l’entérocolite immuno-induite (Collins et al, 2017; Soularue et al, 2018). Le côlon est le deuxième organe le plus fréquemment touché par l’immuno-toxicité, après la peau et le premier organe à l’origine d’une toxicité sévère.
- La diarrhée de tout grade survient chez 35-50 % des patients sous anti-CTLA-4 et 10-20 % sous anti-PD(L)-1.
- La colite sévère, requérant un traitement spécifique, survient chez 5-10 % des patients sous anti-CTLA-4, 2-5 % sous antiPD(L)-1, et 13 % sous bi-thérapie. Ces chiffres sont ceux d’essais majoritairement conduits chez les patients atteints de mélanome.(Wang et al, 2017) Les colites sont la cause de 70 % des décès toxiques sous anti-CTLA-4 (Wang et al, 2018a). La précocité de la prise en charge pourrait réduire ce chiffre.
- Elle peut survenir dès le 1er cycle de traitement par ICI (en particulier sous anti-CTLA-4) mais à tout moment, y compris après son arrêt (jusqu’à un an après l’arrêt d’un anti-PD1).
- Le risque de colite est majoré par la prise d’AINS (Marthey et al, 2016).
- Le symptôme principal est la diarrhée, isolée ou associée à des douleurs abdominales, parfois des rectorragies, de la fièvre.
- Les formes sévères se présentent comme une colite aiguë grave (signes généraux, retentissement hydro-électrolytique et nutritionnel, mégacôlon toxique, avec risque de perforation colique). Elles surviennent principalement chez les malades pris en charge tardivement et de manière inefficace. Les modalités de prise en charge diagnostique et thérapeutique des colites immuno-induites ont été détaillées dans les recommandations pratiques de l’AGA et de l’ESMO (Dougan et al, 2021; Haanen et al, 2022).
Le gastroentérologue à un rôle clé dans la prise en charge de ces patients dès la survenue d’une toxicité de grade 2 (cf. infra 7-1. ANNEXES : Tableau S5, Grades des toxicités gastro-intestinales).
En-dehors des colites immuno-induites, d’autres formes cliniques de toxicité digestive sont décrites :
• colite microscopique (plus tardive, tableau clinique de diarrhée hydro électrolytique avec risque d’hypokaliémie et de déshydratation, lésions histologiques de colite lymphocytaire ou collagène, avec endoscopie normale ou plages d’érythème) ;
• œsophagites, gastrites ou duodénites (se manifestant par des douleurs épigastriques, des nausées et des vomissements) ;
• jéjunites ou iléites isolées ;
• atrophie villositaire, révélation d'une maladie cœliaque. Plus rarement, une diarrhée sous ICPI peut être liée à une insuffisance pancréatique exocrine (Dougan et al, 2021).
26.4.2.2. Dépistage des toxicités fréquentes (1-5 %)
26.4.2.2.1. Surveillance pulmonaire
Les EI immunomédiés pulmonaires regroupent des entités pathologiques hétérogènes, la plus fréquente étant la pneumopathie interstitielle immuno-induite (cf. infra 7-1. ANNEXES : Tableau S6, Grades des toxicités pulmonaires). Des bronchiolites et des granulomatoses immuno-induites de type sarcoïdose peuvent également survenir.
• Les pneumopathies immuno-induites sont surtout associées aux anti-PD-1, avec une forme sévère chez 1 % des patients traités (majoré en cas de bi-immunothérapie).
• La présence d’une pathologie respiratoire chronique (en particulier une pneumopathie interstitielle sous-jacente) étant susceptible d’augmenter ce risque, un avis spécialisé doit être pris chez ces patients avant l’initiation du traitement.
• La radiothérapie thoracique peut majorer le risque de pneumopathie interstitielle diffuse (effet recall).
• Le symptôme prédominant est la dyspnée, parfois la toux, douleur thoracique, fièvre.
• En cas de doute clinique, il est nécessaire de mesurer la SaO2 en air ambiant, et au moindre doute de pneumopathie immuno-induite, de réaliser un scanner thoracique en urgence, si possible avec injection de produit de contraste iodé (pour éliminer le diagnostic d’embolie pulmonaire et celui d’une pneumopathie infectieuse).
26.4.2.2.3. Surveillance hépatique
- La toxicité hépatique est fréquente sous tous les ICI et en règle générale asymptomatique sauf en cas d’ictère, signant alors un grade 3, ou avec des symptômes aspécifiques (asthénie, anorexie, fièvre). Elle survient chez 5-10% sous mono-ICI (1-2 % de grades 3-4) et 25-30 % sous bi-ICI (15 % de grades 3-4).
- Sa fréquence est également augmentée en cas d’association ICI + autre traitement, ce qui rend difficile l’identification de l’agent causal (Haanen et al, 2022). Le diagnostic est en général fait lors de la surveillance en routine du bilan hépatique (recommandé avant chaque cure), montrant l’apparition d’une hépatite cytolytique aiguë, cholestatique, ou mixte.(Hountondji et al, 2023)
- Prise en charge, cette toxicité est une cause exceptionnelle de décès.
- Les autres causes d’hépatite aigue doivent être recherchées, virales (sans oublier l’Hépatite E), médicamenteuses et toxiques autres, tumorale sur progression hépatique, ou vasculaire.
- Les marqueurs auto-immuns hépatiques sont généralement négatifs.
La ponction-biopsie hépatique est nécessaire en cas de doute sur le médicament causal, ou de corticorésistance avant d’initier un traitement immunosuppresseur.
Plusieurs formes histologiques sont décrites.
- Les hépatites lobulaires sont les plus fréquentes, les hépatites granulomateuses sont notamment décrites sous anti-CTL4-A (De Martin et al, 2018).
- D’autres formes d’EI immunomédié hépatiques sont décrites, notamment une atteinte cholangitique des gros canaux, et des maladies à IgG4 immuno-induites.
26.4.2.3. Dépistage des toxicités rares (≤ 1 %)
26.4.2.3.1. Surveillance cardiaque
Différentes formes d’EI immunomédiés cardiaques sont décrites, la myocardite étant la plus fréquente d’entre elles et la plus grave, malgré une meilleure connaissance et un dépistage plus précoce ayant permis une réduction de la mortalité (Coustal et al, 2023; Lehmann et al, 2023; Dubey et al, 2025).
- Les formes rares "triples" associant myocardite + myosite + syndrome myasthéniforme sont les plus graves avec des taux de mortalité qui restent élevés.
- Les dosages systématiques de la troponine chez les patients asymptomatiques traités par ICI ont révélé une fréquence de ces EI immunomédiés de l’ordre de < 5 % des patients. Les formes graves sont rares (< 0,1 % des patients sous anti-PD(L)-1 et < 0,5 % des patients sous bithérapie anti-PD-1+anti-CTLA-4) même si, compte tenu de la rareté de l’évènement, son incidence ne peut être établie précisément.
- Il s’agit de l’EI immunomédié ayant la létalité la plus élevée (environ 50 %), par mort subite sur trouble du rythme ou conductif, ou par défaillance cardiaque avec choc cardiogénique.
- Les myocardites, péricardites, vascularites cardiaques, troubles conductifs aigus, sont en général précoces (75 % au cours des 4 premiers cycles de traitement).
- D’autres manifestations cardiaques peuvent survenir plus tardivement (arythmies, accidents coronariens aigus, défaillance cardiaque immuno-induite non inflammatoire).
- Le diagnostic d’EI immunomédié cardiaque est suspecté devant une dyspnée, douleur thoracique, palpitations, malaise, asthénie intense, œdèmes périphériques…
- Les symptômes sont parfois masqués par ceux d’un autre EI immunomédié (hyperthyroïdie, pneumopathie, myosite…).
- Une myocardite peut être parfaitement asymptomatique initialement et peut évoluer vers une forme grave.
La société européenne de cardiologie a publié des recommandations de suivi en fonction du risque cardiovasculaire, reprises par l’INCa (Figure 2).
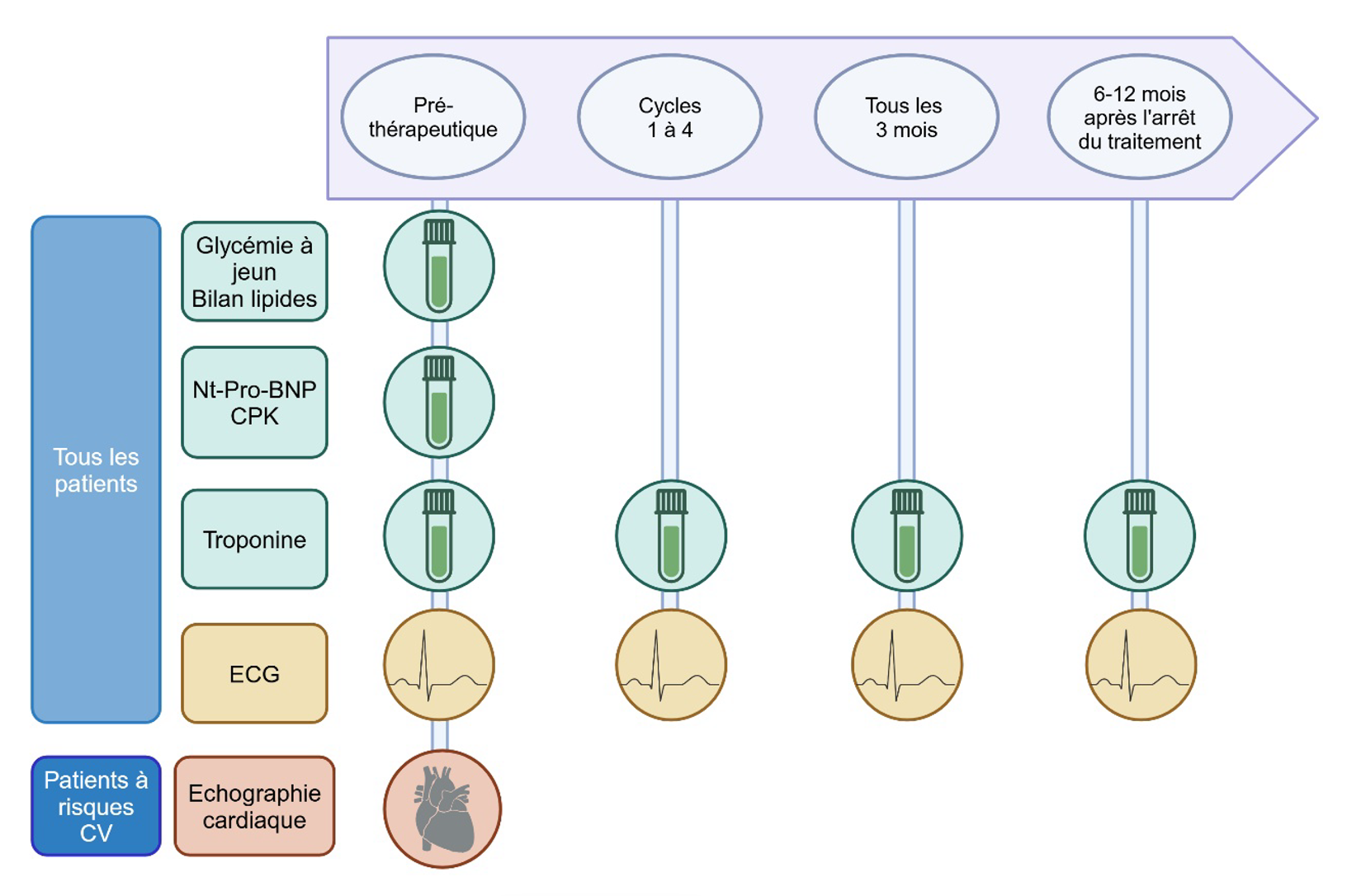
Figure 2. Surveillance cardiovasculaire des patients traités par ICI. (CV : cardiovasculaire).
26.4.2.3.2. Surveillance neurologique et musculaire
Les complications neurologiques liées aux ICI sont rares (1 à 5 % des patients) mais potentiellement graves, nécessitant une reconnaissance rapide pour une prise en charge appropriée.
- Les symptômes neurologiques varient en fonction des zones touchées du système nerveux et peuvent se manifester à tout moment, généralement entre 1 et 4 mois après l’initiation du traitement (Lopes et al, 2025).
- La complication la plus fréquente est l’atteinte neuromusculaire (30 % des cas) liée soit à une myosite soit à un syndrome myasthénique avec anticorps anti-RACH. Elle est évoquée devant des myalgies, une fatigabilité musculaire, une dysphagie ou une atteinte oculomotrice. Cette complication est potentiellement mortelle du fait de son association à des troubles respiratoires dans 40 % des cas ou à une myocardite dans 30 %.
- Des complications neurologiques périphériques comme le syndrome de Guillain-Barré ou les atteintes des nerfs crâniens, représentent également une complication fréquente, accompagnées de déficits sensoriels, sensitifs ou moteurs spécifiques.
- Parmi les complications neurologiques centrales, l’encéphalite est la plus fréquente. Elle se caractérise par une altération de la vigilance, des troubles cognitifs, des crises convulsives, ou des troubles psychiatriques.
- Les symptômes plus focaux comme des déficits moteurs et sensitifs évoquent une myélite.
- Une méningite aseptique peut se manifester par des céphalées, une raideur de nuque modérée, une photophobie et parfois une fièvre, sans altération significative de la conscience.
- De façon générale, tout nouveau symptôme neurologique survenant après le début d’un traitement par ICI doit alerter et motiver des investigations diagnostiques urgentes incluant :
a. dosage des CPK en cas de suspicion de myosite ;
b. IRM cérébrale et ponction lombaire en cas de suspicion d’atteinte centrale ;
c. EMG en cas d’atteinte périphérique ;
d. d’autres tests biologiques pour écarter des causes infectieuses ou paranéoplasiques. - Un avis neurologique doit être sollicité en urgence et le traitement par ICI suspendu jusqu’à confirmation du diagnostic.
26.4.2.3.3. Surveillance hématologique
Les toxicités hématologiques sont rares (< 5 %) mais potentiellement graves car se manifestant le plus souvent de façon très brutale, précocement dans les 3 premiers mois de traitement et d’emblée sévère (> 70 % de grades 3-4) (Michot et al, 2019).
- Elles surviennent presque exclusivement sous anti-PD(L)1.
- Elles se manifestent par une ou des cytopénies de mécanisme varié, central ou, le plus souvent, périphérique (anémie hémolytique auto-immune, purpura thrombopénique immunologique, purpura thrombotique thrombocytopénique, aplasie médullaire, syndrome hémolytique et urémique, neutropénie périphérique).
- Chez les patients traités par une association ICI + chimiothérapie, l’identification de l’étiologie immunologique des cytopénies peut s’avérer particulièrement difficile.
- D’autres formes peuvent survenir, comme des hyperéosinophilies le plus souvent modérées et asymptomatiques (Bernard-Tessier et al, 2017), des troubles de la coagulation par hémophilie acquise, ou le syndrome d’activation macrophagique (=lymphohistiocytose hémophagocytaire) qui associe fièvre, hépato-splénomégalie, cytopénies, hyperferritinémie et hypertriglycéridémie (Diaz et al, 2023).
Un avis hématologique rapide est nécessaire, avec réalisation d’un myélogramme.
26.4.2.3.4. Surveillance néphrologique
Les toxicités rénales sont rares (< 5 %) mais potentiellement graves.
- Les trois facteurs de risque connus et identifiés de toxicité rénale sont : l’existence d’une maladie rénale chronique préalable, l’exposition à un IPP, et une combinaison d’ICI (en particulier ipilimumab+nivolumab).
- Les signes cliniques sont inconstants mais il faut rechercher des variations de poids, une HTA de novo ou l’aggravation d’une HTA pré-existante, des œdèmes déclives ou une oligo-anurie. Ces signes sont le témoin d’une baisse déjà importante du DFG ou les symptômes d'une atteinte systémique touchant également les reins. Si l’élévation aiguë du taux de créatinine est habituellement bien repérée, correspondant à une insuffisance rénale aiguë (IRA), les augmentations lentement progressives demandent à confronter la créatininémie à son taux de référence avant l’immunothérapie.
- Une dégradation lente de la fonction rénale a de fort risque de passer inaperçue sans cette vigilance particulière. Le suivi du débit de filtration glomérulaire (DFG) estimé pour les baisses progressives permet de détecter ces situations.
- Le recours au néphrologue devant une situation d’IRA potentiellement liée à l’immunothérapie est proposé dès que la créatinine augmente de 26 µmol/l en 48h (la créatininémie devant être monitorée en cas de situation d’IRA).
La majorité des IRA au cours d’un traitement par immunothérapie ne sont pas des atteintes parenchymateuses (IRA obstructive, fonctionnelle).
La réalisation d’une imagerie rénale (échographie ou scanner non injecté) est indispensable.
- Des cas d’obstructions par urétérites auto-immunes ayant été rapportés, l’imagerie doit être renouvelée au moindre doute.
- Il est très difficile de distinguer cliniquement la molécule responsable de l’atteinte rénale en cas d’utilisation concomitante d’une immunothérapie ou d’une chimiothérapie néphrotoxique.
- Il est important de documenter histologiquement l’atteinte pour guider au mieux le traitement, et les recommandations sont décrites par les sociétés savantes (Gueutin et al, 2025), avec possibilité de discussion en RCP nationale d’onconéphrologie mensuelle. Dans 93 % des cas où l’ICI est en cause, la toxicité de l’ICI se traduit par une néphrite interstitielle aiguë (NIA).
- La biopsie rénale est un élément clé du diagnostic, compte tenu des autres causes d’atteintes rénales que la NIA dans le contexte du traitement du cancer.
- Elle permet de confirmer histologiquement la NIA et de ne pas suspendre l’immunothérapie à tort.
- Elle évite une exposition inutile à la corticothérapie non dénuée de complications et l’impact potentiellement délétère des stéroïdes sur l’efficacité du traitement du cancer. Le recours à la biopsie doit être systématiquement discuté avec un néphrologue.
26.4.3. Examens complémentaires systématiques : dépistage des toxicités immuno-induites asymptomatiques ou pauci-symptomatiques
Les examens paracliniques à renouveler à chaque cure ou périodiquement au cours du traitement sont synthétisés dans le tableau 3 et Annexe 7-7 Figure S1.
Organe à risque
| REFERENCE Bilan intercure recommandé | OPTION Bilan optionnel |
|---|---|---|
| Bilan biologique général | • Hémogramme • Ionogramme sanguin • Créatininémie avec DFG • Bilan hépatique complet | |
| Endocrinien | • Glycémie à jeun L’ensemble est à réaliser à chaque cycle pendant 6 mois puis tous les 2 cycles pendant la durée du traitement ou en cas de point d’alerte clinique | |
| Cardiaque | • Troponine cTN pendant les 4 premiers cycles puis tous les 3 mois • ECG pendant les 4 premiers cycles puis tous les 3 mois | |
| Rénal | • Protéinurie/créatininurie sur échantillon urinaire à chaque cycle • ECBU à chaque cycle |
Tableau 3 : Examens paracliniques à renouveler périodiquement au cours du traitement
26.4.4. Prise en charge des toxicités immuno-induites
26.4.4.1. Généralités
Les généralités sur les prises en charge des EI immunomédiés sont illustrées en annexe et résumées ci-dessous (cf. infra 7-8. ANNEXES : Figure S2). Ce tableau général de prise en charge ne s’applique pas aux toxicités endocriniennes par exemple, qui ne nécessitent généralement pas de corticothérapie et qui ne sont habituellement pas une contre-indication à la poursuite d’une immunothérapie.
- Initier une corticothérapie : une fois les diagnostics différentiels écartés, la quasi-totalité des EI immunomédiés sont traités en 1ère intention par corticothérapie, en sus des mesures symptomatiques.
- Les toxicités endocriniennes (thyroïdite, diabète sucré, hypophysite) font exception : elles ont pour particularité d’être définitives et d’être prises en charge par hormonothérapie substitutive (hormones thyroïdiennes, hydrocortisone, insuline…), sans nécessité d’interrompre l’immunothérapie et sans recours aux corticoïdes (sauf atteinte glandulaire très inflammatoire).
- Plusieurs études suggèrent un impact négatif de la corticothérapie sur la survie lorsque celle-ci est initiée avant le traitement par ICI, ce qui est possiblement la traduction non d’un effet négatif direct de la corticothérapie sur l’efficacité du traitement mais plutôt d’une maladie cancéreuse grave car symptomatique (Cortellini et al, 2020; Buti et al, 2021; Skribek et al, 2021).
- En revanche cet impact négatif de la corticothérapie sur le pronostic oncologique n’est pas retrouvé dans les études rétrospectives lorsque la corticothérapie est introduite pour gérer un EI immunomédié (Horvat et al, 2015; Aldea et al, 2020; Dupont et al, 2020; Skribek et al, 2021; Wang et al, 2021; Van Buren et al, 2023).
Dans la majorité des situations, l’efficacité de la corticothérapie est jugée après 72 h de traitement.
L’absence d’amélioration fait rechercher des diagnostics différentiels, en premier lieu les causes infectieuses (pneumopathie, colite…).
- Si la recherche est négative, on évoquera une toxicité corticorésistante.
- Si le patient a été traité à faible dose et par voie orale, il reste possible d’optimiser le traitement jusqu’à 1 à 1,5 mg/kg par voie IV, en hospitalisation.
- En l’absence de réponse après 72 h, il s’agit d’une cortico-résistance vraie nécessitant l’ajout rapide d’un traitement immunosuppresseur.
- Après réponse complète à la corticothérapie d’attaque (retour à un grade < 1), le sevrage est rapidement débuté, après 48 h de traitement, en général conduite sur 4-6 semaines (6-8 semaines pour certaines toxicités sévères), par paliers de 10 mg jusqu’à 20 mg puis par paliers de 5 mg, tous les 3 à 7 jours.
- Le passage de la forme IV à la forme orale se fait à posologie au moins équivalente.
- Après une corticothérapie prolongée, une recherche d’insuffisance surrénalienne doit être réalisée avant arrêt complet du traitement (à faire 24 h après la dernière prise, soit au palier de dose de 5 mg/jour de Prednisone, soit après relais par Hydrocortisone 10 mg matin + 5 mg midi).
- La corticothérapie lorsqu’elle doit être prolongée plusieurs semaines nécessite une prévention des risques associés : supplémentation en calcium et vitamine D, prophylaxie infectieuse (notamment de la pneumocystose, nécessaire en cas de corticothérapie ≥ 20 mg/j pendant > 4 semaines, ou > 30 mg/j pendant > 3 semaines), dépistage d’un diabète sucré. La corticothérapie est le principal facteur de risque de complication infectieuse et de complication infectieuse grave sous ICI (Guo et al, 2023).
- Un traitement immunosuppresseur d’épargne cortisonique doit être envisagé en cas de mauvaise tolérance de la corticothérapie, ou chez les patients les plus à risque de complication (hypertension artérielle, diabète sucré, glaucome…).
- Compte tenu du risque de néphrite lié à la prise d’IPP, la prescription d’IPP à titre systématique à l’instauration de la corticothérapie doit être reconsidérée en discutant d’autres alternatives (pansements gastriques ou anti H2).
- Discuter les alternatives à la corticothérapie, qui existent pour la majorité des toxicités.
- Il s’agit d’immunosuppresseurs conventionnels, d’agents biologiques (anti-TNF, vedolizumab, anti-IL6, Immunoglobulines…) ou d’anti-JAK.
- Ces traitements doivent être envisagés précocement en cas de non-réponse à la corticothérapie (corticorésistance) soit dès 72 h de traitement par corticoïdes bien conduit (ils sont alors ajoutés à la corticothérapie), ou plus tard en cas de cortico-dépendance (traitement d’épargne cortisonique) en raison des effets indésirables attendus d’une corticothérapie poursuivie plusieurs semaines à forte dose.
- Les connaissances sur leur impact éventuel sur le pronostic oncologique et l’efficacité de l’immunothérapie restent limitées, mais les données disponibles sont rassurantes (Lesage et al, 2019; Parvathareddy et al, 2023).
De façon générale les recommandations sont donc les suivantes :
- Toxicités de grade 1 :
- traitement symptomatique ;
- poursuite de l’immunothérapie, sauf toxicité cardiaque et certaines toxicités neuromusculaires et hématologiques.
- Toxicités de grade 2 :
- corticothérapie orale de 40 à 60 mg/jour d’équivalent-prednisone, soit d’emblée, soit en cas de persistance du grade 2 pendant >1 semaine, en fonction de la nature de l’EI immunomédié ;
- en fonction de l’organe affecté et du risque évolutif, soit suspension d’emblée de l’immunothérapie, puis reprise dès que l’effet indésirable est résolu et que la dose de corticoïdes a pu être diminuée sous 10 mg/j, soit poursuite sous surveillance rapprochée.
- Toxicités de grade 3-4 :
- prise en charge spécialisée le plus souvent en hospitalisation, avec une corticothérapie dont les modalités d’administration (per os ou IV) dépendront de la sévérité clinique ;
- arrêt de l’immunothérapie.
Le risque d’évolution fatale d’une toxicité cardiaque sous toutes ses formes (myocardite, trouble conductif, syndrome de Takotsubo…) est si important que dès qu’elle est suspectée, même pauci-symptomatique, l’immunothérapie doit être interrompue, et le patient admis en unité de soins intensifs de cardiologie. De même, certaines toxicités neurologiques et hématologiques imposent l’arrêt du traitement dès la survenue d’une toxicité de grade 1, et dans tous les cas dès un grade 2, et une prise en charge spécialisée précoce.
Des algorithmes plus précis, propres à chaque toxicité, sont présentés dans les consensus de l’ASCO et de l’ESMO (Schneider et al, 2021; Haanen et al, 2022).
26.4.4.2. Prise en charge des toxicités très fréquentes
26.4.4.2.1. Toxicités cutanées
- Les formes classiques (prurit, rash) sont traitées de façon symptomatique (émollients, photoprotection, antihistaminiques de seconde génération, dermocorticoïdes) pour les grades 1-2.
- A partir du grade 2, la suspension de l’ICI et la corticothérapie systémique orale sont discutées.
- L’avis d’un spécialiste avec réalisation éventuelle d’une biopsie de peau peut être nécessaire dès une toxicité de grade 2, et indispensable à partir d’un grade 3 et ne pas retarder la prise en charge thérapeutique.
26.4.4.2.2. Toxicités endocriniennes
La distinction des atteintes centrales et périphériques est indispensable pour guider la prise en charge.
- En particulier, la supplémentation en hormones thyroïdiennes en méconnaissant une insuffisance surrénalienne associée (en cas d’atteinte centrale) peut précipiter une crise d’insuffisance surrénalienne aiguë.
- En-dehors de la supplémentation d’une hypothyroïdie (avec les précautions usuelles chez les sujets âgés ou cardiopathes), l’avis d’un endocrinologue est le plus souvent nécessaire.
- Le traitement par ICI peut généralement être poursuivi, mais sa suspension peut être nécessaire en cas de grade élevé le temps d’obtenir le contrôle symptomatique de l’endocrinopathie.
- Le traitement repose sur l’hormonothérapie substitutive (généralement définitive) ou les antithyroïdiens de synthèse en cas d’hyperthyroïdie, et les mesures symptomatiques, mais une corticothérapie systémique peut être nécessaire dans certaines formes très inflammatoires (hypophysite avec signes neurovisuels, goitre inflammatoire par exemple).
26.4.4.2.3. Toxicités gastro-intestinales
Les diagnostics différentiels infectieux (colite infectieuse à germe entéropathogène et surtout à Clostridioides difficile, colite à CMV) doivent être écartés avant l’initiation d’une corticothérapie (coproculture, recherche de la toxine de C difficile, PCR sanguine pour le CMV), ainsi qu’une hyperthyroïdie (TSH) ou une insuffisance corticotrope devant une diarrhée isolée sous ICI.
La confirmation diagnostique repose sur la recto-sigmoïdoscopie avec biopsies dans un 1er temps, et en 2ème intention l’iléocoloscopie avec biopsies (Collins et al, 2020).
- L’intérêt est diagnostique et pronostique.
- L’aspect endoscopique peut être une muqueuse peu modifiée, simplement œdématiée, ou le plus souvent érythémateuse, friable, avec des lésions volontiers diffuses.
- La présence d’ulcérations est prédictive de mauvais pronostic et de cortico-résistance et doit faire envisager une escalade thérapeutique rapide (Abu-Sbeih et al, 2018b; Wang et al, 2018b; Dougan et al, 2021).
- En cas d’aspect macroscopique normal ou peu modifié le diagnostic n’est pas écarté tant qu’il n’y a pas de confirmation histologique, et l’ICI ne doit pas être réinitié.
- L’évaluation endoscopique est recommandée dès la survenue d’une toxicité de grade 2 (= 4 à 6 selles en plus /jour par rapport à la normale). Elle est indispensable en cas de grade 3-4 en vue de pouvoir initier une biothérapie, de grade 2 cortico-résistant, ou de doute diagnostique notamment lorsque l’ICI est associé à un autre traitement pouvant être à l’origine d’une diarrhée (chimiothérapie, TKI).
- L’analyse histologique des biopsies montre un infiltrat inflammatoire mixte aigu (polynucléaires neutrophiles, éosinophiles, abcès cryptiques) parfois avec des signes d’inflammation chronique (lymphocytes, plasmocytes, rarement des granulomes, des lésions d’apoptose) et permet de chercher une colite à CMV.
- La calprotectine fécale est corrélée à la sévérité des lésions endoscopiques (Abu-Sbeih et al, 2018b).
- L’intérêt du scanner est limité sauf suspicion de complication grave (perforation) (Dougan et al, 2021).
Une prise en charge spécifique (suspension de l’ICI, prélèvement d’un bilan pré-anti-TNF si non fait en pré-thérapeutique, initiation d’une corticothérapie après élimination des hypothèses infectieuses et médicamenteuses autres) est nécessaire dès l’apparition de diarrhée de grade 2.
- Le patient doit être évalué toutes les 72 h afin d’optimiser le traitement en l’absence d’efficacité.
- Les corticoïdes sont administrés par voie orale chez les malades avec une diarrhée de grade 2 (prednisone 40 à 60 mg/24h) et en cas de colite microscopique (Budésonide 9 mg un sachet par jour en une prise matinale).
- Ils sont administrés par voie IV (methylprednisolone à 40-60 mg/24 h pendant 3 jours) chez les patients avec un grade 3 ou 4.
- Des doses plus élevées de corticoïdes ne sont pas recommandées car plus toxiques, pas plus efficaces, et associées à un pronostic oncologique plus mauvais (Verheijden et al, 2024).
- L’anti-TNF-α infliximab est le traitement de première intention des formes corticorésistantes. Le vedolizumab a un délai d’action est plus long ; il est réservé aux malades avec une forme modérée, corticodépendante plutôt que corticorésistante (Abu-Sbeih et al, 2018a).
- Une méta analyse a évalué l’efficacité des médicaments des entérocolites aux ICPI. Les taux de réponse aux corticoïdes, à l’infliximab et au vedolizumab étaient, dans cette étude de 59 %, 81 % et 85 % respectivement (Ibraheim et al, 2020). La prise en charge des toxicités gastroduodénales est similaire à celle des entérocolites (Bresteau et al, 2023).
- Comme dans les MICI en poussée grave, les complications thromboemboliques sont fréquentes et doivent être prévenues.
- Les surinfections secondaires notamment à C.difficile et les réactivation du CMV doivent être régulièrement recherchées car fréquentes en cas de rechute des symptômes (Dahl et al, 2022). L’ajout d’antibiotiques à la prise en charge de la colite immuno-induite est inutile et augmente le risque de forme grave (Abu-Sbeih et al, 2019a).
- En cas de réponse à la corticothérapie, celle-ci doit être sevrée en 4-6 semaines. Le recours à une biothérapie doit être envisagé en cas de cortico-dépendance à la décroissance afin de limiter la durée d’exposition aux corticoïdes.
24.4.4.3. Prise en charge des toxicités fréquentes (1-5 %)
24.4.4.3.1. Toxicités pulmonaires
Un scanner thoracique haute résolution doit être réalisé, avec angioscanner pour éliminer une embolie pulmonaire. Plusieurs sous-types radiologiques sont décrits.
On distingue principalement deux présentations radiologiques :
- les Pneumopathies Organisées (opacités alvéolaires multi focale) ;
- et les Pneumopathies interstitielles de type Pneumopathie Interstitielle Non Spécifique (association de plages de verre dépoli et de réticulations).
Mais les signes radiologiques de PID peuvent correspondre à plusieurs causes et nécessitent de faire un bilan étiologique complet.
Les principaux diagnostics différentiels sont les infections, l’atteinte pulmonaire parenchymateuse néoplasiques (lymphangite), les toxicités radiques ou médicamenteuses pulmonaires, l’insuffisance cardiaque ou les hémorragies alvéolaires.
Un lavage broncho-alvéolaire (LBA) doit si possible être réalisé pour éliminer les causes infectieuses ou tumorales et le résultat retrouve en général une alvéolite lymphocytaire.
Un bilan biologique complet peut orienter également le diagnostic, (en particulier si le patient n’est pas éligible à un LBA) : bilan cardiologique (troponine, BNP), bilan infectieux (antigénurie légionnelle, sérologie aspergillaire, dosage des beta D glucan, PCR virale (grippe, covid)).
La prise en charge dépend également du grade de la toxicité :
- Grade 1 : Les lésions radiologiques asymptomatiques définissent un grade 1 et nécessitent une surveillance rapprochée des symptômes respiratoires, de la saturation en O2, la répétition du scanner à 1 mois en l’absence de dégradation clinique, avec suspension de l’ICPI le temps de juger de l’évolution.
- ≥ Grade 2 une corticothérapie est indiquée.
Le schéma de corticothérapie est fonction de la sévérité, avec une dose de charge de 1mg/kg (voir 2mg/kg en cas de grade 3 ou 4) jusqu’à une résolution ≤ à grade 1, puis diminution de 10 mg semaine environ, sur 4 à 6 semaines pour un grade 2, et sur au moins 6 à 8 semaines pour les grades 3 et 4.
- 10 à 15 % des patients présentent une forme chronique avec une récurrence à la décroissance de la corticothérapie, nécessitant une corticothérapie plus prolongée (> à 12 semaines).
- 10 % des patients développent des formes cortico résistantes pour lesquelles les traitements immunosuppresseurs de recours sont mal codifiés. Les principales thérapeutiques sont soit les anti-TNFα (infliximab – 5 mg/kg, à renouveler 15 jours après si nécessaire) soit anti-IL6 (tocilizumab – 8 mg/kg, à renouveler 15 jours après si nécessaire) éventuellement en association aux Immunoglobulines intraveineuses (IgIV – 2 g/kg sur 2 à 5 jours).
- Le pronostic reste sombre puisque seulement 20 à 30 % des patients s’améliorent, selon les séries.
Un grade 4 une détresse respiratoire nécessitant une prise en charge en réanimation.
26.4.4.3.2. Toxicités rhumatologiques
- Le bilan biologique suivant est réalisé en cas d’arthrite ou de PPR, avec a minima le dosage des AC anti CCP, AAN, et du Facteur Rhumatoïde, CRP.
- Des radiographies et/ou échographies sont à réaliser, centrées sur les zones atteintes.
- Une ponction articulaire sera à discuter en fonction de la consultation rhumatologique.
- En cas de corticodépendance, les médicaments les plus souvent utilisés sont le méthotrexate, le tocilizumab et les anti-TNFs.
26.4.4.3.3. Toxicités hépatiques
Les recommandations de prise en charge sont consensuelles bien que reposant sur des données limitées (Dougan et al, 2021; Schneider et al, 2021; Haanen et al, 2022).
- En cas de toxicité de grade 1, l’ICI est poursuivi en rapprochant la surveillance du bilan hépatique.
- A partir d’un grade 2 (transaminases 3-5N sans ictère), l’ICI est suspendu et une corticothérapie est initiée après avoir écarté les causes infectieuses.
- Il est nécessaire de réaliser quelques jours d'observation de la cinétique du bilan hépatique (le temps d'obtenir le bilan infectieux) car il arrive que le bilan hépatique s'améliore spontanément.
- A partir d’un grade 3 (transaminases 5-20N ou ictère, avec bilirubine < 10N), les patients sont généralement hospitalisés et une corticothérapie forte dose initiée (1 à 1,5 mg/kg selon la gravité et notamment la présence d’une insuffisance hépatocellulaire témoignant d’un grade 4) (Hountondji et al, 2024).
La possibilité d’associer l’acide ursodésoxycholique peut se discuter en cas de forme cholestatique, d’après des données rétrospectives (L et al, 2025).
En cas de corticorésistance (non-réponse à J3), l’ajout d’un traitement immunosuppresseur est recommandé, sans recommandations très précises sur le choix de la molécule.
Le mycophenolate mofetil (MMF, Cellcept®) à la posologie de 1 g x 2/jour, bien toléré et rapidement efficace, est le plus souvent cité, dont la durée sera établie par l’hépato-gastroentérologue (Alouani et al, 2023).
En cas de réponse à la corticothérapie, celle-ci doit être sevrée en 4-6 semaines, guidée par la surveillance biologique.
26.4.4.4. Prise en charge des toxicités rares (≤ 1 %)
26.4.4.4.1. Toxicités cardiaques
Tout patient suspect d’EI immunomédié cardiaque doit être admis en soins intensifs de cardiologie et scopé. L’ICI est stoppé jusqu’à confirmation ou infirmation du diagnostic.
- L’embolie pulmonaire et le syndrome coronarien aigu sont les principaux diagnostics différentiels. La prise en charge très spécifique de ces patients n’est pas détaillée ici.
- Le diagnostic positif de myocardite repose sur une combinaison de critères cliniques, ECG, élévation de la troponine, et imagerie (échocardiographie en 1ère intention, éventuellement complétée d’une IRM cardiaque et/ou d’un TEP scanner cardiaque, voire d’une biopsie endomyocardique).
- Les critères diagnostiques et pronostiques ont été publiés par l’International Cardio-Oncology Society et repris par les consensus de l’ASCO et de l’ESMO (Herrmann et al, 2022).
- En cas de corticorésistance, l’utilisation des anti-TNF est théoriquement contre indiquée et soumise à avis de cardiologue (éliminer insuffisance cardiaque associée).
Après EI immunomédié cardiaque, l’arrêt de l’ICI est en général définitif, mais selon certaines formes cliniques (ex : péricardite) et en fonction de la gravité du tableau, une reprise au cas par cas de l'immunothérapie peut être envisagée après discussion en RCP.
26.4.4.4.2. Toxicités neurologiques et musculaires
La prise en charge des complications neurologiques associées aux ICI repose sur une identification rapide et un traitement approprié, afin de réduire la mortalité et le risque de séquelles. Dans la majorité des cas, il est indispensable de consulter un neurologue spécialisé dans ce domaine, souvent dans le cadre d'une RCP dédiée.
- La première étape est de suspendre temporairement l'ICI et de graduer la toxicité selon les critères CTCAE.
- La corticothérapie est le traitement de base pour les événements de grade ≥ 2.
- La dose et la durée dépendent de la sévérité, débutant souvent par une administration orale pour les grades 2 et intraveineuse avec un relai per os pour les grades 3 ou 4.
- La décroissance de la corticothérapie orale s’effectue ensuite sur plusieurs semaines pour éviter les rechutes.
- Dans les cas de non-réponse ou de résistance aux stéroïdes, une immunosuppression plus prolongée avec du rituximab, du cyclophosphamide ou du tocilizumab peut être envisagée.
Dans le cas particulier de l’encéphalite, un traitement antiviral (aciclovir) est initialement recommandé jusqu’à exclusion d’une étiologie virale par PCR.
On notera également que le traitement du syndrome de Guillain Barré reposera aussi sur une corticothérapie initiale. Dans la majorité des cas, à la phase aigüe un traitement par échanges plasmatiques ou immunoglobulines intraveineuses sera proposé en cas d’échec de la corticothérapie.
- La reprise des ICI après une toxicité neurologique est une décision complexe et nécessite une évaluation multidisciplinaire. Celle-ci repose sur la résolution complète ou partielle des symptômes, le grade initial et les options oncologiques alternatives. Une prudence particulière est requise en présence d’anticorps auto-immuns.
- En général, la réintroduction des ICIs est déconseillée pour les toxicités graves de grade 4. La réintroduction ne peut être retenue qu’après une évaluation au cas par cas de la balance bénéfice-risque en RCP dédiée aux toxicités immuno-induites.
26.4.4.4.3. Toxicités hématologiques
L’ICI est suspendu dès la suspicion diagnostique. La prise en charge est similaire aux cytopénies auto-immunes hors immunothérapie consistant en premier lieu en une corticothérapie systémique, efficace dans la majorité des cas (Delanoy et al, 2019; Michot et al, 2019).
- En cas de corticodépendance, le rituximab est souvent préconisé dans ce contexte oncologique pour les PTI et AHAI immuno-induites, même en cas d’anémie hémolytique à anticorps froid (Plaçais et al, 2024).
- L’ajout de facteur de croissance est à discuter dans les neutropénies périphériques notamment en cas de complications infectieuses (Michot et al, 2019).
- Dans la majorité des cas, les hyperoéosinophilies ne nécessitent qu’une simple surveillance (Bernard-Tessier, et al 2017).
- En ce qui concerne les syndromes d’activation macrophagiques immuno-induits, une corticothérapie systémique est souvent préconisée en première ligne. Une corticorésistance/dépendance est rare et fait alors discuter une seconde ligne par tocilizumab ou étoposide (Diaz, et al. 2023).
- Le rechallenge est souvent compromis par la sévérité de l’atteinte hématologique, la persistance d’anomalies prolongées de la NFS et un risque élevé de rechute en cas de réexposition au traitement.
26.4.4.4.4. Toxicités rénales
Face à une IRA survenant sous ICI, la première étape est d’identifier une cause réversible évidente, à l’aide des examens complémentaires détaillés ci-dessus.
- Si une cause réversible évidente est établie, la prise en charge étiologique est indiquée, et l’ICI peut être poursuivi.
- En l’absence de cause réversible évidente, l’avis néphrologique est indiqué d’emblée, d’autant plus si l’ICI n’est pas utilisé en monothérapie (par exemple : association à une autre molécule de chimiothérapie ou thérapie ciblée).
- En cas de monothérapie, l’oncologue doit évaluer la sévérité de l’IRA selon le stade KDIGO, et continuer l’ICI uniquement en cas d’IRA KDIGO 1, sous réserve d’une amélioration de la créatinine qui doit impérativement être recontrôlée à 72 h.
Classification KDIGO des Insuffisances rénales aiguës :
- KDIGO 1 : augmentation de la créatinine sérique x1,5 à 2 par rapport à la base en 7 jours ou hausse de la créatinine de plus de ≥ 26.5 μmol/L ou oligurie < 0.5 ml/kg/h en 6-12 heures
- KDIGO 2 : augmentation de la créatinine sérique x2 à 3
- KDIGO 3 : augmentation de la créatinine de référence de plus de 3 fois par rapport à la base, ou oligurie < 0.3 ml/kg/h en plus de 24 heures ou anurie pendant plus de 12 heures,
ou créatinine > 350 µmol/l ou initiation de dialyse – anurie
En cas d’IRA KDIGO 2 ou 3, ou d’aggravation à 72 h d’une IRA KDIGO 1, l’ICI est interrompu. La durée de cette suspension dépend des éléments cliniques et de la prise en charge oncologique.
- La prise en charge d’une néphrite interstitielle aiguë à l’immunothérapie (NIAIT) doit se faire de concert avec le néphrologue.
- Une biopsie rénale doit être discutée avant le démarrage de la corticothérapie. En fonction de l’organisation locale, la corticothérapie peut être démarrée avant la biopsie ou les résultats après accord entre l’oncologue et le néphrologue.
- Il existe un bénéfice à démarrer au plus tôt la corticothérapie en cas de suspicion de NIAIT, dès les premiers jours. Le traitement est à réévaluer précocement avec le néphrologue. Une amélioration est attendue au plus tard à 4 semaines environ.
- Après amélioration de la fonction rénale et avis collégial, la réintroduction de l’ICI semble bien tolérée, elle doit être discutée et préparée en limitant toute prescription qui pourrait favoriser une NIAIT. La co-prescription de corticoïdes à la reprise ne semble pas apporter de bénéfice mais peut être discutée au cas par cas. En cas de reprise de l’immunothérapie, les prescriptions à risque de NIA doivent être évitées (IPP, AINS, fluindione…).
- Le traitement de seconde ligne est à discuter en absence de réponse thérapeutique (absence d’amélioration ou dégradation de la fonction rénale), les recommandations sont rappelées par les sociétés savantes (Gueutin et al, 2025).
Après une toxicité, l’évaluation de la fonction rénale se fera selon la sévérité de l’atteinte rénale :
- tous les jours pour les IRA KDIGO 3 ;
- tous les 2 jours pour IRA KDIGO 2 ;
- tous les 3 jours pour IRA KDIGO 1.
- Un suivi mensuel pendant 3 mois puis à 6 mois et 3 ans de l’épisode est suggéré.
26.4.5. Références - Options de prise en charge des EI immunodédiés
REFERENCES :
La détection précoce des EI immunomédiés et leur classification en grades sont essentiels, et cela nécessite de connaitre les valeurs et situations de références (ECG de référence, valeurs biologiques, examen clinique complet…) et de réaliser la surveillance adéquate – le clinicien doit toujours éliminer une progression tumorale, et évoquer l’EI immunomédié en réalisant les examens adaptés (accord d’experts).
Clinique :
- Interrogatoire précis sur le transit, douleurs articulaires, état général/fatigue, état neurologique, douleurs thoraciques, dyspnée.
- Un examen cutané et des muqueuses est recommandé avant chaque perfusion Examen clinique adapté en fonction de l’interrogatoire.
Paraclinique :
- Un bilan biologique avant chaque perfusion : Ionogramme sanguin, créatininémie avec DFG, bilan hépatique complet, hémogramme
- Un bilan endocrinien (glycémie à jeun) TSHus, T4L si TSH anormale, cortisolémie à 8h, à chaque cycle pendant 6 mois puis tous les 2 cycles pendant la durée du traitement ou en cas de point d’alerte clinique.
- ECG, Troponine cTN à chaque cycle pendant les 4 premiers cycles puis tous les 3 mois
- A chaque cycle : protéinurie/créatininurie et ECBU
Dès la suspicion d’un EI immunomédié neuromusculaire, cardiaque, pulmonaire, hématologique, ou rénal : un avis spécialisé urgent est recommandé ainsi que la suspension du traitement par ICI jusqu’à confirmation ou infirmation du diagnostic.

