4. Cancer colorectal métastatique
(Dernière mise à jour le : )Principaux changements de la mise à jour du 16/07/2025
4.4.D. traitement des métas jamais résécables BRAF V600E mutées et pMMR/MSS : intégration des résultats de phase III BREAKWATER :
• REFERENCE : encorafenib + cetuximab + FOLFOX (grade A) AMM et rembousement en attente
• OPTIONS :
o LV5FU2 + encorafenib + cetuximab ou encorafenib + cetuximab sans chimiothérapie en cas d’état général dégradé (avis d’experts)
o FOLFIRI + encorafenib + cetuximab en cas de neuropathie, progression sous FOLFOX adjuvant ou dans les 6 mois suivant son arrêt (avis d’experts)
4.4.D. traitement des métas jamais résécables BRAF V600E mutées et dMMR/MSI en 2ème ligne après immunothérapie : association FOLFOX + encorafenib + cetuximab à privilégier (avis d’experts)
4.11. ANNEXES 1C, 7 à 11 : modifications de stratégies thérapeutiques dans les tableaux et figures
Principaux changements de la mise à jour du 01/04/2025
4.4.B. traitement des carcinose péritonéales : CHIP avec mitomycine C à discuter au cas par cas (avis d’experts) et ne pas utiliser l’oxaliplatine
4.4.C. et D. suppression de l’option trichimiothérapie + anti-EGFR
4.4.D. traitement des métas jamais résécables :
• intégration des résultats de phase III TRANSMET : option de transplantation hépatique (grade A) cf. tableau des critères de sélection et procédure de soumission des dossiers médicaux au comité de validation national
• intégration des résultats de phase III CheckMate 8HW : option nivolumab et ipilumumab en 1ère ligne du CCRm dMMR ou MSI (grade B) AMM mais attente de remboursement
• trifluridine-tipiracil seul sans bevacizumab plus de place en 3ème ligne et plus (sauf contre-indication au bévazimab)
• intégration des résultats de phase II CITRIC : rechallenge cetuximab si RAS sauvage sur ADNct
• rappel de définition de rechallenge et ré-introduction
• pour patients chimio-résistants, discuter :
o si altération moléculaire d’intérêt (surexpression ou amplification d’HER2, mutation KRAS G12C, fusion NTRK) : en RCP des alternatives ciblées dès l’instauration de trifluridine/tipiracil + bévacizumab.
o si métas hépatiques exclusives : SIRT
o si absence de métas hépatique et pMMR/MSS : balstilimab + botensillimab (accès compassionel)
• recherche « idéalement » en 1ère ligne, des altérations moléculaires d’intérêt (type mutation KRAS (G12C), surexpression/amplification HER2) et autres mutations ciblables via RCP moléculaire et plan France génomique (AURAGEN et SEQUOIA).
• accès compassionnels :
o fruquitinib après trifluridine/tipiracil et regorafenib
o balstilimab plus botensillimab si pMMR/MSS sans métas hépatiques
• essais cliniques : ouverture de PHARBEVACOL, fermeture de NEXT-REGIRI
4.8. Destruction focalisée : intégration des résultats de phase III COLLISION : thermo-ablation alternative à la résection chirurgicale si métas hépatiques < à 3 cm et < à 10 métas (grade A)
4.11. ANNEXES 7 à 11 : modifications de stratégies thérapeutiques dans les tableaux et figures
Groupe de travail et relecteurs
Responsable du chapitre :
Jean-Marc Phelip, service d’HGE et Oncologie Digestive, CHU Hôpital Nord 42055 Saint-Etienne.
Léonor BENHAIM (Villejuif), Olivier BOUCHE (Reims), Patrick CHEVALLIER (Nice), Niki CHRISTOU (Limoges), Grégoire DESOLNEUX (Bordeaux), Anthony DOHAN (Paris), Frédéric DI FIORE (Rouen), Aurélien DUPRE (Lyon), David LEONARD (Saumur), Marie MULLER (Nancy), Christophe PENNA (Paris), Jean-Marc PHELIP (Saint-Etienne), David TOUGERON (Poitiers), Christophe TOURNIGAND (Paris).
Relecture :
Antoine ADENIS (Montpellier), Thomas APARICIO (Paris), Koceila AMROUN (Reims), Marion CHAUVENET (Lyon), Christelle de LA FOUCHARDIERE (Lyon), Michel DUCREUX (Villejuif), Sébastien GAUJOUX (Paris), Boris GUIU (Montpellier), Florence HUGUET (Paris), Mathieu LAPEYRE (Toulouse), Thierry LECOMTE (Tours), Christophe LOUVET (Paris), Léon MAGGIORI (Paris), Philippe MAINGON (Paris), Pascale MARIANI (Paris), William MINA (Reims), Laurent MOSSER (Rodez), Guillaume PASSOT (Lyon), Enam SOBKENG GOUFAK (Château-Thierry), Ariane RAYNAUD CRAYSSAC (Biarritz), Julien VOLET (Reims).
Comment citer ce chapitre du TNCD ?
Phelip JM, Tougeron D, Léonard D, Benhaim L, Desolneux G, Dupré A, Di Fiore F, Michel P, Penna C, Tournigand C, Louvet C, Christou N, Chevallier P, Dohan A, Rousseau B, Bouché O. Metastatic colorectal cancer (mCRC): French intergroup clinical practice guidelines for diagnosis, treatments and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, ACHBT, SFRO, SFR). Dig Liver Dis. 2019 Oct;51(10):1357-1363. doi: 10.1016/j.dld.2019.05.035.
Et mise à jour 2025 :
Phelip JM, Benhaim L, Chevallier P, Christou N, Desolneux G, Dohan A, Dupré A, Di Fiore F, Léonard D, Muller M, Penna C, Tougeron D, Tournigand C, Louvet C, Bouché O. « Cancer colorectal métastatique ». Thésaurus National de Cancérologie Digestive, juillet 2025, en ligne [http://www.tncd.org]
Méthodologie de la recherche bibliographique
Définition du sujet et des mots clés : Cancer, Tumor, adenocarcinoma, Colorectal, Colon, Rectal, Metastatic, Diagnostic, Palliative, Treatment, Chemotherapy, Surgery, Liver, Hepatectomy, stent, strategy, clinical trial, Follow-up
Langue : anglais et français
Site de recherche : PubMed
Les grades des recommandations suivent les critères de la HAS pour les niveaux de preuve scientifique fournis par la littérature (source : www.has-sante.fr - avril 2013) :
A : Preuve scientifique établie
Niveau 1
- essais comparatifs randomisés de forte puissance ;
- méta-analyse d’essais comparatifs randomisés ;
- analyse de décision fondée sur des études bien menées.
B : Présomption scientifique
Niveau 2
- essais comparatifs randomisés de faible puissance ;
- études comparatives non randomisées bien menées ;
- études de cohortes.
Niveau 3
- études cas-témoins.
C : Faible niveau de preuve scientifique
Niveau 4
- études comparatives comportant des biais importants ;
- études rétrospectives ;
- séries de cas ;
- études épidémiologiques descriptives (transversale, longitudinale).
Accord d’experts
Approbation d’au moins 80 % des membres du groupe de travail.
Avis d’experts
Les recommandations non gradées sont implicitement des avis d’experts ou des accords professionnels.
4.1. Introduction
Association de patients « Mon réseau cancer colorectal »
Un réseau social pour les personnes touchées par un cancer colorectal et leurs proches. Pour échanger, se comprendre, se soutenir.
Pour retrouver informations et adresses utiles :
https://www.monreseau-cancercolorectal.com/
La présence de métastases viscérales fait classer les patients en M1 du TNM et au Stade IV de la classification de l’UICC. L’atteinte des ganglions iliaques externes ou communs est considérée comme M1.
Les métastases sont observées dans 40 à 60 % des cas de cancer colorectal (synchrones dans 25 % des cas).
Malgré le progrès des chimiothérapies et des thérapies ciblées, seule la résection ou la destruction des lésions par un traitement local peut permettre la rémission complète et parfois la guérison. L’immunothérapie a récemment montré des taux de contrôles de la maladie de très longue durée et de probables guérisons chez des patients avec une tumeur MSI/dMMR (5 % des CCRm).
Les progrès sont venus depuis plus de 10 ans de la personnalisation des traitements liée :
- A une meilleure prise en compte des profils patients et des caractéristiques de la maladie métastatique.
- Aux développement de stratégies médico-chirurgicales complexe enrichies d’approches locorégionale notamment pour le traitement (ou la destruction physique) des métastases hépatiques.
- Aux développement de stratégies médico-chirurgicales complexe enrichies d’approches locorégionale notamment pour le traitement (ou la destruction physique) des métastases hépatiques.
Ce document à pour objectif de guider le praticien dans un processus complexe où les choix thérapeutiques de chaque patient doivent être définis au mieux dès le diagnostic car ils guideront le choix des traitements à chaque étape de la prise en charge.
4.2. Explorations pré-thérapeutiques
1. Références
a- Examen clinique complet
b- Bilan biologique
- NFS plaquettes, TP, TCA, créatininémie, albuminémie, bilirubinémie totale et conjuguée, phosphatases alcalines, TGO, TGP (accord d’experts)
- ACE en particulier si maladie non mesurable (recommandation : grade B)
- CRP et LDH totales (accord d’experts)
- Recherche d’un déficit en DPD par phénotypage (dosage de l'uracilémie) avec ajustement des doses de 5FU et capécitabine en cas de déficit partiel et contre-indication du 5FU et de la capécitabine en cas de déficit complet (accord d’experts)
c- ECG, voire consultation de cardiologie si ECG anormal ou facteurs de risque cardio-vasculaires
d- Scanner thoraco-abdomino-pelvien avec injection de produit de contraste (recommandation : grade B), ou IRM abdominale et pelvienne plus TDM thoracique non injecté si TDM injecté contre-indiqué (accord d’experts)
e- Détermination du statut du gène RAS tumoral (KRAS et NRAS) sur tissu de tumeur primitive ou métastases (recommandation : grade A)
f- Détermination du statut du gène BRAF tumoral (soit au niveau de la tumeur primitive, soit au niveau des métastases) (recommandation : grade A)
g- Détermination de l’instabilité microsatellitaire en biologie moléculaire (statut MSS/MSI) et/ou en immunohistochimie des 4 protéines MMR (MLH1, MSH2, PMS2, MSH6) (statut dMMR/pMMR) afin de pouvoir proposer une ’immunothérapie (anti-PD1et anti-CTLA-4) pour les cancers colorectaux métastatiques et dans le cadre de la recherche d’un syndrome de Lynch (recommandation : grade A)
h- Réalisation d’un questionnaire de dépistage G8 pour les patients > 70 ans pour déterminer la nécessité d’un avis oncogériatrique (patients de plus de 70 ans) (accord d’experts)
i- Si une exérèse de métastase hépatique est envisagée :
- IRM hépatique avec injection de gadolinium (recommandation : grade C) +/- séquence diffusion (accord d’experts) [Görgec et al. 2024]
- Coloscopie si la précédente date de plus de 3 ans ou a été incomplète (accord d’experts)
2. Options
a- Bilan biologique : CA 19-9 si ACE normal et maladie non mesurable (accord d’experts)
b- Génotypage du gène DPYD si phénotype DPD (uracilémie) anormal (avis d'experts)
c- Génotypage de l’UGT1A1 en cas d’utilisation de l’irinotecan (avis d'experts)
d- Ponction biopsie hépatique percutanée en cas d’abstention chirurgicale et si doute diagnostique ou si besoin de matériel tumoral pour la détermination du statut RAS, BRAF et MSI en l’absence de biopsie de la tumeur primitive disponible (recommandation : grade C)
e- Détermination du statut RAS/BRAF sur biopsie liquide (cf. TNCD chapitre 20.6. Indications tests moléculaires des adénocarcinomes colorectaux https://www.snfge.org/sites/default/files/SNFGE/TNCD/recommandations-inca_patients_atteints_dun_adenocarcinome_colorectal_-_indications_des_tests_moleculaires_en_vue_de_la_prescription_de_traitements_de_precision.pdf )
- En l’absence de matériel tissulaire tumoral disponible et/ou si le délai de rendu des résultats moléculaires escomptés est supérieur à 21 jours et uniquement si le patient nécessite une mise sous traitement rapide, une recherche des mutations RAS et BRAF par l’analyse de l’ADNtc peut être réalisée dans un centre expert qui a développé et validé une des techniques d’analyse (Recommandations INCa 2022) (recommandation : grade C).
- Si la présence d’ADNtc n’est pas confirmée dans l’échantillon ou s’il n’y a pas de métastases hépatiques, un résultat négatif pour l’identification des mutations recherchées doit être considéré comme non contributif et un nouvel examen à partir d’un échantillon de tissu tumoral doit alors être réalisé (accord d’experts).
f- Si une exérèse de métastases hépatiques est envisagée :
- TEP scanner pour éliminer d’autres métastases à distance [Ruers et al. 2009] (recommandation : grade C)
- Clairance du vert d’indocyanine si hépatopathie sous-jacente ou chimiothérapie(s) préalable(s) prolongée(s) notamment à base d’irinotecan (accord d’experts)
- Volumétrie hépatique et tumorale par scanner si doute sur le pourcentage de foie sain restant après hépatectomie (recommandation : grade C)
- Échographie doppler avec injection de produit de contraste si doute diagnostic au TDM ou à l’IRM sur la présence de métastase(s) hépatique(s) (accord d’experts)
- Ponction biopsie en foie non tumoral si doute diagnostique sur une hépatopathie associée (accord d’experts).
4.3 Critères de résécabilité et d'opérabilité des métastases (hépatiques principalement)
La résection chirurgicale ou la thermo-ablation doit toujours être discutée et éventuellement rediscutée en réunion de concertation pluridisciplinaire (RCP) comprenant au moins un oncologue digestif, un chirurgien et un radiologue expérimenté en pathologie hépatique. La discussion repose sur le rapport risque/bénéfice de la chirurgie. Pour les métastases hépatiques (pulmonaires et péritonéales les critères sont [Chiche 2003 ; Martin 2020] :
- Le terrain : compatible avec une anesthésie générale et une résection des métastases (PS < 2, pas de comorbidité sévère) ;
- Carcinologiques : résection R0 possible de toutes les métastases ;
- Anatomiques : en cas d’envahissement vasculaire (pédicule portal, veines sus-hépatiques), résection permettant de laisser un parenchyme avec sa propre vascularisation et son drainage biliaire ;
- Techniques : possibilité de laisser en place un volume résiduel > 25 % à 40 % de foie « non tumoral », selon l’existence ou non d’une hépatopathie sous-jacente ;
- Chimio-sensibilité : absence de progression sous chimiothérapie [Adam et al. 2004].
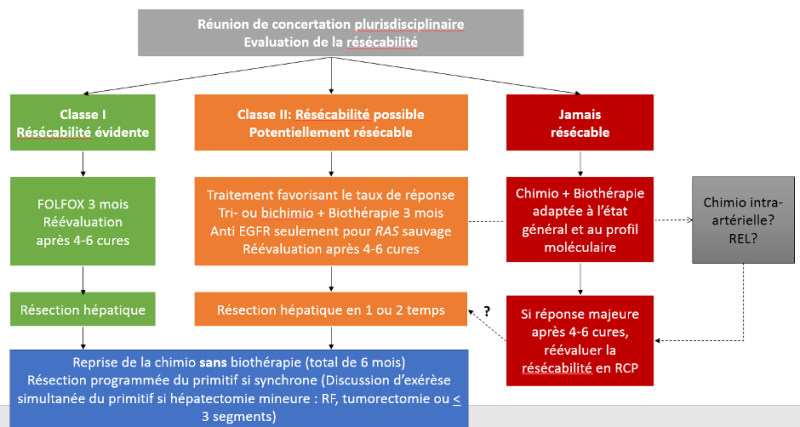
Au terme du bilan, on peut définir 2 niveaux de difficultés (métastases hépatiques d’emblée résécables et métastases hépatiques potentiellement résécables) et des critères carcinologiques pronostiques péjoratifs [Chiche et al. 2003].
RF : radiofréquence, REL : radio-embolisation
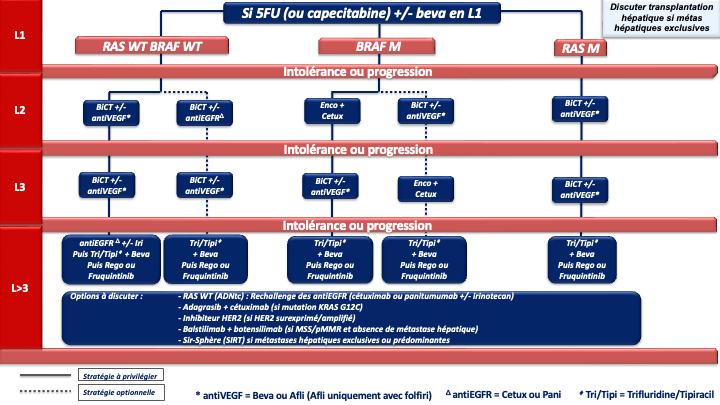
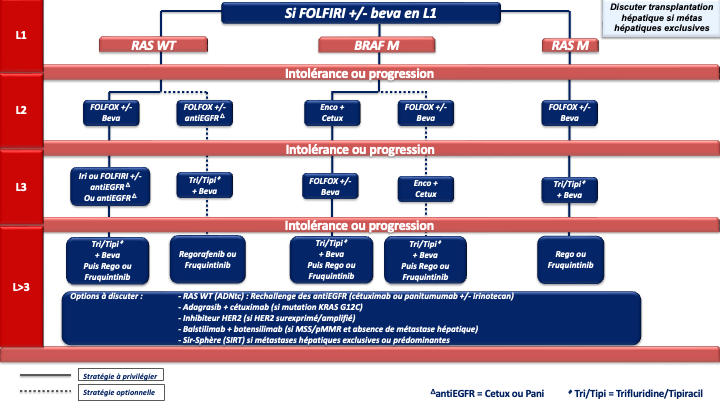
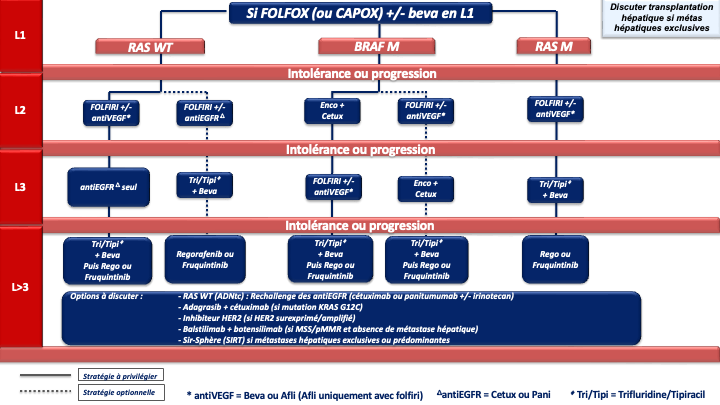
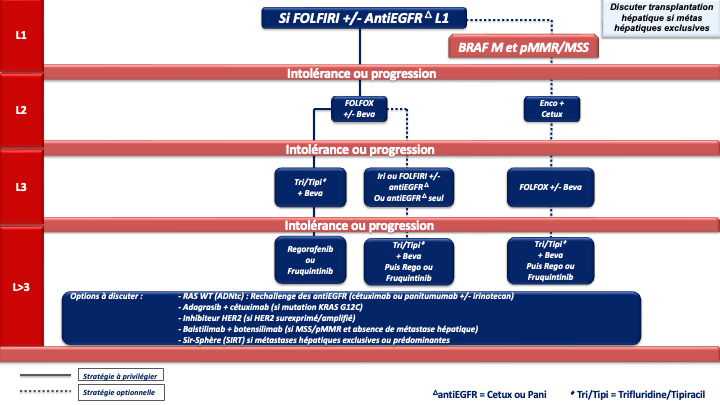
4.4. Traitement (Stratégies de traitement en annexes 7 à 10)
A. Métastases hépatiques résécables (classe I ou II)
1. REFERENCES
- L’intervention débute par l’exploration complète de la cavité abdominale puis l’exploration visuelle et manuelle du foie complétée par une échographie per-opératoire [Wildi et al. 2008] (recommandation : grade C). Tout ganglion suspect doit être prélevé. La chirurgie d’exérèse des métastases hépatiques doit enlever de manière radicale toutes les métastases individualisées sur le bilan morphologique préopératoire, complété par l’échographie per-opératoire. Les zones intéressant des lésions qui auraient disparues sous chimiothérapie doivent aussi être réséquées dans la mesure du possible (accord d’experts).
- La résection est indiquée seulement si une exérèse complète (R0) ou R1 "de nécessité" est possible (en 1 ou 2 temps).
- Le nombre des métastases n’est pas en soi un facteur limitant.
- Une résection atypique (wedge résection) offre les mêmes chances de guérison qu'une hépatectomie réglée [Zorzi et al. 2006].
- L’exérèse doit se faire si possible : avec une marge de sécurité de foie sain au mieux d’1cm et d’au moins 5mm (recommandation : grade C). Une marge de moins d’1cm ou possiblement R1 n’est pas une contre-indication à la résection (recommandation : grade C). En effet, plusieurs études ont montré l’absence de différence des taux de rechute entre les patients ayant eu une résection R1 ou R0 si une chimiothérapie adjuvante est réalisée [De Haas et al. 2008 ; Vigano et al . 2016].
- Le statut BRAFV600E muté n’est pas une contre indication à la résection car elle permet une amélioration de la survie sans rechute et de la survie globale [Javed et al. 2022] (recommandation : grade C).
a- En cas de résécabilité de classe I :
- FOLFOX 4 simplifié périopératoire : 6 cures préopératoires et 6 cures postopératoires [Norldinger et al. 2008 ; Norldinger et al. 2013] (recommandation : grade B) sauf si le patient a déjà reçu 6 mois de FOLFOX ou 3 mois de CAPOX en adjuvant de la résection de la tumeur primitive terminée depuis moins de 6 mois ou si résections itératives de métastases avec plusieurs séquences de chimiothérapie.
- Chirurgie hépatique première : à envisager si nécessité diagnostique ou en cas de lésion(s) de petite taille faisant craindre une disparition sous chimiothérapie (lésions moins de 2 cm) (recommandation : grade C). Pour ces petites lésions il est également possible avant de débuter la chimiothérapie de mettre en place par voie radiologique un coil qui permettra de repérer le site métastatique à réséquer en cas de réponse majeure ou complète (accord d’experts). Une autre option peut être la destruction par radiofréquence des petites métastases avant la chimiothérapie pré-opératoire (accord d’experts).
b- En cas de disparition en imagerie d'une métastase hépatique après chimiothérapie :
- La résection hépatique doit intéresser le site initial de la lésion disparue dans la mesure du possible car une réponse complète histologique est obtenue dans moins de 30 % des cas [Barimani et al. 2020] (recommandation : grade C). Si le site ne peut pas être réséqué, une surveillance rapprochée devra être réalisée pour exérèse ou destruction en cas de réapparition (accord d’experts).
c- En cas de métastases synchrones à la tumeur primitive :
- En cas de résécabilité de classe I et si la tumeur primitive est non compliquée et l’état général du patient conservé et sans comorbidité sévère, la possibilité d’une résection en un temps avec anastomose digestive avant l’hépatectomie pourra être envisagé [Elias et al. 1995 ; Reddy et al. 2007 ; Boudjema et al. 2021] (accord d’experts). Discuter une CT péri-opératoire par FOLFOX 4 simplifié (accord d’experts). Une résection en un temps n’est pas recommandée en cas de tumeur rectale basse (accord d’experts). En cas de tumeur du rectum nécessitant une radio-chimiothérapie pré-opératoire celle-ci doit être réalisée au mieux selon la stratégie PRODIGE 23 (cf. TNCD chapitre 5 rectum).
- Si résécabilité de classe II on privilégiera une stratégie d’exérèse différée.
- La résection du primitif colique peut précéder l’hépatectomie en un temps. La résection hépatique sera en général programmée 2 à 3 mois après l’exérèse colique (recommandation : grade C) et encadré par une chimiothérapie.
- La stratégie inversée (chirurgie hépatique première éventuellement précédée de CT, et colectomie secondaire) [Bachmeyer et al. 2013] peut être envisagée notamment lorsque la tumeur primitive n’est pas symptomatique (accord d’experts). Une CT péri-opératoire avant la chirurgie hépatique et après la chirurgie colique est recommandée. La réalisation d’une CT entre le temps hépatique et le temps colique est à discuter au cas par cas (accord d’experts).
- Une stratégie combinée est possible comprenant la résection du primitif et le « nettoyage » du foie restant suivi d’une hépatectomie majeure dans un second temps (accord d’experts).
d- En cas de métastases pulmonaires résécables associées :
- Débuter par l'exérèse hépatique puis résection pulmonaire 2 à 3 mois plus tard (recommandation : grade C).
- La radiofréquence percutanée est une option pour les lésions facilement accessibles et de petite taille et avec un risque d’envahissement ganglionnaire faible. (accord d’experts).
- La radiothérapie stéréotaxique est également une option qui peut être discutée notamment pour des lésions difficilement accessibles par la radiofréquence (accord d’experts).
e- En cas de métastases progressant sous chimiothérapie :
- La progression sous CT est un critère pronostic défavorable qui limite l’indication de résection. La résection pourra cependant être discutée notamment en cas de métastase unique progressive après 1 ou 2 lignes de chimiothérapie car elle semble améliorer le pronostic (accord d’experts) [Vigano et al. 2012].
- Une CT intra-artérielle est à discuter en cas de progression ou de réponse insuffisante sous CT systémique (accord d’experts).
f- En cas de résécabilité de classe II :
- Prise en charge dans un centre médico-chirurgical spécialisé dans la chirurgie hépatique (accord d’experts).
g- En cas d’adénopathie pédiculaire ou cœliaque :
- Si résécabilité de classe I : chirurgie avec curage [Adam et al. 2008].
- Si classe II : La chirurgie n’est pas recommandée (recommandation : grade C).
2. OPTIONS
a- FOLFOX 4 post opératoire : 12 cycles. Un essai Japonnais a en effet objectivé une amélioration de la SSR avec un traitement exclusivement post-opératoire (recommandation : grade B) [Kanemitsu et al. 2021]
b- Laparoscopie avec écho-laparoscopie si forte suspicion de non résécabilité ou de carcinose (recommandation : grade C)
c- L’exérèse par voie mini-invasive (cœlioscopique ou robot-assistée) est possible dans des centres experts en chirurgie hépatique et mini-invasive avec une diminution de la morbidité et de la durée de séjour et avec un pronostic oncologique similaire à la laparotomie (accord d’experts) [Fretland et al. 2017 ; Si-Ming Xie et al. 2017]
d- Embolisation portale préopératoire (+/- ligature de la branche portale droite) [Rivoire et al. 2003 ; Elias et al. 2002 ; Covey et al. 2008] +/- embolisation sus-hépatique (accord d'experts) Si hépatectomie droite avec volume du foie gauche restant < 25 % (si entre 25 % et 40 %, à discuter au cas par cas) et/ou ratio volume de foie restant/poids du corps <0,5 et/ou hépatopathie sous-jacente [Truant et al. 2007].
- 30 à 45 jours avant l'hépatectomie.
- En cas de métastases dans le foie controlatéral et compte tenu du risque de croissance tumorale dans le foie non embolisé, une exérèse chirurgicale (chirurgie en 2 temps) [Adam et al. 2000] ou un traitement par radiofréquence/micro-onde des lésions du futur foie restant est conseillé avant l’embolisation portale [Elias et al. 2004] (recommandation : grade C).
- Bévacizumab : la littérature est discordante et il n’y a pas de preuve pour recommander l’arrêt du bévacizumab avant embolisation portale pré-opératoire [Aussilhou et al. 2009, Zorzi et al. 2008, Millet et al. 2012] (recommandation : grade C)
e- Hépatectomie en 2 temps [Adam et al. 2000 ; Chun et al. 2007 ; Wicherts et al. 2008]
f- Un intervalle libre d'au moins 5 à 6 semaines (2 demi-vies) est nécessaire entre la dernière administration de bévacizumab ou autre molécule anti-angiogénique et la chirurgie (en pratique pas de bévacizumab associé à la dernière cure de chimiothérapie préopératoire) (accord d'experts)
g- Destruction par radio-fréquence/micro-onde ou radiothérapie stéréotaxique [Parickh et al. 2002 ; De Baere et al. 2003 ; Pawlik et al. 2009 ; Van der Lei et al. 2025] : si moins de 3 cm et moins de 10 métastases cf. infra chapitre 4.8. « Place des traitements locorégionaux dans le traitement des métastases hépatiques »]
h- Chimiothérapie post-opératoire (recommandation : grade B) à discuter par LV5FU2 [Portier et al. 2006 ; Mitry et al. 2008] ou FOLFOX 4 simplifié pendant 6 mois si pas de CT préopératoire ou par la CT d’induction ayant permis la résécabilité pendant une durée conduisant à un total de 6 mois péri-opératoires [Kopetz et al. 2009] (accord d’experts). Lorsqu’un patient a reçu 6 mois ou plus de traitement préopératoire (> 12 cycles) la chimiothérapie adjuvante sera discutée au cas par cas pour un maximum de 3 mois (accord d’experts). Cette CT postopératoire doit débuter au maximum dans les 4 à 6 semaines suivant l’intervention (accord d’experts). Il n’y a aucun intérêt démontré à réutiliser une biothérapie en post-opératoire même quand le traitement préopératoire s’est montré très efficace (accord d’experts)
i- En cas de disparition de la métastase sous CT et si le site de la lésion disparue ne peut être réséqué, une CT intra artérielle hépatique adjuvante sera discutée en option car elle pourrait réduire le risque de récidive dans les séries rétrospectives [Elias et al. 2007] (accord d’experts)
j- CT intra-artérielle hépatique post-opératoire associée à une CT systémique dans les centres experts [Kopets et al. 2009 ; Goere et al. 2013] (recommandation : grade C) : cf. chapitre 4-8 « Place des traitements locorégionaux dans le traitement des métastases hépatiques »
3. ESSAIS CLINIQUES
- HYPER-LIV01 : Embolisation simultanée portale et sus-hépatique versus embolisation portale seule pour hypertrophier le futur foie restant avant résection hépatique majeure sur foie non-cirrhotique : essai multicentrique randomisé comparatif de phase II. Coordonnateur Pr B Guiu (Montpelier).
https://clinicaltrials.gov/ct2/show/NCT03841305 - METALAP : Effet de la laparoscopie sur la réduction des complications après hépatectomie pour métastases hépatiques de cancer colorectal : essai prospectif, randomisé et contrôlé. Coordonnateur : Pr D Fuks (Paris)
https://clinicaltrials.gov/ct2/show/NCT04163887
B. Métastases extra-hépatiques résécables
1. REFERENCES
a- Pour les métastases pulmonaires : les indications sont les mêmes que pour les métastases hépatiques : chirurgie seulement si exérèse complète possible (métastasectomie de type wedge ou lobectomie sous thoracotomie ou thoracoscopie ou sternotomie (recommandation : grade B). Une CT péri-opératoire est à discuter (accord d’experts). Plusieurs options sont possibles : destruction par radiofréquence percutanée ou radiothérapie stéréotaxique ou micro-ondes (accord d’experts). Il est possible de combiner ces différentes options selon la position et la taille des métastases pour assurer une ablation/résection de l’ensemble des lésions.
b- Pour les carcinoses péritonéales :
• une résection complète des lésions est recommandée lorsque la carcinose est isolée et d’extension modérée (PCI < 15) chez un malade en bon état général et sans insuffisance viscérale [Faron et al. 2016] (recommandation : grade A). La cytoréduction sans chimiothérapie intra-péritonéale doit être réalisée par laparotomie xypho-pubienne avec exploration complète de la cavité péritonéale et en centre expert (accord d’experts).
• La CHIP après cytoréduction doit être discuté au cas par cas et réalisée au mieux à la mitomicyne C (MMC) à la dose de 35 mg/m2, en 3 fractions en 90 minutes à 41°. [Hubner M et al. 2024]. (avis d’experts).
• La CHIP avec oxaliplatine et notamment à forte dose sur 30 minutes n’est pas recommandée [Quenet et al. 2021 ; Hubner M et al. 2024] (recommandation : grade A).
• Une CT péri-opératoire intraveineuse est à discuter comme pour les métastases hépatiques pour un total n’excédant pas 6 mois (accord d’experts). Lorsqu’un patient a reçu 6 mois ou plus de traitement préopératoire (> 12 cycles) la chimiothérapie adjuvante sera discutée au cas par cas pour un maximum de 3 mois (accord d’experts).
• En cas de carcinose synchrone à une lésion primitive non menaçante, l’exérèse de la tumeur primitive doit se faire après chimiothérapie et dans le même temps que l’exérèse des lésions péritonéales (accord d’experts).
2. OPTIONS
- La résection complète est exceptionnellement possible au niveau des ganglions, du cerveau et des surrénales. La chirurgie de debulking n’a pas d’indication (essai ORCHESTRA). Les traitements locorégionaux (radiothérapie, radiofréquence) peuvent être discutés en centre experts, seuls ou en complément de la résection chirurgicale, lorsque la maladie est oligo-métastatique et le pronostic relativement bon (accord d’experts).
- Une radiothérapie postopératoire en condition stéréotaxique du lit opératoire est recommandée après résection de métastase cérébrale (recommandation : grade B). L’irradiation de l’encéphale en totalité après résection n’est pas indiquée sauf en cas d’atteinte cérébrale diffuse.
- Pour les métastases ovariennes : une ovariectomie à visée symptomatique (et si possible préventive, sans attendre la survenue des symptomes) peut être proposée même en cas d’autres métastases extra-ovariennes non résécables compte tenu de la chimio-résistance de cette localisation [Goere et al. 2008] (accord d'experts). En cas de résection à visée curative, la CHIP prophylactique n’est pas recommandée malgré un risque de lésions péritonéales synchrone de 50 %.
- La CHIP peut être discutée au cas par cas et notamment chez les patients à haut risque de récidive péritonéale (tumeurs mucineuses, tumeurs BRAF V600E muté, cellules indépendantes…), hors essai thérapeutique, si discutée en RCP en pré-opératoire en centre expert et à condition d’avoir une morbidité attendue faible, après une chirurgie d’exérèse complète, en utilisant la mitomycine C (avis d’experts).
- Après résection complète des métastases ovariennes ou péritonéales, une chirurgie de « second look » n’est pas recommandée [Goere et al. 2008] (recommandation : grade B).
C. Métastases à la limite de la résécabilité
Ce cas de figure ne concerne en général que les métastases exclusivement hépatiques (associées dans de rares cas à des métastases pulmonaires ou péritonéales peu nombreuses et potentiellement résécables).
1. REFERENCES pour la chimiothérapie pour les métastases à la limite de la résécabilité
a- Pour les métastases pouvant devenir résécables en cas de réponse majeure, il est recommandé de privilégier, un protocole de CT donnant un taux de réponse élevé (réponses objectives selon les RECIST1.1) dans l'optique d'une résécabilité secondaire [Kopetz et al. 2009] : tri-CT ou bi-CT plus biothérapie. Quatres essais de phase III ayant inclus des patients non sélectionnés sur la résécabilité secondaire ont objectivé des taux de réponse objective RECIST plus élevés avec une bi-CT associée au cétuximab qu’avec une bi-CT associée au bévacizumab, en l’absence de mutation RAS [Heinemann et al. 2014 ; Venook et al. 2014 ; Yoshino et al. 2021 ; Punt et al. 2022].
b- Des essais de phase II randomisés ont objectivé, chez des patients sélectionnés, potentiellement résécables de métastases limitées au foie, des taux de réponses proches de 80 % et des taux de résection secondaire de 25 % avec une bi-CT associée au cétuximab, jusqu’à 60 % avec une tri-CT associée au cétuximab ou au panitumumab (RAS non mutés) [Kopetz et al. 2009 ; Ychou et al. 2022 ; Modest et al. 2019] et 50 % avec une tri-CT associée au bévacizumab [Gruenberger et al. 2013].
c- En cas de tumeur RAS/BRAF WT colique gauche, un essai de phase III ayant comparé un doublet (FOLFOX) versus un triplet de chimiothérapie (FOLFOXIRI) associé à un antiEGFR (panitumumab) pour des cancers RAS/BRAF WT colique gauches, a objectivé des taux de réponse RECIST1.1 et une résécabilité secondaire et une SSP similaires [Rossini et al. 2022]. Il n’est donc pas necessaire d’intensifier la chimiothérapie avec un triplet dans cette situation favorable aux antiEGFR (recommandation : grade B).
d- En cas de mutation BRAF V600E, les antiEGFR ne sont pas l’option à privilégier [Stintzing et al. 2021]. Dans cette situation (et en l’absence de statut dMMR/MSI, présent dans 20 à 40 % des cas de tumeur BRAF muté), l’association encorafenib + cetuximab + FOLFOX est recommandée en 1ère intention [E Elez et al. 2025] (en cours de remboursement) (recommandatIon : grade A)
e- En cas de tumeur dMMR et MSI (y compris BRAF muté) et compte tenu des résultats très favorables en termes de SSP et de contrôle prolongé de la maladie par le pembrolizumab en monothérapie [André et al. 2020], ce traitement devra être proposé et la résection chirurgicale des métastases ne devra pas être systématique lorsqu’elle devient possible (notamment lorsque le risque opératoire est élevé : patients âgés avec comorbidités). En effet, des réponse complète (10 %) et des réponses partielles (30 %) prolongées de nombreuses années sont possibles. En cas de contrôle prolongé de la maladie le pembrolizumab doit être arrêté à 35 cycles (accord d'experts).
f- En cas de métastases non résécables traitées par CT avec une réponse permettant d'envisager secondairement une résection, la morbidité de l'hépatectomie est majorée après 6 cycles [Brouquet et al. 2009 ; Karoui et al. 2006 ; Chun et al. 2009 ; Nakano et al. 2008]. Un IMC > 27 et un diabète augmentent le risque de stéatohépatite. Il est recommandé :
- D’opérer dès que les métastases deviennent résécables sans attendre au-delà de 4 mois de CT (réponse maximum obtenue entre 2 et 4 mois) [White et al. 2008]. Les bilans d’évaluation sont à faire toutes les 8 semaines et les dossiers doivent être rediscutés systématiquement avec ces bilans morphologiques en RCP.
- De respecter un délai de 4 à 6 semaines après la fin de la CT avant d'opérer [Karoui et al. 2006 ; Benoist et al. 2006].
g- La chimiothérapie intra-artérielle hépatique (CIAH) a montré dans des essais de phase II des taux de réponses élevés (5FUdr ou oxaliplatine associé à une chimiothérapie IV (LV5FU2 +/- biothérapie) et peut constituer une alternative à la chimiothérapie IV (recommandations : grade C). Néanmoins ces essais sont anciens et la CIAH n’a pas été comparée aux chimiothérapies plus thérapies ciblées modernes dans des essais de phase III. Elle doit être réservée à des centres expérimentés maitrisant cette technique.
h- Pour les patients métastatiques opérés :
- une durée de 6 mois de CT au total pré- et post-opératoire est recommandée (accord d’experts) ;
- chez les patients devenus résécables après plus de 6 mois de traitement : CT post-opératoire de 3 mois maximum selon la toxicité cumulative et les suites postopératoires (accord d'experts) ;
- il n’y a pas d’argument dans la littérature pour recommander la poursuite en postopératoire d’une thérapie ciblée associée en préopératoire à la chimiothérapie qui a permis la résection (accord d’experts).
2. OPTIONS pour la chimiothérapie pour les métastases à la limite de la résécabilité
a- FOLFIRI ou FOLFOX + cétuximab (Erbitux®) ou panitumumab (Vectibix®) chez les patients avec une tumeur RAS/BRAF non mutés [Bokemeyer et al. 2009 ; Van Cutsem et al. 2009 ; Folprecht et al. 2009 ; Douillard et al. 2010 ; Van Cutsem et al. 2011 ; Maughan et al. 2011 ; Ye et al. 2013 ; Watanabe et al. 2022 ; Rossini et al. 2022] (recommandation : grade B) avec nouvelle discussion de la résécabilité en RCP après 4 à 6 cures
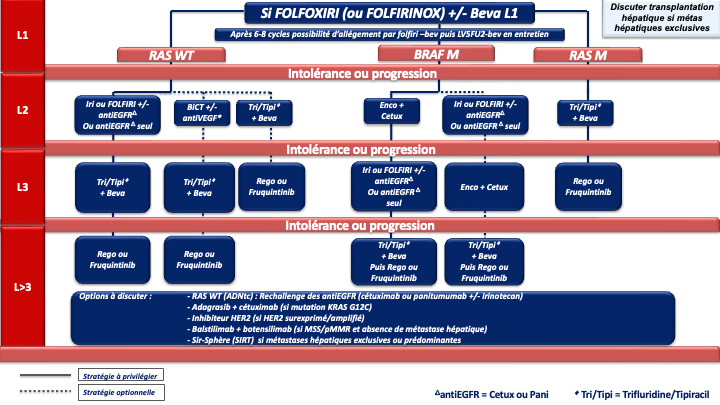
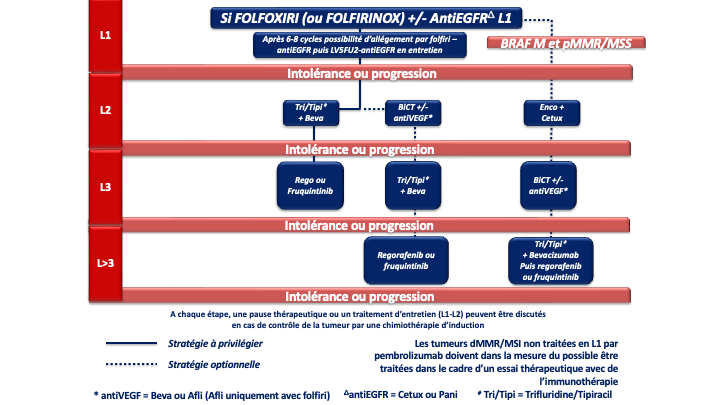
b- FOLFOXIRI ou FOLFIRINOX (5FU, acide folinique, oxaliplatine et irinotécan) [Souglakos et al 2006. Masi et al. 2006 ; Falcone et al. 2007 ; Falcone et al. 2007] + bévacizumab (Avastin®) chez les patients avec une tumeur colique droite et/ou RAS ou BRAF muté (recommandation : grade B) avec nouvelle discussion de la résécabilité en RCP après 4 à 6 cures
c- FOLFIRI ou FOLFOX (XELOX) + bévacizumab en cas de contre-indication à un triplet et d’un statut RAS/BRAF muté [Maughan et al. 2003 ; Hochster et al. 2008 ; Fuchs et al. 2007 ; Saltz et al. 2008 ; Schmiegel et al. 2007 ; Ducreux et al. 2013] (recommandation : grade C)
d- FOLFOX 4 simplifié ou FOLFIRI 6 cures en cas de contre-indication à un triplet et au thérapie ciblée [Douillard et al. 2000 ; Tournigand et al. 2006 ; Grothey et al. 2008] (recommandation : grade C)
e- CT intra-artérielle hépatique par oxaliplatine associée à LV5FU2 par voie IV +/- thérapie ciblée [Ducreux et al. 2005] (recommandation : grade C) si métastases uniquement hépatiques et dans les centres expérimentés
f- Pembrolizumab 200 mg IV toutes les 3 semaines si tumeur dMMR et MSI et métastases de résécabilité de classe II ou patients agés avec comorbidité importante avec un risque opératoire élevé (accord d’experts). En cas de contrôle de la maladie à 35 cycles un arrêt du traitement est à discuter) (accord d'experts)
D. Métastases « jamais résécables »
Définition
La caractérisation des métastases qui ne seront jamais résécables est parfois difficile. La non résécabilité doit toujours être définie après discussion en RCP avec présence d’au moins un chirurgien hépatique et d’un radiologue interventionnel expérimenté, spécialisé dans l’imagerie hépatique. Il est raisonnable de considérer comme non résécables :
- Les métastases chez des patients incapables, du fait de comorbidités, de supporter l’acte chirurgical (ou les actes successifs) nécessaire(s) à l’éradication de tous les sites métastatiques.
- Les métastases :
- des sites non résécables (os, cerveau, …). Une métastase cérébrale isolée non résécable doit être traitée par irradiation stéréotaxique. Celle-ci peut être indiquée jusqu’à 3 à 5 lésions. Elle évite les troubles cognitifs liés au traitement encéphalique complet.
- Ou trop nombreuses pour la résection ou le traitement local de tous les sites (par exemple, dans tous les segments du foie ou miliaire pulmonaire).
- En cas d’envahissement ganglionnaire massif (adénopathies mésentériques ou médiastinales) ou de lymphangite carcinomateuse pulmonaire.
- En cas de maladie métastatique synchrone non résécable, la résection de la tumeur primitive ne devra pas être envisagée si elle est asymptomatique (recommandation grade B) [Kanemitsu et al. 2021 ; Rahbari et al. J Clin Oncol 2024].
Indications de la transplantation hépatique
Un essai de phase III (TRANSMET) a comparé la transplantation hépatique à la poursuite d’une chimiothérapie cytotoxique de L1, L2 voir L3 chez des patients en bon état général avec métastases hépatiques exclusives non résécables [Adam et al. 2024]. Les résultats ont objectivé un gain majeur de survie à 5 ans (57% vs 13% et 73% vs 13% en analyse per protocole) chez les patients transplantés pâr rapport à la poursuite de la chimiothérapie. Plus de 70% d’entre eux ont présenté une récidive (essentiellement pulmonaire) qui a pu faire l’objet d’un traitement à visée curative dans près de 50 % des cas. Cette stratégie impose d’avoir une maladie métastatique exclusivement hépatique et parfaitement contrôlée par la chimiothérapie « néoadjuvante » ainsi qu’une résection préalable de la tumeur primitive. Le groupe de travail rercommande de présenter ces patients le plus tôt possible, dès la 1ère évaluation, en RCP spécialisé (RCP nationale TRANSMET dédiée à la transplantation hépatique en place) afin de pouvoir adresser précocement le patient dans un centre spécialisé de transplantation hépatique où l’indication sera discutée (recommandation grade A).
Les critères de sélection à vérifier avant présentation à la RCP nationale de validation (APHP Paul Brousse) sont :
- Age < 65 ans
- Etat général OMS 0 ou 1
- Métastases exclusivement hépatiques (TDM et TEP-scan) et non résécables
- Tumeur primitive réséquée
- BRAF sauvage
- Contrôle pendant > à 3 mois de chimiothérapie et < 3 lignes de traitement
- ACE < microg/L ou diminution de plus de 50% du taux maximum d'ACE observé durant la maladie 80 ng/m L ou baisse de 50% par rapport au baseline
Lien vers la procédure de soumission des dossiers médicaux au comité de validation à envoyer par courriel à : mariem.arfaoui@aphp.fr :
Indications et choix de la chimiothérapie de 1ère ligne [Kopetz et al. 2009]
L’objectif de la CT palliative est de maintenir la qualité de vie et allonger la durée de survie (recommandation : grade B). Les conditions suivantes sont recommandées :
- sans attendre qu'apparaissent des symptômes ;
- à des doses adaptées à la tolérance ;
- preuve anatomopathologique formelle au moins sur la tumeur primitive ;
- patient alité moins de 50 % de la période diurne (état général OMS 0, 1 ou 2) ;
- patient informé du traitement avec bénéfices, contraintes et effets secondaires potentiels
- métastases non résécables
- pas de défaillance viscérale grave.
Pour les patients âgés de plus de 75 ans l’indication dépendra du niveau de dépendance et des comorbidités [Aparicio et al. 2020] ; chez les patients sans comorbidité et en état général OMS 0 ou 1 (voir OMS 2 si cela est lié à la maladie), les indications sont proches de celles des patients plus jeunes. En revanche en cas de fragilité, une CT n’est envisageable qu’après évaluation onco-gériatrique approfondie (EGA). L’indication d’une EGA sera guidée par la mesure du score G8 (si < 15) [Bellera et al. 2012] (accord d’experts). La Société Francophone d'Onco-Gériatrie (SOFOG) a publié récemment des recommandations spécifiques [Aparicio et al. 2020].
Choix de la chimiothérapie de 1ère ligne
Mono ou polychimiothérapie d’emblée :
La détermination du statut moléculaire tumoral (RAS, BRAF et MSI) est indispensable dès le début de la prise en charge
Le choix entre les différents schémas de CT par fluoropyrimidines seules, ou associées à l’irinotécan et/ou oxaliplatine plus ou moins bévacizumab, cétuximab (RAS WT) ou panitumumab (RAS WT), est à discuter en fonction des souhaits du patient, des toxicités, des contre-indications, des caractéristiques de la maladie notamment biologique et de la stratégie retenue.
La question de l’utilisation d’emblée d’une polychimiothérapie (bithérapie +/- biothérapie) ou d’une monothérapie (LV5FU2 ou capécitabine +/- biothérapie) avec intensification en cas de progression fait l’objet de nombreuse controverses Quatre essais de phase III, dont l’essai FFCD 2000-05, ont comparé ces stratégies (sans biothérapie) et ont montré chez ces patients jamais résécables des résultats superposables avec des médianes de survie dans les 2 groupes de l’ordre de 16 mois, liées à l’inclusion de patients souvent âgés, polymétastatiques et à l’état général altéré [Seymour et al. 2007 ; Ducreux et al. 2011 ; Koopman et al. 2007 ; Cunningham et al. 2009]. Une monothérapie ne doit pas être proposée en cas de maladie agressive (métastases symptomatiques, multi-métastatiques, statut BRAF muté…). En outre, l’essai FFCD 2001-02 chez les patients de plus de 75 ans ne montre pas d’avantage à prescrire une bithérapie (FOLFIRI) en première ligne par rapport à une monothérapie (LV5FU2) [Aparicio et al. 2016]. Les données issues de l’essai AIO, concluent dans ce sens en particulier pour les patients RAS WT ou le 5FU monothérapie associé au bévacizumab apparaissait plus efficace dans le sous-groupe des patients RAS/BRAF WT [Modest et al. 2017]. Chez les patients de plus de 70 ans, la capécitabine combinée au bévacizumab est supérieur à la capécitabine seule [Cunningham et al. 2013].
Une méta-analyse de Sargent et al suggère que les patients OMS 2 tirent un bénéfice des traitements du même ordre que les patients en bon état général (HR survie globale=0,79 ; p=0,04 et HR réponse=2,85 ; p=0,003). Ils ne doivent donc pas recevoir systématiquement un traitement allégé et chaque cas doit être discuté en RCP, pour définir si le mauvais état général est dû à l’agressivité de la tumeur (orientant vers une bi- ou une tri-thérapie) ou à une fragilité ou des comorbidités (orientant vers une monothérapie première) [Sargent et al. 2009].
Impact du statut BRAF et MSI/dMMR :
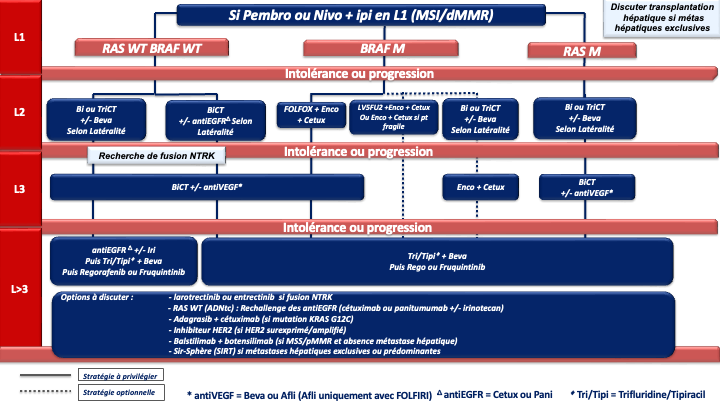
- La recherche d’une instabilité microsatellitaire (MSI) et/ou de déficience du système MMR (IHC des 4 protéines MMR) doit être systématique. En cas de statut dMMR ou MSI l’autre test doit être réalisé avant tout traitement par immunothérapie. En cas de statut discordant (pMMR/MSI ou dMMR/MSS) les tests doivent être relus et/ou refaits et en cas de persistance d’un statut discordant l’avis d’un centre expert est souhaitable (accord d’experts). La présence d’un statut dMMR/MSI (5 % des CCRm et jusqu’à 30 % des tumeurs BRAF mutées) confère une sensibilité particulière à l’immunothérapie et ce quelque-soit la latéralité de la tumeur primitive et le statut BRAF. Les résultats de survies prolongées des essais de phases II (pembrolizumab et nivolumab +/- ipilimumab) ont été confirmés en 1ère ligne métastatique par :
- un essai de phase III (KEYNOTE 177) avec le pembrolizumab en monothérapie qui a permis d’obtenir une SSP de 16,5 mois et des taux de réponses objectives de 43,8 % supérieur au traitement de première ligne standard (SSP de 8,2 mois et des taux de réponses de 33,1 %). Les données de SG non significatives du fait d’un cross over dans 60 % des cas sont inédites (médiane non atteinte à 45 mois de suivi). Ainsi, le pembrolizumab est devenu le traitement de référence en 1ère ligne des CCRm dMMR/MSI (recommandation : grade A) [André et al. 2020]
- l’essai CheckMate 8HW dont les résultats ont été publiés récemment. Il comparait, chez des patients avec un CCRm MSI ou dMMR, le nivolumab + l’ipilimumab à la chimiothérapie conventionnelle (objectif principal SSP) et la même association au nivolumab seul (objectif principal SSP). Le nivolumab + ipilimumab en 1ère ligne du CCRm MSI/dMMR a permis une amélioration majeure de la SSP par rapport à la chimiothérapie conventionnelle de 1ère ligne (non atteinte après 31 mois de suivi vs 6,2 mois dans le bras chimiothérapie) [Andre et al. 2024]. La comparaison avec le nivolumab seul a été effectué chez les patients de 1ère ligne ou de lignes ultérieures. Là encore, la SSP était significativement meilleure avec l’association. La SSP médiane n’était pas atteinte vs 39,3 mois dans le bras nivolumab seul (HR : 0,62 [0,48-0,81]) [Andre et al. 2025]. Les résultats de cette comparaison exclusivement pour les patients de 1ère ligne ainsi que la SG sont attendus prochainement. L’association nivolumab + ipilimumab constitue une nouvelle option de 1ère ligne pour les CCRm MSI/dMMR (recommandation : grade B) (AMM actuellement non remboursé)
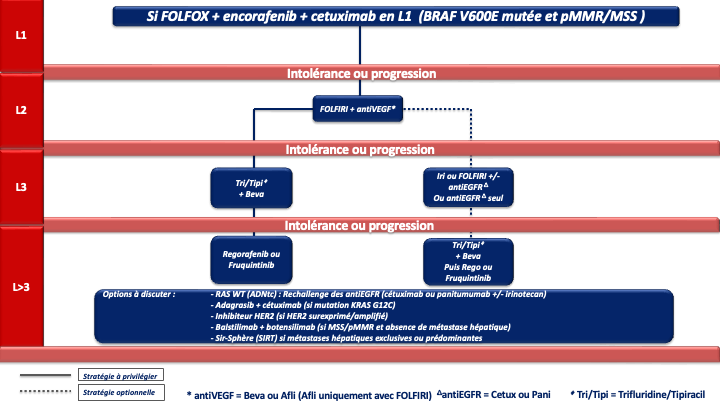
- La présence d’une mutation BRAF V600E confère un mauvais pronostic. Des données exploratoires sur de petits effectifs suggèraient un bénéfice en termes de survie globale avec une tri-CT + bévacizumab (Van Cutsem et al. 2011 ; Loupakis et al. 2014] mais une méta analyse récente n’a pas retrouvé de bénéfice de la tri-CT + bévacizumab comparé à la bi-CT + bévacizumab en terme de SG [Cremolini C et al. 2020]. L’essai FIRE-4.5 de phase IIR, qui comparait la tri-CT + bévacizumab à la tri-CT + cétuximab à suggéré un bénéfice en faveur de la trichimothérapie + bévacizumab en terme de SSP [Stintzing et al. 2021]. Plus recemment, Un essai de phase III, BREAKWATER, à démontré la supériorité de l’association encorafenib + cetuximab + FOLFOX en 1ère ligne (bénéfice significatif en termes d’ORR : 65,7%, de SSP : 12,8 mois et de SG : 30,3 mois) par rapport à la chimiothérapie standard de type doublet ou triplet + bévacizumab [E Elez et al. 2025 ; Kopetz et al. ASCO GI 2025 ; Kopetz et al. Nature Medicine 2025]. Cette association en cours de remboursement est actuellement le traitement de référence pour ces tumeurs de très mauvais pronostic (recommandatIon : grade A). Un 3ème bras de traitement avec l’association encorafenib + cetuximab sans chimiothérapie à par ailleurs montré un SG proche de 20 mois faisant de cette association une option de 1ère ligne chez un patient fragile pour lequel une chimiothérapie cytotoxique n’est pas envisageable (avis d’experts). En cas de neuropathie, progression sous FOLFOX adjuvant ou dans les 6 mois suivant son arrêt, l’option d’un traitement par FOLFIRI + encorafenib + cetuximab pourra être discutée car des données préliminaires d’une cohorte de l’essai BREAKWATER suggèrent une efficacité similaire et un profil de tolérance acceptable [Tabernero et al. ESMO 2024] (avis d’experts). De la même manière lorsque l’oxaliplatine ne peut être réalisé (patient fragile et/ou progression sous FOLFOX adjuvant) un schéma de type 5FU (LV5FU2) + encorafenib + cetuximab pourra être discuté (avis d’experts).
- En présence d’une mutation BRAF V600E et d’une tumeur MSI/dMMR : Le choix de 1ère ligne devra être une immunothérapie (pembrolizumab ou nivolumab + ipilimumab. En cas d’échappement à l’immunothérapie, il n’y a pas de données dans la littérature pour privilégier un traitement plus qu’un autre. Cependant, compte tenu de l’ampleur du bénéfice de l’association FOLFOX + encorafenib + cetuximab en 1ère ligne des tumeurs BRAF V600E muté, cette association devra être privilégiée (avis d’experts).
Impact de la latéralité sur le choix d’un anti-VEGF ou d’un anti-EGFR
- Plusieurs études ont montré que la latéralité du cancer était un facteur pronostic indépendant du statut mutationnel dans le cancer du côlon métastatique, avec un pronostic péjoratif pour les cancers du côlon droit [Fausto-Petrelli et al. 2017 ; Boeckx et al. 2017]. Les données actuelles concernant l’Influence de la localisation tumorale (côlon droit/gauche) dans le choix thérapeutique suggèrent un effet prédictif d’efficacité des anti-EGFR (tumeur RAS WT) en termes de réponse, et de SG pour les cancers du côlon gauche (2/3 des CCR) | [Watanabe et al. 2023] et à l’inverse une tendance à une meilleure efficacité du bévacizumab en termes de SG pour les cancers du côlon droit (1/3 des CCR) [Venook et al. 2016 ; Heinemann et al. 2014 ; Holch et al. 2017].
- Par ailleurs un essai de phase III a recemment montré une équivalence d’efficacité en termes de réponse et de SSP entre un doublet et un triplet associé à un antiEGFR pour les cancers du côlon gauche RAS/BRAF WT [Rossini et al. 2022].
- Un autre essai de phase III dédié aux CCRm « coliques droit et/ou RAS/BRAF mutés » a suggèré une tendance à l’amélioraton du pronostic en faveur d’un triplet + bevacizumab comparé à un doublet + bévacizumab [Punt et al. 2022]. Dans cette situation, les antiEGFRs peuvent également être envisagés uniquement si une réponse RECIST est recherchée car une métanalyse a suggéré une efficacité au moins égale à celle d’une chimiothérapie associée au bévacizumab [Cremolini et al. 2020] (avis d’experts).
1. REFERENCE pour la stratégie et le traitement de 1ère ligne chez les patients « jamais résécables » :
a- Stratégie d’escalade thérapeutique : ne sera envisageable qu’en cas de volume tumoral modéré, de métastases non ou peu symptomatiques, non menaçantes à court terme, ou chez un patient à l’état général altéré du fait de l’âge ou d’une comorbidité (et non du fait d’un syndrôme tumoral). On débutera par une monochimiothérapie (5FU/capécitabine) si possible combinée à une thérapie ciblée selon le statut RAS/BRAF. Dans ce cas la réponse sera évaluée tous les 2 à 3 mois selon le caractère menaçant de la maladie métastatique. En cas de progression, une ou plusieurs lignes supplémentaires de traitement seront proposées (recommandation : grade A). Si un biomédicament est utilisé avec une monothérapie (5FU/capecitabine), il s’agira de préférence du bévacizumab, qui est la seule thérapie ciblée évaluée en association au LV5FU2 ou à la capécitabine dans un essai de phase III [Kabbinavar et al. 2005 ; Kabinavar et al. 2003 ; Tebbutt et al. 2010] (recommandation : grade B). Néanmoins, des essais de phase II [Lonardi et al. 2020] et plusieurs séries rétrospectives ont montré l’efficacité et un profil de tolérance acceptable avec l’association de 5FU / capécitabine + antiEGFR (tumeur RAS WT) qui pourra être choisi en option (recommandation : grade C).
b- Transplantation hépatique : si critère de sélection présents, présenter les patients le plus tôt possible, dès la 1ère évaluation, en cas de contrôle tumoral sous chimiothérapie , en RCP nationale TRANSMET dédiée à la transplantation hépatique (recommandation grade A).
c- Polychimiothérapie +/- biothérapie d’emblée : pour faciliter une pause thérapeutique (recommandation grade A) ou un allègement sous forme de monochimiothérapie 5FU/ capecitabine +/- bévacizumab (recommandation grade B) ou d’une association 5FU (ou capecitabine) +/- antiEGFR [Simkens et al. 2015 ; Berry et al. 2015 ; Pietrantonio et al. 2019 ; Modest et al. 2022].
d- En cas de métastases menaçantes, de progression tumorale rapide, d’un syndrome tumoral et/ou d’un état général altéré (OMS 2) du fait de l’importance de la maladie métastatique : on privilégiera une association de bi- ou tri-chimiothérapie + biothérapie capable de donner des taux de réponses élevés, adaptée à l’état général du patient, au profil moléculaire de la tumeur et à la latéralité (accord d’experts).
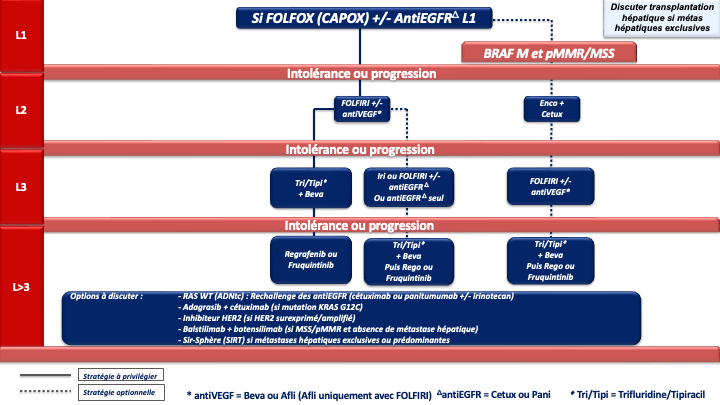
e- Le choix d’une chimiothérapie associée à un biomédicament (antiVEGF ou antiEGFR) devra tenir compte du statut RAS, BRAF, MSI/dMMR et de la latéralité de la tumeur primitive :
- Les cancers du côlon gauche
- RAS/BRAF WT doivent être traités par un doublet associé à un antiEGFR (panitumumab ou cétuximab) (recommandation : grade A).
- RAS muté et pMMR/MSS on privilégiera un doublet/triplet + bévacizumab (recommandation : grade A)
- BRAF muté et pMMR/MSS on privilégiera un traitement par encorafenib + cetuximab + FOLFOX (recommandation : grade A)
• Option LV5FU2 + encorafenib + cetuximab ou encorafenib + cetuximab sans chimiothérapie en cas d’état général dégradé ou FOLFIRI + encorafenib + cetuximab si contre-indication à l’oxaliplatine (avis d’experts)
- Les cancers du côlon droit
- et/ou RAS mutés et pMMR/MSS doivent être traités préférentiellement par un doublet/triplet + bévacizumab (recommandation : grade A)
- BRAF mutés et pMMR/MSS doivent être traités préférentiellement par encorafenib + cetuximab + FOLFOX (recommandation : grade A)
• Option LV5FU2 + encorafenib + cetuximab ou encorafenib + cetuximab sans chimiothérapie en cas d’état général dégradé ou FOLFIRI + encorafenib + cetuximab si contre-indication à l’oxaliplatine (avis d’experts) - RAS/BRAF WT : privilégier un triplet + bévacizumab mais possibilité d’utiliser un doublet + antiEGFR si une réponse RECIST est recherchée (avis d’experts)
f- Immunothérapie pour les cancers MSI/dMMR (quelque-soit la latéralité et le statut RAS/BRAF) : pembrolizumab à la dose de 200 mg toutes les 3 semaines pour une durée maximale de 35 cycles (recommandation : grade A) [André et al. 2020] ou l’association nivolumab + ipilimumab (recommandation : grade B) (AMM, non remboursé).
g- En cas d’échappement à l’immunothérapie pour une tumeur MSI/dMMR et BRAF V600E muté : association FOLFOX + encorafenib + cetuximab en 2ème ligne (avis d’experts)
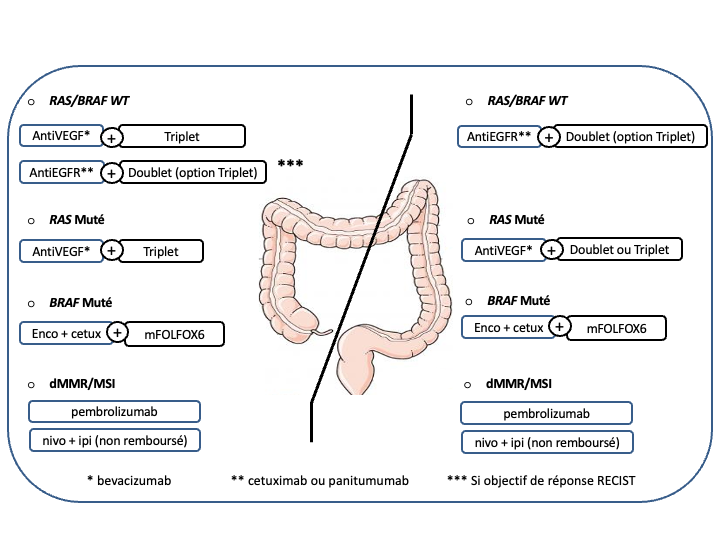
Choix de la chimiothérapie et de la thérapie ciblée en fonction de la latéralité
En cas du choix d’une monochimiothérapie (comorbidité ou stratégie d’excalade thérapeutique, le choix de la thérapie ciblée (antiEGFR ou antiVEGF) sera identique à celui fait pour un doublet ou un triplet (accord d’experts).
2. OPTIONS pour la stratégie et le traitement de 1ère ligne chez les patients « jamais résécables » :
a- L’administration d’une double dose de cétuximab (500 mg/m2) toutes les deux semaines est recommandée car la pharmacocinétique est identique à l’administration de 250 mg / m2 hebdomadaire et cela rend le schéma d’administration avec la CT (LV5FU2, FOLFOX ou FOLFIRI plus simple [Tabernero et al. 2008 ; Pfeiffer et al. 2008 ; Bouchahda et al. 2010 ; Ciuleanu et al. 2011] (recommandation : grade C).
b- Possibilité de faire les perfusions de bévacizumab en 10 minutes que la dose soit de 5 mg/kg toutes les 2 semaines ou de 7,5 mg/kg toutes les 3 semaines [Mir et al. 2012 ; Mahfoud et al. 2012 ; Reidy et al. 2007] (accord d’experts).
c- Immunothérapie pour les cancers MSI/dMMR (quelque-soit la latéralité) : nivolumab 240 mg + ipilumumab 1 mg/kg toutes les 3 semaines pendant 12 semaines puis nivolumab 480 mg toutes les 4 semaines [André et al. 2024 ; André et al. 2025] (recommandation : grade B). AMM obtenu et en attente de remboursement .
d- Situations particulières :
a. Métastases hépatiques exclusives : CT intra-artérielle hépatique par 5FU [Meta-Analysis Group in Cancer. 1996 ; Rougier et al. 1992 ; Kerr et al. 2003] (recommandation : grade B) ou oxaliplatine [Ducreux et al. 2005] (recommandation : grade C) dans un centre expert.
b. Radiothérapie stéreotaxique si métastases cérébrales et à discuter si métastases incomplètement réséquées et reliquat tumoral minime, ou si récidive locale non résécable ou à titre symptomatique (accord d’experts).
3. ESSAIS CLINIQUES en première ligne pour la stratégie et le traitement de 1ère ligne chez les patients « jamais résécables » :
- PRODIGE 71 (BEVAMAINT) : Essai de phase III comparant le traitement d'entretien par fluoropyrimidine + bévacizumab versus fluoropyrimidine après chimiothérapie d'induction pour un cancer colorectal métastatique. Coordonnateur : T Aparicio (Paris).
https://www.ffcd.fr/index.php?option=com_content&view=article&id=83&etude=00137&Itemid=144 - PRODIGE 49 - OSCAR : Hepatic Intra-arterial chemotherapy with oxaliplatin (HIAC-ox) plus intravenous Fluorouracil, leucovorin (iv LV5FU2) and Panitumumab (RAS WT) or bévacizumab (RAS M) versus intravenous oxaliplatin, fluorouracil, leucovorin (FOLFOX) and Panitumumab (RAS WT) or bévacizumab (RAS M) in patients with liver limited metastatic colorectal cancer. Coordonnateur : J Taïeb (Paris).
https://www.ffcd.fr/index.php?option=com_content&view=article&id=83&etude=00058&Itemid=144 - FFCD 1703 - POCHI : Etude preuve de concept : Prembrolizumab associé à de la capecitabine, oxaliplatine et bevacizumab chez les patients atteints de cancer colorectal avec stabilité microsatellitaire (MSS) et fort infiltrat immun. Coordonnateur : Pr D.Tougeron (Poitiers)
https://clinicaltrials.gov/ct2/history/NCT04262687?V_4=View - FFCD 1709 - SIRTCI-01 : Etude prospective, multicentrique, ouverte, de phase 2, évaluant l’efficacité et la tolérance de la radio- thérapie interne vectorisée associée au XELOX, bévacizumab et atézolizumab (inhibiteur du point de contrôle immunitaire) chez les patients atteints d’un cancer colorectal métastasique. Coordonnateur : Pr D.Tougeron (Poitiers)
https://www.ffcd.fr/index.php?option=com_content&view=article&id=83&etude=00140&Itemid=144 - PRODIGE S10 - PHARBEVACOL : Etude de phase 3 randomisée en double aveugle évaluant une chimiothérapie à base de bevacizumab adaptée à la pharmacocinétique du bevacizumab en 1ère ligne du cancer colorectal métastatique non résécable. Coordonnateur : Pr T Lecomte (Tours)
https://www.snfge.org/sites/www.snfge.org/files/medias/documents/Essai%20PRODIGE%20S10-PHARBEVACOL_Re%CC%81sume%CC%81.pdf
4. Protocoles de chimiothérapie de 1ère ligne les plus utilisés en France et leur grade de recommandation (cf. Annexe 1)
| Chimiothérapie | Biomédicament associé | Préférence biologique | Préférence clinique | Recommandations |
|---|---|---|---|---|
| 5FU/Capecitabine | . Agé, comorbidité . Faible masse tumorale et asymptomatique | Grade A | ||
| 5FU/Capecitabine | Bevacizumab | . Agé, comorbidité . Faible masse tumorale, asymptomatique | Grade B Grade B | |
| 5FU/Capecitabine | Cétuximab ou panitumumab | - RAS/BRAF WT | . Côlon gauche . Non éligible à une bi-CT | Grade C |
| FOLFIRI ou FOLFOX | . Contre indication aux thérapies ciblées | Grade A | ||
| FOLFIRI ou FOLFOX | Bevacizumab | - RAS M - BRAF M | . Côlon droit . Non éligible à une tri-CT | Grade A Grade B |
| FOLFIRI ou FOLFOX | Cétuximab ou panitumumab | - RAS/BRAF WT - RAS/BRAF WT | . Côlon gauche . Côlon droit et objectif réponse | Grade A Avis d'experts |
| FOLFOXIRI ou FOLFIRINOX | . Maladie agressive et contre indication aux thérapies ciblées | Grade A | ||
| FOLFOXIRI ou FOLFIRINOX | Bevacizumab | - RAS M - BRAF M - RAS/BRAF WT | . Côlon droit . Côlon gauche si RAS/BRAF muté | Grade A Grade B Grade B |
| Pembrolizumab | - dMMR/MSI | Grade A |
Choix de la chimiothérapie de 2ème ligne
Si l’état général du patient est dégradé (ECOG PS >2) ou en cas d’ictère (non drainable) ou d’occlusion, persistante et non résolutive seul un traitement symptomatique sans CT s’impose.
Lorsqu’un patient peut recevoir une nouvelle chimiothérapie, la séquence thérapeutique L1-L2 pourrait avoir un impact sur l’efficacité des traitements notamment en ce qui concerne les biomédicaments. Il ressort de 2 essais de phase II randomisés, ayant comparé une bi-CT beva vs bi-CT anti-EGFRs en L2 (après une bi-CT + beva de L1 pour tumeur RAS WT), que numériquement, la SG et la SSP apparaissent meilleures dans le bras bévacizumab lorsque le bévacizumab a été utilisé en L1. Les différences ne sont cependant pas significatives [Hecht et al. 2015 ; Hiret et al. 2016]. Plusieurs analyses exploratoires suggèrent également un pronostic détérioré par la séquence antiVEGF puis antiEGFR [Datian et al. 2019]. Par ailleurs un essai de phase III ayant comparé ces deux modalités stratégiques (antiVEGF-CT puis antiVEGF-CT versus antiEGFR-CT puis antiVEGF-CT) n’a pas montré de différence significative en termes de durée de contrôle de la maladie (critère principal) alors que le bras de maintien de la pression antiangiogénique comprenait 3 lignes de traitement (traitement de L3 par antiEGFR). Les taux de réponses RECIST étaient significativement meilleurs en débutant par un antiEGFR (82,4 % vs 69,7 % ; p<0,001) et la SG était numériquement meilleures dans le bras antiEGFR en L1 (gain de plus de 3 mois de médiane) [Chibaudel et al. 2022]. Compte tenu de la validité de la stratégie de blocage continu de l’angiogénèse à travers 3 essais de phase III [Bennouna et al. 2013 ; Van Cutsem et al. 2012 ; Tabernero et al. 2015], du rationnel biologique [Wainberg et al. 2015] et des résultats de ces analyses exploratoires de séquences et de ces essais de phases II concordants, le groupe de travail recommande :
- La poursuite du blocage de l’angiogénèse en L2 lorsque le bévacizumab a été utilisé en L1 y compris chez les patients RAS WT (accord d’experts) ;
- A l’inverse lorsqu’un antiEGFR a été utilisé en première ligne le choix de la biothérapie s’orientera vers un anti-angiogénique en deuxième ligne. Cette séquence permet outre les meilleurs taux de réponses en L1, d’envisager un rechallenge des antiEGFRs en lignes avancées (accord d’experts).
En cas de progression sous chimiothérapie +/- thérapie ciblée et de tumeur BRAF V600E mutée (8 à 12 % des CCRm), un essai de phase III (essai BEACON) a démontré la supériorité de l’association encorafénib + cétuximab sur une chimiothérapie de type FOLFIRI ou irinotecan associé au cétuximab), en 2ème ou 3ème ligne de traitement, en termes de SG (9 mois versus 5,4 mois) et de réponse objective (20 % versus 2 %) qui étaient les 2 objectifs principaux de l’essai [Kopetz et al. 2019].
En cas de progression sous immunothérapie de 1ère ligne (tumeur MSI-H dMMR), il n’y a pas de donnée dans la littérature qui permette de recommander un traitement plutôt qu’un autre. En pratique, pour les tumeurs BRAF WT, on s’orientera vers une chimiothérapie de 1ère ligne adaptée au profil du patient, au statut RAS de la tumeur et à la latéralité (avis d’experts). Pour les tumeurs BRAF V600E muté, un traitement par encorafenib + cetuximab sera préférentiellement proposé (recommandation : grade B).
Transplantation hépatique : si bon contrôle de la maladie au traitement de 2ième ligne présenter ces patients le plus tôt possible, dès la 1ère évaluation, en RCP spécialisé (RCP nationale de validation TRANSMET dédiée à la transplantation hépatique) (recommandation grade A).
Choix de la chimiothérapie de 3ème ligne ou plus
A ce stade de la maladie, il est souvent difficile de raisonner par ligne de traitement compte tenu des multiples options antérieures possibles (triplet, progression sous ou dans les 6 mois suivant un traitement adjuvant pour un CCR initialement non métastatique, antécédent de résections des métastases avec chimiothérapie pré +/- post opératoires). Dans ces conditions, il est préférable de raisonner par sous-groupes de patients ayant été intolérant ou résistants aux traitements antérieurs.
En pratique en cas de progression sous 5FU, irinotecan, oxaliplatine, antiVEGF, antiEGFR (si RAS WT) plusieurs options sont actuellement disponibles si le patient conserve un bon état général (PS : 0 ou 1) :
- Le trifluridine tipiracil associé au bevacizumab validé (versus le trifluridine tipiracil seul) dans un essai de phase 3 (SUNLIGHT) ayant objectivé un gain significatif en termes de réponse, de SSP et de SG (recommandation : grade A) [Prager et al. 2023].
Compte tenu de la supériorité de la combinaison par rapport au trifluridine tipiracil seul et de l’ampleur du bénéfice, cette option est à privilégier chez tous les patients éligibles (avis d’experts). - Le régorafénib ou le trifluridine tipiracil seul (recommandation : grade A). Chacune de ces options a été validé dans des essais de phase III objectivant un gain de SG et de SSP (versus placebo) [Grothey et al. 2013 ; Mayer et al. 2015].
Le trifluridine tipiracil seul n’a plus de place en 3ème ligne et plus sauf en cas de contre-indication au bévazimab. - Le fruquintinib qui a été validé récemment dans 2 essais de phase 3 (versus placebo) chez des patients en échec du trifluridine tipiracil et/ou du régorafenib) [Dasari et al. 2023].
Il est actuellement accessible en accès compassionnel en attente d’un remboursement (recommandation : grade A) - Le rechallenge des antiEGFR (cétuximab ou panitumumab avec ou sans irinotecan) en cas de tumeur RAS WT résistant aux antiEGFR au mieux délivrés en 1ère ligne (recommandation : grade C). Plusieurs essais non randomisés de phase 2 ont en effet montré l’intérêt de cette stratégie notamment en terme de réponse objective (20 à 25%). Le statut RAS peut au mieux être de nouveau déterminé au moment du rechallenge sur l’ADNtc (ADN tumoral circulant) (accord d’experts). L’étude CHRONOS a en effet montré sur un effectif de 30 patients des taux de réponse objective de 30% chez des patients lourdement prétraités avec un ADNtc RAS WT [Satore Bianchi et al. 2022]. Plus récemment un 1er essai randomisé de phase 2 (étude CITRIC) a objectivé un bénéfice en terme de contrôle de la maladie chez des patients lourdement prétraités (en échec des chimiothérapies cytotoxiques, des antiEGFR, des antiVEGFR, du trifluridine tipiracil et/ou du regorafenib) pour lesquels le statut RAS a été de nouveau déterminé sur l’ADNtc [Santos Vivas et al. 2024]. Il est démontré que plus le délai entre la première utilisation de l’antiEGFR et le rechallenge est long, plus il est efficace.
Il est important de différencier rechallenge (ré-utilisation d’un médicament sous lequel il y a eu une progression) versus ré-introduction (ré-utilisation d’un médicament sous lequel il n’y a pas eu de progression). Le ré-introduction d’un antiEGFR est de manière générale plus efficace que le rechallenge. - L’adagrasib associé au cétuximab (recommandation : grade C). L’adagrasib est un inhibiteur spécifique de KRAS G12C muté qui a montré dans un essai de phase 2 (KRYSTAL-1) des taux de réponse objective élevé (46%) en >3 lignes du CCRm KRAS G12C muté (moins de 4% des CCRm mutés KRAS). La SSP médiane était de 6,9 mois et la SGm de 13,4 mois [Klempner et al. 2022]. D’autre inhibiteurs de KRASG12C dont le sotorasib associé à un antiEGFR sont en développement en 3ème ligne et en 1ère ligne du CCRm.
L’adagrasib et le sotorasib ne sont actuellement pas remboursés. - Le balstilimab (anti-PD1) associé au botensillimab (anti-CTLA4) qui a objectivé un taux de réponse objective élevé (20%) et des SSP et SG significativement amélioré dans un essai de phase 2 randomisé chez des patients avec un CCRm prétraité, MSS et sans métastase hépatiques [Andrea J. Bullock et al. 2024].
Cette association est actuellement accessible en accès compassionnel (recommandation : grade C). - Les antiHER2. Le blocage d’HER-2 pourra être envisagé en cas de surexpression d’HER2 (3+ ou 2+ FISH+ en IHC) en particulier chez les patients RAS WT où le trastuzumab associé au lapatinib ou au pertuzumab a montré des taux de réponses intéressant chez des patients lourdement prétraités (non remboursés) [Narita et al. 2022 ; Meric-Bernstam et al. 2019 ; Satore-Bianchi et al. 2016]. De la même manière, le trastuzumab-deruxtecan a montré des taux de réponse de plus de 45% et le tucatinib associé au trastuzumab des taux de réponse de 38% (non remboursés) (recommandation : grade C) [Siena et al. 2021 ; Wu et al. 2015 ; Strickler et al. 2022]. D’autres inhibiteurs d’HER2 sont actuellement à l’étude et les développements se poursuive en ligne plus précoce du CCRm.
- Les inhibiteurs de NTRK. Le larotrectinib (per os à 200 mg/j) ou l’entrectinib pourront être envisagé en cas de fusion d’un des gènes NTRK (Tropomyosin related kinase fusion proteins) et sans aucune autre option thérapeutique satisfaisante.
La recherche sera à privilégier chez les patients restant en bon état général avec une tumeur ne présentant aucune autre mutation notamment sur RAS et BRAF (mutuellement exclusives). Une vigilance particulière devra porter sur les tumeurs dMMR et/ou MSI non Lynch (fusion NTRK beaucoup plus fréquente dans ce sous-groupe) (avis d’experts).
La recherche sera faite par test immunohistochimique confirmé par séquençage (NGS ARN) ou séquençage (NGS ARN) d’emblée. (recommandation : grade C) [Drilon et al. 2018 ; Marchiò et al. 2019] (non remboursé). - SIR-Spheres® (SIRT Microsphères de résine marquées à l’Y-90) plus mFOLFOX6 (+/- bévacizumab) si métastases hépatiques exclusives ou prédominantes et fonction hépatiques conservées (recommandation : grade B) [Hendlisz et al. 2017].
En pratique pour ces patients chimiorésistants :
- La 1ère option à privilégier devra être le trifluridine tipiracil + bévacizumab (recommandation : grade A) sauf en cas d’altération moléculaire ciblable et/ou de maladie à prédominance hépatique (SIRT).
- Après échec de cette combinaison, le groupe de travail considère qu’il n’y a actuellement aucun argument scientifique solide pour privilégier le régorafenib ou le fruquintinib mais le fruquitinib a un profil de tolérance meilleur que le régorafénib (avis d’experts).
- Lorsqu’il existe une altération moléculaire d’intérêt (surexpression ou amplification d’HER2, mutation KRAS G12C, fusion réarrangement NTRK) il parait licite de discuter en RCP des alternatives ciblées correspondantes dès l’instauration du traitement par trifluridine/tipiracil + bévacizumab.
- De la même manière la présence de métastases hépatiques exclusives, ou à l’inverse de l’absence de métastase hépatique doivent faire discuter d’un traitement par SIRT ou par l’association balstilimab + botensillimab, respectivement.
- Dans cette perspective, le groupe de travail recommande de rechercher le plus tôt possible (idéalement en 1ère ligne) les altérations moléculaires d’intérêt et en particulier le type de mutation KRAS (G12C et autres mutations ciblables) et la présence d’une surexpression/amplification d’HER2. Dans l’idéal ces recherches moléculaires doivent se faire via les RCP moléculaire et le plan France génomique 2025 (plateformes AURAGEN et SEQUOIA).
1. REFERENCES pour un patient progressant sous chimiothérapie (Annexe 11) :
Les différents schémas sont à discuter en fonction des souhaits du patient, des toxicités et des contre-indications :
a- si progression sous LV5FU2 ou capécitabine :
- FOLFIRI [Tournigand et al. 2004 ; Andre et al. 1999] (recommandation : grade B)
+ bévacizumab en l’absence de contre-indication (accord d’experts)
+ cétuximab ou panitumumab si RAS WT (accord d’experts) - FOLFOX 4 ou 6 [Tournigand et al. 2004 ; Andre et al. 1999 ; Maindrault-Goebel et al. 1999 ; Maindrault-Goebel et al. 2000] (recommandation : grade B)
+ bévacizumab (accord d’experts)
+ cétuximab ou panitumumab si RAS WT (accord d’experts)
b- si progression sous 5FU/capécitabine-bévacizumab :
- FOLFIRI ou FOLFOX 4 ou 6 (recommandation grade B) + bévacizumab (accord d’experts)
- FOLFIRI + aflibercept hors AMM (avis d’experts)
c- si progression sous FOLFIRI :
- FOLFOX 4 ou 6 [Tournigand et al. 2004 , Andre et al. 1999 ; Maindrault-Goebel et al. 1999 ; Maindrault-Goebel et al. 2000] (recommandation : grade B)
+ bévacizumab [Giantonio et al. 2007] (recommandation : grade B)
+ cétuximab ou panitumumab si RAS WT (accord d’experts) - XELOX [117] (recommandation : grade B)
+ bévacizumab (recommandation : grade B)
d- si progression sous FOLFIRI-bévacizumab :
- FOLFOX 4 ou 6 ou XELOX (recommandation : grade A) + bévacizumab [Bennouna et al. 2013] (recommandation : grade A)
e- si progression sous FOLFIRI-cétuximab ou panitumumab :
- FOLFOX 4 ou 6 + bévacizumab [Giantonio et al. 2007] (recommandation : grade B)
f- si progression sous FOLFOX :
- FOLFIRI [Tournigand et al. 2004 ; Andre et al. 1999] (recommandation : grade B) + bévacizumab [Bennouna et al. 2013] ou aflibercept [Van Cutsem et al. 2012] (recommandation : grade A)
+ cétuximab ou panitumumab (si RAS WT) [Peters et al. 2010 ; Di Nicolantonio et al. 2008] (recommandation : grade B)
g- si progression sous FOLFOX-bévacizumab :
- FOLFIRI [Tournigand et al. 2004 ; Andre et al. 1999] (recommandation : grade B)
+ bévacizumab [Bennouna et al. 2013] ou aflibercept [Van Cutsem et al. 2012] (recommandation : grade A)
h- si progression sous FOLFOX-cétuximab ou panitumumab (si RAS WT) :
- FOLFIRI [Tournigand et al. 2004 ; Andre et al. 1999] (recommandation : grade B)
+ bévacizumab [Bennouna et al. 2013] ou aflibercept [Van Cutsem et al. 2012] (recommandation : grade A)
i- si progression sous immunothérapie (pembrolizumab ou nivolumab+ipilumumab) en L1 :
- Chimiothérapies « classiques » de L1 associée à une thérapie ciblée selon le profil moléculaire de la tumeur, le caractère résécable des métastases, la latéralité et le profil patient(accord d’experts)
- Les tumeurs BRAF V600E mutées seront préférentiellement traitées par l’association encorafenib + FOLFOX + cetuximab (avis d’experts)
j- si progression sous FOLFOX et/ou FOLFIRI seuls ou associés au bévacizumab/aflibercept et tumeur BRAF V600E muté :
- Encorafénib (encorafénib 300 mg/j per os) + cétuximab (400 mg/m² puis 250 mg/m²/semaine) en 2ème ou 3ème ligne [Kopetz et al. 2019] (recommandation : grade A).
- Encorafénib (encorafénib 300 mg/j per os) + cétuximab à la dose de 500 mg/m² tous les 14 jours en 2ème ou 3ème ligne (accord d’experts)
k- si progression sous 5FU, irinotecan, oxaliplatine +/- bévacizumab (FOLFIRINOX ou FOLFOXIRI) et RAS muté :
- Trifluridine/tipiracil (per os 70 mg/m2/j J1-J5, J8-J12 (J1=J28) + bevacizumab (recommandation : grade A) [Prager et al. 2023]
- Régorafénib en monothérapie (per os à 160 mg/j 3 semaines / 4) si état général OMS 0 ou 1 (recommandation : grade A) [Grothey et al. 2013]Le régorafénib peut être débuté à dose réduite (80 mg/j) et augmenté par palier de 40 mg chaque semaine s’il n’existe pas de toxicité reliée limitante, jusqu’à la dose maximale de 160 mg/j 3 semaines / 4. En cas de toxicité limitante reliée au traitement, le palier inférieur sera conservé (schéma REDOSE) (recommandation : grade C) [Bekaii-Saab et al. 2019
- Trifluridine/tipiracil (per os 70 mg/m2/j J1-J5, J8-J12 (J1=J28) seulement en cas de contre indication au bevacizumab (recommandation : grade A) [Mayer et al. 2015]
l- si progression sous 5FU, irinotecan, oxaliplatine +/- bévacizumab (FOLFIRINOX ou FOLFOXIRI) et RAS non muté :
- Cétuximab 400 mg/m 2 puis 250 mg/m2 hebdomadaire +/- irinotécan tous les 14 j (si RAS non muté) [Cunningham et al. 2004 ; Karapetis et al. 2008] (recommandation : grade B)
- Panitumumab 6 mg/kg tous les 14 j +/- irinotecan (si RAS non muté) [Van Cutsem et al. 2007 ; Amado et al. 2008] (recommandation : grade B)
- Soins palliatifs (ECOG PS > 2) ou essai thérapeutiques (accord d’experts)
m- si progression sous fluoropyrimidines, irinotécan, oxaliplatine, bévacizumab et cétuximab ou panitumumab (si RAS WT) :
- Trifluridine/tipiracil (per os 70 mg/m2/j J1-J5, J8-J12 (J1=J28) + bevacizumab. Cette option est à privilégier en l’absence d’anomalie moléculaire ciblable et de maladie hépatique prédominante (recommandation: grade A) [Prager et al. 2023]
- Régorafénib en monothérapie (per os à 160 mg/j 3 semaines / 4) si état général OMS 0 ou 1 (recommandation grade A) [Grothey et al. 2013]
- Le régorafénib sera plus favorablement débuté à dose réduite (80 mg/j) et augmenté par palier de 40 mg chaque semaine s’il n’existe pas de toxicité reliée limitante, jusqu’à la dose maximale de 160 mg/j 3 semaines / 4. En cas de toxicité limitante reliée au traitement, le palier inférieur sera conservé (recommandation : grade C) [Bekaii-Saab et al. 2019]
- Trifluridine/tipiracil (per os 70 mg/m2/j J1-J5, J8-J12 ; J1=J28) si contre indication au bevacizumab (recommandation grade A) [Mayer et al. 2015]
- SIR-Spheres® (Microspheres de résine marquées à l’Y-90) plus mFOLFOX6 (+/- bévacizumab) si metastases hépatiques exclusives ou prédominantes et fonction hépatiques conservées (recommandation : grade B) [Sharma et al. 2017]
n- si progression sous fluoropyrimidines, irinotécan, oxaliplatine, bévacizumab, cétuximab ou panitumumab (si RAS WT), trifluridine/tipiracil et/ou régorafénib
- Fruquintinib 5 mg/j 3 semaines sur 4 (recommandation : grade A) [Li et al. 2018 ; Dasari et al. 2023] (actuellement en accès compassionnel)
- Régorafénib en monothérapie (per os à 160 mg/j 3 semaines / 4) si état général OMS 0 ou 1 (recommandation grade A) [Grothey et al. 2013] Le régorafénib sera plus favorablement débuté à dose réduite (80 mg/j) et augmenté par palier de 40 mg chaque semaine s’il n’existe pas de toxicité reliée limitante, jusqu’à la dose maximale de 160 mg/j 3 semaines / 4. En cas de toxicité limitante reliée au traitement, le palier inférieur sera conservé (shéma REDOSE) (recommandation : grade C) [Bekaii-Saab et al. 2019]
- Rechallenge des antiEGFR (cétuximab ou panitumumab) (si RAS WT) en monothérapie ou associé à l’irinotecan si RAS sauvage en biopsie liquide (recommandation grade C)
o- si progression sous fluoropyrimidines, irinotécan, oxaliplatine, bévacizumab, cétuximab ou panitumumab (si RAS WT), régorafénib et trifluridine/tipiracil et fruquintinib :
- Larotrectinib (per os à 200 mg/j) ou entrectinib si fusion d’un des gènes NTRK (Tropomyosin related kinase fusion proteins) sans aucune autre option thérapeutique satisfaisante. La recherche sera à privilégier chez les patients restant en bon état général avec une tumeur ne présentant aucune autre mutation notamment sur RAS et BRAF (mutuellement exclusives). Une vigilance particulière devra porter sur les tumeurs dMMR et/ou MSI (fusion NTRK beaucoup plus fréquente dans ce sous-groupe). La recherche sera faite par test immunohistochimique confirmé par séquençage (NGS ARN) ou séquençage (NGS ARN) d’emblée. (recommandation : grade C) [Drilon et al. 2018 ; Marchiò et al. 2019]. (non remboursé)
- Trastuzumab (4 mg/kg puis 2 mg/kg / semaine) + Lapatinib (1000 mg/j) ou Trastuzumab (8 mg/kg puis 6 mg/kg / 3 semaines) + Pertuzumab (840 mg IV puis 420 mg / 3 semaines) ou T-Dxd (6,4 mg/kg / 3 semaines) ou Tucatinib associé au trastuzumab, si HER2 3+ ou 2+ FISH+ (recommandation : grade C) (non remboursé) [Narita et al. 2022 ; Meric-Bernstam et al. 2019 ; Satore-Bianchi et al. 2016 ; Wu et al. 2015 ; Siena et al. 2021 ; Siena et al. 2021 ; Wu et al. 2015 ; Strickler et al. 2022].
2. OPTIONS pour un patient progressif sous chimiothérapie
a- cétuximab (si RAS WT) administré tous les 14 j à la dose de 500 mg/m2 en 2h puis en 1h avec prémédication par corticoïdes et anti-H1 +/- associé à irinotécan [Tabernero et al. 2008, Pfeiffer et al. 2008 ; Wilke et al. 2008 ; Bouchahda et al. 2010 ; Ciuleanu et al. 2011] moins contraignant que le schéma hebdomadaire mais seulement validé par des résultats de pharmacodynamique et pharmacocinétique d’un essai de phase I et de séries rétrospectives (recommandation : grade C)
b- panitumumab (si RAS WT) 6 mg/kg tous les 14 j [Van Cutsem et al. 2007 ; Heun et al. 2007] après administration de cétuximab et survenue d’une allergie (sous surveillance compte tenu d’exceptionnelles allergies croisées) ou d’une intolérance à l’irinotécan (accord d’experts)
c- réintroduction de l’oxaliplatine [Maindrault-Goebel et al. 2004] si régression d’une neurotoxicité ayant justifié son arrêt (recommandation : grade C)
d- chimiothérapie intra-artérielle hépatique par oxaliplatine IA et par LV5FU2 IV [Boige et al. 2008] (recommandation : grade C) dans les centres expérimentés
e- irinotécan 90 mg/m2 à J1 et J3 de LV5FU2 simplifié (FOLFIRI 3) [Viel et al. 2008 ; Mabro et al. 2006 ; Bidard et al. 2009] après progression sous oxaliplatine (recommandation : grade C)
f- raltitrexed-oxaliplatine (TOMOX) [Seitz et al. 2002 ; Scheithauer et al. 2001] si contre-indication au 5FU (recommandation : grade C)
3. ESSAIS CLINIQUES pour un patient progressant sous chimiothérapie de 1ère ligne
Pas d'essai clinique
4.5. Evaluation de la réponse aux traitements par chimiothérapie et/ou biomédicament
1- REFERENCE pour l’évaluation de la réponse :
a- Selon les critères RECIST1.1 ou e-RECIST (immunothérapie).
b- Elle devra être faite par la même méthode d’imagerie après 2 à 3 mois de traitement (la méthode de référence est le scanner).
c- Elle devra prendre en compte les réponses vasculaires sous antiangiogéniques avec parfois un aspect de pseudo-progression notamment en cas de nécrose tumorale pouvant majorer artificiellement la taille tumorale et/ou faire apparaitre des lésions initialement infra-radiologiques.
d- L’évaluation de la réponse à l’immunothérapie devra par ailleurs prendre en compte une possible pseudo-progression traduisant une sensibilité au traitement. Dans ce cas il existe fréquemment une discordance entre l’imagerie et l’état général du patient qui s’améliore avec une diminution des marqueurs tumoraux. L’immunothérapie ne devra pas être stoppée et un contrôle de l’imagerie devra être effectuée entre 4 à 8 semaines plus tard.
2- Conduite à tenir selon la réponse observée :
- En cas de réponse majeure : la chirurgie devra être rediscutée en RCP y compris pour un patient sous immunothérapie et quelque-soit la ligne de traitement et a fortiori chez les patients avec métastases hépatiques exclusives.
- En cas de réponse ou de stabilité sous chimiothérapie d’induction de 1ère et 2ème ligne : poursuite de la chimiothérapie ou discussion avec le patient d’une pause thérapeutique jusqu’à progression avec réévaluation tous les 2 mois ou d’un traitement d’entretien en cas de bi-CT initiale. En cas de réponse majeure, la pause thérapeutique peut se justifier (recommandation grade C) [Simkens et al. 2015 ; Berry et al. 2015]. Le 5FU/capécitabine +/- associé au bévacizumab constitue le traitement d’entretien à privilégier après une chimiothérapie d’induction associée au bevacizumab (recommandation grade B). De nombreux essais ont également montré un bénéfice en terme de PFS à un allégement thérapeutique de type 5FU/capecitabine +/- antiEGFR après une chimiothérapie d’induction associée à un antiEGFR [Pietrantonio et al. 2019 ; Modest et al. 2022]. Aucune des stratégie d’entretien ou d’allégement thérapeutique n’a démontré d’impact sur la survie globale. En cas de stabilité, il n’y a pas lieu de reprendre la CT d’induction. En cas de progression, une reprise de la chimiothérapie +/- biothérapie ayant amené au contrôle initial de la maladie doit être envisagée.
- En cas de progression sous chimiothérapie : arrêt ou changement de protocole de CT (Annexe 11).
4.6. Quel traitement de la tumeur primitive colique en cas de métastases synchrones non résécables ?
1- REFERENCES
a- si la tumeur primitive est symptomatique (hémorragie, sténose) : discuter chirurgie (résection ou stomie d’amont) ou prothèse endoscopique (si sténose occlusive et soins palliatifs exclusifs envisagés)
b- si elle est asymptomatique : 2 essais de phase III n’ont pas montré de bénéfice à la résection de la tumeur primitive en cas de métastases synchrones non résécables asymptomatique [Kanemitsu et al. 2021 ; Van der Kruijssen et al. 2021]. La résection de la tumeur primitive ne doit donc pas être réalisée dans cette situation
2. OPTION
Mise en place d’un cathéter pour chimiothérapie intra-artérielle hépatique au décours de la laparotomie pour colectomie si métastases hépatiques isolées, en centre spécialisé (recommandation : grade C).
4.7. Quel traitement de la tumeur primitive rectale en cas de métastases synchrones non résécables ?
Cf. chapitre 5 « Cancer du rectum » du TNCD
4.8. Place des traitements locorégionaux dans le traitement des métastases hépatiques
Les traitements intra-artériels hépatiques
a- Chimiothérapie Intra-Artérielle Hépatique (CIAH) :
Injecter directement un traitement oncologique dans les artères hépatiques permet d’augmenter l’effet local tout en diminuant les effets systémiques. Cela se justifie aussi par le fait que la vascularisation des métastases hépatiques de plus de 5 mm est à 80 % artérielle, alors que le foie sain a une vascularisation essentiellement portale. Les traitements intra-artériels peuvent avoir une place dans 3 situations distinctes :
- en situation néo-adjuvante afin d’obtenir un downstaging plus important des lésions hépatiques et ainsi faciliter une résection chirurgicale R0
- en situation adjuvante d’une résection hépatique afin de diminuer le taux de récidive
- en situation palliative permettant de traiter une maladie chimiorésistante afin d’augmenter la survie.
La CIAH est la technique la plus ancienne, et consiste à injecter de la chimiothérapie, le plus souvent de l’oxaliplatine, dans les artères hépatiques. Deux nouveaux types de traitements intra-artériels ont été récemment développés, la chimio-embolisation à l’irinotécan (DEBIRI) et la radio-embolisation hépatique (REL) (ThéraSphère® ou SIR-sphère®). Ces traitements ne sont envisageables qu’en cas de maladie hépatique prédominante (≤ 5 lésions extra-hépatiques n’engageant pas le pronostic vital) et de fonction hépatique conservée (bilirubine ≤ 2N). Dès lors qu’il y a des métastases hépatiques prédominantes de CCR, non résécables d’emblée, la question d’un traitement intra-artériel doit maintenant se poser systématiquement (environ 15 % des patients).
La CIAH a été utilisée initialement en comparaison au 5FU intra-veineux et a démontré une efficacité supérieure au 5FU seul [Kemeny et al. 2006]. Il n’y a pas d’essai randomisé publiés comparant la CIAH aux protocoles récents de chimiothérapie. Actuellement elle est préférentiellement utilisée en 1ère ou 2ème ligne de traitement afin de permettre une résection chirurgicale des métastases, notamment chez les patients résistants à une chimiothérapie systémique en raison de taux de réponse élevé (≈90%) et de conversion à la chirurgie (≈40%) [Morcellin et al. 2009 ; Malka et al. 2010 ; Kemeny et al. 2009 ; Boige et al. 2008 ; Levi et al. 2016]. Elle pourrait également être intéressante en situation adjuvante de résection de métastases hépatiques [Goere et al. 2013]. Cependant, la CIAH est une technique complexe, réalisée dans peu de centres et non validée dans des essais de phase III. Les essais OSCAR et PACHA testent actuellement l’intérêt de la CIAH dans des essais randomisés respectivement en 1ère ligne et en situation adjuvante après chirurgie de métastases hépatiques.
b- Le DEBIRI est une chimioembolisation hépatique
Avec des billes chargées à l’irinotécan en injection intra-artérielle hépatique. L’étude de phase III de Fiorentini et al. chez 74 patients en situation de chimiorésistance a mis en évidence une survie globale significativement meilleure avec le DEBIRI comparé au FOLFIRI systémique (22 mois versus 15 mois, p=0,031) [Fiorentini et al. 2012]. Il n’y a pas de donnée d’étude randomisée en situation néo-adjuvante ou adjuvante de résection de métastases hépatiques mais uniquement des séries de cas [Jones et al. 2016]. Un essai de phase II monobras a testé la combinaison DEBIRI plus FOLFOX en 1ère ligne de traitement mais n’a pas objectivé d’amélioration de la SSP à 9 mois (essai FFCD 1201) [Pernot et al 2020].
c- La Radio-Embolisation (REL) utilise des microsphères d’Yttrium90 (SIRT)
Emettent un rayonnement β avec une demi-vie de 64,2 heures, une pénétration tissulaire de 2,5 mm et une énergie moyenne de 0,937 MeV), injectées dans l’artère hépatique, qui émettent un rayonnement β et permettent de traiter les MHCCR. Elle a une AMM dans le traitement des MHCCR en échappement à la chimiothérapie. La radio-embolisation nécessite une phase préparatoire afin de déterminer les shunts pulmonaire et digestif pour éventuellement les obstruer. L’essai randomisé de phase III d’Hendlisz et al. en 2010 a évalué la REL chez des patients avec des MHCCR en échappement [Hendlisz et al. 2010]. Les patients recevaient soit du 5FU intra-veineux seul (n=23), soit en association avec la REL (n=21). Il existait une différence significative en survie sans progression, 2,1 mois dans le bras 5FU versus 5,5 mois dans le bras 5FU plus REL (HR=0,38; 95%IC, 0,2-0,72, p=0,003), mais pas de différence significative en survie globale (7,3 mois versus 10, 0 mois). La tolérance était excellente. Des résultats similaires ont été retrouvés dans une autre étude rétrospective australienne chez 302 patients avec des MHCCR non résécables et résistantes à la chimiothérapie [Saxena et al. 2015]. La médiane de SG après REL chez des patients en échappement est de 8,3 à 36 mois selon les études, avec à 2 ans une survie de 0 à 39% et un taux de réponse compris entre 0 et 73% [Stubbs et al. 2006 ; Murthy et al. 2005]. Ainsi, les survies obtenues avec la REL semblent nettement supérieures à la poursuite d’une chimiothérapie systémique de niéme ligne qui permettent des taux de contrôle de la maladie très faibles et des SG de l’ordre de 4 à 6 mois. L’essai FOXFIRE GLOBAL a évalué l’efficacité et la tolérance de la REL en 1ère ligne chez des patients ayant un CCR avec métastases hépatiques prédominantes non résécables. Cet essai de phase III randomisé comparait le FOLFOX ± bévacizumab au FOLFOX ± bévacizumab plus REL. Il a été mis en évidence un gain en SSP hépatique mais pas en SSP ni en SG [Sharma et al. 2017]. Une métaanalyse des essais de REL en 1ère ligne a confirmé l’absence de bénéfice en termes de SSP et de SG [Wasan et al. 2017]. A l’inverse, dans l’étude multicentrique de phase III EPOCH qui a évalué, chez les patients avec MHCCR prédominantes en progression après une 1ère ligne de chimiothérapie, une 2ème ligne de chimiothérapie seule versus 2ème ligne de chimiothérapie plus REL, il existait une amélioration de la SSP hépatique et de la SSP en faveur de la REL [Mulcahy et al. 2021].
1. REFERENCES pour les traitements intra-artériels hépatiques
a. SIRT (REL) : en situation palliative en cas de maladie hépatique prédominante résistante à la chimiothérapie systémique (recommandation : grade B)
2. OPTIONS pour les traitements intra-artériels hépatiques
En cas de maladie à prédominance hépatique non résécable d’emblée.
a. CIAH :
- En post-opératoire associée à une CT systémique en cas de probable missing métastases ou à haut risque de récidive (recommandation : grade C).
- En pré-opératoire associée à une CT systémique si la CT systémique seule n’a pas permis un downstaging suffisant ou ne permettra pas un downstaging suffisant (recommandation : grade C).
- En situation palliative en cas de maladie résistante à la chimiothérapie systémique (accord d’experts).
b. DEBIRI : en situation palliative en cas de maladie hépatique prédominante et résistante à la chimiothérapie systémique (avis d'experts)
3. ESSAIS CLINIQUES pour les traitements intra-artériels hépatiques :
- PRODIGE 49 - OSCAR : Oxaliplatine Systémique ou en Chimiothérapie intra-ARtérielle combiné au LV5FU2 et une thérapie ciblée en première ligne de traitement des cancers colorectaux métastatiques limités au foie. Etude de phase III randomisée multicentrique. Coordonnateur : J Taïeb (Paris).
https://www.ffcd.fr/index.php?option=com_content&view=article&id=83&etude=00058&Itemid=144 - FFCD 1709 - SIRTCI-01 : Etude prospective, multicentrique, ouverte, de phase 2, évaluant l’efficacité et la tolérance de la radio- thérapie interne vectorisée associée au XELOX, bévacizumab et atézolizumab (inhibiteur du point de contrôle immunitaire) chez les patients atteints d’un cancer colorectal métastasique. Coordonnateur : D Tougeron (Poitiers).
https://www.ffcd.fr/index.php?option=com_content&view=article&id=83&etude=00140&Itemid=144
Destruction focalisée
Les techniques de destruction focalisée sont divisées en 2 catégories, basées ou non sur une destruction thermique.
- Les techniques basées sur la température les plus utilisées sont la radiofréquence uni ou bi-polaire, les micro-ondes et la cryothérapie.
- L’électroporation irréversible est la technique de destruction non thermique la plus répandue.
Toutes les techniques de destruction focalisée peuvent être employée de manière percutanée ou au cours d’un abord chirurgical (laparotomie ou laparoscopie).
Le traitement de référence, à visée curative, des métastases hépatiques (ou pulmonaires) d’origine colorectale restait la chirurgie d’exérèse [Cirocchi et al. 2012]. L’essai de phase III COLLISION a montré que la thermo-ablation n’était pas inférieur à la résection chirurgicale pour les métastases de moins de 3 cm (n < 10) en terme de survie globale. La thermo-ablation réduisait la durée d’hospitalisation et les complications avec un meilleur contrôle local [Van der Lei et al. 2025].
Choix de la technique de destruction focalisée
La réalisation d’une technique plutôt qu’une autre ne peut être recommandée même si la trechnique la plus utilisée est la radiofréquence en France.
- La destruction par micro-onde (micro wave) pourrait être associée à un risque de récidive locale plus faible que la radio-fréquence [Correa-Gallego et al. 2014], mais peu de données comparatives et à long terme ont été publiées.
- L’électroporation irréversible est en cours d’évaluation et peut-être proposée, lorsqu’elle est disponible, seulement en cas de contre-indication technique des autres techniques de destruction focalisée, notamment contact vasculaire.
Indications thérapeutiques des destructions focalisées
Indications thérapeutiques des destructions focalisées
Critères d’efficacité : Les meilleurs résultats carcinologiques sont obtenus lorsque les métastases sont petites (<3cm), en nombre limité (<5), à distance des structures vasculaires et biliaires [Gillams et al. 2015].
Métastases hépatiques résécables
- En cas de contre-indication chirurgicale
- En cas de métastases hépatiques de petite taille et en nombre limité, dont la localisation nécessiterait une résection hépatique étendue, une destruction focalisée peut être discutée.
- En cas de métastase hépatique susceptible de disparaître sous chimiothérapie, une destruction focalisée ou le repérage par un coil hépatique avant le début de la chimiothérapie peuvent être discutés.
- En alternative à la résection si métastases < 3 cm [Van der Lei et al. 2025] (recommandation grade A)
Métastases hépatiques non résécables
- Lorsque l’ensemble de la maladie métastatique hépatique ne peut être réséquée à cause d’un futur foie restant insuffisant et/ou exposant à risque élevé d’insuffisance hépatique post-opératoire, la combinaison des techniques de résection et de destruction focalisée peut être proposée si elle permet une chirurgie R0/R1 [Evrard et al. 2012]. (recommandation : grade B)
- Lors d’une chirurgie hépatique en deux temps, une technique de destruction focalisée peut être utilisée lors du premier et/ou du deuxième temps hépatique [Chua et al. 2012].
- Si les métastases hépatiques sont non résécables mais toutes accessibles à un traitement par destruction focalisée (<10 métastases), l’association chimiothérapie et destruction focalisée permet d’obtenir de meilleures survies, sans progression et globale, qu’une chimiothérapie palliative [Ruers et al. 2017 ; Van der Lei et al. 2025] (recommandation : grade B).
Surveillance après destruction focalisée
- La surveillance après destruction focalisée est identique à celle réalisée après résection. Cependant, l’évaluation de la destruction tumorale per-procédure est difficile, il est donc nécessaire de réaliser une imagerie de contrôle (TDM ou IRM), 1 à 2 mois après le geste de destruction focalisée.
- L’évolution habituelle de la cicatrice de destruction est la diminution de taille à partir du 3ème mois.
- Les signes évocateurs de récidive locale sont : l’augmentation de taille de la cicatrice et/ou une prise de contraste au sein de la lésion en TDM (particulièrement en périphérie).
- En cas de doute diagnostique, la réalisation d’une IRM et/ou d’un TEP scanner peut-être utile [Stoltz et al. 2014].
Contre-indications techniques de la destruction focalisée
Les facteurs de risque de complications sont : ascite, trouble de l’hémostase sévère non corrigeable, cirrhose, localisation sous-capsulaire, dilatation des voies biliaires intrahépatiques, métastases au contact d’une structure digestive ou biliaire de premier ordre, prothèse biliaire, destruction multiple (> 3), présence d’une anastomose bilio-digestive, expérience < 50 procédures. Il s’agit donc, pour la plupart, de contre-indications relatives, dépendantes de l’expertise de l’équipe de radiologie interventionnelle.
Radiothérapie stéréotaxique
Considérations cliniques et techniques lors du traitement des métastases hépatiques du cancer colorectal (MHCCR) avec radiothérapie stéréotaxique (SBRT : « stereotactic body radiotherapy »).
Grâce à l’émergence de logiciels de planification de traitement et de méthodes de guidage d’image, les champs de traitement de radiothérapie permettent d’administrer des doses plus élevées en moins de séances au sein de lésions tumorales hépatiques ciblées tout en minimisant l’irradiation des tissus sains environnants et réduisant le risque de maladie hépatique radio induite.
En cas de difficulté à visualiser les tumeurs hépatiques, des marqueurs radio opaques (fiducials) peuvent être utilisés pour le suivi du positionnement.
La contrainte de dose impose le maintien de 700 mL de foie sain recevant moins de 15 Gy en 3-5 fractions. Ainsi en prenant en compte ces contraintes et en sélectionnant les patients sur la fonction hépatique (hépatopathie sous-jacente), il existe moins de 5 % de risque de développer un maladie hépatique radio-induite [Depuydt et al. 2011 ; Pan et al. 2010].
La toxicité la plus importante est gastro-intestinale avec un risque de gastrite ou de duodénite réactionnelle. Elle peut constituer un facteur limitant de la technique.
Indications pertinentes de la radiothérapie stéréotaxique
Indication curative : Maladie oligométastatique (OMD)
- Stratégie thérapeutique R0 avec traitement ablatif local +/- précédée par une chimiothérapie systémique chez des patients non opérables sans possibilité de recours à d’autres traitements ablatifs locaux (radiofréquence ou le micro-onde) (accord d’experts) [ESMO. 2022 ; Hoyer et al. 2012]. Les tumeurs les plus petites ont été associées à un meilleur contrôle local [Rusthoven et al. 2009 ; Herfarth et al. 2001]. Un taux de contrôle local supérieur à 90 % a été atteint lorsque des doses de 46-52 Gy dans 3 fractions ont été livrées [Chang et al. 2011]
- Pour les patients avec OMD plus extensive impliquant plus de sites ou de lésions, par exemple : tumeur primaire, foie, poumon, péritoine, ganglions, os, cerveau, ovaire et plus de 4 organes les interventions ablatives localisées (dont la SBRT) peuvent être discutées combinées à une thérapie systémique [Weiser et al. 2013]
- Il n’existe que peu d’études comparatives / essais cliniques de phase III entre SBRT et autres techniques ablatives locales en cours :
- Clinical trial NCT01233544 : comparant Radiofréquence Versus SBRT au sein des métastases hépatiques de CCR
- Clinical Trial NCT00892424 comparant SBRT et sorafénib dans le traitement de métastases hépatiques non résécables
- SBRT versus radiofréquence (RF) ? [Stintzing et al. 2013]
- La SBRT est à discuter en cas de patient non opérable et de contre-indications relatives à la RF ou de facteurs prédictifs d’inefficacité : le voisinage de la métastase avec les vaisseaux, un endroit proche de la capsule du foie, un diamètre maximal de la lésion dépassant 30 mm [Bleicher et al. 2003].
- Indication palliative : radiothérapie hépatique faible dose, « low-dose whole-liver radiotherapy » (WLRT)
- Lorsque les métastases hépatiques sont multiples non résécables et devenues symptomatiques, la WLRT semble correspondre à un traitement potentiel palliatif. En effet, des études prospectives ont montré des effets considérables après WLRT, avec diminution de la douleur dans 55 % à 80 % des cas [254]. Les taux de toxicité attendus avec ces faibles doses d’irradiation et avec un traitement antiémétique sont très faibles [Bydder et al. 2003].
1. REFERENCE de la radiothérapie stéréotaxique
Pas de référence en l’absence d’essai randomisé pertinent
2. OPTIONS de la radiothérapie stéréotaxique (accord d'experts)
a-Maladie résiduelle après chimiothérapie ou oligo-métastases lorsque patients non résécables chirurgicalement et/ou non opérables et/ou non accessibles à un traitement per-cutané après discussion en RCP avec avis du chirurgien hépatique – radiologue et radiothérapeute
b-Limites de la SBRT : en volume et en taille selon le pourcentage de foie sain
c-Indiquée en particulier lorsqu’il existe une contre-indication aux traitements radiologiques :
- Métastase proche des vaisseaux
- Métastase proche de la capsule hépatique
- Diamètre maximal de la lésion dépassant 30 mm
d-Possible si repousse après traitement radiologique et vice versa
e-Par contre, prendre en compte la proximité des voies biliaires et la muqueuse gastro-duodénale.
4.9. Les prothèses coliques ou rectales
Quelle que soit la situation, une discussion médico-chirurgicale doit avoir lieu avant toute décision thérapeutique. La pose d’une prothèse colique n’est pas recommandée en l’absence de signes cliniques et radiologiques d’occlusion, même lorsque la tumeur n’est pas franchissable par un endoscope.
La prothèse colique est contre-indiquée en cas de perforation, de souffrance colique d’amont clinique et/ou radiologique, de cancer du bas ou du moyen rectum, d’occlusion du grêle par incarcération associée.
Délai de mise en place
- La pose d’une prothèse colique dans le cancer colorectal compliqué d’occlusion doit s’envisager dans les 12 à 24 heures suivant l’admission (avis d’experts).
- Ce délai est conditionné par : la présence de signes de souffrance colique (clinique et/ou radiologique), le diamètre du cæcum, l’ancienneté et l’intensité des symptômes occlusifs (occlusion franche), et la nécessaire obtention des meilleures conditions d’examen (anesthésiques et techniques).
Technique endoscopique ou radiologique ?
La pose de prothèse colique doit être réalisée par voie endoscopique et sous contrôle radiologique (accord d’experts).
- Environnement et conditionnement du malade : l’absence d’opérateur entrainé et de structure adaptée est une contre-indication à la mise en place d’une prothèse colique. Il est indispensable d’obtenir les meilleures conditions d’examen. La préparation du malade doit se faire par voie rectale. La réalisation du geste sous anesthésie générale avec intubation et en décubitus dorsal doit être privilégiée (accord d’experts). L’utilisation de polyéthylène glycol (PEG) et d’autres préparations par voie orale est contre indiquée.
- Matériel spécifique : l’utilisation d’un insufflateur à CO2 et d’une pompe de lavage est recommandée (avis d’experts).
- Technique de pose : la dilatation préalable et le passage de la sténose par l’endoscope de gros calibre sont à proscrire (accord d’experts). L’utilisation du matériel de cathétérisme bilio-pancréatique est préconisée, notamment des fils-guides longs à extrémité hydrophile non traumatique. Les biopsies en nombre suffisant pour un diagnostic anatomopathologique et d’éventuelles analyses de biologie moléculaire (RAS, statut MSI) sont indispensables pour la prise en charge ultérieure. La pose de repères radio-opaques externes est à éviter.
Matériel prothétique
Il est recommandé d’utiliser des prothèses métalliques auto-expansibles non couvertes, de taille adaptée à la forme et à la longueur de l’obstacle et au moins 4 cm plus longues que la sténose.
Les situations et localisations particulières
Il faut éviter la pose de prothèse dans le bas rectum (tumeurs situées à moins de 3 à 5 cm de la marge anale) (recommandation : grade C).
- La prothèse colique en situation curative : préalable à la chirurgie, n’est pas recommandée (tumeur non métastatique ou métastatique résécable, patient opérable) (recommandation : grade C). Elle n’est envisageable que si la chirurgie première n’est pas possible.
- La prothèse colique en situation palliative : la prothèse colique en situation palliative (métastases non résécables, patient non opérable) est une option (recommandation : grade C). Elle réduit le recours à la stomie, la durée d’hospitalisation et la morbimortalité ; elle permet de commencer plus rapidement une chimiothérapie et pourrait ainsi réduire les coûts. Dans cette situation, la chirurgie est l’autre option, à privilégier chez les patients les plus jeunes ou sans comorbidité importante.
- Prothèse colique et anti-angiogéniques : compte tenu du risque majoré de perforation colique, il est recommandé de ne pas administrer un traitement anti-angiogénique chez des patients porteurs d’une prothèse colique (accord d’experts). De même, il est recommandé de ne pas mettre en place une prothèse colique chez un patient traité par un anti-angiogénique.
Ces recommandations permettent d’élaborer un arbre décisionnel (Annexe 6).
4.10. Surveillance post-thérapeutique
Après traitement curatif
1. REFERENCES pour la surveillance chez les patients capables de supporter une ré-intervention ou une chimiothérapie (recommandation : grade C)
a-Examen clinique tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans
b-Scanner abdominal tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans (A défaut : échographie abdominale)
c-Scanner thoracique tous les ans pendant 5 ans (scanner thoracique tous les 6 mois pendant 3 ans si métas pulmonaires réséquées) (A défaut : radiographie pulmonaire
d-Coloscopie à 3 ans puis tous les 5 ans si normale :
- sauf si 3 adénomes ou plus dont un > 1 cm ou contingent villeux ou en dysplasie de haut grade => à 3 an
- sauf si syndrome HNPCC => tous les 1 à 2 ans
- sauf si exploration colique pré-opératoire incomplète => dans les 3 à 6 mois suivant la colectomie.
2. OPTIONS
- ACE tous les 3 mois s’il était élevé avant le traitement.
Après radiofréquence [Parikh et al. 2002 ; De Baere et al. 2003] cf. chapitre « Surveillance après destruction focalisée »
1. REFERENCES (recommandation : grade C)
a-Scanner ou IRM à 2 mois puis tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans. Les critères d’efficacité sur un scanner sont :
- Hypodensité présente sur tous les temps vasculaires
- Taille supérieure à la taille de la lésion traitée
- Absence de prise de contraste
- Pas de nouvelle lésion
2. OPTIONS (accord d'experts)
a-TEP scanner : si doute à la TDM ou IRM
b-Échographie Doppler avec contraste si doute à la TDM ou IRM
c-ACE tous les 3 mois s’il était élevé avant le traitement.
Pendant le traitement palliatif
1. REFERENCES (recommandation : grade C)
Avant chaque cure :
a-Examen clinique (poids, état général, tolérance de la CT avec examen neurologique si oxaliplatine, mesure de la pression artérielle si bévacizumab et examen cutané si cétuximab ou panitumumab) (cf. annexes 1 et 2 pour anti-EGFR et bévacizumab)
b-NFS + plaquettes (plus bilirubinémie si irinotécan ; plus clairance de la créatinine si capécitabine ou oxaliplatine ; plus transaminases si capécitabine ; plus bandelette urinaire si bévacizumab ; plus Mg si anti-EGFR).
Tous les 2 à 3 mois (= 4 à 6 cures si chimiothérapie /14 j ou 3 à 4 cures si chimiothérapie / 21 j) :
a- Scanner avec injection avec mesure des diamètres des principales métastases mesurables (critères RECIST 1.1) ou IRM abdominale plus TDM tho non injecté si CI à l’injection.
2. OPTIONS (accord d'experts)
a-Échographie si scanner / IRM impossible, par le même opérateur (mesure comparative)
b-ACE en particulier si maladie non mesurable avec dosage à chaque cure pour calcul de la cinétique [Iwanicki-Caron et al. 2008]
c-CA19-9 si élevé initialement et ACE normal.
4.11. Traitement des récidives
En cas de récidive de métastases discuter la résécabilité et l’opérabilité
- Si résécables et opérables : les résections itératives permettent d’obtenir des résultats comparables aux premières résections ; une nouvelle hépatectomie est justifiée sur les mêmes critères que la première résection [Chiche et al. 2003] (recommandation : grade C)
- Si non résécables
Prise en charge selon les recommandations concernant les maladies métastatiques non résécables
4.12. Bibliographie
- Adam R, de Haas RJ, Wicherts DA, Aloia TA, Delvart V, Azoulay D, et al. Is hepatic resection justified after chemotherapy in patients with colorectal liver metastases and lymph node involvement? J Clin Oncol 2008;26:3672-80
- Adam R, Laurent A, Azoulay D, Castaing D, Bismuth H. Two-stage hepatectomy: a planned strategy to treat irresectable liver tumors. Ann Surg 2000;232:777-85.
- Adam R, Pascal G, Castaing D, Azoulay D, Delvart V, Paule B et al. Tumor progression while on chemotherapy: a contraindication to liver resection for multiple colorectal metastases? Ann Surg 2004;240:1052-61
- Adam R, Piedvache C, Chiche L, Adam JP, Salamé E, Bucur P et al. Liver transplantation plus chemotherapy versus chemotherapy alone in patients with permanently unresectable colorectal liver metastases (TransMet): results from a multicentre, open-label, prospective, randomised controlled trial. Lancet 2024; 404; 1107–18
- Adams RA, Meade AM, Seymour MT, Wilson RH, Madi A, Fisher D et al. Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol 2011;12:642-53.
- Amado RG, Wolf M, Peeters M, Van Cutsem E, Siena S, Freeman DJ, et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008;26:1626-34
- André T, Bensmaine MA, Louvet C, François E, Lucas V, Desseigne F. Multicenter phase II study of bimonthly high-dose leucovorin, fluorouracil infusion and oxaliplatin for metastatic colorectal cancer resistant to the same leucovorin and fluorouracil regimen. J Clin Oncol 1999;17;11:3560-8.
- André T, Louvet C, Maindrault-Goebel F, Couteau C, Mabro M, Lotz JP. CPT-11 (irinotecan) addition to bimonthly, high-dose leucovorin and bolus and continuous-infusion 5-fluorouracil (FOLFIRI) for pretreated metastatic colorectal cancer. Eur J Cancer 1999;35;9 :1343-7.
- André T, Shiu KK, Kim TW et al. Pembrolizumab in Microsatellite-Instability–High Advanced Colorectal Cancer. N Engl J Med 2020; 383:2207-2218
- Andre T, Elez E, Van Cutsem E, et al; CheckMate 8HW Investigators. Nivolumab plus Ipilimumab in Microsatellite-Instability-High Metastatic Colorectal Cancer. N Engl J Med. 2024 ;391(21):2014-2026. doi: 10.1056/NEJMoa2402141. PMID: 39602630
- André T, Elez E, Lenz HJ, Jensen LH, Touchefeu Y, Van Cutsem E,et al. Nivolumab plus ipilimumab versus nivolumab in microsatellite instability-high metastatic colorectal cancer (CheckMate 8HW): a randomised, open-label, phase 3 trial. Lancet. 2025 ;405(10476):383-395. doi: 10.1016/S0140-6736(24)02848-4. Epub 2025 Jan 25.
- Aparicio T Ghiringhelli F, Boige V et al. Bévacizumab Maintenance Versus No Maintenance During Chemotherapy-Free Intervals in Metastatic Colorectal Cancer: A Randomized Phase III Trial (PRODIGE 9). J Clin Oncol 2018 Mar 1;36(7):674-681
- Aparicio T, Bennouna J, Le Malicot K, Boige V, Taieb J, Bouché O, Phelip JM, François E, Borel C, Faroux R, Dahan L, Bachet JB, Egreteau J, Kaminsky MC, Gornet JM, Cojocarasu O, Gasmi M, Guerin-Meyer V, Lepage C, Ghiringhelli F; for PRODIGE investigators/collaborators. Predictive factors for early progression during induction chemotherapy and chemotherapy-free interval: analysis from PRODIGE 9 trial. Br J Cancer. 2020 Mar;122(7):957-962.
- Aparicio T, Canouï-Poitrine F, Caillet P, François E, Cudennec T, Carola E, Albrand G, Bouvier AM, Petri C, Couturier B, Phelip JM, Bengrine-Lefevre L, Paillaud E. Treatment guidelines of metastatic colorectal cancer in older patients from the French Society of Geriatric Oncology (SoFOG). Dig Liver Dis. 2020;52:493-505.
- Aparicio T, Lavau-Denes S, Phelip JM et al. Randomized phase III trial in elderly patients comparing LV5FU2 with or without irinotecan for first-line treatment of metastatic colorectal cancer (FFCD 2001-02). Ann Oncol 2016.27:121-7
- Ardalan B, Luis R, Jaime M, Franceschi D. Biomodulation of Fluorouracil in colorectal cancer. Cancer Invest. 1998;16(4):237-51. Review.
- Aussilhou B, Dokmak S, Faivre S et al. Preoperative liver hypertrophy induced by portal flow occlusion before major hepatic resection for colorectal metastases can be impaired by bévacizumab. Ann Surg Oncol 2009;16:1553-9.
- Aussilhou B, Dokmak S, Faivre S, Paradis V, Vilgrain V, Belghiti J. Preoperative liver hypertrophy induced by portal flow occlusion before major hepatic resection for colorectal metastases can be impaired by bévacizumab. Ann Surg Oncol 2009;16:1553-9
- Ayav A, Navarra G, Basaglia E, Tierris J, Healey A, Spalding D,et al. Results of major hepatectomy without vascular clamping using radiofrequency-assisted technique compared with total vascular exclusion. Hepatogastroenterology 2007;54:806-9.
- Bachmeyer C, Reguiaï Z, Peuvrel L, Bachet JB, Bensadoun RJ, Ychou M et al. Cutaneous adverse reactions of EGFR (epidermal growth factor receptor)-inhibitors: therapeutic algorithm of the French PROCUR group. Bull Cancer. 2013;100:417-26.
- Barimani D, Kauppila JH, Sturesson C, Sparrelid E et al. Imaging in disappearing colorectal liver metastases and their accuracy: a systematic review. World J Surg Oncol. 2020 Oct 8;18(1):264.
- Becouarn Y, Ychou M, Ducreux M, Borel C, Bertheault-Cvitkovic F, Seitz JF et al. Phase II trial of oxaliplatin as first-line chemotherapy in metastatic colorectal cancer patients. Digestive Group of French Federation of Cancer Centers. J Clin Oncol 1998;16:2739-44.
- Bekaii-Saab TS, Ou FS, Ahn DH et al. Régorafénib dose-optimisation in patients with refractory metastatic colorectal cancer (ReDOS): a randomised, multicentre, open-label, phase 2 study. Lancet Oncol. 2019;20:1070-1082
- Bellera CA, Rainfray M, Mathoulin-Pelissier et al. Screening older cancer patients: first evaluation of the G-8 geriatric screening tool. Ann Oncol 2012;23:2166-72
- Bennouna J, Sastre J, Arnold D, Osterlund P, Greil R, Van Cutsem E et al. Continuation of Bévacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncol 2013;14:29-37
- Benoist S, Brouquet A, Penna C, Julié C, El Hajjam, Chagnon S, et al. Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol 2006;24:3939-45.
- Benoist S, Pautrat K, Mitry E, Rougier P, Penna C, Nordlinger B. Treatment strategy for patients with colorectal cancer and synchronous irresectable liver metastases. Br J Surg 2005;92:1155-60.
- Benoist S, Salabert AS, Penna C, Karoui M, Julié C, Rougier P, et al. Portal triad clamping (TC) or hepatic vascular exclusion (VE) for major liver resection after prolonged neoadjuvant chemotherapy? A case- matched study in 60 patients. Surgery 2006;140:396-403
- Benvenuti S, Sartore-Bianchi A, Di Nicolantonio F, Zanon C, Moroni M, Veronese S et al. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to anti- epidermal growth factor receptor antibody therapies. Cancer Res 2007;67:2643-8.
- Berry SR, Cosby R, Asmis T, et al. Continuous versus intermittent chemotherapy strategies in metastatic colorectal cancer: a systematic review and meta-analysis. Ann Oncol. 2015;26:477-85
- Bidard FC, Tournigand C, André T, Mabro M, Figer A, Cervantes A et al. Efficacy of FOLFIRI-3 (irinotecan D1,D3 combined with LV5-FU2) or other irinotecan-based regimens in oxaliplatin-pretreated metastatic colorectal cancer in the GERCOR OPTIMOX1 study. Ann Oncol 2009;20:1042-7
- Bleicher RJ, Allegra DP, Nora DT, et al. Radiofrequency Ablation in 447 Complex Unresectable Liver Tumors: Lessons Learned. Ann Surg Oncol. 2003 Jan 1;10(1):52–8
- Boeckx N, Koukakis R, Op de Beeck K et al. Primary tumor sidedness has an impact on prognosis and treatment outcome in metastatic colorectal cancer: results from two randomized first-line panitumumab studies. Ann Oncol. 2017 Aug 1;28(8):1862-1868
- Boige V, Malka D, Elias D, Castaing M, De Baere T, Goere D et al. Hepatic arterial infusion of oxaliplatin and intravenous LV5FU2 in unresectable liver metastases from colorectal cancer after systemic chemotherapy failure. Ann Surg Oncol 2008;15:219-26
- Boige V, Malka D, Elias D, Castaing M, De Baere T, Goere D,et al. Hepatic arterial infusion of oxaliplatin and intravenous LV5FU2 in unresectable liver metastases from colorectal cancer after systemic chemotherapy failure. Ann Surg Oncol2008;15(1):219–26.
- Bokemeyer C, Bondarenko I, Makhson A, Hartmann JT, Aparicio J, de Braud F et al. Fluorouracil, leucovorin, and oxaliplatin with and without cétuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol 2009;27:663-71
- Bouchahda M, Macarulla T, Liedo G, Lévi F, Elez ME, Paule B et al. Feasibility of cétuximab given with a simplified schedule every 2 weeks in advanced colorectal cancer: a multicenter, retrospective analysis. Med Oncol 2010 Nov 5
- Bouché O, Scaglia E, Reguiai Z, Singha V, Brixi-Benmansour H, Lagarde S. Biothérapies ciblées en cancérologie digestive : prise en charge de leurs effets secondaires. Gastroenterol Clin Biol 2009;33:306-22
- Boudjema K, Locher C, Sabbagh C et al. METASYNC Study group. Simultaneous Versus Delayed Resection for Initially Resectable SynchronousColorectal Cancer Liver Metastases: A Prospective, Open-label, Randomized, Controlled Trial. Ann Surg. 2021;273:49-56
- Brouquet A, Benoist S, Julie C, Penna C, Beauchet A, Rougier P, Nordlinger B. Risk factors for chemotherapy-associated liver injuries: A multivariate analysis of a group of 146 patients with colorectal metastases. Surgery 2009;145:362-71
- Bullock AJ, Benjamin L. Schlechter, Marwan G. Fakih , Apostolia M. Tsimberidou, Joseph E. Grossman, Michael S. Gordon et al. Botensilimab plus balstilimab in relapsed/ refractory microsatellite stable metastatic colorectal cancer: a phase 1 trial. Nature Medicine 2024;30 :2558–2567
- Bydder S, Spry NA, Christie DR, et al. A prospective trial of short-fractionation radiotherapy for the palliation of liver metastases. Australas Radiol. 2003 Sep 1;47(3):284–8
- Carmichael J, Popiela T, Radstone S, Falk S, Borner M, Oza A, et al. Randomized comparative study of tegafur/uracil plus leucovorin (LV)) versus parenteral 5-fluorouracil (5-FU) plus LV in patients with metastatic colorectal cancer. J Clin Oncol 2002;20:3617-27.
- Cassidy J, Clarke S, Díaz-Rubio E, Scheithauer W, Figer A, Wong R et al. Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J Clin Oncol 2008;26:2006-12
- Chang DT, Swaminath A, Kozak M, et al. Stereotactic body radiotherapy for colorectal liver metastases. Cancer. 2011 Sep 1;117(17):4060–9
- Chester JD, Dent JT, Wilson G, Ride E, Seymour MT. Protracted infusional 5-fluorouracil (5FU) with bolus mitomycin C in 5-FU-resistant colorectal cancer. Ann Oncol 2000;11:235-7.
- Chibaudel B, Maindrault-Goebel F, Lledo G, Mineur L, André T, Bennamoun M et al. Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX 2 Study. J Clin Oncol 2009;27:5727-33.
- Chibaudel B, Tournigand C, Artru P, André T, Cervantes A, Figer A et al. FOLFOX in patients with metastatic colorectal cancer and high alkaline phosphatase level: an exploratory cohort of the GERCOR OPTIMOX1 study. Ann Oncol. 2009;20:1383-6.
- Chibaudel B, Dourthe LM, Andre T, Henriques J, Bourgeois V, Etienne PL et al. STRATEGIC-1: Multi-line therapy trial in unresectable wild-type KRAS/NRAS/BRAF metastatic colorectal cancer—A GERCOR-PRODIGE randomized open-label phase III study. J Clin Oncol 2022 ;40:3504A
- Chiche L. Quelles métastases hépatiques sont résécables d’emblée ? Gastroenterol Clin Biol 2003;27 (suppl2):B41-B62
- Chong G, Dickson JL, Cunningham D, Norman AR, Rao S, Hill ME et al. Capecitabine and mitomycin C as third-line therapy for patients with metastatic colorectal cancer resistant to fluorouracil and irinotecan. Br J Cancer. 2005;93:510-4
- Chua TC, Liauw W, Chu F, Morris DL. Summary outcomes of two-stage resection for advanced colorectal liver metastases. J Surg Oncol. 2012 May 30. PubMed PMID: 22648977
- Chun YS, Laurent A, Maru D, Vauthey JN. Management of chemotherapy-associated hepatotoxicity in colorectal liver metastases. Lancet Oncol 2009;10:278-86
- Chun YS, Vauthey JN, Ribero D, Donadon M, Mullen JT, Eng C, et al. Systemic chemotherapy and two-stage hepatectomy for extensive bilateral colorectal liver metastases: perioperative safety and survival. J Gastrointest Surg. 2007;11:1498-504
- Chung KY, Shia J, Kemeny NE, Shah M, Schwartz GK, Tse A, et al. Cétuximab shows activity in colorectal cancer patients with tumors that do not express the Epidermal Growth Factor Receptor by immunohistochemistry. J Clin Oncol 2005;23;1803-10
- Cirocchi R, Trastulli S, Boselli C, Montedori A, Cavaliere D, Parisi A, et al. Radiofrequency ablation in the treatment of liver metastases from colorectal cancer. The Cochrane database of systematic reviews. 2012;6:CD006317. PubMed PMID: 22696357
- Ciuleanu T, Nikolic V, Shmueli E, Vrbanec D, Plate S, Z. Krampotic M. Cétuximab weekly (q1w) versus every two weeks (q2w) plus FOLFOX4 as first-line therapy in patients (pts) with KRAS wild-type (wt) metastatic colorectal cancer (mCRC). J Clin Oncol 29: 2011 (suppl; abstr 3580)
- Cocconi G, Cunningham D, Van Cutsem E, François E, Gustavsson B, van Hazel G et al. Open, randomized, multicenter trial of raltitrexed versus fluorouracil plus high-dose leucovorin in patients with advanced colorectal cancer. Tomudex colorectal cancer study group. J Clin Oncol 1998;16:2943-52
- Coriat R, Mir O, Chaussade S, Goldwasser F. Safety of 10 min infusion of bévacizumab in combination with 5FU-based chemotherapy in non-selected metastatic colorectal cancer patients. Dig Liver Dis 2011;43:248-9
- Correa-Gallego C, Fong Y, Gonen M, D'Angelica MI, Allen PJ, DeMatteo RP, et al. A retrospective comparison of microwave ablation vs. radiofrequency ablation for colorectal cancer hepatic metastases. Ann Surg Oncol. 2014 Dec;21(13):4278-83. PubMed PMID: 24889486. Pubmed Central PMCID: 4529120
- Cosimelli M, Golfieri R, Cagol PP, et al. Multi-centre phase II clinical trial of yttrium-90 resin microspheres alone in unresectable, chemotherapy refractory colorectal liver metastases. Br J Cancer. 2010;103:324–31
- Covey AM, Brown KT, Jarnagin WR, Brody LA, Schwartz L, Tuorto S, et al. Combined portal vein embolization and neoadjuvant chemotherapy as a treatment strategy for resectable hepatic colorectal metastases. Ann Surg 2008;24:451-5
- Cremolini C, Antoniotti C, Stein A et al. FOLFOXIRI/bevacizumab (bev) versus doublets/bev as initial therapy of unresectable metastatic colorectal cancer (mCRC): A meta-analysis of individual patient data (IPD) from five randomized trials. J Clin Oncol 2020 ;38 suppl 15 : 4015
- Cunningham D, Humblet Y, Siena S, Khayat D, Bleiberg H, Santoro A, et al. Cétuximab monotherapy and cétuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004;351:337-45
- Cunningham D, Lang I, Marcuello E, et al ; AVEX study investigators.Bévacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label,randomised phase 3 trial. Lancet Oncol. 2013 Oct;14(11):1077-85
- Cunningham D, Zalcberg JR, Rath U, Oliver I, van Cutsem E, Svensson C et al. Final results of a randomised trial comparing Tomudex (raltitrexed) with 5-fluorouracil plus leucovorin in advanced colorectal cancer. Tomudex colorectal cancer study group. Ann Oncol 1996;7:961-5
- Cunningham et al. Two different first-line 5-fluorouracil regimens with or without oxaliplatin in patients with metastatic colorectal cancer Ann Oncol 2009 ;20 :244-5
- Dasari A, Yao JC, Sobrero AF et al. FRESCO-2: A global phase III study of the efficacy and safety of fruquintinib in patients (pts) with metastatic colorectal cancer (mCRC). Lancet Oncol 2023 sous presse
- Datian Chen1 Kaikai Gu2 Huiyu Wang et al. Optimizing sequential treatment with anti-EGFR and VEGF mAb in metastatic colorectal cancer: current results and controversies. Cancer Management and Research 2019:11 1705–1716
- Dawson LA, Eccles C, Bissonnette JP, et al. Accuracy of daily image guidance for hypofractionated liver radiotherapy with active breathing control. Int J Radiat Oncol. 2005 Jul 15;62(4):1247–52
- De Baere T. Modalités et faisabilité des traitements par destruction locale des métastases hépatiques. Gastroenterol Clin Biol 2003;27(suppl2):B80-B87
- De Gramont A, Bosset JF, Milan C, Rougier P, Bouché O, Etienne PL et al. Randomized trial comparing monthly low-dose leucovorin and fluorouracil bolus with bimonthly high-dose leucovorin and fluorouracil bolus plus continuous infusion for advanced colorectal cancer : a French intergroup study. J Clin Oncol 1997;15:808-15
- De Gramont A, Figer A, Seymour M, Homerin M, Hmissi A, Cassidy J et al. Leucovorin and 5-fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 2000;18:2938-47
- De Haas RJ, Wicherts DA, Flores E, Azoulay D, Castaing D, Adam R. R1 resection by necessity for colorectal liver metastases: is it still a contraindication to surgery? Ann Surg 2008;248:626-37
- De Roock W, Claes B, Bernasconi D, De Schutter J, Biesmans B, Fountzilas G et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cétuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol 2010;11:753-62
- De Roock W, Piessevaux H, De Schutter J, Janssens M, De Hertogh G, Personeni N et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cétuximab. Ann Oncol 2008;19:508-15
- Depuydt T, Verellen D, Haas O, et al. Geometric accuracy of a novel gimbals based radiation therapy tumor tracking system. Radiother Oncol. 2011 Mar 1;98(3):365–72
- Di Fiore F, Blanchard F, Charbonnier F, Le Pessot F, Lamy A, Galais MP et al. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by cétuximab plus chemotherapy. Br J Cancer 2007;96:1166-9
- Di Nicolantonio F, Martini M, Molinari F, Sartore-Bianchi A, Arena S, Saletti P, et al. Wild-type BRAF is required for response to panitumumab or cétuximab in metastatic colorectal cancer. J Clin Oncol 2008;26:5705-12
- Diaz-Rubio E, Tabernero J, Gomez-Espana A, Massuti B, Sastre J, Chaves M et al. Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-line therapy in metastatic colorectal cancer: final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial. J Clin Oncol 2007;25:4224-30
- Douillard JY, Cunningham D, Roth AD, Navarro M, James RD, Karasek P et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 2000 ; 355 : 1041-7
- Douillard JY, Hoff PM, Skillings JR, Eisenberg P, Davidson N, Harper P et al. Multicenter phase III study of uracil/ tegafur UFT and oral leucovorin versus fluorouracil and leucovorin in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2002;20:3605-16
- Douillard JY, Oliner KS, Siena S, et al: Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med. 2013 Sep 12;369(11):1023-34
- Douillard JY, Siena S, Cassidy J, Tabernero J, Burkes R, Barugel M et al. Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 2010;28:4697-705.
- Drilon A, Laetsch TW, Kummar S et al. Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med. 2018 Feb 22;378(8):731-739
- Ducreux M, Adenis A, Pignon JP, François E, Chauffert B, Ichante JL et al. Efficacy and safety of bévacizumab-based combination regimens in patients with previously untreated metastatic colorectal cancer: final results from a randomised phase II study of bévacizumab plus FOLFIRI versus bévacizumab plus XELIRI (FNCLCC ACCORD 13/0503 study). Eur J Cancer 2013;49:1236-45
- Ducreux M, Bennouna J, Hebbar M, Ychou M, Lledo G, Conroy T et al.. Capecitabine plus oxaliplatin (XELOX) versus 5-fluorouracil/leucovorin plus oxaliplatin (FOLFOX-6) as first-line treatment for metastatic colorectal cancer. Int J Cancer. 2011;128:682-90
- Ducreux M, Bouché O, Pignon JP, Mousseau M, Raoul JL, Cassan P et al. Randomised Trial Comparing Three Different Schedules of Infusional 5FU and Raltitrexed Alone as First-Line Therapy in Metastatic Colorectal Cancer. Final Results of the Fédération Francophone de Cancérologie Digestive (FFCD) 9601 Trial. Oncology 2006;70:222-30
- Ducreux M, Malka D, Mendiboure J, Etienne PL, Texereau P, Auby D et al. Sequential versus combination chemotherapy for the treatment of advanced colorectal cancer (FFCD 2000-05): an open-label, randomised, phase 3 trial. Lancet Oncol 2011;12:1032-1044
- Ducreux M, Raoul JL, Marti P, Merrouche Y, Tigaud JM, Rebischung C et al. High-Dose Irinotecan plus LV5FU2 or Simplified LV5FU (HD-FOLFIRI) for Patients with Untreated Metastatic Colorectal Cancer: A New Way to Allow Resection of Liver Metastases? Oncology 2008;74:17-24
- Ducreux M, Ychou M, Laplanche A, Gamelin E, Lasser P, Husseini F et al. Hepatic arterial oxaliplatin infusion plus intravenous chemotherapy in colorectal cancer with inoperable hepatic metastases: a trial of the gastrointestinal group of the Federation Nationale des Centres de Lutte Contre le Cancer. J Clin Oncol 2005;23:4881-7
- Ducreux M, Ychou M, Seitz J-F, Bonnay M, Bexon A, Armand J-P, et al. Irinotecan combined with bolus fluorouracil, continuous infusion fluorouracil, and high-dose leucovorin every two weeks (LV5FU2 regimen): a clinical dose-finding and pharmacokinetic study in patients with pretreated metastatic colorectal cancer. J Clin Oncol 1999;17:2901-8
- Elias D, Detroz B, Lasser P, Plaub B, Jerbi G. Is simultaneous hepatectomy and intestinal anastomosis safe ? Am J Surg 1995;169:254-60
- Elias D, Di Pietroantonio, Gachot B, Menegon P, Hakime A, de Baere T. Liver abscess after radiofrequency ablation of tumors in patients with a biliary tract procedure. Gastroenterol Clin Biol 2006;30:823-7
- Elias D, Goere D, Boige V, et al. Outcome of posthepatectomy-missing colorectal liver metastases after complete response to chemotherapy: impact of adjuvant intra-arterial hepatic oxaliplatin. Ann Surg Oncol 2007;14:3188-94
- Elias D, Ouellet JF, de Baere T, Lasser P, Roche A. Preoperative selective portal vein embolization before hepatectomy for liver metastaese : long term results and impact on survival. Surgery 2002;131:294-9
- Elias D, Raynard B, Farkhondeh F, Goéré D, Rouquié D, Ciuchendea R et al. Peritoneal carcinomatosis of colorectal origin. Long term results of intraperitoneal chemohyperthermia with oxaliplatin following complete cytoreductive surgery. Gastroenterol Clin Biol 2006; 30: 1200-4
- Elias D, Santoro R, Ouellet JF, Osmak L, de Baere T, Roche A. Simultaneous percutaneous right portal vein embolization and left liver tumor radiofrequency ablation prior to a major right hepatic resection for bilateral colorectal metastases. Hepatogastroenterology 2004;51:1788-91
- Elez E, Yoshino T, Shen L, et al; BREAKWATER Trial Investigators. Encorafenib, Cetuximab, and mFOLFOX6 in BRAF-Mutated Colorectal Cancer. N Engl J Med. 2025 Jun 26;392(24):2425-2437. doi: 10.1056/NEJMoa2501912. Epub 2025 May 30. PMID: 40444708; PMCID: PMC12197837.
- ESMO consensus guidelines for the management of patients with metastatic colorectal cancer | Annals of Oncology | Oxford Academic [Internet]. Available from: https://academic.oup.com/annonc/article/27/8/1386/1741549/ESMO-consensus-guidelines
- Evrard S, Rivoire M, Arnaud J, Lermite E, Bellera C, Fonck M, et al. Unresectable colorectal cancer liver metastases treated by intraoperative radiofrequency ablation with or without resection. Br J Surg. 2012 Apr;99(4):558-65. PubMed PMID: 22396054. Epub 2012/03/08. eng
- Falcone A, Ricci S, Brunetti I, Pfanner E, Allegrini G, Barbara C et al. Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol 2007;25:1670-6
- Faron M, Macovei R, Goéré D et al. Linear Relationship of Peritoneal Cancer Index and Survival in Patients with Peritoneal Metastases from Colorectal Cancer. Ann Surg Oncol 2016;23:114-9
- Fausto Petrelli, Gianluca Tomasello, Karen Borgonovo et al. Prognostic Survival Associated With Left-Sided vs Right-Sided Colon CancerA Systematic Review and Meta-analysis. JAMA Oncol. 2017;3(2):211-219
- Feliu J, Castanon C, Salud A, Mel JR, Escudero P, Pelegrin A et al. Phase II randomised trial of raltitrexed- oxaliplatin vs raltitrexed-irinotecan as first-line treatment in advanced colorectal cancer. Br J Cancer 2005;93:1230-5
- Ferrand F, Malka D, Bourredjem A, Allonier C,, Bouché O, Louafi S et al. Impact of primary tumour resection on survival of patients with colorectal cancer and synchronous metastases treated by chemotherapy: results from the multicenter, randomised trial FFCD 96-01. Eur J Cancer 2013;49:90-97
- Fiorentini G, Aliberti C, Tilli M et al. Intra-arterial infusion of irinotecan loaded drug-eluting beads (DEBIRI) versus intravenous therapy (FOLFIRI) for hepatic metastases from colorectal cancer: final results of a phase III study. Anticancer Res 2012;32:1387-95
- Fiorentini G, Aliberti C, Tilli M, et al. Intra-arterial infusion of irinotecan-loaded drug-eluting beads (DEBIRI) versus intravenous therapy (FOLFIRI) for hepatic metastases from colorectal cancer: final results of a phase III study. Anticancer Res. 2012;32:1387–5
- Folprecht G, Gruenberger T, Bechstein WO, Raab HR, Lordick F, Hartmann JT et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cétuximab: the CELIM randomised phase 2 trial. Lancet Oncol 2009 Nov 24
- Fretland ÅA, Dagenborg VJ, Bjørnelv GMW et al. Laparoscopic Versus Open Resection for Colorectal Liver Metastases: The OSLO-COMET Randomized Controlled Trial. Ann Surg 2017
- Fuchs C, Marshall J, Mitchell E, Wierzbicki R, Ganju V, Jeffery M et al. Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C Study. J Clin Oncol 2007;25:4779-86
- Gallix B. Quels sont les examens à réaliser dans le bilan d’extension préthérapeutique ? Critères de qualité et résultats attendus. Gastroenterol Clin Biol 2003;27(suppl2):B25-B40
- Gamelin E, Boisdron-Celle M, Delva R, Rebimbeau C, Cailleux PE, Alleaume C et al. Long-term weekly treatment of colorectal metastatic cancer with fluorouracil and leucovorin: results of a multicentric prospective trial of fluorouracil dosage optimization by pharmacokinetic monitoring in 152 patients. J Clin Oncol 1998;16:1470-8
- Gamelin E, Danquechin-Dorval EM, Dumesnil YF, Maillart PJ, Goudier MJ, Burtin PC, et al. Relationship between 5-fluorouracil (5FU) dose intensity and therapeutic response in patients with advanced colorectal cancer receiving infusional therapy containing 5FU. Cancer 1996;77:441-51
- Gamelin L, Boisdron-Celle M, Delva R, Guérin-Meyer V, Ifrah N, Morel A et al. Prevention of oxaliplatin-related neurotoxicity by calcium and magnesium infusions: a retrospective study of 161 patients receiving oxaliplatin combined with 5-Fluorouracil and leucovorin for advanced colorectal cancer. Clin Cancer Res 2004;10:4055-61
- Giantonio BJ, Catalano PJ, Meropol NJ, O'Dwyer PJ, Mitchell EP, Alberts SR, et al. Bévacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007;25:1539-44
- Gillams A, Goldberg N, Ahmed M, Bale R, Breen D, Callstrom M, et al. Thermal ablation of colorectal liver metastases: a position paper by an international panel of ablation experts, The Interventional Oncology Sans Frontieres meeting 2013. Eur Radiol. 2015;25(12):3438-54
- Glehen O, Cotte E, Schreiber V, Sayag-Beaujard AC, Vignal J, Gilly FN. Intraperitoneal chemohyperthermia and attempted cytoreductive surgery in patients with peritoneal carcinomatosis of colorectal origin. Br J Surg 2004;91:747-54
- Glehen O, Kwiatkowski F, Sugarbaker PH, Elias D, Levine EA, De Simone M, et al. Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer: a multi-institutional study. J Clin Oncol 2004;22:3284-92
- Goéré D, Benhaim L, Bonnet S, et al. Adjuvant chemotherapy after resection of colorectal liver metastases in patients at high risk of hepatic recurrence: a comparative study between hepatic arterial infusion of oxaliplatin and modern systemic chemotherapy. Ann Surg. 2013;257:114-20
- Goéré D, Daveau C, Elias D, Boige V, Tomasic G, Bonnet S et al. The differential response to chemotherapy of ovarian metastases from colorectal carcinoma. Eur J Surg Oncol 2008;34:1335-9
- Goéré D, Benhaim L, Bonnet S et al. Adjuvant chemotherapy after resection of colorectal liver metastases in patients at high risk of hepatic recurrence: a comparative study between hepatic arterial infusion of oxaliplatin and modern systemic chemotherapy. Ann Surg 2013;257:114-20
- Goéré D, Glehen O, Quenet F, Guilloit JM, Bereder JM, Lorimier G, Thibaudeau E, Ghouti L, Pinto A, Tuech JJ, Kianmanesh R, Carretier M, Marchal F, Arvieux C, Brigand C, Meeus P, Rat P, Durand-Fontanier S, Mariani P, Lakkis Z, Loi V, Pirro N, Sabbagh C, Texier M, Elias D; BIG-RENAPE group. Second-look surgery plus hyperthermic intraperitoneal chemotherapy versus surveillance in patients at high risk of developing colorectal peritoneal metastases (PROPHYLOCHIP-PRODIGE 15): a randomised, phase 3 studyLancet Oncol 2020;21(9):1147-1154
- Goldberg RM, Sargent DJ, Morton RF, Fuchs CS, Ramanathan RK, Williamson SK et al. A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2004;22:23-30
- Görgec B, Hansen IS, Kemmerich G, Syversveen T, Abu Hilal M, Belt EJT, et al; CAMINO Study Group. MRI in addition to CT in patients scheduled for local therapy of colorectal liver metastases (CAMINO): an international, multicentre, prospective, diagnostic accuracy trial. Lancet Oncol. 2024 Jan;25(1):137-146. doi: 10.1016/S1470-2045(23)00572-7. Epub 2023 Dec 8. PMID: 38081200.
- Grothey A, Hart LL, Rowland KM, Ansari RH, Alberts SR, Chowhan NM et al. Intermittent oxaliplatin (oxali) administration and time-to-treatment-failure (TTF) in metastatic colorectal cancer (mCRC): Final results of the phase III CONcePT trial (abstract). J Clin Oncol 2008;26(Suppl15S):4010a
- Grothey A, Nikcevich DA, Sloan JA, Kugler JW, Silberstein PT, Dentchev T et al. Intravenous calcium and magnesium for oxaliplatin-induced sensory neurotoxicity in adjuvant colon cancer: NCCTG N047. J Clin Oncol. 2011;29:421-7
- Grothey A, Sugrue MM, Purdie DM, Dong W, Sargent D, Hedrick E et al. Bévacizumab beyond first progression is associated with prolonged overall survival in metastatic colorectal cancer: results from a large observational cohort study (BRiTE). J Clin Oncol 2008;26:5326-34
- Grothey A, Van Cutsem E, Sobrero A et al. Régorafénib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre randomised, placebo-controlled, phase 3 trial. Lancet 2013;381:303-12
- Grothey A, Van Cutsem E, Sobrero A, et al. Régorafénib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013;381(9863):303-12
- Gruenberger B, Tamand D, Schueller J, Scheithauer W, Zielinski C, Herbst F et al. Bévacizumab, Capecitabine, and Oxaliplatin as Neoadjuvant Therapy for Patients with Potentially Curable Metastatic Colorectal Cancer. J Clin Oncol 2008;26:1830-5
- Gruenberger T, Bridgewater JA, Chau I et al. Randomized, phase II study of bévacizumab with mFOLFOX6 or FOLFOXIRI in patients with initially unresectable liver metastases from colorectal cancer: resectability and safety in OLIVIA. J Clin Oncol 31, 2013 (suppl; abstr 3619)
- Gurusamy KS, Sheth H, Kumar Y, Sharma D, Davidson BR. Methods of vascular occlusion for elective liver resections. Cochrane Database Syst Rev 2009 Jan 21;(1):CD007632
- Halimi JM, Azizi M, Bobrie G, Bouché O, Deray G, des Guetz G, et al. Effets vasculaires et rénaux des médicaments anti-angiogéniques : Recommandations françaises pour la pratique (SN, SFHTA, APNET, FFCD). Nephrol Ther 2008;4:602-15
- Hebbar M, Wacrenier A, Desauw C, Romano O, Cattan S, Triboulet JP et al. Lack of usefulness of epidermal growth factor receptor expression determination for cétuximab therapy in patients with colorectal cancer. Anticancer Drugs 2006;17:855-7
- Hecht JR, Cohn A, Dakhil S et al. SPIRITT: A Randomized, Multicenter, Phase II Study of Panitumumab with FOLFIRI and Bévacizumab with FOLFIRI as Second-Line Treatment in Patients with Unresectable Wild Type KRAS Metastatic Colorectal Cancer. Clin Colorectal Cancer 2015 ;14:72-80
- Hendlisz A, Van Den Eynde M, Peeters M et al. Phase III trial comparing protracted intravenous fluorouracil infusion alone or with yttrium-90 resin microspheres radioembolization for liver-limited metastatic colorectal cancer refractory to standard chemotherapy. J Clin Oncol 2017. 10 ;28 :3687-94
- Heinemann V, Dominik Modest DP, Von Weikersthal LF et al. Gender and tumor location as predictors for efficacy: Influence on endpoints in first-line treatment with FOLFIRI in combination with cétuximab or bévacizumab in the AIO KRK 0306 (FIRE3) trial. J Clin Oncol 32:5s, 2014 (suppl; abstr 3600)
- Heinemann V, von Weikersthal LF, Decker T et al. Randomized comparison of FOLFIRI plus cétuximab versus FOLFIRI plus bévacizumab as first-line treatment of KRAS-wild type metastatic colorectal cancer: German AIO study KRK-0306 (FIRE-3). Lancet Oncol 2014; 15:1065-75
- Heinzerling JH, Anderson JF, Papiez L, et al. Four-Dimensional Computed Tomography Scan Analysis of Tumor and Organ Motion at Varying Levels of Abdominal Compression During Stereotactic Treatment of Lung and Liver. Int J Radiat Oncol. 2008 Apr 1;70(5):1571–8
- Herfarth KK, Debus J, Lohr F, et al. Stereotactic Single-Dose Radiation Therapy of Liver Tumors: Results of a Phase I/II Trial. J Clin Oncol. 2001 Jan 1;19(1):164–70
- Heun J, Holen K. Treatment with panitumumab after a severe infusion reaction to cétuximab in a patient with metastatic colorectal cancer: a case report. Clin Colorectal Cancer 2007;6:529-31
- Hiret S et al. Bévacizumab or cétuximab plus chemotherapy after progression with bévacizumab plus chemotherapy in patients with wtKRAS metastatic colorectal cancer: A randomized phase II study (Prodige 18 – Accord 22). J Clin Oncol 2016; 34 (suppl): abstr 3514
- Hochster HS, Hart LL, Ramanathan RK, Childs BH, Hainsworth JD, Cohn AL et al. Safety and efficacy of oxaliplatin and fluoropyrimidine regimens with or without bévacizumab as first-line treatment of metastatic colorectal cancer: results of the TREE Study. J Clin Oncol 2008;26:3523-9
- Hoff PM, Ansari R, Batist G, Cox J, Kocha W, Kuperminc M et al. Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 2001;19:2282-92
- Hoff PM, Wolff RA, Xiong H, Jones D, Lin E, Eng C et al. Phase II trial of combined irinotecan and oxaliplatin given every 3 weeks to patients with metastatic colorectal cancer. Cancer 2006;106:2241-6.
- Holch, J.W., Ricard, I., Stintzing, S., Modest, D.P., Heinemann, V. The relevance of primary tumour location in patients with metastatic colorectal cancer: a meta-analysis of first-line clinical trials. Eur J Cancer. 2017;70:87–98
- Høyer M, Swaminath A, Bydder S, et al. Radiotherapy for Liver Metastases: A Review of Evidence. Int J Radiat Oncol. 2012 Mar 1;82(3):1047–57
- Hubner M, Van Der Speeten K, Govaerts K, De Hingh I, Villeneuve L, Kusamura S et al. 2022 Peritoneal Surface Oncology Group International Consensus on HIPEC Regimens for Peritoneal Malignancies: Colorectal Cancer. Ann Surg Oncol 2024;31:567-576.
- Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W et al. Bévacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004;350:2335-42
- Iwanicki-Caron I, Di Fiore F, Roque I, Astruc E, Stetiu M, Duclos A et al. Usefulness of the serum carcinoembryonic antigen kinetic for chemotherapy monitoring in patients with unresectable metastasis of colorectal cancer. J Clin Oncol 2008;26:3681-6
- Javed S, Benoist S, Devos P, Truant S, Guimbaud R, Lièvre A, et al. Prognostic factors of BRAF V600E colorectal cancer with liver metastases: a retrospective multicentric study. World J Surg Oncol. 2022 Apr 23;20(1):131
- Jones RP, Malik HZ, Fenwick SW, Terlizzo M, O'Grady E, Stremitzer S et al. PARAGONII-A single arm multicenter phase II study of neoadjuvant therapy using irinotécan bead in patients with resectable liver metastases from colorectal cancer. Eur J Surg Oncol 2016.
- Kabbinavar F, Hurwitz HI, Fehrenbacher L, Meropol NJ, Novotny WF, Lieberman G et al. Phase II, randomized trial comparing bévacizumab plus fluorouracil (FU)/leucovorin (LV) with FU/LV alone in patients with metastatic colorectal cancer. J Clin Oncol 2003;21:60-5.
- Kabbinavar FF, Hurwitz HI, Yi J, Sarkar S, Rosen O. Addition of bévacizumab to fluorouracil-based first-line treatment of metastatic colorectal cancer: pooled analysis of cohorts of older patients from two randomized clinical trials. J Clin Oncol 2009;27:199-205
- Kabbinavar FF, Schulz J, McCleod M, Patel T, Hamm JT, Hecht R et al. Addition of bévacizumab to bolus fluorouracil and leucovorin in first-line metastatic colorectal cancer: results of a randomized phase II trial. J Clin Oncol 2005;23:3697-705.
- Kanemitsu Y, Shitara K, Mizusawa J, et al. Primary Tumor Resection Plus Chemotherapy Versus Chemotherapy Alone for Colorectal Cancer Patients With Asymptomatic, Synchronous Unresectable Metastases (JCOG1007; iPACS): A Randomized Clinical Trial. J Clin Oncol 2021;39:1098-107
- Karapetis CS, Khambata-Ford S, Jonker DJ, O'Callaghan CJ, Tu D, Tebbutt NC et al. K-ras mutations and benefit from cétuximab in advanced colorectal cancer. N Engl J Med 2008;359:1757-65.
- Karoui M, Penna C, Amin-Hashem M, Mitry E, Benoist S, Franc B,et al. Influence of preoperative chemotherapy on the risk of major hepatectomy for colorectal liver metastases. Ann Surg 2006;243:1-7
- Kemeny NE, Melendez FD, Capanu M, Paty PB, Fong Y, Schwartz LH, et al. Conversion to resectability using hepatic artery infusion plus systemic chemotherapy for the treatment of unresectable liver metastases from colorectal carcinoma. J Clin Oncol2009;27(21):3465–71.
- Kemeny NE, Niedzwiecki D, Hollis DR, Lenz HJ, Warren RS, Naughton MJ et al. Hepatic arterial infusion versus systemic therapy for hepatic metastases from colorectal cancer: a randomized trial of efficacy, quality of life, and molecular markers (CALGB 9481). J Clin Oncol 2006;24:1395-403.
- Kemeny NE, Niedzwiecki D, Hollis DR, Lenz HJ, Warren RS, Naughton MJ, Weeks JC, Sigurdson ER, Herndon JE 2nd, Zhang C, Mayer RJ. Hepatic arterial infusion versus systemic therapy for hepatic metastases from colorectal cancer: a randomized trial of efficacy, quality of life, and molecular markers (CALGB 9481). J Clin Oncol. 2006 Mar 20;24(9):1395-403.
- Kennedy AS, Coldwell D, Nutting C, et al. Resin 90Y-microsphere brachytherapy for unresectable colorectal liver metastases: Radioembolization of CRCLM 801 modern USA experience. Int J Radiat Oncol Biol Phys. 2006;65:412–25.
- Kerr DJ, McArdle CS, Ledermann J, Taylor I, Sherlock DJ, Schlag PM et al. Intrahepatic arterial versus intravenous fluorouracil and folinic acid for colorectal cancer liver metastases: a multicentre randomized trial. Lancet 2003;361:368-73.
- Kesmodel SB, Ellis LM, Lin E, Chang GJ, Abdalla EK, Kopetz S et al. Preoperative bévacizumab does not significantly increase postoperative complication rates in patients undergoing hepatic surgery for colorectal cancer liver metastases. J Clin Oncol 2008;26:5254-60
- Khambata-Ford S, Garrett CR, Meropol NJ, Basik M, Harbison CT, Wu S et al. Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cétuximab. J Clin Oncol 2007;25:3230-7
- Köhne CH, Cunningham D, Di CF, Glimelius B, Bli jham G G, Aranda E et al. Clinical determinants of survival in patients with 5-fluorouracil-based treatment for metastatic colorectal cancer: results of a multivariate analysis of 3825 patients. Ann Oncol 2002 ;20 :308-17.
- Koopman M, Antonini NF, Douma J, Wals J, Honkoop AH, Erdkamp FL et al. Sequential versus combination chemotherapy with capecitabine, irinotecan, and oxaliplatin in advanced colorectal cancer (CAIRO): a phase III randomised controlled trial. Lancet 2007;370:135-42.
- Kopetz S, Chang GJ, Overman MJ. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy. J Clin Oncol 2009;27:3677.
- Kopetz S, Grothey A, Yaeger R et al. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E–Mutated Colorectal Cancer. N Engl J Med 2019; 381:1632-1643
- Kopetz S, Yoshino T, Van Cutsem E, Eng C, Kim TW, Wasan HS, et al. BREAKWATER: Analysis of first-line encorafenib + cetuximab + chemotherapy in BRAF V600E-mutant metastatic colorectal cancer. J Clin Oncol 2025 ; 43 (suppl 16: https://doi.org/10.1200/JCO.2025.43.4_suppl.16
- Kopetz S, Yoshino T, Van Cutsem E, Eng C, Kim TW, Wasan HS, et al. Encorafenib, cetuximab and chemotherapy in BRAF-mutant colorectal cancer: a randomized phase 3 trial. Nat Med. 2025 Mar;31(3):901-908. doi: 10.1038/s41591-024-03443-3. Epub 2025 Jan 25. PMID: 39863775; PMCID: PMC11922750.
- Labianca R, Sobrero A, Isa L, Cortesi E, Barni S, Nicolella D. Italian Group for the Study of Gastrointestinal Cancer-GISCAD. Intermittent versus continuous chemotherapy in advanced colorectal cancer: a randomised 'GISCAD' trial. Ann Oncol 2011;22:1236-42.
- Lacouture ME, Mitchell EP, Piperdi B, Pillai MV, Shearer H, Iannotti N, Xu F, Yassine M. Skin toxicity evaluation protocol with panitumumab (STEPP), a phase II, open-label, randomized trial evaluating the impact of a pre-emptive skin treatment regimen on skin toxicities and quality of life in patients with metastatic colorectal cancer. J Clin Oncol 2010;28:1351-7.
- Landre T, Maillard E, Taleb C, Ghebriou D, Guetz GD, Zelek L, Aparicio T. Impact of the addition of bevacizumab, oxaliplatin, or irinotecan to fluoropyrimidin in the first-line treatment of metastatic colorectal cancer in elderly patients. Int J Colorectal Dis. 2018 Aug;33(8):1125-1130.
- Lawrence TS, Robertson JM, Anscher MS, et al. Hepatic toxicity resulting from cancer treatment. Int J Radiat Oncol. 1995 Mar 30;31(5):1237–48
- Levi FA, Boige V, Hebbar M, Smith D,Lepere C, Focan C, et al. Conversion to resection of liver metastases from colorectal cancer with hepatic artery infusion of combined chemotherapy and systemic cétuximab in multicenter trial OPTILIV. Ann Oncol 2016;27(2):267–74.
- Li J, Qin S, Xu RH, et al. Effect of Fruquintinib vs Placebo on Overall Survival in Patients With Previously Treated Metastatic Colorectal Cancer: The FRESCO Randomized Clinical Trial. JAMA 2018 Jun 26;319(24):2486-2496
- Lièvre A, Bachet JB, Boige V, Cayre A, Le Corre D, Buc E et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cétuximab. J Clin Oncol 2008;26:374-9
- Lièvre A, Bachet JB, Le Corre D, Boige V, Landi B, Emile JF et al. KRAS mutation status is predictive of response to cétuximab therapy in colorectal cancer. Cancer Res 2006;66:3992-5.
- Lim do H, Park YS, Park BB, Ji SH, Lee J, Park KW et al. Mitomycin-C and capecitabine as third-line chemotherapy in patients with advanced colorectal cancer: a phase II study. Cancer Chemother Pharmacol 2005;56:10-4.
- Lonardi S, Schirripa M, Buggin F et al. First-line FOLFOX plus panitumumab versus 5FU plus panitumumab in RAS-BRAF wild-type metastatic colorectal cancer elderly patients: The PANDA study. J Clin Oncol 2020, 38 (suppl; abstr A4002)
- Lordick F, Geinitz H, Theisen J, Sendler A, Sarbia M. Increased risk of ischemic bowel complications during treatment with bévacizumab after pelvic irradiation: report of three cases. Int J Radiat Oncol Biol Phys 2006;64:1295-8.
- Loupakis F, Cremolini C, Masi G et al. Initial therapy with FOLFOXIRI and bévacizumab for metastatic colorectal cancer. N Engl J Med 2014;371:1609-1618
- Mabro M, Artru P, André T, Flesch M, Maindrault-Goebel F, Landi B et al. A phase II study of FOLFIRI-3 (double infusion of irinotecan combined with LV5FU) after FOLFOX in advanced colorectal cancer patients. Br J Cancer 2006;94:1287-92
- Mahfoud T, Tanz R, Mesmoudi M et al. Bévacizumab 5 or 7.5 mg/kg in metastatic colorectal cancer can be infused safety over 10 minutes. J Gastrointest Cancer 2012;43 :244-8
- Maindrault-Goebel F, De Gramont A, Gilles V, Lotz JP, Tournigand C, Mabro M et al. Evaluation of oxaliplatin dose intensity in bimonthly leucovorin and 48-hour 5-fluorouracil continuous infusion regimens (FOLFOX) in pretreated metastatic colorectal cancer. Ann Oncol 2000;11;11:1477-83.
- Maindrault-Goebel F, Louvet C, Andre T, Carola E, Lotz JP, Molitor JL. Oxaliplatin added to the simplified bimonthly leucovorin and 5-fluorouracil regimen as second-line therapy for metastatic colorectal cancer (FOLFOX 6). GERCOR. Eur J Cancer 1999;35:1338-42.
- Maindrault-Goebel F, Tournigand C, Andre T, Carola E, Mabro M, Artru P et al. Oxaliplatin reintroduction in patients previously treated with leucovorin, fluorouracil and oxaliplatin for metastatic colorectal cancer. Ann Oncol 2004;15:1210-4.
- Malka D, Paris E, Caramella C, et al. Hepatic arterial infusion (HAI) of oxaliplatin plus intravenous (iv) fluorouracil (FU), leucovorin (LV), and cétuximab for first-line treatment of unresectable colorectal liver metastases (CRLM) (CHOICE): A multicenter phase II study. J Clin Oncol 2010;28,abstr 3558.
- Manfredi S, Sabbagh C, Vanbiervliet G, Lecomte T, Laugier R, Karoui M. Endoscopy and Cancer Committee of the French Society of Digestive Endoscopy (SFED) and the French Federation of Digestive Oncology (FFCD). Place of colorectal stents in therapeutic management of malignant large bowel obstructions. Endoscopy 2014;46:546-52
- Marchiò C, Scaltriti M, Ladanyi M et al. ESMO recommendations on the standard methods to detect NTRK fusions in daily practice and clinical research. Marchiò et al. Ann Oncol. 2019 Sep 1;30(9):1417-1427
- Masi G, Cupini S, Marcucci L, Cerri E, Loupakis F, Allegrini G et al. Treatment with 5-fluorouracil/folinic acid, oxaliplatin, and irinotecan enables surgical resection of metastases in patients with initially unresectable metastatic colorectal cancer. Ann Surg Oncol 2006;13:58-65.
- Maughan TS, Adams RA, Smith CG, Meade AM, Seymour MT, Wilson RH, MRC COIN Trial Investigators. Addition of cétuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 2011;377:2103-14.
- Maughan TS, James RD, Kerr DJ, Ledermann JA, McArdle C, Seymour M et al. Comparison of survival, palliation, and quality of life with three chemotherapy regimens in metastatic colorectal cancer: a multicentre randomised trial. Lancet 2002;359:1555-63.
- Maughan TS, James RD, Kerr DJ, Ledermann JA, Seymour M, Topham C et al. Comparison of intermittent and continuous palliative chemotherapy for advanced colorectal cancer: a multicenter randomised trial. Lancet 2003;361:457-64.
- Mayer RJ, Van Cutsem E, Falcone A et al. Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 2015;372:1909-19
- Mentha G, Maino PA, Andres A, Rubbia-Brandt L, Morel P, Roth AD. Neoadjuvant chemotherapy and resection of advanced synchronous liver metastases before treatment of the colorectal primary. Br J Surg 2006;93:872-8
- Meric-Bernstam F, Hurwitz H, Singh Raghav KP et al, Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol 2019;20(4):518-530
- Meta-Analysis Group in Cancer. Reappraisal of hepatic arterial infusion in the treatment of nonresectable liver metastases from colorectal cancer. J Natl Cancer Inst 1996;88:252-8.
- Michel P, Roque I, Di Fiore F, Langlois S, Scotte M, Teniere P, et al. Colorectal cancer with non-resectable synchronous metastases: should the primary tumor be resected? Gastroenterol Clin Biol 2004;28:434-7.
- Millet G, Truant S, Leteurtre E et al. Volumetric analysis of remnant liver regeneration after major hepatectomy in bévacizumab-treated patients: a case-matched study in 82 patients. Ann Surg 2012; 256:755-61
- Mir O, Alexandre J, Coriat R et al. Safety of bévacizumab 7.5 mg/m2 infusion over 10 minutes in NSCLC patients. Invest New Drugs 2012;30 :1756-60
- Mitry E, Fields AL, Bleiberg H, Labianca R, Portier G, Tu D, Nitti D et al. Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer. A pooled analysis of two randomized trials. J Clin Oncol 2008; 26, 4906-4911
- Mitry E, Tournigand C, André T, Douillard JY, Louvet C, Cunningham D et al. Comparison of the tolerance and efficacy of LV5FU2-CPT11 and FOLFIRI regimens in front-line treatment of advanced colorectal cancer – A pooled analysis of 254 patients included in 2 randomised trials (abstract). Proc Am Soc Clin Oncol 2004;23:3576a.
- Mocellin S, Pasquali S, Nitti D. Fluoropyrimidine-HAI (hepatic arterial infusion) versus systemic chemotherapy (SCT) for unresectable liver metastases from colorectal cancer. Cochrane Database Syst Rev. 2009;8:CD007823.
- Modest D.P, L. Fischer von Weikersthal, T. Decker et al. The AIO KRK-0110 study compares a sequential application of FP+ BEV followed by IRI + FP + BEV at first progression (arm A) vs. initial FP+ IRI+ BEV (arm B) in patients (pts) with untreated mCRC. ESMO 2017; Abs 486
- Modest DP, Uwe M. Martens, Jorge Riera-Knorrenschild et al. FOLFOXIRI Plus Panitumumab As First-Line Treatment of RAS Wild-Type Metastatic Colorectal Cancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109). J Clin Oncol 2019;37:3401-3411
- Mulcahy MF, Mahvash A, Marc Pracht M et al. Radioembolization With Chemotherapy for Colorectal Liver Metastases: A Randomized, Open-Label, International, Multicenter, Phase III Trial. J Clin Oncol 2021 Dec 10;39(35):3897-3907
- Murthy R, Xiong H, Nunez R, et al. Yttrium 90 resin microspheres for the treatment of unresectable colorectal hepatic metastases after failure of multiple chemotherapy regimens: preliminary results. J Vasc Interv Radiol. 2005;16:937–45.
- Nakano H, Oussoultzoglou E, Rosso E, Casnedi S, Chenard-Neu MP, Dufour P et al. Sinusoidal injury increases morbidity after major hepatectomy in patients with colorectal liver metastases receiving preoperative chemotherapy. Ann Surg 2008;247:118-24
- Narita Y et al. Pertuzumab Plus Trastuzumab for Treatment-Refractory HER2-Amplified Metastatic Colorectal Cancer: Comparison of the MyPathway Trial With a Real-World External Control Arm. JCO Clin Cancer Inform 2022 6:e2200022
- Nordlinger B, Guiguet M, Vaillant JC, Balladur P, Boudjema K, Bachellier P et al. Surgical resection of colorectal carcinoma metastases to the liver. Cancer 1996;77:1254-62.
- Nordlinger B, Sorbye H, Glimelius B et al. Perioperative FOLFOX4 chemotherapy and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC 40983): long-term results of a randomised, controlled, phase 3 trial. Lancet Oncol 2013;14:1208-15.
- Nordlinger B, Sorbye H, Glimelius B, Poston GJ, Schlag PM, Rougier P et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 2008;371:1007-16
- Okines A, del Puerto O, Cunningham D, Chau I, van Cutsem E, Saltz L et al. Surgery with curative-intent in patients treated with first-line chemotherapy plus bévacizumab for metastatic colorectal cancer First BEAT and the randomised phase-III NO16966 trial. Br J Cancer 2009;101:1033-8
- Pan CC, Kavanagh BD, Dawson LA, et al. Radiation-Associated Liver Injury. Int J Radiat Oncol. 2010 Mar 1;76(3):S94–100
- Parikh AA, Curley SA, Fornage BD, Ellis LM. Radiofrequency ablation of hepatic metastases. Semin Oncol 2002;29:168-82.
- Pawlik TM, Izzo F, Cohen DS, Morris JS, Curley SA. Combined resection and radiofrequency ablation for advanced hepatic malignancies: results in 172 patients. Ann Surg Oncol 2003;10:1059-69
- Pernot S, Pellerin O, Artru P, Montérymard C, Smith D, Raoul JL et al; for FFCD1201-DEBIRI investigators/Collaborators. Intra-arterial hepatic beads loaded with irinotecan (DEBIRI) with mFOLFOX6 in unresectable liver metastases from colorectal cancer: a Phase 2 study. Br J Cancer. 2020 Aug;123(4):518-524.
- Peters M, Price TJ, Cervantes A, Sobrero AF, Ducreux M, Hotko Y et al. Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol 2010;28:4706-13.
- Pfeiffer P, Nielsen D, Bjerregaard J, Qvortrup C, Yilmaz M, Jensen B. Biweekly cétuximab and irinotecan as third-line therapy in patients with advanced colorectal cancer after failure to irinotecan, oxaliplatin and 5-fluorouracil. Ann Oncol 2008;19:1141-5
- Prager GW, Taieb J, Fakih M, Ciardiello F, Van Cutsem E, Elez E, et al; SUNLIGHT Investigators. Trifluridine-Tipiracil and Bevacizumab in Refractory Metastatic Colorectal Cancer. N Engl J Med. 2023 May 4;388(18):1657-1667.
- Portier G, Elias D, Bouché O, Rougier P, Gillet M, Bosset JF et al. Multicenter randomized trial of adjuvant systemic chemotherapy using 5-Fluorouracil and folinic acid versus observation after resection of liver metastases of colorectal origin. Results of an intergroup phase III study (FFCD-ACHBTH-AURC 9002 trial). J Clin Oncol 2006;24 :4976-82.
- Poultsides GA, Servais EL, Saltz LB, Patil S, Kemeny NE, Guillem JG et al. Outcome of primary tumor in patients with synchronous stage IV colorectal cancer receiving combination chemotherapy without surgery as initial treatment. J Clin Oncol 2009;27:3379-84.
- Punt CJA, Bond MJG, Bolhuis K et al. FOLFOXIRI + bevacizumab versus FOLFOX/FOLFIRI + bevacizumab in patients with initially unresectable colorectal liver metastases (CRLM) and right-sided and/or RAS/BRAFV600E-mutated primary tumor: Phase III CAIRO5 study of the Dutch Colorectal Cancer Group. J Clin Oncol. 2022;40:LBA3506
- Quénet F, Elias D, Roca L, Goéré D, Ghouti L, Pocard M, Facy O, Arvieux C, Lorimier G, Pezet D, Marchal F, Loi V, Meeus P, Juzyna B, de Forges, H, Paineau J, Glehen O; UNICANCER-GI Group and BIG Renape Group. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy versus cytoreductive surgery alone for colorectal peritoneal metastases (PRODIGE 7): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2021;22(2):256-266
- Rahbari NN, Koch M, Mehrabi A, Weidmann K, Motschall E, Kahlert C,et al. Portal triad clamping versus vascular exclusion for vascular control during hepatic resection: a systematic review and meta-analysis. J Gastrointest Surg 2009;13:558-68
- Reddy SK, Pawlik TM, Zorzi D, Gleisner AL, Ribero D, Assumpcao L,et al. Simultaneous resections of colorectal cancer and synchronous liver metastases: a multi-institutional analysis. Ann Surg Oncol. 2007;14:3481-91
- Reguiai Z, Bachet JB, Bachmeyer C, Peuvrel L, Beylot-Barry M, Bezier M et al. Management of cutaneous adverse events induced by anti-EGFR (epidermal growth factor receptor): a French interdisciplinary therapeutic algorithm. Support Care Cancer 2012 ;20:1395-404.
- Reidy DL, Chung KG, Timoney JP et al. Bévacizumab 5 mg/kg can be infused safety over 10 minutes. J Clin Oncol 2007;25 :2691-5
- Reidy DL, Chung KY, Timoney JP, Park VJ, Hollywood E, Sklarin NT et al. Bévacizumab 5 mg/kg can be infused safely over 10 minutes. J Clin Oncol 2007;25:2691-5
- Rivoire M. Peut-on rendre résécables des métastases hépatiques initialement non résécables ? Gastroenterol Clin Biol 2003;27(suppl2):B88-B104.
- Rossini D, Antoniotti C, Lonardi S, Pietrantonio F, Moretto R, Antonuzzo L, Boccaccino A, et al. Upfront Modified Fluorouracil, Leucovorin, Oxaliplatin, and Irinotecan Plus Panitumumab Versus Fluorouracil, Leucovorin, and Oxaliplatin Plus Panitumumab for Patients With RAS/BRAF Wild-Type Metastatic Colorectal Cancer: The Phase III TRIPLETE Study by GONO. J Clin Oncol 2022. 40:2878-2888.
- Ross P, Norman A, Cunningham D, Webb A, Iveson T, Padhani A et al. A prospective randomised trial of protracted venous infusion 5-fluorouracil with or without mitomycin C in advanced colorectal cancer. Ann Oncol 1997;8:995-1001.
- Rothenberg ML, Cox JV, Butts C, Navarro M, Bang YJ, Goel R et al. Capecitabine plus oxaliplatin (XELOX) versus 5-fluorouracil/folinic acid plus oxaliplatin (FOLFOX-4) as second-line therapy in metastatic colorectal cancer: a randomized phase III noninferiority study. Ann Oncol 2008;19:1720-6
- Rougier P, Laplanche A, Huguier M, Hay JM, Ollivier JM, Escat J et al. Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma: long-term results of a prospective randomized trial. J Clin Oncol 1992;10:1112-8.
- Rougier P, Milan C, Lazorthes F, Fourtanier G, Partensky C, Baumel H et al. Prospective study of prognostic factors in patients with unresected hepatic metastases from colorectal cancer. Fondation Francaise de Cancérologie Digestive. Br J Surg 1995;82:1397-400.
- Ruers T, Van Coevorden F, Punt CJ, Pierie JE, Borel-Rinkes I, Ledermann JA, et al. Local Treatment of Unresectable Colorectal Liver Metastases: Results of a Randomized Phase II Trial. J Natl Cancer Inst. 2017;109(9).
- Ruers TJ, Wiering B, van der Sijp JR, Roumen RM, de Jong KP, Comans EF et al. Improved Selection of Patients for Hepatic Surgery of Colorectal Liver Metastases with 18F-FDG PET: A Randomized Study. J Nucl Med 2009 Jun 12.
- Rusthoven KE, Kavanagh BD, Cardenes H, et al. Multi-Institutional Phase I/II Trial of Stereotactic Body Radiation Therapy for Liver Metastases. J Clin Oncol. 2009 Apr 1;27(10):1572–8
- Saltz LB, Clarke S, Díaz-Rubio E, Scheithauer W, Figer A, Wong R et al. Bévacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008;26:2013-9
- Saltz LB, Cox JV, Blanke C, Rosen LS, Fehrenbacher L, Moore MJ et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. N Engl J Med 2000;343:905-14.
- Santos Vivas C, LaPelusa M, QIAO W, Thomas J, You N, Thirumurthi S et al. Third line rechallenge with cetuximab (Cet) and irinotecan in circulating tumor DNA (ctDNA) selected metastatic colorectal cancer (mCRC) patients: The randomized phase II CITRIC trial. Ann Oncol 2024;35:S433
- Sargent D et al. Pooled Safety and Efficacy Analysis Examining the Effect of Performance Status on Outcomes in Nine First-Line Treatment Trials Using Individual Data From Patients With Metastatic Colorectal Cancer. J Clin Oncol 2009;27 :1948-55
- Sartore-Bianchi A, Trusolino L, Martino C et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016;17(6):738-746
- Satore-Bianchi A, Pietrantonio F, Lonardi S, Mussolin B, Rua F et al. Circulating tumor DNA to guide rechallenge with panitumumab in metastatic colorectal cancer: the phase 2 CHRONOS trial. Nat Medicine 2022. 28;1612–1618
- Saxena A, Meteling B, Kapoor J, et al. Is yttrium-90 radioembolization a viable treatment option for unresectable, chemorefractory colorectal cancer liver metastases? A large single-center experience of 302 patients. Ann Surg Oncol. 2015;22:794-802.
- Scartozzi M, Bearzi I, Berardi R, Mandolesi A, Fabris G, Cascinu S. Epidermal growth factor receptor (EGFR) status in primary colorectal tumors does not correlate with EGFR expression in related metastatic sites: implications for treatment with EGFR-targeted monoclonal antibodies. J Clin Oncol 2004;22:4720-6.
- Scheithauer W, Kornek GV, Raderer M, Ulrich-Pur H, Fiebiger W, Gedlicka C et al. Randomized multicenter phase II trial of oxaliplatin plus irinotecan versus raltitrexed as first-line treatment in advanced colorectal cancer. J Clin Oncol 2002;20:165-72.
- Scheithauer W, Kornek GV, Schuell B, Ulrich-Pur H, Penz M, Raderer M et al. Second line treatment with oxaliplatin plus raltitrexed in patients with advanced colorectal cancer failing fluoropyrimidine/leucovorin- based chemotherapy. Ann Oncol 2001;12:709-14.
- Schmiegel WH, Reinacher-Schick A, Freier W, Dietrich G, Arnold D, Kanzler S et al. Comparable safety and response rate with bévacizumab in combination with capecitabine/oxaliplatin (CapOx/Bev) versus capecitabine/irinotecan (CapIri/Bev) in advanced CRC (mCRC): A randomized phase II study of the AIO GI tumor study group. J Clin Oncol 2007;25(Suppl 18S):4034a
- Scoggins CR, Meszoely IM, Blanke CD, Beauchamp RD, Leach SD. Nonoperative management of primary colorectal cancer in patients with stage IV disease. Ann Surg Oncol 1999;6:651-7.
- Seitz JF, Bennouna J, Paillot B, Gamelin E, Francois E, Conroy T et al. Multicenter non-randomized phase II study of raltitrexed and oxaliplatin in non pre-treated metastatic colorectal cancer patients. Ann Oncol 2002;13:1072-9.
- Seitz JF, Perrier H, Giovannini M, Bernardini D, Capodano G, Girodengo L, Bardou VJ. 5Fluorouracil, high dose folinic acid and mitomycin-C combination chemotherapy in previously treated patients with advanced colorectal carcinomas. J Chemotherapy 1998;10:258-65.
- Seymour MT, Maughan TS, Ledermann JA, Topham C, James R, Gwyther SJ, et al. Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial. Lancet 2007;370:143-52
- Sharma RA, Wasan HS, Van Hazel GA et al. Overall survival analysis of the FOXFIRE prospective randomized studies of first-line selective internal radiotherapy (SIRT) in patients with liver metastases from colorectal cancer. J Clin Oncol. 2017.35.15_suppl.3507
- Siena S, Di Bartolomeo M, Raghav K et al. Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): a multicentre, open-label, phase 2 trial. Lancet Oncol 2021; 22 (6): 779-789
- Si-Ming Xie, Jun-Jie Xiong, Xue-Ting Liu et al. Laparoscopic Versus Open Liver Resection for Colorectal Liver Metastases: A Comprehensive Systematic Review and Meta-analysis. Nature Scientific Reports 2017. Article number: 1012
- Simkens LH, van Tinteren H, May A, ten Tije AJ et al.Maintenance treatment with capecitabine and bévacizumab in metastatic colorectal cancer (CAIRO3): a phase 3 randomised controlled trial of the Dutch Colorectal Cancer Group. Lancet 2015;385:1843-52.
- Souglakos J, Androulakis N, Syrigos K, Polyzos A, Ziras N, Athanasiadis A et al. FOLFOXIRI (folinic acid, 5-fluorouracil, oxaliplatin and irinotecan) vs FOLFIRI (folinic acid, 5-fluorouracil and irinotecan) as first-line treatment in metastatic colorectal cancer (MCC): a multicentre randomised phase III trial from the Hellenic Oncology Research Group (HORG). Br J Cancer 2006;94:798-805.
- Stintzing S, Grothe A, Hendrich S, et al. Percutaneous radiofrequency ablation (RFA) or robotic radiosurgery (RRS) for salvage treatment of colorectal liver metastases. Acta Oncol. 2013 Jun 1;52(5):971–7
- Stintzing S, Jung A, Rossius L et al. Analysis of KRAS/NRAS and BRAF mutations in FIRE-3 : a randomized phase III study of folfiri plus cétuximab or bévacizumab as first line treatment for wild-type KRAS (exon 2) in metastatic colorectal cancer patients. Oral communication in European Cancer Congress 2013; Amsterdam. Abstract LBA17
- Stintzing S, Heinrich K, Tougeron D, et al. Randomized study to investigate FOLFOXIRI plus either bevacizumab or cetuximab as first-line treatment of BRAF V600E-mutant mCRC: The phase-II FIRE-4.5 study (AIO KRK-0116). J Clin Oncol 2021;39 15_suppl : 3502
- Stintzing S, Heinrich K, Tougeron D, et al. Randomized study to investigate FOLFOXIRI plus either bevacizumab or cetuximab as first-line treatment of BRAF V600E-mutant mCRC: The phase-II FIRE-4.5 study (AIO KRK-0116). J Clin Oncol 2021;39 15_suppl : 3502
- Stoltz A, Gagniere J, Dupre A, Rivoire M. Radiofrequency ablation for colorectal liver metastases. J Visc Surg. 2014 Apr;151 Suppl 1:S33-44
- Stubbs RS, O’Brien I, Correia MM. Selective internal radiation therapy with 90Y microspheres for colorectal liver metastases: single-centre experience with 100 patients. ANZ J Surg. 2006;76:696–703.
- Sugrue M, Kozloff M, Hainsworth J, Badarinath S, Cohn A, Flynn P et al. Risk factors for gastrointestinal perforations in patients with metastatic colorectal cancer receiving bévacizumab plus chemotherapy. J Clin Oncol 2006;24 (Suppl 18S):3535a.
- Tabernero J, Pfeiffer P, Cervantes A. Administration of cétuximab every 2 weeks in the treatment of metastatic colorectal cancer: an effective, more convenient alternative to weekly administration? Oncologist 2008;13:113-9
- Tabernero J, Yoshino T, Cohn AL et al. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bévacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 2015;16:499-508
- Tabernero J, Yoshino T, Kim TW, et al. Encorafenib + cetuximab (EC) + FOLFIRI for BRAF V600E-mutant metastatic colorectal cancer (mCRC): Updated results from the BREAKWATER safety lead-in (SLI). Ann Oncol 2024;35 (Suppl 2 S435-36):515MO
- Tebbutt NC, Norman AR, Cunningham D, Hill ME, Tait D, Oates J et al. Intestinal complications after chemotherapy for patients with unresected primary colorectal cancer and synchronous metastases. Gut 2003;52:568-73.
- Tebbutt NC, Wilson K, Gebski VJ, Cummins MM, Zannino D, van Hazel GA et al. Capecitabine, bévacizumab and mitomycin in first-line treatment of metastatic colorectal cancer: results of the Australasian Gastrointestinal Trials Group Randomized Phase III MAX Study. J Clin Oncol 2010;28:3191-8.
- Tol J, Koopman M, Cats A, Rodenburg CJ, Creemers GJ, Schrama JG, et al. Chemotherapy, bévacizumab, and cétuximab in metastatic colorectal cancer. N Engl J Med 2009;360:563-72
- Tournigand C, Andre T, Achille E, Lledo G, Flesh M, Mery-Mignard D et al. FOLFIRI followed by FOLFOX 6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol. 2004;22:229-37.
- Tournigand C, Cervantes A, Figer A, Lledo G, Flesch M, Buyse M et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-go fashion in advanced colorectal cancer—a GERCOR study. J Clin Oncol 2006;24:394-400.
- Tournigand C, de Gramont A, Louvet C, André T, Carola E, Gilles Amar V et al. A simplified bimonthly regiment with leucovorin (LV) and 5-fluorouracil (5FU) for metastatic colorectal cancer (MCRC) (abstract). Proc Am Soc Clin Oncol 1998;17:274a.
- Truant S, Oberlin O, Sergent G et al. Remnant liver volume to body weight ratio > or =0.5%: A new cut-off to estimate postoperative risks after extended resection in noncirrhotic liver. J Am Coll. Surg 2007;204(1):22-33
- Van Cutsem E, Köhne CH, Hitre E, Zaluski J, Chang Chien CR, Makhson A et al. Cétuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009;360:1408-17
- Van Cutsem E, Köhne CH, Lang I, Folprecht G, Nowacki MP, Cascinu S et al. Cétuximab plus irinotecan, fluorouracil and leucovorin as first-line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor RAS and BRAF mutation status. J Clin Oncol 2011;29:2011-9.
- Van Cutsem E, Peeters M, Siena S, Humblet Y, Hendlisz A, Neyns B et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007;25:1658-64
- Van Cutsem E, Tabernero J, Lakomy R, Prenen H, Prausova J, Macarulla T et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012;30:3499-506
- Van Cutsem E, Twelves C, Cassidy J, Allman D, Bajetta E, Boyer M et al. Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 2001;19:4097-106
- Van den Eynde M, Peeters M, et al. Phase III trial comparing protracted intravenous fluorouracil infusion alone or with yttrium-90 resin microspheres radioembolization for liver-limited metastatic colorectal cancer refractory to standard chemotherapy. J Clin Oncol. 2010;28:3687-94
- Van der Kruijssen DEW, Elias SG, Vink GR, et al. Sixty-Day Mortality of Patients With Metastatic Colorectal Cancer Randomized to Systemic Treatment vs Primary Tumor Resection Followed by Systemic Treatment: The CAIRO4 Phase 3 Randomized Clinical Trial. JAMA Surg 2021;156:1093-101
- Van der Lei S, Puijk RS, Dijkstra M, Schulz HH, Vos DJW, De Vries JJJ, et al. Thermal ablation versus surgical resection of small-size colorectal liver metastases (COLLISION): an international, randomised, controlled, phase 3 non-inferiority trial. Lancet Oncol. 2025 Feb;26(2):187-199. doi: 10.1016/S1470-2045(24)00660-0. Epub 2025 Jan 20. PMID: 39848272.
- Vedam SS, Keall PJ, Kini VR, et al. Determining parameters for respiration-gated radiotherapy. Med Phys. 2001 Oct 1;28(10):2139–4
- Venook A, Niedzwiecki D, Innocenti F et al. Impact of primary (1º) tumor location on overall survival (OS) and progression-free survival (PFS) in patients (pts) with metastatic colorectal cancer (mCRC): Analysis of CALGB/SWOG 80405 (Alliance). J Clin Oncol 34, 2016 (suppl; abstr 3504)
- Venook AP, Donna Niedzwiecki D, Heinz-Josef Lenz HJ et al. CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bévacizumab (BV) or cétuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). J Clin Oncol 32:5s, 2014 (suppl; abstr LBA3)
- Verwaal VJ, van Ruth S, de Bree E, van Sloothen GW, van Tinteren H, Boot H et al. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin Oncol 2003;21:3737-43.
- Viel E, Demarchi MF, Chaigneau L, Nguyen T, Legat C, Stein U et al. A retrospective study of bifractionated CPT-11 with LF5FU infusion (FOLFIRI-3) in colorectal cancer patients pretreated with oxaliplatin and CPT-11 containing chemotherapies. Am J Clin Oncol 2008;31:89-94
- Vigano L, Capussotti L, Barosso E et al. Progression while receiving preoperative chemotherapy should not be an absolute contraindication to liver resection for colorectal metastases. Ann Surg Oncol 2012;19:2786-96
- Viganò L, Procopio F, Cimino MM, Donadon M, Gatti A, Costa G, et al. Is Tumor Detachment from Vascular Structures Equivalent to R0 Resection in Surgery for Colorectal Liver Metastases? An Observational Cohort. Ann Surg Oncol. 2016 Apr;23(4):1352-60. doi: 10.1245/s10434-015-5009-y. Epub 2015 Dec 29. PMID: 26714946.
- Wainberg, Z.A., Drakaki, A. The importance of optimal drug sequencing in metastatic colorectal cancer: biological rationales for the observed survival benefit conferred by first-line treatment with EGFR inhibitors. Expert Opin Biol Ther. 2015;15:1205–1220
- Wasan HS, Gibbs P, Sharma NK et al. First-line selective internal radiotherapy plus chemotherapy versus chemotherapy alone in patients with liver metastases from colorectal cancer (FOXFIRE, SIRFLOX, and FOXFIRE-Global): a combined analysis of three multicentre, randomised, phase 3 trials. Lancet Oncol 2017; 18: 1159–71.
- Watanabe J, Muro K, Shitara K, er al. Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2023 Apr 18;329(15):1271-1282.
- Weiser MR, Jarnagin WR, Saltz LB. Colorectal cancer patients with oligometastatic liver disease: what is the optimal approach? Oncology. 2013 Nov 1;27(11):1074–1074
- White RR, Schwartz LH, Munoz JA, Raggio G, Jarnagin WR, Fong Y,et al. Assessing the optimal duration of chemotherapy in patients with colorectal liver metastases. J Surg Oncol 2008;97:601-4
- Wicherts DA, Miller R, de Haas RJ, Bitsakou G, Vibert E, Veilhan LA, et al. Long-term results of two-stage hepatectomy for irresectable colorectal cancer liver metastases. Ann Surg 2008;248:994-1005
- Wildi SM, Gubler C, Hany T, Petrowsky H, Clavien PA, Jochum W, et al. Intraoperative sonography in patients with colorectal cancer and resectable liver metastases on preoperative FDG-PET-CT. J Clin Ultrasound 2008;36:20-6
- Wilke H, Glynne-Jones R, Thaler J, Adenis A, Preusser P, Aguilar EA et al. Cétuximab plus irinotecan in heavily pretreated metastatic colorectal cancer progressing on irinotecan: MABEL Study. J Clin Oncol 2008;26:5335-43
- Wong R, Cunningham D, Barbachano Y, Saffery C, Valle J, Hickish T et al. A multicentre study of capecitabine, oxaliplatin plus bévacizumab as perioperative treatment of patients with poor-risk colorectal liver-only metastases not selected for upfront resection. Ann Oncol 2011;22:2042-8
- Ychou M, Rivoire M, Simon Thezenas S et al. Chemotherapy (doublet or triplet) plus targeted therapy by RAS status as conversion therapy in colorectal cancer patients with initially unresectable liver-only metastases. The UNICANCER PRODIGE-14 randomised clinical trial. Br J Cancer 2022 May;126(9):1264-1270
- Ychou M, Viret F, Kramar A, Desseigne F, Mitry E, Guimbaud R et al. Tritherapy with fluorouracil/leucovorin, irinotecan and oxaliplatin (FOLFIRINOX): a phase II study in colorectal cancer patients with non-resectable liver metastases. Cancer Chemother Pharmacol 2007;62:195-201
- Ye LC, Liu TS, Ren L, Wei Y, Zhu DX, Zai SD et al. Randomised controlled trial of cétuximab plus chemotherapy for patients with KRAS wild-type unresectable colorectal liver-limited metastases. J Clin Oncol 2013;31:1931-8
- Zorzi D, Chun YS, Madoff DC, Abdalla EK, Vauthey JN. Chemotherapy with bévacizumab does not affect liver regeneration after portal vein embolization in the treatment of colorectal liver metastases. Ann Surg Oncol 2008;15:2765-72
- Zorzi D, Mullen JT, Abdalla EK, Pawlik TM, Andres A, Muratore A,et al. Comparison between hepatic wedge resection and anatomic resection for colorectal liver metastases. J Gastrointest Surg 2006;10:86-94
4.13. Annexes
Annexe 1
A- Principaux schémas de chimiothérapie de 1ère ligne
- Capécitabine (Xéloda ®) = 2500 mg/m2 /j (1 250 mg/m2 matin et soir), 2 semaines sur 3 2 semaines sur 3 avec évaluation après 3 cures (9 semaines). [Koopman et al. 2007 ; Tebbutt et al. 2010]
- LV5FU2 simplifié = acide folinique 400 mg/m2 (ou l-folinique 200 mg/m²) en 2 h dans 250 ml G 5 %, rincer puis 5 FU 400 mg/m2 en 10 min dans 100 ml de G 5 % puis 5 FU 2400 mg/m2 en perfusion continue de 46 h dans du G 5 % par infuseur portable (QSP 230 ml, 5 ml / h), pompe ou pousse seringue portable. Tous les 14 jours avec évaluation après 4 cures (2 mois) [Seymour et al. 2007]
- LVfd bolus 5FU2 simplifié = acide folinique 40 mg/m2 (ou l-folinique 20 mg/m2) en bolus IV dans 100 ml G 5 % rincer puis 5 FU 400 mg/m2 en 10 min dans 100 ml de G 5 % puis 5 FU 2400 mg/m2 en perfusion continue de 46 h dans du G 5 % par infuseur portable (QSP 230 ml, 5 ml / h), pompe ou pousse seringue portable. Tous les 14 jours avec évaluation après 4 cures (2 mois) (d’après [Ducreux et al. 2006])
- XELOX = oxaliplatine 130 mg/m2 en 2 h dans 250 ml de G 5 % puis capécitabine (Xéloda®) 2000 mg/m2 /j (1000 mg/m2 matin et soir), 2 semaines sur 3 (J2 à J15). Toutes les 3 semaines avec évaluation après 3 cures (2 mois) [Cassidy et al. 2008 ; Ducreux et al. 2011].
- XELOX 2 = oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G 5 % puis capécitabine 1 semaine sur 2
- XELIRI = irinotécan 240 mg/m2 en 90 min dans 250 ml de G 5 % puis capécitabine (Xéloda®) 2000 mg/m2/j (1000 mg/m2 matin et soir), 2 semaines sur 3 (J2 à J15). Toutes les 3 semaines avec évaluation après 3 cures (2 mois) [Koopman et al. 2007].
- FOLFIRI = irinotécan (Campto®) + LV5FU2 simplifié = irinotécan 180 mg/m2 en perfusion de 90 min dans 250 ml de G5 % en Y de l'acide folinique au J1 du LV5FU2 simplifié. Tous les 14 jours avec évaluation après 4 cures (2 mois) [Tournigand et al. 2004 ,Andre et al. 1999].
- FOLFOX 4 simplifié (USA=FOLFOX 6 modifié) = oxaliplatine (Eloxatine®) + LV5FU2 simplifié = oxaliplatine 85 mg/m en 2 h dans 250 ml de G 5 % en Y de l’a.folinique Toutes les 2 semaines avec évaluation après 4 cures (2 mois) [Cassidy et al. 2006].
- FOLFOX 6 = oxaliplatine (Eloxatine ®) + LV5FU2 simplifié = oxaliplatine 100 mg/m2 en 2 h dans 250 ml de G 5 % en Y de l’a.folinique. Toutes les 2 semaines avec évaluation après 4 cures (2 mois) [Tournigand et al. 2004 ; Ducreux et al. 2011].
- FOLFOX 7 = oxaliplatine (Eloxatine ®) + LV5FU2 simplifié sans 5FU bolus = oxaliplatine 130 mg/m2 en 2 h dans 250 ml de G 5 % en Y de l’acide folinique 400 mg/m2 (ou l-folinique 200 mg/m2) en 2 h dans 250 ml G 5 % puis rincer puis 5 FU 2400 mg/m2 en perfusion continue de 46 h dans du G 5 % par infuseur portable (QSP 230 ml, 5 ml / h), pompe ou pousse seringue portable. Toutes les 2 semaines avec évaluation après 4 cures (2 mois) [Tournigang et al. 2006].
- Raltitrexed (Tomudex ®) = raltitrexed 3 mg/m2 en 15 min dans 250 ml de G 5 % (voie périphérique et administration à domicile possible) ; adaptation des doses à la clairance de la créatinine si < 65 ml/min ; antidote = acide folinique.
- TOMOX = raltitrexed (Tomudex ®) + oxaliplatine (Eloxatine ®) = raltitrexed 3 mg/m2 en 15 min dans 250 ml de G 5 % puis 45 minutes après oxaliplatine 130 mg/m2 en 2 h dans 250 ml de G 5 % ; adaptation des doses de raltitrexed à la clairance de la créatinine si < 65 ml/min ; antidote = acide folinique. Toutes les 3 semaines avec évaluation après 3 cures [Seitz et al. 2002 ; Scheithauer et al. 2001]
- FOLFOXIRI = irinotécan 165 mg/m2 puis oxaliplatine 85 mg/m2en 2 h dans 250 ml de G 5 % en Y de l’acide folinique 400 mg/m2 (ou l-folinique 200 mg/m2) en 2 h dans 250 ml G 5 % puis rincer puis 5 FU 3200 mg/m2 en perfusion continue de 46 h dans du G 5 % par infuseur portable (QSP 230 ml, 5 ml/h), pompe ou pousse seringue portable. Toutes les 2 semaines avec évaluation après 4 cures (2 mois) [Souglakos et al. 2006 ; Masi et al. 2006 ; Falcone et al. 2007]
- FOLFIRINOX = irinotécan 180 mg/m2 puis oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G 5 % en Y de l’acide folinique 400 mg/m2 (ou l-folinique 200 mg/m2) en 2 h dans 250 ml G 5 % puis rincer puis 5FU bolus 400 mg/m2 puis 5 FU 2400 mg/m2 en perfusion continue de 46 h dans du G 5 % par infuseur portable (QSP 230 ml, 5 ml / h), pompe ou pousse seringue portable. Toutes les 2 semaines avec évaluation après 4 cures (2 mois) [Ychou et al. 2007]
- FOLFIRI fort = irinotécan (Campto®) 240 mg/m2 à J1 de LV 5FU2 simplifié tous les 14 jours avec évaluation après 4 cures (2 mois) [Ducreux et al. 2008]
- FOLFIRI 3 = irinotécan (Campto®) 100 mg/m2 à J1 et J3 de LV5FU2 simplifié tous les 14 jours avec évaluation après 4 cures (2 mois) [Viel et al. 2008 ; Mabro et al. 2006 ; Bidard et al. 2009].
- Trifluridine/Tipiracil (Lonsurf ®) = Trifluridine/Tipiracil, administré par voie orale à la dose initiale recommandée de 35 mg/m2/, à raison de 2 administrations par jour, aux Jours 1 à 5 puis aux Jours 8 à 12 de chaque cycle de traitement (J1=J28). [Mayer et al. 2015]
B- Les thérapies ciblées
bévacizumab (Avastin®)
REFERENCE
- bévacizumab 5 mg/kg en 90 min à la cure 1 puis 60 min à la cure 2 puis 30 min aux cures suivantes dans 100 ml de sérum physio après chimio au J1 de LV5FU2 plus ou moins irinotécan ; contre-indications : protéinurie > 2g/24h (précaution si > 1g/24h), antécédent thrombo-embolique artériel récent (< 6 mois) et/ou symptomatique, chirurgie < 28 jours, ulcère ou plaie non cicatrisé, aspirine > 325 mg/j, HTA non contrôlée, prothèse colique en place ; précautions : si anti-coagulants car risque hémorragique (bilan de coagulation à chaque cure), si inflammation intra-abdominale (diverticulite, colite, ulcère, tumeur primitive en place, radiothérapie abdomino-pelvienne, carcinose) car risque de perforation accru. Toutes les 2 semaines avec évaluation après 4 à 6 cures (2 à 3 mois) (d’après [Kabbinavar et al. 2005 ; Kabinavar et al. 2003 ; Hurwitz et al. 2004 ; Fuchs et al. 2007 ; Ducreux et al. 2013]).
OPTIONS
- bévacizumab 5 mg/kg en 30 minutes dès la cure 1 puis en 10 minutes à la cure 2 si la tolérance est bonne [Coriat et al. 2011 ; Reidy et al. 2007]
- bévacizumab 5 mg/kg après chimio au J1 de LV5FU2 plus oxaliplatine toutes les 2 semaines [Hochster et al. 2008 ; Giantonio et al. 2007 ; Saltz et al. 2008];
- bévacizumab 7,5 mg/kg si associé à chimiothérapie capécitabine toutes les 3 semaines et avec évaluation après 3 à 4 cures (2 à 3 mois) [Tebbutt et al. 2010]
- bévacizumab 7,5 mg/kg si associé au schéma de chimiothérapie ELOX toutes les 3 semaines et avec évaluation après 3 à 4 cures (2 à 3 mois) [Hochster et al. 2008 ; Saltz et al. 2008]
- bévacizumab 7,5 mg/kg si associé au schéma de chimiothérapie ELIRIX toutes les 3 semaines et avec évaluation après 3 à 4 cures (2 à 3 mois) [Schmiegel et al. 2007, Ducreux et al. 2013].
cétuximab (Erbitux ®) / panitumumab (Vectibix®) (tumeur RAS WT)
REFERENCE
Il est indispensable de tester le statut mutationnel tumoral RAS et en option le statut tumoral BRAF. Il n’y a pas de réponse objective chez les patients dont le gène RAS tumoral est muté dans plusieurs séries rétrospectives et une analyse poolée [Liève et al. 2006 ; Lièvre et al. 2008 ; De Rook et al. 2010 ; Heinemann et al. 2014 ; Stintzing et al. 2013]. Ces résultats ainsi que ceux constatés en première ligne ont impliqué une restriction d’AMM au statut RAS non muté par l’EMEA. Il n’est plus recommandé de tester le statut d’EGFR par immunohistochimie, car il n’est pas prédictif de réponse.
- cétuximab 400 mg/m2 en 2h IV à cure 1 puis dose d’entretien hebdomadaire 250 mg /m2 en 1h IV associé tous les 14 jours après 1 heure de repos à irinotécan 180 mg/m2 en perfusion de 90 min dans 250 ml de G5 %. Prémédication par corticoïdes et anti-H1 et surveillance car risque d’allergie. Toutes les semaines avec évaluation après 8 à 12 cures (2 à 3 mois) [Cunningham et al. 2004]
- cétuximab 400 mg/m2 en 2h IV à cure 1 puis dose d’entretien hebdomadaire 250 mg /m2 en 1h IV associé tous les 14 jours après 1 heure de repos à FOLFIRI. Prémédication par corticoïdes et anti-H1 et surveillance car risque d’allergie. Toutes les semaines avec évaluation après 8 à 12 cures (2 à 3 mois) [Van Cutsem et al. 2009 ; Folprecht et al. 2009 ; Van Cutsem et al. 2011]
- cétuximab 400 mg/m2 en 2h IV à cure 1 puis dose d’entretien hebdomadaire 250 mg /m2 en 1h IV associé tous les 14 jours après 1 heure de repos à FOLFOX. Prémédication par corticoïdes et anti-H1 et surveillance car risque d’allergie. Toutes les semaines avec évaluation après 8 à 12 cures (2 à 3 mois) [Bokemeyer et al. 2009 ; Folprecht et al. 2009 ; Maughan et al. 2011]
- cétuximab tous les 14 j à la dose de 500 mg/m2 (avec prémédication par corticoïdes et anti-H1) en 2h IV puis en 1h à la cure 2 associé après 1 heure de repos à irinotécan 180 mg/m2 en perfusion de 90 min avec évaluation après 4 à 6 cures (2 à 3 mois) [Tabernero et al. 2008, Pfeiffer et al. 2008,Wilke H et al. 2008 ; Bouchahda et al. 2010, Ciuleanu et al. 2011]
- panitumumab (Vectibix®) = 6 mg/kg tous les 14 j en perfusion de 1h dans 100 ml de chlorure de sodium à 0,9% sans prémédication avec évaluation après 4 à 6 cures (2 à 3 mois) [Wilke et al. 2008]
- panitumumab = 6 mg/kg tous les 14 j en perfusion de 1h dans 100 ml de chlorure de sodium à 0,9 % sans prémédication associé à FOLFOX4 avec évaluation après 4 à 6 cures (2 à 3 mois) [Douillard et al. 2010]
- panitumumab = 6 mg/kg tous les 14 j en perfusion de 1h dans 100 ml de chlorure de sodium à 0,9 % sans prémédication associé à FOLFIRI avec évaluation après 4 à 6 cures (2 à 3 mois) [Peters et al. 2010]
autres biothérapies : encorafénib, regorafenib et fruquintinib
- Encorafenib (BraftoviI®) = encorafenib, administré par voie orale à la dose recommandée de 300 mg (quatre gélules de 75 mg) une fois par jour, en association au cetuximab (400 mg/m² en dose initiale puis 250 mg/m² toutes les semaines)
- Regorafenib (Stivarga®) = regorafenib, administré par voie orale à la dose recommandée de 160 mg (4 comprimés de 40 mg) une fois par jour pendant 3 semaines, suivies d’une semaine de pause. Cette période de 4 semaines correspond à un cycle de traitement
Fruquintinib (Fruzaqla®) = fruquintinib, administré par voie orale à la dose recommandée de 5 mg (gélules de 1mg et 5 mg) une fois par jour pendant 3 semaines, suivies d’une semaine de pause. Cette période de 4 semaines correspond à un cycle de traitement
immunothérapies : pembrolizumab, nivolumab et ipilumumab
- Pembrolizumab (Keytruda®) = pembrolizumab, administré par voie IV à la dose recommandée 200 mg toutes les 3 semaines pendant 30 minutes.
- Nivolumab (Optivo®) + ipilumumab (Yervoy®) = nivolumab 240 mg + ipilumumab 1 mg/kg par voie IV en 30 minutes toutes les 3 semaines pendant 12 semaines
puis nivolumab 480 mg toutes les 4 semaines
C- Principaux protocoles de chimiothérapies de 1ère ligne associés à une thérapie ciblée utilisés en France
LV5FU2 simplifié (recommandation : grade A)
- +/- bévacizumab 5 mg/kg (Avastin®) [Kabbinavar et al. 2005 ; Kabinavar et al. 2003] avec schéma de 5FU modifié (recommandation : grade B)
capecitabine (Xeloda®) [Tebbutt et al. 2010] (recommandation : grade A)
- +/- bévacizumab 7,5 mg/kg [Tebbutt et al. 2010] (recommandation : grade B)
FOLFIRI (irinotécan 180 mg/m2 - LV5FU2 simplifié) [Tournigand et al. 2004] (recommandation : grade A)
- o+/- bévacizumab 5 mg/kg - FOLFIRI [Fuchs et al. 2007 ; Ducreux et al. 2013] (recommandation : grade B)
- +/- cétuximab 400 mg/m2 puis 250 mg/m2 hebdomadaire [Van Cutsem et al. 2009 ; Van Cutsem et al. 2011] si statut tumoral RAS non muté (recommandation : grade B). Possibilité d’administrer une double dose (500 mg/m2) toutes les deux semaines [Tabernero et al. 2008, Pfeiffer et al. 2008, Bouchahda et al. 2010, Ciuleanu et al. 2011] (recommandation : grade B)
- +/- panitumumab 6 mg/kg [Douillard et al. 2010] si le statut tumoral RAS est non muté (recommandation : grade C)
FOLFOX 4 simplifié (US =6 modifié) (oxaliplatine 85 mg/m2-LV5FU2 simplifié) (recommandation : grade A)
- +/- bévacizumab 5 mg/kg [Saltz et al. 2008] (recommandation : grade B - cette association n'a pas été retenue par l'ensemble des membres du groupe de travail du fait de l’absence d’amélioration de la survie sans progression dans l’analyse de sous-groupe d’un essai de phase III) (avis d’experts)
- +/- panitumumab 6 mg/kg [Douillard et al. 2010] si le statut tumoral RAS est non muté (recommandation : grade B)
- +/- cétuximab 400 mg/m2 puis 250 mg/m2 hebdomadaire [Van Cutsem et al. 2009 ; Van Cutsem et al. 2011] si statut tumoral RAS non muté. Possibilité d’administrer une double dose (500 mg/m2) toutes les deux semaines [Tabernero et al. 2008, Pfeiffer et al. 2008, Bouchahda et al. 2010, Ciuleanu et al. 2011] (recommandation : grade C)
- +/- encorafenib [Elez et al. 2025] par voie orale à la dose recommandée de 300 mg (quatre gélules de 75 mg) une fois par jour, en association au cetuximab (400 mg/m² en dose initiale puis 250 mg/m² toutes les semaines) (recommandation : grade A)
FOLFOXIRI (irinotécan 165 mg/m2 - oxaliplatine 85 mg/m2 – Ac Folinique 200 mg/m2 5FU continu 3200 mg/m2)
- +/- bévacizumab 5 mg/kg [Loupakis et al. 2014]
- +/- cétuximab 500 mg/m2) toutes les deux semaines [Ychou et al. 2016]
- +/- panitumumab 6 mg/kg [Modest et al. 2019]
FOLFIRINOX (irinotécan 180 mg/m2 - oxaliplatine 85 mg/m2 - LV5FU2 simplifié)
- +/- bévacizumab 5 mg/kg [Ychou et al. 2022]
- +/- panitumumab 6 mg/kg [Ychou et al. 2022]
- +/- cétuximab 400 mg/m2 cure 1 puis 250 mg /m2
FOLFOX 7 (oxaliplatine 130mg/m² -LV5FU2 simplifié sans 5FU bolus)
6 cures puis LV5FU2 simplifié puis réintroduction de l’oxaliplatine à la progression (stratégie OPTIMOX 1) (recommandation : grade B)
XELOX (recommandation : grade A)
+/- bévacizumab 7,5 mg/kg [Saltz et al. 2008](recommandation : grade B)/em>
- L’association du cétuximab ou du panitumumab à l’oxaliplatine est formellement contre-indiquée lorsque RAS est muté car délétère en termes de survie, et inefficace avec l’irinotecan [Bokemeyer et al. 2009 ; Douillard et al. 2010]
- L’association XELOX-cétuximab est déconseillée car toxique et sans bénéfice (retrait d’AMM) [étude COIN Maughan et al. 2011]
Options si contre-indication aux fluoropyrimidines (5FU, capécitabine)
- raltitrexed (Tomudex®) adaptation des doses à la clairance de la créatinine ; antidote = acide folinique (recommandation : grade C)
- raltitrexed-oxaliplatine (TOMOX) [Seitz et al. 2002 ; Scheithauer et al. 2001] (recommandation : grade C)
- raltitrexed-irinotécan (TOMIRI) (recommandation : grade C)
- irinotécan-oxaliplatine (IRINOX) (recommandation : grade C)
- irinotécan (recommandation : grade C)
- oxaliplatine 130 mg/m 2 tous les 21 jours [Ducreux et al. 1999] (recommandation : grade C)
- Trifluridine/Tipiracil (Lonsurf ®) = Trifluridine/Tipiracil, administré par voie orale à la dose initiale recommandée de 35 mg/m2/, à raison de 2 administrations par jour, aux Jours 1 à 5 puis aux Jours 8 à 12 de chaque cycle de traitement (J1=J28). [Mayer et al. 2015]
Options en l’absence de contre-indication au bévacizumab
- bévacizumab 5 mg/kg - LVfd5FU2 d'après Kabinavar et al [Kabbinavar et al. 2005 ; Kabinavar et al. 2003] avec schéma de 5FU modifié (accord d’experts)
- bévacizumab 7,5 mg/kg - XELIRI [Schmiegel et al. 2007, Ducreux et al. 2013] (recommandation : grade C)
Options en l’absence de contre-indication aux fluoropyrimidines
- LVfd5FU2 [37] schéma plus court que LV5FU2 (recommandation : grade B)
- FOLFOX 6 (oxaliplatine 100mg/m2-LV5FU2 simplifié) [Tournigand et al. 2004] schéma intensifié mais pas de comparaison disponible avec le FOLFOX4 simplifié (recommandation : grade C)
- XELIRI [Ducreux et al. 2013] alternative moins contraignante que FOLFIRI (recommandation : grade C)
Chimiothérapie avec adaptation pharmacocinétique du 5FU [Gamelin et al. 1996 et 1998] (recommandation : grade C)
Annexe 2 : Conseils pour la prise en charge des effets indésirables des inhibiteurs de l’EGFR (cétuximab, panitumumab)
D’après le thésaurus du Réseau Champardennais d’Oncologie Digestive (RESCOD) coordonné par Olivier Bouché (CHU Reims).
Remerciements à la relectrice : Géraldine Perceau (Dermatologie, CHU Robert Debré, Reims).
D’après une revue de la littérature avec illustrations photographiques des lésions cutanées [Bouché et al. 2009 ; Bachmeyer et al. 2013 ; Reguiai et al. 2012].
Xérose
- maintien bonne hydratation cutanée par émollients ; exemples de produits remboursés : Dexeryl® crème 2 applications par jour après toilette ou préparation magistrale (Cold Cream® du Codex ; Cerat de Galien®) avec la mention « prescription médicale à visée thérapeutique en l’absence de spécialité équivalente disponible ».
- anti-histaminiques si prurit (ex : Clarityne® 1cp par jour le matin).
Éruption acnéiforme
Facteurs aggravants
- exposition solaire excessive
- radiothérapie concomitante
- hydratation cutanée insuffisante
- gels ou lotions avec excipient alcoolique irritant
Traitements préventifs
Un essai randomisé a montré qu’un traitement préventif systématique diminuait significativement la fréquence et l’intensité de la toxicité cutanée [Lacouture et al. 2010] :
- émollients le matin, toilette avec pain dermatologique,
- crème solaire protectrice, éviction solaire
- tétracycline de type doxycycline (par exemple Tolexine ® Gé 100 mg 1 cpr ou 2 cpr par jour au milieu des repas)
- crème à l’hydrocortisone à 1 % le soir sur la face, les mains, les pieds, la nuque, le dos et le torse (recommandation non retenue par l'ensemble des membres du groupe de travail en préventif
- pas de contre-indication à maquillage couvrant par fond de teint (ex : Dermablend®).
Traitements curatifs : (exemples d’ordonnances)
Cf. la référence [Bouché et al. 2009] pour l’iconographie des formes cliniques.
Formes minimes : émollient
- Dexeryl® crème 1 à 2 applications par jour après la toilette.
Formes intermédiaires : émollient, cyclines PO et corticoïde local classe III (activité forte)
- Dexeryl® crème 1 application le soir
- Tolexine® Gé 100 mg 1 cpr par jour au milieu des repas pendant 1 mois puis 1 cpr à 50 mg par jour renouvelable sur plusieurs mois
- Diprosone® crème 1 application le soir
Formes graves (surinfection) ou atypiques => AVIS DERMATOLOGIQUE
- arrêt de l’anti-EGFR discuté entre le dermatologue, l’oncologue et le patient.
- écouvillonnage avec mise en culture bactériologique et virale
- anti-biothérapie topique (acide fusidique : crème Fucidine®) plus ou moins orale ciblant le staphyloccoque doré en fonction du nombre des lésions, type pénicilline résistante aux pénicillinases (oxacilline) ou synergistine (pristinamycine).
Hypertrichose
- couper les cils en cas de gêne oculaire
- épilation si retentissement esthétique et psychologique.
Périonyxis = « faux panaris »
Traitements préventifs
- soins pédicures avant de débuter le traitement
- ne pas couper les ongles à ras dans les coins
- bonne hygiène, éviter les microtraumatismes (chaussures trop serrées, talons trop hauts)
Traitements curatifs
- antiseptiques (ex : Betadine® scrub 4 % ou Dakin bain 1 fois par jour ou Bétadine 10 % gel)
- si douloureux : antiseptiques + corticoïde local classe IV (ex. d’ordonnance ci-dessous) :
- Biseptine® spray 1 application par jour puis
- Dermoval® crème une couche épaisse puis pansement occlusif
- Compresses 10 x 10, 1 boîte de 100
- Omnifix 1 boîte.
- si surinfection : avis dermatologique
- si aspect végétant douloureux (granulome pyogénique) : application quotidienne de nitrate d’argent (crayon)
Asthénie et/ou paresthésies
- dosage de la magnésémie et de la calcémie avant traitement puis régulièrement (toutes les 2 semaines sous panitumumab)
- supplémentation intra-veineuse si hypomagnésémie <1,2 mg/dL et/ou symptomatique par sulfate de magnésium :
- si hypomagnésémie entre 1,2 et 0,9 mg/dL => 4 g IV en 2 heures à chaque cure
- si hypomagnésémie < 0,9 mg/dL => 8 g IV en 4 heures/j ou tous les 2 jours jusqu’à normalisation
Fissures cutanées
- crèmes grasses (Cold Cream® ou vaseline du Codex) ou pommades cicatrisantes non remboursées (ex : Bépanthène® ou Avibon®)
- pansements hydrocolloïdes (ex : Comfeel® mince)
Annexe 3 : Conseils pour la prise en charge des effets indésirables des anti-angiogéniques (bévacizumab)
D'après le thésaurus du Réseau Champardennais d’Oncologie Digestive (RESCOD) coordonné par Olivier Bouché (CHU Reims).
Remerciements au relecteur : Jean-Pierre Chabert (Cardiologie, CHU Robert Debré, Reims).
Dans tous les cas, il faut être attentif aux contre-indications et précautions d’emploi du bévacizumab, en particulier en cas d’athérosclérose. Il faut informer les patients des risques du traitement : HTA, hémorragies, perforations digestives ou accidents thromboemboliques artériels.
Sous l’égide de plusieurs sociétés savantes françaises (SN, SFHTA, APNET, FFCD), un groupe de travail d’hypertensiologues, de néphrologues, de cardiologues et d’oncologues a élaboré des Recommandations de Pratiques Cliniques sur la prise en charge des effets vasculaires et rénaux des anti-angiogéniques [Halimi et al. 2008].
Hypertension Artérielle
Mesure de la PA au mieux en ambulatoire par le médecin traitant et/ou par auto-mesure à domicile par un appareil validé par l’AFSSAPS.
Prise de PA après au moins 5 minutes de repos.
- Le « schéma des 3 » édicté par l'HAS est conseillé : 3 prises de la PA le matin au réveil à 5 minutes d’intervalle, 3 prises de la PA le soir au coucher à cinq minutes d’intervalle, 3 jours de suite
- HTA est définie par PA systolique > 140mmHg et/ou PA diastolique > 90mmHg (en ambulatoire PA systolique > 135mmHg et/ou PA diastolique > 85mmHg)
- Si PA systolique > 140mmHg et/ou PA diastolique > 90mmHg reprendre après 5 nouvelles minutes de repos
- La prise en charge se fera au mieux par un travail en réseau comprenant médecin généraliste, oncologue, cardiologue et néphrologue avec carnet de suivi
- Les objectifs seront d’éviter, d’une part, un arrêt inapproprié du bévacizumab, et d’autre part, une complication grave de l’HTA
- Seule une « urgence hypertensive » (encéphalopathie, HTA maligne, HTA avec insuffisance cardiaque, dissection aortique, accidents vasculaires cérébraux, infarctus du myocarde, ou leuco-encéphalopathie postérieure) nécessite un arrêt définitif du traitement.
[Halimi et al. 2008]
Traitement anti-hypertenseur (exemples pour faciliter la prescription)
1ère intention = monothérapie
| diurétique | Esidrex® 1 cpr/j asilix® retard 60 mg 1 gél/j |
| ou inhibiteur enzyme conversion (IEC) | Zestril® 20 mg 1 cpr/j Triatec® 5 mg 1 cpr/j |
| (si insuffisance rénale) | Zestril® 5 mg 1 cpr/j Triatec® 1,25 mg 1 cpr/j |
| ou antagoniste angiotensine 2 (ARA2) | Cozaar® 50 mg 2 cpr/j |
| ou antagoniste calcique | Amlor® 5 mg 1 cpr/j |
2ème intention = bithérapie par association à dose fixe
Si après 4 semaines de monothérapie PA systolique >140 mmHg et PA diastolique > 90 mmHg
| IEC + diurétique | Co-rénitec®1 cpr/j Zestorétic®1 cpr/j |
| ou antagoniste angiotensine 2 + diurétique | Hyzaar® puis Fortzaar® 1 cpr/j Cotareg® 80 puis 160 1 cpr/j |
3ème intention, si résistance à une bithérapie => visa d’un cardiologue
Anti-hypertenseurs et pathologies associées
| Pathologies associées | Classe à privilégier | Classe à éviter ou à utiliser avec prudence |
|---|---|---|
| Protéinurie | IEC, ARA2 | |
| Insuffisance coronaire | Bêta-bloquants, antagonistes calc. | Vasodilatateurs directs |
| Insuffisance cardiaque | IEC, diurétiques | Bêta-bloquants antagonistes calciques (vérapamil, diltiazem) |
| Troubles conductifs | IEC, diurétiques | A. calciques (vérapamil, diltiazem), bêta-bloquants |
| Cardiopathie obstructive | vérapamil, diltiazem | IEC,bêta-bloquants, anti-HTA centraux, diurétiques |
| Artériopathie | IEC, antagonistes calciques | Bêta-bloquants |
| Insuffisance rénale | IEC faible dose, diurétiques anse | Thiazidiques, diurétiques épargneurs de K |
| Diabète | IEC, antagonistes calciques | Bêta-bloquants |
| Asthme BPCO | Bêta-bloquants | |
| Dyslipidémie | Bêta-bloquants, diurétiques | |
| Hypercalcémie | Thiazidiques | |
| Dépression | Antihypertenseurs centraux |
CAT si anticoagulants ou/et thrombose
Si traitement à dose préventive
=
> association possible à l’Avastin®
- aspirine < 325 mg/j si AVK ou HBPM = prudence avec surveillance par bilan de coagulation avant chaque cure
Si accident thrombo-embolique artériel
= > arrêt définitif de l’Avastin®
Si accident thrombo-embolique veineux
=> suspension 2 semaines puis reprise si anti-coagulation stable
surveillance coagulation / 2j première semaine, puis 2 fois/ sem., puis si stable au moins avant chaque cure
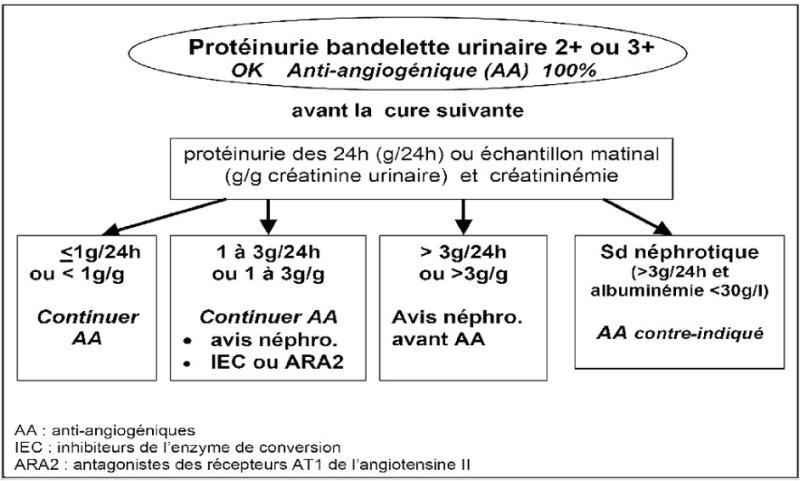
Contre-indications
- grossesse
- allergie à la substance active
Précautions d’emploi
- début de traitement au moins 28 j après chirurgie et après cicatrisation complète de la plaie chirurgicale
- arrêt du traitement au moins 4 à 5 semaines avant une intervention chirurgicale, une extraction dentaire ou une polypectomie endoscopique planifiée
- risque accru de perforation gastro-intestinale si diverticulite, ulcère gastro-intestinal, tumeur en place, carcinose péritonéale ou antécédent de radiothérapie abdominale ou pelvienne
- risque accru d’ischémie colique si antécédent de radiothérapie abdominale ou pelvienne
- risque accru d’accident thrombo-embolique artériel si âge > 65 ans et/ou antécédent d’accident thrombo-embolique artériel
Annexe 4 : Outil de dépistage gériatrique en oncologie : G8
Systématique pour les patients âgés de 75 ans et plus
Entre 70 et 75 ans, à discuter en fonction des fragilités et des comorbidités
Items
| Réponses possibles (score) |
|---|---|
| Le patient présente-t-il une perte d’appétit ? A-t-il mangé moins ces 3 derniers mois par manque d’appétit, problèmes digestifs, difficultés de mastication ou de déglutition ? | 0 : anorexie sévère 1 : anorexie modérée 2 : pas d’anorexie |
| Perte récente de poids (< 3 mois) | 0 : perte de poids > 3 kg
|
Motricité
| 0 : du lit au fauteuil 1 : autonome à l’intérieur 2 : sort du domicile |
| Problèmes neuro-psychologiques | 0 : démence ou dépression sévère 1 : démence ou dépression modérée 2 : pas de problème psychologique |
| Indice de masse corporelle (IMC) | 0 : IMC < 19 1 : 19 ≤ IMC < 21 2 : 21 ≤ IMC < 23 3 : IMC ≥ 23 |
Prend plus de 3 médicaments
| 0 : oui 1 : non |
Le patient se sent-il en meilleure ou moins bonne santé que la plupart des personnes de son âge
| 0 : moins bonne 0,5 : ne sait pas 1 : aussi bonne 2 : meilleure |
| Age (ans) | 0 : > 85 1 : 80-85 2 : < 80 |
| TOTAL / 17 |
Si score ≤ 14 : indication d’évaluation oncogériatrique
Annexe 5 : Tableaux
Tableau I - Niveaux de difficulté de résécabilité des métastases hépatiques et critères carcinologiques pronostiques péjoratifs
Possible par une hépatectomie complexe ou très large (plus de 4 segments) requérant une procédure difficile et/ou risquée (par exemple hépatectomie centrale sous exclusion vasculaire, hépatectomie droite élargie, reconstruction vasculaire) Atteinte des 2 pédicules portaux, atteinte d’un pédicule portal et de la veine sus-hépatique contro-latérale, atteinte des 3 veines sus-hépatiques Taille > 5 cm, nombre > 3, caractère bilobaire, ganglion pédiculaire envahi, ACE élevé
| Résécabilité de classe I | Evidente par une hépatectomie classique (4 segments ou moins, laissant plus de 40 % de parenchyme résiduel) |
| Résécabilité de classe II | Possible par une hépatectomie complexe ou très large (plus de 4 segments) requérant une procédure difficile et/ou risquée (par exemple hépatectomie centrale sous exclusion vasculaire, hépatectomie droite élargie, reconstruction vasculaire) |
| Résécabilité impossible | Atteinte des 2 pédicules portaux, atteinte d’un pédicule portal et de la veine sus-hépatique contro-latérale, atteinte des 3 veines sus-hépatiques |
| Critères carcinologiques pronostiques péjoratifs | Taille > 5 cm, nombre > 3, caractère bilobaire, ganglion pédiculaire envahi, ACE élevé |
Tableau II - Critères permettant de discuter l’indication d’une cyto-réduction (+/- CHIP) pour carcinose péritonéale (en cours de validation[Chiche et al. 2003])
| Critères majeurs d’exclusion | 1.Métastases extra-abdominales 2.Métastases hépatiques (sauf si < 3, périphériques et aisément résécables) 3.Progression sous chimiothérapie systémique |
| Critères mineurs d’exclusion | 1.Carcinose étendue au scanner ou cliniquement importante 2.Age > 70 ans 3.Obésité (IMC > 40) 4.Occlusion 5.Métastase associée intra-abdominale autre que la carcinose sauf si peu nombreuses et facilement résécables |
| Aucun critère présent | Indication à une CHIP => patient à adresser dans un centre de référence. En cas de carcinose synchrone ne pas réaliser la colectomie |
| Un critère mineur présent | Indication possible de CHIP => contacter un centre de référence pour un avis dès le diagnostic de carcinose posé |
| Un critère majeur ou 2 critères mineurs | Indication peu probable de CHIP => refaire un bilan à trois mois, puis contacter un centre si réponse objective à la chimiothérapie ou modification des critères |
| Plus d’un critère majeur ou de 3 critères mineurs | Pas d’indication de CHIP => traitement par chimiothérapie systémique si possible |
Tableau III - Facteurs pronostiques de survie en cas de maladie métastatique traitée par 5FU[Köhne et al. 2002]
| Risque | Fréquence | Définition | Médiane de survie |
|---|---|---|---|
| Faible | 44 % | OMS 0-1, 1 site envahi | 14,7 mois |
| Intermédiaire | 35 % | 0MS 0-1, plus d’1 site et phosphatases alcalines <300 U/L ou OMS >1, Globules blancs < 10.109/L, 1 Seul site envahi | 10,5 mois |
| Haut | 21 % | OMS 0/1, plus d’1 site, et phosphatases alcalines > 300 U/L ou OMS > 1, plus d’1 site envahi Ou Globules blancs >10.109 /L | 6,4 mois |
Annexe 6 : Arbre décisionnel lors d’un cancer colique occlusif
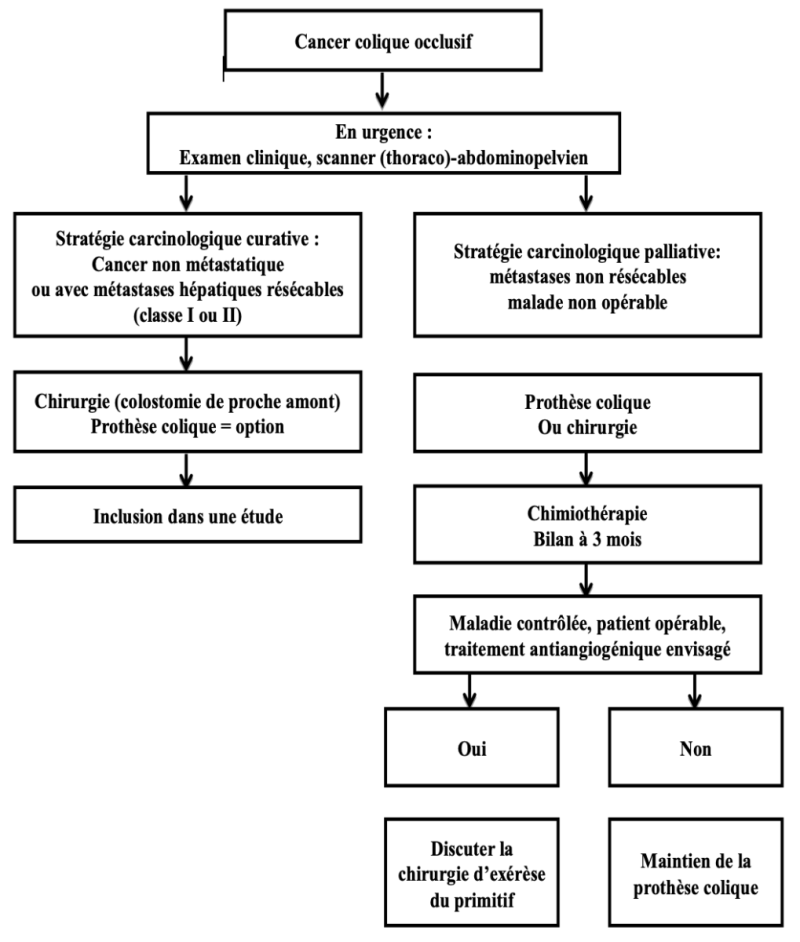
Annexe 7 : Stratégie CCRM RAS WT (KRAS et NRAS exon 2, 3 et 4) et BRAF V600E WT et non MSI-H et grades (Gr) de recommandation
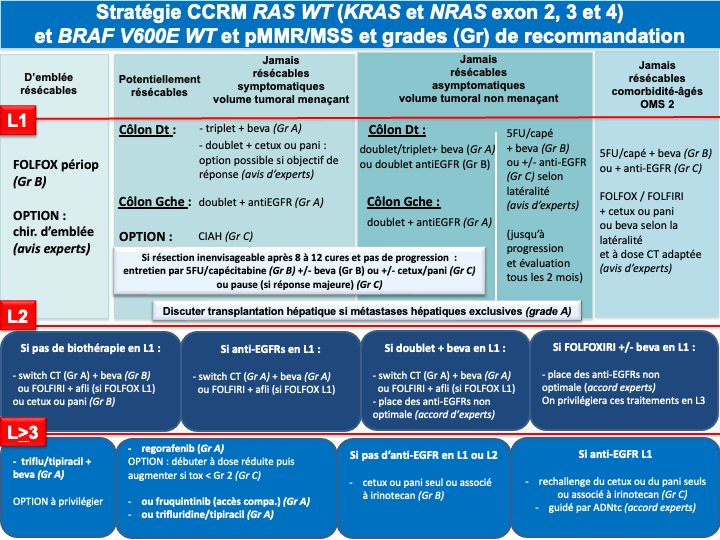
Annexe 8 : Stratégie CCRM BRAF V600E Muté et non MSI-H et grades (Gr) de recommandation
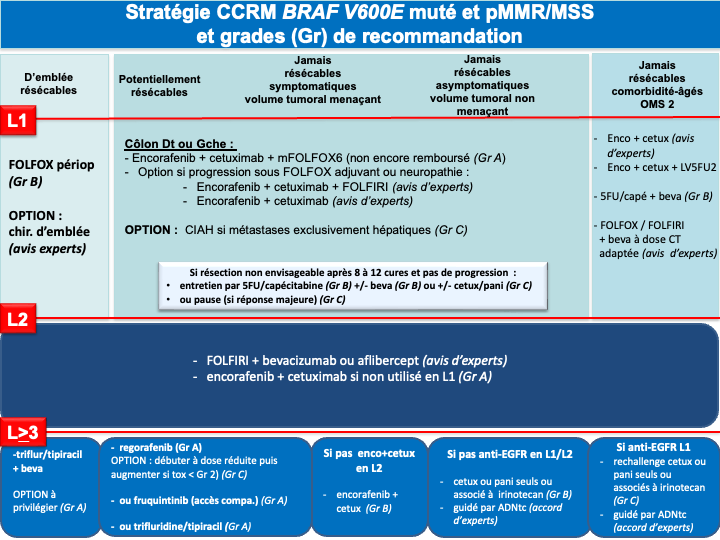
Annexe 9 : Stratégie CCRM RAS M (KRAS et NRAS exon 2, 3 et 4) et non MSI-H et grades (Gr) de recommandation
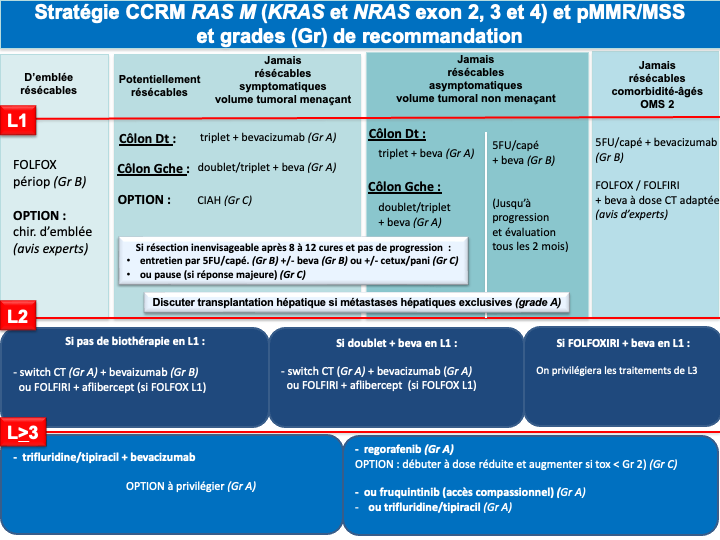
Annexe 10 : Stratégie CCRM MSI-H (quelque-soit le statut RAS et BRAF) et grades (Gr) de recommandation
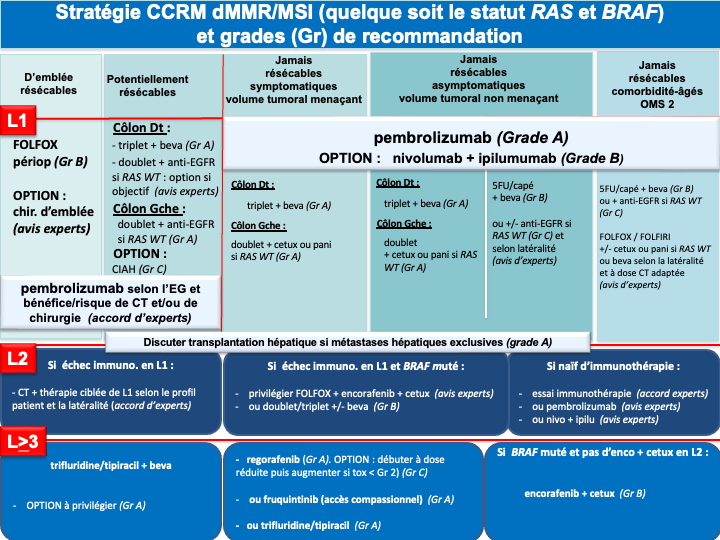
Annexe 11 : Stratégie de choix des traitements (chimiothérapies et/ou biothérapies) en fonction du choix de première ligne