3. Cancer du côlon non métastatique
(Dernière mise à jour le : )Principaux changements de la mise à jour du 11/07/2025
3.4.6.3. Stade II : ajout de méta-analyse des études pivotales MOSAIC et C-07 suggèrant que l’ajout de l’oxaliplatine n’améliorait pas de manière significative la survie globale.
3.4.6.4. Stade III tumeur dMMR/MSI : essai phase III ATOMIC (FOLFOX 6 mois versus le FOLFOX 6 mois plus atézolizumab (anti-PD-L1) pendant 12 mois) positif sur son critère principal de jugement mais valeur ajoutée de l’atezolizumab en adjuvant semble moindre que celle de l’immunothérapie néo-adjuvante ; le positionnement optimal de l’immunothérapie pour les cancers coliques pMMR/MSI de stade III reste encore à déterminer.
Stade III dMMR/MSI : (figure 9 et tableau 4)
OPTIONS pour cancers sans traitement néo-adjuvant par immunothérapie, la combinaison FOLFOX 6 mois plus atézolizumab 12 mois est à discuter au cas par cas en RCP (absence d’AMM et de remboursement) (grade B).
3.4.6.7.3. Activité physique (cf. TNCD chapitre 17 Nutrition et Activité Physique) : étude phase III CHALLENGE dans cancers coliques stade II à haut risque et stade III démontrant l’intérêt d’un activité physique renforcée avec programme de 3 ans
Stade II : (figure 7 et tableau 4)
OPTIONS Pratique d’une activité physique d’intensité modérée, adaptée à la condition du patient et encadrée doit être prescrite, notamment pour les stade II à haut risque de récidive (grade A).
Stade III : (figure 9 et tableau 4)
REFERENCES Pratique d’une activité physique d’intensité modérée, adaptée à la condition du patient et encadrée doit être prescrite (grade A).
Principaux changements de la mise à jour du 19/11/2024
3.2.2. bilan d’extension : colo-scanner avec distension au CO2 (et non à l’eau)
3.4.6.7.1. et 3.4.7. optimisation de chimiothérapie : essai LEANOX avec l’option d’adaptation de dose d’oxaliplatine en fonction de la masse maigre si sarcopénie (accord d’experts)
3.4.7. et 3.4.8. traitements adjuvants : option d’asssociation trifluridine/tipiracil + oxaliplatine (TAS-OX) si toxicité cardiaque C1 de fluoromyridines ou déficit complet en DPD (avis d’experts)
3.5.1. surveillance : option de scanner thoraco-abdominopelvien en cas de risque de récidive élevé (T4 et/ou N2) (avis d’experts)
3.4.5.3., 3.4.7. et 3.5.1. essais cliniques : fermeture de IMOTEP, RILUZOX-01 et DONEPEZOX
Groupe de travail et relecteurs
Groupe de travail :
D TOUGERON (Poitiers), coordonnateur,
L BENHAIM (Paris), F BIBEAU (Caen), B BLANC (Dax), R COHEN (Paris), J JACQUES (Limoges), JP LAGASSE (Orléans), P LAURENT-PUIG (Paris), C LEPAGE (Dijon), O LUCIDARME (Paris), J MARTIN BABAU (Saint-Brieuc), Y PANIS (Clichy-la-Garenne), F PORTALES (Montpellier), J TAIEB (Paris), T LECOMTE (Tours), E VAILLANT (Lille).
Relecteurs :
K AMROUN (Reims), T APARICIO (Paris), S AUVRAY (Caen), L BENHAIM (Villejuif), O BOUCHE (Reims), M BRASSEUR (Reims), D BRESSAND (Tours), R CAYLA (Biarritz), T DELEBECQ-JANECKI (Roubaix), M DUCREUX (Villejuif), A DUPRE (Lyon), L ETCHECHOURY (Bayonne), S GAUJOUX (Paris), B GUIU (Montpellier), F HUGUET (Paris), L LELONG (Bayonne), C LOUVET (Paris), L MAGGIORI (Paris), F MILOU (Lyon), L MOSSER (Rodez), P SEVE (Lyon), Y PARC (Paris), G PASSOT (Lyon), L QUINTANE (Valence), S ROOS (Albi), E SOBKENG-GOUFACK (Soissons), L VERNAY (Grenoble).
Comment citer ce chapitre :
Lecomte T, Tougeron D, Chautard R, Bressand D, André T, Bibeau F, Blanc B, Cohen R, Jacques J, Lagasse JP, Laurent-Puig P, Lepage C, Lucidarme O, Martin-Babau J, Panis Y, Portales F, Taïeb J, Aparicio T, Bouché O. Non-metastatic colon cancer - French Intergroup Clinical Practice Guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, SFP, AFEF, SFR). Dig Liver Dis. 2024;56(5):756-769. doi: 10.1016/j.dld.2024.01.208.
3.1. Généralités
- Nouvelle association de patients « Mon réseau cancer colorectal »
- Un réseau social pour les personnes touchées par un cancer colorectal et leurs proches. Pour échanger, se comprendre, se soutenir.
- Pour retrouver informations et adresses utiles :https://www.monreseau-cancercolorectal.com/
3.1.1. Epidémiologie
En France, le cancer colorectal se situe au 3ème rang (20 % de tous les cancers) après le cancer de la prostate et celui du sein [Defossez et al. 2019]. Le nombre de nouveaux cas estimés en 2018 était de 43 000 cancers colorectaux avec 65 % de localisation colique [Defossez et al. 2019]. Il représentait la 2ème cause de mortalité par cancer avec 17 000 décès en 2018. Tous stades confondus, la survie à 5 ans du cancer du côlon est d’environ 63 % [Defossez et al. 2019].
3.1.2. Définition
Ce travail repose sur les recommandations de la FFCD, du GERCOR, de la SNFGE, d’Unicancer, de la SFED et de l’INCa, et sur leur actualisation par une recherche bibliographique.
Celle-ci a reposé sur l’extraction à partir de la base de données Medline, interrogée depuis la dernière actualisation, des essais randomisés, méta-analyses, conférences de consensus et recommandations de pratique clinique avec les mots-clés « colon cancer ». Les essais cliniques accessibles en France ont été cherchés par interrogation de la base de données de l’INCa et des sites internet des sociétés nationales d’hépato-gastro-entérologie et de cancérologie.
La gradation des recommandations correspond à la présentation retenue pour le TNCD selon 4 niveaux (A, B, C, accord ou avis d’experts). Cela est résumé dans le tableau 1.
3.1.3. Méthodologie
Ce travail repose sur les recommandations de la FFCD, du GERCOR, de la SNFGE, d’Unicancer, de la SFED et de l’INCa, et sur leur actualisation par une recherche bibliographique.
Celle-ci a reposé sur l’extraction à partir de la base de données Medline, interrogée depuis la dernière actualisation, des essais randomisés, méta-analyses, conférences de consensus et recommandations de pratique clinique avec les mots-clés « colon cancer ». Les essais cliniques accessibles en France ont été cherchés par interrogation de la base de données de l’INCa et des sites internet des sociétés nationales d’hépato-gastro-entérologie et de cancérologie.
La gradation des recommandations correspond à la présentation retenue pour le TNCD selon 4 niveaux (A, B, C, accord ou avis d’experts). Cela est résumé dans le tableau 1.
Tableau 1
Système de gradation des recommandations utilisé dans ce chapitre
| GRADE | NIVEAU DE PREUVE CORRESPONDANT |
|---|---|
| A | Recommandation forte basée par exemple sur un/des essai(s) comparatif(s) randomisé(s) de forte puissance, une/des méta-analyse d’essai(s) comparatif(s) randomisé(s), ou une analyse de décision fondée sur des études bien menées. |
| B | Recommandation basée sur une présomption scientifique à partir d’essais comparatifs randomisés de faible puissance, d’études comparatives non randomisées bien menées ou d’études de cohortes. |
| C | Recommandation basée sur un faible niveau de preuve à partir d’études cas-témoins, d’études comparatives comportant des biais importants, d’études rétrospectives, de séries de cas, d’études épidémiologiques descriptives (transversale, longitudinale). |
| Accord ou Avis d’experts | Recommandation basée sur un accord d’experts ou un avis d’experts en l’absence de données suffisantes de la littérature |
3.1.4. Classification
La classification à utiliser est celle proposée par l’AJCC et l’UICC (www.uicc.org/tnm- https://cancerstaging.org/Pages/default.aspx) (tableaux 2 et 3). Elle est régulièrement mise à jour et la dernière édition (TNM 8ème édition) est applicable depuis 2017 [Amin et al. 2017].
Il est recommandé que les pathologistes précisent la classification et son année d'édition qu’ils utilisent dans leur compte-rendu (recommandation Assurance Qualité en Anatomie Pathologique).
L’examen d’au moins 12 ganglions régionaux est recommandé par l’UICC et l’AJCC pour établir le statut N de la classification TNM [Amin et al. 2017]. Quel que soit le stade, en particulier pour les stades II et III, le pronostic est d’autant meilleur que le nombre de ganglions prélevés et analysés est élevé [Le Voyer et al. 2003]. Le choix de 12 ganglions résulte d’un consensus au niveau international.
Certains travaux suggèrent que le nombre optimal de ganglions à examiner dépend du statut T de la tumeur. Pour les stades I, un nombre de ganglions analysés < à 12 pourrait être suffisant et, inversement, pour les tumeurs T4 un nombre de ganglions > à 12 est plus adapté [Gönen et al. 2009; Maggard et al. 2009; Wu et al. 2017].
Tableau 2
Classification TNM (8ème édition, 2017) [Amin et al. 2017]
| Tis | Carcinome in situ, tumeur intra-muqueuse envahissant la lamina propria (chorion) sans extension à travers la musculaire muqueuse à la sous-muqueuse |
| T1 | Tumeur envahissant la sous-muqueuse |
| T2 | Tumeur envahissant la musculeuse |
| T3 | Tumeur envahissant la sous-séreuse ou les tissus péri-coliques et péri-rectaux non péritonisés |
| T4 | Tumeur envahissant directement les autres organes ou structures et/ou perforant le péritoine viscéral T4a : tumeur perforant le péritoine viscéral * T4b : tumeur envahissant directement des autres organes ou structures de voisinage ** |
| Nx | Renseignements insuffisants pour classer les adénopathies régionales |
| N0 | Pas de métastase ganglionnaire régionale |
| N1 | Métastase dans 1 à 3 ganglions lymphatiques régionaux *** N1a : métastase dans 1 ganglion lymphatique régional N1b : métastases dans 2-3 ganglions lymphatiques régionaux N1c : nodule(s) (ou) dépôt(s) tumoral(aux) « satellites » dans la sous-séreuse, ou dans les tissus péri-coliques ou péri-rectaux non péritonisés, sans ganglion métastatique régional **** |
| N2 | Métastases ≥ 4 ganglions lymphatiques régionaux N2a : métastases dans 4-6 ganglions lymphatiques régionaux N2b : métastases dans ≥ 7 ganglions lymphatiques régionaux |
| M0 | Pas de métastase(s) à distance |
| M1 | Métastase(s) à distance M1a : métastase(s) localisée(s) à un seul organe (foie, poumon, ovaire, ganglion(s) lymphatique(s) non régionaux) sans métastase péritonéale M1b : métastases atteignant plusieurs organes sans métastase péritonéale M1c : métastase(s) péritonéale(s) avec ou sans métastases d’autres organes |
NB - Micro-métastases et cellules tumorales isolées :
- Les micro-métastases correspondent à des foyers tumoraux dont la taille est comprise entre 0,2 mm et 2 mm et sont classés pN1. L’addition de « (mi) » est optionnelle.
- Les cellules tumorales isolées (CTI) sont des cellules tumorales uniques ou de petits amas mesurant < 0,2 mm, pouvant être détectés par méthodes morphologiques (colorations de routine ou immunohistochimie) ou non morphologiques. Les cas de CTI dans les ganglions lymphatiques ou à distance doivent être classés N0.
- * : T4a. Un stade T4a est défini selon la classification TNM-UICC par une extension de la tumeur à travers le péritoine viscéral avec invasion de la surface. La classification TNM-AJCC spécifie que le stade pT4a peut correspondre : 1) à une perforation où les cellules tumorales sont en continuité avec la séreuse par des remaniements inflammatoires ; 2) à une tumeur atteignant la surface de la séreuse accompagnée de phénomènes réactionnels (hyperplasie mésothéliale, inflammation, érosion ou ulcération) ; 3) à des cellules tumorales libres à la surface de la séreuse avec des phénomènes réactionnels. Toujours selon la classification TNM-AJCC une tumeur située à moins d’1 mm de la séreuse doit être considérée comme pT3 et non pT4, mais des niveaux de coupe supplémentaires sont recommandés pour s’assurer du niveau d’invasion.
- ** : T4b. L’invasion directe du T4b comprend l’invasion des autres organes ou segment du côlon-rectum par la voie de la séreuse, décelée à l’examen microscopique ou comprend, pour les tumeurs survenant dans une localisation rétro- ou sous-péritonéale, l’invasion directe des autres organes ou structures du fait de l’extension au-delà de la musculeuse. Une tumeur adhérente macroscopiquement à d’autres organes ou structures est classée cT4b. Cependant, si aucune tumeur n’est présente microscopiquement au niveau de l’adhésion, la classification histo-pathologique sera pT1 à pT3 selon la profondeur de l’infiltration.
- *** : Les ganglions régionaux du côlon sont :
- Appendice : iléo-coliques
- Cæcum : iléo-coliques, coliques droits
- Côlon ascendant : iléo-coliques, coliques droits, coliques moyens
- Angle droit - hépatique : coliques moyens, coliques droits
- Côlon transverse : coliques droits, coliques moyens, coliques gauches, mésentériques inférieurs
- Angle colique gauche : coliques moyens, coliques gauches, mésentériques inférieurs
- Côlon sigmoïde : nœuds sigmoïdiens, coliques gauches, rectaux supérieurs, recto-sigmoïdiens et mésentériques inférieurs
- **** : Les dépôts ou nodules tumoraux « satellites » correspondent à des nodules macroscopiques ou microscopiques dans le tissu adipeux péri-colique ou péri-rectal, dans le territoire de drainage lymphatique de la tumeur, sans continuité avec la tumeur, sans argument histologique en faveur d’un ganglion lymphatique résiduel ou d'une structure vasculaire ou nerveuse identifiable. Si une paroi veineuse est identifiable par les colorations de routine hemotoxyline et éosine, celle des fibres élastiques ou autres, le nodule sera classé comme une invasion veineuse (V1/V2) ou lymphatique (L1). De même, si des structures nerveuses sont identifiables, le nodule sera classé comme une invasion péri-nerveuse (Pn1). La présence d’un (ou de plusieurs) nodule(s) ne modifie pas la catégorie T mais change le statut N en pN1c si tous les ganglions lymphatiques régionaux sont indemnes de métastase à l’examen microscopique.
En l’absence de ganglions lymphatiques métastatiques, la présence de nodules tumoraux « satellites » est classée N1c. En présence de ganglions lymphatiques métastatiques, les dépôts tumoraux et leur nombre sont signalés mais ne doivent pas être actuellement additionnés aux ganglions métastatiques. Ces définitions sont celles de la 8ème édition classification TNM. Elles font l’objet d’un débat, certains auteurs considérant que l’impact pronostique péjoratif des dépôts tumoraux n’est actuellement pas assez souligné [Nagtegaal et al. 2017]. Les analyses post hoc des essais de phase III IDEA France et CALGB/SWOG 80702 ont confirmé la valeur histo-pronostique défavorable des dépôts tumoraux et souligné qu'ils devraient être additionnés aux ganglions métastatiques régionaux, ce qui suggère de possibles changements de classification TNM et de stratégies thérapeutiques à l’avenir [Delattre et al. 2020 ; Cohen et al. 2022].
Les nodules tumoraux « satellites » ne sont pas à confondre avec le « tumor budding » [Lugli et al, 2021].
« Tumor budding »
• Définition : présence, au niveau du front d’invasion de la tumeur, de cellules isolées ou groupées en petits amas de moins de 5 cellules tumorales se détachant du reste de la tumeur. • Le « tumor budding » est un facteur pronostique péjoratif dans le cancer colorectal : • Cependant le tumor budding n’est pas validé comme facteur décisionnel orientant la thérapeutique. |
Tableau 3
Classification par stade
Stade 0
Stade I
Stade IIA Stade IIB Stade IIC
Stade IIIA Stade IIIB Stade IIIC
Stade IVA Stade IVB Stade IVC | pTis N0 M0
pT1-2 N0 M0
pT3 N0 M0 pT4a N0 M0 pT4b N0 M0
pT1-T2 N1/N1c M0 et pT1 N2a M0 pT3-T4a N1N1c M0, pT2-T3 N2a M0, pT1-T2 N2b M0 pT4a N2a M0; p T3-T4a N2b M0; pT4b N1-N2 M0
tout T, tout N, M1a tout T, tout N, M1b tout T, tout N, M1c |
Malgré ses évolutions et ses complexités, il est important que la nouvelle classification UICC soit adoptée notamment pour la recherche clinique.
3.2. Explorations pré-thérapeutiques
3.2.1. Diagnostic
REFERENCES
- En dehors d’une complication (perforation, occlusion), une coloscopie de bonne qualité, et si possible totale, avec biopsies de la (des) lésion(s) colique(s) suspecte(s) non accessible(s) à un geste d’exérèse endoscopique doit être réalisée.
Si possible, dans le même temps ou de façon différée après avoir discuté de l’indication chirurgicale, un traitement endoscopique des éventuelles lésions colorectales synchrones accessibles à un traitement endoscopique et non concernées par le traitement chirurgical envisagé devra être proposé. Il n’est pas utile de réséquer en endoscopie les lésions situées a priori dans la zone de résection chirurgicale envisagée. Dans le but de faciliter le repérage de la ou des lésions (en particulier quand elles sont de petite taille) dont l’exérèse est indiquée chirurgicalement, leur tatouage en endoscopie est recommandé. Si la prise en charge endoscopique des éventuelles lésions synchrones n’est pas réalisée en pré-opératoire, il conviendra de l’envisager en post-opératoire.
- La recherche d’extinction des protéines MLH1, MSH2, MSH6 et PMS2 en immunohistochimie (dénommé dMMR pour deficient MisMatch Repair) et/ou la recherche d’une instabilité des microsatellites (dénommé phénotype moléculaire MSI pour MicroSatellite Instability) en biologie moléculaire à partir du tissu de la pièce opératoire ou des biopsies doit être proposée à tous les patients.
(Recommandations INCa : évaluation du statut MMR tumoral, décembre 2021 et indications des tests moléculaires, juin 2022 : cf. TNCD chapitre 20 Autres thématiques sous-chapitre 20.5 et 20.6) - En cas de suspicion de cancer avancé (localement avancé non résécable et/ou métastatique), une demande de détermination des statuts mutationnels des gènes KRAS, NRAS et BRAF doit également être effectuée à partir de biopsies de la lésion réalisées en endoscopie. Dans cette situation, et même si l’âge n’est pas de moins de 70 ans et qu’il n’y a pas de suspicion de syndrome de Lynch, la détermination du statut MSI/dMMR doit être proposée pour discuter d’un traitement par immunothérapie (anti-PD1 - penbrolizumab) [André et al. 2020].
Recommandations INCa : indications des tests moléculaires, juin 2022 : cf. TNCD chapitre 20 Autres thématiques sous-chapitre 20.6)
- Devant la nécessité croissante de tests de biologie moléculaire utiles à la prise en charge du cancer du côlon, un nombre suffisant de biopsies endoscopiques doit être réalisé (au minimum 10 à 15 biopsies).
3.2.2. Bilan d'extension
Le délai entre la réalisation du bilan d’extension et la décision thérapeutique doit être le plus court possible. Le bilan doit être adapté au terrain et aux co-morbidités éventuelles (intérêt d’une évaluation onco-gériatrique chez les plus de 75 ans au moyen du score G8 - Un score ≤ à 14 révèle une fragilité gériatrique devant faire discuter une consultation d’onco-gériatrie) [Soubeyran et al. 2014]. Le Tep-scan n’a pas de place dans le bilan d’extension d’un cancer colique sauf en cas de doute sur une lésion métastatique sur le scanner.
REFERENCES
- Examen clinique.
- Scanner thoraco-abdomino-pelvien avec injection de produit de contraste (en cas d’impossibilité de scanner avec injection : IRM hépatique injectée au gadolinium + scanner thoracique sans injection). Compte tenu des stratégies dans la prise en charge des cancers avancés (traitements néo-adjuvants), il est nécessaire de réaliser un staging pré-opératoire précis [Balthazar et al. 1988].
- Pour une lésion de la charnière recto-sigmoïdienne, en cas de doute avec une lésion du haut rectum, une IRM rectale avec remplissage du rectum et des images de profil doit être réalisée pour préciser la hauteur de la lésion, et son statut sus- ou sous-péritonéal et pour la recherche de ganglion(s) dans le méso-rectum.
- Coloscopie (si incomplète en pré-opératoire, il faut la prévoir dans les 6 mois post-opératoires) après une éventuelle chimiothérapie adjuvante mais avant un éventuel rétablissement de continuité.
OPTIONS
- Colo-scanner avec distension au CO2 en cas de coloscopie incomplète ou en cas de problème de repérage de la lésion ou tumeur infranchissable.
- Dosage de l'ACE (avis d'experts, non recommandé par la conférence de consensus de 1998). [Conférence de consensus. Prévention, dépistage et prise en charge des cancers du côlon. 1998]. Il peut avoir un intérêt pronostique, et faire suspecter une extension métastatique (taux très élevé). En cas d’augmentation pré-opératoire, sa normalisation sera à vérifier en post-opératoire.
- Endoscopie œso-gastroduodénale en cas de cancer du côlon droit/angle droit en contact avec le duodénum.
3.3. Dépistage des formes familiales (cf. futur TNCD Chapitre 23 "Oncogénétique")
Préciser par l’interrogatoire les antécédents personnels et familiaux de cancers (colorectaux et extra-colorectaux) et d’adénomes colorectaux. Porter une attention particulière aux cancers du spectre du syndrome de Lynch (endomètre, ovaire, grêle, uretère ou cavités excrétrices rénales, estomac, pancréas, voies biliaires, glioblastome).
3.3.1. Syndrome de Lynch (HNPCC)
Les critères d’Amsterdam II (au moins 3 sujets atteints de cancers du spectre du syndrome de Lynch (côlon, rectum, endomètre, ovaire, grêle, uretère ou cavités excrétrices rénales, estomac, pancréas, voies biliaires, tumeurs sébacées, glioblastome)) dont 1 uni aux 2 autres au 1er degré ; au moins 2 générations successives concernées ; au moins 1 cancer diagnostiqué avant l'âge de 50 ans ; tumeurs vérifiées par examen anatomopathologique) correspondant à la définition clinique princeps du syndrome de Lynch sont trop peu sensibles pour l’identification de la majorité des patients atteints d’un syndrome de Lynch. Par conséquent, des critères moins restrictifs devant faire entreprendre une enquête à la recherche d’un syndrome de Lynch ont été proposés, en particulier par la conférence d’expertise collective française et, plus récemment, par un groupe d’experts européens [Olschwang et al. 2004 ; Vasen et al. 2013]. Il s’agit de critères cliniques de Bethesda élargis et/ou d’un critère moléculaire tumoral (statut MSI et/ou dMMR) nécessitant la prescription d’une consultation d’oncogénétique.
La recherche du phénotype d’instabilité microsatellitaire présent dans les cellules tumorales à l’aide des techniques de biologie moléculaire permet notamment une reconnaissance de formes potentiellement prédisposées. Au moins 2 des 5 marqueurs microsatellites testés devront être positifs pour retenir le phénotype MSI [Xicola et al. 2007; Goel et al. 2010]. En complément, l’immunohistochimie à la recherche d’une extinction d'une ou plusieurs des protéines de la réparation (MMR) MSH2, MLH1, MSH6 et PMS2 orientera la recherche de l’altération génétique causale.
- En cas d'extinction de MLH1 (isolée ou conjointe à celle de PMS2), la recherche de la mutation V600E du gène BRAF et/ou la recherche d’une hyper-méthylation du promoteur du gène MLH1 est recommandée [Vasen et al. 2013].
- En cas de mutation de BRAF V600E ou en cas d’hyperméthylation du promoteur de MLH1, il n'est pas nécessaire d’adresser le patient en consultation d’oncogénétique sauf histoire familiale évocatrice de syndrome de Lynch (de rares hyperméthylations constitutionnelles de MLH1 existent [Pinto D, et al. 2018]).
- En l'absence de la mutation BRAF V600E et/ou d'hyperméthylation du promoteur de MLH1 ou d'emblée en cas d'extinction de MSH2 ou MSH6 ou de perte isolée de PMS2, un séquençage des gènes MMR peut être proposé. Une altération constitutionnelle d’un gène MMR sera recherchée par une prise de sang proposée à l’issue d’une consultation d’oncogénétique au cours de laquelle un diagnostic génétique sera proposé.
A noter deux formes variantes du syndrome de Lynch :
- le syndrome de Muirr Torre dont le spectre est élargi aux tumeurs cutanées sébacées et aux kérato-acanthomes
- le syndrome de Turcot dont le spectre inclus le cancer du côlon et des tumeurs du système nerveux central (glioblastome, médulloblastome, épendymone)
REFERENCES (figure 1 : Arbre décisionnel - Oncogénétique et cancer du côlon)
Indications de recherche d'une instabilité microsatellitaire (MSI ou dMMR) dans le cadre de la recherche d’un syndrome de Lynch (accord d’experts) :
- Tous les patients pris en charge pour un cancer colorectal quel que soit l’âge (la recherche d’extinction des protéines MMR en immunohistochimie et/ou la recherche d’une instabilité des microsatellites en biologie moléculaire à partir du tissu de la pièce opératoire ou des biopsies doit être proposée à tous les patients depuis les recommandations INCa de décembre 2021).
Indication d’une consultation d’oncogénétique (accord d’experts) :
- Patient de moins de 40 ans.
- Présence d'un phénotype MSI ou dMMR - test effectué dans le cadre de la recherche d’un syndrome de Lynch (en cas de perte d’expression de hMLH1 et de PMS2 associée à une hyperméthylation du promoteur du gène hMLH1 et/ou à la mutation BRAF V600E et en l’absence d’antécédent familial de cancer du spectre du syndrome de Lynch, il n’est pas nécessaire d’adresser le patient en consultation d’oncogénétique, sauf contexte clinique très évocateur).
Recommandations INCa : évaluation du statut MMR tumoral, décembre 2021 et indications des tests moléculaires, juin 2022).
(Cf. TNCD chapitre 20 Autres thématiques sous-chapitre 20.5 et 20.6)
3.3.2. Polypose adénomateuse
Une polypose familiale est à suspecter si plus de 10 polypes adénomateux colorectaux synchrones ou métachrones sont mis en évidence (à discuter en fonction de l’âge et de l’histoire familliale). En cas de polypose colorectale, une fibroscopie œso-gastroduodénale est indiquée à la recherche d’une polypose adénomateuse duodénale et glandulo-kystique gastrique dont l’identification est un argument supplémentaire en faveur de l’analyse génétique constitutionnelle.
Sur le plan génétique, les altérations de deux gènes principaux ont été reconnues comme responsables du phénotype : le gène APC, qui est responsable d’une transmission autosomique dominante de la maladie et le gène MUTYH, qui est responsable d’une transmission autosomique récessive de la maladie. Il peut exister dans les deux cas des formes atténuées de polypose de diagnostic plus difficile. Dans les deux cas, des manifestations extra-coliques bénignes et malignes peuvent être responsables d’une morbidité importante (tumeur desmoïde, polypose duodénale adénomateuse). D’autres gènes plus rares et d’identification plus récente sont associés à des formes de polyposes colorectales héréditaires. C’est le cas par exemple de mutations des gènes POLE et POLD1 associées à une polypose colorectale de transmission autosomique dominante [Mur et al, 2020].
REFERENCES (figure 1)
Indication d’une consultation d’oncogénétique en vue d’une analyse génétique des gènes APC, MUTYH, POLE et POLD1, le plus souvent par séquençage haut débit, chez le cas index (accord d’experts) [Monahan et al. 2020] :
- ≥ 15 polypes adénomateux colorectaux synchrones ou métachrones (compter les polypes sur les coloscopies successives) au-delà de 60 ans.
- ≥ 10 polypes adénomateux colorectaux synchrones ou métachrones (compter les polypes sur les coloscopies successives) associé à une histoire familiale de cancer colorectal au delà de 60 ans.
- ≥ 10 polypes adénomateux colorectaux synchrones ou métachrones (compter les polypes sur les coloscopies successives) avant 60 ans.
- ≥ 5 polypes adénomateux colorectaux avancés (> 1 cm, dysplasie de haut grade) synchrones ou métachrones (compter les polypes sur les coloscopies successives) avec au moins un des critères suivants (avant 40 ans ; associés à un cancer colorectal MSS (MSS pour MicroSatellite Stability) avant 60 ans ; adénomes duodénaux ; atteinte cutanée sébacée (adénome ou carcinome sébacé ; hyperplasies sébacées multiples ou de grande taille avant 50 ans).
En cas de polypose floride (> 100 polypes) ou d’atteinte d’individus de génération successive ou de tumeur desmoïde, une mutation du gène APC sera le plus souvent observée.
En cas de phénotype atténué en l’absence d’agrégation trans-générationelle, le gène MUTYH sera le plus souvent impliqué.
NB : Il existe d’autres syndromes de prédisposition au cancer colorectal plus rares qui ne sont pas développé dans ce chapitre et notamment les polyposes harmartomateuses (syndrome de Peutz-Jeghers et polypose juvénile). A noter que le sur-risque de cancer colorectal en cas de syndrome de Cowden (une forme de polypose hamartomateuse) est discuté.
Figure 1
Arbre décisionnel : Oncogénétique et cancer du côlon

3.4. Traitements
3.4.1. Critères d'opérabilité et de résécabilité
- L’extension locale (T) et métastatique (M) conditionnent la résécabilité :
- si M0 : résection première sauf si envahissement empêchant une résection en bloc de type R0 du cancer et des organes et structures envahies ; un traitement pré-opératoire (plutôt du type chimiothérapie) est à proposer pour tenter de rendre résécable cette lésion (niveau de la recommandation : grade C).
- si M1 non résécable : pas d’indication formelle au traitement initial du cancer primitif sauf si tumeur primitive symptomatique et/ou compliquée (hémorragie, syndrome occlusif ou sub-occlusif, perforation, abcès péri-tumoral, distension colique en amont de la tumeur primitive au scanner). Une chimiothérapie première est alors discutée (cf. Chap. TNCD "Côlon métastatique") (niveau de la recommandation : grade C).
- si M1 résécable : résection de la tumeur primitive et des métastases en un ou plusieurs temps en fonction des symptômes et des localisations avec chimiothérapie péri-opératoire de type FOLFOX4 [Prise en charge thérapeutique des métastases hépatiques des cancers colorectaux. Recommandations pour la pratique clinique. 2003 ; Nordlinger et al. 2008] (niveau de la recommandation : grade B) (cf. Chap. TNCD « Côlon métastatique »).
3.4.2. Traitement chirurgical
REFERENCES
- Exérèse du cancer avec une marge distale et proximale d’au minimum 5 cm (sur pièce fraiche), une exérèse en bloc du méso côlon attenant avec repérage du pédicule vasculaire (pour les tumeurs de la charnière recto-sigmoïdienne, il faut enlever 5 cm de méso-rectum sous le pôle inférieur de la tumeur).
- La résection par voie cœlioscopique est recommandée pour les tumeurs T1 à T3 (niveau de la recommandation : grade A) (cela reste discuté pour les T4).
Type de résection en fonction de la localisation (accord d'experts) :
La résection colique pour cancer impose, d'une part, d'assurer une marge intestinale suffisante (5 cm de chaque côté de la tumeur) et, d‘autre part, de préserver une vascularisation satisfaisante des segments coliques anastomosés. De ces impératifs, découle le type de résection en fonction de la localisation.- Côlon droit comprenant le cæcum, le côlon ascendant, l’angle colique droit : colectomie droite avec anastomose iléo-colique.
- Côlon transverse :
- colectomie droite étendue au transverse (accord d'experts) ;
- ou colectomie subtotale étendue jusqu'au côlon gauche non inclus (ou inclus laissant juste le sigmoïde) selon certaines équipes, notamment, si syndrome de Lynch ou même de manière systématique (accord d'experts) ;
- une colectomie transverse avec anastomose colo-colique n’est jamais recommandée car le risque de fistule anastomotique est considéré élevé pour la plupart des équipes.
- Angle colique gauche et côlon descendant :
- colectomie angulaire gauche avec anastomose colo-colique emportant l'artère colique supérieure gauche [Manceau et al. 2022] (accord d'experts) ;
- ou colectomie subtotale pour certaines équipes du fait d'un curage plus étendu et d'un risque probablement plus faible de fistule anastomotique (avis d'experts) mais les suites fonctionnelles sont moins bonnes ;
- l’hémicolectomie gauche « vraie » avec anastomose colorectale emportant l'artère mésentérique inférieure est quasiment abandonnée aujourd'hui.
- Côlon sigmoïde : sigmoïdectomie avec anastomose colorectale emportant l'artère mésentérique inférieure au-dessus ou en dessous de l'artère colique supérieure gauche.
- En cas de syndrome de Lynch ou de polypose adénomateuse familiale avéré ou suspecté, se référer aux recommandations INCa, aux fiches GENMAD et aux dernières recommandations internationales [Syngal et al. 2015; Stoffel et al. 2015; Monahan et al. 2020]
Fiche GENMAD - 2017 : Conseils de prise en charge de la maladie de Lynch
Fiche GENMAD - 2021 : Conseils de prise en charge de la Maladie de la polypose familiale liée au gène APC
Fiche GENMAD - 2009 : Conseils de prise en charge de la polypose familiale liée au gène MYH
Chirurgie prophylactique des cancers avec prédisposition génétique - INCa Août 2009
https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Chirurgie-prophylactique-des-cancers-avec-predisposition-genetique
La polypose associée aux mutations bi-alléliques du gène MUTYH - INCa Avril 2011
https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/La-polypose-associee-aux-mutations-bi-alleliques-du-gene-MUTYH
- En cas de suspicion de tumeur T4, l'exérèse chirurgicale doit être monobloc, enlevant la tumeur et son extension locale. La faisabilité d’une stratégie de traitement néo-adjuvant par chimiothérapie pour les tumeurs localement avancées a été rapportée dans plusieurs études de phase II randomisée avec des résultats intéressants en termes de downstaging [Morton et al. 2023 ; Karoui et al. 2020]. Un traitement néo-adjuvant systémique doit se discuter pour les tumeurs localement avancées jugées inextirpables ou à la limite de la résécabilité (avis d’experts). (cf. chapitre 3.4.5. Traitement néo-adjuvant)
- En cas de cancer du côlon localisé révélé par une occlusion : la prothèse colique est une option [Place des prothèses coliques dans la stratégie thérapeutique du cancer colorectal. 2014 ; van Hooft et al. 2014 ; van Hooft et al. 2020. Recommandations françaises sous l’égide de la commission endoscopie et cancer de la SFED et de la FFCD. 2014].
Le faible niveau de preuve concernant la place de la prothèse colique comme un « pont » vers la chirurgie en situation curative ne permet pas de la recommander en 1ère intention. Le traitement chirurgical de l’occlusion (colostomie de proche amont si la lésion est située à gauche) est à privilégier.
A noter que dans cette indication, les recommandations européennes de l’ESGE actualisées en 2020 accordent une plus grande place de la prothèse colique sous réserve qu’elle soit mise en place dans des centres experts et que l’indication fasse l’objet d’une discussion médico-chirurgicale [van Hooft et al. 2020]. - En cas de découverte per-opératoire d'une tumeur de la charnière recto-sigmoïdienne T4 avec atteinte vésicale ou utérine, il est possible de réaliser une stomie d'amont avant de débuter une chimiothérapie et/ou une radio-chimiothérapie (« néo-adjuvante ») puis une ré-intervention à visée d'exérèse (avis d’experts). Cette option thérapeutique devrait être discutée en RCP en pré-opératoire en cas de suspicion de tumeur T4 au cours du bilan pré-opératoire. A noter que les tumeurs avec un envahissement de l’utérus ou de la vessie ne présentent pas en soi un problème de résécabilité contrairement aux tumeurs qui envahissent le sacrum, les uretères et/ou les vaisseaux iliaques.
- En cas de doute sur l’existence de métastases hépatiques sur les données des examens pré-opératoires incluant une IRM hépatique avec des séquences de diffusion, une échographie per-opératoire éventuellement associée à un prélèvement et/ou à une résection per-opératoire, est recommandée.
- Compte tenu des résultats négatifs mais controversés de l’étude PROPHYLOCHIP – PRODIGE 15 (Essai de phase III multicentrique, randomisé comparant la surveillance standard à la laparotomie exploratrice plus chimio-hyperthermie intrapéritonéale (CHIP), chez les patients atteints d’un cancer colorectal, traités initialement par chirurgie et chimiothérapie adjuvante, et présentant un haut risque de développer une carcinose péritonéale) et de ceux également négatifs de l’étude hollandaise COLPEC, une CHIP n’est pas recommandée en cas risque de carcinose péritonéale (niveau de la recommandation : grade B) [Klaver et al. 2019 ; Goéré et al. 2020].
OPTIONS
- Technique « no-touch » et ligature première des vaisseaux (niveau de la recommandation : grade C).
- En cas de risque élevé de carcinose péritonéale chez un patient jeune (< 65 ans) et sans co-morbidité majeure, la discussion d’une laparotomie exploratrice en vue d’une éventuelle exérèse de carcinose sans CHIP dans un centre expert peut être proposée au cas par cas (niveau de la recommandation : avis d’experts) [Pinto et al. 2017].
3.4.3. Traitement endoscopique
3.4.3.1. Exérèse locale par traitement endoscopique du cancer du côlon
Pour les « polypes » coliques à risque de contenir un cancer superficiel, une exérèse locale endoscopique mono-bloc doit être privilégiée car elle peut être curative tout en préservant l’organe.
1) Sur le plan carcinologique, une résection locale d’adénocarcinome colique peut être considérée curative lorsque la tumeur a été réséquée complètement avec des marges de sécurité latérales et profondes (résection R0) et qu’elle présente les critères suivants :
- Tumeurs à très bas risque ganglionnaire : adénocarcinomes intra-muqueux purs (Tis) car le risque d’évolution métastatique ganglionnaire est inférieur à 1 %.
- Tumeurs à bas risque ganglionnaire : adénocarcinomes à envahissement sous-muqueux superficiel (sm1 = T1a) lorsque l’invasion sous-muqueuse est inférieure à 1000 microns et qu’aucun critère qualitatif de risque d’invasion ganglionnaire n’est présent : pas d’embole vasculaire, lymphatique ou nerveux, pas de budding de haut grade (grade 2 ou 3). Le risque de métastases ganglionnaires est alors inférieur à 3 % (recommandations European Society of Gastrointestinal Endoscopy (ESGE) 2022, Pimentel Nunes et al. 2022) et la résection locale R0 de la lésion est alors curative. Un bilan d’extension par TDM TAP est toutefois recommandé en post-résection par la société européenne d’endoscopie digestive.
2) Une prise en charge chirurgicale « adjuvante » après bilan d’extension doit être proposé en cas de résection endoscopique de cancer T1 selon certaines circonstances :
- Tumeurs à haut risque d’invasion ganglionnaire : en cas de présence d’un cancer T1 avec critères anatomopathologiques péjoratifs à risque d’invasion ganglionnaire :
- infiltration sous muqueuse de plus de 1000 microns (T1b, tumeur sm2 ou sm3)
- présence d’emboles vasculaires, lympathiques ou nerveux
- lésion peu différenciée, adénocarcinome mucosécrétant
- présence de budding de haut grade (grade 2 ou 3) : le budding correspond à une infiltration tumorale sur le front d’invasion sous la forme de cellules cancéreuses isolées ou de petits amas de cellules (bourgeon de < 5 cellules cohèsives au maximum) Il est considéré de haut grade si il existe plus de 5 bourgeons par champ au grossissement x 20 correspondant à une surface de 0,785 mm2. Il est défini en 3 classes selon le nombre amas cellulaires (grade 1: 1 à 4, grade 2: 5 à 9, grade 3: 10 et plus).
Si la résection endoscopique est considérée comme non curative avec un risque ganglionnaire de plus de 3%, une prise en charge chirurgicale adjuvante après bilan d’extension par TDM TAP doit être discutée. L’intérêt de la prise en charge chirurgicale doit être contrebalancé par le risque de celle-ci et la décision doit être individualisée selon le risque opératoire du patient (âge et comorbidités). Le type de critères péjoratifs présents sur la pièce de résection endoscopique doit également être pris en compte. La présence d’emboles est le plus mauvais facteur pronostic péjoratif avec un risque d’invasion ganglionnaire entre 20 et 30 %. A l’inverse, une infiltration sous-muqueuse de plus de 1000 microns sans autres critère péjoratif présente un risque d’invasion ganglionnaire de 5 % et chez des patients à risque chirurgical élevé, le risque chirurgical peut être supérieur au risque de récidive de la maladie carcinologique.
- Tumeur T1 avec marge profonde envahie
En cas de marges latérales envahies ou de résection fragmentée, la tumeur est à considérer en tumeur à risque de récidive locale :
- une surveillance par coloscopie est recommandée en cas tumeur Tis (dysplasie de haut grade ou cancer intra-muqueux) avec une coloscopie à 6 et 18 mois
- une chirurgie est recommandée en cas d’adénocarcinome T1 avec facteurs de risque d’invasion ganglionnaire (>1000 microns ; et/ou emboles vasculaires, lymphatiques ou nerveux ; et/ou adénocarcinome peu différencié ; et/ou budding de haut grade. (recommandation ESGE 2022, Pimentel Nunes et al. 2022)
- en cas d’adénocarcinome T1a (<1000 microns = sm1) sans facteur de risque péjoratif, une prise en charge chirurgicale sera recommandée si une marge d’un fragment est envahie par du cancer. Si les marges latérales des fragments d’une résection fragmentée ne sont pas envahies par du cancer (marges en dysplasie de bas grade ou de haut grade), la décision devra être individualisé au cas par cas en fonction du risque chirurgical (recommandation ESGE 2022, Pimentel Nunes et al. 2022)
Cas particuliers des polypes pédiculés :
L’évaluation semi-quantitative de la hauteur d’infiltration selon les niveaux de Haggitt s’applique aux polypes pédiculés si un pédicule et un collet sont bien visibles en histologie.
- Le risque de métastase ganglionnaire est quasi nul pour les niveaux d’infiltration 1 et 2 (limitée à la tête du polype ou étendue jusqu’au collet sans le dépasser),
- et il est significatif pour les niveaux d’infiltration 3 et 4 (étendue sous le collet dans le pédicule ou le pied), évalué respectivement à environ 15% et 27% et doit donc entraîner une prise en charge chirurgicale secondaire.
- Pour le niveau d’infiltration 3, une hauteur d’infiltration du pédicule < 3000 μm mesurée à partir du collet est néanmoins associée à un faible risque ganglionnaire.
L’évaluation qualitative est identique aux polypes non pédiculés avec les facteurs péjoratifs ci-dessous :
- présence d’emboles vasculaires, lympathiques ou nerveux
- lésion peu différenciée, adénocarcinome mucosécrétant
- présence de budding de haut grade (grade 2 ou 3)
3.4.3.2 Choix de la technique de résection endoscopique en fonction de la caractérisation endoscopique
La difficulté réside dans le fait de prédire la présence ou non de cancer dans la pièce et son degré d’invasion avant de débuter la résection pour adapter la qualité d’exérèse au risque carcinologique, principalement d’envahissement ganglionnaire. La présence potentielle de cancer dans la lésion doit faire choisir une technique permettant d’obtenir une résection en monobloc avec des marges de sécurité (résection dite R0).
La sélection des lésions superficielles susceptibles de bénéficier d’une exérèse endoscopique est basée :
- sur l’analyse de l’aspect de la morphologie de la lésion (polype, laterally spreading tumors (LST), classification de Paris) ;
- ainsi que de l’architecture glandulaire et vasculaire de la lésion en utilisant des endoscopes haute définition utilisant des outils de chromoendoscopie virtuelle (figures 2 et 3).
Cette sélection doit se faire par des gastroentérologues ayant l’habitude de ces classifications.
En cas de doute, il est recommandé d’adresser des photos ou vidéos de la lésion en lumière blanche et en chromoendoscopie, de loin puis de près à une équipe experte dans le domaine des tumeurs superficielles pour éviter des résections endoscopiques incomplètes et des chirurgies inutiles.
Figure 2
Classification des LST (laterally spreading tumors)
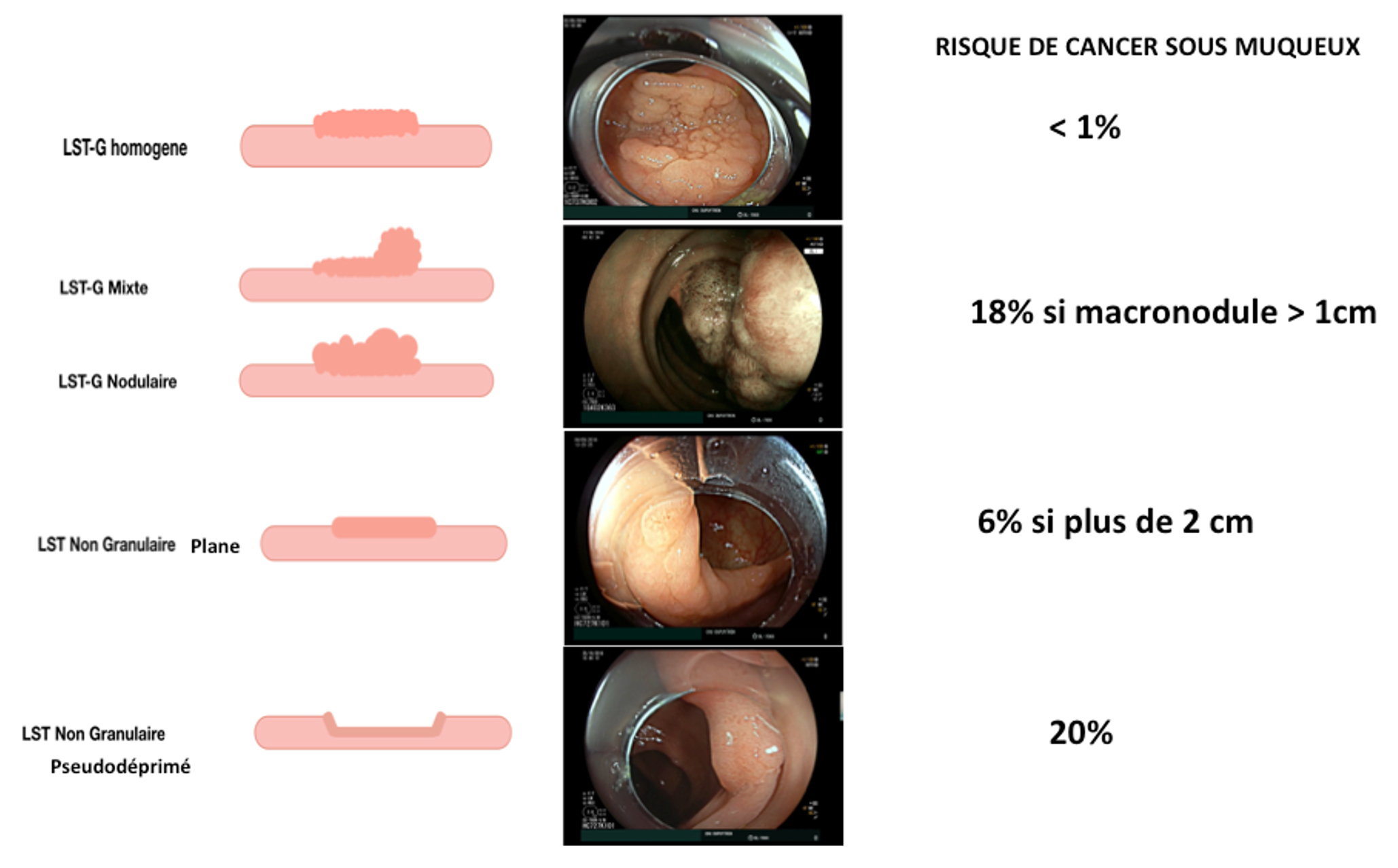
Figure 3
Classification de Paris 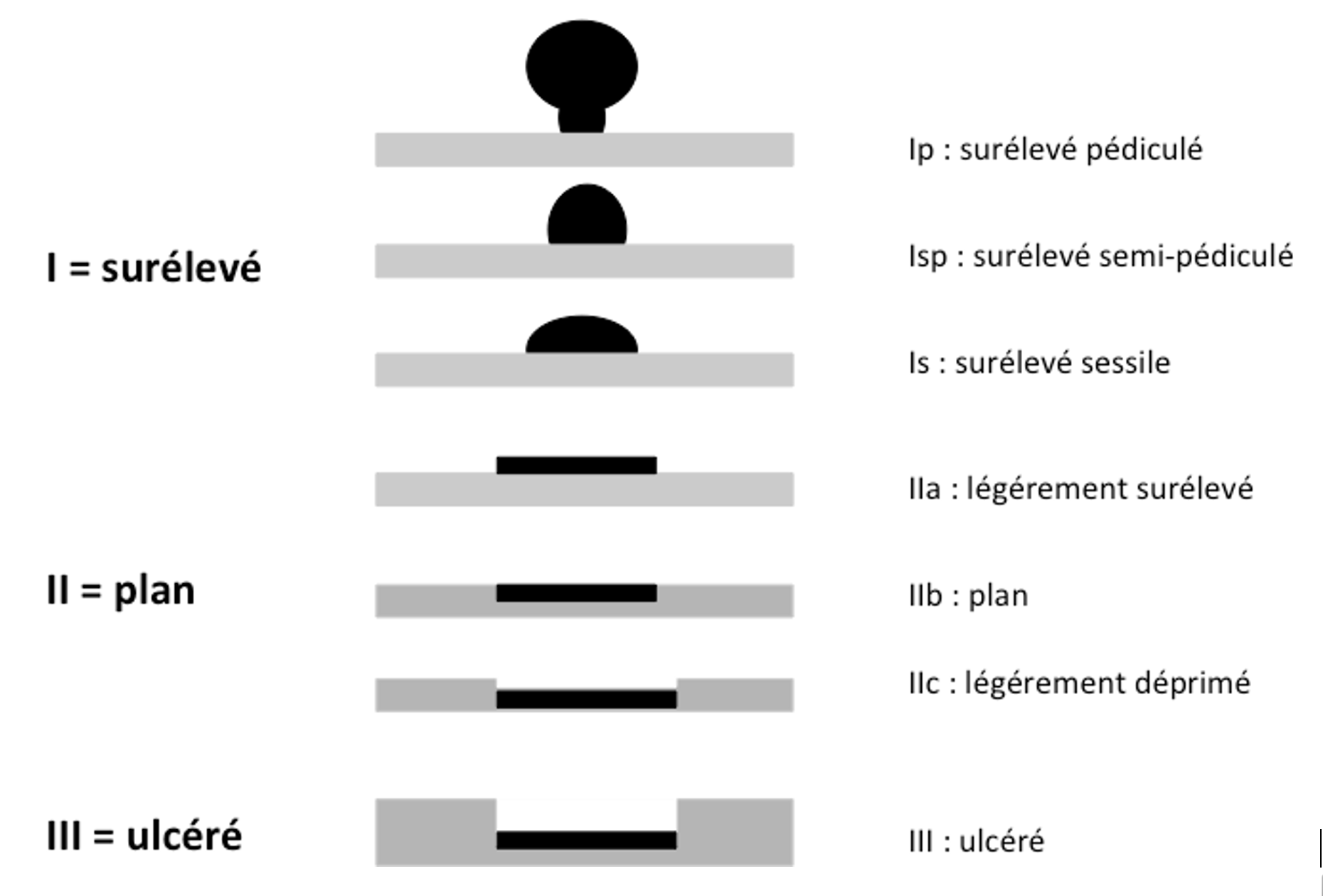
L’étape de caractérisation endoscopique se réalise en 2 temps.
- La première étape est l’analyse du risque statistique de cancer T1 dans une lésion d’allure superficielle. Celui-ci est évalué selon l’aspect morphologique en lumière blanche sur un colon bien insufflé. Il est estimé à 18% en cas de LST granulaire avec un macronodule de plus de 1 cm, de 20% en cas de LST non granulaire pseudodéprimé, de 6% en cas de LST non granulaire plane et de moins de 1% en cas de LST granulaire homogène (Brule et al. 2022). La présence d’une ulcération au sein d’une de ces lésions augmente ce risque de cancer T1 à 30%.
- Une fois ce risque statistique évalué selon l’aspect morphologique, une évaluation de l’architecture glandulaire et vasculaire va être réalisée en chromoendoscopie virtuelle (classification de JNET, Iwatate et al. 2018) (figure 4).
Figure 4
Classification de JNET (Japan NBI expert team)
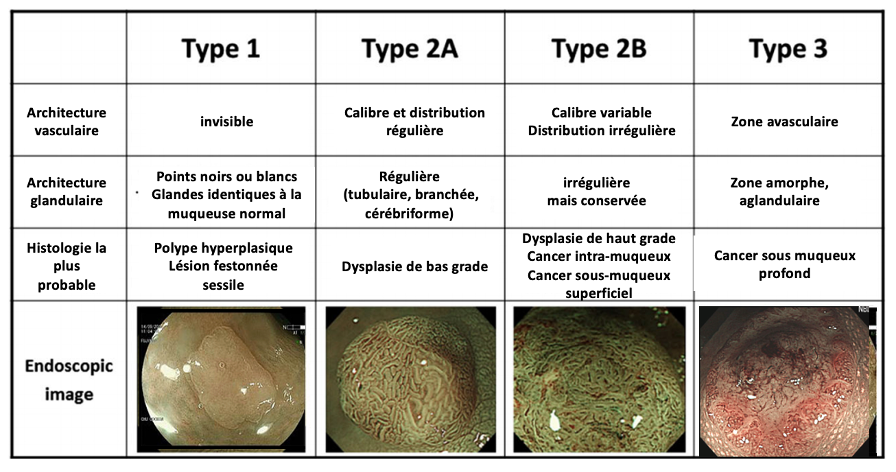
- En cas de lésion non granulaire ou granulaire homogène, si l’aspect glandulaire ou vasculaire est parfaitement régulier, il s’agit le plus souvent d’une lésion bénigne (Brule et al. UEG journal 2022).
- En cas de lésion macronodulaire, du cancer T1 peut être présent en profondeur dans le macronodule avec cependant une normalité vasculaire ou glandulaire en surface.
- La présence d’irrégularités vasculaires ou glandulaires de surface oriente quel que soit la lésion vers une lésion à risque de cancer superficiel (au moins en dysplasie de haut grade).
La classification française CONECCT (Fabritius et al. 2019) facilite ce temps de diagnostic optique en mixant l’ensemble des classifications sus-citées et en proposant une prise en charge thérapeutique adéquate (Figure 5).
Figure 5
Classification CONECCT (colorectal néoplasique classification to choose the treatment)
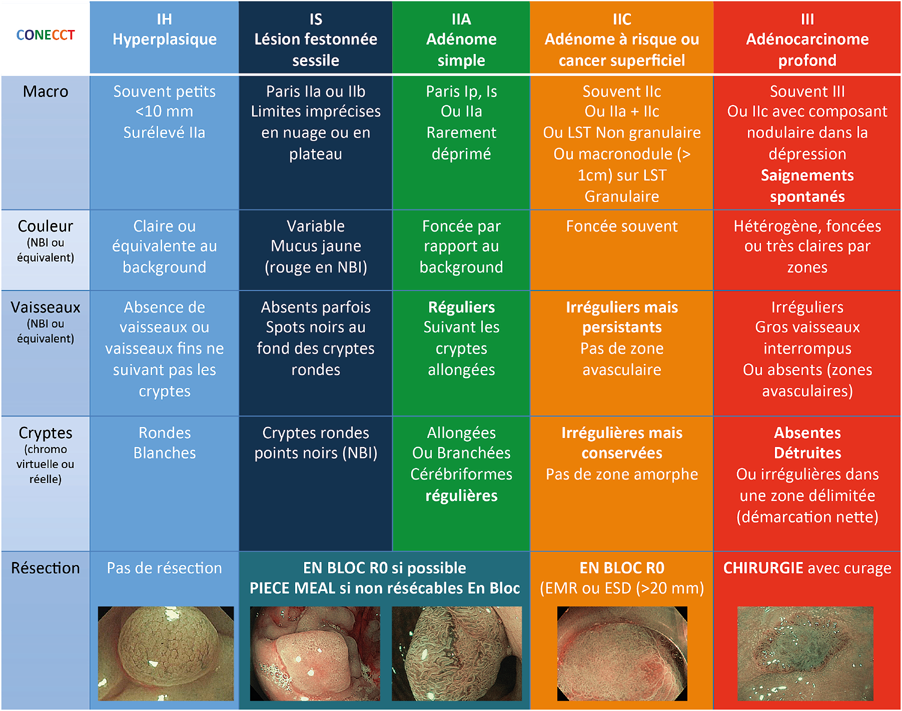
Vu ces données, l’ESGE recommande une résection endoscopique monobloc pour toute lésion présentant un critère de risque de cancer T1(recommandation ESGE 2022, Pimentel Nunes) :
- macronodule de plus d’1cm
- LST non granulaire
- zone déprimée démarquée avec anomalie vasculaire ou glandulaire
- Cette résection se fera par mucosectomie à l’anse en cas de lésion de moins de 20 mm et par dissection sous-muqueuse pour les lésions de plus de 20 mm.
- La mucosectomie sous-marine (Yamashina et al. 2019) ou par ancrage de l’anse (Imai et al. 2021) doivent être privilégiées à la mucosectomie standard pour les lésions de moins de 20 mm à risque en raison d’une supériorité démontrée du taux de résection R0.
- Au contraire, les lésions présentant d’emblée des critères évocateurs d’adénocarcinomes invasifs profonds (>1000 microns dans la sous-muqueuse) comme un aspect ulcéré (ou dépression nette démarquée) ou une absence de relief muqueux ou vasculaire (JNET III, Kudo Vn, Sano IIIb) doivent d’emblée bénéficier d’un bilan d’extension régional et à distance (TDM TAP) avant d’être référées aux chirurgiens pour une exérèse chirurgicale avec curage ganglionnaire.
- Cependant en cas de zone suspecte d’invasion profonde de moins de 5 mm et en cas de comorbidités marquées un avis auprès d’un centre expert en dissection sous-muqueuse peut être pris car des données récentes suggèrent des taux de résection curative par résection endoscopique dans 1/3 cas (Patenotte et al. 2022).
- Il est important de noter qu’une prise en charge endoscopique non curative n’a aucun impact sur le pronostique carcinologique d’une éventuelle prise en charge chirurgicale ou oncologique adjuvante ultérieure.
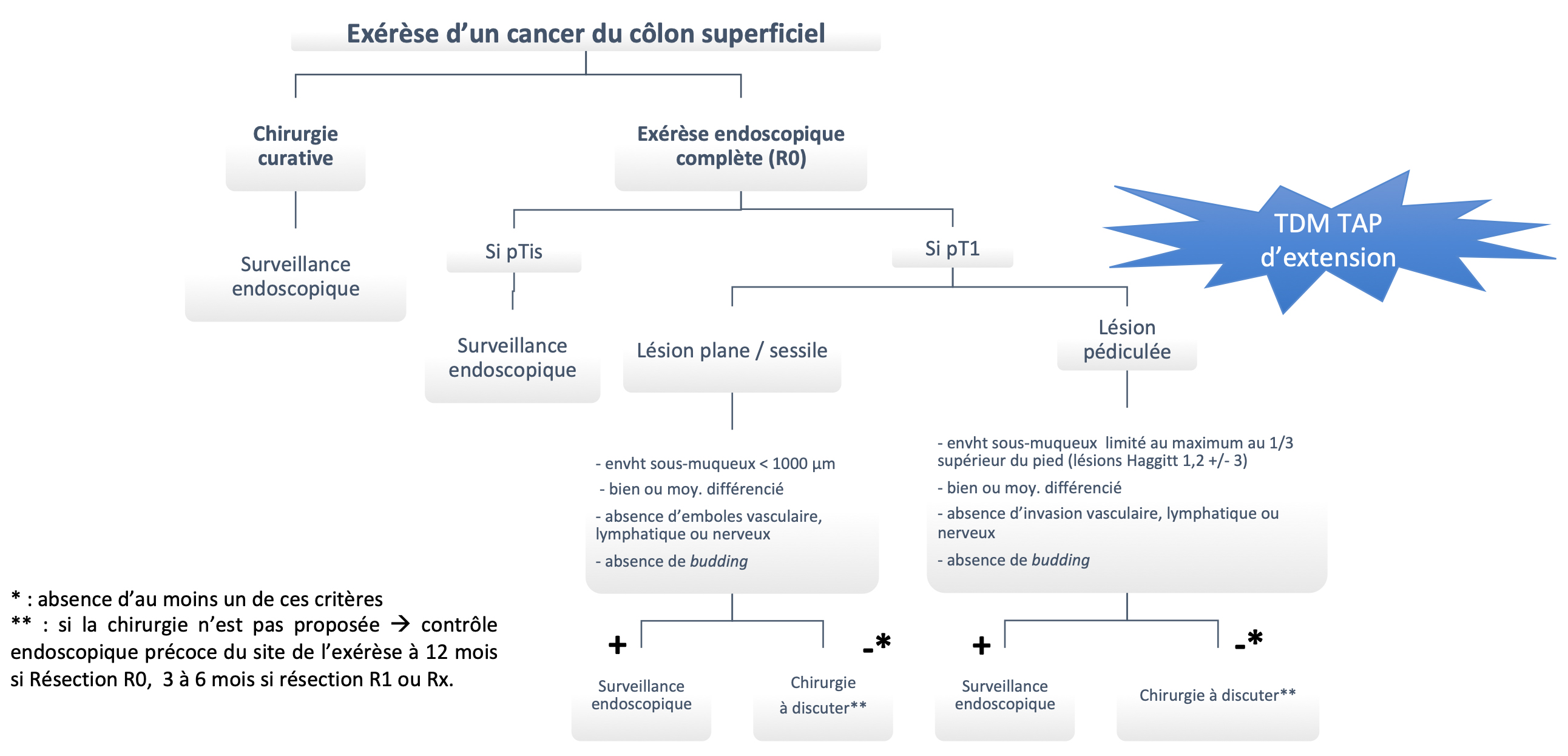
3.4.3.3 Surveillance après résection endoscopique d’une tumeur (Recos ESGE Hassan 2020) (Figure 6)
REFERENCES (accord d’experts)
- Tumeurs à très bas risque ganglionnaires (adénocarcinomes intra-muqueux purs (Tis)) : contrôle endoscopique uniquement, à 3 ans si exèrese R0, à 6 mois si exérèse monobloc R1, à 6 et 18 mois si exérèse fragmentée.
- Tumeurs à bas risque ganglionnaires (adénocarcinomes à envahissement sous-muqueux superficiel (sm1 = T1a) lorsque l’invasion sous-muqueuse est inférieure à 1000 microns et qu’aucun critère qualitatif de risque d’invasion ganglionnaire n’est présent) : TDM TAP d’extension en post-résection puis coloscopie à 1 an et 3 ans.
- Tumeurs à haut risque ganglionnaires (en cas de présence d’un cancer T1 avec critères anatomopathologiques péjoratifs à risque d’invasion ganglionnaire): surveillance oncologique selon les résultats de la chirurgie adjuvante, coloscopie à 1 an et à 3 ans.
Figure 6
Arbre décisionnel : Cancer du côlon superficiel (pTis ou pT1)
3.4.4. Anatomopathologie et biologie moléculaire
Le compte-rendu anatomo-pathologique d’un cancer du côlon opéré doit être établi de façon standardisée selon le modèle proposé par la Société Française de Pathologie et l’INCa. Il doit comporter les items indispensables pour la prise en charge du patient (type histologique, grade histo-pronostique, extension tumorale permettant de déterminer le pT/pN, ainsi que d‘autres facteurs pronostiques et/ou prédictifs) [INCA ACTUALISATION 2011 DES INDICATIONS ET RECOMMANDATIONS AUX TUMOROTHÈQUES - Conservation et utilisation des échantillons tumoraux en cancérologie https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Conservation-et-utilisation-des-echantillons-tumoraux-en-cancerologie ; Amin et al. 2017].
Cf. TNCD Chapitre 20 Autres thématiques sous-chapitre 20.5 et 20.6
(Recommandations INCa : évaluation du statut MMR tumoral, décembre 2021 et indications des tests moléculaires, juin 2022).
L'examen d’un minimum de 12 ganglions est recommandé.
Pour les tumeurs localement avancées envahissant les organes de voisinage, le caractère mono-bloc ou non de la résection doit être précisé sur les comptes-rendus opératoire et anatomopathologique du fait de sa valeur pronostique.
La classification TNM-UICC est recommandée. Le nombre de ganglions examinés et le nombre de ganglions envahis ont une valeur pronostique. Une analyse fine des facteurs pronostiques TNM permet d’observer que les tumeurs T4N0 ont un pronostic plus mauvais que les tumeurs T1N1 ou T2N1, dont le pronostic est similaire aux tumeurs T3N0 [Le Voyer, et al. 2003].
La dernière version de la classification TNM indique comme paramètres pronostiques essentiels les catégories T, N et M et additionnels, l’invasion vasculaire/lymphatique, l’invasion péri-nerveuse, le grade, le bourgeonnement tumoral (ou tumor budding), l’existence d’une perforation, les statuts RAS, MSI et BRAF.
Le test recommandé dans le cadre de la prise en charge des cancers du côlon est la recherche d’un statut dMMR en raison de sa valeur pronostique, théranostique et de son intérêt pour la recherche d’un syndrome de Lynch (environ 20 % des cancers colorectaux de stade II et 12 % des stades III sont dMMR/MSI) [Boland et al. 2010]. Il s’agit d’une caractéristique moléculaire dont la fréquence augmente avec l’âge des patients (> 20 % après 75 ans et > 30 % après 85 ans) [Aparicio et al. 2013].
Parmi ces cancers de phénotype dMMR/MSI, il faut distinguer les cancers sporadiques (environ 80 %), qui sont décrits majoritairement chez des sujets âgés, de ceux observés chez les patients atteints d’un syndrome de Lynch (20 %). Ce phénotype moléculaire tumoral doit être déterminé au moyen d’une technique d’immunohistochimie (anticorps anti-MLH1, MSH2, MSH6 et PMS2) et/ou de biologie moléculaire après extraction d’ADN à partir de matériel tumoral fixé et inclus en paraffine. L’absence d’expression de l’une des protéines de réparation MMR (MLH1, MSH2, MSH6 et PMS2) au niveau tumoral est en faveur d’un phénotype dMMR [Ward et al. 2005]. En cas de tumeur MSI en biologie moléculaire et dans le cadre d’une suspicion de syndrome de Lynch, une analyse immunohistochimique au sein de la tumeur de l’expression des protéines de réparation MMR (MLH1, MSH2, MSH6 et PMS2) permet d’orienter le diagnostic génétique vers le gène altéré. L’extinction de MSH2, MSH6 et PMS2 oriente le plus souvent vers un syndrome de Lynch alors que l’extinction de MLH1 peut se rencontrer dans un cadre héréditaire ou sporadique. Dans ce cadre, en cas de tumeur BRAF mutée ou en cas d’hyperméthylation du promoteur de MLH1, ces altérations moléculaires tumorales sont associées aux tumeurs dMMR/MSI sporadiques.
La mise en place par l’INCa au niveau de l’ensemble du territoire de plateformes de biologie moléculaire des cancers permet un accès en routine au au test MSI en biologie moléculaire.
En cas de récidive de la maladie pour laquelle un traitement par anti-EGFR sera éventuellement discuté, la conservation de l’ADN tumoral au sein des plateformes permettra la détermination du statut RAS dans un délai court. Les statuts BRAF et MMR tumotal seront aussi utiles en cas de rechute car ils apportent des informations pronostiques et permettent d’orienter le patient vers une stratégie thérapeutique avec possibilité de ciblage thérapeutique, ou encore de sélectionner le patient pour des essais dédiés à ces formes rares [Kopetz et al. 2019 ; Kopetz et al. 2020 ; André et al. 2020].
Compte-tenu de l’ensemble de ces données et des résultats récents concernant l’impact positif de l’immunothérapie en première ligne métastatique des cancers colorectaux, la détermination systématique du statut tumoral MMR dans tous les cancers colorectaux est recommandée.
Les études de biologie moléculaire sont à encourager. Afin de les rendre possibles, un prélèvement pour congélation à visée sanitaire est souhaitable. Cependant, l'utilisation du formol comme fixateur et des blocs en paraffine qui permet la réalisation de ces tests dans la très grande majorité des cas est à privilégier [INCA ACTUALISATION 2011 DES INDICATIONS ET RECOMMANDATIONS AUX TUMOROTHÈQUES - Conservation et utilisation des échantillons tumoraux en cancérologie https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Conservation-et-utilisation-des-echantillons-tumoraux-en-cancerologie].
3.4.5. Traitement néo-adjuvant
3.4.5.1. Chimiothérapie néo-adjuvante dans les cancers coliques localisés résécables pMMR/MSS
Différents essais cliniques publiés ou en cours évaluent l’intérêt d’un traitement néo-adjuvant pour les patients avec un cancer colique localisé.
L’essai de phase III FOxTROT (NCT00647530) a comparé une stratégie de chimiothérapie péri-opératoire (FOLFOX, 3 cycles pré-opératoires, puis 9 cycles post-opératoires ; oxaliplatine 85 mg/m², L-acide folinique 175 mg, 5-fluorouracile 400 mg/m², 5-fluorouracile 2400 mg/m² sur 46 heures) au schéma classique par FOLFOX post-opératoire pour 12 cycles, selon une randomisation 2:1 chez 1052 patients avec un cancer colique localisé cT3-4, cN0-2, cM0. Les patients avec une tumeur KRAS sauvage étaient également randomisés en 1:1 pour recevoir ou non du panitumumab 6 mg/kg pour les 3 premiers cycles de traitement. Dans la phase pilote de l’étude (N=150), évaluant la faisabilité et la sécurité d’une stratégie néo-adjuvante, 85 des 99 patients (85,9%) du groupe expérimental ont reçu les 3 cycles de traitement néo-adjuvant, et tous ont pu être opérés sans augmentation de la morbidité post-opératoire. La capacité de prédiction du stade pTN par le scanner initial était évaluée dans le groupe contrôle : 50% des tumeurs considérées cT4 (n=8/16) étaient effectivement pT4 ; 44% des tumeurs considérée cN+ étaient en fait pN-. Ces données sont en accord avec les données de la littérature, montrant que le scanner est peu performant pour poser le diagnostic de cancer colique de stade III (valeur prédictive positive de 39 à 70%, valeur prédictive négative de 68 à 91% [Erik Rollvén et al. 2017].
Les résultats matures de l’essai FOxTROT ont été publiés récemment [Morton et al. 2023]. L’étude atteint son objectif principal, avec une réduction significative du taux d’échec (maladie récurrente ou persistante) à 2 ans (16,9% dans le bras expérimental versus 21,5% dans le bras standard, hazard ratio=0,72, p=0,037). 90% des patients du groupe expérimental ont reçu les 3 cycles de FOLFOX néo-adjuvant. Dans le bras expérimental 99,6% ont effectivement été opérés, contre 99,2% dans le bras standard démontrant la faisabilité d’un traitement néo-adjuvant. Le taux de résection incomplète R1/R2 était de 6%, contre 11% dans le bras standard. Le taux de réponse pathologique était de 62% dans le bras expérimental, dont 4% de réponse complète pathologique. La réponse histologique variait selon le statut MMR, avec aucun signe de régression pour 70,4% des tumeurs MMR-déficientes (N=115) contre 27,3% des cas MMR-proficients (N=553).
En l’état actuel des connaissances, le traitement néo-adjuvant de cancers coliques localisés résécables d’emblée n’est pas recommandé en dehors d’essais cliniques.
3.4.5.2. Immunothérapie néo-adjuvante dans les cancers coliques localisés résécables dMMR/MSI
Les données s’accumulent concernant l’efficacité des inhibiteurs de point de contrôle immunitaire (ICIs) en néo-adjuvant pour les patients avec un cancer colorectal localisé dMMR/MSI, avec dans chaque étude approximativement deux tiers des patients en réponse complète pathologique (pCR) (Figure 7). Dans l’étude NICHE-1, parmi 21 patients avec un cancer colique dMMR/MSI traités avec une dose d’ipilimumab (anti-CTLA-4) et deux injections de nivolumab (anti-PD1) 4 semaines avant la chirurgie, le taux de réponse pathologique majeure (réponse histologique majeure ; ≤10% de tumeur résiduelle viable) était de 95% et le taux de pCR était de 60% [Chalabi et al. 2020]. Ces données sont confirmées par les résultats de NICHE-2 (intégrant les données de l’étude NICHE-1), présentés au congrès de l’ESMO 2022 (N=112 ; 95% de réponse histologique majeure ; 67% de pCR), sans rechute à distance (suivi médian de 13 mois) et avec des données de sécurité satisfaisantes (95% des chirurgies réalisées dans les délais impartis, uniquement 4% d’événements indésirables immuno-médiés de grade 3-4). Les capacités de prédiction du scanner baseline (corrélation entre le stade cTN et le stade pTN) n’ont pas été rapportées ; l’existence de signes de régression tumorale au niveau ganglionnaire sur les pièces opératoires dans NICHE-2 (26% de tumeurs classées initialement cN1 et 62% cN2) pourraient partiellement répondre à cette question spécifiquement pour les tumeurs dMMR/MSI, mais n’ont pas encore été communiquées.
Il est à noter que le taux de pCR semble équivalent dans les différentes études, que les patients soient traités par anti-PD1 seul ou combiné à un anti-CTLA4, et que la durée de traitement soit courte ou prolongée (Figure 7), et est également similaire à celui observé pour les cancers œso-gastriques dMMR/MSI (essais NEONIPIGA).
L’essai clinique IMHOTEP actuellement en cours de recrutement en France qui évalue le pembrolizumab en néoadjuvant pour les tumeurs digestives et endométriales dMMR/MSI résécables (NCT04795661). Un statut dMMR en IHC des protéines concordant avec un statut MSI en biologie moléculaire est indispensable avant toute inclusion dans un essai thérapeutique.
Ces données permettent d’envisager des stratégies de « watch and wait », telles que cela a été évalué dans une étude de phase II pour les cancers du rectum dMMR/MSI [Cercek et al., 2022]. Dans cette étude avec le dostarlimab (anti-PD1) toutes les 3 semaines pendant 6 mois, les patients en réponse clinique complète à la fin du traitement étaient surveillés sans traitement additionnel, ni chimioradiothérapie, ni chirurgie. Parmi les 12 premiers patients inclus, tous étaient en réponse clinique complète, aucun n’avait été opéré et aucun n’avait rechuté après un suivi médian de 12 mois. Il est à noter que les biopsies de certains patients se négativaient secondairement, après des prélèvements positifs à 6 et/ou 12 semaines. Dans le cadre des stratégies « watch and wait », il reste à préciser les modalités de surveillance et de décision de prise en charge non chirurgicale (suivi endoscopique, biopsies systématiques, imagerie etc.). Par ailleurs, il manque actuellement des données à long terme sur le risque de rechute et de seconds cancers après traitement par ICIs pour les patients porteurs d’un syndrome de Lynch, notamment pour savoir comment concilier stratégie de préservation d’organe et chirurgie de prévention du risque de seconds cancers. Ainsi, ce type de stratégie « watch and wait » actuellement un faible niveau de preuve scientifique ne peuvent s’envisager que en cas de chirurgie morbide et dans le cadre d’essai thérapeutique.
En l’état actuel des connaissances, le traitement néo-adjuvant de cancers coliques localisés dMMR/MSI résécables d’emblée n’est pas recommandé, en dehors d’essais cliniques. Il peut néanmoins se justifier pour les tumeurs localement avancées imposant une chirurgie à haut risque de morbi-mortalité.
Figure 7
Résultats des essais d’immunothérapie néo-adjuvante dans les tumeurs colorectales localisées opérables dMMR/MSI
| Etude | Population | Durée de la phase néoadjuvante | Exploration d’une désescalade chirurgicale | Intervention | Nombre de patients inclus | Taux de réponse complète pathologique | Taux de réponse complète clinique |
|---|---|---|---|---|---|---|---|
| NICHE (Chalabi et al., 2020) | Cancercolique dMMR/MSI | 4 semaines | Non | nivolumab + ipilimumab | 21 | 60 % | - |
| NICHE-2 (Chalabi et al., ESMO 2022 ) | Cancercolique dMMR/MSI | 4 semaines | Non | nivolumab + ipilimumab | 112 | 67 % | - |
| PICC (Hu et al., 2022) | Cancercolique dMMR/MSI | 12 semaines | Non | noripalimab + celecoxib toripalimab | 17 17 | 88 % 65 % | - - |
| MD Anderson (Ludford et al., 2021 ESMO ) | Cancers localement avancés dMMR/MSI | 24 semaines | Oui | pembrolizumab | 35 | 71 % | 12/22 (55 %) |
| MSKCC Cercek et al., 2022) | Cancers rectaux dMMR/MSI | 24 semaines | Oui | dostarlimab | 12 | - | 100 % |
3.4.5.3. Recommandations sur les traitements néo-adjuvants
1/ Stade I et II résécable pMMR/MSS
REFERENCE
- Pas de traitement néo-adjuvant.
2/ Stade III résécable pMMR/MSS
REFERENCE
- Pas de traitement néo-adjuvant.
OPTION
- Une chimiothérapie néo-adjuvante par FOLFOX peut être proposée en cas de tumeur cT3 fort (extension extra-murale > 5 mm au scanner) ou cT4. (niveau de la recommandation : grade B)
ESSAI CLINIQUE
- FFCD 2006 - NEORAF : Étude pilote non randomisée multicentrique, en ouvert, évaluant l’association encorafenib et cetuximab en situation néoadjuvante chez des patients atteints d’un cancer du côlon localisé porteur de la mutation BRAF V600E. Coordonnateur : C Gallois (Paris) Clinical Study Protocol (ffcd.fr)
3/ Stade II et III résécable dMMR/MSI
REFERENCE
- Pas de traitement néo-adjuvant ni de stratégie « watch and wait ».
- Les patients doivent être orientés vers les essais thérapeutiques d’immunothérapie néo-adjuvante compte tenu des taux de réponse histologique complète de l’ordre de 70 % (essai PREMICES).
OPTION
- Une immunothérapie néo-adjuvante peut être proposée aux patients avec une tumeur dMMR/MSI non éligible à un essai thérapeutique et avec une chirurgie potentiellement « délabrante » ou à risque opératoire élevé notamment chez les patients âgés et/ou un risque de résection R1/R2 et après avis d’un centre expert dans la prise en charge des tumeurs dMMR/MSI.
ESSAIS CLINIQUE
- FFCD 2006 - NEORAF : Étude pilote non randomisée multicentrique, en ouvert, évaluant l’association encorafenib et cetuximab en situation néoadjuvante chez des patients atteints d’un cancer du côlon localisé porteur de la mutation BRAF V600E. Coordonnateur : C Gallois (Paris)
Clinical Study Protocol (ffcd.fr)
3.4.6. Traitement adjuvant : synthèse de la littérature
3.4.6.1. Stade 0 = pTis N0 M0
- Exérèse endoscopique seule
3.4.6.2. Stade I = T1-T2-N0 = sous-séreuse intacte
- Chirurgie seule
- Exérèse endoscopique seule pour certains pT1 (cf. chapitre 3.4.3. précédent)
3.4.6.3. Stade II = T3-T4-N0 = sous-séreuse atteinte (T3) ou dépassée (T4)
Les cancers coliques de stade II forment un groupe très hétérogène du point de vue anatomopathologique auquel est associé un pronostic très hétérogène avec des taux de survie globale à 5 ans de 87,5 % en cas de stade IIa et de 58,4 % en cas de stade IIc [Gunderson et al. 2010]. Ainsi certains stades II à risque « relatif » élevé de récidive sont de moins bon pronostic de certains stade III à faible risque [Li et al. 2020 ; Sobrero et al. 2020].
Les résultats rapportés sur l’effet de la chimiothérapie adjuvante dans le traitement des cancers coliques de stade II sont également très hétérogènes et peu d’essais spécifiques ont été menés pour tenter de répondre à la question. Il s’agit le plus souvent de résultats issus d’analyses de sous-groupes au sein d’essais qui ont inclus des stades II et III et de méta-analyses. L’analyse au moyen de tests d’interaction des données des essais NSABP C01-4 a montré que la chimiothérapie adjuvante bénéficiait aux patients de stade II inclus avec une diminution relative de mortalité identique à celle des stades III (test d’interaction négatif) [Mamounas et al. 1999].
Les résultats de la méta-analyse plus homogène IMPACT-B2 qui a regroupé cinq essais de conception analogue n’a pas montré de bénéfice en faveur de la chimiothérapie adjuvante pour les stades II [Erlichman et al. 1999]. Les résultats des différentes méta-analyses publiées ne sont donc pas concluants en raison de leurs résultats contradictoires [Mamounas et al. 1999; Erlichman et al. 1999; Meta-analysis Groupe, 2004; Gill et al 2004 ; Figuerado et al. 2004].
Globalement, il existe une tendance en faveur d’un bénéfice en survie sans récidive de la chimiothérapie adjuvante pour les cancers de stade II mais qui concernent a priori seulement un sous-groupe de patients. La démonstration de l’intérêt potentiel d’une chimiothérapie adjuvante pour les cancers de stade II a été rapportée au travers des résultats de l’étude QUASAR [Quasar Collaborative Group, 2007].
Cette étude (n = 3239 patients atteints d’un cancer colique ou rectal) a comparé une chimiothérapie adjuvante par 5-fluorouracile (5-FU) + acide folinique ± lévamisole à un bras sans chimiothérapie adjuvante chez des patients porteurs de cancers colorectaux majoritairement de stade II (91 %). En analyse de sous-groupe, pour les cancers coliques de stade II, le risque relatif de récidive à 2 ans était diminué de 29 % avec un hazard ratio (HR) de 0,71 (IC 95 % : 0,54 - 0,92 ; p = 0,01) avec une tendance non significative à l’amélioration de la survie globale un HR de 0,83 (IC 95 % : 0,65 - 1,07 ; NS).
De plus, dans cette étude les patients de plus de 70 ans ne tiraient aucun bénéfice d’une chimiothérapie adjuvante avec une risque relatif de décès de 1,02 (IC 95 % : 0,70-1,48 ; NS).
La détermination du statut MSI ou dMMR en routine doit être recommandée pour discuter de l’indication d’une chimiothérapie adjuvante pour un patient opéré d’un cancer du côlon de stade II avec des facteurs de mauvais pronostic. Le bon pronostic des patients opérés d’un cancer du côlon de stade II avec un phénotype moléculaire MSI et/ou immunohistochimique dMMR est un argument pour ne pas proposer une chimiothérapie adjuvante. Cet élément ne peut intervenir dans la discussion que si le statut MMR/MSI est disponible dans un délai compatible avec la mise en place d’une chimiothérapie adjuvante (idéalement dans un délai de 4 semaines après la date de la chirurgie).
Les facteurs pronostiques associés au risque de récidive qui ressortaient de façon significative en analyse multivariée étaient le statut pMMR/MSS versus dMMR/MSI (HR : 0,32 pour les cancers MSI ; IC 95 % : 0,15 – 0,69 ; p < 0,001), le stade T4 versus T1-3 (HR : 1,83 pour les T4 ; IC 95 % : 1,23 - 2,75 ; p = 0,005), le nombre de ganglions analysés (HR : 1,47 si moins de 12 ; IC 95 % : 1,01 - 2,14 ; p = 0,04) et un profil génomique basé sur l’analyse de 18 gènes [Kerr et al. 2009].
L'étude MOSAIC qui a inclus des patients de stade II et III a comparé une chimiothérapie adjuvante par FOLFOX4 au LV5FU2 [André et al. 2004 ; André et al. 2009 ; Teixera et al. 2010 ; André et al. 2015]. Dans le sous-groupe de l’ensemble des patients de stade II, il n’y a aucun bénéfice de survie à 10 ans en faveur du FOLFOX4 (78,4 % versus 79,8 % ; HR : 1,00; IC 95 %, 0,74 - 1,35 ; p = 0,98).
Pour le sous-groupe des stades II à haut risque (T4, tumeur perforée, ou nombre de ganglions examinés < 10), le traitement par FOLFOX4 entrainait une amélioration statistiquement non significative de la survie sans maladie, comparé au LV5FU2 (RR : 0,79 ; IC 95 % : 0,55 - 1,13 ; NS) et de la survie globale à 10 ans (RR : 0,89 ; IC 95 % : 0,60 - 1,32 ; NS) [André et al. 2009].
Au sein de la collaboration internationale IDEA (International Duration Evaluation of Adjuvant Chemotherapy) dont l’objectif était d’évaluer la non-infériorité entre 3 mois versus 6 mois de chimiothérapie adjuvante à base d’oxaliplatine (FOLFOX ou CAPOX selon le choix de l’investigateur), les 4 études SCOT, TOSCA, ACHIEVE2 et HORG ont inclus 3 273 patients (23 % de l’ensemble des patients d’IDEA) atteints d'un cancer du côlon de stade II à risque « relatif » élevé de récidive [Iveson et al. 2019 ; Petrelli et al. 2020 ; Yamazaki et al. 2021]. Les cancers de stades II à risque « relatif » élevé de récidive inclus étaient définis par au moins un des critères suivants : T4, peu différencié, nombre de ganglions examinés < à 12 ou 10 selon les pays, occlusion, perforation, emboles vasculaires ou engainements péri-nerveux. Les patients ont été traités majoritairement par CAPOX (62 %). La tolérance neurologique était significativement en faveur d’un traitement de 3 mois. Les résultats de survie sans récidive à 3 ans sont concordants avec ceux obtenus pour les cancers de stade III avec une non-infériorité non confirmée pour un traitement de 3 mois pour l’ensemble de la population quel que soit le traitement (survie sans récidive à 3 ans de 80,3 % chez les patients traités 3 mois versus 83,9 % chez les patients traités 6 mois ; HR : 1,17 ; IC 95 % 1,05 - 1,31 ; p = 0,38) sans que les facteurs histo-pronostiques associés qui étaient très variables d’une étude à l’autre n’influencent ces résultats. Comme pour les stades III le type de chimiothérapie apparaît déterminant car les résultats suggèrent une équivalence entre 3 et 6 mois de traitement par CAPOX (survie sans récidive à 3 ans de 81,7 % chez les patients traités 3 mois versus 82 % chez les patients traités 6 mois) avec un profil de tolérance très en faveur du choix de 3 mois, et inversement une survie sans récidive supérieure avec 6 mois de FOLFOX versus 3 mois (survie sans récidive à 3 ans de 79,2 % chez les patients traités 3 mois versus 86,5 % chez les patients traités 6 mois) au prix d’une moins bonne tolérance en particulier neurologique. Par conséquent, si une chimiothérapie à base d’oxalipatine est discutée pour un cancer du côlon de stade II à risque « relatif » élevé de récidive, 3 mois de CAPOX est une alternative à 6 mois de FOLFOX.
Il est bon de rappeler que certains stades II à risque « relatif » élevé (essentiellement les T4b et les tumeurs pMMR/MSS avec plusieurs des facteurs de mauvais pronostic) de récidive sont de moins bon pronostic que certains stades III à faible risque de récidive et que l’oxaliplatine n’a pas montré dans l’étude MOSAIC d’amélioration statistiquement significative de la survie sans rechute et de la survie globale en ITT pour la totalité des stades II ce qui peut faire préférer chez ces patients une chimiothérapie par fluoropyrimidine seule [Tournigand et al. 2012].
Une méta-analyse sur données individuelles des études pivotales MOSAIC et C-07 a étudié l’intérêt de l’ajout de l’oxaliplatine dans la population avec un cancer colique de stade II (N=1595), selon les critères histopronostiques disponibles dans ces études (pT4, sans distinction pT4a/pT4b ; perforation tumorale ; moins de 10 ganglions analysés) [Chibaudel B et al. 2024]. Aucun effet statistiquement significatif n’était retrouvé dans les sous-groupes histopronostiques , et le nombre de facteurs de risque n’était pas prédictif de l’intérêt de l’oxaliplatine. Dans la population de stade II dite à haut risque (pT4 ou perforation tumorale ou moins de 10 ganglions analysés), l’ajout de l’oxaliplatine n’améliorait pas de manière significative la survie globale (HR=0,86, IC95% 0,63-1,18, P=0.349).
Les données de la littérature sont unanimes vis à vis du bon pronostic des cancers du côlon de stade II de phénotype moléculaire dMMR/MSI [Ribic et al. 2003; Parc et al. 2004 ; Kim et al. 2007; Sargent et al. 2010 ; Klingbiel et al. 2015 ; Bertagnolli et al. 2011; Roth et al. 2012]. A noter qu’il existe peu d’arguments convaincants concernant la valeur prédictive de ce paramètre vis à vis de l’effet de la chimiothérapie adjuvante.
La détermination du statut MMR/MSI est utile pour discuter de l’indication d’une chimiothérapie adjuvante pour un patient opéré d’un cancer du côlon de stade II avec des facteurs de mauvais pronostic. Le bon pronostic des cancers du côlon de stade II dMMR/MSI est un argument pour ne pas proposer une chimiothérapie adjuvante aux stades II pour lesquels l’indication d’une chimiothérapie est généralement discutée [Sargent et al. 2010].
Au vu de ces résultats, l'indication d'une chimiothérapie adjuvante pour les patients présentant un cancer de stade II est à discuter au cas par cas avec évaluation du rapport bénéfice-risque de cette chimiothérapie adjuvante et avec la connaissance du statut MMR/MSI du cancer.
Le gain potentiel d’une chimiothérapie adjuvante dans les stades II est à pondérer en fonction de la toxicité de la chimiothérapie et du rapport bénéfice risque. Le bénéfice en survie étant modéré (entre 2 à 5 % en valeur absolue selon le risque de récidive avec les fluoropyrimidines seules), il doit inciter les praticiens à séparer les tumeurs de stade II selon leur risque « relatif » de récidive :
risque « relatif » faible ou modéré de récidive :
tumeur pMMR/MSS avec les facteurs de bon pronostiques suivants : T3, analyse de plus de 12 ganglions, absence d’emboles veineux, péri-nerveux et/ou lymphatiques, tumeur bien ou moyennement différenciée, et absence de perforation tumorale
tumeur dMMR/MSI
risque « relatif » élevé de récidive (tumeurs pMMR/MSS avec un ou plusieurs des facteurs de mauvais pronostic suivants) : T4, analyse de moins de 12 ganglions, présence d’emboles veineux, péri-nerveux et/ou lymphatiques, tumeur peu différenciée, perforation tumorale et pour certains occlusion révélatrice et présence de cellules néoplasiques isolées dans un ganglion N0 (CTI).
Pour certains experts, la présence d’emboles veineux, péri-nerveux et/ou lymphatiques ne peut être considérée quand il s’agit d’un seul facteur de risque comme un risque élevé. Il en est de même de l’occlusion tumorale dont la définition est souvent très floue et hétérogène dans les publications (le caractère occlusif de la tumeur en endoscopie n’est pas un facteur de mauvais pronostic contrairement au syndrome occlusif clinique et radiologique traité par stomie ou colectomie en urgence) [Cortet M et al. 2013].
Le caractère peu différencié de la tumeur est associé à un risque élevé uniquement en cas de tumeur MSS (les tumeurs MSI sont très souvent peu différenciées et sont de bon pronostic). La présence de cellules néoplasiques isolées dans un ganglion- T3N0(CTI) - est une situation rare qui est considérée par certains comme un facteur de risque élevé [Mescoli et al. 2012].
A noter que les données de la littérature sur ces facteurs de risque anatomopathologique de récidive pour les stades II sont issues d’analyses a posteriori par sous-groupes et que le bénéfice d’une chimiothérapie adjuvante en fonction de ces facteurs n’est pas démontré.
De nouveaux facteurs tumoraux biologiques associés à un bon pronostic ont été identifiés (absence de délétion du bras long du chromosome 18, présence d'un infiltrat intra-tumoral de lymphocytes mémoires, expression conservée de la protéine SMAD4, signatures génétiques tumorales telles que le test Oncoprint® qui est commercialisé aux États-Unis ou encore le test Oncotype DX®), ces tests n’étant ni remboursés ni recommandés en France car ils n’apportent aucune valeur ajoutée à nos patients actuellement par rapport aux autres critères histo-pronostiques cités ci-dessus [Zhou et al. 2002 ; Wang et al. 2004 ; Pagès et al. 2009 ; Gray et al. 2011 ; Yothers et al. 2013; Roth et al. 2012 ; Venook et al. 2013].
La valeur pronostique de CDX2 a été rapportée avec des résultats qui doivent être confirmés [Dalerba et al. 2016 ; den Uil et al. 2020] en particulier pour les stades II [Derangère et al. 2022].
L’importance pronostique des mutations RAS et BRAF V600E, établie pour les stades III doit être validée pour les stades II [Sinicrope et al. 2015 ; Taïeb et al. 2016].
Un immunoscore de quantification in situ de l’infiltrat lymphocytaire a été évalué dans le cadre d’un consortium international dans un but de standardisation de ce score en pratique clinique [Pagès F et al. 2018]. La reproductibilité du score standardisé a été validée dans une série de 2681 patients atteints d’un cancer du côlon de stade I, II ou III et sa valeur pronostique dans les cancers du côlon localisé a été confirmée. Plus récemment, la valeur pronostic de cet immunoscore a été rapportée dans une large cohorte de patients pris en charge pour un cancer du côlon de stade III [Mlecnik et al. 2020]. D’autres scores histopronostiques ont également été évalués avec des résultats également intéressants [Reichling et al. 2020 ; Alexander et al. 2020 ; Derangère et al. 2022].
Plusieurs classifications moléculaires des cancers colorectaux ont fait l’objet d’un consensus international pour retenir 4 sous-groupes moléculaires reliés à des paramètres cliniques et moléculaires et à des données de survie (Concensus Molecular Subtype - CMS1 : « immun » avec MSI et activation immunitaire; CMS2 : « canonique » avec différenciation épithéliale et activation de la voie WNT/MYC ; CMS3 : « métabolique » avec dérégulation épithéliale et métabolique ; CMS4 : « mésenchymateux » avec activation de la voie TGFβ, angiogenèse et implication du stroma) [Guinney et al. 2015 ; Dientsmann et al. 2017].
L’intérêt potentiel de ces paramètres biologiques pronostiques n’est pas validé en pratique vis à vis de l’impact qu’ils pourraient avoir sur la décision thérapeutique et, notamment, sur l’indication d’une chimiothérapie adjuvante des cancers de stade II classés à risque relatif élevé de récidive au moyen de ces paramètres. Par conséquent leur utilisation en pratique courante ne peut pas être recommandée.
Il est probable que dans un futur proche, une classification moléculaire plus précise des cancers du côlon permettra de stratifier la prise en charge thérapeutique des patients atteints d’un cancer du côlon localisé avec peut être des traitements différents pour les tumeurs BRAF muté, dMMR/MSI, HER2 amplifiées, KRAS G12C muté… [Bruzzi et al. 2019].
Une autre approche est le monitoring de la maladie résiduelle au moyen de l’ADN circulant d’origine tumoral (ADNct) sanguin. La détection d'ADNct sanguin en postopératoire chez des patients traités pour un cancer localisé du côlon semble très prometteuse comme biomarqueur associé à la survie sans récidive et à la survie globale et pour monitorer une chimiothérapie adjuvante [Lecomte et al. 2002 ; Fan et al. 2017; Tarazona et al. 2019 ; Tie et al. 2019 ; Reinert et al. 2019; Taïeb et al. 2019 ; Fleming et al. 2020 ; Tie et al. 2021 ; Tie et al. 2022]. Il sera probablement un futur facteur important dans la stratégie du traitement adjuvant du cancer du côlon localisé et des études prospectives sont actuellement en cours pour le valider telle que l’étude CIRCULATE-PRODIGE 70 dans les stades II [Taïeb et al. 2020].
Au final, en situation adjuvante, aucun facteur biologique prédictif de l’efficacité d’une chimiothérapie adjuvante n’a été à ce jour identifié avec un niveau de preuve suffisant mais des études sont actuellement en cours pour évaluer leur place comme facteur décisionnel dans des stratégies thérapeutiques de prise en charge des cancers du côlon localisés.
3.4.6.4. Stade III = tous pT-N1 ou N2 = envahissement ganglionnaire
L’envahissement ganglionnaire est le facteur pronostique le plus important des cancers du côlon localisés. Depuis l’étude rapportée par Moertel et al. en 1990, l’efficacité d’une chimiothérapie adjuvante à base de fluoropyrimidines dans le cancer du côlon de stade III est démontrée [Mortel et al. 1990 ; IMPACT investigators, 1995 ; Zaniboni et al. 1998].
Quelle chimiothérapie ?
Les chimiothérapies adjuvantes par FUFOL (fort ou faible) pendant 6 mois diminuent de 12 à 16% le risque absolu de décès à 5 ans [Francini et al. 1994 ; IMPACT investigators. 1995 ; O’Connell et al. 1997 ; Zaniboni et al. 1998 ; QUASAR Collaborative Groupe. 2000; Haller et al. 2005]. Le protocole LV5FU2 est aussi efficace et mieux toléré que le FUFOL forte dose. Le 5-FU en perfusion continue selon l’un des 3 schémas européen (LV5FU2, TTD, AIO) est aussi efficace et mieux toléré que le FUFOL faible dose (Mayo Clinic) [André et al. 2003 ; André et al. 2007 ; Köhne et al. 2013]. Le schéma FOLFOX4 (association de 5-FU, d’acide folinique et d’oxaliplatine) a été comparé en adjuvant au schéma LV5FU2 dans l’essai MOSAIC [André et al. 2004 ; André et al. 2009 ; André et al. 2015]. Les résultats sont en faveur du bras FOLFOX4 avec une amélioration significative de la survie sans rechute à 3 ans (78% versus 73%, soit une réduction relative de 23% du risque de rechute), au prix d’une neurotoxicité de grade 3 pour 12% des patients. Le FOLFOX4 adjuvant pendant 6 mois améliore aussi significativement la survie à 10 ans comparé au LV5FU2 (71,7% versus 67,1% (HR : 0,85, p = 0,043) [André et al. 2015]. L’étude C07 du NSABBP a confirmé l’intérêt de l’oxaliplatine en association avec le schéma hebdomadaire du Roswell Park en montrant une amélioration de 6,2% de la survie sans maladie (DFS) à 3 ans [Kuebler et al. 2007].
Le bénéfice d’une chimiothérapie adjuvante à base d’oxaliplatine semble concerner également le sous-groupe des patients traités pour un cancer de stade III dMMR/MSI [André et al. 2015; Shah et al. 2016; Tougeron et al. 2016; Shaib et al. 2020].
Les combinaisons associant irinotécan et 5-FU n’ont pas démontré d’efficacité en situation adjuvante [Saltz et al. 2007; Ychou et al. 2009; Van Cutsem et al. 2009]. Le raltitrexed a été comparé dans une étude de phase 3 de non-inférioritéau schéma FUFOL dans les stades III [Popov et al. 2008]. Cette étudea dû être interrompue prématurément en raison d’une surmortalité par toxicité liée au raltitrexed. Ellen’a pas permis de conclure à une non-infériorité du raltitrexed en terme de survie sans rechute mais montrait une survie globale équivalente (HR : 1,04). Par conséquent, le raltitrexed n’est pas indiqué dans le traitement adjuvant du cancer du côlon. L’association raltitrexed et oxaliplatine reste une option (avis d’expert) en cas de stade III, surtout à haut risque (T4 ou N2), en cas de toxicité cardiaque aux premiers cycles de fluoromyridines, ou de déficit complet en DPD après évaluation du bénéfice risque, en réunion de concertation multidisciplinaire [Gravelos et al, 2012]. La prescription de cette molécule nécessite des précautions tenant compte de la fonction rénale. Dans cette situation la trifluridine / tipiracil (TAS102) n’a pas été évaluée et ne peut pas être recommandée en routine.
Le traitement par bévacizumab ou cétuximab n’est pas indiqué dans le traitement adjuvant des cancers du côlon de stade III. En effet, les études de phase III évaluant ces lthérapies ciblées (bévacizumab et cétuximab) en association à la chimiothérapie (fluoropyrimidine + oxaliplatine) n’ont pas montré de bénéfice avec des HR dans la majorité des études en défaveur de la thérapie ciblée [Allegra et al. 2011 ; de Gramont et al. 2012 ; Alberts et al. 2012 ; Taïeb et al. 2014 ; André et al, 2020].
L’impact pronostique des mutations RAS et BRAF V600E est maintenant établie pour les stades III [Yoon et al. 2014 ; Blons et al. 2014 Sinicrope et al. 2015 ; Taïeb et al. 2016]. Les futurs essais adjuvants devront tant que possible être stratifiés sur ces facteurs pour évaluer leur intérêt en pratique clinique.
Quel délai entre la chirurgie et le traitement ?
Une méta-analyse d‘essais prospectifs a montré une augmentation du risque relatif de décès lorsque la chimiothérapie est débutée plus de 8 semaines après la résection tumorale (RR : 1,20 ; IC 95 % 1,15 - 1,26 ; p = 0,001) [Des Guetz et al. 2010]. Dans cette méta-analyse l’administration de chimiothérapie était retardée suite à des complications post-opératoires ou à un mauvais état général qui constituent eux-mêmes des facteurs de mauvais pronostic. Même si le délai de « démarrage » n’était pas le seul élément pronostique péjoratif dans ce travail est recommandé de débuter une chimiothérapie adjuvante dans les 8 semaines qui suivent la chirurgie. Au-delà du 3ème mois après la chirurgie, la chimiothérapie se discute et elle n’est probablement plus indiquée au-delà du 5ème mois (accord d’experts) [Kim et al. 2017 ; Turner et al. 2018].
Quelle durée de traitement ?
Les résultats de l’étude collaborative internationale IDEA (International Duration Evaluation of Adjuvant Chemotherapy) rapportés en 2017 ont amèné à revoir les recommandations sur les modalités de la chimiothérapie adjuvante à base d’oxaliplatine dans le cancer du côlon de stade III et par analogie dans le cancer du côlon de stade II [Grothey et al. 2018 ; André et al. 2018 ; Iveson et al. 2018 ; Sobrero et al. 2018 ; Yoshino et al. 2019 ; Petrelli et al. 2021 ; André et al, 2020]. Six études randomisées ont été conduites dans 12 pays avec un objectif de non-infériorité entre 3 mois versus 6 mois de chimiothérapie adjuvante à base d’oxaliplatine (FOLFOX ou CAPOX selon le choix de l’investigateur) dans les cancers du côlon de stade III avec comme critère de jugement principal la survie sans récidive à 3 ans. Au total, 12 834 patients atteints d’un cancer du côlon de stade III ont été randomisés. Le schéma FOLFOX était administré dans 60% des cas.
La non infériorité de 3 mois de traitement n’a pu être démontrée statistiquement sur la poppulation globale de l’étude. La DFS à 3 ans était de 74,6% dans le bras 3 mois versus 75,5% dans le bras 6 mois (HR : 1,07 ; IC 95 % : 1 - 1,15) soit une différence absolue inférieure à 1%.
Des analyses avaient été prédéfinies par sous-groupe en fonction des stades T et N définissant des groupes bas risque de récidive (T1-3, N1, M0) ou haut risque de récidive (T4 et/ou N2, M0) et du schéma de chimiothérapie administrée (FOLFOX ou CAPOX). La survie sans récidive à 3 ans est significativement non inférieure dans le bras 3 mois de CAPOX 75,9% versus 74,8% dans le bras 6 mois de CAPOX (- HR : 0,95 ; IC 95 % : 0,85 - 1,06). La survie sans récidive à 3 ans est significativement inférieure dans le bras 3 mois de FOLFOX, 73,6% versus 76% dans le bras 6 mois de FOLFOX (- HR : 1,16 ; IC 95 % : 1,06 - 1,26). Par conséquent, l’efficacité du schéma FOLFOX administré pendant 3 mois est inférieure à celle rapportée avec le schéma FOLFOX administré pendant 6 mois.
Pour les cancers du côlon stade III à bas risque de récidive (60% de l’effectif de l’étude)., les résultats sont en faveur d’un traitement par CAPOX 3 mois. En effet la survie sans récidive à 3 ans est de 83,1% dans le bras 3 mois de CAPOX ou FOLFOX versus 83,3% dans le bras 6 mois de CAPOX ou FOLFOX (significativement non inférieure - HR : 1,01 ; IC 95 % : 0,9 - 1,12). Le schéma CAPOX 3 mois était non inférieur au schéma 6 mois pour les tumeurs de bas risque (DFS à 3 ans est de 85% dans le bras 3 mois de CAPOX versus 83,1% dans le bras 6 mois de CAPOX - HR : 0,85 ; IC 95 % : 0,71 - 1,01).
Pour les cancers du côlon à haut risque de récidive, la DFS à 3 ans est de 62,7% dans le bras 3 mois de CAPOX ou FOLFOX versus 64,4% dans le bras 6 mois de CAPOX ou FOLFOX (significativement inférieure - HR : 1,12 ; IC 95 % : 1,03 - 1,23). Le schéma FOLFOX administré 6 mois était supérieur au schéma FOLFOX administré 3 mois (la DFS à 3 ans est de 61,5% dans le bras 3 mois de FOLFOX versus 64,7% dans le bras 6 mois de FOLFOX - HR : 1,20 ; IC 95 % : 1,07 - 1,35).
Le risque de neuropathie de grade 2 ou 3 était significativement plus faible dans le bras 3 mois avec des diminutions des risques relatifs variant entre 3 à 6 selon le grade de la neurotoxicité et le schéma de chimiothérapie. Chez les patients traités par CAPOX, les taux de neurotoxicité de grade 2 et 3 sont respectivement de 12% et 3% dans le bras 3 mois versus 36% et 9% dans le bras 6 mois (différence significative). Chez les patients traités par FOLFOX, les taux de neurotoxicité de grade 2 et 3 sont respectivement de 14% et 3% dans le bras 3 mois versus 32% et 16% dans le bras 6 mois (différence significative).
A noter que la valeur pronostique de l‘immunoscore a été validée chez les patients de stade III traités par une chimiothérapie adjuvante à base d’oxaliplatine dans le cadre de l’étude IDEA « France » [Pagès et al. 2020]. Les patients avec un l’infiltrat lymphocytaire tumoral élevé avaient la meilleure survie sans récidive à 3 ans : 77,1% (IC 95 % : 73,5-80,3) versus 66,8% (IC 95 % : 62,2-70,9).
Les données de survie globale et de DFS à plus long terme de l’étude IDEA ont été récemment publiées [André et al. 2020]confirment ceux précédemment rapportés. L’analyse en population globale raprès un suivi médian d’environ 5 ans indique qu’une durée de chimiothérapie de 3 mois impacte la survie globale, mais avec une différence très faible de 0,4% ne permettant pas de conclure à la non infériorité, entre les deux groupes de traitement (3 mois et 6 mois), avec des taux de survie globale à 5 ans de 82,4% (3 mois) et de 82,8% (6 mois) (HR : 1,02 ; IC 95 % : 0,95-1,11 ; p = 0,058) et une toxicité en particulier neurologique diminuée d’un facteur 2 à 6 entre 3 et 6 mois de traitement.
Les analyses de la survie globale dans différents sous-groupes apportent des informations complémentaires :
- Il existe un effet du schéma de chimiothérapie FOLFOX6m ou CAPOX (interaction entre durée du traitement et schéma de la chimiothérapie)
- Il n’y a pas de perte d’efficacité chez les patients avec tumeurs à faible risque (T1 à T3, N1) avec 3 mois de CAPOX
- Il y a une minime perte d’efficacité avec 3 mois de CAPOX chez les patients avec tumeur à haut risque (T4 et/ou ou N2) (1% sur la survie globale à 5 ans et 2,6% sur la survie sans rechute à 5 ans) et avec 3 mois de FOLFOX pour les patients avec tumeur à faible risque (0,3% sur la survie globale à 5 ans et 2,4% sur la survie sans récidive à 5 ans)
- Il y a une perte d’efficacité certaine (3%) avec 3 mois de FOLFOX chez les patients avec tumeur à haut risque.
En tout état de cause raccourcir à 3 mois la durée de traitement permet de diminuer nettement les toxicités, notamment, le risque de toxicité neurologique lié au traitement, d’éviter de poser un site implantable en cas d’utilisation du schéma CAPOX 3 mois, et de simplifier la vie des patients et doit être discuté au cas par cas avec le patient.
Les tumeurs dMMR/MSI :
En l’absence de traitement néo-adjuvant par immunothérapie, la chimiothérapie adjuvante des cancers coliques dMMR/MSI de stade III repose sur une chimiothérapie par fluoropyrimidine et oxaliplatine, pour 3 à 6 mois. Une méta-analyse ACCENT a montré que l’ajout de l’oxaliplatine améliore significativement la SG (HR=0,52 ; 0,28-0,93), alors qu’une monothérapie par fluoropyrimidine seule n’améliore pas la SSM ni la SG des patients avec un cancer colique dMMR/MSI de stade III. [Cohen et al. JCO 2020]. L’essai ATOMIC a comparé dans les cancers coliques stade III dMMR/MSI le FOLFOX 6 mois versus le FOLFOX 6 mois plus atézolizumab (anti-PD-L1) pendant 12 mois (n=712) [Sinicrope et al. ASCO 2025]. L’essai est positif sur son critère principal de jugement avecla SSM à 3 ans qui passe de 76,6% à 86,4% (HR=0,50 ; 0,34-0,72 ; p<0,0001). Tous les sous-groupes ont un gain en SSM. La tolérance est acceptable avec néanmoins une majoration des effets indésirables de grade 3 et plus de 59,2% à 72,3% dans le bras atézolizumab, notamment neutropénie (43% versus 36%), diarrhée (12% versus 8%) et neuropathie (19% versus 15%) et 2 décès toxiques (versus 0) directement reliés au traitement dans le bras FOLOFX-ATZ. L’ajout de l’atezolizumab (1 an) au FOLFOX (6 mois) diminue le risque de rechute de 50% par rapport à la chimiothérapie seule. Cette stratégie doit être discutée en RCP pour les patients avec un cancer du côlon stade III dMMR/MSI opéré. La valeur ajoutée de l’atezolizumab en adjuvant semble néanmoins moindre que celle de l’immunothérapie en situation néo-adjuvante (essais NICHE). Le positionnement optimal de l’immunothérapie pour les cancers coliques dMMR/MSI de stade III reste encore à déterminer et la publication des résultats complets de l’essai ATOMIC reste attendus.
3.4.6.5. Prise en compte de l’âge dans l’indication d’une chimiothérapie adjuvante
Bien qu’en pratique clinique, l’âge physiologique compte plus que l’âge chronologique pour poser l’indication d’une chimiothérapie, il existe peu de données spécifiques sur l’évaluation de la chimiothérapie adjuvante chez les patients âgées. Au même titre que les co-morbidités, l’âge est un facteur à prendre en considération dans l’indication d’une chimiothérapie adjuvante. Il existe peu de données bien documentées, notamment au-delà de 80 ans.
L’indication d’une chimiothérapie adjuvante doit être mise en balance avec l’espérance de vie du malade dont on espère améliorer la survie à 5 ans. Une chimiothérapie adjuvante au-delà de 85 ans est discutable et doit toujours faire l’objet d’une décision de RCP après une consultation oncogériatrique. Dans les études qui ont évalué l’intérêt d’une chimiothérapie adjuvante, la part des patients âgés est faible et les patients âgés inclus dans ces études étaient certainement sélectionnés. Les résultats de l’analyse en fonction de l’âge des essais qui ont évalué le 5-FU en adjuvant (versus pas de traitement adjuvant) sont en faveur d’un gain en survie de ce traitement chez les patients de plus de 70 ans comparable à celui observé chez les patients plus jeunes sans augmentation significative de la toxicité, avec néanmoins très peu de patients de plus de 80 ans dans ces études [Sargent et al. 2001; Mayer et al. 2015]. Dans l’étude QUASAR, aucun bénéfice n’était observé dans le sous-groupe des patients âgés de plus de 70 ans et traités par une chimiothérapie adjuvante par 5-FU pour un cancer de stade II [QUASAR. 2007].
Chez les patients de plus de 70 ans, le bénéfice de l’ajout de l’oxaliplatine au 5-FU n’est pas établi [Yothers et al. 2011 ; Tournigand et al. 2012 ; Sanoff et al. 2012 ; McLeary et al. 2013]. Toutefois, l’analyse poolée des 4 études contrôlées (NSABP C-08, XELOXA, X-ACT et AVANT) montre un bénéfice en faveur d’un schéma à base d’oxaliplatine chez les sujets âgés de plus de 70 ans [Haller et al. 2015]. Compte tenu de l’âge médian de survenue du cancer colique dans les pays développés (> 70 ans), des études sur le bénéfice de la chimiothérapie adjuvante au-delà de 75 voire 80 ans restent pertinentes. C’est l’objet de l’étude ADAGE en cours chez les patients de 70 ans et plus [Aparicio et al. 2016]. L’analyse préliminaire de toxicité de l’étude ADAGE montre que les patients recevant de l’oxaliplatine ont plus de toxicité que ceux traités par fluoropyrimidine seule et que les patients fragiles ont plus de toxicité et arrêtent plus précocement le traitement que les patients les moins fragiles [Aparicio et al. 2022].
Dans tous les cas, il est nécessaire de prendre en compte les co-morbidités et l’espérance de vie présumée avant d’instituer le traitement. Le recours à une évaluation onco-gériatrique peut être une aide à la décision dans ce type de situation difficile.
3.4.6.6. Place des dérivés oraux du 5-FU en adjuvant (capécitabine)
Un traitement adjuvant par capécitabine est aussi efficace que l’association FUFOL pour la survie sans récidive à 3 ans et pour la survie globale à 5 ans avec moins d’effets secondaires [Twelves et al. 2005 ; Twelves et al. 2012].
La supériorité du CAPOX sur une association de 5-FU bolus /AF (étude NO16968, XELOXA) a été montrée pour la survie sans maladie pour les cancers de stade III, (DFS à 3 ans de 71,0 % versus 67,0 % respectivement (HR : 0,80 ; p = 0,0045)) [Haller et al. 2014]. Les résultats de survie globale à long terme (sept ans) sont significativement en faveur de l’association CAPOX (HR : 0,83 ; p = 0,04) [Schmoll et al. 2015]. L’analyse poolée des 4 études contrôlées NSABP C-08, XELOXA, X-ACT et AVANT est en faveur d’un bénéfice équivalent entre les deux schémas FOLFOX et CAPOX [Schmoll et al. 2014].
Ces résultats sont des arguments en faveur de l’utilisation d’une fluoropyrimidine orale en remplacement d’une chimiothérapie par association 5-FU-acide folinique lorsque celle-ci est choisie en restant cependant précautionneux chez les sujets âgés ne tolérant pas toujours bien cette molécule et en l’évitant en cas d’insuffisance rénale même modérée (avis d’expert).
En cas d’association d’une fluoropyrimidine (intraveineuse ou orale) avec l’oxaliplatine, et en l’absence de données sur la comparaison des schémas CAPOX et FOLFOX en adjuvant dans le cancer du côlon, les 2 schémas sont des standards pour les stades III. Le schéma CAPOX à l’avantage de pouvoir être administré sans site implantable, ce qui n’est pas le cas du schéma FOLFOX [Lapeyre-Prost et al. 2016].
Dans le cadre de l’étude IDEA, les schémas CAPOX et FOLFOX ne peuvent être comparés entre eux. Les analyses prévues par sous-groupes sont en faveur du schéma CAPOX pendant 3 mois versus 6 mois de CAPOX pour les cancers du côlon de stade III à faible risque (T1-3, N1, M0). Pour les stades III de risque élevé (T4 et/ou N2), les standards sont le FOLFOX ou le CAPOX administré pendant 6 mois.
Du fait de son mode d’administration per os, le maniement de la capécitabine est parfois difficile en pratique quotidienne avec un risque augmenté de toxicité parfois sévère chez les sujets âgés. Un contrôle rigoureux de la fonction rénale avant de débuter la capécitabine est nécessaire. En monothérapie, la dose standard est de 2500 mg/m2 par jour. Certains auteurs, chez les sujets âgés, proposent d’initier le traitement à la dose de 2000 mg/m2 par jour et de n’augmenter la dose qu’en cas de tolérance satisfaisante [Chang et al. 2012].
3.4.6.7. Autres mesures « adjuvantes »
3.4.6.7.1. Optimisation de la chimiothérapie
- Recherche d’un déficit en DPD avant l’administration d’une chimiothérapie à base d’une fluoropyrimidine (le 5-FU et une prodrogue du 5-FU, la capécitabine) : le 5-FU est métabolisé à plus de 80 % par la dihydropyrimidine déshydrogénase (DPD). Une faible activité de la DPD entraîne une diminution du catabolisme du 5-FU avec pour corollaire une augmentation de ses métabolites actifs et un risque de toxicité sévère au 5-FU qui peut être létale [Daisio et al. 1988]. Une diminution d’activité de la DPD est rapportée selon les études chez environ 0,3% de la population et dans 40 à 60 % des cas de toxicité sévère au 5-FU. Différentes approches classées en phénotypiques et génotypiques de recherche d’un déficit en DPD ont été développées [Boisdron-Celle et al. 2007 ; Lee et al. 2014 ; Meulendijks et al. 2015]. Plusieurs études montrent l’intérêt potentiel de la recherche d’un déficit en DPD avant la prescription d’une chimiothérapie à base de 5-FU [Boisdron-Celle et al. 2013 ; Henricks et al. 2018 ; Barin-Le Guellec C et al. 2020 ; Pallet et al. 2020].
En février 2018, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) avait préconisé la recherche d’un déficit en DPD pour tout patient concerné par une chimiothérapie intégrant des fluoropyrimidines. En décembre 2018, le Groupe de Pharmacologie Clinique Oncologique, l’Institut national du cancer (INCa) et la Haute Autorité de Santé (HAS) ont recommandé la recherche du déficit en enzyme DPD par la mesure de l’uracilémie dorénavant facilement accessible sur l’ensemble du territoire [Loriot et al. 2018] :
- en cas d’uracilémie supérieure ou égale à 150 ng/ml (évocatrice d’un déficit complet en DPD), le traitement par fluoropyrimidines est contre-indiqué. L’association raltitrexed et oxaliplatine est une option après évaluation du rapport bénéfice/risque.
- en cas d’uracilémie comprise entre 16 ng/ml et 150 ng/ml (évocatrice d’un déficit partiel en DPD), et sur la base d’un dialogue entre le laboratoire de pharmacologie et l’équipe médicale, la posologie initiale des fluoropyrimidines doit être adaptée en tenant compte du niveau d’uracilémie mesuré, en plus des autres facteurs de risque de toxicité déjà pris en compte (protocole de traitement, âge, état général du patient …). Un réajustement thérapeutique doit être envisagé dès le deuxième cycle de chimiothérapie en fonction de la tolérance au traitement et/ou du suivi thérapeutique pharmacologique s’il est disponible.
- Traitement préventif de la neuropathie à l’oxaliplatine : les perfusions de calcium/magnésium sont inefficaces en prévention primaire de la neurotoxicité induite par l'oxaliplatine [Loprinzi et al. 2014].
- Impact de la masse corporelle sur la neuropathie à l’oxaliplatine :
Plusieurs études suggèrent que la sarcopénie est reliée à la toxicité de l’oxaliplatine. Chez les patients sarcopéniques, l’étude LEANOX a montré que l’adaptation de dose d’oxaliplatine en fonction de la masse maigre (vs le calcul standard de 85 mg/m²) permettait de diminuer le taux de patients avec neuropathie de grade ≥2 de 47% (HR=0,53 95%CI 0,34-0,84 ; p=0,01), avec une amélioration de la qualité de vie (score QLQ CIPN20 évaluant la qualité de vie reliée aux neuropathies) et sans impact sur la SSR et la SG [Assenat E et al. ESMO 2024].
En pratique :
| • L’évaluation de la masse maigre peut être facilement réalisée par une coupe scanner en L3. • Les logiciels de segmentation largement utilisés par les radiologues calculent la surface des muscles para vertébraux et abdominaux). • Le calcul de la masse maigre (en kg) est réalisé par la formule ci-dessous : Masse Maigre (MM) = Surface musculaire mesurée en L3 (cm²) × 0.3) + 6,06 • Dans l’étude LEANOX, patient considéré comme sarcopénique = si la dose d’oxaliplatine calculée en fonction de la surface corporelle (85mg/m²) > 3,09 mg / kg de MM. • Chez patients sarcopéniques, dose d’oxaliplatine adaptée à MM (mg) = MM (kg) X 3,09. Par exemple : si MM (L3 scanner = 42kg) alors dose oxaliplatine = 42 x 3,09 = 129 mg |
3.4.6.7.2. Chimioprévention par l’aspirine
Deux études basées sur l’analyse rétrospective de patients inclus dans des études prospectives ainsi qu’une méta-analyse montrent que le traitement par aspirine des patients opérés d’un cancer colorectal de stade II-III avec une mutation tumorale activatrice du gène PI3KCA (qui code la phosphatidylinositol-4,5-bisphosphonate 3-kinase impliquée dans la voie de signalisation PI3kinase) augmente significativement la survie sans récidive et la survie globale [Liao et al. 2012 ; Domingo et al. 2013 ; Paleari et al. 2015 ; Kothari et al. 2015 125-128]. Cet effet positif de l’aspirine a été rapporté pour des doses ≤ 100 mg/j. Ces résultats sont en accord avec les données précliniques d’un effet positif de l’inhibition par l’aspirine de la voie PI3kinase activée. Environ 10 à 15 % des cancers colorectaux présentent une mutation tumorale activatrice du gène PI3KCA. Une troisième étude rétrospective issue de 2 cohortes de patients avec un cancer du côlon opéré ne montre pas de bénéfice significatif de l’aspirine [Kothari et al. 2015]. Le niveau de preuve est encore insuffisant pour affirmer l’intérêt de l’aspirine à faible dose en adjuvant. Des études prospectives sont actuellement en cours pour le valider telle que l’étude ASPIK French-PRODIGE 50 dans les stade II ou III [Michel et al. 2018].
3.4.6.7.3. Activité physique (cf. TNCD chapitre 17 Nutrition et Activité Physique)
Plusieurs études de cohorte de patients atteints de cancer colorectal ont montré une association positive entre la survie globale ou spécifiquement liée au cancer et la pratique d’une activité physique d’intensité modérée, de 6 à 9 heures par semaine, avant et après le diagnostic [Haydon et al. 2006; Meyerhardt et al. 2006 ; Meyerhardt et al. 2006 ; Van Blarigan et al. 2015 ; van Blarigan et al. 2018 ; Phipps et al. 2018 ; van Roekel et al. 2020], association confirmée dans l’essai de phase III CALGB/SWOG 80702 au sein duquel était nichée une étude de cohorte prospective [Brown et al. 2022]. Des recommandations françaises sont publiées sur l’activité physique et la nutrition chez les patients pris en charge pour un cancer digestif [Neuzillet et al. 2020] [cf TNCD Nutrition et activité physique].
L’étude de phase III randomisée CHALLENGE a évalué dans les cancers coliques opérés de stade II à haut risque et de stade III l’intérêt d’un activité physique renforcée avec une programme de 3 ans [Courneya et al. 2025]. Les patients étaient randomisés entre un programme d’exercice adapté (SEP) versus uniquement la remise d’une brochure sur l’intérêt de l’APA (n=889). Il s’agissait d’une activité physique coachée avec des sessions obligatoires d’intensité modérée à intense (correspondant à au moins 10 heures de marche rapide par semaine) et une augmentation progressive de l’intensité en fonction de l’activité physique de base du patient avec un objectif maximal de 27 MET heures/semaines. L’observance à 3 ans était de 63%. L’étude est positive sur son critère principal de jugement de SSM qui passait de 73,9% à 80,3% à 5 ans (HR=0,72 (0,55-0,94) ; p=0,017). Un gain en SG était également observé qui passait de 83,2% à 90,3% (HR=0,63 (0,43-0,94) ; p=0,022). L’APA, en plus de la chimiothérapie, doit donc être recommandée dans le cadre d’un Plan Personnalisé Après-Cancer pour tous les patients en situation adjuvante d’un CCR mais son applicabilité à large échelle reste limitée par la disponibilité d’éducateur physique.
3.4.6.7.4. Le schéma FOLFOX6 modifié (FOLFOX6m) (ou FOLFOX4 simplifié) peut remplacer le schéma FOLFOX4
Le schéma FOLFOX6m (oxaliplatine 85 mg/m2 perfusion intraveineuse avec LV 400mg/m2 pendant 2 heures, suivie d'une injection en bolus de 5-FU 400 mg/m2, puis par une injection intraveineuse de 5-FU 2400 mg/m2 pour 46 heures) est plus commode pour le patient et moins coûteux que le schéma FOLFOX4 (une journée versus deux jours en hôpital de jour) avec une tolérance équivalente ou meilleure et une dose intensité de 5-FU supérieure.
Aujourd'hui, aucune étude n'a encore comparé FOLFOX4 à FOLFOX6m dans le cadre du traitement adjuvant. Cependant, dans l'étude NSABPC-08, qui a évalué le FOLFOX6m avec ou sans bévacizumab et dans l’étude NCCTG NO147 qui a évalué le FOLFOX6m avec ou sans cétuximab, toutes deux chez des patients avec cancer du côlon de stade III, la survie sans maladie à 3 ans était équivalente à celle observée chez les patients traités soit avec le bras FLOX de l’étude NSABPC-07 soit par FOLFOX4 dans l'étude MOSAIC [André et al. 2004; André et al. 2009; André et al. 2015; Kuebler et al. 2007; Allegra et al. 2011; Alberts et al. 2012].
3.4.7. Recommandations sur les traitements adjuvants
Stade I :
REFERENCE
- Pas de traitement adjuvant
Stade II : (figure 7 et tableau 4)
REFERENCES
- Pour les cancers de stade II pMMR/MSS :
- En l’absence de facteurs de mauvais pronostic : pas de chimiothérapie adjuvante
- En cas de facteurs de mauvais pronostic : pas de REFERENCE
- Pour les cancers de stade II dMMR/MSI : pas de chimiothérapie adjuvante
OPTIONS
Une chimiothérapie peut être proposée aux patients n’ayant pas de co-morbidité sévère, en bon état général et sans déficit complet en DPD dans les situations suivantes * :
* En l’absence de preuve de niveau A d’efficacité et de consensus dans cette situation, la prudence est souhaitable et la balance bénéfice/risque doit être évaluée et expliquée au patient.
- Recherche d’un déficit en DPD par phénotypage (dosage de l'uracilémie) avec ajustement des doses de 5FU et capécitabine en cas de déficit partiel et contre-indication du 5FU et de la capécitabine en cas de déficit complet (accord d’experts).
- En cas de cancer de statut pMMR/MSS sans facteur de mauvais pronostic ou avec un facteur de mauvais pronostic à l’exclusion du caractère T4 et d’un nombre de nombre de ganglions examinés < 12. Les schémas proposés doivent avoir peu de risque toxique : capécitabine (évitant la pose d’une voie veineuse centrale) ou LV5FU2 simplifié pendant 6 mois.
- En cas de cancer de statut pMMR/MSS avec un ou des facteurs de mauvais pronostic reconnus (T4, nombre de ganglions examinés < 12, tumeur peu différenciée, perforation tumorale et pour certains occlusion) - Stade II à risque « relatif » élevé de récidive. Les schémas proposés doivent avoir peu de risque toxique :
- Capécitabine, LV5FU2 simplifié pendant 6 mois.
- Un schéma à base d’oxaliplatine (FOLFOX6m ou CAPOX) peut se discuter principalement chez des patients de moins de 70 ans avec tumeur T4 et/ou moins de 10 à 12 ganglions analysés. En cas d’utilisation d’oxaliplatine, celui-ci devra être interrompu dès l’apparition d’une neurotoxicité de grade 2 (accord d'experts). En tenant compte des résultats de l’étude IDEA pour les stades II, si une chimiothérapie adjuvante à base de fluoropyrimidines et d’oxaliplatine est proposée, le schéma FOLFOX6m pendant 6 mois et le schéma CAPOX pendant 3 mois sont les deux alternatives possibles avec arrêt de l’oxaliplatine en cas de neuropathie ≥ grade 2.
- En cas de cancer de stade II dMMR/MSI pT4b et/ou avec de multiples facteurs de mauvais pronostic : une chimiothérapie adjuvante à base de fluoropyrimidines et d’oxaliplatine (FOLFOX6m pendant 6 mois ou CAPOX pendant 3 mois) est à discuter (accord d'experts). Une chimiothérapie par fluoropyrimidine seule n’est pas indiquée. En cas de neuropathie ≥ grade 2 la chimiothérapie adjuvante doit être complétement arrêtée compte tenu qu’une fluoropyrimidine seule n’est pas efficace dans les stade II dMMR/SMI.
- Il est recommandé de débuter une chimiothérapie adjuvante dans les 8 semaines qui suivent la chirurgie (accord d’experts), sans que cela signifie que passé ce délai, il ne faille pas administrer de chimiothérapie adjuvante. En revanche au-delà du 3ème mois après la chirurgie, la chimiothérapie se discute et elle n’est probablement plus indiquée au-delà de 5 mois (accord d’experts).
- Génotypage du gène DPYD si phénotype DPD (uracilémie) anormal (avis d'experts).
- La pratique d’une activité physique d’intensité modérée et adaptée à la condition du patient et encadrée doit être prescrite, notamment pour les stade II à haut risque de récidive (niveau de la recommandation : grade A).
- Adaptation de la dose d’oxaliplatine en fonction de la masse maigre si patients sarcopéniques (vs la dose standard de 85 mg/m²) (accord d’experts) cf .supra 3.4.6.7.1 Optimisation de la chimiothérapie.
ESSAI CLINIQUE
PRODIGE 70 - CIRCULATE : décision de traitement adjuvant des cancers coliques de stade II basée sur l’analyse de l’ADN tumoral circulant. Coordonnateurs : J Taïeb (Paris), C Lepage (Dijon), T André (Paris), L Benhaim (Villejuif)
PRODIGE 70 - CIRCULATE - Résumé - v2.0 08.02.2023.pdf
Figure 8
Arbre décisionnel : Cancer du côlon de stade II 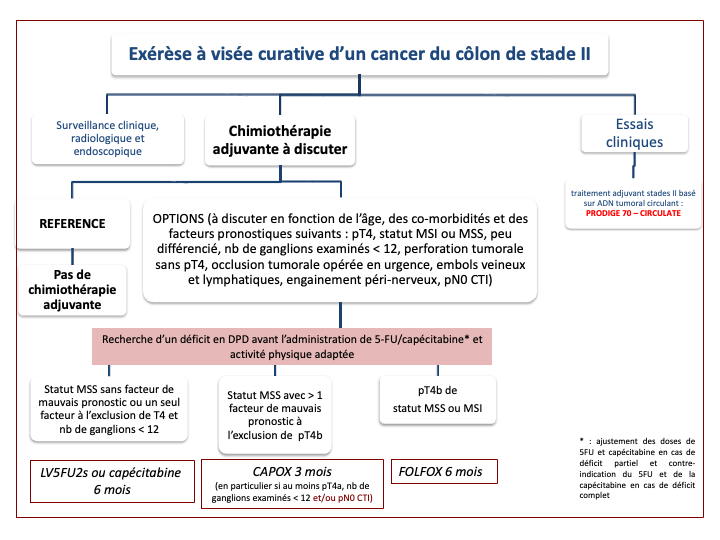
Tableau 4
Chimiothérapie adjuvante à base d’oxaliplatine pour les stades II et III :
Schémas et durées d’administration
| STADE | Schéma | |
| XELOX | FOLFOX | |
| Stade III Faible risque (T1-3,N1) | 3 mois | 6 mois (alternative : 3 mois) |
| Stade III Haut risque (T4 et/ou N2) | 6 mois (alternative : 3 mois) | 6 mois |
| Stade II pMMR/MSS à risque « relatif » élevé de récidive et stade II dMMR/MSI pT4b | 3 mois | 6 mois |
Stade III : (figure 9 et tableau 4)
REFERENCES
- Chimiothérapie post-opératoire par FOLFOX6m (en remplacement du schéma FOLFOX4 - (accord d’experts) ou CAPOX commencée si possible avant le 42ème jour post-opératoire (niveau de la recommandation : grade A) .
- La pratique d’une activité physique d’intensité modérée, adaptée à la condition du patient et encadrée doit être prescrite (niveau de la recommandation : grade A).
- La durée d’administration de la chimiothérapie dépend du niveau de risque de récidive et du choix du schéma de chimiothérapie (figure 9) :
- Si stade III à bas risque (T1-3, N1, M0) : CAPOX administré pendant 3 mois (4 cures) est le standard (niveau de la recommandation : grade A). L’alternative «non démontrée statistiquement » est FOLFOX6m administré pendant 3 mois.
- Si stade III à haut risque (T4, N1-2, M0 et T1-3, N2, M0) : FOLFOX6m ou CAPOX administré pendant 6 mois sont les deux standards (niveau de la recommandation : grade A). L’alternative « non démontrée statistiquement » est CAPOX administré pendant 3 mois (pas 3 mois de FOLFOX6m car perte d’efficacité certaine).
- L’arrêt de l’oxaliplatine est recommandé dès l’apparition d’une neuropathie de grade 2 (paresthésies douloureuses spontanées, non déclenchées par le froid et persistantes entre deux cycles) et obligatoire en cas d’apparition d’une gêne fonctionnelle (grade 3) ou d’une réaction allergique ou de toute autre toxicité de grade supérieur à 1 spécifique de l’oxaliplatine (respiratoire notamment).
- Recherche d’un déficit en DPD par phénotypage (dosage de l'uracilémie éventuellement complété par le rapport dihydro-uracilémie/uracilémie) avec ajustement des doses de 5FU ou de capécitabine en cas de déficit partiel et contre-indication du 5FU ou de la capécitabine en cas de déficit complet (niveau de la recommandation : accord d’experts).
- Chez les sujets de plus de 70 ans et en fonction de « l’âge physiologique » une mono-chimiothérapie par fluoropyrimidine pendant 6 mois est recommandée (niveau de la recommandation : grade B).
- Le bénéfice d’une chimiothérapie adjuvante par fluoropyrimidines et oxaliplatine pour les stades III est observé quel que soit le statut d ou pMMR/MSS ou dMMR/MSI de la tumeur.
OPTIONS
- Chez les patients n’acceptant pas la probabilité d'une toxicité majorée liée à l’oxaliplatine, ou non candidats à cette chimiothérapie, traitement par :
- association 5-FU-acide folinique (niveau de la recommandation : grade A) selon le schéma LV5FU2 standard ou simplifié pendant 6 mois (accord d’experts).
- 5-FU oral : capécitabine pendant 6 mois (niveau de la recommandation : grade A).
- Chez certains sujets de plus de 70 ans une chimiothérapie associant fluropyrimidines et oxaliplatine (FOLFOX6m ou CAPOX) peut être une alternative aux fluoropyrimidines seules à discuter au cas par cas (niveau de la recommandation : avis d’experts).
- Génotypage du gène DPYD si phénotype DPD (uracilémie +/- rapport dihydro-uracilémie/uracilémie) anormal (niveau de la recommandation : avis d'experts).
- Il est recommandé de débuter une chimiothérapie adjuvante dans les 8 semaines qui suivent la chirurgie (accord d’experts), sans que cela signifie que passé ce délai, il ne faille pas administrer de chimiothérapie adjuvante. En revanche au-delà du 3ème mois après la chirurgie, la chimiothérapie se discute et elle n’est probablement plus indiquée au-delà de 5 mois (accord d’experts).
- Pour les cancers coliques dMMR/MSI sans traitement néo-adjuvant par immunothérapie, la combinaison FOLFOX 6 mois plus atézolizumab 12 mois doit être discutée au cas par cas en RCP (absence d’AMM et de remboursement) (niveau de la recommandation : grade B).
- Adaptation de la dose d’oxaliplatine en fonction de la masse maigre si patients sarcopéniques (vs la dose standard de 85 mg/m²) (accord d’experts) cf. supra 3.4.6.7.1 Optimisation de la chimiothérapie.
- L’association raltitrexed et oxaliplatine (TOMOX) ou trifluridine/tipiracil et oxaliplatine (TAS-OX) en cas de toxicité cardiaque aux premiers cycles de fluoromyridines ou de déficit complet en DPD est une option après évaluation du bénéfice risque (stade III, surtout à haut risque - T4 ou N2) (niveau de la recommandation : avis d’experts).
ESSAIS CLINIQUES
- PRODIGE 88 - CIRCULATE PAC : « Etude de phase III multicentrique, randomisée, évaluant l’efficacité d’un traitement chez les patients avec ADN tumoral circulant après chirurgie et chimiothérapie adjuvante pour un cancer colorectal de stade III ».
Coordonnateur : J Taïeb (Paris)
PRODIGE 88 CIRCULATE PAC Résumé FR V1.2du 09082023.pdf - PRODIGE 84 - PREMICES : “Neoadjuvant Pembrolizumab with a Watch-and-wait Strategy for Patients with DMMR/MSI-H Localized Colon Cancer” Coordonateur : R Cohen (Paris)
Figure 9
Arbre décisionnel - Cancer du côlon de stade III 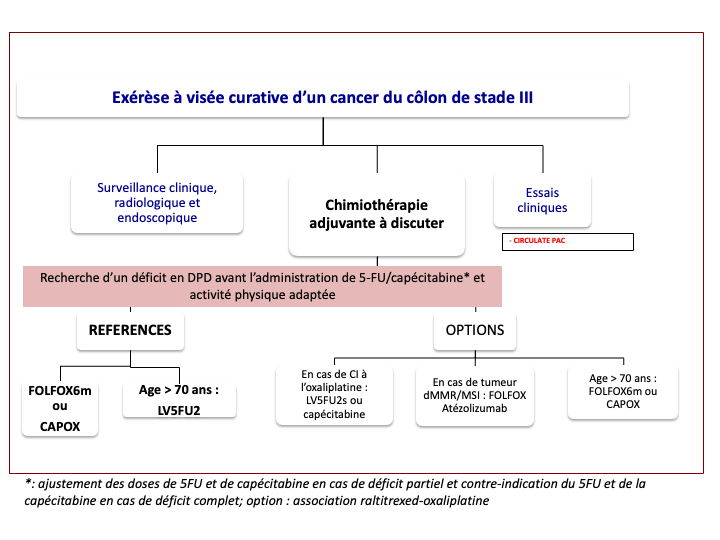
3.4.8. Protocoles de chimiothérapie adjuvante
LLV5FU2 = acide folinique 200 mg/m² (ou l-folinique 100 mg/m²) en 2 h dans 250 ml G 5 %, rincer, puis 5-FU 400 mg/m² en 10 min dans 100 ml de G 5 %, puis 5-FU 1 200 mg/m² en perfusion continue de 44 h dans G 5 % dans infuseur portable (QSP 220 ml, 5 ml/h), pompe ou pousse-seringue portable ; à J2, clamper infuseur de H24 à H26 pour passer AF en 2H et 5-FU bolus idem à J1 ; tous les 14 jours.
LV5FU2 simplifié = acide folinique 400 mg/m² (ou l-folinique 200 mg/m²) en 2 h dans 250 ml G 5 %, rincer puis 5-FU 400 mg/m² en 10 min dans 100 ml de G 5 % puis 5-FU 2400 mg/m² en perfusion continue de 44 h dans G 5 % par infuseur portable (QSP 220 ml, 5 ml/h), pompe ou pousse seringue portable.
FOLFOX4 = oxaliplatine (Eloxatine®) + LV5FU2. Oxaliplatine 85 mg/m² en 2 h dans 250 ml de G 5 % en Y de l’acide folinique au J1 du LV5FU2 ; toutes les 2 semaines (12 cycles).
FOLFOX6 modifié (aussi dénommé FOLFOX4 simplifié) = oxaliplatine (Eloxatine®) + LV5FU2 simplifié. Oxaliplatine 85 mg/m² en 2 h dans 250 ml de G 5 % en Y de l’acide folinique au J1 du LV5FU2 ; toutes les 2 semaines (12 cycles).
CAPOX (aussi dénommé XELOX) = oxaliplatine (Eloxatine®) + capécitabine. Oxaliplatine 130 mg/m² en 2 h dans 250 ml de G 5 % puis capécitabine (Xéloda®) 2000 mg/m²/j (1000 mg/m² matin et soir), 2 semaines sur 3 (J2 à J15) ; toutes les 3 semaines.
Capécitabine (Xéloda®) = 2500 mg/m²/j (1250 mg/m² matin et soir), 2 semaines sur 3 (8 cycles=24 semaines).
TOMOX = raltitrexed (Tomudex ®) + oxaliplatine (Eloxatine ®) = raltitrexed 3 mg/m2 en 15 min dans 250 ml de G 5 % puis 45 minutes après oxaliplatine 130 mg/m2 en 2 h dans 250 ml de G 5 % ; adaptation des doses de raltitrexed à la clairance de la créatinine si < 65 ml/min ; antidote = acide folinique ; toutes les 3 semaines
TAS-OX = oxaliplatine (Eloxatine®) + trifluridine/tipiracil (TAS102, Lonsurf®). Oxaliplatine 85 mg/m² en 2 h dans 250 ml de G 5 % et TAS102 à la dose de 35 mg/m2 deux fois par jour du J1 au J5 ; toutes les 2 semaines (12 cycles).
FOLFOX6 modifié + atézolizumab = oxaliplatine (Eloxatine®) + LV5FU2 simplifié. Oxaliplatine 85 mg/m² en 2 h dans 250 ml de G 5 % en Y de l’acide folinique au J1 du LV5FU2 + atézolizumab 840 mg IV ; toutes les 2 semaines (12 cycles). Puis Atézolizumab 840 mg IV toutes les 2 semaines (12 cycles).
3.5. Surveillance après traitement curatif
Les récidives du cancer du côlon sont principalement métastatiques et surviennent dans environ 80 % des cas durant les 3 premières années qui suivent le traitement curatif [Manfredi et al. 2006]. Environ 25 % des récidives sont accessibles à un traitement à visée curative [Guyot et al. 2005].
Une surveillance clinique, radiologique et endoscopique sera proposée chez les patients capables de supporter une ré-intervention ou une chimiothérapie.
L’ACE est le marqueur biologique utilisable mais sa spécificité est mauvaise et l’impact sur la survie de son dosage répété n’est pas démontré [Jeffery et al. 2019].
L’échographie abdominale reste l’examen ayant le meilleur rapport coût/bénéfice pour le dépistage de métastases hépatiques. La sensibilité de détection voisine de 85 % peut être diminuée par des difficultés d’ordre technique ou par certaines caractéristiques de la tumeur (caractère iso-échogène, taille < 10 mm, situation périphérique, sous capsulaire ou dans le dôme). La spécificité est voisine de 95 %. Elle peut également montrer des adénopathies ou une carcinose péritonéale.
La radiographie de thorax est un examen peu sensible pour la recherche des métastases pulmonaires. Le scanner est plus sensible pour détecter les métastases pulmonaires et hépatiques. Néanmoins il n’y a aucune évidence que l’avance au diagnostic fournie par le scanner se traduit en termes de bénéfice de survie pour les patients.
Les données disponibles reposent sur un nombre limité et hétérogène d’études randomisées avec des résultats discordants. La tendance des résultats rapportés est plutôt en faveur d’une surveillance basée sur la réalisation régulière d’une imagerie hépatique, thoracique et d’un dosage de l’ACE [Chau et al. 2004 ; Rodríguez-Moranta et al. 2006]. La démonstration d’un bénéfice sur la survie globale d’une stratégie de surveillance n’est pas démontrée. Les résultats des études FACS et CEA Watch plaident en faveur d’une stratégie de surveillance plus intensive basée sur le dosage régulier de l’ACE avec un bénéfice en termes de récidives accessibles à un traitement à visée curative [Primrose et al. 2014 ; Verberne et al. 2015]. Cependant la dernière étude publiée ne montre pas de bénéfice en survie globale d’une stratégie de surveillance plus intensive basée sur le dosage régulier de l’ACE et la réalisation de scanners [Wille-Jørgensen et al. 2018].
Les résultats récents de l’essai de phase III PRODIGE 13 sont similaires et ne sont pas en faveur d’un bénéfice d’une stratégie de surveillance « renforcée » par scanner et/ou dosage de l’ACE [Lepage et al. 2022]. Dans cette étude tous les patients bénéficiaient d'un examen clinique tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans. Le design de PRODIGE 13 reposait sur une double randomisation :
La première évaluait une surveillance par "imagerie intensive" (scanner thoraco-abdominopelvien et échographie abdominale en alternance tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans) versus surveillance « standard » (échographie abdominale tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans; radiographie thoracique tous les 6 mois pendant 3 ans puis annuelle pendant 2 ans).
La seconde randomisation évaluait l’intérêt du dosage sanguin de l’ACE tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans, puis annuel versus pas de dosage. Le critère de jugement principal était la survie globale. Au total, 2009 patients ont été inclus (stade II et III respectivement 48 % et 52 %, cancer du rectum 16 %) et le suivi médian était de 7,8 ans. Il n’y avait pas de différence significative de survie globale et de survie sans récidive entre les 4 groupes. Dans le sous-groupe des patients présentant une récidive (21, 6% des cas), le taux de recours à une chirurgie curative était significativement plus important dans les 2 groupes de surveillance intensive, mais sans aucun bénéfice significatif, ni sur le temps jusqu’à récidive, traduisant l’absence d’avance au diagnostic, ni sur la survie globale. Ces résultats confirment ceux obtenus dans l'étude de Northover et al. et ceux de la dernière méta-analyse sur cette question [Nothover, et al. 1994 ; Jeffery et al. 2019].
Le TEP-scan au 18-FDG n’a pas montré son intérêt dans la surveillance systématique des patients non métastatiques après chirurgie à visée curatrice pour cancer colorectal [Sobhani et al. 2018].
Enfin le taux cumulé de récidive métastatique entre 5 et 10 ans après la chirurgie initiale d’un cancer du côlon est très faible de 2,9 % pour récidive locale et de 4,3 % pour les métastases [Bouvier et al. 2015]. Pour les cancers du rectum ces taux sont respectivement de 3,0 % et 3,4 % [Cottet et al, 2015]. Ces taux ne permettent pas de recommander d’étendre la surveillance au-delà de 5 ans.
Les recommandations proposées sont surtout de l’avis d’experts et restent basées sur celles de la conférence de consensus de 1998 [Conférence de consensus. Prévention, dépistage et prise en charge des cancers du côlon. 1998]. Il s’agit d’une surveillance jugée intensive. Cependant, les études de pratiques montrent qu’elles sont peu suivies à l'échelle de la population [Boulin et al. 2005].
3.5.1. Surveillance après résection chirurgicale
REFERENCES
- Examen clinique tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans.
- Échographie abdomino-pelvienne tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans.
- Radiographie de thorax tous les 6 mois pendant 3 ans puis annuel pendant 2 ans.
- Compte tenu des données récentes rapportées, la surveillance de l’ACE, d’intérêt non démontré, n’est plus recommandée (niveau de la recommandation : grade B). En cas d’élévation préopératoire, sa normalisation doit être évaluée par un dosage à réaliser dans le 6 à 8 semaines après la chirurgie. Son élévation persistante indique la persistance d’un reliquat tumoral nécessitant à un bilan morphologique.
Les cancers de stade I ne nécessitent pas de surveillance de récidive à distance.
Les éléments de surveillance cités ci-dessus s’appliquent aux cancers coliques de stades II et III.
Le rythme de la surveillance peut être modulé dans le sens d’un espacement des intervalles de surveillance à tous les 6 mois en cas de stade II à faible risque de récidive (niveau de la recommandation : avis d’experts).
- Coloscopie selon les recommandations de l’ESGE 2019 et 2020 et celles de la SFED 2021 [Hassan et al. 2019 ; Hassan et al. 2020 ; Recommandations SFED 2021 - sous presse] - En cas d’antécédent personnel de cancer colorectal traité par exérèse endoscopique ou chirurgicale :
- si incomplète ou de mauvaise qualité avant l'intervention, coloscopie à faire dans les 6 mois post-opératoires (niveau de la recommandation : grade C) puis à 1 an (niveau de la recommandation : grade B), à 3 ans et à 5 ans, si la coloscopie précédente est normale (niveau de la recommandation : grade C).
- si complète et de bonne qualité en pré-opératoire, elle sera à réaliser à 1 an (niveau de la recommandation : grade B), puis à 3 ans et à 5 ans, si la coloscopie précédente est normale (niveau recommandation : grade C).
- au-delà, en l’absence de syndrome de prédisposition génétique au cancer colorectal, le rythme de surveillance par coloscopie sera fonction :
- * du résultat de la dernière coloscopie
- * de l’espérance de vie du patient du fait de son âge et/ou de co-morbidité
Particularités liées aux syndromes génétiques :
- si syndrome de Lynch : contrôle tous les 1 à 2 ans avec chromoscopie par indigo-carmin à partir de l’âge de 20 ans (recommandation GENMAD 2017).
- si PAF : contrôle endoscopique avec chromo-endoscopie du réservoir après anastomose iléo-anale tous les 2 ans (1 fois par an en cas d’anastomose iléo-rectale) (recommandation GENMAD 2021).
- si polypose MYH : contrôle endoscopique avec chromo-endoscopie annuel du côlon restant (recommandation GENMAD 2009).
Les éléments de surveillance endoscopique cités ci-dessus s’appliquent aux cancers coliques quel que soit leur stade (I, II et III).
OPTIONS
Les éléments de surveillance cités ci-dessus s’appliquent aux cancers coliques de stades II et III (non indiqués pour les cancers coliques de stade I).
- Scanner thoraco-abdominopelvien en remplacement de l’échographie et de la radiographie de thorax en cas de patients peu échogènes ou de risque de récidive élevé (T4 et/ou N2) (avis d’experts).
- TEP scan au 18-FDG : Il est indiqué en cas de suspicion de récidive au scanner ou d’élévation inexpliquée de l’ACE.
3.5.2. Surveillance après résection endoscopique
(Recos ESGE Hassan 2020) (cf. figure 6)
REFERENCES (accord d’experts)
- strong>Tumeurs à très bas risque ganglionnaires (adénocarcinomes intra-muqueux purs (Tis)) : contrôle endoscopique uniquement, à 3 ans si exérèse R0, à 6 mois si exérèse monobloc R1, à 6 et 18 mois si exérèse fragmentée.
- strong>Tumeurs à bas risque ganglionnaires (adénocarcinomes à envahissement sous-muqueux superficiel (sm1 = T1a) lorsque l’invasion sous-muqueuse est inférieure à 1000 microns et qu’aucun critère qualitatif de risque d’invasion ganglionnaire n’est présent) : TDM TAP d’extension en post-résection puis coloscopie à 1 an et 3 ans.
- strong>Tumeurs à haut risque ganglionnaires (en cas de présence d’un cancer T1 avec critères anatomopathologiques péjoratifs à risque d’invasion ganglionnaire) : surveillance oncologique selon les résultats de la chirurgie adjuvante, coloscopie à 1 an et à 3 ans.
3.6. Bibliographie
- Alberts SR, Sargent DJ, Nair S, et al. Effect of oxaliplatin, fluorouracil, and leucovorin with or without cetuximab on survival among patients with resected stage III colon cancer: a randomized trial. JAMA. 2012;307:1383-93.
- Alexander PG, Roseweir AK, Pennel KAF, et al. The Glasgow Microenvironment Score associates with prognosis and adjuvant chemotherapy response in colorectal cancer. Br J Cancer. 2020 Nov 23. Epub ahead of print.
- Allegra CJ, Yothers G, O'Connell MJ, et al. Phase III trial assessing bevacizumab in stages II and III carcinoma of the colon: results of NSABP protocol C-08. J Clin Oncol. 2011;29:11-6.
- Amin MB, Edge S, Green F, et al. (Eds) AJCC Cancer Staging Manual (ed 8th Edition). New York : Springer, 2017.
- André T, Colin P, Louvet C, et al. For the GERCOR Group, Paris France. Bimonthly Regimen of 5-Fluorouracil and Leucovorin (LV5FU2) as Adjuvant Therapy in Stage II and III Côlon Cancer: 4-Year Results of a Randomized Trial. J Clin Oncol. 2003;21:2896-903.
- André T, Boni C, Mounedji-Boudiaf L, et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med. 2004;350:2343-51.
- André T, Quinaux E, Louvet C, et al. Phase III study comparing a semimonthly with a monthly regimen of fluorouracil and leucovorin as adjuvant treatment for stage II and III colon cancer patients: final results of GERCOR C96.1. J Clin Oncol. 2007;25:3732-8.
- André T, Boni C, Navarro M, et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol. 2009;27:3109-16.
- André T, de Gramont A, Vernerey D, et al. Adjuvant Fluorouracil, Leucovorin, and Oxaliplatin in Stage II to III Colon Cancer: Updated 10-Year Survival and Outcomes According to BRAF Mutation and Mismatch Repair Status of the MOSAIC Study. J Clin Oncol. 2015;33:4176-87.
- André T, Vernerey D, Mineur L, et al. Three Versus 6 Months of Oxaliplatin-Based Adjuvant Chemotherapy for Patients With Stage III Colon Cancer: Disease-Free Survival Results From a Randomized, Open-Label, International Duration Evaluation of Adjuvant (IDEA) France, Phase III Trial. J Clin Oncol. 2018;36:1469-77
- André T, Shiu KK, Kim TW, et al. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med. 2020;383:2207-18.
- André T, Vernerey D, Im SA, et al, Bevacizumab as adjuvant treatment of colon cancer: updated results from the S-AVANT phase III study by the GERCOR Group., Ann Oncol, 2020;31:246-56.
- André T, Meyerhardt J, Iveson T, et al. Effect of duration of adjuvant chemotherapy for patients with stage III colon cancer (IDEA collaboration): final results from a prospective, pooled analysis of six randomised, phase 3 trials. Lancet Oncol. 2020;21:1620-9.
- Aparicio T, Schischmanoff O, Poupardin C, et al. Deficient mismatch repair phenotype is a prognostic factor for colorectal cancer in elderly patients. Dig Liver Dis. 2013;45:245-50.
- Aparicio T, Francois E, Cristol-Dalstein L, et al. PRODIGE 34-FFCD 1402-ADAGE: Adjuvant chemotherapy in elderly patients with resected stage III colon cancer: A randomized phase 3 trial. Dig Liver Dis. 2016;48:206-7.
- Aparicio T, Bouché O, Etienne PL et al. Preliminary tolerance analysis of adjuvant chemotherapy in older patients after resection of stage III colon cancer from the PRODIGE 34-FFCD randomized trial. Dig Liver Dis. 2023 Apr;55(4):541-548.
- Assenat E, Ben Abdelghani M, Gourgou S et al. Impact of lean body mass-based oxaliplatin dosage on neurotoxicity in adjuvant treatment of stage III colorectal cancer: Final results of the phase II randomized multicenter LEANOX trial. Ann Oncol. 2024 Sept,35:S431 (ESMO 2024).
- Balthazar EJ, Megibow AJ, Hulnick D, Naidich DP. Carcinoma of the colon: detection and preoperative staging by CT. AJR Am J Roentgenol. 1988;150:301-6.
- Barin-Le Guellec C, Lafay-Chebassier C, Ingrand I, et al. Toxicities associated with chemotherapy regimens containing a fluoropyrimidine: A real-life evaluation in France. Eur J Cancer. 2020;124:37-46.
- Basile D, Broudin C, Emile JF et al; for PRODIGE investigators, GERCOR, Fédération Française de Cancerologie Digestive, and UNICANCER. Tumor budding is an independent prognostic factor in stage III colon cancer patients: a post-hoc analysis of the IDEA-France phase III trial (PRODIGE-GERCOR). Ann Oncol. 2022;33(6):628-637.
- Bertagnolli MM, Redston M, Compton CC, et al. Microsatellite instability and loss of heterozygosity at chromosomal location 18q: prospective evaluation of biomarkers for stages II and III colon cancer--a study of CALGB 9581 and 89803. J Clin Oncol. 2011;29:3153-62.
- Blons H, Emile JF, LeMalicot K, et al. Prognostic value of KRAS mutations in stage III colon cancer: post hoc analysis of the PETACC8 phase III trial dataset. Ann Oncol. 2014;25:2378-85.
- Boisdron-Celle M, Remaud G, Traore S, et al. 5-Fluorouracil-related severe toxicity: a comparison of different methods for the pretherapeutic detection of dihydropyrimidine dehydrogenase deficiency. Cancer Lett. 2007;249:271-82.
- Boisdron-Celle M, Capitain O, Faroux R, et al. Prevention of 5-fluorouracil-induced early severe toxicity by pre-therapeutic dihydropyrimidine dehydrogenase deficiency screening: Assessment of a multiparametric approach. Semin Oncol. 2017;44:13-23.
- Boland CR, Goel A. Microsatellite instability in colorectal cancer. Gastroenterology. 2010;138:2073-87.
- Bosch SL, Teerenstra S, de Wilt JH, et al. Predicting lymph node metastasis in pT1 colorectal cancer: a systematic review of risk factors providing rationale for therapy decisions. Endoscopy. 2013;45:827-34.
- Boulin M, Lejeune C, Le Teuff G, et al. Patterns of surveillance practices after curative surgery for colorectal cancer in a French population. Dis Colon Rectum. 2005;48:1890-9.
- Bouvier AM, Launoy G, Bouvier V, et al. Incidence and patterns of late recurrences in colon cancer patients. Int J Cancer 2015;137:2133-8.
- Brown JC, Ma C, Shi Q, et al. Physical Activity in Stage III Colon Cancer: CALGB/SWOG 80702 (Alliance). J Clin Oncol. 2022 Aug 9:JCO2200171.
- Brule C, Pioche M, Albouys J, et al. The COlorectal NEoplasia Endoscopic Classification to Choose the Treatment classification for identification of large laterally spreading lesions lacking submucosal carcinomas: A prospective study of 663 lesions. United European Gastroenterol J. 2022;10:80-92.
- Bruzzi M, Auclin E, Lo Dico R, et al. Influence of Molecular Status on Recurrence Site in Patients Treated for a Stage III Colon Cancer: a Post Hoc Analysis of the PETACC-8 Trial. Ann Surg Oncol. 2019;26:3561-67.
- Cappellesso R, Luchini C, Veronese N, et al. Tumor budding as a risk factor for nodal metastasis in pT1 colorectal cancers: a meta-analysis. Hum Pathol. 2017;65:62-70.
- Cercek A, Lumish M, Sinopoli J, et al. PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med. 2022 Jun 23;386:2363-2376.
- Chalabi M, Fanchi LF, Dijkstra KK, et al. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med. 2020 Apr;26:566-576.
- Chang HJ, Lee KW, Kim JH, et al. Adjuvant capecitabine chemotherapy using a tailored dose strategy in elderly patients with colon cancer. Annals of Oncology. 2012;23:911–18.
- Chau I, Allen MJ, Cunningham D, et al. The value of routine serum carcino-embryonic antigen measurement and computed tomography in the surveillance of patients after adjuvant chemotherapy for colorectal cancer. J Clin Oncol. 2004;22:1420-9.
- Cohen R, Shi Q, Meyers J, et al. Combining tumor deposits with the number of lymph node metastases to improve the prognostic accuracy in stage III colon cancer: a post hoc analysis of the CALGB/SWOG 80702 phase III study (Alliance). Ann Oncol. 2021;32:1267-1275.
- Conférence de Consensus. Conclusions et recommandations du jury. Texte de Consensus. Prévention, dépistage et prise en charge des cancers du côlon. Gastroenterol Clin Biol. 1998;22:S275-88.
- Cortet M, Grimault A, Cheynel N, et al. Patterns of recurrence of obstructing colon cancers after surgery for cure: a population-based study. Colorectal Dis. 2013;15:1100-6.
- Cottet V, Bouvier V, Rollot F, et al. Incidence and patterns of late recurrences in rectal cancer patients. Ann Surg Oncol 2015;22:520-7.
- Daisio RB, Beavers T, Carpenter JT. Familial deficiency of dihydropyrimidine dehydrogenase. Biochemical basis for familial pyridinemia and severe 5-fluorouracil-induced toxicity. J Clin Invest. 1988;81:47-51.
- Dalerba P, Sahoo D, Paik S, et al. CDX2 as a Prognostic Biomarker in Stage II and Stage III Colon Cancer. N Engl J Med. 2016;374:211-22.
- de Gramont A, Van Cutsem E, Schmoll HJ, et al. Bevacizumab plus oxaliplatin-based chemotherapy as adjuvant treatment for colon cancer (AVANT): a phase 3 randomised controlled trial. Lancet Oncol. 2012;13:1225-33.
- Defossez G, Le Guyader‑Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Volume 1 – Tumeurs Solides. 372 p. Saint‑Maurice : Santé publique France, 2019.
- Delattre JF, Cohen R, Henriques J, et al. Prognostic Value of Tumor Deposits for Disease-Free Survival in Patients With Stage III Colon Cancer: A Post Hoc Analysis of the IDEA France Phase III Trial (PRODIGE-GERCOR). J Clin Oncol. 2020;38:1702-10.
- Des Guetz G, Nicolas P, Perret GY, et al. Does delaying adjuvant chemotherapy after curative surgery for colorectal cancer impair survival? A meta-analysis. Eur J Cancer. 2010;46:1049-55.
- den Uil SH, de Wit M, Slebos RJC, et al. Quantitative analysis of CDX2 protein expression improves its clinical utility as a prognostic biomarker in stage II and III colon cancer. Eur J Cancer. 2020;144:91-100.
- Derangère V, Lecuelle J, Lepage C, et al. Combination of CDX2 H-score quantitative analysis with CD3 AI-guided analysis identifies patients with a good prognosis only in stage III colon cancer. Eur J Cancer. 2022;172:221-230.
- Dienstmann R, Vermeulen L, Guinney J, et al. Consensus molecular subtypes and the evolution of precision medicine in colorectal cancer. Nat Rev Cancer. 2017;17:79-92.
- Domingo E, Church DN, Sieber O, et al. Evaluation of PIK3CA Mutation As a Predictor of Benefit From Nonsteroidal Anti-Inflammatory Drug Therapy in Colorectal Cancer. J Clin Oncol. 2013;31:4297-305.
- Erlichman C, Marsoni S, Seitz JF, et al. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators. Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. J Clin Oncol. 1999;17:1356-63.
- Fabritius M, Gonzalez JM, Becq A, et al. A simplified table using validated diagnostic criteria is effective to improve characterization of colorectal polyps: the CONECCT teaching program. Endosc Int Open. 2019;7:E1197-E1206.
- Fan G, Zhang K, Yang X, et al. Prognostic value of circulating tumor DNA in patients with colon cancer: Systematic review. PLoS ONE 2017;12:e0171991.
- Ferlitsch M, Moss A, Hassan C, et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2017;49:270-97.
- Fiche Pratique : Conduite à tenir après polypectomie ou mucosectomie rectocolique selon le résultat de l’analyse d’anatomie pathologique. Acta Endosc 2011;41:185-9.
- Figueredo A, Charette ML, Maroun J, et al. Adjuvant therapy for stage II colon cancer: a systematic review from the Cancer Care Ontario Program in Evidence-Based Care’s Gastrointestinal Cancer Disease Site Group. J Clin Oncol 2004; 22:3395-407.
- Fleming CA, O'Leary DP, Wang J, Redmond HP. Association of Observed Perioperative Cell-Free DNA Dynamics With Early Recurrence in Patients With Colon Cancer. JAMA Surg. 2020;155:168-70.
- Francini G, Petrioli R, Lorenzini L, et al. Folinic acid and 5-fluorouracil as adjuvant chemotherapy in colon cancer. Gastroenterology 1994;106:899-906.
- Gill S, Loprinzi CL, Sargent DJ, et al. Pooled analysis of fluorouracil- based adjuvant therapy for stage II and III colon cancer: who benefits and by how much? J Clin Oncol. 2004; 22:1797-806.
- Goel A, Nagasaka T, Hamelin R, Boland CR. An optimized pentaplex PCR for detecting DNA mismatch repair-deficient colorectal cancers. PLoS One. 2010;5:e9393. Erratum in: PLoS One. 2010;5(3).
- Gönen M, Schrag D, Weiser MR. Nodal staging score: a tool to assess adequate staging of node-negative colon cancer. J Clin Oncol. 2009;27:6166-71.
- Goéré D, Glehen O, Quenet F, et al. Second-look surgery plus hyperthermic intraperitoneal chemotherapy versus surveillance in patients at high risk of developing colorectal peritoneal metastases (PROPHYLOCHIP-PRODIGE15): a randomised, phase 3 study. Lancet Oncol. 2020;21:1147-54.
- Gravalos C, Salut A, García-Girón C, et al. A randomized phase II study to compare oxaliplatin plus 5-fluorouracil and leucovorin (FOLFOX4) versus oxaliplatin plus raltitrexed (TOMOX) as first-line chemotherapy for advanced colorectal cancer. Clin Transl Oncol. 2012;14:606-12.
- Gray RG, Quirke P, Handley K, et al. Validation study of a quantitative multigene reverse transcriptase-polymerase chain reaction assay for assessment of recurrence risk in patients with stage II colon cancer. J Clin Oncol. 2011;29:4611-9.
- Grothey A, Sobrero AF, Shields AF, et al. Duration of adjuvant chemotherapy for stage III colon cancer. N Engl J Med. 2018;378:1177-88.
- Guinney J, Dienstmann R, Wang X, et al. The consensus molecular subtypes of colorectal cancer. Nat Med. 2015;21:1350-6.
- Gunderson LL, Jessup JM, Sargent DJ, et al. Revised TN categorization for colon cancer based on national survival outcomes data. J Clin Oncol. 2010;28:264-71.
- Guyot F, Faivre J, Manfredi S, et al. Time trends in the treatment and survival of recurrences from colorectal cancer. Ann Oncol. 2005;16:756-61.
- Haller DG, Catalano PJ, Macdonald JS, et al. Phase III study of fluorouracil, leucovorin, and levamisol in high-risk stage II and III colon cancer: final report of Intergroup 0089. J Clin Oncol. 2005;23:8671-8.
- Haller DG, Tabernero J, Maroun J, et al. Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid asadjuvant therapy for stage III colon cancer. J Clin Oncol. 2011;29:1465-71.
- Haller DG, O'Connell MJ, Cartwright TH, et al. Impact of age and medical comorbidity on adjuvant treatment outcomes for stage III colon cancer: a pooled analysis of individual patient data from four randomized, controlled trials. Ann Oncol. 2015;26:715-24.
- Hassan C, Wysocki PT, Fuccio L, et al. Endoscopic surveillance after surgical or endoscopic resection for colorectal cancer: European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Digestive Oncology (ESDO) Guideline. Endoscopy. 2019;51:266-77.
- Hassan C, Antonelli G, Dumonceau JM, et al. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy. 2020;52:687-700.
- Haydon AM, Macinnis RJ, English DR, Giles GG. Effect of physical activity and body size on survival after diagnosis with colorectal cancer. Gut. 2006;55:62-7.
- Henricks LM, Lunenburg CATC, de Man FM, et al. DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol. 2018;19:1459-67.
- Hu H, Kang L, Zhang J, et al. Neoadjuvant PD-1 blockade with toripalimab, with or without celecoxib, in mismatch repair-deficient or microsatellite instability-high, locally advanced, colorectal cancer (PICC): a single-centre, parallel-group, non-comparative, randomised, phase 2 trial. Lancet Gastroenterol Hepatol. 2022 Jan;7:38-48.
- Imai K, Hotta K, Ito S, et al. Tip-in Endoscopic Mucosal Resection for 15- to 25-mm Colorectal Adenomas: A Single-Center, Randomized Controlled Trial (STAR Trial). Am J Gastroenterol. 2021;116:1398-1405.
- IMPACT investigators. Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. Lancet 1995;345:939-44.
- Iveson TJ, Kerr RS, Saunders MP, et al. 3 versus 6 months of adjuvant oxaliplatin-fluoropyrimidine combination therapy for colorectal cancer (SCOT): an international, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2018;19:562-78.
- Iveson T, Sobrero AF, Yoshino T, et al: Prospective pooled analysis of four randomized trials investigating duration of adjuvant oxaliplatin-based therapy (3 vs 6 months) for patients with high-risk stage II colorectal cancer. J Clin Oncol. 2019;37(suppl.15):Abstract 3501.
- Iwatate M, Sano Y, Tanaka S, et al; Japan NBI Expert Team (JNET). Validation study for development of the Japan NBI Expert Team classification of colorectal lesions. Dig Endosc. 2018;30:642-651.
- Jeffery M, Hickey BE, Hider PN. Follow-up strategies for patients treated for non-metastatic colorectal cancer. Cochrane Database Syst Rev. 2019;9:CD002200.
- Kamiński MF, Hassan C, Bisschops R, et al. Advanced imaging for detection and differentiation of colorectal neoplasia: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2014;46:435-49.
- Karoui M, Rullier A, Piessen G, et al. Perioperative FOLFOX 4 Versus FOLFOX4 Plus Cetuximab Versus Immediate Surgery for High-Risk Stage II and III Colon Cancers: A Phase II Multicenter Randomized Controlled Trial (PRODIGE 22). Ann Surg. 2020;271:637-45.
- Kerr D, Gray R, Quirke P, et al. A quantitative multi-gene RT-PCR assay for prediction of recurrence in stage II colon cancer: Selection of the genes in 4 large studies and results of the independent, prospectively-designed QUASAR validation study. J Clin Oncol. 2009;27(suppl.15): Abstract 4000.
- Kim GP, Colangelo LH, Wieand HS, et al. Prognostic and predictive roles of high-degree microsatellite instability in colon cancer: a National Cancer Institute-National Surgical Adjuvant Breast and Bowel Project Collaborative Study. J Clin Oncol. 2007;25:767-72.
- Kim YW, Choi EH, Kim BR et al. The impact of delayed commencement of adjuvant chemotherapy (eight or more weeks) on survival in stage II and III colon cancer: a national population-based cohort study. Oncotarget. 2017;8:80061–72.
- Klaver CEL, Wisselink DD, Punt CJA, Snaebjornsson P, Crezee J, Aalbers AGJ, et al. Adjuvant hyperthermic intraperitoneal chemotherapy in patients with locally advanced colon cancer (COLOPEC): a multicentre, open-label, randomised trial. Lancet Gastroenterol Hepatol. 2019;4:761-70.
- Klingbiel D, Saridaki Z, Roth AD, et al. Prognosis of stage II and III colon cancer treated with adjuvant 5-fluorouracil or FOLFIRI in relation to microsatellite status: results of the PETACC-3 trial. Ann Oncol. 2015;26:126-32.
- Köhne CH, Bedenne L, Carrato A, et al. A randomised phase III intergroup trial comparing high-dose infusional 5-fluorouracil with or without folinic acid with standard bolus 5-fluorouracil/folinic acid in the adjuvant treatment of stage III colon cancer: the Pan-European Trial in Adjuvant Colon Cancer 2 study. Eur J Cancer. 2013;49:1868-75.
- Kopetz S, Grothey A, Yaeger R, et al. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med. 2019;381:1632-43.
- Kopetz S, Grothey A, Van Cutsem E, et. Encorafenib plus cetuximab with or without binimetinib for BRAF V600E-mutant metastatic colorectal cancer: Quality-of-life results from a randomized, three-arm, phase III study versus the choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC). J Clin Oncol. 2020 ;38 (suppl):4039-4039.
- Kothari N, Kim R, Jorissen RN, et al. Impact of regular aspirin use on overall and cancer-specific survival in patients with colorectal cancer harboring a PIK3CA mutation. Acta Oncol. 2015;54:487-92.
- Kuebler JP, Wieand HS, O'Connell MJ, et al. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP C-07. J Clin Oncol. 2007;25:2198-204.
- Lapeyre-Prost A, Hug de Larauze M, Chibaudel B, et al. Feasibility of Capecitabine and Oxaliplatin Combination Chemotherapy Without Central Venous Access Device in Patients With Stage III Colorectal Cancer. Clin Colorectal Cancer. 2016;15:250-6.
- Le Voyer TE, Sigurdson ER, Hanlon AL, et al. Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of Intergroup Trial INT-0089. J Clin Oncol. 2003; 21:2912-2919.
- Lecomte T, Berger A, Zinzindohoué F, et al. Detection of free-circulating tumor-associated DNA in plasma of colorectal cancer patients and its association with prognosis. Int. J. Cancer 2002, 100, 542–8.
- Lee AM, Shi Q, Pavey E, et al. DPYD variants as predictors of 5-fluorouracil toxicity in adjuvant colon cancer treatment (NCCTG N0147). J Natl Cancer Inst. 2014;106(12). pii: dju298. doi: 10.1093/jnci/dju298.
- Lepage C, Phelip JM, Cany L, et al. Prognostic effect of imaging and CEA follow-up in resected colorectal cancer (CRC): Final results and relapse free survival (RFS) - PRODIGE 13 a FFCD phase III trial. Ann Oncol (2022) 33 (suppl_7): S808-S869. 10.1016/annonc/annonc1089
- Li H, Fu G, Wei W, et al. Re-Evaluation of the Survival Paradox Between Stage IIB/IIC and Stage IIIA Colon Cancer. Front Oncol. 2020;10:595107.
- Liao X, Lochhead P, Nishihara R, et al. Aspirin use, tumor PIK3CA mutation, and colorectal-cancer survival. N Engl J Med. 2012 ;367:1596-606.
- Loprinzi CL, Qin R, Dakhil SR, et al. Phase III randomized, placebo-controlled, double-blind study of intravenous calcium and magnesium to prevent oxaliplatin-induced sensory neurotoxicity (N08CB/Alliance). J Clin Oncol. 2014;32:997-1005.
- Loriot MA, Ciccolini J, Thomas F, et al. Dépistage du déficit en dihydropyrimidine déshydrogénase (DPD) et sécurisation des chimiothérapies à base de fluoropyrimidines : mise au point et recommandations nationales du GPCO-Unicancer et du RNPGx [Dihydropyrimidine déhydrogenase (DPD) deficiency screening and securing of fluoropyrimidine-based chemotherapies: Update and recommendations of the French GPCO-Unicancer and RNPGx networks]. Bull Cancer. 2018;105:397-407.
- Lugli A, Zlobec I, Berger MD, et al. Tumour budding in solid cancers. Nat Rev Clin Oncol. 2021;18:101-115.
- Maggard MA, Yermilov I, Tomlinson JS, Ko CY. Are 12 nodes needed to accurately stage T1 and T2 colon cancers? Dig Dis Sci. 2009;54:640-7.
- Mamounas E, Wieand S, Wolmark N, et al. Comparative efficacy of adjuvant chemotherapy in patients with Dukes' B versus Dukes' C colon cancer: Results from four National Surgical Adjuvant Breast and Bowel Project adjuvant studies (C-01, C-02, C-03, and C-04). J Clin Oncol.1999;17:1349-55.
- Manceau G, Alves A, Meillat H, et al. What Is the Optimal Elective Colectomy for Splenic Flexure Cancer: End of the Debate? A Multicenter Study From the GRECCAR Group With a Propensity Score Analysis. Dis Colon Rectum. 2022;65:55-65.
- Manfredi S, Bouvier AM, Lepage C, et al. Incidence and patterns of recurrence after resection for cure of colonic cancer in a well defined population. Br J Surg. 2006;93:1115-22.
- Marisa L, Ayadi M, Balogoun R, et al. Clinical utility of colon cancer molecular subtypes: validation of two main colorectal molecular classifications on the PETACC-8 phase III trial cohort. J Clin Oncol. 2017;35(suppl):abstr 3509.
- Mayer B, Sander S, Paschke S, et al. Stratified Survival Analysis After Adjuvant Chemotherapy of Colon Cancer Reveals a Benefit for Older Patients. Anticancer Res. 2015;35:5587-93.
- McCleary NJ, Meyerhardt JA, Green E, et al. Impact of age on the efficacy of newer adjuvant therapies in patients with stage II/III colon cancer: findings from the ACCENT database. J Clin Oncol. 2013;31:2600-6.
- Mescoli C, Albertoni L, Pucciarelli S, et al. Isolated tumor cells in regional lymph nodes as relapse predictors in stage I and II colorectal cancer. J Clin Oncol. 2012;30:965-71.
- Meta-Analysis Group of the Japanese Society for Cancer of the Colon and Rectum and the Meta-Analysis Group in Cancer. Efficacy of oral adjuvant therapy after resection of colorectal cancer: 5-year results from three randomized trials. J Clin Oncol. 2004;22:484-92.
- Meulendijks D, Henricks LM, Sonke GS, et al. Clinical relevance of DPYD variants c.1679T>G, c.1236G>A/HapB3, and c.1601G>A as predictors of severe fluoropyrimidine associated toxicity: a systematic review and meta-analysis of individual patient data. Lancet Oncol. 2015;16:1639-50.
- Meyerhardt JA, Heseltine D, Niedzwiecki D, et al. Impact of physical activity on cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803. J Clin Oncol. 2006;24:3535-41.
- Meyerhardt JA, Giovannucci EL, Holmes MD, et al. Physical activity and survival after colorectal cancer diagnosis. J Clin Oncol. 2006;24:3527-34.
- Michel P, Boige V, Andre T, et al. Aspirin versus placebo in stage III or high-risk stage II colon cancer with PIK3CA mutation: A French randomised double-blind phase III trial (PRODIGE 50-ASPIK). Dig Liver Dis. 2018;50:305-307.
- Mlecnik B, Bifulco C, Bindea G, et al. Multicenter International Society for Immunotherapy of Cancer Study of the Consensus Immunoscore for the Prediction of Survival and Response to Chemotherapy in Stage III Colon Cancer. J Clin Oncol. 2020;38:3638-51.
- Monahan KJ, Bradshaw N, Dolwani S, et al. Hereditary CRC guidelines eDelphi consensus group. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/UnitedKingdom Cancer Genetics Group (UKCGG). Gut. 2020;69:411-44.
- Moertel CG, Fleming TR, Mac Donald JS, et al. Levamisole and fluorouracil for adjuvant therapy of resected colon carcinoma. N Engl J Med 1990;322:352-8.
- Morton D, Seymour M, Magill L,et al. FOxTROT Collaborative Group. Preoperative Chemotherapy for Operable Colon Cancer: Mature Results of an International Randomized Controlled Trial. J Clin Oncol. 2023;41:1541-1552.
- Mur P, García-Mulero S, Del Valle J, et al. Role of POLE and POLD1 in familial cancer. Genet Med. 2020;22:2089-2100.
- Nagtegaal ID, Knijn N, Hugen N, et al. Tumor Deposits in Colorectal Cancer: Improving the Value of Modern Staging-A Systematic Review and Meta-Analysis. J Clin Oncol Off J Am Soc Clin Oncol 2017;35:1119–27.
- Neuzillet C, Anota A, Foucaut AM, et al. Nutrition and physical activity: French intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, AFC, SFP-APA, SFNCM, AFSOS). BMJ Support Palliat Care. 2020:bmjspcare-2020-002751.
- Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomized controlled trial. Lancet. 2008;371:1007-16.
- Northover J, Houghton J, Lennon T. CEA to Detect Recurrence of Colon-Cancer. JAMA. 1994;272:31-31.
- O'Connell MJ, Mailliard JA, Kahn MJ, et al. Controlled trial of fluorouracil and low-dose leucovorin given for 6 months as postoperative adjuvant therapy for colon cancer. J Clin Oncol. 1997;15:246-50.
- Olschwang S, Bonaïti C, Feingold J, et al. [Identification and management of HNPCC syndrome (hereditary non polyposis colon cancer), hereditary predisposition to colorectal and endometrial adenocarcinomas]. Bull Cancer. 2004;91:303-15.
- Pagès F, Kirilovsky A, Mlecnik B, et al. In situ cytotoxic and memory T cells predict outcome in patients with early-stage colorectal cancer. J Clin Oncol. 2009;27:5944-51.
- Pagès F, Mlecnik B, Marliot F, et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 2018;391:2128-39.
- Pagès F, André T, Taieb J, et al. Prognostic and predictive value of the Immunoscore in stage III colon cancer patients treated with oxaliplatin in the prospective IDEA France PRODIGE-GERCOR cohort study. Ann Oncol. 2020;31:921-9.
- Paleari L, Puntoni M, Clavarezza M, et al. PIK3CA Mutation, Aspirin Use after Diagnosis and Survival of Colorectal Cancer. A Systematic Review and Meta-analysis of Epidemiological Studies. Clin Oncol (R CollRadiol). 2015. pii: S0936-6555(15)00443-4.
- Pallet N, Hamdane S, Garinet S, et al. A comprehensive population-based study comparing the phenotype and genotype in a pretherapeutic screen of dihydropyrimidine dehydrogenase deficiency. Br J Cancer. 2020;123:811-8.
- Parc Y, Gueroult S, Mourra N, et al. Prognostic significance of microsatellite instability determined by immunohistochemical staining of MSH2 and MLH1 in sporadic T3N0M0 colon cancer. Gut. 2004; 53:371-75.
- Petrelli F, Rulli E, Labianca R, et al. Overall survival with 3 or 6 months of adjuvant chemotherapy in Italian TOSCA phase 3 randomised trial. Ann Oncol. 2021;32:66-76.
- Petrelli F, Labianca R, Zaniboni A, et al. Assessment of Duration and Effects of 3 vs 6 Months of Adjuvant Chemotherapy in High-Risk Stage II Colorectal Cancer: A Subgroup Analysis of the TOSCA Randomized Clinical Trial. JAMA Oncol. 2020;6:547-51.
- Phipps AI, Shi Q, Zemla TJ, et al. Physical Activity and Outcomes in Patients with Stage III Colon Cancer: A Correlative Analysis of Phase III Trial NCCTG N0147 (Alliance). Cancer Epidemiol Biomarkers Prev. 2018;27:696-703.
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2015;47:829-54.
- Pimentel-Nunes P, Libânio D, Bastiaansen BAJ, et al. Endoscopic submucosal dissection for superficial gastrointestinal lesions: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2022. Endoscopy. 2022;54:591-622.
- Pinto A, Eveno C, Pocard M. Update on clinical trials in colorectal cancer peritoneal metastasis. Int J Hyperthermia. 2017;33:543-47.
- Pinto D, Pinto C, Guerra J, et al. Contribution of MLH1 constitutional methylation for Lynch syndrome diagnosis in patients with tumor MLH1 downregulation. Cancer Med. 2018;7:433-444.
- Place des prothèses coliques dans la stratégie thérapeutique du cancer colorectal. Recommandations françaises sous l’égide de la commission endoscopie et cancer de la Société française d’endoscopie digestive (SFED) et de la Fédération francophone de cancérologie digestive (FFCD). Acta Endosc. 2014;44:208-18.
- Popov I, Carrato A, Sobrero A, et al. Raltitrexed (Tomudex) versus standard leucovorin-modulated bolus 5-fluorouracil: Results from the randomized phase III Pan-European Trial in Adjuvant Colon Cancer 01 (PETACC-1). Eur J Cancer. 2008;44:2204-11.
- Primrose JN, Perera R, Gray A, et al. Effect of 3 to 5 years of scheduled CEA and CT follow-up to detect recurrence of colorectal cancer: the FACS randomized clinical trial. JAMA. 2014;311:263-70.
- Prise en charge thérapeutique des métastases hépatiques des cancers colorectaux. Recommandations pour la pratique clinique. Gastroenterol Clin Biol. 2003; 27,HS2:B14-B15.
- QUASAR Collaborative Group. Comparison on fluorouracil with additional levamisole, higher-dose folinic acid, or both, as adjuvant chemotherapy for colorectal cancer: a randomised trial. Lancet. 2000;355:1588-1596.
- Quasar Collaborative Group, Gray R, Barnwell J, McConkey C, Hills RK, Williams NS, Kerr DJ. Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study. Lancet. 2007;370:2020-29.
- Reichling C, Taieb J, Derangere V, et al. Artificial intelligence-guided tissue analysis combined with immune infiltrate assessment predicts stage III colon cancer outcomes in PETACC08 study. Gut. 2020;69:681-90.
- Reinert T, Henriksen TV, Christensen E, et al. Analysis of Plasma Cell-Free DNA by Ultradeep Sequencing in Patients With Stages I to III Colorectal Cancer. JAMA Oncol. 2019;5:1124-31.
- Ribic CM, Sargent DJ, Moore MJ, et al. Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med. 2003; 349:247-257.
- Roth AD, Delorenzi M, Tejpar S, et al. Integrated analysis of molecular and clinical prognostic factors in stage II/III colon cancer. J Natl Cancer Inst. 2012;104:1635-46.
- Rodríguez-Moranta F, Saló J, Arcusa A, et al. Postoperative surveillance in patients with colorectal cancer who have undergone curative resection: a prospective, multicenter, randomized, controlled trial. J Clin Oncol. 2006;24:386-93.
- Rollvén E, Abraham-Nordling M, Holm T, Blomqvist L. Assessment and diagnostic accuracy of lymph node status to predict stage III colon cancer using computed tomography. Cancer Imaging. 2017 Jan 19;17:3.
- Saltz LB, Niedzwiecki D, Hollis D, et al. Irinotecan fluorouracil plus leucovorin is not superior to fluorouracil plus leucovorin alone as adjuvant treatment for stage III colon cancer: results of CALGB 89803. J Clin Oncol. 2007;25:3456-61.
- Sanoff HK, Carpenter WR, Stürmer T, et al. Effect of adjuvant chemotherapy on survival of patients with stage III colon cancer diagnosed after age 75 years. J Clin Oncol. 2012;30:2624-34.
- Sargent DJ, Goldberg RM, Jacobson SD, et al. A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. N Engl J Med. 2001;345:1091-7.
- Sargent DJ, Marsoni S, Monges G, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol. 2010;28:3219-26.
- Schmoll HJ, Twelves C, Sun W, et al. Effect of adjuvant capecitabine or fluorouracil, with or without oxaliplatin, on survival outcomes in stage III colon cancer and the effect of oxaliplatin on post-relapse survival: a pooled analysis of individual patient data from four randomised controlled trials. Lancet Oncol. 2014;15:1481-92.
- Schmoll HJ, Tabernero J, Maroun J, et al. Capecitabine Plus Oxaliplatin Compared With Fluorouracil/Folinic Acid As Adjuvant Therapy for Stage III Colon Cancer: Final Results of the NO16968 Randomized Controlled Phase III Trial. J Clin Oncol. 2015;33:3733-40.
- Shah MA, Renfro LA, Allegra CJ, et al. Impact of Patient Factors on Recurrence Risk and Time Dependency of Oxaliplatin Benefit in Patients With Colon Cancer: Analysis From Modern-Era Adjuvant Studies in the Adjuvant Colon Cancer End Points (ACCENT) Database. J Clin Oncol. 2016;34:843-53.
- Shaib WL, Zakka KM, Jiang R, et al. Survival outcome of adjuvant chemotherapy in deficient mismatch repair stage III colon cancer. Cancer. 2020;126:4136-47.
- Sinicrope FA, Shi Q, Smyrk TC, et al. Molecular markers identify subtypes of stage III colon cancer associated with patient outcomes. Gastroenterology. 2015;148:88-99.
- Sobhani I, Itti E, Luciani A, et al. Colorectal cancer (CRC) monitoring by 6-monthly 18FDG-PET/CT: an open-label multicentre randomised trial. Ann Oncol. 2018;29:931-37
- Sobrero A, Lonardi S, Rosati G, et al. FOLFOX or CAPOX in Stage II to III Colon Cancer: Efficacy Results of the Italian Three or Six Colon Adjuvant Trial. J Clin Oncol. 2018;36:1478-85.
- Sobrero AF, Puccini A, Shi Q, et al. A new prognostic and predictive tool for shared decision making in stage III colon cancer. Eur J Cancer. 2020;138:182-8.
- Soubeyran P, Bellera C, Goyard J, et al. Screening for vulnerability in older cancer patients: the ONCODAGE Prospective Multicenter Cohort Study. PLoS One. 2014;9:e115060.
- Stoffel EM, Mangu PB, Gruber SB, et al. Hereditary colorectal cancer syndromes: American Society of Clinical Oncology Clinical Practice Guideline endorsement of the familial risk-colorectal cancer: European Society for Medical Oncology Clinical Practice Guidelines. J Clin Oncol. 2015;33:209-17.
- Syngal S, Brand RE, Church JM, et al. ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015;110:223-62.
- Taïeb J, Tabernero J, Mini E, et al. Oxaliplatin, fluorouracil, and leucovorin with or without cetuximab in patients with resected stage III colon cancer (PETACC-8): an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15:862-73.
- Taïeb J, Zaanan A, Le Malicot K, et al. Prognostic Effect of BRAF and KRAS Mutations in Patients With Stage III Colon Cancer Treated With Leucovorin, Fluorouracil, and Oxaliplatin With or Without Cetuximab: A Post Hoc Analysis of the PETACC-8 Trial. JAMA Oncol. 2016;14:1-11.
- Taïeb J, Taly V, Vernerey D, et al. LBA30_PR-Analysis of circulating tumour DNA (ctDNA) from patients enrolled in the IDEA-FRANCE phase III trial: Prognostic and predictive value for adjuvant treatment duration. Ann. Oncol. 2019, 30, v867.
- Taïeb J, Benhaim L, Laurent Puig P, et al. "Decision for adjuvant treatment in stage II colon cancer based on circulating tumor DNA:The CIRCULATE-PRODIGE 70 trial". Dig Liver Dis. 2020;52:730-3.
- Teixeira L, Hickish T, Tournigand L et al. Efficacy of FOLFOX4 as adjuvant therapy in stage II colon cancer (CC): A new analysis of the MOSAIC trial according to risk factors. J Clin Oncol. 2010;28(15S):3524.
- Tarazona N, Gimeno-Valiente F, Gambardella V, et al. Targeted next-generation sequencing of circulating-tumor DNA for tracking minimal residual disease in localized colon cancer. Ann Oncol. 2019;30:1804-12.
- Tie J, Cohen JD, Wang Y, et al. Circulating Tumor DNA Analyses as Markers of Recurrence Risk and Benefit of Adjuvant Therapy for Stage III Colon Cancer. JAMA Oncol. 2019;5:1710–7.
- Tie J, Cohen JD, Lo SN, Wang Y, et al. Prognostic significance of postsurgery circulating tumor DNA in nonmetastatic colorectal cancer: Individual patient pooled analysis of three cohort studies. Int J Cancer. 2021;148:1014-26.
- Tie J, Cohen JD, Lahouel K, et al. Circulating Tumor DNA Analysis Guiding Adjuvant Therapy in Stage II Colon Cancer. N Engl J Med. 2022 Jun;386:2261-2272.
- Tougeron D, Mouillet G, Trouilloud I, et al. Efficacy of Adjuvant Chemotherapy in Colon Cancer With Microsatellite Instability: A Large Multicenter AGEO Study. J Natl Cancer Inst. 2016;108(7).
- Tournigand C, André T, Bonnetain F, et al. Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer: subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancer trial. J Clin Oncol. 2012:30;3353-60.
- Tournigand C, André T, Bonnetain F, et al. Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer: subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancer trial. J Clin Oncol. 2012;30:3353-60.
- Turner MC, Farrow NE, Rhodin KE, et al. Delay in Adjuvant Chemotherapy and Survival Advantage in Stage III Colon Cancer. J Am Coll Surg. 2018; 226: 670–8.
- Twelves C, Wong A, Nowacki MP, et al. Capecitabine as adjuvant treatment for stage III colon cancer. N Engl J Med 2005;352:2696-704.
- Twelves C, Scheithauer W, McKendrick J, et al. Capecitabine versus 5-fluorouracil/folinic acid as adjuvant therapy for stage III colon cancer: final results from the X-ACT trial with analysis by age and preliminary evidence of a pharmacodynamic marker of efficacy. Ann Oncol. 2012;23:1190-7.
- Ueno H, Ishiguro M, Nakatani E, et al. Prospective Multicenter Study on the Prognostic and Predictive Impact of Tumor Budding in Stage II Colon Cancer: Results From the SACURA Trial. J Clin Oncol. 2019;37:1886-1894.
- Van Blarigan EL, Meyerhardt JA. Role of physical activity and diet after colorectal cancer diagnosis. J Clin Oncol. 2015;33:1825-34.
- Van Blarigan EL, Fuchs CS, Niedzwiecki D, et al. Association of Survival With Adherence to the American Cancer Society Nutrition and Physical Activity Guidelines for Cancer Survivors After Colon Cancer Diagnosis: The CALGB 89803/Alliance Trial. JAMA Oncol. 2018;4:783-90.
- Van Cutsem E, Labianca R, Bodoky G, et al. Randomized phase III trial comparing biweekly infusional fluorouracil/leucovorin alone or with irinotecan in the adjuvant treatment of stage III colon cancer: PETACC-3. J Clin Oncol. 2009;27:3117-25.
- van Hooft JE, van Halsema EE, Vanbiervliet G et al. Self-expandable metal stents for obstructing colonic and extracolonic cancer: Euro- pean Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Gastrointest Endosc 2014; 80: 747–61.
- van Hooft JE, Veld JV, Arnold D, et al. Self-expandable metal stents for obstructing colonic and extracolonic cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy. 2020;52:389-407.
- van Roekel EH, Duchâteau J, Bours MJL, et al. Longitudinal associations of light-intensity physical activity with quality of life, functioning and fatigue after colorectal cancer. Qual Life Res. 2020;29:2987-98.
- Vasen HF, Blanco I, Aktan-Collan K, et al. Revised guidelines for the clinical management of Lynch syndrome (HNPCC): recommendations by a group of European experts. Gut. 2013;62:812-23.
- Venook AP, Niedzwiecki D, Lopatin M, et al. Biologic determinants of tumor recurrence in stage II colon cancer: validation study of the 12-gene recurrence score in cancer and leukemia group B (CALGB) 9581. J Clin Oncol. 2013;31:1775-81.
- Verberne CJ, Zhan Z, van den Heuvel E, et al. Intensified follow-up in colorectal cancer patients using frequent Carcino-Embryonic Antigen (CEA) measurements and CEA-triggered imaging: Results of the randomized "CEA watch" trial. Eur J Surg Oncol. 2015;41:1188-96.
- Wang Y, Jatkoe T, Zhang Y, et al. Gene expression profiles and molecular markers to predict recurrence of Dukes' B colon cancer. J Clin Oncol. 2004;22:1564-71.
- Ward RL, Turner J, Williams R, et al. Routine testing for mismatch repair deficiency in sporadic colorectal cancer is justified. J Pathol. 2005;207:377-84.
- Wille-Jørgensen P, Syk I, Smedh K, et al. Effect of More vs Less Frequent Follow-up Testing on Overall and Colorectal Cancer- Specific Mortality in Patients With Stage II or III Colorectal Cancer: The COLOFOL Randomized Clinical Trial. JAMA. 2018;319:2095-2103.
- Wu Z, Qin G, Zhao N, Jia H, Zheng X. Assessing the adequacy of lymph node yield for different tumor stages of colon cancer by nodal staging scores. BMC Cancer. 2017;17:498.
- Xicola RM, Llor X, Pons E, et al. Performance of different microsatellite marker panels for detection of mismatch repair-deficient colorectal tumors. J Natl Cancer Inst. 2007;99:244-52.
- Yamashina T, Uedo N, Akasaka T, et al. Comparison of Underwater vs Conventional Endoscopic Mucosal Resection of Intermediate-Size Colorectal Polyps. Gastroenterology. 2019;157:451-461.e2.
- Yamazaki K, Yamanaka T, Shiozawa M, et al. Oxaliplatin-based adjuvant chemotherapy duration (3 versus 6 months) for high-risk stage II colon cancer: the randomized phase III ACHIEVE-2 trial. Ann Oncol. 2021;32:77-84.
- Ychou M, Raoul JL, Douillard JY, et al. A phase III randomised trial of LV5FU2 + irinotecan versus LV5FU2 alone in adjuvant high-risk colon cancer (FNCLCC Accord02/FFCD9802). Ann Oncol. 2009;20:674-80.
- Yoon HH, Tougeron D, Shi Q, et al. KRAS codon 12 and 13 mutations in relation to disease-free survival in BRAF-wild-type stage III colon cancers from an adjuvant chemotherapy trial (N0147 alliance). Clin Cancer Res. 2014;20:3033-43.
- Yoshino T, Yamanaka T, Oki E, et al. Efficacy and Long-term Peripheral Sensory Neuropathy of 3 vs 6 Months of Oxaliplatin-Based Adjuvant Chemotherapy for Colon Cancer: The ACHIEVE Phase 3 Randomized Clinical Trial. JAMA Oncol. 2019;5:1574–81.
- Yothers G, O'Connell MJ, Allegra CJ, et al. Oxaliplatin as adjuvant therapy for colon cancer: updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol. 2011;29:3768-74.
- Yothers G, O'Connell MJ, Lee M, et al. Validation of the 12-gene colon cancer recurrence score in NSABP C-07 as a predictor of recurrence in patients with stage II and III colon cancer treated with fluorouracil and leucovorin (FU/LV) and FU/LV plus oxaliplatin. J Clin Oncol. 2013;31:4512-9.
- Zaniboni A, Labianca R, Marsoni S, et al. GIVIO-SITAC 01: a randomized trial of adjuvant 5-fluorouracil and folinic acid administered to patients with colon carcinoma -- Long term results and evaluation of the indicators of health-related quality of life. Cancer. 1998;82:2135-44.
- Zhou W, Goodman SN, Galizia G, et al. Counting alleles to predict recurrence of early-stage colorectal cancers. Lancet. 2002;359:219-25.

