9. Cancer du pancréas
(Dernière mise à jour le : )Principaux changements de la mise à jour du 17/05/2024
9.1.2. épidémio : incidence en hausse en France (environ 16 000 nouveaux cas en 2023).
9.2.3.4. drainage biliaire : sous échoendos (prothèse Axios) si échec de CPRE.
9.2.3.5. bilan : TEP FDG non standard mais peut être discutée dans certaines situations.
9.2.4. et 9.2.7.2. rares circonstances où chimio sans preuve histologique.
9.2.5. critères A (anatomiques), B (biologiques) et C (cliniques) ajoutés.
9.3.1. lésions précancéreuses : recommandations de prise en charge de TIPMP actualisées.
9.3.3. dépistage sujets à risque : ajout de mutation germinale des gènes CDKN2A ou PRSS1.
9.4.1.1. chirurgie : indication de laparoscopie validées pour les pancréatectomies gauches.
9.4.1.4. traitement néoadjuvant : chimiothérapie, option dans certaines circonstances.
9.4.3.1. tumeurs localement avancées : FOLFIRINOX > gemcitabine dans l’essai NEOPAN.
9.4.3.2. tumeurs localement avancées : essai CONKO-007 et nouvelles modalités de radiothérapie.
9.4.4.1. métas, chimio 1ère L : traitements « séquentiels » alternant 2 schémas précisés.
9.4.4.2. chimio 2ème L : résultats essai GEMPAX-PRODIGE 65 mentionnés.
9.4.4.3. chirurgie : traitement « local » des formes oligométastatiques discuté.
9.4.5. mutations G12C, NGR1 et NTRK ; inhibiteurs pan-KRAS et thérapies cellulaires.
9.4.6. soins de support : résultats des études françaises URGENCE et APACaP mentionnés.
9.5.1. reco. opérables : classification A, B, C pour discuter traitement néoadjuvant.
9.5.1. option de SPG robotique pour tumeur corps et queue du pancréas.
9.5.2. reco. borderline : nouveaux essais cliniques mentionnés.
9.5.3. reco. non résécable : mFOLFIRINOX (standard), gemcitabine+nab-paclitaxel (non remboursée).
9.5.4. option anastomose gastro-entérale sous échoendoscopie à discuter avec opérateur expérimenté.
9.5.4.1. reco métas : mFOLFIRINOX et NALIFIROX, recherche d’anomalies ciblables (KRAS, MSI et BRCA 1/2), 2 nouveaux essais cliniques (PANORAMIX, PROACTIF-1).
9.5.4.2. 2ème L : 5FU-nalIRI, gemcitabine-paclitaxel, gemcitabine-nab-paclitaxel, recherche d’anomalies génétiques ciblables (KRAS, MSI et BRCA 1/2) si bon état général.
9.5.4.3. 3ème L : larotrectinib (f NTRK), adagrasib/sotorasib (mKRASG12C) mais non remboursés.
9.8. protocoles : schéma du protocole NALIRIFOX ajouté.
9.9. arbres décisionnels : algorithmes adaptés en fonction des modifications du texte.
9.10. Références : 52 nouvelles références ajoutées.
Groupe de travail et relecteurs
Groupe de travail :
Pascal HAMMEL (Villejuif), coordonnateur,
Jean-Baptiste BACHET (Paris), Lucile BAUGUION (La Roche-sur-Yon), Laurianne COLSON DURAND (Créteil), Thierry CONROY (Nancy), Laëtitia DAHAN (Marseille), Sébastien GAUJOUX (Paris), Marine GILABERT † (Marseille), Florence HUGUET (Paris), Lysiane MARTHEY (Bicêtre), Julie MEILLEROUX (Toulouse), Louis de MESTIER (Clichy), Bertrand NAPOLEON (Lyon), Cindy NEUZILLET (Saint-Cloud), Fabienne PORTALES (Montpellier), Gaël ROTH (Grenoble), Antonio SA CUNHA (Villejuif), Lilian SCHWARZ (Rouen), Julien TAIEB (Paris), Nicolas WILLIET (Saint-Etienne)
Relecteurs :
Thomas APARICIO (Paris), Léonor BENHAIM (Villejuif), Karine BIDEAU (Quimper), Olivier BOUCHE (Reims), Emmanuel BUC (Clermont-Ferrand), Louis BUSCAIL (Toulouse), Mathilde BRASSEUR (Reims), Jean-Robert DELPERO (Marseille), Michel DUCREUX (Villejuif), Aurélien DUPRE (Lyon), Pierre FAJADET (Toulouse), Christelle de la FOUCHARDIERE (Lyon), Eric FRANCOIS (Nice), Dany GARGOT (Blois), Rosine GUIMBAULT (Toulouse), Reza KIANMANESH (Reims), Dine KORICHE (Béthune-Lens), Matthieu LAPEYRE (Toulouse), Thierry LECOMTE (Tours), Christophe LOUVET (Paris), Jean LUBRANO (Caen), Léon MAGGIORI (Paris), Philippe MAINGON (Paris), Pascale MARIANI (Paris), Laurent MOSSER (Rodez), Benjamin MENAHEM (Caen), Tulio PIARDI (Reims), Alain SAUVANET (Paris), Enam SOBKENG-GOUFAK (Château-Thierry), Christine SILVAIN (Poitiers), Véronique VENDRELY (Bordeaux)
Neuzillet C, Gaujoux S, Williet N, Bachet JB, Bauguion L, Colson Durand L, Conroy T, Dahan L, Gilabert M, Huguet F, Marthey L, Meilleroux J, de Mestier L, Napoléon B, Portales F, Sa Cunha A, Schwarz L, Taïeb J, Chibaudel B, Bouché O, Hammel P; Thésaurus National de Cancérologie Digestive (TNCD); Pancreatic cancer: French clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, AFC). Dig Liver Dis. 2018 Dec; 50(12):1257-1271. doi: 10.1016/j.dld.2018.08.008
Et mise à jour 2024 :
P Hammel, C Neuzillet, JB Bachet, L Bauguion, L Colson Durand, T Conroy, L Dahan, S Gaujoux, L Marthey, J Meilleroux, L de Mestier , B Napoléon, F Portales, G Roth, A Sa Cunha, L Schwarz, J Taïeb, Williet N, F Huguet, O Bouché. « Cancer du pancréas ». Thésaurus National de Cancérologie Digestive, juin 2024, en ligne [http://www.tncd.org]
9.1. Introduction
Nous ne traiterons dans ce chapitre que des tumeurs malignes du pancréas exocrine, excluant les tumeurs ampullaires, les cholangiocarcinomes intra-pancréatiques (cf. Chapitre 8 TNCD - Cancer des voies biliaires et 19 Ampullome vatériens) et les néoplasies neuroendocrines (cf. Chapitre 11 TNCD - NNE).
L’association « ESPOIR PANCREAS » regroupe des malades et des familles de malades atteints d’un cancer du pancréas.
9.1.1. Méthodologie
Ce travail repose sur les recommandations (publications internes) de la Fédération Francophone de Cancérologie Digestive (FFCD) du GERCOR, de la Société Française de Chirurgie Digestive (SFCD), de l’Association de Chirurgie Hépato-Bilio-Pancréatique et de Transplantation (ACHBT), de l’Association Française de Chirurgie (AFC), de l’European Society of Medical Oncology (ESMO) (Conroy T, et al. 2023), du National Comprehensive Cancer Network (www.nccn.org) et sur leur actualisation par une recherche bibliographique. Celle-ci a reposé sur l'extraction, à partir de la base de données PubMed interrogée en janvier 2024, des essais randomisés, méta-analyses, conférences de consensus et recommandations de pratique clinique avec les mots-clés « pancreatic cancer » et « pancreatic adenocarcinoma », en anglais ou en français, sans limitation de date.
Les présentes recommandations ont été gradées selon le niveau des preuves disponibles dans la littérature, ou en cas de preuves insuffisantes selon l'accord ou l’avis d'experts.
9.1.2. Epidémiologie
L’adénocarcinome du pancréas (AP) représente 90 % des tumeurs du pancréas et devrait être la deuxième cause de mortalité par cancer en Europe et aux États Unis en 2030 (Ferlay, Partensky, & Bray, 2016; Rahib et al., 2021; Huang et al., Gastroenterology 2021; Dalmartello et al., Ann Oncol 2022). Son incidence en France a doublé chez les hommes et triplé chez les femmes entre 1982 et 2012, atteignant 15 991 nouveaux cas en 2023 (Lapôtre-Ledoux B et al., 2023 ; Bouvier et al., 2017; INCa, 2023). Une augmentation de l’incidence plus particulièrement marquée chez les femmes jeunes est observée aux Etats-Unis (+7,68 %/an chez les moins de 35 ans) (Gaddam S., JAMA 2021). Il reste le cancer digestif dont le pronostic est le plus défavorable, avec un taux de survie globale (SG) nette standardisée à 5 ans, tous stades confondus, de 11 % (INCa, 2023).
9.2. Diagnostic et explorations pré-thérapeutiques
9.2.1. Présentation clinique
Le type et la chronologie des manifestations cliniques dépendent principalement du site de la tumeur primitive et de son stade au diagnostic (Modolell, Guarner, & Malagelada, 1999). L’AP localisé dans la tête (70%-80%) est plus rapidement symptomatique que celui du corps ou de la queue du pancréas (20%-30%), ce dernier étant souvent diagnostiqué à un stade plus avancé (Neuzillet, Sauvanet, & Hammel, 2011). Les symptômes les plus fréquents, asthénie, anorexie et amaigrissement, sont tardifs et non spécifiques.
- Une douleur souvent intense (nécessitant des antalgiques de palier 3), abdominale à irradiation postérieure et/ou dorsale, est évocatrice d’une tumeur non résécable par envahissement cœliaque et associée à un mauvais pronostic (Kalser, Barkin, & MacIntyre, 1985; Modolell et al., 1999).
- L’ictère est un signe parfois précoce quand il est causé par une tumeur céphalique obstruant la voie biliaire principale (VBP) (Modolell et al., 1999).
- Un diabète soit récent (< 2 ans), causé par l’AP (ou diabète de type IIIc (Hart et al., 2016), paranéoplasique ou par obstruction canalaire avec atrophie pancréatique d’amont), soit ancien (facteur de risque, mieux documenté pour le diabète de type II), est présent dans 50% des cas (Chari et al., 2005; Yuan et al., 2015). Ainsi, un diabète inaugural ou la décompensation d’un diabète ancien peuvent révéler un AP.
- D’autres modes de révélation sont plus rares : pancréatite aiguë, événement thrombo-embolique, occlusion, hémorragie digestive, diarrhée par maldigestion, ascite, anxiété/dépression ou panniculite (syndrome de Weber-Christian).
- Il importe de préciser par l’interrogatoire les antécédents personnels et familiaux de cancers (recherche d’une forme familiale de cancer du pancréas) et/ou de maladie du pancréas (pancréatite, lésions kystiques).
9.2.2. Marqueurs tumoraux sériques : CA19-9
9.2.2.1. Diagnostic
L’antigène carbohydrate 19-9 (CA 19-9) n’a pas les performances diagnostiques exigées pour être un marqueur fiable.
- Sa sensibilité et sa spécificité sont de 80% et 80%-90%, respectivement, chez les patients symptomatiques, mais sa valeur prédictive positive est insuffisante pour le diagnostic ou le dépistage de l’AP (Huang & Liu, 2014; Ni et al., 2005).
9.2.2.2. Pronostic
Le taux de CA 19-9 apporte une information pronostique dans deux circonstances (Ballehaninna & Chamberlain, 2012; Chiorean et al., 2016) :
- au diagnostic, s’il dépasse 500 U/mL sans cholestase, il suggère fortement son caractère métastatique (Isaji, et al. 2018, Schouten et al. 2024). Après traitement néoadjuvant, il devrait être inférieur à 100 U/mL (Heger et al. 2020) ;
- pour le suivi thérapeutique,
- sa forte diminution de plus de 40%-60% sous chimiothérapie plus ou moins radiothérapie est en faveur d’un contrôle tumoral satisfaisant (Seelen et al. 2024)
- et sa normalisation après chirurgie est de bon pronostic
9.2.2.3. Interprétation du CA 19-9
Il faut connaître pour l’interprétation du CA 19-9 l’existence :
- de faux négatifs chez les patients n’exprimant pas le marqueur sanguin Lewis (a-b-, 5 %-10 % de la population) ;
- de nombreux faux positifs : cholestase quelle qu’en soit la cause, diabète, pancréatite chronique, cirrhose et autres cancers (Ballehaninna & Chamberlain, 2012; Poruk et al., 2013).
Au total, le dosage du CA 19-9 doit être interprété avec prudence, toujours couplé à un examen d’imagerie, à intervalle de 2-3 mois, et ses limites soigneusement expliquées au patient (caractère anxiogène).
9.2.2.4. Autres marqueurs
D’autres marqueurs sanguins sont en cours d’exploration (ex. thrombospondine 2, ADN tumoral circulant, cellules tumorales circulantes, et vésicules extracellulaires circulantes) mais ne sont pas validés et ne peuvent être recommandés à ce jour.
9.2.3. Examens morphologiques
9.2.3.1. Tomodensitométrie thoraco-abdomino-pelvienne (TDM TAP)
Une fois le diagnostic d’AP suspecté cliniquement ou après qu’une masse pancréatique a été détectée (ex. signes directs ou indirects [dilatation des voies biliaires ou bicanalaire] à l’échographie abdominale transpariétale), l’examen de référence pour évaluer le stade tumoral et juger de la résécabilité tumorale éventuelle est la tomodensitométrie thoraco-abdomino-pelvienne (TDM TAP) en coupes fines avec injection de produit de contraste.
- Le protocole recommandé (Al-Hawary et al., 2014; Tamm et al., 2012) est un examen tri-phasique par angioscanner multidétecteur, avec une épaisseur de coupes ≤ 0,5-1 mm,
- sans injection ;
- puis après injection intraveineuse de produit de contraste iodé, une phase artérielle tardive, dite parenchymateuse pancréatique (à 40-50 secondes) ;
- suivie d’une phase veineuse portale (à 65-70 secondes).
- Les AP, tant au niveau de la tumeur primitive que des métastases, sont typiquement hypodenses à la phase artérielle et isodenses/faiblement rehaussées à la phase portale. Des reconstructions peuvent être réalisées en complément de l’acquisition pour l’étude vasculaire.
- Le compte rendu doit préciser :
- la taille de la tumeur,
- son aspect avant et après injection,
- sa localisation,
- la présence d’une sténose canalaire biliaire et/ou pancréatique et/ou d’une dilatation d’amont,
- les rapports vasculaires,
- la présence éventuelle d’une extension extra-pancréatique contre-indiquant la chirurgie (ex. ganglions extra-régionaux, métastases hépatiques, péritonéales, ou pulmonaires) (Al-Hawary et al., 2014).
- L’évaluation de la résécabilité de l’AP à la TDM implique la description précise de l’atteinte (circonférence de contact, présence d’un rétrécissement vasculaire ou d’une irrégularité des contours) des artères (artère mésentérique supérieure [AMS], tronc cœliaque, artère splénique, artère hépatique et ses variantes anatomiques) et des veines régionales (veine mésentérique supérieure [VMS], veine porte [VP], veine splénique) par la tumeur et de son retentissement fonctionnel (thrombose ou occlusion, circulation collatérale), et l’éventuelle présence d’un ligament arqué.
- La standardisation du compte-rendu, sous forme de check-list (Al-Hawary et al., 2014) est actuellement recommandée (Tableau I).
- L’imagerie au moment de l’évaluation doit impérativement être récente (<4 semaines) car l’évolution des AP peut être rapide et un délai plus long augmente le risque (> 20%) de découverte per-opératoire de métastases non vues à l’imagerie pour une tumeur présumée résécable (Glant et al., 2011; Raman et al., 2015).
Tableau I - Conditions de réalisation et compte rendu standardisé de TDM
| Paramètre | Détails |
| Type de scanner | Hélicoïdal (de préférence 64 barrettes ou plus) |
| Épaisseur de coupe | Les plus fines possible, de préférence ≤ 0,5-1 mm |
| Intervalle | Identique à l’épaisseur de coupe |
| Contraste oral | Neutre (type hydrique 100 mL, juste avant l'examen), l’opacification digestive par du contraste positif (baryte ou hydrosoluble) doit être bannie car ce produit diminue le contraste parenchymateux pancréatique |
| Contraste intraveineux | Produit de contraste iodé, de préférence fortement concentré (< 300 mg I/L), à une vitesse de 3-5 mL/sec |
| Acquisition | Sans injection, puis phase parenchymateuse pancréatique (à 40-50 secondes), suivie d’une phase veineuse portale (à 65-70 secondes). |
| Analyse et reconstructions | - Coupes axiales et reconstructions multiplanaires de 2-3 mm - MIP ou coupes 3D volumétriques épaisses pour l’évaluation vasculaire |
Evaluation morphologique | |||
| Aspect à la phase parenchymateuse hépatique | ☐ Hypodense | ☐ Isodense | ☐ Hyperdense |
| Taille (plus grand axe en cm) | ☐ Mesurable | ☐ Non mesurable (tumeur isodense) | |
| Localisation | ☐ Tête/crochet (à droite de la VMS) | ☐ Corps/queue (à gauche de la VMS) | |
| Sténose canalaire pancréatique avec ou sans dilatation d’amont | ☐ Présente | ☐ Absente | |
| Sténose biliaire avec ou sans dilatation d’amont | ☐ Présente | ☐ Absente | |
| Évaluation artérielle | |||
| Contact avec l’AMS | ☐ Présent | ☐ Absent | |
| Circonférence de contact (degrés) | ☐ ≤ 180 | ☐> 180 | |
| Rétrécissement vasculaire ou irrégularité des contours | ☐ Présent | ☐ Absent | |
| Extension à la 1ère branche de l’AMS | ☐ Présente | ☐ Absente | |
| Contact avec le tronc coeliaque | ☐ Présent | ☐ Absent | |
| Circonférence de contact (degrés) | ☐ ≤ 180 | ☐> 180 | |
| Rétrécissement vasculaire ou irrégularité des contours | ☐ Présent | ☐ Absent | |
| Contact avec l’artère hépatique commune | ☐ Présent | ☐ Absent | |
| Circonférence de contact (degrés) | ☐ ≤ 180 | ☐> 180 | |
| Rétrécissement vasculaire ou irrégularité des contours | ☐ Présent | ☐ Absent | |
| Extension au tronc coeliaque | ☐ Présente | ☐ Absente | |
| Extension à la bifurcation de l’artère hépatique droite/gauche | ☐ Présente | ☐ Absente | |
| Variantes anatomiques artérielles | ☐ Présente | ☐ Absente | |
| Type | ☐ Artère hépatique droite issue de l’artère mésentérique supérieure pour le foie droit | ☐ Artère hépatique droite issue de l’artère mésentérique supérieure pour foie total | ☐ Autre : …………................. |
| Circonférence de contact vasculaire | ☐ ≤ 180 | ☐> 180 | |
| Sténose de l’ostium de l’AMS ou du TC ou autre anomalie | ☐ Présent | ☐ Absent | ☐ Description : ......................……. |
9.2.3.2. Imagerie par résonance magnétique (IRM)
L’imagerie par résonance magnétique (IRM) avec séquences de cholangio-pancréatographie est une alternative aussi sensible et spécifique que la TDM pour le bilan diagnostique et d’extension de l’AP à l’étage abdominal, mais est moins utilisée en raison de son coût et de sa disponibilité plus limitée (Bipat et al., 2005).
- Elle a une valeur ajoutée pour le diagnostic des lésions pancréatiques isodenses, non ou mal visibles en TDM, et les lésions hépatiques trop petites pour être caractérisées ou de nature indéterminée.
- Il est recommandé de réaliser une IRM hépatique de diffusion au diagnostic de tout AP localisé (résécable, de résécabilité limite ou localement avancé), en particulier avant chirurgie pour s’assurer de l’absence de métastases hépatiques infra-centimétriques.
- L'IRM de diffusion est plus sensible que la TDM pour détecter les petites métastases hépatiques et permet d’éviter une laparotomie inutile chez 12% des patients ayant un AP présumé résécable (Marion-Audibert et al., 2018).
La découverte d’une lésion hépatique infra-centimétrique restreignant la diffusion, est fortement évocatrice de métastase. Il existe cependant de rares faux positifs (3,5%). La décision de contre-indiquer la résection ou d’obtenir une preuve histologique par voie transpariétale ou par coelioscopie doit alors être discutée en RCP.
- Si l’IRM abdominale est choisie pour le bilan d’extension, celui-ci doit être complété par une TDM thoracique.
9.2.3.3. Echoendoscopie
- Si l’écho-endoscopie (EE) digestive haute a pour principal intérêt de permettre la réalisation de prélèvements à visée cytologique ou histologique (cf. 9.2.4.), elle peut aussi apporter des informations complémentaires à la TDM concernant l’extension locorégionale.
- Néanmoins, du fait de variantes anatomiques artérielles hépatiques fréquentes (jusqu'à 10% des patients) et de son caractère opérateur-dépendant, elle ne constitue pas l’examen de référence pour l’évaluation de l'atteinte vasculaire.
- Ses quatre indications dans l’AP sont :
- une forte suspicion d’AP non visualisé par les autres examens d’imagerie, notamment en cas de sténose du canal pancréatique principal ;
- une masse pancréatique de nature incertaine à la TDM et l'IRM (ex. diagnostic différentiel avec une pancréatite auto-immune pseudo-tumorale ou une autre pancréatite chronique) ;
- la nécessité d’obtenir une confirmation anatomo-pathologique de l’AP en l’absence d’autre site tumoral d'accès plus facile;
- ou si une cholangio-pancréatographie rétrograde endoscopique (CPRE) est envisagée pour réaliser un geste de drainage biliaire (De Angelis, Brizzi, & Pellicano, 2013).
- Les améliorations techniques de l’EE (sono-élastométrie, injection veineuse de produit de contraste ou endo-microscopie confocale) n’ont pas fait l’objet d’une validation suffisamment robuste pour les recommander.
9.2.3.4. Drainage biliaire
La CPRE ne présente qu’un intérêt thérapeutique afin de drainer une sténose biliaire.
- Un brossage à visée diagnostique peut être réalisé au cours de la procédure, mais sa sensibilité est inférieure à celle de la cytoponction/biopsie (Weilert et al., 2014).
- Une prothèse biliaire, si indiquée hors contexte d’urgence (angiocholite, bilirubine > 250 µmol/L, prurit invalidant) ne doit être mise en place qu’après une imagerie complète et de qualité.
- En cas de doute sur la nature ou sur la résécabilité de la tumeur en situation d’urgence, une courte prothèse biliaire métallique couverte doit être privilégiée.
- En l’absence d’urgence, l’indication de drainage biliaire doit être posée idéalement en RCP en présence d’endoscopistes et/ou de chirurgiens spécialisés.
Le drainage cholédocien sous écho-endoscopie par prothèse d'apposition (lumen apposing metallic stent (LAMS)) (Jin et al., 2020 ; Vanella et al., 2022)
- Est une alternative en cas d'échec de la CPRE en contexte d'obstruction tumorale avec dilatation de la voie biliaire principale (VBP) après discussion en RCP et par un opérateur expérimenté
- 2 techniques sont possibles :
- cholédoco-duodénostomie à privilégier sauf si sténose duodénale
- hépatico-gastrostomie si sténose duodénale
- cholécysto-duodénostomie
- Elle évite aux patients des drains radiologiques et leurs complications.
Le taux de succès technique dépasse les 90 % mais des complications sévères sont possibles.
9.2.3.5. TEP FDG
La tomographie par émission de positons au 18-fluorodesoxyglucose (TEP FDG) ne fait pas partie du bilan systématique de l’AP.
- Elle est inconstamment informative, en particulier dans les variantes d’AP produisant de la mucine ou pauci-cellulaires, ou en cas de diabète mal équilibré.
- A contrario, des lésions inflammatoires non tumorales (ex. pancréatite autoimmune) peuvent causer des faux positifs.
- La valeur de cet examen pour améliorer le diagnostic et le bilan d’extension des patients atteints d’AP par rapport aux autres examens disponibles reste discutée (Ghaneh et al., 2018; Marion-Audibert et al., 2014; Rijkers, Valkema, Duivenvoorden, & van Eijck, 2014; Tang et al., 2011; Wang, Chen, Liu, Qin, & Huang, 2013). La TEP FDG pourrait augmenter le taux de détection de métastases hépatiques en particulier en cas de primitif et/ou d’adénopathies péritumorales volumineux, ou de CA 19.9 élevé (NCCN 1.2024, MS11).
- La TEP FDG se développe comme outil pour l’étude de la réponse au traitement néoadjuvant/d’induction mais n’est pas validée à ce jour pour la routine et doit être évaluée prospectivement (Soloff et al., 2022 ; Abdelrahman et al., JNCCN 2022).
9.2.3.6. Laparoscopie
La laparoscopie permet de détecter et de biopsier de petites métastases péritonéales et/ou hépatiques et de modifier la stratégie thérapeutique chez un nombre limité de patients avec tumeur supposée résécable à l’issue d’un bilan d’imagerie moderne et rigoureusement interprété (Allen, Gurusamy, Takwoingi, Kalia, & Davidson, 2016; Fong et al., 2017).
- Elle ne doit pas être systématique, mais peut être discutée dans les cas suivants :
- avant la résection d’une volumineuse tumeur du corps ou de la queue,
- et/ou en cas de taux élevé de CA 19-9 (seuil > 130 à 400 U/mL),
- en cas de doute sur des lésions hépatiques ou de carcinoses,
- ou lorsqu'un traitement néoadjuvant ou d’induction est envisagé (Allen et al., 2016; Fong et al., 2017; Maithel et al., 2008).
9.2.4. Preuve histologique
- Les biopsies doivent être réalisées sur le site tumoral le plus facile d’accès (pancréas ou foie le plus souvent, cf. section 9.1.3) et en privilégiant, pour le site pancréatique, la voie échoendoscopique à l’abord transpariétal sous contrôle TDM (Brugge et al., 2014; Okasha et al., 2013).
- Elle est indiquée dans les situations suivantes :
- doute diagnostique avec une lésion bénigne ;
- tumeur non résécable (localement avancée ou métastatique mais sans métastase facilement accessible par voie transpariétale), pour avoir une preuve histologique avant de débuter la chimiothérapie ;
- tumeur résécable/borderline si un traitement néoadjuvant/d’induction est envisagé.
- Le calibre de l’aiguille utilisée (25G, 22G ou 19G), son type (ex. Procore®, à fenêtre latérale…) ou certaines modalités techniques (ex. wet aspiration ou fanning) permettraient d’optimiser les performances des biopsies sous EE.
- Une métastase hépatique (gauche) découverte pendant l’examen peut faire l’objet de la cytoponction sachant que le rendement histo/cytologique est meilleur que pour la tumeur primitive.
- En revanche, une métastase hépatique connue et accessible par voie transpariétale doit être prélevée sous contrôle échographique ou TDM en l’absence de contre indication (ex. lésion à proximité de voies biliaires dilatées).
- Il est important de rappeler que la preuve cyto/histologique de malignité n'est pas systématique ni nécessaire avant la résection chirurgicale pour une maladie résécable d’emblée, et qu'une biopsie non informative ne doit pas retarder la résection chirurgicale en cas de forte suspicion clinique de cancer pancréatique.
- A contrario, elle est considérée comme nécessaire avant tout traitement médical. Néanmoins, dans les cas exceptionnels de patients ayant une tumeur avancée, avec retentissement sur l’état général (PS 2), au moins une tentative de biopsie diagnostique non contributive, et une indication de chimiothérapie urgente, un faisceau d’arguments cliniques, biologiques (CA 19-9 > 10N sans cholestase) et radiologiques (tumeur hypodense au scanner avec injection de produit de contraste) peut être suffisant pour débuter une chimiothérapie rapidement (Nouts, Levy, Voitot, & Bernades, 1998; Poruk et al., 2013). Cette décision doit être validée en réunion de concertation pluridisciplinaire (RCP).
- Une ponction sous EE et des biopsies de l’ampoule de Vater avec un immunomarquage IgG4 sont conseillées pour éliminer une pancréatite auto-immune de type 1 (Yoon et al., 2020) en cas de tumeur de la tête du pancréas quand la tumeur présente certaines caractéristiques (absence de dilatation du canal de Wirsung en amont de la masse, aspect de cholangite associé). Une aiguille à biopsie de 20G ou 22G sera alors privilégiée.
9.2.5. Classification thérapeutique
La classification TNM AJCC 2017 (8ème version) (Tableaux II et III)
- introduit des modifications dans les catégories T et N par rapport aux classifications antérieures (Kamarajah, Burns, Frankel, Cho, & Nathan, 2017).
- s’applique aux carcinomes du pancréas exocrine et aux carcinomes neuroendocrines de haut grade. La maladie doit être confirmée histologiquement ou par cytologie.
Définition du caractère régional des adénopathies
- Les ganglions lymphatiques régionaux pour les tumeurs de la tête et de l’isthme ne sont pas définis de façon consensuelle. Classiquement, les adénopathies régionales sont définies comme étant celles du pédicule hépatique, de l’artère hépatique commune, de la veine porte, pyloriques, antérieurs ou postérieurs aux vaisseaux pancréatico-duodénaux, et le long de la VMS et du bord latéral droit de l’AMS (AJCC 2017).
- Les ganglions lymphatiques régionaux pour les tumeurs du corps et de la queue ne sont pas non plus définis de façon consensuelle et pourraient ne pas être les mêmes pour les tumeurs la partie proximale du corps et de la queue. Classiquement, les adénopathies régionales sont définies comme étant celles le long de l’artère hépatique commune, du tronc cœliaque, de l’artère splénique, et du hile splénique (AJCC 2017).
- Les atteintes des autres groupes lymphatiques sont considérées comme des métastases à distance.
Tableau II - Classification TNM
| Catégorie T | Taille de la tumeur, mesurée dans sa plus grande dimension | Modifications par rapport à la 7ème classification* | |
| T1 | Tumeur ≤ 2 cm T1a Tumeur ≤ 0,5 cm T1b Tumeur > 0,5 cm et < 1 cm T1c Tumeur > 1 cm et ≤ 2 cm | ||
| T2 | Tumeur > 2 et ≤ 4 cm | Basée sur la taille et non pas sur l’invasion extra-pancréatique (avantage : plus objective, meilleure corrélation avec la survie) | |
| T3 | Tumeur > 4 cm | ||
| T4 | Tumeur envahissant l’axe cœliaque l’artère mésentérique supérieure et/ou à l’artère hépatique commune | Basée sur l’envahissement des artères et non pas la notion de résécabilité | |
| Catégorie N | Adénopathies régionales (subdivision dans la nouvelle classification) | ||
| N0 | Pas de métastase ganglionnaire régionale | ||
| N1 | 1 à 3 ganglions régionaux métastatiques | Distinction N1/N2.
| |
| N2 | ≥ 4 ganglions régionaux métastatiques | ||
| Catégorie M | Métastases à distance (pas de changement) | ||
| M0 | Pas de métastase à distance | ||
| M1 | Présence de métastase(s) à distance | ||
*En italique : les modifications par rapport à l’édition précédente.
Tableau III - Synthèse des stades pTNM
| Stade IA | T1 | N0 | M0 |
| Stade IB | T2 | N0 | M0 |
| Stade IIA | T3 | N0 | M0 |
| Stade IIB | T1-T3 | N1 | M0 |
| Stade III | Tout T | N2 | M0 |
| Stage IV | Tout T | Tout N | M1 |
En pratique, la stratification des tumeurs en fonction de leur caractère résécable, borderline, localement avancé ou métastatique (Tableau IV) est plus utile que la classification TNM (Tempero et al., 2017).
Définition de l'atteinte vasculaire
- La détermination précise de l’atteinte vasculaire en imagerie peut être difficile, notamment pour distinguer une infiltration tumorale d’une zone de fibrose ou inflammatoire.
- Les images de TDM/IRM doivent être analysées en réunion pluridisciplinaire en présence de radiologues, chirurgiens et oncologues/gastroentérologues expérimentés en pathologie bilio-pancréatique.
Tableau IV - Définition des critères de résécabilité selon le stade d'envahissement vasculaire selon le MD Anderson Cancer Center (MDACC) ou le National Comprehensive Cancer Network (NCCN). AMS : artère mésentérique supérieure, AHC : artère hépatique commune, VMS/VP : veine mésentérique supérieure/veine porte, TC : tronc cœliaque
| NCCN 2015 - Consensus Isaji et al.,2018 | |||
|---|---|---|---|
| Résécable | Borderline | Localement avancé | |
| VMS/VP | Contact < 180° sans irrégularité du calibre de la veine | Contact ≥ 180° Contact < 180° avec irrégularité du calibre de la veinesans occlusion et/ou occlusion tumorale chirurgicalement reconstructible | Occlusion tumorale chirurgicalement non reconstructible ou envahissement des principales veines jéjunales |
| AMS | Pas de contact | Contact< 180° | Contact ≥ 180° |
| AHC | Pas de contact | Contact court, quel que soit le degré de circonférence, sans envahissement du tronc cœliaque ou de l’origine de l’artère hépatique commune, chirurgicalement reconstructible | Chirurgicalement non reconstructible |
| TC | Pas de contact | Contact< 180° | Contact ≥ 180° |
VMS : veine mésentérique supérieure ; VP : veine porte ; AMS : artère mésentérique supérieure ; AHC : artère hépatique commune ; TC : tronc coeliaque
- En cas de TIPMP dégénérée, il est fréquent que l’atteinte vasculaire soit surestimée.
- Toutes les extensions vasculaires ne sont pas synonymes de non-résécabilité. En particulier, En particulier, un envahissement de l’artère et/ou de la veine splénique ou d’une artère hépatique droite foie doit pour un AP de la tête ? ne constitue(nt) pas une contre-indication à une résection chirurgicale d’emblée pour un AP du corps ou de la queue du pancréas.
- L’envahissement ganglionnaire de la loge pancréatique est un facteur pronostique indépendant défavorable de la survie, mais ne contre-indique pas une exérèse (Moutardier et al., 2004). En revanche, une atteinte ganglionnaire à distance documentée (hile hépatique, racine du mésentère, rétro-péritonéale ou inter-aortico-cave) est un facteur de très mauvais pronostic et doit contre-indiquer une stratégie de chirurgie première.
Au-delà de la résécabilité anatomique, la prise en compte des critères biologiques (taux de CA19-9, seuil > 500 U/mL) et cliniques (état général, ECOG PS ≥ 1) (critères ABC) (Isaji et al., 2018) permet d’améliorer la stratification pronostique et thérapeutique des patients atteints d’AP potentiellement résécable (Dekker et al., 2024).
| Définition Résécabilité | Anatomique | Biologique | Clinique** |
| Résécable | R-Type A | Non R-Type A Oui BL-Type AB | Non R-Type A Oui BL-Type AC |
| BorderLine | B-Type A | Non BL-Type A Oui BL-Type AB | Non BL-Type A Oui BL-Type AC |
| Localement Avancé | LA-Type A | Non LA-Type A Oui LA-Type AB | Non LA-Type A |
* B CA 19-9 > 500 UI/MI
** C état général OMS 2 ou plus
9.2.6. Stratification pronostique
L'évaluation du patient (performance status [PS], état nutritionnel, comorbidités) est déterminante pour les possibilités thérapeutiques.
9.2.6.1. Tumeurs potentiellement résécables
- Le pronostic est principalement déterminé par les facteurs liés à la tumeur (diamètre, différenciation, envahissement ganglionnaire et/ou des marges chirurgicales), et le fait qu’une chimiothérapie adjuvante puisse être administrée (Neuzillet et al., 2011 ; Groot et al., 2019; Strobel et al., 2022).
- L'âge n'est pas un critère pour récuser les patients pour une approche chirurgicale. En effet, la faisabilité et l’efficacité sur la survie de la chirurgie pancréatique a été démontrée chez les sujets âgés (y compris ceux âgés de plus de 80 ans) (Turrini et al., 2013). Cependant, en cas de comorbidités lourdes, de PS altéré (ECOG > 2) ou de dénutrition sévère malgré des soins de support optimaux, l'abstention d’une chirurgie pourtant techniquement possible peut être justifiée (intérêt d’algorithmes nord-américains pour évaluer le risque de morbidité et de mortalité postopératoires dans ce contexte ; https://riskcalculator.facs.org/RiskCalculator/).
9.2.6.2. Tumeurs avancées
- Les facteurs liés au patient et au volume tumoral métastatique jouent un rôle pronostique majeur.
- L’altération de l'état général (PS ECOG ≥ 2), un âge > 65 ans, une albuminémie < 35 g/L, une qualité de vie altérée, la présence de métastases synchrones et leur localisation hépatique, le nombre de sites métastatiques et un taux sérique élevé de CA 19-9 sont associés négativement à la survie (T. Conroy et al., 2011; Gourgou-Bourgade et al., 2013; Tabernero et al., 2015; Vernerey et al., 2015; Vernerey et al., 2016).
9.2.7. Recommandations d'explorations pré-thérapeutiques
9.2.7.1. REFERENCES
- L’évaluation de l’état général (PS ECOG), des symptômes et de l’état nutritionnel ainsi que des co-morbidités est indispensable.
- Recherche d’un déficit en DPD par phénotypage (dosage de l'uracilémie) avec ajustement des doses de 5FU et capécitabine en cas de déficit partiel et contre-indication du 5FU et de la capécitabine en cas de déficit complet (accord d’experts).
Le bilan diagnostique, d’extension et de résécabilité repose sur :
- la TDM TAP selon le protocole recommandé au paragraphe 9.2.3.1. (niveau de recommandation : grade A).
- l’IRM avec séquences de diffusion en complément de la TDM-TAP pour toute tumeur non métastatique à la TDM TAP pour éliminer des métastases hépatiques de petite taille, à condition que cela ne retarde pas l’intervention chirurgicale ou l’initiation de la chimiothérapie (niveau de recommandation : grade B).
- le CA 19-9 : n’a pas d’utilité diagnostique mais un intérêt pronostique avant laparotomie (en l’absence de cholestase, le seuil de 500 U/mL est proposé Pour la discussion d’une chimiothérapie néoadjuvante en cas de tumeur résécable anatomiquement) et pour le suivi sous traitement ainsi que pour le surveillance après traitement à visée curative (niveau de recommandation : grade B).
Indications de la biopsie :
- Sous EE pour tumeur potentiellement opérable/résécable d’emblée seulement si doute diagnostique ou si un traitement néoadjuvant est envisagé (niveau de recommandation : grade A).
- Avant décision thérapeutique pour tumeur non opérable ou non résécable d’emblée, biopsie du site le plus facilement accessible, préférentiellement sous contrôle EE s’il s’agit du pancréas, ou par voie transpariétale (contrôle échographique ou TDM) en cas de métastase hépatique ou extra-hépatique accessible (niveau de recommandation : grade A).
9.2.7.2. OPTIONS
- EE : son principal intérêt est de permettre la réalisation de biopsies guidées du pancréas (niveau de recommandation : grade A). Autres indications : forte suspicion d’AP non visible avec les autres examens d’imagerie ou masse pancréatique de nature incertaine.
- IRM avec séquences de cholangio-pancréatographie en alternative à la TDM abdomino-pelvienne ou en cas de tumeur pancréatique isodense ou de lésion hépatique indéterminée en TDM (niveau de recommandation : grade B). Elle doit dans ce cas être complétée par une TDM thoracique pour le bilan d’extension.
- Brossage biliaire per-CPRE si indication à un geste de drainage biliaire endoscopique (niveau de recommandation : grade B).
- Laparoscopie avant tentative de résection ou traitement néoadjuvant ou d’induction si volumineuse tumeur du corps ou de la queue et/ou CA 19-9 sérique > 500 U/mL (avis d’experts).
- TEP scan avant traitement néoadjuvant ou d’induction pour évaluation ultérieure de la réponse thérapeutique (à ne répéter après traitement que si positif initialement) (avis d’experts).
- Génotypage du gène DPYD si phénotype DPD (uracilémie) anormal (avis d'experts).
- Dans les cas exceptionnels de patients ayant une tumeur avancée, avec retentissement sur l’état général (PS 2), au moins une tentative de biopsie diagnostique non contributive, et une indication de chimiothérapie urgente, un faisceau d’arguments cliniques, biologiques (CA 19-9 > 10N sans cholestase) et radiologiques (tumeur hypodense au scanner avec injection de produit de contraste) peut être suffisant pour débuter une chimiothérapie sous réserve de validation de cette décision en RCP (avis d'experts).
9.3. Dépistage des lésions précancéreuses et des formes familiales
9.3.1. Lésions précancéreuses
- Elles comprennent les néoplasies intra-épithéliales (PanIN), les tumeurs intra-canalaires papillaires et mucineuses du pancréas (TIPMP) et les cystadénomes mucineux (Basturk et al., 2015; Lennon et al., 2014; Vogelstein et al., 1988).
- Des signes radiologiques préoccupants ont été définis pour guider les indications opératoires des TIPMP et des cystadénomes mucineux (European Study Group on Cystic Tumours of the, 2018 ; Ohtsuka et al., 2024). Sont en faveur d’une résection :
- pour les TIPMP :
- indications relatives (« worrisome features ») : (i) pancréatite aiguë, (ii) CA19.9 >37 U/mL en l’absence de cholestase, (iii) diabète d’apparition ou d’exacerbation récente (≤ 1 an), (iv) kyste/canal secondaire ≥ 30 mm, (v) nodule mural de diamètre < 5 mm, (vi) paroi du kyste épaissie/prenant le contraste, (vii) diamètre du canal de Wirsung ≥ 5 et < 10 mm, (viii) changement abrupte de calibre du canal de Wirsung avec atrophie pancréatique d’amont, (ix) adénopathie suspecte, (x) croissance du kyste ≥ 2,5 mm/an ;
- indications absolues (« high risk stigmata ») : (i) ictère, (ii) nodule mural ≥ 5 mm prenant le contraste, masse solide ou (iii) diamètre du canal de Wirsung ≥ 10 mm, (iiii) cytologie positive (cancer ou dysplasie de haut grade).
- pour les cystadénomes mucineux : (i) diamètre ≥ 40 mm, ou (ii) nodule prenant le contraste.
- pour les TIPMP :
- Il est recommandé de réaliser une surveillance par IRM et/ou EE tous les 6 mois la première année, puis annuelle (European Study Group on Cystic Tumours of the, 2018).
- La cohorte prospective TEAM-P a inclus 1817 patients ayant une TIPMP des canaux secondaires. Avec un suivi médian depuis le début des symptômes de 4,29 ans, le taux de cancérisation était inférieur à 1 %, suggérant qu’une surveillance annuelle par IRM ou échoendoscopie est excessive (Rebours et al., 2022).
- Les recommandations internationales de prise en charge des TIPMP sont régulièrement actualisées et insistent sur l’importance d’identifier les formes à risque (worrisome features) et très haut risque de transformation malignes (high-risk stigmata) et proposent d’adapter la surveillance selon des critères d’imagerie plus précis (Ohtsuka et al., 2024).
9.3.2. Formes génétiques
- Une susceptibilité génétique expliquerait environ 5%-10% des AP (de Mestier, Védie, Salfati, Rebours, & Hammel, 2017; Ryan, Hong, & Bardeesy, 2014).
- Les cancers du pancréas familiaux (CaPaFa) sont définis par la survenue d’un AP, quel que soit l’âge de diagnostic, chez au moins 2 apparentés au premier degré, ou chez au moins 3 apparentés quels que soient le degré de parenté (Goggins et al., 2020). La discussion concernant le dépistage s’applique alors aux apparentés au 1er degré des cas index.
- Les situations et syndromes de prédisposition héréditaires indiqués dans le Tableau V sont associés à un risque augmenté de développer un AP (Canto et al., 2013; de Mestier et al., 2017).
- Aucune mutation germinale n’est actuellement identifiée dans près de 85 % des cas de CaPaFa (contexte d’agrégation familiale non syndromique), et à l’inverse des mutations germinales (BRCA1/2, ATM, PALB2, MLH1, CDKN2A et TP53) peuvent être identifiées chez des patients sans histoire familiale (Shindo et al., 2017).
Tableau V - Risque de développer un adénocarcinome pancréatique et principaux syndromes héréditaires de prédisposition à l’adénocarcinome du pancréas
| Histoires familiales et syndromes de prédisposition héréditaires | Gène(s) | Risque relatif | Risque d’AP à 70 ans (%) | % parmi les CaPaFa | Autres cancers liés |
| Pas d’antécédent familial | - | 1 | 0,5-1 | - | - |
| 2 apparentés au premier degré atteints d’AP | Inconnus | 4-6 | 5-12 | 80-85 | ? |
| ≥ 3 apparentés au premier degré atteints d’AP | Inconnus | 20-40 | 40 | ? | |
| Cancers héréditaires du sein et de l’ovaire | BRCA1 | 2-4 | 3-4 | 1-5 | Sein, ovaire, prostate, +/- côlon, mélanome |
| BRCA2 | 2-10 | 4-5 | 5-20 | ||
| PALB2, FANC-C/G | 2-6 | 4-5 | 1-3 | ||
| Pancréatite héréditaire | PRSS1 | 50-80 | 40-55 | 1-4 | |
| Mélanomes multiples héréditaires (FAMMM) | p16/CDKN2A | 10-25 | 5-25 | 2-3 | Mélanome, rein, ORL glioblastome, plèvre |
| Peutz-Jeghers | LKB1/STK11 | 100-130 | 30-40 | 1-3 | Côlon, estomac, intestin grêle, sein, col utérin, ovaire, testicule |
| Lynch | hMLH1, hMSH2, hMSH6, PMS1/2 | 4-8 | 3-5 | 1-3 | Côlon, endomètre, intestin grêle, estomac, voies urinaires, ovaire, voies biliaire |
| Ataxie-télangiectasie | ATM | ? | ? | < 2 % | Hémopathies, sein, estomac |
| Li-Fraumeni | TP53 | ? | ? | < 2 % | Sarcomes, sein, hémopathies, cerveau, surrénale |
| Mc Cune Albright | GNAS | ? | ? | 0% | thyroïde TIPMP |
9.3.3. Dépistage
- L’objectif du dépistage de l’AP est de détecter les lésions précancéreuses (PanIN de haut grade et TIPMP en dysplasie de haut grade) accessibles à une prise en charge chirurgicale précoce à visée curative et donc seulement chez les sujets éligibles à une chirurgie pancréatique.
- Il s’applique aux individus ayant un risque théorique cumulé d’AP > 5 % au cours de la vie ou un risque relatif estimé ≥ 5 (Bartsch et al., 2016; Canto et al., 2013; de Mestier et al., 2017; Goggins et al., 2020): (i) ayant ≥ 2 apparentés atteints d’AP dont ≥ 1 au premier degré ; (ii) porteurs d’une mutation germinale d’un gène de prédisposition et ayant ≥ 2 apparentés atteints d’un AP ou ≥ 1 au premier degré ; (iii) tout patient atteint d’un syndrome de Peutz-Jeghers (mutation de LKB1/STK11), d’une mutation germinale de CDKN2A ou de PRSS1, indépendamment de l’histoire familiale.
- Ces sujets doivent être adressés à des centres experts pour consultation d’oncogénétique et discussion en RCP du rapport bénéfice/risque et des modalités (types d’examens, intervalles) d’un éventuel dépistage, conformément aux recommandations internationales CAPS (Goggins et al, 2020).
- Dans tous les cas, la prise en charge des sujets à risque doit inclure la correction des éventuels co-facteurs de risque (tabagisme, surpoids ou diabète) et prendre en compte leur espérance de vie et opérabilité, ainsi que l’acceptabilité psychologique du dépistage, une fois expliquées ses contraintes et ses incertitudes quant à son efficacité.
REFERENCES (accord d’experts)
- Le dépistage est indiqué chez les sujets ayant un risque théorique cumulé d’AP > 5 % ou un risque relatif ≥ 5 :
- ayant ≥2 apparentés atteints d’AP dont ≥1 au premier degré ;
- ou ayant une mutation germinale d’un gène de prédisposition et ≥2 apparentés atteint d’un AP ou ≥1 au premier degré ;
- ou un syndrome de Peutz-Jeghers, une mutation germinale du gène CDKN2A/p16 ou du gène PRSS1 ;
- et éligibles à une éventuelle résection pancréatique (espérance de vie théorique, co-mordibités) ;
- et après discussion des avantages potentiels et risques d’un tel dépistage (accord d’experts).
- Les modalités de dépistage sont à discuter en RCP d’oncogénétique en centre expert (accord d’experts) et doivent reposer sur des examens non irradiants (EE et IRM).
- La correction des autres facteurs de risque est recommandée (tabagisme, obésité, diabète) (accord d’experts).
9.4. Traitements
9.4.1. Tumeurs résécables d’emblée
9.4.1.1. Chirurgie
Après une évaluation pré-thérapeutique rigoureuse, seuls 15 % à 20 % des patients sont candidats à une résection chirurgicale.
L'objectif de la chirurgie est de réaliser une résection en limites saines (marges R0) pour espérer qu’elle soit à visée curative (Seufferlein, Bachet, Van Cutsem, Rougier, & Group, 2012). Pour cela, elle doit être réalisée dans un centre expert à haut volume, dont la définition précise reste controversée mais dont le seuil minimal de résection pancréatique en France a été fixé à 5 par an (Farges et al., 2017; Nimptsch, Krautz, Weber, Mansky, & Grutzmann, 2016), et dans les 3-4 semaines suivant la dernière évaluation scanographique (Sanjeevi et al., 2016).
- Il faut identifier et déterminer dès le diagnostic :
(i) d’éventuelle(s) contre-indication(s) opératoire(s) : métastases à distance, contre-indication technique ou comorbidités ;
(ii) le risque de mortalité post-opératoire ;
(iii) les possibilités d’exérèse R0 (résécable d’emblée versus borderline faisant discuter un traitement d’induction) ;
(iv) la prise en charge optimale d’un éventuel ictère et de l’état nutritionnel (pré-habilitation).
Le type de résection chirurgicale est déterminé par la localisation et l’extension de la tumeur (J.R. Delpero, Paye, & Bachellier, 2010).
- Pour les cancers de la tête du pancréas, la duodéno-pancréatectomie céphalique (DPC) par laparotomie est l'intervention de référence.
- Un curage ganglionnaire, emportant au moins 15 ganglions (Tol et al., 2014) et les relais 5, 6, 8a, 12b1, 12b2, 12c, 13a, 13b, 14a, 14b, 17a, et 17b (Figure 1), et une résection de la lame rétroporte mettant à nu le bord droit de l’artère mésentérique supérieure doivent être réalisés. Une chirurgie plus agressive, avec lymphadénectomie étendue et/ou résection artérielle en bloc, n'améliore pas la survie à long terme et n'est pas recommandée (Martin et al., 2009; Tol et al., 2014)
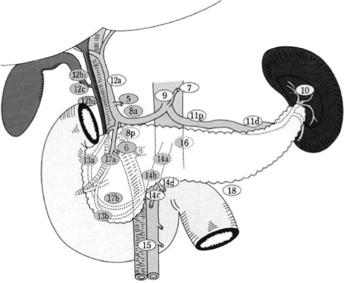
- La conservation du pylore n’a pas d’influence pronostique négative (Diener et al., 2014; Hackert et al., 2017).
- Un picking inter-aortico-cave avec examen extemporané est une option (Schwarz et al., 2014).
- La présence d’une artère hépatique droite ou d’un ligament arqué ne contre-indique pas définitivement une tentative de résection carcinologique, mais doivent être dépistés en pré-opératoire (Eshuis, Olde Loohuis, Busch, van Gulik, & Gouma, 2011; Sulpice et al., 2013; Turrini et al., 2010).
- Les AP du corps ou de la queue du pancréas sont traités par spléno-pancréatectomie gauche (SPG), qui doit être réalisée de la droite vers la gauche avec un curage ganglionnaire associé, emportant au moins les relais 10, 11, et 18. Il doit comporter de 15 à 20 ganglions (Malleo et al., 2018).
- La voie d’abord chirurgicale laparoscopique (et mini-invasive en général) est à présent validée pour les pancréatectomies distales pour AP, en terme de récupération fonctionnelle (étude LEOPARD, de Rooij et al., 2019), de morbidité (Klompmaker et al., 2021), ainsi que de qualité d’exérèse chirurgicale et de résultats oncologiques, depuis les résultats de l’étude de non-infériorité DIPLOMA (Korrel et al., 2023). Elle ne doit être réalisée que par des équipes et des opérateurs qui en ont l’experience. En revanche, elle n’est pas recommandée pour les tumeurs céphaliques (étude LEOPARD-2, van Hilst et al., 2019 et méta-analyse de Nickel et al., 2020).
- Les indications de la pancréatectomie totale sont très rares :
(i) une tumeur intra-canalaire papillaire et mucineuse (TIPMP) diffuse dégénérée ;
(ii) ou une nouvelle tumeur (ou plus rarement une récidive loco-régionale unique) localisée au pancréas restant.
- Un examen pathologique extemporané est systématique pour écarter un envahissement de la tranche de section pancréatique et éventuellement élargir le geste.
- La définition d’une résection R0, dont le taux a été précédemment surestimé, nécessite un examen attentif des marges de résection incluant l'encrage multicolore par le chirurgien des trois marges de résection (VMS/VP, AMS et marge postérieure). Une résection R0 doit être définie comme une clairance (distance cellules tumorales-marge) >1 mm (J. R. Delpero et al., 2014; J. R. Delpero et al., 2017).
- La pièce opératoire doit être classifiée selon l’OMS 2010 et l’AJCC 2017. La standardisation du compte-rendu, par exemple selon les items du Royal College of Pathologists (www.rcpath.org) ou le College of American Pathologists (www.cap.org) (qui propose un score d’évaluation de la réponse tumorale après traitement néoadjuvant/d’induction), est encouragée.
9.4.1.2. Drainage biliaire
- La CPRE avec pose d’une prothèse biliaire avant chirurgie n’est pas systématique car on observe une augmentation du taux de complications, notamment infectieuses, après drainage biliaire préopératoire, plus particulièrement en cas de prothèse plastique (Eshuis et al., 2010; van der Gaag et al., 2010).
- En cas d’indication d’un drainage biliaire, il doit être réalisé avec une prothèse métallique courte car le taux de complication est inférieur à celui des prothèses plastiques (Tol et al., 2016).
- Le drainage bilaire sous échoendoscopie par prothèse Axios est à discuter en cas d’échec de drainage par CPRE et par un opérateur expérimenté.
- Un drainage endoscopique est discuté en cas de :
(i) angiocholite ;
(ii) taux de bilirubine > 250 μmol/L ;
(iii) traitement néoadjuvant envisagé ;
(iv) chirurgie différée (> 3-4 semaines).
9.4.1.3. Traitement adjuvant
Environ 80 % des patients opérés à visée « curative » pour un AP localisé auront une récidive locale ou métastatique (Hishinuma et al., 2006 ; Groot et al., 2019; Strobel et al., 2022).
Un traitement adjuvant est indiqué chez tous les patients opérés d'un AP, quel que soit le stade pTNM, et en mesure de pouvoir le débuter dans les 3 mois suivant la chirurgie.
- Depuis 2001, la chimiothérapie adjuvante est le standard (étude de phase III ESPAC-1, chimiothérapie par 5-fluorouracile [5-FU] en bolus et acide folinique [AF] supérieure à observation) (Neoptolemos et al., 2001; Neoptolemos et al., 2004). Sur la base des études de phase III CONKO-001 (Oettle et al., 2013) (gemcitabine supérieure à observation) et ESPAC-3 (Neoptolemos et al., 2010) (gemcitabine aussi efficace que 5-FU, mais moins toxique), 6 mois de chimiothérapie adjuvante par gemcitabine ou 5-FU sont recommandés. L’expression du transporteur hENT-1 a été proposée comme marqueur prédictif de l’efficacité de la gemcitabine (Greenhalf et al., 2014), mais ne peut être recommandée en raison de résultats discordants et en l’absence d’anticorps validé pour la routine (Svrcek et al., 2015).
- En 2017, l’étude de phase III ESPAC-4 a montré une augmentation de la SG à 28 mois versus 25,5 mois (hazard ratio [HR] : 0,82, p=0,032) avec l’association gemcitabine plus capécitabine versus gemcitabine seule (Neoptolemos et al., 2017). Cette étude a fait l’objet de critiques méthodologiques, en particulier du fait de l’absence de scanner post-opératoire à l’inclusion et surtout de l’absence de bénéfice significatif en survie sans maladie (SSM) (T. Conroy, Gourgou, & Malka, 2017). Néanmoins, compte tenu de la différence significative observée pour la SG, la combinaison gemcitabine plus capécitabine est une option en situation adjuvante.
- Le composé S-1, un dérivé oral de fluoropyrimidine, s'est révélé non inférieur, et même supérieur à la gemcitabine dans un essai randomisé de phase III dans une population japonaise (JASPAC-01) mais ce produit n’a pas été testé en Europe et n’est pas disponible (Uesaka et al., 2016).
- Deux études randomisées, la phase III CONKO-005 (après résection R0) et la phase IIb CONKO-006 (après résection R1), évaluant respectivement l'adjonction d'erlotinib ou de sorafenib à la gemcitabine adjuvante n'ont pas montré d’amélioration de la SSM ni de la SG (Sinn et al., 2017; Sinn et al., 2014).
- Les résultats de l’étude de phase III PRODIGE 24 publiés en 2018 (Conroy et al., 2018) ont été actualisés en 2022 (Conroy et al., 2022). Elle démontrait la supériorité du mFOLIFIRINOX sur la gemcitabine, en situation adjuvante : SSM médiane de 21,4 mois (IC 95%, 17,5-26,7) vs 12,8 mois (IC 95%, 11,6-15,2) (HR 0,66; IC 95%, 0,54-0,82; P < 0,001), SG médiane de 53,5 mois (IC 95%, 43,5-58,4) vs 35,5 mois (IC 95%, 30,1-40,3) (HR, 0,68; IC 95%, 0,54-0,85; P = 0,001), et taux de SG à 5 ans de 43,2% vs 31,4%, survie médiane sans métastase de 29,4 mois (IC 95%, 21,4-40,1) vs 17,7 mois (IC 95%, 14,0-21,2) (HR, 0,64; IC 95%, 0,52-0,80; P < 0,001); survie spécifique au cancer de 54,7 mois (IC 95%, 45,8-68,4) vs 36,3 mois (IC 95%, 30,5-43,9) (HR, 0,65; IC 95%, 0,51-0.82; P < 0,001). En analyse multivariée, l’âge, le grade et l’extension tumorale, ainsi qu’un nombre plus élevé de patients traités par centre étaient des facteurs pronostiques favorables de survie.
- En revanche, l’’étude de phase III APACT n’a pas montré de supériorité de l’association gemcitabine plus nab-paclitaxel sur la gemcitabine seule sur le critère principal de jugement (DFS en relecture centraliée) (Tempero et al., 2019).
- La chimiothérapie apporte un bénéfice de survie quels que soient les statuts T, N et R (T. Conroy et al., 2018; Neoptolemos et al., 2017).
- Quelle que soit la chimiothérapie choisie, il est important de la réaliser en totalité (6 mois) même si son initiation est retardée (mais avec un délai ne devant pas dépasser 3 mois) (Valle et al., 2014). Dans l’étude PRODIGE 24, le fait d’avoir reçu les 12 cycles prévus était associé à une réduction du risque de décès (HR : 0,64, IC 95% 0,49-0,84, p=0,002), alors qu’il n’y avait pas d’effet de la dose-intensité/réductions de dose, de la durée totale d’administration ou du délai d’initiation (Conroy et al., 2022).
- La radiothérapie en situation adjuvante n'est pas recommabdée (études contradictoires mais anciennes et protocoles d'irradiation non optimaux/non contrôlés) (Corsini et al., 2008; Hsu et al., 2010; Klinkenbijl et al., 1999; Liu et al., 2015; Lutz et al., 2017; McDonald et al., 2015; Neoptolemos et al., 2004; Stocken et al., 2005; Van Laethem et al., 2010). Même en cas de résection R1, aucun gain de survie n'a été observé avec la chimioradiothérapie adjuvante dans un essai prospectif. Un essai randomisé dans cette indication est en cours aux États-Unis (RTOG-0848, NCT01013649). La chimioradiothérapie en situation adjuvante n’est donc pas recommandée même en clôture en cas de résection R1.
9.4.1.4. Traitement néoadjuvant
Cette stratégie n’est actuellement pas la référence, mais des essais randomisés sont en cours pour évaluer son intérêt.
- Son rationnel est de: (i) se donner un temps d'observation (4-6 mois) pour identifier les patients atteints d'une tumeur agressive, à l’évolution métastatique précoce, qui ne sont pas de bons candidats à la chirurgie (environ 30 %) ; (ii) induire une réponse tumorale et ainsi augmenter les chances de résection R0 ; (iii) traiter précocement une éventuelle maladie micrométastatique ; (iv) tester la chimiosensibilité de la tumeur, ainsi que la tolérance du patient au traitement comme éléments de sélection pour la chirurgie (v) : d’améliorer le taux de patients recevant un traitement combiné de chirurgie et chimiothérapie (40 %-60 % des patients ne reçoivent pas de traitement adjuvant après chirurgie)..
- Les méta-analyses de Gillen et al. (Gillen, Schuster, Meyer Zum Buschenfelde, Friess, & Kleeff, 2010) et Assifi et al. (Assifi et al., 2011), très fréquemment citées, ont été critiquées pour leur méthodologie, rassemblant des études très hétérogènes et de petits effectifs ; de plus, les associations FOLFIRINOX et gemcitabine plus nab-paclitaxel, ultérieures à leur parution, n’ont pas été prises en compte.
- L’étude de phase II randomisée non comparative PANACHE-01 a évalué la chirurgie d’emblée vs. une chimiothérapie néoadjuvante par FOLFOX ou FOLFIRINOX modifié chez des patients ayant un AP résécable (Schwarz et al., 2022). Le bras FOLFOX a été arrêté après l’analyse intermédiaire pour efficacité insuffisante. L’administration des 4 cycles de mFOLFIRINOX a été possible chez 88,6 % des patients, avec une réduction de dose dans 52 % des cas. Le taux de résection complète après mFOLFIRINOX était de 61 % vs 53 % en cas de chirurgie d’emblée. Le taux de survie à 1 an était de 84,1 %, contre 80,8 % chez les patients opérés d’emblée. Ces résultats montraient que la chimiothérapie néoadjuvante était faisable et non délétère.
- D’autres études de phase II randomisées, avec des faiblesses méthodologiques, ne sont pas parvenues à montrer un bénéfice à la chimiothérapie néoadjuvante par FOLFIRINOX (étude NORPACT, Labori et al., 2024) ou gemcitabine plus nab-paclitaxel (étude NEONAX, seufferlein et al., 2023) vs. chirurgie d’emblée.
- Dans une méta-analyse ayant repris les résultats de 6 études randomisées de phase II ou III avec un échantillon combiné de 805 patients (dont les essais PACT-15, PREP-02/JSAP-05 et les résultats à long terme actualisés des essais PREOPANC et NEONAX), la chimiothérapie ou la chimioradiothérapie néoadjuvante n'amélioraient pas la SSM ou la SG dans les AP résécables d’emblée par rapport à la chirurgie suivie d'un traitement adjuvant (Uson Junior et al., 2023). Le traitement néoadjuvant améliorait les taux de résection R0 d’environ 20 %.
- Des questions restent en suspens concernant : (i) l’intérêt d’administrer une chimioradiothérapie pré-opératoire après la chimiothérapie et (ii) le type et la durée de chimiothérapie adjuvante dans cette situation, et son bénéfice selon la réponse tumorale au traitement néoadjuvant (Hammad et al., 2023). Certaines de ces questions seront explorées dans l’étude PANACHE-02.
- La chimiothérapie néoadjuvante n’étant pas délétère, tant sur le plan de la morbidité chirurgicale, que sur les résultats oncologiques, elle peut être discutée comme une option à la chirurgie première, en traitement de sélection à la chirurgie, en particulier dans les situations suivantes :
o Lésion volumineuse et/ou de contours mal limités avec doute sur extension extrapancréatique (lésions infiltrantes avec risque d’engainement perinerveux) et possibilités de resection R0 incertaine
o CA 19-9 > 500 U/mL
o Extension ganglionnaire suspectée sur examen scannographique de référence (à noter que > 65 % d’envahissement ganglionnaire est trouvé après chirurgie première)
o Dénutrition modérée à sévère avec impact sur l’état général, dont la correction est possible par une préhabilitation bien menée (Isaji et al., 2018 ; Dekker et al., 2024).
9.4.2. Tumeurs borderline
9.4.2.1. Traitement
Leur prise en charge doit se faire idéalement dans un centre expert et si possible dans le cadre d’un essai clinique.
- En raison du risque élevé de résection R1 et malgré l’absence d’étude de haut niveau de preuve, un traitement d’induction doit être privilégié à une chirurgie d’emblée. La faisabilité et la tolérance de celle-ci semblent correctes. Les taux de résection R0, de réponses tumorales majeures, et de survie prolongée, dans le sous-groupe des malades opérés, notamment après FOLFIRINOX, sont prometteurs (Bockhorn et al., 2014; J. R. Delpero et al., 2015; Katz et al., 2016; Pietrasz et al., 2015, Janssen et al., 2019).
- Les résultats des premières études prospectives de phase II randomisées sont clairement en faveur d’un traitement d’induction systématique (ESPAC-5F, Ghaneh P, et al., 2023 ; PREOPANC, Versteijne et al.,2020 ; Jang et al., 2018).
- Dans les essais en cours, cette stratégie d’induction se base le plus souvent sur une chimiothérapie de type FOLFIRINOX ou gemcitabine plus nab-paclitaxel.
- La nécessité de la faire suivre d’une chimioradiothérapie est discutée. Il semblerait que celle-ci augmente le taux de réponse histologique (Pietrasz et al., 2015). Cette question est explorée dans l’étude PRODIGE 44 PANDAS (phase II, randomisée multicentrique, évaluant l’efficacité d’une chimiothérapie d’induction par mFOLFIRINOX, suivie ou non d’une chimioradiothérapie concomitante avec capécitabine avant chirurgie d’un adénocarcinome du pancréas à la limite de la résécabilité) dont les inclusions sont terminées. De nouvelles modalités de radiothérapie (stéréotaxie, IRM Linac, protons) sont également en cours d’exploration.
- Il n’existe actuellement pas de données prospectives sur l’efficacité de la chimiothérapie adjuvante et de la durée requise après un traitement d’induction suivi de chirurgie.
9.4.2.2. L'évaluation de la réponse tumorale
- Elle se base sur un faisceau d’arguments cliniques (diminution de la douleur), biologiques (diminution du CA 19.9 s’il était élevé) et d’imagerie (Evans et al.,2015).
- L'évaluation de la réponse tumorale après traitement d’induction par imagerie est difficile (Cassinotto et al., 2014; Ferrone et al., 2015; Wagner et al., 2017). La corrélation entre la réponse radiologique et la réponse anatomopathologique est mauvaise, et une absence de réponse radiologique ne doit pas contre indiquer une exploration chirurgicale pour évaluer la possibilité d’une résection.
- Un aspect d’infiltration périvasculaire persiste souvent et il est difficile de distinguer des remaniements fibro-inflammatoires d’une infiltration tumorale résiduelle (Kim et al., 2009). Néanmoins, la diminution de la taille tumorale et surtout du contact entre la tumeur et les vaisseaux et/ou le rétablissement du calibre vasculaire, suggèrent la possibilité d’aboutir à une résection R0, et doivent inciter à réaliser une exploration chirurgicale (Cassinotto et al., 2014).
- Un autre critère d’efficacité important est l’absence d’apparition de métastases à distance, qui du fait de la difficulté d’évaluation de la réponse thérapeutique locale, peut suffire à inciter à l’exploration chirurgicale.
- La disparition des douleurs pancréatiques et la diminution voire une normalisation du taux de CA 19-9 peuvent aussi guider l’indication opératoire (Bockhorn et al., 2014; Takahashi et al., 2010). L’évolution de la fixation au PET scan pourrait aussi être utile (Soloff et al., 2022 ; Abdelrahman et al., JNCCN 2022).
- Il n'y a pas de consensus sur les critères d’analyse pathologique permettant de définir la réponse tumorale (pourcentage de cellules résiduelles, nécrose, fibrose) et leur valeur pronostique est controversée ; le score du College of American Pathologists est le système de classification le plus largement utilisé (Verbeke, Lohr, Karlsson, & Del Chiaro, 2015; Washington et al., 2014).
9.4.3. Tumeurs localement avancées
9.4.3.1. Chimiothérapie
Le traitement de référence des AP localement avancés est la chimiothérapie qui, comme pour les tumeurs borderline, ne doit pas prendre l’appellation de “néoadjuvante” car la résection secondaire n’est pas la règle, même si elle peut être envisagée dans certains cas favorables. On doit parler de chimiothérapie « d’induction ».
- La gemcitabine a longtemps été la chimiothérapie de référence, sur la base des études menées dans les AP «avancés», regroupant des patients atteints de tumeurs métastatiques et localement avancées.
- L'ajout de l'erlotinib à la gemcitabine ne s'est pas avéré supérieur dans l'étude LAP07 (Hammel et al., 2016).
- Au vu des résultats obtenus avec les associations FOLFIRINOX et gemcitabine plus nab-paclitaxel en situation métastatique et par extrapolation, elles ont été testées chez des patients atteints d’un AP localement avancé avec des résultats intéressants (Ferrone et al., 2015; Mahaseth et al., 2013; Marthey et al., 2015; Petrelli et al., 2015; Suker et al., 2016, Philip et al., 2020).
- L’étude de phase III NEOPAN a montré la supériorité du FOLFIRINOX sur la gemcitabine pour la survie sans progression (SSP, objectif principal) : 9,7 mois (IC 95%, 7-11,7) vs. 7,5 mois (IC 95%, 6,1-9,2), p=0,03 (Ducreux et al., 2023). La SG n’était pas statistiquemnent différente : 15,1 mois (IC 95%, 11,9-20,4) vs. 15,6 mois (IC 95%, 12,5-18,7, p=0,50).
- Les problématiques d’imagerie et d'examen pathologique après traitement d’induction sont les mêmes que pour les tumeurs borderline (Ferrone et al., 2015; Verbeke et al., 2015).
9.4.3.2. Radiothérapie
- La place de la radiothérapie n’est pas consensuelle.
- Elle peut être proposée comme traitement de « clôture » après une chimiothérapie d'induction de 3 à 6 mois (afin d’écarter les patients mauvais candidats avec une évolution tumorale agressive métastatique précoce) et avec administration concomitante de capécitabine à visée radiosensibilisante (Chauffert et al., 2008 ; F. Huguet et al., 2007 ; Krishnan et al., 2007; Loehrer et al., 2011 ; Mukherjee et al., 2013).
- L'étude de phase III LAP07 n'a pas montré de supériorité en terme de SG avec la chimioradiothérapie par rapport à la poursuite de la chimiothérapie initiale(Hammel et al., 2016). Une analyse secondaire indiquait que l’administration de la chimioradiothérapie était associée à un meilleur contrôle local et à un délai plus long avant reprise d'un traitement (F. Huguet et al., 2014).
- L’étude de phase III CONKO-007 (Fietkau et al, 2022) a comparé, chez des patients ayant un AP localement avancé sans progression après une chimiothérapie d’induction (gemcitabine ou FOLFIRINOX), la poursuite de la chimiothérapie ou une chimioradiothérapie (50,5 Gy, gemcitabine concomitante). L’objectif principal initial était la survie globale, mais a été remplacé par le taux de résection R0 en raison d’un recrutement insuffisant. L’étude a inclus 495 patients ayant débuté la chimiothérapie d’induction (402 avec FOLFIRINOX, 93 avec gemcitabine) et 336 patients ont ensuite été randomisés. Soixante patients dans le bras chimiothérapie ont été opérés et 62 patients dans le bras chimioradiothérapie. Dans la population randomisée, le taux de résection secondaire était élevé (36% dans les deux bras) avec des taux de résection R0 de 18% dans le bras chimiothérapie, versus 25 % dans le bras chimioradiothérapie (p=0,11). Il n’y avait pas de différence en termes de SSP et survie sans récidive entre les bras.
- Les données sont insuffisantes pour évaluer spécifiquement les effets de la radiothérapie chez les patients avec AP localement avancées « définitivement non résécables » en traitement de clôture, vs. ceux chez lesquels la chimioradiothérapie vient compléter une séquence d’induction avant exploration chirurgicale.
- De nouvelles modalités de radiothérapie (stéréotaxie, IRM Linac, protons) sont également en cours d’exploration.
La chimioradiothérapie de « clôture » définitive ou en fin d’induction avant exploration chirurgicale reste une option à discuter en RCP chez des patients sélectionnés.
9.4.3.3. Chirurgie
- La chirurgie de dérivation des AP non résécables de la tête du pancréas n’a pas de place chez un patient asymptomatique.
- Un traitement endoscopique (prothèse biliaire et/ou duodénale) est à préférer chez les patients symptomatiques.
- En cas de découverte per-opératoire d’une contre-indication à un geste chirurgical curatif, il est licite, chez un patient ayant une sténose biliaire justifiant un drainage, de réaliser une anastomose cholédoco-duodénale, plus simple à réaliser et aussi efficace que l'anastomose cholédoco-jéjunale.
- La réalisation d’une gastro-jéjunostomie prophylactique pour mettre à l’abri des conséquences d’une sténose duodénale ne semble pas justifiée.
- En cas d’obstruction digestive haute chez un patient non candidat à un geste chirurgical potentiellement curatif, un traitement endoscopique est à préférer en première intention (Ducreux et al., 2015).
9.4.4. Formes métastatiques
9.4.4.1. Chimiothérapie de première ligne
- La chimiothérapie par gemcitabine a été établie comme référence dans le traitement de l’AP avancé en 1997, sur la base d’une étude de phase II randomisée ayant montré sa supériorité par rapport au 5-FU en termes de bénéfice clinique (Burris et al., 1997).
- Ensuite, de multiples études de phase II et III ont tenté d’améliorer les résultats de la gemcitabine, soit par modulation de sa pharmacocinétique, soit par association avec d’autres agents. Cependant, ni la perfusion de gemcitabine à un débit optimisé (fixed dose rate, FDR) (Poplin et al., 2009), ni le CO-101, sa forme conjuguée à un lipide (Poplin et al., 2013), n’ont montré de supériorité. Parallèlement, l’association à d’autres molécules de chimiothérapie ou de thérapies dites ciblées a aussi été décevante. Les résultats des méta-analyses regroupant ces essais ont montré que le bénéfice des doublets de chimiothérapie (en particulier, gemcitabine avec dérivés de platine ou capécitabine) était restreint aux patients en bon état général (PS 0-1) (Bria et al., 2007; Ciliberto et al., 2013; Heinemann, Boeck, Hinke, Labianca, & Louvet, 2008; Sultana et al., 2007; Xie et al., 2010). Les thérapies ciblées (notamment les anti-angiogéniques, les agents ciblant le récepteur de l’EGF, de l’IGF, les voies de Hedgehog et des MAP kinases, ou l’acide hyaluronique) n’ont apporté aucun bénéfice de SG en association avec la gemcitabine versus gemcitabine seule, excepté pour l’association gemcitabine plus erlotinib, qui procurait un gain de SG statistiquement significatif mais cliniquement très modeste (< 1 mois) (Bramhall et al., 2002; Catenacci et al., 2015; Fuchs et al., 2015; Goncalves et al., 2012; Harder et al., 2012; Kindler et al., 2011; Kindler et al., 2010; Moore et al., 2007; Philip et al., 2010; Philip et al., 2014; Rinehart et al., 2004; Rougier et al., 2013; Safran et al., 2011; Van Cutsem et al., 2004; Van Cutsem et al., 2009; Van Laethem et al., 2017, Van Cutsem et al., 2020).
- L'inefficacité de l'erlotinib chez les patients ayant un AP localement avancé dans l'essai LAP07 est un argument supplémentaire contre son utilisation dans cette indication (Hammel et al., 2016).
- En 2011, l’étude de phase III PRODIGE-4/ACCORD-11 a démontré la supériorité du schéma FOLFIRINOX par rapport à la gemcitabine (SG médiane : 11,1 contre 6,8 mois, p<0,001) chez des patients âgés de moins de 75 ans avec PS 0-1 et taux de bilirubine < 1,5 fois la limite supérieure de la normale (LSN) (Conroy et al., 2011). Une plus grande fréquence d’événements indésirables a été observée dans le groupe FOLFIRINOX, dont 5,4% de patients ayant eu une neutropénie avec fièvre. Le FOLFIRINOX modifié (mFOLFIRINOX, sans bolus de 5-FU +/- diminution de la dose d’irinotécan à 150 mg/m2) semble avoir un meilleur profil de tolérance et une efficacité maintenue au vu des études rétrospectives ultérieures (Mahaseth et al., 2013). La place des stratégies de maintenance (allègement du FOLFIRINOX) après une période de contrôle tumoral, reste à préciser ; les résultats de l’étude de phase II randomisée PRODIGE 35 PANOPTIMOX suggèrent que la maintenance par LV5FU2 après 4 mois de chimiothérapie d’induction par FOLFIRINOX est une option (Dahan et al., 2021).
- En 2013, l’association de la gemcitabine au nab-paclitaxel a aussi montré une augmentation significative de la SG (médiane : 8,5 contre 6,7 mois, p<0,001) en comparaison avec la gemcitabine seule dans l’étude de phase III MPACT (Von Hoff et al., 2013). Cela a conduit à une AMM mais sans remboursement en France.
- Il n’existe pas d’étude comparant directement FOLFIRINOX et gemcitabine plus nab-paclitaxel en population non-asiatique ni de marqueur prédictif de réponse validé pour l’un ou l’autre de ces schémas. L’étude NAPOLI-3 (Wainberg et al., 2023) a montré une supériorité de du NALIRIFOX (5FU, irinotécan liposomal [nal-IRI] et oxaliplatine à 60 mg/m2) sur l’association gemcitabine plus nab-paclitaxel, avec une SG médiane de 11,1 mois vs. 9,2 mois (HR 0,83 ; IC 95% 0,70-0,99 ; p=0,036). Néanmoins, le nal-IRI n’est pas remboursé en France. Par ailleurs, l’étude japonaise de phase III GENERATE (Ohba et al., 2023), a comparé l’association gemcitabine plus nab-paclitaxel, mFOLFIRINOX et SIRINOX (S-1, irinotecan et oxaliplatine). La SG médiane était de 17,1 mois dans le groupe gemcitabine plus nab-paclitaxel, de 14,0 mois dans le groupe mFOLFIRINOX (HR 1,31, IC à 95 % 0,97-1,77) et de 13,6 mois dans le groupe S-IROX (HR 1,35, IC à 95 % 1,00-1,82). L’étude a donc été interrompue pour cause de futilité. La toxicité non hématologique de grade 3-4 la plus fréquente, à savoir l’anorexie, a été plus fréquente dans le groupe FOLFIRINOX modifié (23,3 %) et S-IROX (27,5 %) que dans le groupe nab-paclitaxel plus gemcitabine (5,0 %). Ces résultats ont soulevé de nombreuses questions, en particulier sur les résultats favorables inattendus observés dans le bras contrôle gemcitabine plus nab-paclitaxel, et sur la pharmacocinétique spécifique / le profil de tolérance plus défavorable de l’irinotécan chez les patients asiatiques. Les résultats ne sont pas transposables à une population non asiatique, c’est pourquoi en Europe la chimiothérapie triple (FOLFIRINOX) reste un standard.
9.4.4.2. Chimiothérapie de deuxième ligne
- Après progression sous une première ligne de chimiothérapie, la moitié environ des patients atteints d’AP métastatique sont en mesure de recevoir une ou plusieurs ligne(s) ultérieure(s) (Walker & Ko, 2014). Seuls les patients restant dans un bon état général (PS ECOG 0-1) semblent en tirer un bénéfice.
- Après progression sous gemcitabine, les associations de 5-FU avec un platine (oxaliplatine ou cisplatine) ou l’irinotécan (forme standard ou nanoliposomale) ont été principalement étudiées (Chen et al., 2015; Dahan et al., 2010; Gill et al., 2016; Neuzillet et al., 2012; Oettle et al., 2014; Wang-Gillam et al., 2016; Yoo et al., 2009; Zaanan et al., 2014).
- L’association du nal-IRI, avec le 5-FU et l’AF a montré une amélioration de la SG (médiane : 6,1 contre 4,2 mois, p=0,012) par rapport au 5-FU/AF seul dans une étude de phase III (NAPOLI-1) (Wang-Gillam et al., 2016). Cela a conduit à une AMM mais sans remboursement en France.
- Les données concernant l’association 5-FU et platine en deuxième ligne sont plus controversées : un essai de phase III randomisé (CONKO-003) avait montré une amélioration significative de la SG (médiane : 5,9 contre 3,3 mois, p=0,010) avec le schéma OFF (oxaliplatine, 5-FU, AF) par rapport au même schéma sans oxaliplatine (FF) (Oettle et al., 2014). Ce bénéfice n’a pas été retrouvé avec le schéma FOLFOX6 modifié (mFOLFOX6) en comparaison avec le 5-FU/AF dans un autre essai de phase III (PANCREOX) (Gill et al., 2016). Cette absence de bénéfice pourrait s’expliquer par une toxicité plus marquée dans le bras mFOLFOX6 avec un plus grand nombre de patients sortis de l'étude en raison d'événements indésirables, et le recours plus fréquent à des lignes de traitement ultérieures après progression dans le bras 5-FU/AF.
- Les données concernant les traitements de deuxième ligne chez les patients atteints d’AP métastatique progressant sous FOLFIRINOX ou gemcitabine plus nab-paclitaxel ont été jusqu'à récemment limitées à des études rétrospectives (Assaf et al., 2011; Lee et al., 2013; Portal et al., 2015; Taïeb et al.,2020).
- L’étude GEMPAX-PRODIGE 65 n’a pas apporté la supériorité de l’association gemcitabine-paclitaxel (80 mg/m²) J1-J8-J15 sur la gemcitabine seule en terme de SG (objectif principal), malgré une meilleure SSP médiane (3,1 mois (IC 95, 2,2–4,3) vs 2.0 mois (IC 95%,), HR : 0,64 ; IC 95% : 0,47–0,89) et un meilleur taux de réponse objective : 19.2% (IC 95% : 12,7–27,2) avec GEMPAX vs 4,8% (IC 95%, 1,0–13,3%) (de la Fouchardière et al., 2024).
9.4.4.3. Chirurgie
- Chez des patients très sélectionnés, en particulier, par une bonne réponse à la chimiothérapie, la résection/ablation de lésions oligométastatiques pulmonaires (Kruger et al., 2022) voire hépatiques (Muzzolini et al., 2024), préférentiellement métachrones, d’AP peut être associée à des survies postopératoires prolongées. Cependant, ces résultats doivent être interprétés avec prudence car il est difficile d’établir, avec les données actuellement disponibles, le rôle respectif de la chimiosensibilité et/ou des traitements interventionnels dans ces résultats. Il n’y a pas de place pour la chirurgie de l’AP métastatique en dehors d’études prospectives.
9.4.5. Traitements spécifiques en cas d’anomalie génétique germinale ou somatique actionnable et des sous-types histologiques plus rares
- Environ 10%-15% des AP sont le siège d’une anomalie potentiellement ciblable (Turpin et al., 2022).
- Les patients atteints d’un AP dans le cadre d’une mutation germinale des gènes BRCA1 ou BRCA2 sont plus sensibles aux agents entraînant des lésions de l’ADN (ex. dérivés de platines) (de Mestier et al., 2016; Waddell et al., 2015).
- L’étude randomisée POLO a comparé en maintenance un inhibiteur de l’enzyme PARP, l’olaparib, ou un placebo après ≥ 4 mois de chimiothérapie d’induction avec un platine chez les patients avec AP métastatique et mutation germinale BRCA ½. Elle a montré une supériorité de l’olaparib sur la SSP (7,4 vs. 3,8 mois ; HR : 0,53 ; p=0,004) et permis l’obtention d’une A.M.M. Européenne (Golan et al., 2109). La SG n’était pas augmentée (Kindler et al., 2022).
- Si une analyse moléculaire est réalisée (incluant le statut BRCA1/BRCA2, KRAS, et MSI) et qu’elle met en évidence une (ou plusieurs) anomalies, l’indication d’un traitement ciblé devrait être : 1) anticipée en fonction des molécules accessibles en essais cliniques (screening moléculaire tumoral précoce) ; 2) restreinte aux patients en bon état général et sans comorbidité limitante ; 3) évaluée selon la classification européenne ESCAT (Mateo, et al. 2018) ; et 4) subordonnée à l’avis d’une RCP moléculaire (Pishvaian et al., 2020). La détermination du statut tumoral MMR devrait en revanche être systématique, compte tenu des perspectives d’immunothérapie (en essai clinique pour le moment) en cas de statut MSI.
- Environ 1-2% des adénocarcinomes du pancréas présentent une mutation KRAS G12C. L’adragrasib et le sotorasib ont montré de premières données d’efficacité dans cette indication (Bekaii-Saab et al., 2023 ; Strickler et al., 2023).
- Les autres mutations de KRAS plus fréquentes (G12D, G12V) ne sont à ce jour pas ciblables en routine. Des essais cliniques débutent avec un inhibiteur de G12D (ex. : MRTX1133), voire des inihibiteurs pan-KRAS (ex. : BI-2865, HBI-2376, BI-1701963). Certaines thérapies cellulaires (Leidner et al., 2022) et vaccinales (Pant et al., 2024) ciblant KRAS ont également montré de premiers résultats.
- Les tumeurs sans mutation KRAS (5 %-10 %) sont enrichies en altérations actionnables (fusion NTRK, NRG1, RET, ALK, mutation ou fusion BRAF) (Singhi, et al., 2019 ; Philip et al., 2022).
- En cas de fusion du gène NRG1 (< 1 %) le zenocutuzumab a montré des taux de réponse objective d’environ 40% (Schram et al., 2022), avec des réponses précoces dès la première évaluation et prolongées chez la majorité des patients.
- En cas de fusion du gène NTRK (< 1 %) le larotrectinib peut être efficace, et en l’absence d’autre option thérapeutique pourrait être proposé après discussion en RCP moléculaire (Drilon et al., 2018 ; Marchiò et al., 2019) ; le larotrectinib a reçu une AMM mais n’est pas remboursé.
- Il n’y a pas de spécificité thérapeutique pour les cystadénocarcinomes, les carcinomes à cellules acineuses (à noter que ceux-ci sont plus souvent KRAS non mutés et enrichis en gènes de fusion) ou adénosquameux (associés à un moins bon pronostic) et les autres variantes histologiques d’AP ; les mêmes recommandations s’appliquent.
9.4.6. Soins de support
Les soins de support occupent une place centrale dans la prise en charge. (cf Chapitre 17 du TNCD Nutrition-APA) (Neuzillet et al., 2020) Ils ont pour but d’améliorer la qualité de vie et la tolérance, et l’adhérence aux traitements anti-tumoraux.
- Ils comprennent le traitement (Pelzer et al., 2015; Tempero et al., 2014) :
(i) des obstructions biliaire et/ou digestive,
(ii) de la douleur,
(iii) des troubles anxieux et dépressifs,
(iv) de la dénutrition et de la sarcopénie,
(v) des complications thromboemboliques.
- Une prévention primaire des complications thromboemboliques par HBPM est une option chez les patients ayant un AP métastatique ou localement avancé traité par chimiothérapie (Farge et al., 2022).
- L’étude URGENCE Pancréas (D16-1) a montré que chez les patients atteints d’AP métastatique et symptomatiques, un programme de soins de support personnalisé de 14 jours était faisable qu’il pouvait procurer un bénéfice clinique significatif. Les patients qui débutaient une chimiothérapie systémique dans les 30 jours avaient une meilleure survie, avec l’administration rendue possible de doublet/triplet à doses adaptées, même en cas d’indice ECOG-PS2 (Rousseau et al., 2023).
- L’étude APACaP ayant inclus 313 patients atteints d’un AP non résécable traité par chimiothérapie a évalué un programme d’activité physique adaptée (APA). L’analyse de la qualité de vie à inclusion et la 16ème semaine pour trois dimensions ciblées (mITT1) ne montrait pas de différence significative (objectif primaire) mais l’APA améliorait plusieurs dimensions de qualité de vie dans les analyses longitudinales (Neuzillet et al., 202).
- Par ailleurs, une irradiation hypofractionnée à visée antalgique (Valverde et al., 2024) ou hémostatique peut être envisagée en situation palliative.
- Le bloc du plexus cœliaque guidé sous contrôle EE ou radiologique chez les patients atteints de douleur liée au cancer du pancréas non résécable peut être discuté en cas de douleurs réfractaires ou mal contrôlées par les traitements antalgiques standard en alternative à la radiothérapie à visée antalgique.
9.5. Indications thérapeutiques
9.5.1. Tumeur opérable/résécable d’emblée (Algorithme 1)
RÉFÉRENCES
- Chirurgie à visée curative (R0) :
- AP de la tête du pancréas :
- DPC par laparotomie dans un centre expert avec seuil d’activité suffisant (niveau de recommandation : grade A) avec un curage emportant au moins 15 ganglions et les relais 5, 6, 8a, 12b1, 12b2, 12c, 13a, 13b, 14a, 14b, 17a, et 17b (niveau de recommandation : grade B).
- La résection rétro-artérielle (marge rétro-artérielle, ou lame rétro-porte) du pancréas, jusqu’au bord droit de l’AMS est fortement conseillée (avis d’experts).
- La lymphadénectomie étendue et résection artérielle en bloc ne sont pas recommandées.
- AP du corps ou de la queue du pancréas :
- SPG (niveau de recommandation : grade A) par laparotomie ou laparoscopie (grade A) avec un curage ganglionnaire, emportant au moins les relais 10, 11, et 18 (niveau de recommandation : grade B).
- AP de la tête du pancréas :
- Une approche de la droite vers la gauche de type RAMPS (radical antegrade modular pancreatosplenectomy) est fortement conseillée (avis d’experts).
- Chimiothérapie adjuvante pendant 6 mois (à débuter dans les 3 mois post-opératoires si possible) chez tous les patients après résection d’un AP, quels que soient les statuts T, N et R ; par FOLFIRINOX modifié avec irinotécan 150 mg/m2, et si patient non éligible par gemcitabine, 5-FU ou gemcitabine plus capécitabine, à discuter au cas par cas (niveau de recommandation : grade A).
- Pas de chimioradiothérapie hors essai clinique (accord d’experts).
OPTIONS
- Drainage biliaire (CPRE, avec prothèse métallique courte avec alternative de drainage sous échoendoscopie en cas d’échec) avant chirurgie
- si angiocholite, taux de bilirubine > 250 μmol/L (niveau de recommandation : grade A) ;
- si traitement néoadjuvant envisagé, ou chirurgie retardée (accord d’experts).
- SPG par chirurgie robotique pour les tumeurs du corps et de la queue par des opérateurs entrainés (accord d’experts).
- Si tumeur résécable mais malade non opérable : prise en charge comme une tumeur localement avancée (chimiothérapie si l’état général le permet +/- chimioradiothérapie) (accord d’experts).
- Si tumeur résécable anatomiquement mais critères biologiques (taux de CA19-9, seuil > 500 UI/ml) et/ou cliniques (état général fragile, dénutrition) (critères ABC) péjoratifs, chimiothérapie néoadjuvante à discuter (avis d’experts).
ESSAI CLINIQUE
- Essai FRENCH-PRODIGE PANACHE-02 : étude de phase II/III randomisée évaluant la chimiothérapie adjuvante adaptée au stade tumoral pour adenocarcinome du pancréas opéré après chimiothérapie néoadjuvante par FOLFIRINOX. PHRC-K, coordonnateur : L. Schwarz (Rouen). NCT en activation.
9.5.2. Tumeur borderline (Algorithme 1)
RÉFÉRENCES
- Traitement d’induction avant éventuelle chirurgie.
- Privilégier l’inclusion dans les essais cliniques.
- Drainage biliaire (CPRE, prothèse métallique courte de préférence) avant chirurgie
- si angiocholite, taux de bilirubine > 250 μmol/L (niveau de recommandation : grade A)
- si angiocholite, taux de bilirubine > 250 μmol/L (niveau de recommandation : grade A)
OPTIONS
- Traitement d’induction par FOLFIRINOX modifié (sans bolus de 5FU, irinotécan 180 mg/m2) (niveau de recommandation : grade B).
- Chimioradiothérapie (avec capécitabine) pré-opératoire après chimiothérapie d’induction (avis d’experts).
- Chirurgie secondaire si absence d’apparition de métastases et patient opérable (accord d’experts).
- Chimiothérapie adjuvante pour totaliser 6 mois de traitement péri-opératoire (accord d’experts).
- Drainage biliaire (CPRE, prothèse métallique courte de préférence) avant chirurgie
o Si traitement d’induction, ou chirurgie retardée (accord d’experts). - Drainage bilaire sous échoendoscopie par prothèse LAMS à discuter en cas d’échec de drainage par CPRE après discussion en RCP et par opérateur expérimenté (avis d’experts).
ESSAIS CLINIQUES
- Essai NEOPROPANC : étude de phase II randomisée évaluant un traitement neoadjuvant complet incluant une chimiothérapie suivie d’une radiochimiothérapie vs. protonthérapie avec modulation d’intensité suivie d’une chirurgie chez des patients porteurs d’un cancer du pancréas résécable borderline. PHRC-K, coordonnateur : G. Créhange (Paris). NCT en activation.
- Essai PRODIGE NEOPREDICT : étude de phase II multicentrique pour personnaliser grâce à une signature transcriptomique la chimiothérapie néoadjuvante des patients porteurs d’un adénocarcinome pancréatique borderline résécable. Coordonnateur : B. Chanez (Marseille). NCT en activation.
9.5.3. Tumeur localement avancée (Algorithme 2)
RÉFÉRENCES
- Soins de support dès le diagnostic (niveau de recommandation : grade A) :
• pour drainage biliaire en cas d’ictère par CPRE et prothèse métallique ou si échec sous échoendoscopique avec prothèse type LAMS
• endoprothèse duodénale en cas de sténose symptomatique,
• traitement de la douleur,
• prise en charge nutritionnelle (cf. Chapitre TNCD Nutrition et APA). - PS 0-1 : Chimiothérapie (induction) par FOLFIRINOX modifié sans bolus de 5FU et avec irinotécan 180 mg/m2 (PS 0-1) (niveau de recommandation : grade A).
- PS 2 : chimiothérapie par gemcitabine (niveau de recommandation : grade A).
- PS 3-4 : soins de supports exclusifs (accord d’experts).
- Ré-évaluation à chaque contrôle de l’opérabilité potentielle en cas de bonne réponse tumorale (accord d’experts).
OPTIONS
- Chimiothérapie (induction) par gemcitabine plus nab-paclitaxel (PS 0-2) (avis d’experts, non remboursé).
- Chimioradiothérapie avec capécitabine après au moins 4 mois de contrôle tumoral par chimiothérapie systémique (niveau de recommandation : grade B).
- Chirurgie secondaire si très bonne réponse (clinique, imagerie, CA19-9), absence d’apparition de métastases et patient opérable (accord d’experts).
- Anastomose gastro-entérale sous échoendoscopie à discuter avec un opérateur expérimenté en alternative à endoprothèse duodénale ou dérivation chirurgicale (Teo et al., 2024 ; Vanella et al. 2022) (avis d’experts).
ESSAIS CLINIQUES
- Aucun
9.5.4. Tumeur métastatique (Algorithme 3)
9.5.4.1. Première ligne
RÉFÉRENCES
- Soins de support dès le diagnostic (niveau de recommandation : grade A) : pour drainage biliaire en cas d’ictère par CPRE et prothèse métallique ou si échec sous échoendoscopique avec prothèse type LAMS
• endoprothèse duodénale en cas de sténose symptomatique,
• traitement de la douleur,
• prise en charge nutritionnelle (cf. Chapitre TNCD Nutrition et APA). - PS 3-4 : soins de supports exclusifs (accord d’experts).
- Age < 75 ans, PS 0-1 et bilirubine < 1,5 LSN : chimiothérapie par FOLFIRINOX (standard (niveau de recommandation : grade A) ou modifié sans bolus de 5FU et avec irinotécan 180 mg/m2 ou 150 mg/m2 (accord d’experts)) ou gemcitabine plus nab-paclitaxel (niveau de recommandation : grade A, non remboursé) ou NALIRIFOX (niveau de recommandation : grade A, non remboursé).
- PS 2 et bilirubine < 1,5 LSN : chimiothérapie par gemcitabine (niveau de recommandation : grade A) ou gemcitabine plus nab-paclitaxel (niveau de recommandation : grade B, non remboursé).
- PS 0-2 et bilirubine ≥ 1,5 LSN ou comorbidités : chimiothérapie par gemcitabine (niveau de recommandation : grade A).
- Si mutation germinale de BRCA1/2 avec absence de progression après au minimum 16 semaines de chimiothérapie de première ligne à base de platine et patients non éligibles à la poursuite de la chimiothérapie contenant des sels de platine : olaparib 300 mg matin et soir en traitement de maintenance jusqu’à progression (niveau de recommandation : grade B).
OPTIONS
- Anastomose gastro-entérale sous échoendoscopie à discuter avec un opérateur expérimenté en alternative à endoprothèse duodénale ou dérivation chirurgicale (Teo et al., 2024 ; Vanella et al. 2022) (avis d’experts).
- LV5FU2 en traitement de maintenance jusqu’à progression après 8 cycles de FOLFIRINOX (niveau de recommandation : grade B).
- PS 0-1, en cas de contre-indication au mFOLFIRINOX et gemcitabine plus nab-paclitaxel : gemcitabine plus platine ou gemcitabine plus 5-FU ou capécitabine (niveau de recommandation : grade C).
- PS 2 et/ou bilirubine ≥ 1,5 LSN : chimiothérapie par FOLFOX (avis d’experts).
- Rechercher altération ciblable (KRAS, MSI, BRCA1/2) (accord d’experts).
ESSAIS CLINIQUES
- Essai GEMFOX : étude de phase III comparant le FOLFOX à la gemcitabine en 1ère ligne métastatique chez les patients avec un adénocarcinome du pancréas et non éligibles au FOLFIRINOX. Coordonnateur : JB Bachet (Paris). NCT04167007.
- Essai PRODIGE PANORAMIX : étude de phase II randomisée évaluant l’optimisation du traitement de première ligne du cancer du pancréas métastatique par NALIRIFOX avec maintenance du 5-FU et rôle des antibiotiques et de l'exploration du microbiote dans le traitement de deuxième ligne. NCT en activation.
- Essai PROACTIF-01 : étude de phase II randomisée d’évaluation d’un programme de nutrition et d’activité physique adaptée individualisé chez des patients atteints de cancers bronchiques ou digestifs avancés en situation de fragilité. PHRC-K, coordonnnateur : C. Neuzillet (Saint-Cloud), soutenu UNICANCER SDS. NCT05441163
9.5.4.2. Deuxième ligne
RÉFÉRENCES
- Chimiothérapie si PS 0-1 (niveau de recommandation : grade A).
- Chimiothérapie par 5-FU plus nal-IRI après 1ère ligne à base de gemcitabine (niveau de recommandation : grade A, non remboursé).
- Chimiothérapie par 5-FU plus oxaliplatine après 1ère ligne à base de gemcitabine (niveau de recommandation : grade B).
- Chimiothérapie par gemcitabine après 1ère ligne par FOLFIRINOX (niveau de recommandation : grade B).
- Chimiothérapie par gemcitabine plus paclitaxel après progression sous FOLFIRINOX si besoin de réponse tumorale / patient symptomatique (niveau de recommandation : grade B).
OPTIONS
- Chimiothérapie par gemcitabine plus nab-paclitaxel après 1ère ligne par FOLFIRINOX si PS 0-1 (avis d’experts, non remboursé).
- Chimiothérapie par FOLFIRI après 1ère ligne à base de gemcitabine (niveau de recommandation : grade C).
- Monothérapie par gemcitabine ou 5-FU si PS 2 (avis d’experts).
- Rechercher altération ciblable (KRAS, dMMR/MSI, BRCA1/2) (accord d’experts).
9.5.4.3. Troisième ligne
RÉFÉRENCES
- Aucune.
- Inclusion dans essai clinique si patient PS 0-1.
OPTIONS
- Si PS 0-1 discussion en RCP moléculaire notamment si RAS sauvage (avis d’experts).
- Larotrectinib (per os 200 mg/j) si fusion du gène NTRK sans aucune autre option thérapeutique satisfaisante (sélection par test immunohistochimique confirmé par séquencage (NGS ARN) ou séquençage (NGS ARN) d’emblée) (niveau de recommandation : grade B, non remboursé) [Drillon et al., 2018 ; Marchiò et al., 2019).
- Adagrasib ou sotorasib si mutation KRAS G12C (séquençage NGS) sur proposition d’une RCP moléculaire (niveau de recommandation : grade B, non remboursé).
- Immunothérapie si MSI/d MMR sur proposition d’une RCP moléculaire (niveau de recommandation : grade C).
- Chimiothérapie par taxane seul en 3ème ligne si non reçu en ligne antérieure (avis d’experts).
9.6. Surveillance post-thérapeutique
9.6.1. Surveillance après traitement
- Après résection chirurgicale à visée curative une surveillance clinique et paraclinique pourrait être utile pour diagnostiquer précocement les récidives (Tjaden et al., 2016; Tzeng et al., 2012). Elle doit être adaptée à l’état général et aux comorbidités et s’appuie sur :
(i) un examen clinique ;
(ii) un dosage du taux de CA19-9 sérique s’il était élevé au diagnostic ;
(iii) et une TDM TAP, tous les 3 mois pendant la période la plus à risque de récidive (2-3 ans) puis selon un rythme plus espacé tous les 6-12 mois.
9.6.2. Evaluations en cours de traitement
- Il n’existe pas de données de la littérature comparant les modalités et les rythmes optimaux de surveillance.
On peut proposer selon l’état général (capable de recevoir un traitement systémique si récidive) :
(i) un examen clinique ;
(ii) un suivi nutritionnel et du risque de diabéte ;
(iii) un dosage du taux de CA 19-9 sérique ;
(iv) une TDM TAP comme suit :
- en situation néoadjuvante ou d’induction : tous les 2 mois ;
- en situation adjuvante : tous les 3 mois ;
- en situation avancée : tous les 2 à 3 mois.
RÉFÉRENCES
- Aucune.
OPTIONS
- Après résection chirurgicale : examen clinique, dosage du CA19-9 sérique et TDM TAP tous les 3-6 mois pendant 2-3 ans (accord d’experts) puis tous les 6-12 mois (avis d’experts) selon l’état général.
- Evaluations en cours de traitement : examen clinique, dosage du CA19-9 sérique et TDM TAP (accord d’experts)
- tous les 2 mois en situation néoadjuvante ou d’induction ;
- tous les 3 mois en situation adjuvante ;
- tous les 2-3 mois en situation avancée.
9.7. Traitement des récidives
9.7.1. Récidive métastatique
- En cas de récidive métastatique (70 %), le traitement repose sur la chimiothérapie dont le choix dépend :
(i) de l’état général (PS, état nutritionnel, comorbidités) du patient
(ii) de l’extension de la maladie et de son caractère symptomatique ou non ;
(iii) d’une éventuelle toxicité résiduelle des traitements antérieurs (ex. neuropathie) ;
(iv) de leur efficacité initiale ;
(v) et du délai de la récidive.
- Chez des patients très sélectionnés (intervalle long entre l’exérèse de la lésion primitive et celle de la métastase ; réponse prolongée à une chimiothérapie ; en particulier s’il s’agit d’une atteinte pulmonaire isolée et oligométastatique, celle-ci étant de meilleur pronostic) et avec une possibilité de traitement R0, une chirurgie ou un traitement de destruction locale (ex. radiofréquence ou radiothérapie stéréotaxique) peut être discutée. En cas d’antécédent de DPC, la chirurgie hépatique est préconisée plutôt que la destruction locale en raison du risque de complication infectieuse (abcès sur cholangite ischémique secondaire à la réduction de la vascularisation artérielle biliaire) en présence d’une anastomose bilio-digestive.
9.7.2. Récidive loco-régionale
- En cas de récidive loco-régionale (30 %), le patient doit être traitée comme les formes non résécables.
- De façon exceptionnelle, en cas de stabilité ou de réponse prolongée à une chimiothérapie +/- chimioradiothérapie, et de possibilité technique de résection R0, une chirurgie peut être discutée (Strobel et al., 2013).
- Cette situation doit être distinguée de la survenue d’un second cancer sur pancréas restant dans le cadre d’une affection prédisposante (ex. mutation germinale prédisposante ou TIPMP diffuse) qui doit être pris en charge comme un premier cancer s’il est résécable (chirurgie et traitement péri-opératoire), sous réserve de l’état général/co-morbidités du patient et de son acceptation des contraintes liées à la réalisation d’une pancréatectomie totale.
RÉFÉRENCE
- Aucune
OPTIONS
- Récidive : chimiothérapie (niveau de recommandation : grade B).
- Chez des patients très sélectionnés (réponse prolongée à une chimiothérapie) et avec une possibilité de résection R0, une chirurgie peut être discutée (avis d’experts).
9.8. Protocoles thérapeutiques
Gemcitabine (adjuvant)
1000 mg/m² en perfusion de 30 min à J1.
Traitement répété toutes les semaines 3 semaines/4.
LV5-FU2 simplifié (adjuvant)
Acide folinique 400 mg/m2 (ou l-folinique 200 mg/m²) en 2 h dans 250 ml G5 %,
rincer puis 5-FU 400 mg/m2 en 10 min dans 100 ml de G5 %,
puis 5-FU 2400 mg/m2 en perfusion continue de 46 h dans du G5% par infuseur portable, pompe ou pousse seringue portable.
Traitement répété tous les 14 jours.
Gemcitabine - Capécitabine (adjuvant)
Gemcitabine 1000 mg/m² en perfusion de 30 min à J1,
plus capécitabine 1660 mg/m²/j par voie orale en deux prises J1-J21.
Traitement répété toutes les semaines 3 semaines/4.
FOLFIRINOX
Oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G5%,
puis acide folinique 400 mg/m2 (ou l-folinique 200 mg/m2) en 2 h dans 250 ml G5%,
puis après 30 min démarrer en Y irinotécan 180 mg/m2en 90 minutes,
puis 5-FU bolus 400 mg/m2,
puis 5-FU 2400 mg/m2 en perfusion continue de 46 h dans du G5% par infuseur portable, pompe ou pousse seringue portable.
Traitement répété tous les 14 jours.
FOLFIRINOX modifié (mFOLFIRINOX) (sans 5FU bolus)
Oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G5%,
puis acide folinique 400 mg/m2 (ou l-folinique 200 mg/m2) en 2 h dans 250 ml G5%,
puis après 30 min démarrer en Y irinotécan 180 (métastatique ou localement avancé ou borderline) ou 150 mg/m2 (adjuvant) en 90 minutes,
puis 5-FU 2400 mg/m2 en perfusion continue de 46 h dans du G5% par infuseur portable, pompe ou pousse seringue portable.
Traitement répété tous les 14 jours.
NALIRIFOX
irinotécan liposomal 50 mg/m2, oxaliplatine 60 mg/m2, acide folinique 400 mg/m2 et fluorouracile 2400 mg/m2 en perfusion intraveineuse continue pendant 46 h, administrés séquentiellement.
Traitement répété tous les 14 jours.
Gemcitabine plus nab-paclitaxel
nab-paclitaxel 125 mg/m2 en perfusion de 30-40 min à J1,
puis gemcitabine 1000 mg/m² en perfusion de 30 min à J1.
Traitement répété toutes les semaines 3 semaines/4 (J1, J8 et J15, 1 cycle = 4 semaines).
Gemcitabine (formes avancées)
1000 mg/m² en perfusion de 30 min à J1.
Traitement répété toutes les semaines (7 semaines/8 pour le premier cycle puis 3 semaines/4.
Gemcitabine FDR (formes avancées)
1500 mg/m² en perfusion de 150 min à J1.
Traitement répété tous les 14 jours.
Gemcitabine plus paclitaxel
Paclitaxel 80 mg/m2 en perfusion de 1 heure à J1,
puis gemcitabine 1000 mg/m² en perfusion de 30 min à J1.
Traitement répété toutes les semaines 3 semaines/4 (J1, J8 et J15, 1 cycle = 4 semaines).
LV5-FU2 simplifié (formes avancées)
Identique à l’adjuvant.
FOLFOX 4 simplifié (USA=FOLFOX 6 modifié)
Oxaliplatine + LV5-FU2 simplifié =
Oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G5%
en Y de l’acide folinique au J1 du LV5-FU2 simplifié.
Traitement répété tous les 14 jours.
LV5-FU2 simplifié plus nal-IRI
Irinotécan nanoliposomal (nal-IRI) 80 mg/m2 en perfusion de 90 minutes,
suivi de acide folinique 400 mg/m2 (ou l-folinique 200 mg/m²) en 2 h dans 250 ml G5 %, rincer puis 5-FU 400 mg/m2 en 10 min dans 100 ml de G5 %,
puis 5-FU 2400 mg/m2 en perfusion continue de 46 h dans du G5% par infuseur portable (QSP 230 ml, 5 ml/h), pompe ou pousse seringue portable.
Traitement répété tous les 14 jours.
FOLFIRI
Chimioradiothérapie néoadjuvante (Huguet et al., 2022)
Dose totale recommandée est de 45 à 50,4 Gy
- à raison de 5 fractions de 1,8 Gy par semaine,
- délivrée par radiothérapie conformationnelle en 3 dimensions ou radiothérapie conformationnelle avec modulation d'intensité.
- Le pancréas ne doit pas être inclus en totalité dans la zone irradiée.
- Pas d'indication d’irradiation prophylactique systématique des aires ganglionnaires non suspectes.
- Si possible, les mouvements de la tumeur liés à la respiration doivent être pris en compte.
Chimiothérapie concomitante par capécitabine
- administrée pendant toute la durée de la radiothérapie, du lundi au vendredi,
- à une dose de 1650 mg/m2 par jour, divisée en 2 prises espacées de 12h.
Chimioradiothérapie pour les tumeurs localement avancées (Huguet et al., 2022)
Dose totale recommandée est de 50,4 à 54 Gy
- à raison de 5 fractions de 1,8 Gy par semaine,
- délivrée par radiothérapie conformationnelle en 3 dimensions ou radiothérapie conformationnelle avec modulation d'intensité.
Les modalités sont les mêmes qu'en cas de traitement néoadjuvant.
9.9. Arbres décisionnels (algorithmes)
Algorithme 1 - Traitements pour cancer résécable ou borderline
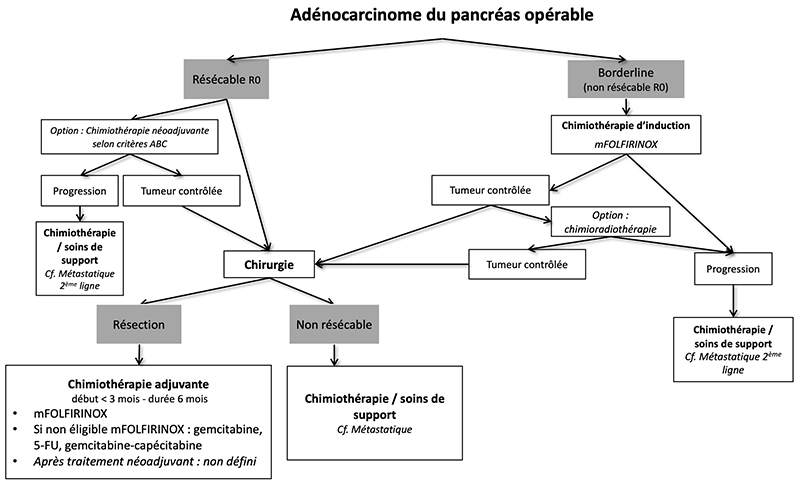
Algorithme 2 - Traitements pour cancer localement avancé
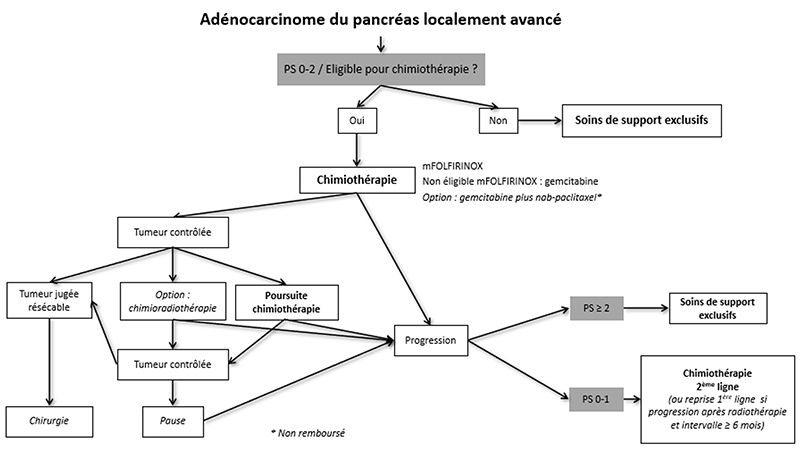
Algorithme 3 - Traitements pour cancer métastatique
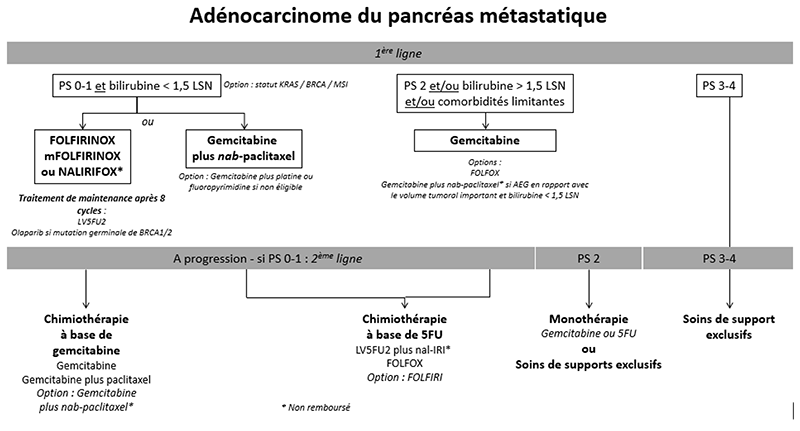
9.10. Références bibliographiques
- Abdelrahman, A.M., Goenka, A.H., Alva-Ruiz, R., et al (2022). FDG-PET predicts neoadjuvant therapy response and survival in borderline resectable/locally advanced pancreatic adenocarcinoma. J Natl Compr Canc Netw, 20(9):1023-1032.e3. doi: 10.6004/jnccn.2022.7041.
- Al-Hawary, M. M., Francis, I. R., Chari, S. T., Fishman, E. K., Hough, D. M., Lu, D. S., . . . Simeone, D. M. (2014). Pancreatic ductal adenocarcinoma radiology reporting template: consensus statement of the society of abdominal radiology and the andomiz pancreatic association. Gastroenterology, 146(1), 291-304 e291. Doi :10.1053/j.gastro.2013.11.004
- Allen, V. B., Gurusamy, K. S., Takwoingi, Y., Kalia, A., & Davidson, B. R. (2016). Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer. Cochrane Database Syst Rev, 7, CD009323. Doi :10.1002/14651858.CD009323.pub3
- Assaf, E., Verlinde-Carvalho, M., Delbaldo, C., Grenier, J., Sellam, Z., Pouessel, D., . . . Culine, S. (2011). 5-fluorouracil/leucovorin combined with irinotecan and oxaliplatin (FOLFIRINOX) as second-line chemotherapy in patients with metastatic pancreatic adenocarcinoma. Oncology, 80(5-6), 301-306. Doi :10.1159/000329803
- Assenat, E., de la Fouchardière, C., Portales, F., et al. (2021). Sequential first-line treatment with nab-paclitaxel/gemcitabine and FOLFIRINOX in metastatic pancreatic adenocarcinoma: GABRINOX phase Ib-II controlled clinical trial. ESMO Open, 6(6):100318. doi: 10.1016/j.esmoop.2021.100318
- Assifi, M. M., Lu, X., Eibl, G., Reber, H. A., Li, G., & Hines, O. J. (2011). Neoadjuvant therapy in pancreatic adenocarcinoma: a meta-analysis of phase II trials. Surgery, 150(3), 466-473. Doi :10.1016/j.surg.2011.07.006
- Ballehaninna, U. K., & Chamberlain, R. S. (2012). The clinical utility of serum CA 19-9 in the diagnosis, prognosis and management of pancreatic adenocarcinoma: An evidence based appraisal. J Gastrointest Oncol, 3(2), 105-119. Doi :10.3978/j.issn.2078-6891.2011.021
- Bartsch, D. K., Slater, E. P., Carrato, A., Ibrahim, I. S., Guillen-Ponce, C., Vasen, H. F., . . . Gress, T. M. (2016). Refinement of screening for familial pancreatic cancer. Gut, 65(8), 1314-1321. Doi:10.1136/gutjnl-2015-311098
- Basturk, O., Hong, S. M., Wood, L. D., Adsay, N. V., Albores-Saavedra, J., Biankin, A. V., . . . Baltimore Consensus, M. (2015). A Revised Classification System and Recommendations From the Baltimore Consensus Meeting for Neoplastic Precursor Lesions in the Pancreas. Am J Surg Pathol, 39(12), 1730-1741. Doi :10.1097/PAS.0000000000000533
- Bekaii-Saab, T. S., Yaeger, R., Spira, A.I., et al. (2023). Adagrasib in Advanced Solid Tumors Harboring a KRAS(G12C) Mutation. J Clin Oncol, 41(25):4097-4106. doi: 10.1200/JCO.23.0043
- Bipat, S., Phoa, S. S., van Delden, O. M., Bossuyt, P. M., Gouma, D. J., Lameris, J. S., & Stoker, J. (2005). Ultrasonography, computed tomography and magnetic resonance imaging for diagnosis and determining resectability of pancreatic adenocarcinoma: a meta-analysis. J Comput Assist Tomogr, 29(4), 438-445.
- Bockhorn, M., Uzunoglu, F. G., Adham, M., Imrie, C., Milicevic, M., Sandberg, A. A., . . . International Study Group of Pancreatic, S. (2014). Borderline resectable pancreatic cancer: a consensus statement by the International Study Group of Pancreatic Surgery (ISGPS). Surgery, 155(6), 977-988. Doi :10.1016/j.surg.2014.02.001
- Bouvier, A. M., Uhry, Z., Jooste, V., Drouillard, A., Remontet, L., Launoy, G., . . . French Network of Cancer, R. (2017). Focus on an unusual rise in pancreatic cancer incidence in France. Int J Epidemiol, 46(6), 1764-1772. Doi :10.1093/ije/dyx088
- Bramhall, S. R., Schulz, J., Nemunaitis, J., Brown, P. D., Baillet, M., & Buckels, J. A. (2002). A double-blind placebo-controlled, andomized study comparing gemcitabine and marimastat with gemcitabine and placebo as first line therapy in patients with advanced pancreatic cancer. Br J Cancer, 87(2), 161-167. Doi :10.1038/sj.bjc.6600446
- Bria, E., Milella, M., Gelibter, A., Cuppone, F., Pino, M. S., Ruggeri, E. M., . . . Giannarelli, D. (2007). Gemcitabine-based combinations for inoperable pancreatic cancer: have we made real progress? A meta-analysis of 20 phase 3 trials. Cancer, 110(3), 525-533. Doi :10.1002/cncr.22809
- Brugge, W. R., De Witt, J., Klapman, J. B., Ashfaq, R., Shidham, V., Chhieng, D., . . . Staerkel, G. (2014). Techniques for cytologic sampling of pancreatic and bile duct lesions: The Papanicolaou Society of Cytopathology Guidelines. Cytojournal, 11(Suppl 1), 2. Doi :10.4103/1742-6413.133311
- Burris, H. A., 3rd, Moore, M. J., Andersen, J., Green, M. R., Rothenberg, M. L., Modiano, M. R., . . . Von Hoff, D. D. (1997). Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol, 15(6), 2403-2413.
- Carrato A., Pazo-Cid, R., Macarulla, T., et al. (2024). Nab-Paclitaxel plus Gemcitabine and FOLFOX in Metastatic Pancreatic Cancer. NEJM Evid, 3(2). doi: 10.1056/EVIDoa2300144
- Cassinotto, C., Mouries, A., Lafourcade, J. P., Terrebonne, E., Belleannee, G., Blanc, J. F., . . . Montaudon, M. (2014). Locally advanced pancreatic adenocarcinoma: reassessment of response with CT after neoadjuvant chemotherapy and radiation therapy. Radiology, 273(1), 108-116. Doi :10.1148/radiol.14132914
- Catenacci, D. V., Junttila, M. R., Karrison, T., Bahary, N., Horiba, M. N., Nattam, S. R., . . . Kindler, H. L. (2015). Randomized Phase Ib/II Study of Gemcitabine Plus Placebo or Vismodegib, a Hedgehog Pathway Inhibitor, in Patients With Metastatic Pancreatic Cancer. J Clin Oncol, 33(36), 4284-4292. Doi :10.1200/JCO.2015.62.8719
- Chari, S. T., Leibson, C. L., Rabe, K. G., Ransom, J., de Andrade, M., & Petersen, G. M. (2005). Probability of pancreatic cancer following diabetes: a population-based study. Gastroenterology, 129(2), 504-511. Doi :10.1016/j.gastro.2005.05.007
- Chauffert, B., Mornex, F., Bonnetain, F., Rougier, P., Mariette, C., Bouche, O., . . . Bedenne, L. (2008). Phase III trial comparing intensive induction chemoradiotherapy (60 Gy, infusional 5-FU and intermittent cisplatin) followed by maintenance gemcitabine with gemcitabine alone for locally advanced unresectable pancreatic cancer. Definitive results of the 2000-01 FFCD/SFRO study. Ann Oncol, 19(9), 1592-1599. Doi:10.1093/annonc/mdn281
- Chen, L. T., Von Hoff, D. D., Li, C. P., Wang-Gillam, A., Bodoky, G., Dean, A. P., . . . Bayever, E. (2015). Expanded analyses of andom-1: Phase 3 study of MM-398 (nal-IRI), with or without 5-fluorouracil and leucovorin, versus 5-fluorouracil and leucovorin, in metastatic pancreatic cancer (mPAC) previously treated with gemcitabine-based therapy. J Clin Oncol, 33(suppl 3), abstr #234.
- Chiorean, E. G., Von Hoff, D. D., Reni, M., Arena, F. P., Infante, J. R., Bathini, V. G., . . . Ko, A. (2016). CA19-9 decrease at 8 weeks as a predictor of overall survival in a randomized phase III trial (MPACT) of weekly nab-paclitaxel plus gemcitabine versus gemcitabine alone in patients with metastatic pancreatic cancer. Ann Oncol, 27(4), 654-660. Doi :10.1093/annonc/mdw006
- Ciliberto, D., Botta, C., Correale, P., Rossi, M., Caraglia, M., Tassone, P., & Tagliaferri, P. (2013). Role of gemcitabine-based combination therapy in the management of advanced pancreatic cancer: a meta-analysis of andomized trials. Eur J Cancer, 49(3), 593-603. Doi :10.1016/j.ejca.2012.08.019
- Conroy, T., Desseigne, F., Ychou, M., Bouche, O., Guimbaud, R., Becouarn, Y., . . . Intergroup, P. (2011). FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med, 364(19), 1817-1825. Doi:10.1056/NEJMoa1011923.
- Conroy, T., Gourgou, S., & Malka, D. (2017). Traitement adjuvant du cancer du pancréas : CAP ou pas CAP ? Hépato-Gastro & Oncologie Digestive, 24, 532-538.
- Conroy T, Hammel P, Hebbar M, Ben Abdelghani M, Wei AC, Raoul JL, Choné L, Francois E, Artru P, Biagi JJ, Lecomte T,Assenat E, Faroux R, Ychou M, Volet J, Sauvanet A, Breysacher G, Di Fiore F, Cripps C, Kavan P, Texereau P, BouhierLeporrier K, Khemissa-Akouz F, Legoux JL, Juzyna B, Gourgou S, O’Callaghan CJ, Jouffroy-Zeller C, Rat P, Malka D, Castan F, Bachet JB ; Canadian Cancer Trials Group and the Unicancer-GI–PRODIGE Group. (2018). FOLFIRINOX or Gemcitabine as Adjuvant Therapy for Pancreatic Cancer. N Engl J Med;379(25):2395-2406. doi: 10.1056/NEJMoa1809775
- Conroy, T., Castan, F., Lopez, A., et al. (2022). Five-year outcomes of FOLFIRINOX vs gemcitabine as adjuvant therapy for pancreatic cancer: a randomized clinical trial. JAMA Oncol, 8:1571-1578.
- Conroy T, Pfeiffer P, Vilgrain V, Lamarca A, Seufferlein T, O'Reilly EM, Hackert T, Golan T, Prager G, Haustermans K, Vogel A, Ducreux M; Pancreatic cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up ESMO Guidelines Committee. Ann Oncol 2023:S0923-7534(23)00824-4.
- Corsini, M. M., Miller, R. C., Haddock, M. G., Donohue, J. H., Farnell, M. B., Nagorney, D. M., . . . Gunderson, L. L. (2008). Adjuvant radiotherapy and chemotherapy for pancreatic carcinoma: the Mayo Clinic experience (1975-2005). J Clin Oncol, 26(21), 3511-3516. doi:10.1200/JCO.2007.15.8782
- Dahan, L., Bonnetain, F., Ychou, M., Mitry, E., Gasmi, M., Raoul, J. L., . . . Federation Francophone de Cancerologie, D. (2010). Combination 5-fluorouracil, folinic acid and cisplatin (LV5FU2-CDDP) followed by gemcitabine or the reverse sequence in metastatic pancreatic cancer: final results of a randomised strategic phase III trial (FFCD 0301). Gut, 59(11), 1527-1534. doi:10.1136/gut.2010.216135
- Dahan, L., Williet, N., Le Malicot, K., et al. ; PRODIGE 35 Investigators/Collaborators. (2021). Randomized Phase II Trial Evaluating Two Sequential Treatments in First Line of Metastatic Pancreatic Cancer: Results of the PANOPTIMOX-PRODIGE 35 Trial. J Clin Oncol, 39(29):3242-3250. doi: 10.1200/JCO.20.03329
- Dalmartello, M., La Vecchia, C., Bertuccio, P. et al. (2022). European cancer mortality predictions for the year 2022 with focus on ovarian cancer. Ann Oncol, 33(3):330-339. doi: 10.1016/j.annonc.2021.12.007
- De Angelis, C., Brizzi, R. F., & Pellicano, R. (2013). Endoscopic ultrasonography for pancreatic cancer: current and future perspectives. J Gastrointest Oncol, 4(2), 220-230. doi:10.3978/j.issn.2078-6891.2013.002
- de la Fouchardière, C., Malka, D., Cropet, C., et al. (2024). Gemcitabine and Paclitaxel Versus Gemcitabine Alone After 5-Fluorouracil, Oxaliplatin, and Irinotecan in Metastatic Pancreatic Adenocarcinoma: A Randomized Phase III PRODIGE 65-UCGI 36-GEMPAX UNICANCER Study. J Clin Oncol, 42(9):1055-1066. doi: 10.1200/JCO.23.00795
- de Mestier, L., Danset, J. B., Neuzillet, C., Rebours, V., Cros, J., Soufir, N., & Hammel, P. (2016). Pancreatic ductal adenocarcinoma in BRCA2 mutation carriers. Endocr Relat Cancer, 23(10), T57-67. doi:10.1530/ERC-16-0269
- de Mestier, L., Védie, A. L., Salfati, D., Rebours, V., & Hammel, P. (2017). Cancer du pancréas : causes, formes génétiques et dépistage. Hépato-Gastro Oncol Dig, 24, 7-17. doi:doi:10.1684/hpg.2017.1445
- de Rooij, T., Sitarz, R., Busch, O. R., Besselink, M. G., & Abu Hilal, M. (2015). Technical Aspects of Laparoscopic Distal Pancreatectomy for Benign and Malignant Disease: Review of the Literature. Gastroenterol Res Pract, 2015, 472906. doi:10.1155/2015/472906
- de Rooij, T., van Hilst, J., van Santvoort, H., et al.; Dutch Pancreatic Cancer Group (2019). Minimally Invasive Versus Open Distal Pancreatectomy (LEOPARD): A Multicenter Patient-blinded Randomized Controlled Trial. Ann Surg, 269(1):2-9. doi: 10.1097/SLA.0000000000002979
- Dekker, E. N., van Dam, J. L., Janssen, Q. P., et al.; Trans-Atlantic Pancreatic Surgery (TAPS) Consortium (2024). Improved Clinical Staging System for Localized Pancreatic Cancer Using the ABC Factors: A TAPS Consortium Study. J Clin Oncol, JCO2301311. doi: 10.1200/JCO.23.01311
- Delpero, J. R., Bachellier, P., Regenet, N., Le Treut, Y. P., Paye, F., Carrere, N., . . . Boher, J. M. (2014). Pancreaticoduodenectomy for pancreatic ductal adenocarcinoma: a French multicentre prospective evaluation of resection margins in 150 evaluable specimens. HPB (Oxford), 16(1), 20-33. doi:10.1111/hpb.12061
- Delpero, J. R., Boher, J. M., Sauvanet, A., Le Treut, Y. P., Sa-Cunha, A., Mabrut, J. Y., . . . Paye, F. (2015). Pancreatic adenocarcinoma with venous involvement: is up-front synchronous portal-superior mesenteric vein resection still justified? A survey of the association francaise de chirurgie. Ann Surg Oncol, 22(6), 1874-1883. doi:10.1245/s10434-014-4304-3
- Delpero, J. R., Jeune, F., Bachellier, P., Regenet, N., Le Treut, Y. P., Paye, F., . . . Boher, J. M. (2017). Prognostic Value of Resection Margin Involvement After Pancreaticoduodenectomy for Ductal Adenocarcinoma: Updates From a French Prospective Multicenter Study. Ann Surg, 266(5), 787-796. doi:10.1097/SLA.0000000000002432
- Delpero, J. R., Paye, F., & Bachellier, P. (2010). Cancer du Pancréas Monographies de l’Association Française de Chirurgie (Vol. 112e Congrès Français de Chirurgie ). Paris: Wolters Kluwer France.
- Diener, M. K., Fitzmaurice, C., Schwarzer, G., Seiler, C. M., Huttner, F. J., Antes, G., . . . Buchler, M. W. (2014). Pylorus-preserving pancreaticoduodenectomy (pp Whipple) versus pancreaticoduodenectomy (classic Whipple) for surgical treatment of periampullary and pancreatic carcinoma. Cochrane Database Syst Rev, 11, CD006053. doi:10.1002/14651858.CD006053.pub5
- Drilon A, Laetsch TW, Kummar S et al. Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med. 2018 Feb 22;378(8):731-739
- Ducreux M, Desgrippes R, Rinaldi Y, Di Fiore F, Guimbaud R, Follana P, Bachet JB, Vanelslander P, Lecomte T, Capitain O, Parzy A, Bolliet M, Etienne P, Forestier J, El Hajbi F, Bignon AL, Bretagne, Ly Lebrun V, De Sousa Carvalho N, Texier M, Bouche O. PRODIGE 29-UCGI 26 (NEOPAN): A phase III randomised trial comparing chemotherapy with folfirinox or gemcitabine in locally advanced pancreatic carcinoma (LAPC). Ann Oncol 2022;33 (suppl_7): S592-S598.
- Eshuis, W. J., Olde Loohuis, K. M., Busch, O. R., van Gulik, T. M., & Gouma, D. J. (2011). Influence of aberrant right hepatic artery on perioperative course and longterm survival after pancreatoduodenectomy. HPB (Oxford), 13(3), 161-167. doi:10.1111/j.1477-2574.2010.00258.x
- Eshuis, W. J., van der Gaag, N. A., Rauws, E. A., van Eijck, C. H., Bruno, M. J., Kuipers, E. J., . . . Gouma, D. J. (2010). Therapeutic delay and survival after surgery for cancer of the pancreatic head with or without preoperative biliary drainage. Ann Surg, 252(5), 840-849. doi:10.1097/SLA.0b013e3181fd36a2
- European Study Group on Cystic Tumours of the, P. (2018). European evidence-based guidelines on pancreatic cystic neoplasms. Gut, 67(5), 789-804. doi:10.1136/gutjnl-2018-316027
- Evans DB, George B, Tsai S.Evans (2015) Non-metastatic Pancreatic Cancer: Resectable, Borderline Resectable, and Locally Advanced-Definitions of Increasing Importance for the Optimal Delivery of Multimodality Therapy. Ann Surg Oncol;22(11):3409-13. doi: 10.1245/s10434-015-4649-2.
- Farge, D., Frere, C., Connors, J. M., et al.; International Initiative on Thrombosis and Cancer (ITAC) advisory panel. (2022). 2022 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer, including patients with COVID-19. Lancet Oncol, 23(7):e334-e347. doi: 10.1016/S1470-2045(22)00160-7
- Farges, O., Bendersky, N., Truant, S., Delpero, J. R., Pruvot, F. R., & Sauvanet, A. (2017). The Theory and Practice of Pancreatic Surgery in France. Ann Surg, 266(5), 797-804. doi:10.1097/SLA.0000000000002399
- Ferlay, J., Partensky, C., & Bray, F. (2016). More deaths from pancreatic cancer than breast cancer in the EU by 2017. Acta Oncol, 55(9-10), 1158-1160. doi:10.1080/0284186X.2016.1197419
- Ferrone, C. R., Marchegiani, G., Hong, T. S., Ryan, D. P., Deshpande, V., McDonnell, E. I., . . . Fernandez-del Castillo, C. (2015). Radiological and surgical implications of neoadjuvant treatment with FOLFIRINOX for locally advanced and borderline resectable pancreatic cancer. Ann Surg, 261(1), 12-17. doi:10.1097/SLA.0000000000000867
- Fietkau R. et al. (2022). Randomized phase III trial of induction chemotherapy followed by chemoradiotherapy or chemotherapy alone for nonresectable locally advanced pancreatic cancer: First results of the CONKO-007 trial. J Clin Oncol 40, 4008-4008. doi:10.1200/JCO.2022.40.16_suppl.4008
- Fong, Z. V., Alvino, D. M. L., Fernandez-Del Castillo, C., Mehtsun, W. T., Pergolini, I., Warshaw, A. L., . . . Ferrone, C. R. (2017). Reappraisal of Staging Laparoscopy for Patients with Pancreatic Adenocarcinoma: A Contemporary Analysis of 1001 Patients. Ann Surg Oncol, 24(11), 3203-3211. doi:10.1245/s10434-017-5973-5
- Fuchs, C. S., Azevedo, S., Okusaka, T., Van Laethem, J. L., Lipton, L. R., Riess, H., . . . Carrato, A. (2015). A phase 3 randomized, double-blind, placebo-controlled trial of ganitumab or placebo in combination with gemcitabine as first-line therapy for metastatic adenocarcinoma of the pancreas: the GAMMA trial. Ann Oncol, 26(5), 921-927. doi:10.1093/annonc/mdv027
- Gaddam, S., Abboud, Y., Oh, J., et al. (2021). Incidence of pancreatic cancer by age and sex in the US, 2000-2018. JAMA, 326(20):2075-2077. doi: 10.1001/jama.2021.18859
- Ghaneh, P., Hanson, R., Titman, A., Lancaster, G., Plumpton, C., Lloyd-Williams, H., . . . Neoptolemos, J. P. (2018). PET-PANC: multicentre prospective diagnostic accuracy and health economic analysis study of the impact of combined modality 18fluorine-2-fluoro-2-deoxy-d-glucose positron emission tomography with computed tomography scanning in the diagnosis and management of pancreatic cancer. Health Technol Assess, 22(7), 1-114. doi:10.3310/hta22070
- Ghaneh, P., Palmer, D., Cicconi, S., et al.; European Study Group for Pancreatic Cancer. (2023). Immediate surgery compared with short-course neoadjuvant gemcitabine plus capecitabine, FOLFIRINOX, or chemoradiotherapy in patients with borderline resectable pancreatic cancer (ESPAC5): a four-arm, multicentre, randomised, phase 2 trial. Lancet Gastroenterol Hepatol, 8(2):157-168. doi: 10.1016/S2468-1253(22)00348-X.
- Gill, S., Ko, Y. J., Cripps, C., Beaudoin, A., Dhesy-Thind, S., Zulfiqar, M., . . . Moore, M. (2016). PANCREOX: A Randomized Phase III Study of 5-Fluorouracil/Leucovorin With or Without Oxaliplatin for Second-Line Advanced Pancreatic Cancer in Patients Who Have Received Gemcitabine-Based Chemotherapy. J Clin Oncol. doi:10.1200/JCO.2016.68.5776
- Gillen, S., Schuster, T., Meyer Zum Buschenfelde, C., Friess, H., & Kleeff, J. (2010). Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages. PLoS Med, 7(4), e1000267. doi:10.1371/journal.pmed.1000267
- Glant, J. A., Waters, J. A., House, M. G., Zyromski, N. J., Nakeeb, A., Pitt, H. A., . . . Schmidt, C. M. (2011). Does the interval from imaging to operation affect the rate of unanticipated metastasis encountered during operation for pancreatic adenocarcinoma? Surgery, 150(4), 607-616. doi:10.1016/j.surg.2011.07.048
- Goggins M, Overbeek KA, Brand R, Syngal S, Del Chiaro M, Bartsch DK, et al. (2020). Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut, 69(1):7-17. doi: 10.1136/gutjnl-2019-319352.
- Golan T, Hammel P, Reni M, Van Cutsem E, Macarulla T, Hall MJ, Park JO, Hochhauser D, Arnold D, Oh DY, Reinacher-Schick A, Tortora G, Algül H, O'Reilly EM, McGuinness D, Cui KY, Schlienger K, Locker GY, Kindler HL. (2019) Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. N Engl J Med;381(4):317-327. doi: 10.1056/NEJMoa1903387
- Goncalves, A., Gilabert, M., Francois, E., Dahan, L., Perrier, H., Lamy, R., . . . Raoul, J. L. (2012). BAYPAN study: a double-blind phase III randomized trial comparing gemcitabine plus sorafenib and gemcitabine plus placebo in patients with advanced pancreatic cancer. Ann Oncol, 23(11), 2799-2805. doi:10.1093/annonc/mds135
- Gourgou-Bourgade, S., Bascoul-Mollevi, C., Desseigne, F., Ychou, M., Bouche, O., Guimbaud, R., . . . Conroy, T. (2013). Impact of FOLFIRINOX compared with gemcitabine on quality of life in patients with metastatic pancreatic cancer: results from the PRODIGE 4/ACCORD 11 randomized trial. J Clin Oncol, 31(1), 23-29. doi:10.1200/JCO.2012.44.4869
- Greenhalf, W., Ghaneh, P., Neoptolemos, J. P., Palmer, D. H., Cox, T. F., Lamb, R. F., . . . European Study Group for Pancreatic, C. (2014). Pancreatic cancer hENT1 expression and survival from gemcitabine in patients from the ESPAC-3 trial. J Natl Cancer Inst, 106(1), djt347. doi:10.1093/jnci/djt347
- Groot, V., Gemenetzis, G., Blair, A., et al. (2019). Defining and Predicting Early Recurrence in 957 Patients With Resected Pancreatic Ductal Adenocarcinoma. Ann Surg, 69(6):1154-1162. doi: 10.1097/SLA.0000000000002734
- Hackert, T., Probst, P., Knebel, P., Doerr-Harim, C., Bruckner, T., Klaiber, U., . . . Buchler, M. W. (2017). Pylorus Resection Does Not Reduce Delayed Gastric Emptying After Partial Pancreatoduodenectomy: A Blinded Randomized Controlled Trial (PROPP Study, DRKS00004191). Ann Surg. doi:10.1097/SLA.0000000000002480
- Hammad, A. Y., Hodges, J. C., AlMasri, S., et al. (2023). Evaluation of Adjuvant Chemotherapy Survival Outcomes Among Patients With Surgically Resected Pancreatic Carcinoma With Node-Negative Disease After Neoadjuvant Therapy. JAMA Surg, 158(1):55-62. doi: 10.1001/jamasurg.2022.5696
- Hammel, P., Huguet, F., van Laethem, J. L., Goldstein, D., Glimelius, B., Artru, P., . . . Group, L. A. P. T. (2016). Effect of Chemoradiotherapy vs Chemotherapy on Survival in Patients With Locally Advanced Pancreatic Cancer Controlled After 4 Months of Gemcitabine With or Without Erlotinib: The LAP07 Randomized Clinical Trial. JAMA, 315(17), 1844-1853. doi:10.1001/jama.2016.4324
- Harder, J., Ihorst, G., Heinemann, V., Hofheinz, R., Moehler, M., Buechler, P., . . . Geissler, M. (2012). Multicentre phase II trial of trastuzumab and capecitabine in patients with HER2 overexpressing metastatic pancreatic cancer. Br J Cancer, 106(6), 1033-1038. doi:10.1038/bjc.2012.18
- Hart, P. A., Bellin, M. D., Andersen, D. K., Bradley, D., Cruz-Monserrate, Z., Forsmark, C. E., et al.. Pancreatic, C. (2016). Type 3c (pancreatogenic) diabetes mellitus secondary to chronic pancreatitis and pancreatic cancer. Lancet Gastroenterol Hepatol, 1(3), 226-237. doi:10.1016/S2468-1253(16)30106-6.
- Heger U, Sun H, Hinz U , Klaibe U, Masayuki T, Bing L, et al (2020). Induction chemotherapy in pancreatic cancer : CA 19-9 may predict resectability and survival/ HPB (Oxford),22:224-232.
- Heinemann, V., Boeck, S., Hi. nke, A., Labianca, R., & Louvet, C. (2008). Meta-analysis of randomized trials: evaluation of benefit from gemcitabine-based combination chemotherapy applied in advanced pancreatic cancer. BMC Cancer, 8, 82. doi:10.1186/1471-2407-8-82
- Hishinuma, S., Ogata, Y., Tomikawa, M., Ozawa, I., Hirabayashi, K., & Igarashi, S. (2006). Patterns of recurrence after curative resection of pancreatic cancer, based on autopsy findings. J Gastrointest Surg, 10(4), 511-518. doi:10.1016/j.gassur.2005.09.016
- Hsu, C. C., Herman, J. M., Corsini, M. M., Winter, J. M., Callister, M. D., Haddock, M. G., . . . Miller, R. C. (2010). Adjuvant chemoradiation for pancreatic adenocarcinoma: the Johns Hopkins Hospital-Mayo Clinic collaborative study. Ann Surg Oncol, 17(4), 981-990. doi:10.1245/s10434-009-0743-7
- Huang, Z., & Liu, F. (2014). Diagnostic value of serum carbohydrate antigen 19-9 in pancreatic cancer: a meta-analysis. Tumour Biol, 35(8), 7459-7465. doi:10.1007/s13277-014-1995-9
- Huang, J., Lok, V., Ho Ngai, C., et al. (2021). Worldwide Burden of, Risk Factors for, and Trends in Pancreatic Cancer. Gastroenterology, 160(3):744-754. doi: 10.1053/j.gastro.2020.10.007
- Huguet, F., Andre, T., Hammel, P., Artru, P., Balosso, J., Selle, F., . . . Louvet, C. (2007). Impact of chemoradiotherapy after disease control with chemotherapy in locally advanced pancreatic adenocarcinoma in GERCOR phase II and III studies. J Clin Oncol, 25(3), 326-331. doi:10.1200/JCO.2006.07.5663
- Huguet, F., Hammel, P., Vernerey, D., Goldstein, D., van Laethem, J. L., Glimelius, B., . . . Louvet, C. (2014). Impact of chemoradiotherapy (CRT) on local control and time without treatment in patients with locally advanced pancreatic cancer (LAPC) included in the international phase III LAP 07 study. J Clin Oncol, 32(suppl), abstr 4001.
- Huguet, F., Rivin Del Campo, E., Orthuon, A., Mornex, F., Bessières, I., Guimas, V., Vendrely, V. (2022). Radiation therapy of pancreatic cancers. Cancer Radiother, 26(1-2):259-265. doi: 10.1016/j.canrad.2021.08.010.
- Institut National du Cancer. Panorama des cancers en France – édition 2023. https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Panorama-des-cancers-en-France-edition-2023
- Isaji S, Mizuno S, Windsor JA, Bassi C, Fernández-Del Castillo C, Hackert T, Hayasaki A, Katz MHG, Kim SW, Kishiwada M, Kitagawa H, Michalski CW, Wolfgang CL.(2018) International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology;18(1):2-11.
- Jang JY, Han Y, Lee H, Kim SW, Kwon W, Lee KH, Oh DY, Chie EK, Lee JM, Heo JS, Park JO, Lim DH, Kim SH, Park SJ, Lee WJ, Koh YH, Park JS, Yoon DS, Lee IJ, Choi SH. (2018). Oncological Benefits of Neoadjuvant Chemoradiation With Gemcitabine Versus Upfront Surgery in Patients With Borderline Resectable Pancreatic Cancer: A Prospective, Randomized, Open-label, Multicenter Phase 2/3 Trial. Ann Surg ;268(2):215-222.
- Janssen QP, Buettner S, Suker M, Beumer BR, Addeo P, Bachellier P,et al. (2019). Neoadjuvant FOLFIRINOX in Patients With Borderline Resectable Pancreatic Cancer: A Systematic Review and Patient-Level Meta-Analysis. J Natl Cancer Inst;111(8):782-794. doi: 10.1093/jnci/djz073.Kalser, M. H., Barkin, J., & MacIntyre, J. M. (1985). Pancreatic cancer. Assessment of prognosis by clinical presentation. Cancer, 56(2), 397-402.
- Jin Z, Wei Y, Lin H, Yang J, Jin H, Shen S, Zhang X. Endoscopic ultrasound-guided versus endoscopic retrograde cholangiopancreatography-guided biliary drainage for primary treatment of distal malignant biliary obstruction: A systematic review and meta-analysis (2020). Dig Endosc. Jan;32(1):16-26. doi: 10.1111/den.13456. Epub 2019 Jul 6. PMID: 31165527.
- Kamarajah, S. K., Burns, W. R., Frankel, T. L., Cho, C. S., & Nathan, H. (2017). Validation of the American Joint Commission on Cancer (AJCC) 8th Edition Staging System for Patients with Pancreatic Adenocarcinoma: A Surveillance, Epidemiology and End Results (SEER) Analysis. Ann Surg Oncol, 24(7), 2023-2030. doi:10.1245/s10434-017-5810-x
- Katz, M. H., Shi, Q., Ahmad, S. A., Herman, J. M., Marsh Rde, W., Collisson, E., Venook, A. P. (2016). Preoperative Modified FOLFIRINOX Treatment Followed by Capecitabine-Based Chemoradiation for Borderline Resectable Pancreatic Cancer: Alliance for Clinical Trials in Oncology Trial A021101. JAMA Surg, 151(8), e161137. doi:10.1001/jamasurg.2016.1137
- Kim, Y. E., Park, M. S., Hong, H. S., Kang, C. M., Choi, J. Y., Lim, J. S., . . . Kim, K. W. (2009). Effects of neoadjuvant combined chemotherapy and radiation therapy on the CT evaluation of resectability and staging in patients with pancreatic head cancer. Radiology, 250(3), 758-765. doi:10.1148/radiol.2502080501
- Kindler, H. L., Ioka, T., Richel, D. J., Bennouna, J., Letourneau, R., Okusaka, T., . . . Van Cutsem, E. (2011). Axitinib plus gemcitabine versus placebo plus gemcitabine in patients with advanced pancreatic adenocarcinoma: a double-blind randomised phase 3 study. Lancet Oncol, 12(3), 256-262. doi:10.1016/S1470-2045(11)70004-3
- Kindler, H. L., Niedzwiecki, D., Hollis, D., Sutherland, S., Schrag, D., Hurwitz, H., . . . Goldberg, R. M. (2010). Gemcitabine plus bevacizumab compared with gemcitabine plus placebo in patients with advanced pancreatic cancer: phase III trial of the Cancer and Leukemia Group B (CALGB 80303). J Clin Oncol, 28(22), 3617-3622. doi:10.1200/JCO.2010.28.1386
- Kindler, H. L., Hammel, P., Reni, M., et al. (2022). Overall Survival Results From the POLO Trial: A Phase III Study of Active Maintenance Olaparib Versus Placebo for Germline BRCA-Mutated Metastatic Pancreatic Cancer. J Clin Oncol, 40(34):3929-3939. doi: 10.1200/JCO.21.01604
- Klinkenbijl, J. H., Jeekel, J., Sahmoud, T., van Pel, R., Couvreur, M. L., Veenhof, C. H., . . . Wils, J. (1999). Adjuvant radiotherapy and 5-fluorouracil after curative resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group. Ann Surg, 230(6), 776-782; discussion 782-774.
- Klompmaker, S., de Rooij, T., Koerkamp, B.G., et al.; Dutch Pancreatic Cancer Group (2021). International Validation of Reduced Major Morbidity After Minimally Invasive Distal Pancreatectomy Compared With Open Pancreatectomy. Ann Surg, 274(6):e966-e973. doi: 10.1097/SLA.0000000000003659
- Krishnan, S., Rana, V., Janjan, N. A., Varadhachary, G. R., Abbruzzese, J. L., Das, P., . . . Crane, C. H. (2007). Induction chemotherapy selects patients with locally advanced, unresectable pancreatic cancer for optimal benefit from consolidative chemoradiation therapy. Cancer, 110(1), 47-55. doi:10.1002/cncr.22735
- Kruger, S. F., Lohneis, A., Abendroth, A., et al. (2022). Prognosis and tumor biology of pancreatic cancer patients with isolated lung metastases: translational results from the German multicenter AIO-YMO-PAK-0515 study. ESMO Open, 7(1):100388. doi: 10.1016/j.esmoop.2022.100388
- Labori, K. J., Bratlie, S.O., Andersson, B., et al.; Nordic Pancreatic Cancer Trial-1 study group. (2024). Neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer (NORPACT-1): a multicentre, randomised, phase 2 trial. Lancet Gastroenterol Hepatol, 9(3):205-217. doi: 10.1016/S2468-1253(23)00405-3
- Lapôtre-Ledoux B, Remontet L, Uhry Z, Dantony E, Grosclaude P, Molinié F, Woronoff AS, Lecoffre-Bernard C, Lafay L, Defossez G, D’Almeida T et le Réseau français des registres de cancers Francim2. Incidence des principaux cancers en France métropolitaine en 2023 et tendances depuis 1990. Bulletin Epidémiologique Hebdomadaire du 4.7.2023
- Lee, M. G., Lee, S. H., Lee, S. J., Lee, Y. S., Hwang, J. H., Ryu, J. K., . . . Woo, S. M. (2013). 5-Fluorouracil/leucovorin combined with irinotecan and oxaliplatin (FOLFIRINOX) as second-line chemotherapy in patients with advanced pancreatic cancer who have progressed on gemcitabine-based therapy. Chemotherapy, 59(4), 273-279. doi:10.1159/000356158
- Leidner, R., Sanjuan Silva, N., Huang, H., et al. (2022). Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer. N Engl J Med, 386(22):2112-2119. doi: 10.1056/NEJMoa2119662
- Lennon, A. M., Wolfgang, C. L., Canto, M. I., Klein, A. P., Herman, J. M., Goggins, M., . . . Hruban, R. H. (2014). The early detection of pancreatic cancer: what will it take to diagnose and treat curable pancreatic neoplasia? Cancer Res, 74(13), 3381-3389. doi:10.1158/0008-5472.CAN-14-0734
- Liu, Z., Luo, G., Guo, M., Jin, K., Xiao, Z., Liu, L., . . . Yu, X. (2015). Lymph node status predicts the benefit of adjuvant chemoradiotherapy for patients with resected pancreatic cancer. Pancreatology, 15(3), 253-258. doi:10.1016/j.pan.2015.03.012
- Loehrer, P. J., Sr., Feng, Y., Cardenes, H., Wagner, L., Brell, J. M., Cella, D., . . . Benson, A. B., 3rd. (2011). Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer: an Eastern Cooperative Oncology Group trial. J Clin Oncol, 29(31), 4105-4112. doi:10.1200/JCO.2011.34.8904
- Lutz, M. P., Zalcberg, J. R., Ducreux, M., Aust, D., Bruno, M. J., Buchler, M. W., . . . Otto, F. (2017). 3rd St. Gallen EORTC Gastrointestinal Cancer Conference: Consensus recommendations on controversial issues in the primary treatment of pancreatic cancer. Eur J Cancer, 79, 41-49. doi:10.1016/j.ejca.2017.03.022
- Mahaseth, H., Brutcher, E., Kauh, J., Hawk, N., Kim, S., Chen, Z., . . . El-Rayes, B. F. (2013). Modified FOLFIRINOX regimen with improved safety and maintained efficacy in pancreatic adenocarcinoma. Pancreas, 42(8), 1311-1315. doi:10.1097/MPA.0b013e31829e2006
- Maithel, S. K., Maloney, S., Winston, C., Gonen, M., D'Angelica, M. I., Dematteo, R. P., . . . Allen, P. J. (2008). Preoperative CA 19-9 and the yield of staging laparoscopy in patients with radiographically resectable pancreatic adenocarcinoma. Ann Surg Oncol, 15(12), 3512-3520. doi:10.1245/s10434-008-0134-5
- Malleo, G., Maggino, L., Ferrone, C. R., Marchegiani, G., Mino-Kenudson, M., Capelli, P., . . . Salvia, R. (2018). Number of Examined Lymph Nodes and Nodal Status Assessment in Distal Pancreatectomy for Body/Tail Ductal Adenocarcinoma. Ann Surg. doi:10.1097/SLA.0000000000002781
- Marchiò C, Scaltriti M, Ladanyi M et al. ESMO recommendations on the standard methods to detect NTRK fusions in daily practice and clinical research. Marchiò et al. Ann Oncol. 2019 Sep 1;30(9):1417-1427
- Marion-Audibert AM, Vullierme MP, Ronot M, Mabrut JY, Sauvanet A, Zins M, et al. (2018). Routine MRI With DWI Sequences to Detect Liver Metastases in Patients With Potentially Resectable Pancreatic Ductal Carcinoma and Normal Liver CT: A Prospective Multicenter Study. AJR Am J Roentgenol.;211(5):W217-W225
- Marthey, L., Sa-Cunha, A., Blanc, J. F., Gauthier, M., Cueff, A., Francois, E., . . . Taïeb, J. (2015). FOLFIRINOX for locally advanced pancreatic adenocarcinoma: results of an AGEO multicenter prospective observational cohort. Ann Surg Oncol, 22(1), 295-301. doi:10.1245/s10434-014-3898-9
- Martin, R. C., 2nd, Scoggins, C. R., Egnatashvili, V., Staley, C. A., McMasters, K. M., & Kooby, D. A. (2009). Arterial and venous resection for pancreatic adenocarcinoma: operative and long-term outcomes. Arch Surg, 144(2), 154-159. doi:10.1001/archsurg.2008.547
- Mateo J, Chakravarty D, Dienstmann R, Jezdic S, Gonzalez-Perez A, Lopez-Bigas N, Ng CKY, Bedard PL, Tortora G, Douillard JY, Van Allen EM, Schultz N, Swanton C, André F, Pusztai L. (2018 ). Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. Ann Oncol;29(9):1895-1902. doi: 10.1093/annonc/mdy263.
- McDonald, A. M., Dulaney, C. R., Lopez-Araujo, J., Posey, J. A., Keene, K. S., Christein, J. D., . . . Jacob, R. (2015). Patterns of Failure for Lymph Node-Positive Resected Pancreatic Adenocarcinoma After Adjuvant Radiotherapy or Gemcitabine-based Chemotherapy Alone. J Gastrointest Cancer, 46(2), 149-155. doi:10.1007/s12029-015-9702-7
- Modolell, I., Guarner, L., & Malagelada, J. R. (1999). Vagaries of clinical presentation of pancreatic and biliary tract cancer. Ann Oncol, 10 Suppl 4, 82-84.
- Moore, M. J., Goldstein, D., Hamm, J., Figer, A., Hecht, J. R., Gallinger, S., . . . National Cancer Institute of Canada Clinical Trials, G. (2007). Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol, 25(15), 1960-1966. doi:10.1200/JCO.2006.07.9525
- Moutardier, V., Giovannini, M., Magnin, V., Viret, F., Lelong, B., & Delpero, J. R. (2004). [How to improve treatment of resectable pancreatic adenocarcinomas? Surgical resection, histopathological examination, adjuvant therapies]. Gastroenterol Clin Biol, 28(11), 1083-1091.
- Mukherjee, S., Hurt, C. N., Bridgewater, J., Falk, S., Cummins, S., Wasan, H., . . . Maughan, T. (2013). Gemcitabine-based or capecitabine-based chemoradiotherapy for locally advanced pancreatic cancer (SCALOP): a multicentre, randomised, phase 2 trial. Lancet Oncol, 14(4), 317-326. doi:10.1016/S1470-2045(13)70021-4
- Muzzolini, M., Lupinacci, R., Bachet, J. B., Lassoued, D., Sauvanet, A., Gaujoux, S. (2024). Should liver metastases of pancreatic adenocarcinoma be resected? J Visc Surg, S1878-7886(23)00206-0. doi: 10.1016/j.jviscsurg.2023.12.006
- Neoptolemos, J. P., Dunn, J. A., Stocken, D. D., Almond, J., Link, K., Beger, H., . . . European Study Group for Pancreatic, C. (2001). Adjuvant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial. Lancet, 358(9293), 1576-1585.
- Neoptolemos, J. P., Palmer, D. H., Ghaneh, P., Psarelli, E. E., Valle, J. W., Halloran, C. M., . . . European Study Group for Pancreatic, C. (2017). Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. Lancet, 389(10073), 1011-1024. doi:10.1016/S0140-6736(16)32409-6
- Neoptolemos, J. P., Stocken, D. D., Bassi, C., Ghaneh, P., Cunningham, D., Goldstein, D., . . . European Study Group for Pancreatic, C. (2010). Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA, 304(10), 1073-1081. doi:10.1001/jama.2010.1275
- Neoptolemos, J. P., Stocken, D. D., Friess, H., Bassi, C., Dunn, J. A., Hickey, H., . . . European Study Group for Pancreatic, C. (2004). A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer. N Engl J Med, 350(12), 1200-1210. doi:10.1056/NEJMoa032295
- Neuzillet, C., Hentic, O., Rousseau, B., Rebours, V., Bengrine-Lefevre, L., Bonnetain, F., . . . Hammel, P. (2012). FOLFIRI regimen in metastatic pancreatic adenocarcinoma resistant to gemcitabine and platinum-salts. World J Gastroenterol, 18(33), 4533-4541. doi:10.3748/wjg.v18.i33.4533
- Neuzillet, C., Sauvanet, A., & Hammel, P. (2011). Prognostic factors for resectable pancreatic adenocarcinoma. J Visc Surg, 148(4), e232-243. doi:10.1016/j.jviscsurg.2011.07.007
- Neuzillet C, Anota A, Foucaut AM, Védie AL, Antoun S, Barnoud D, Bouleuc C, Chorin F, Cottet V, Fontaine E, Garabige V, Hébuterne X, Huguet F, Lièvre A, Marchal T, Mouillot T, Peschaud F, Quilliot D, Raynard B, Schneider S, Scotté F, Vansteene D, Mariani P, Bouché O, Joly F (2020). Nutrition and physical activity: French intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, AFC, SFP-APA, SFNCM, AFSOS). BMJ Support Palliat Care:bmjspcare-2020-002751. doi: 10.1136/bmjspcare-2020-002751.
- Neuzillet, C., Bouché, O., Tournigand, C., et al. (2023). Effect of Adapted Physical Activity in Patients With Advanced Pancreatic Cancer: The APACaP GERCOR Randomized Trial. J Natl Compr Canc Netw, 21(12):1234-1242.e17. doi: 10.6004/jnccn.2023.7065
- Ni, X. G., Bai, X. F., Mao, Y. L., Shao, Y. F., Wu, J. X., Shan, Y., . . . Zhao, P. (2005). The clinical value of serum CEA, CA19-9, and CA242 in the diagnosis and prognosis of pancreatic cancer. Eur J Surg Oncol, 31(2), 164-169. doi:10.1016/j.ejso.2004.09.007
- Nickel A, Max Haney C, Kowalewski KF, Probst P, Limen EF, Kalkum E, et al. (2020). Laparoscopic Versus Open Pancreaticoduodenectomy: A Systematic Review and Meta-analysis of Randomized Controlled Trials? Ann Surg; 271(1):54-66. doi: 10.1097/SLA.0000000000003309.
- Nimptsch, U., Krautz, C., Weber, G. F., Mansky, T., & Grutzmann, R. (2016). Nationwide In-hospital Mortality Following Pancreatic Surgery in Germany is Higher than Anticipated. Ann Surg, 264(6), 1082-1090. doi:10.1097/SLA.0000000000001693
- Nouts, A., Levy, P., Voitot, H., & Bernades, P. (1998). [Diagnostic value of serum Ca 19-9 antigen in chronic pancreatitis and pancreatic adenocarcinoma]. Gastroenterol Clin Biol, 22(2), 152-159.
- Oettle, H., Neuhaus, P., Hochhaus, A., Hartmann, J. T., Gellert, K., Ridwelski, K., . . . Riess, H. (2013). Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO-001 randomized trial. JAMA, 310(14), 1473-1481. doi:10.1001/jama.2013.279201
- Oettle, H., Riess, H., Stieler, J. M., Heil, G., Schwaner, I., Seraphin, J., . . . Pelzer, U. (2014). Second-line oxaliplatin, folinic acid, and fluorouracil versus folinic acid and fluorouracil alone for gemcitabine-refractory pancreatic cancer: outcomes from the CONKO-003 trial. J Clin Oncol, 32(23), 2423-2429. doi:10.1200/JCO.2013.53.6995
- Ohba, A., Ozaka, M., Ogawa, G., et al. (2023). 1616O - Nab-paclitaxel plus gemcitabine versus modified FOLFIRINOX or S-IROX in metastatic or recurrent pancreatic cancer (JCOG1611, GENERATE): A multicentred, randomized, open-label, three-arm, phase II/III trial. Annals of Oncology (2023) 34 (suppl_2): S895-S924. doi : 10.1016/S0923-7534(23)01944-0
- Ohtsuka, T., Fernandez-Del Castillo, C., Furukawa, T., et al. (2024) International evidence-based Kyoto guidelines for the management of intraductal papillary mucinous neoplasm of the pancreas. Pancreatology, 24(2):255-270. doi: 10.1016/j.pan.2023.12.009
- Okasha, H. H., Naga, M. I., Esmat, S., Naguib, M., Hassanein, M., Hassani, M., . . . Foda, A. M. (2013). Endoscopic Ultrasound-Guided Fine Needle Aspiration versus Percutaneous Ultrasound-Guided Fine Needle Aspiration in Diagnosis of Focal Pancreatic Masses. Endosc Ultrasound, 2(4), 190-193. doi:10.4103/2303-9027.121239
- O’Reilly EM, Hechtman JF, (2019). Tumour response to TRK inhibition in a patient with pancreatic adenocarcinoma harbouring an NTRK gene fusion. Ann Oncol ;30 (Supplement 8): viii36–viii40
- Pant, S., Wainberg, Z. A., Weekes, C. D., et al. (2024). Lymph-node-targeted, mKRAS-specific amphiphile vaccine in pancreatic and colorectal cancer: the phase 1 AMPLIFY-201 trial. Nat Med, 30(2):531-542. doi: 10.1038/s41591-023-02760-3
- Petrelli, F., Coinu, A., Borgonovo, K., Cabiddu, M., Ghilardi, M., Lonati, V., . . . Gruppo Italiano per lo Studio dei Carcinomi dell'Apparato, D. (2015). FOLFIRINOX-Based Neoadjuvant Therapy in Borderline Resectable or Unresectable Pancreatic Cancer: A Meta-Analytical Review of Published Studies. Pancreas, 44(4), 515-521. doi:10.1097/MPA.0000000000000314
- Philip, P. A., Benedetti, J., Corless, C. L., Wong, R., O'Reilly, E. M., Flynn, P. J., . . . Blanke, C. D. (2010). Phase III study comparing gemcitabine plus cetuximab versus gemcitabine in patients with advanced pancreatic adenocarcinoma: Southwest Oncology Group-directed intergroup trial S0205. J Clin Oncol, 28(22), 3605-3610. doi:10.1200/JCO.2009.25.7550
- Philip, P. A., Goldman, B., Ramanathan, R. K., Lenz, H. J., Lowy, A. M., Whitehead, R. P., . . . Blanke, C. D. (2014). Dual blockade of epidermal growth factor receptor and insulin-like growth factor receptor-1 signaling in metastatic pancreatic cancer: phase Ib and randomized phase II trial of gemcitabine, erlotinib, and cixutumumab versus gemcitabine plus erlotinib (SWOG S0727). Cancer, 120(19), 2980-2985. doi:10.1002/cncr.28744
- Philip PA, Lacy J, Portales F, Sobrero A, Pazo-Cid R, Manzano Mozo JL, Kim EJ, Dowden S, Zakari A, Borg C, Terrebonne E, Rivera F, Sastre J, Bathini V, López-Trabada D, Asselah J, Saif MW, Shiansong Li J, Ong TJ, Nydam T, Hammel P (2020). Nab-paclitaxel plus gemcitabine in patients with locally advanced pancreatic cancer (LAPACT): a multicentre, open-label phase 2 study. Lancet Gastroenterol Hepatol;5(3):285-294. doi: 10.1016/S2468-1253(19)30327-9
- Philip, P. A., Azar, I., Xiu, J., et al. (2022). Molecular Characterization of KRAS Wild-type Tumors in Patients with Pancreatic Adenocarcinoma. Clin Cancer Res, 28(12):2704-2714. doi: 10.1158/1078-0432.CCR-21-3581
- Pietrasz, D., Marthey, L., Wagner, M., Blanc, J. F., Laurent, C., Turrini, O., . . . Bachet, J. B. (2015). Pathologic Major Response After FOLFIRINOX is Prognostic for Patients Secondary Resected for Borderline or Locally Advanced Pancreatic Adenocarcinoma: An AGEO-FRENCH, Prospective, Multicentric Cohort. Ann Surg Oncol, 22 Suppl 3, S1196-1205. doi:10.1245/s10434-015-4783-x
- Pishvaian MJ, Blais EM, Brody JR, Lyons E, DeArbeloa P, Hendifar A, Mikhail S, Chung V, Sahai V, Sohal DPS, Bellakbira S, Thach D, Rahib L, Madhavan S, Matrisian LM, Petricoin EF 3rd. (2020). Overall survival in patients with pancreatic cancer receiving matched therapies following molecular profiling: a retrospective analysis of the Know Your Tumor registry trial. Lancet Oncol;21(4):508-518. doi: 10.1016/S1470-2045(20)30074-7
- Poplin, E., Feng, Y., Berlin, J., Rothenberg, M. L., Hochster, H., Mitchell, E., . . . Benson, A. B., 3rd. (2009). Phase III, randomized study of gemcitabine and oxaliplatin versus gemcitabine (fixed-dose rate infusion) compared with gemcitabine (30-minute infusion) in patients with pancreatic carcinoma E6201: a trial of the Eastern Cooperative Oncology Group. J Clin Oncol, 27(23), 3778-3785. doi:10.1200/JCO.2008.20.9007
- Poplin, E., Wasan, H., Rolfe, L., Raponi, M., Ikdahl, T., Bondarenko, I., . . . Allen, A. (2013). Randomized, multicenter, phase II study of CO-101 versus gemcitabine in patients with metastatic pancreatic ductal adenocarcinoma: including a prospective evaluation of the role of hENT1 in gemcitabine or CO-101 sensitivity. J Clin Oncol, 31(35), 4453-4461. doi:10.1200/JCO.2013.51.0826
- Portal, A., Arbaud, C., Bachet, J. B., Bonnetain, F., Dahan, L., Dreanic, J., . . . de la Fouchardière, C. (2015). Gemcitabine et nab-paclitaxel en 2ème ligne de chimiothérapie palliative après FOLFIRINOX chez des patients atteints d’un adénocarcinome du pancréas métastatique : cohorte prospective multicentrique de l’AGEO. Journées Francophones d'Hépato-Gastroenterologie et d'Oncologie Digestive, abstr P256.
- Poruk, K. E., Gay, D. Z., Brown, K., Mulvihill, J. D., Boucher, K. M., Scaife, C. L., . . . Mulvihill, S. J. (2013). The clinical utility of CA 19-9 in pancreatic adenocarcinoma: diagnostic and prognostic updates. Curr Mol Med, 13(3), 340-351.
- Rahib, L., Wehner, M., Matrisian, L.M., Nead, K.T. (2021). Estimated projection of US cancer incidence and death to 2010. JAMA Network Open, 4(4):e214708.
- Raman, S. P., Reddy, S., Weiss, M. J., Manos, L. L., Cameron, J. L., Zheng, L., . . . Wolfgang, C. L. (2015). Impact of the time interval between MDCT imaging and surgery on the accuracy of identifying metastatic disease in patients with pancreatic cancer. AJR Am J Roentgenol, 204(1), W37-42. doi:10.2214/AJR.13.12439.
- Rebours V, Napoleon B, Lefort C, Koch S, Vuitton L, Jean F, et al. Cohorte TEAM-P : étude observationnelle multicentrique longitudinale pour le suivi des tumeurs intracanalaires et mucineuses du pancréas des canaux secondaires. JFHOD 2022, abstr. C.026.
- Rijkers, A. P., Valkema, R., Duivenvoorden, H. J., & van Eijck, C. H. (2014). Usefulness of F-18-fluorodeoxyglucose positron emission tomography to confirm suspected pancreatic cancer: a meta-analysis. Eur J Surg Oncol, 40(7), 794-804. doi:10.1016/j.ejso.2014.03.016
- Rinehart, J., Adjei, A. A., Lorusso, P. M., Waterhouse, D., Hecht, J. R., Natale, R. B., . . . Meyer, M. B. (2004). Multicenter phase II study of the oral MEK inhibitor, CI-1040, in patients with advanced non-small-cell lung, breast, colon, and pancreatic cancer. J Clin Oncol, 22(22), 4456-4462. doi:10.1200/JCO.2004.01.185
- Rougier, P., Riess, H., Manges, R., Karasek, P., Humblet, Y., Barone, C., . . . Philip, P. A. (2013). Randomised, placebo-controlled, double-blind, parallel-group phase III study evaluating aflibercept in patients receiving first-line treatment with gemcitabine for metastatic pancreatic cancer. Eur J Cancer, 49(12), 2633-2642. doi:10.1016/j.ejca.2013.04.002
- Rousseau, B., Falcoz, A., Toullec, C., et al. (2023). Assessment of an emergency 14-day (d) integrative supportive care program (14-EISCP) followed by early chemotherapy (CTx) in symptomatic patients (pts) with advanced pancreatic ductal adenocarcinoma (aPDAC): A prospective ARCAD cohort study. J Clin Oncol, 41(4_suppl):700. doi :10.1200/JCO.2023.41.4_suppl.700
- Ryan, D. P., Hong, T. S., & Bardeesy, N. (2014). Pancreatic adenocarcinoma. N Engl J Med, 371(22), 2140-2141. doi:10.1056/NEJMc1412266
- Safran, H., Miner, T., Bahary, N., Whiting, S., Lopez, C. D., Sun, W., . . . Sio, T. (2011). Lapatinib and gemcitabine for metastatic pancreatic cancer. A phase II study. Am J Clin Oncol, 34(1), 50-52.
- Sanjeevi, S., Ivanics, T., Lundell, L., Kartalis, N., Andren-Sandberg, A., Blomberg, J., . . . Ansorge, C. (2016). Impact of delay between imaging and treatment in patients with potentially curable pancreatic cancer. Br J Surg, 103(3), 267-275. doi:10.1002/bjs.10046
- Schouten TJ, van Goor IWJM, Dorland GA, et al; Dutch Pancreatic Cancer Group. The Value of Biological and Conditional Factors for Staging of Patients with Resectable Pancreatic Cancer Undergoing Upfront Resection: A Nationwide Analysis. Ann Surg Oncol. 2024 Feb 22. doi: 10.1245/s10434-024-15070-w. Epub ahead of print. PMID: 38386198.
- Schram, A.M., Goto, K., Kim, D. W., et al. (2022). Efficacy and safety of zenocutuzumab, a HER2 x HER3 bispecific antibody, across advanced NRG1 fusion (NRG1+) cancers. J Clin Oncol, 40, 105. doi :10.1200/JCO.2022.40.16_suppl.105
- Schwarz, L., Lupinacci, R. M., Svrcek, M., Lesurtel, M., Bubenheim, M., Vuarnesson, H., . . . Paye, F. (2014). Para-aortic lymph node sampling in pancreatic head adenocarcinoma. Br J Surg, 101(5), 530-538. doi:10.1002/bjs.9444.
- Schwarz L, Bachet JB, Meurisse A, Bouché O, Assenat E, Piessen G, Terrebonne E, Hammel P, Regenet N, Turco C, Taieb J, Mabrut JY, Turrini O, Portales F, Paye F, Barbier L, Truant S, Sa Cunha A, and and PANACHE01-PRODIGE48 Authors' Group. Resectable pancreatic adenocarcinoma neo-adjuvant FOLF(IRIN)OX-based chemotherapy: A multicenter, non-comparative, randomized, phase II trial (PANACHE01-PRODIGE48 study). J Clin Oncol;2022 40:16_suppl, 4134-4134
- Seelen LWF, Doppenberg D, Stoop TF,et al. Dutch Pancreatic Cancer Group. Minimum and Optimal CA19-9 Response After Two Months Induction Chemotherapy in Patients With Locally Advanced Pancreatic Cancer: A Nationwide Multicenter Study. Ann Surg. 2024 May 1;279(5):832-841. doi: 10.1097/SLA.0000000000006021. Epub 2023 Jul 21. PMID: 37477009.
- Seufferlein, T., Bachet, J. B., Van Cutsem, E., Rougier, P., & Group, E. G. W. (2012). Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 23 Suppl 7, vii33-40. doi:10.1093/annonc/mds224
- Seufferlein, T., Uhl, W., Kornmann, M., et al. (2023). Perioperative or only adjuvant gemcitabine plus nab-paclitaxel for resectable pancreatic cancer (NEONAX)-a randomized phase II trial of the AIO pancreatic cancer group.Ann Oncol, 34(1):91-100. doi: 10.1016/j.annonc.2022.09.161
- Shindo, K., Yu, J., Suenaga, M., Fesharakizadeh, S., Cho, C., Macgregor-Das, A., . . . Goggins, M. (2017). Deleterious Germline Mutations in Patients With Apparently Sporadic Pancreatic Adenocarcinoma. J Clin Oncol, 35(30), 3382-3390. doi:10.1200/JCO.2017.72.3502
- Singhi AD, George B, Greenbowe JR, Chung J, Suh J, Maitra A, Klempner SJ, Hendifar A, Milind JM, Golan T, Brand RE, Zureikat AH, Roy S, Schrock AB, Miller VA, Ross JS, Ali SM, Bahary N. (2019). Real-Time Targeted Genome Profile Analysis of Pancreatic Ductal Adenocarcinomas Identifies Genetic Alterations That Might Be Targeted With Existing Drugs or Used as Biomarkers. Gastroenterology;156(8):2242-2253.e4. doi: 10.1053/j.gastro.2019.02.037.
- Sinn, M., Bahra, M., Liersch, T., Gellert, K., Messmann, H., Bechstein, W., . . . Riess, H. (2017). CONKO-005: Adjuvant Chemotherapy With Gemcitabine Plus Erlotinib Versus Gemcitabine Alone in Patients After R0 Resection of Pancreatic Cancer: A Multicenter Randomized Phase III Trial. J Clin Oncol, 35(29), 3330-3337. doi:10.1200/JCO.2017.72.6463
- Sinn, M., Liersch, T., Riess, H., Gellert, K., Stübs, P., Waldschmidt, D. T., . . . Oettle, H. (2014). LBA18 - CONKO-006: A randomized double-blinded phase IIb-study of adjuvant therapy with gemcitabine + sorafenib/placebo for patients with R1-resection of pancreatic cancer. Ann Oncol, 25(5).
- Soloff, E.V., Al-Hawary, M.M., Desser, T.S., Fishman, E.K., Minter, R.M., Zins, M. (2022). Imaging assessment of pancreatic cancer resectability after neoadjuvant therapy: AJR Expert Panel Narrative Review. AJR Am J Roentgenol, 218(4):570-581. doi: 10.2214/AJR.21.26931
- Stocken, D. D., Buchler, M. W., Dervenis, C., Bassi, C., Jeekel, H., Klinkenbijl, J. H., . . . Pancreatic Cancer Meta-analysis, G. (2005). Meta-analysis of randomised adjuvant therapy trials for pancreatic cancer. Br J Cancer, 92(8), 1372-1381. doi:10.1038/sj.bjc.6602513
- Strickler, J.H., Satake, H., George, T. J., et al. (2023). Sotorasib in KRAS p.G12C-Mutated Advanced Pancreatic Cancer. N Engl J Med, 388(1):33-43. doi: 10.1056/NEJMoa2208470
- Strobel, O., Hartwig, W., Hackert, T., Hinz, U., Berens, V., Grenacher, L., . . . Werner, J. (2013). Re-resection for isolated local recurrence of pancreatic cancer is feasible, safe, and associated with encouraging survival. Ann Surg Oncol, 20(3), 964-972. doi:10.1245/s10434-012-2762-z
- Strobel, O., Lorenz, P., Hinz, U., et al. (2022). Actual Five-year Survival After Upfront Resection for Pancreatic Ductal Adenocarcinoma: Who Beats the Odds? Ann Surg, 275(5):962-971. doi: 10.1097/SLA.0000000000004147
- Suker, M., Beumer, B. R., Sadot, E., Marthey, L., Faris, J. E., Mellon, E. A., . . . Koerkamp, B. G. (2016). FOLFIRINOX for locally advanced pancreatic cancer: a systematic review and patient-level meta-analysis. Lancet Oncol, 17(6), 801-810. doi:10.1016/S1470-2045(16)00172-8
- Sulpice, L., Rayar, M., Paquet, C., Bergeat, D., Merdrignac, A., Cunin, D., . . . Boudjema, K. (2013). Does an aberrant right hepatic artery really influence the short- and long-term results of a pancreaticoduodenectomy for malignant disease? A matched case-controlled study. J Surg Res, 185(2), 620-625. doi:10.1016/j.jss.2013.07.015
- Sultana, A., Smith, C. T., Cunningham, D., Starling, N., Neoptolemos, J. P., & Ghaneh, P. (2007). Meta-analyses of chemotherapy for locally advanced and metastatic pancreatic cancer. J Clin Oncol, 25(18), 2607-2615. doi:10.1200/JCO.2006.09.2551
- Svrcek, M., Cros, J., Marechal, R., Bachet, J. B., Flejou, J. F., & Demetter, P. (2015). Human equilibrative nucleoside transporter 1 testing in pancreatic ductal adenocarcinoma: a comparison between murine and rabbit antibodies. Histopathology, 66(3), 457-462. doi:10.1111/his.12577
- Tabernero, J., Chiorean, E. G., Infante, J. R., Hingorani, S. R., Ganju, V., Weekes, C., . . . Von Hoff, D. D. (2015). Prognostic factors of survival in a randomized phase III trial (MPACT) of weekly nab-paclitaxel plus gemcitabine versus gemcitabine alone in patients with metastatic pancreatic cancer. Oncologist, 20(2), 143-150. doi:10.1634/theoncologist.2014-0394
- Taieb J, Prager GW, Melisi D, Westphalen CB, D'Esquermes N, Ferreras A, Carrato A, Macarulla T. (2020). First-line and second-line treatment of patients with metastatic pancreatic adenocarcinoma in routine clinical practice across Europe: a retrospective, observational chart review study. ESMO Open;5(1):e000587. doi: 10.1136/esmoopen-2019-000587.
- Takahashi, H., Ohigashi, H., Ishikawa, O., Eguchi, H., Gotoh, K., Yamada, T., . . . Yano, M. (2010). Serum CA19-9 alterations during preoperative gemcitabine-based chemoradiation therapy for resectable invasive ductal carcinoma of the pancreas as an indicator for therapeutic selection and survival. Ann Surg, 251(3), 461-469. doi:10.1097/SLA.0b013e3181cc90a3
- Tamm, E. P., Balachandran, A., Bhosale, P. R., Katz, M. H., Fleming, J. B., Lee, J. H., & Varadhachary, G. R. (2012). Imaging of pancreatic adenocarcinoma: update on staging/resectability. Radiol Clin North Am, 50(3), 407-428. doi:10.1016/j.rcl.2012.03.008
- Tang, S., Huang, G., Liu, J., Liu, T., Treven, L., Song, S., . . . Zhang, T. (2011). Usefulness of 18F-FDG PET, combined FDG-PET/CT and EUS in diagnosing primary pancreatic carcinoma: a meta-analysis. Eur J Radiol, 78(1), 142-150. doi:10.1016/j.ejrad.2009.09.026
- Tempero, M. A., Malafa, M. P., Al-Hawary, M., Asbun, H., Bain, A., Behrman, S. W., . . . Darlow, S. (2017). Pancreatic Adenocarcinoma, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw, 15(8), 1028-1061. doi:10.6004/jnccn.2017.0131
- Tempero, M. A., Malafa, M. P., Behrman, S. W., Benson, A. B., 3rd, Casper, E. S., Chiorean, E. G., . . . Freedman-Cass, D. A. (2014). Pancreatic adenocarcinoma, version 2.2014: featured updates to the NCCN guidelines. J Natl Compr Canc Netw, 12(8), 1083-1093.
- Teoh AYB, Lakhtakia S, Tarantino I, Perez-Miranda M, Kunda R, Maluf-Filho F, Dhir V, Basha J, Chan SM, Ligresti D, Ma MTW, de la Serna-Higuera C, Yip HC, Ng EKW, Chiu PWY, Itoi T. Endoscopic ultrasonography-guided gastroenterostomy versus uncovered duodenal metal stenting for unresectable malignant gastric outlet obstruction (DRA-GOO): a multicentre randomised controlled trial. Lancet Gastroenterol Hepatol. 2024 Feb;9(2):124-132.
- Tjaden, C., Michalski, C. W., Strobel, O., Giese, N., Hennche, A. K., Buchler, M. W., & Hackert, T. (2016). Clinical Impact of Structured Follow-up After Pancreatic Surgery. Pancreas, 45(6), 895-899. doi:10.1097/MPA.0000000000000564
- Tol, J. A., Gouma, D. J., Bassi, C., Dervenis, C., Montorsi, M., Adham, M., . . . International Study Group on Pancreatic, S. (2014). Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma: a consensus statement by the International Study Group on Pancreatic Surgery (ISGPS). Surgery, 156(3), 591-600. doi:10.1016/j.surg.2014.06.016
- Tol, J. A., van Hooft, J. E., Timmer, R., Kubben, F. J., van der Harst, E., de Hingh, I. H., . . . Gouma, D. J. (2016). Metal or plastic stents for preoperative biliary drainage in resectable pancreatic cancer. Gut, 65(12), 1981-1987. doi:10.1136/gutjnl-2014-308762
- Tran Cao, H. S., Lopez, N., Chang, D. C., Lowy, A. M., Bouvet, M., Baumgartner, J. M., . . . Sicklick, J. K. (2014). Improved perioperative outcomes with minimally invasive distal pancreatectomy: results from a population-based analysis. JAMA Surg, 149(3), 237-243. doi:10.1001/jamasurg.2013.3202
- Turpin A, Neuzillet C, Colle E, Dusetti N, Nicolle R, Cros J, de Mestier L, Bachet JB, Hammel P. Therapeutic advances in metastatic pancreatic cancer: a focus on targeted therapies. Ther Adv Med Oncol 2022; 6;14:17588359221118019
- Turrini, O., Paye, F., Bachellier, P., Sauvanet, A., Sa Cunha, A., Le Treut, Y. P., . . . French Surgical, A. (2013). Pancreatectomy for adenocarcinoma in elderly patients: postoperative outcomes and long term results: a study of the French Surgical Association. Eur J Surg Oncol, 39(2), 171-178. doi:10.1016/j.ejso.2012.08.017
- Turrini, O., Wiebke, E. A., Delpero, J. R., Viret, F., Lillemoe, K. D., & Schmidt, C. M. (2010). Preservation of replaced or accessory right hepatic artery during pancreaticoduodenectomy for adenocarcinoma: impact on margin status and survival. J Gastrointest Surg, 14(11), 1813-1819. doi:10.1007/s11605-010-1272-1
- Tzeng, C. W., Fleming, J. B., Lee, J. E., Wang, X., Pisters, P. W., Vauthey, J. N., . . . Katz, M. H. (2012). Yield of clinical and radiographic surveillance in patients with resected pancreatic adenocarcinoma following multimodal therapy. HPB (Oxford), 14(6), 365-372. doi:10.1111/j.1477-2574.2012.00445.x
- Uesaka, K., Boku, N., Fukutomi, A., Okamura, Y., Konishi, M., Matsumoto, I., . . . Group, J. S. (2016). Adjuvant chemotherapy of S-1 versus gemcitabine for resected pancreatic cancer: a phase 3, open-label, randomised, non-inferiority trial (JASPAC 01). Lancet, 388(10041), 248-257. doi:10.1016/S0140-6736(16)30583-9
- Uson Junior, P. L. S., Dias E Silva, D., de Castro, N.M., et al. (2023). Does neoadjuvant treatment in resectable pancreatic cancer improve overall survival? A systematic review and meta-analysis of randomized controlled trials. ESMO Open, 8(1):100771. doi: 10.1016/j.esmoop.2022.100771
- Valle, J. W., Palmer, D., Jackson, R., Cox, T., Neoptolemos, J. P., Ghaneh, P., . . . Buchler, M. W. (2014). Optimal duration and timing of adjuvant chemotherapy after definitive surgery for ductal adenocarcinoma of the pancreas: ongoing lessons from the ESPAC-3 study. J Clin Oncol, 32(6), 504-512. doi:10.1200/JCO.2013.50.7657
- Valverde, C. P. T., Ebrahimi, G., Sprangers, M. A., et al. (2024). Impact of Short-Course Palliative Radiation Therapy on Pancreatic Cancer-Related Pain: Prospective Phase 2 Nonrandomized PAINPANC Trial. Int J Radiat Oncol Biol Phys, 118(2):352-361. doi: 10.1016/j.ijrobp.2023.08.055
- Van Cutsem, E., van de Velde, H., Karasek, P., Oettle, H., Vervenne, W. L., Szawlowski, A., . . . Von Hoff, D. (2004). Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer. J Clin Oncol, 22(8), 1430-1438. doi:10.1200/JCO.2004.10.112
- Van Cutsem, E., Vervenne, W. L., Bennouna, J., Humblet, Y., Gill, S., Van Laethem, J. L., . . . Moore, M. J. (2009). Phase III trial of bevacizumab in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer. J Clin Oncol, 27(13), 2231-2237. doi:10.1200/JCO.2008.20.0238
- Van Cutsem E, Tempero MA, Sigal D, Oh DY, Fazio N, Macarulla T, Hitre E, Hammel P, Hendifar AE, Bates SE, Li CP, Hingorani SR, de la Fouchardiere C, Kasi A, Heinemann V, Maraveyas A, Bahary N, Layos L, Sahai V, Zheng L, Lacy J, Park JO, Portales F, Oberstein P, Wu W, Chondros D, Bullock AJ; HALO 109-301 Investigators. (2020). Randomized Phase III Trial of Pegvorhyaluronidase Alfa With Nab-Paclitaxel Plus Gemcitabine for Patients With Hyaluronan-High Metastatic Pancreatic Adenocarcinoma. J Clin Oncol;38(27):3185-3194. doi: 10.1200/JCO.20.00590.
- van der Gaag, N. A., Rauws, E. A., van Eijck, C. H., Bruno, M. J., van der Harst, E., Kubben, F. J., . . . Gouma, D. J. (2010). Preoperative biliary drainage for cancer of the head of the pancreas. N Engl J Med, 362(2), 129-137. doi:10.1056/NEJMoa0903230
- van Hilst, J., de Rooij, T., Bosscha, K., Bet al.; Dutch Pancreatic Cancer Group (2019). Laparoscopic versus open pancreatoduodenectomy for pancreatic or periampullary tumours (LEOPARD-2): a multicentre, patient-blinded, randomised controlled phase 2/3 trial. Lancet Gastroenterol Hepatol, 4(3):199-207. doi: 10.1016/S2468-1253(19)30004-
- Vanella G, Bronswijk M, van Wanrooij RL, Dell'Anna G, Laleman W, van Malenstein H, Voermans RP, Fockens P, Van derMerwe S, Arcidiacono PG (2022). Combined endoscopic mAnagement of BiliaRy and gastrIc OutLET obstruction (CABRIOLET Study): A multicenter retrospective analysis. DEN Open. Jun 14;3(1):e132. doi: 10.1002/deo2.132. PMID: 35898844; PMCID: PMC9307724.
- Van Laethem, J. L., Hammel, P., Mornex, F., Azria, D., Van Tienhoven, G., Vergauwe, P., . . . Haustermans, K. (2010). Adjuvant gemcitabine alone versus gemcitabine-based chemoradiotherapy after curative resection for pancreatic cancer: a randomized EORTC-40013-22012/FFCD-9203/GERCOR phase II study. J Clin Oncol, 28(29), 4450-4456. doi:10.1200/JCO.2010.30.3446
- Van Laethem, J. L., Riess, H., Jassem, J., Haas, M., Martens, U. M., Weekes, C., . . . Childs, B. H. (2017). Phase I/II Study of Refametinib (BAY 86-9766) in Combination with Gemcitabine in Advanced Pancreatic cancer. Target Oncol, 12(1), 97-109. doi:10.1007/s11523-016-0469-y
- Verbeke, C., Lohr, M., Karlsson, J. S., & Del Chiaro, M. (2015). Pathology reporting of pancreatic cancer following neoadjuvant therapy: challenges and uncertainties. Cancer Treat Rev, 41(1), 17-26. doi:10.1016/j.ctrv.2014.11.002
- Vernerey, D., Hammel, P., Paget-Bailly, S., Huguet, F., Van Laethem, J. L., Goldstein, D., . . . Bonnetain, F. (2015). Prognosis model for overall survival in locally advanced unresecable pancreatic carcinoma: An ancillary study of the LAP 07 trial. J Clin Oncol, 33(3 suppl), abstr #235.
- Vernerey, D., Huguet, F., Vienot, A., Goldstein, D., Paget-Bailly, S., Van Laethem, J. L., . . . Bonnetain, F. (2016). Prognostic nomogram and score to predict overall survival in locally advanced untreated pancreatic cancer (PROLAP). Br J Cancer, 115(3), 281-289. doi:10.1038/bjc.2016.212Versteijne E, Suker M, Groothuis K, Akkermans-Vogelaar JM, Besselink MG, Bonsing BA, Buijsen J, Busch OR, Creemers GM, van Dam RM, Eskens FALM, Festen S, de Groot JWB, Groot Koerkamp B, de Hingh IH, Homs MYV, van Hooft JE, Kerver ED, Luelmo SAC, Neelis KJ, Nuyttens J, Paardekooper GMRM, Patijn GA, van der Sangen MJC, de Vos-Geelen J, Wilmink JW, Zwinderman AH, Punt CJ, van Eijck CH, van Tienhoven G; Dutch Pancreatic Cancer Group. (2020). Preoperative Chemoradiotherapy Versus Immediate Surgery for Resectable and Borderline Resectable Pancreatic Cancer: Results of the Dutch Randomized Phase III PREOPANC Trial. J Clin Oncol ;38(16):1763-1773. doi: 10.1200/JCO.19.02274.
- Vogelstein, B., Fearon, E. R., Hamilton, S. R., Kern, S. E., Preisinger, A. C., Leppert, M., . . . Bos, J. L. (1988). Genetic alterations during colorectal-tumor development. N Engl J Med, 319(9), 525-532. doi:10.1056/NEJM198809013190901
- Von Hoff, D. D., Ervin, T., Arena, F. P., Chiorean, E. G., Infante, J., Moore, M., . . . Renschler, M. F. (2013). Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med, 369(18), 1691-1703. doi:10.1056/NEJMoa1304369
- Waddell, N., Pajic, M., Patch, A. M., Chang, D. K., Kassahn, K. S., Bailey, P., . . . Grimmond, S. M. (2015). Whole genomes redefine the mutational landscape of pancreatic cancer. Nature, 518(7540), 495-501. doi:10.1038/nature14169
- Wagner, M., Antunes, C., Pietrasz, D., Cassinotto, C., Zappa, M., Sa Cunha, A., . . . Bachet, J. B. (2017). CT evaluation after neoadjuvant FOLFIRINOX chemotherapy for borderline and locally advanced pancreatic adenocarcinoma. Eur Radiol, 27(7), 3104-3116. doi:10.1007/s00330-016-4632-8
- Wainberg, Z. A., Melisi, D., Macarulla, T., et al. (2023). NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. Lancet, 402(10409):1272-1281. doi: 10.1016/S0140-6736(23)01366-1
- Walker, E. J., & Ko, A. H. (2014). Beyond first-line chemotherapy for advanced pancreatic cancer: an expanding array of therapeutic options? World J Gastroenterol, 20(9), 2224-2236. doi:10.3748/wjg.v20.i9.2224
- Wang, Z., Chen, J. Q., Liu, J. L., Qin, X. G., & Huang, Y. (2013). FDG-PET in diagnosis, staging and prognosis of pancreatic carcinoma: a meta-analysis. World J Gastroenterol, 19(29), 4808-4817. doi:10.3748/wjg.v19.i29.4808
- Wang-Gillam, A., Li, C. P., Bodoky, G., Dean, A., Shan, Y. S., Jameson, G., . . . Group, N.-S. (2016). Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. Lancet, 387(10018), 545-557. doi:10.1016/S0140-6736(15)00986-1
- Washington, K., Berlin, J., Branton, P., Burgart, L. J., Carter, D. K., Fitzgibbons, P., . . . Compton, C. C. (2014). Protocol for the Examination of Specimens From Patients With Carcinoma of the Exocrine Pancreas College of American Pathologists, http://www.cap.org.
- Weilert, F., Bhat, Y. M., Binmoeller, K. F., Kane, S., Jaffee, I. M., Shaw, R. E., . . . Shah, J. N. (2014). EUS-FNA is superior to ERCP-based tissue sampling in suspected malignant biliary obstruction: results of a prospective, single-blind, comparative study. Gastrointest Endosc, 80(1), 97-104. doi:10.1016/j.gie.2013.12.031
- Xie, D. R., Yang, Q., Chen, D. L., Jiang, Z. M., Bi, Z. F., Ma, W., & Zhang, Y. D. (2010). Gemcitabine-based cytotoxic doublets chemotherapy for advanced pancreatic cancer: updated subgroup meta-analyses of overall survival. Jpn J Clin Oncol, 40(5), 432-441. doi:10.1093/jjco/hyp198
- Yoo, C., Hwang, J. Y., Kim, J. E., Kim, T. W., Lee, J. S., Park, D. H., . . . Lee, J. L. (2009). A randomised phase II study of modified FOLFIRI.3 vs modified FOLFOX as second-line therapy in patients with gemcitabine-refractory advanced pancreatic cancer. Br J Cancer, 101(10), 1658-1663. doi:10.1038/sj.bjc.6605374
- Yoon SB, Moon SH, Kim JH, Song TJ, Kim MH. (2020) .The use of immunohistochemistry for IgG4 in the diagnosis of autoimmune pancreatitis: A systematic review and meta-analysis. Pancreatology, (8):1611-1619. doi: 10.1016/j.pan.2020.10.028. Epub 2020 Oct 10.
- Yuan, C., Rubinson, D. A., Qian, Z. R., Wu, C., Kraft, P., Bao, Y., . . . Wolpin, B. M. (2015). Survival among patients with pancreatic cancer and long-standing or recent-onset diabetes mellitus. J Clin Oncol, 33(1), 29-35. doi:10.1200/JCO.2014.57.5688
- Zaanan, A., Trouilloud, I., Markoutsaki, T., Gauthier, M., Dupont-Gossart, A. C., Lecomte, T., . . . Taïeb, J. (2014). FOLFOX as second-line chemotherapy in patients with pretreated metastatic pancreatic cancer from the FIRGEM study. BMC Cancer, 14, 441. doi:10.1186/1471-2407-14-44

