5. Cancer du rectum
(Dernière mise à jour le : )Principaux changements de la mise à jour du 05/01/2025
5.4.2.1., 5.4.2.2., 5.4.2.3., 5.4.2.4 et 5.7.3. actualisation des essais cliniques :
- ouverture de
PRODIGE 90 – PREDIR-NEOREC : phase II dostarlimab néoadjuvant seul versus associé à radiothérapie courte si localement avancé MSI/dMMR.
PRODIGE 101-GRECCAR 20-EVAREC : phase III surveillance de réponse tumorale avec prise de décision partagée versus évaluation standard dans stratégies de préservation d’organe - fermeture de GRECCAR 17
Groupe de travail et relecteurs
avec le GRECCAR, Groupe de Recherche Chirurgicale sur le Cancer du Rectum
Groupe de travail :
E. Cotte (Lyon), coordonnateur,
P. Artru (Lyon), J.B. Bachet (Paris), L. Benhaim (Villejuif), F. Bibeau (Caen), N. Christou (Limoges), T. Conroy (Nancy), J. Doyen (Nice) J. Fabre (Cestas), F. Huguet (Paris), C. Hoeffel (Reims), D. Léonard (Saumur), N. Meillan (Paris), X. Mirabel (Lille), M. Pioche (Lyon), E. Rivin Del Campo (Paris), V. Vendrely (Bordeaux).
Relecteurs :
T. Aparicio (Paris), A. Dabrowski (Blendecques), F. Darloy (Douai), O. Bouché (Reims), M. Ducreux (Villejuif), A. Dupré (Lyon), F. El Hajbi (Lille), S Gaujoux (Paris), JP. Gérard (Nice), B Guiu (Montpellier), G. Lebreton (Caen), T. Lecomte (Tours), C. Lepage (Dijon), L. Maggiori (Paris), P. Mariani (Paris).
Comment citer ce chapitre du TNCD ?
Cotte E, Arquilliere J, Artru P, Bachet JB, Benhaim L, Bibeau F, Christou N, Conroy T, Doyen J, Hoeffel C, Meillan N, Mirabel X, Pioche M, Rivin Del Campo E, Vendrely V, Huguet F, Bouché O. Rectal cancer - French intergroup clinical practice guidelines for diagnosis, treatment, and follow-up (TNCD, SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, SFP, RENAPE, SNFCP, AFEF, SFR, and GRECCAR). Dig Liver Dis. 2024 Dec 17:S1590-8658(24)01117-4. doi: 10.1016/j.dld.2024.12.004. Epub ahead of print. PMID: 39694751.
5.1. Introduction
Ce texte est consacré aux adénocarcinomes du rectum, cancers primitifs du rectum de loin les plus fréquents. Les tumeurs endocrines et les lymphomes digestifs sont l’objet d’autres chapitres de ce thésaurus. L'incidence des cancers du rectum est voisine de 15 000 nouveaux cas par an en France, peut-être moins si l’on considère que certains cancers du sigmoïde (ou jonction recto-sigmoïdienne) sont enregistrés parfois comme des cancers du (haut) rectum.
Tous stades confondus, la probabilité de survie à 5 ans est d’environ 55 % (Bouvier, 2015). Ce cancer expose non seulement à une diffusion métastatique (hépatique et pulmonaire surtout), mais aussi à des récidives locales très pénibles et généralement non résécables (devenues rares avec les traitements actuels). Son traitement repose sur la résection chirurgicale avec en particulier exérèse totale du mésorectum, souvent associée à une chimioradiothérapie (CRT) préopératoire.
Cette stratégie a permis de réduire le taux de récidive locale à moins de 5% dans les centres experts au prix d’une morbidité périopératoire évaluée à 20-30 % et de séquelles fonctionnelles digestives, urologiques et sexuelles. La décision de la stratégie thérapeutique adaptée à chaque patient nécessite un bilan préthérapeutique spécialisé, un examen clinique par un chirurgien avant tout traitement, puis une discussion en réunion de concertation pluridisciplinaire (RCP) associant gastroentérologues, chirurgiens, radiothérapeutes, chimiothérapeutes, radiologues et anatomopathologistes. L’exérèse endoscopique occupe une place grandissante dans la prise en charge des cancers superficiels du rectum. La qualité de l'exérèse chirurgicale ou endoscopique, de l'anatomo-pathologie, de l’IRM et la qualité de la radiothérapie sont des facteurs primordiaux de la réussite thérapeutique, sur le plan vital et sur le plan fonctionnel.
5.2. Classifications
5.2.1. Classification anatomique
Les examens les plus fiables pour différencier les différents étages du rectum sont le toucher rectal, la rectoscopie rigide (l’utilisation d’un endoscope souple expose à de nombreuses erreurs en pratique), l’échographie endo-rectale et l’IRM. L’examen TDM est moins performant que l’IRM pour visualiser la tumeur. Les distances sont étalonnées par rapport à la marge anale, mesure la plus reproductible, ou par rapport au bord supérieur du sphincter ; cette mesure est importante pour évaluer les possibilités de conservation sphinctérienne, la longueur du canal anal étant variable d’un individu à l’autre (2 à 4 cm). Le siège de la tumeur est défini à partir de son pôle inférieur :
- bas rectum : 0 à 5 cm de la marge anale ou à 2 cm ou moins du bord supérieur du sphincter ;
- moyen rectum : > 5 à 10 cm de la marge anale ou de > 2 à 7 cm du bord supérieur du sphincter ;
- haut rectum : > 10 à 15 cm de la marge anale ou à plus de 7 cm du bord supérieur du sphincter ;
- jonction rectum-sigmoïde > 15 cm ou au-dessus du corps de la 3ème vertèbre sacrée.
5.2.2. Classification anatomo-pathologique
La classification actuellement en vigueur est celle de l’UICC (TNM 8éme édition 2017).
Les ganglions régionaux du rectum sont:
- ganglions rectaux (hémorroïdal) supérieurs – moyens et inférieurs (situés dans la graisse du mésorectum) ou ganglions du mésorectum (synonyme de ganglion rectal)
- ganglions iliaques internes (hypogastrique) (qui sont en continuité avec les ganglions de l’artère rectale moyenne)
- ganglions sacrés latéraux - présacrés et promontoire sacré (Gerota);
- ganglions mésentériques inférieurs (en fait très à distance du rectum et jamais inclus dans les champs d’irradiation mais toujours enlevés lors du curage chirurgical et ayant une forte valeur pronostique). Certains référentiels de RCMI peuvent proposer leur inclusion dans le PTV.
- ganglions inguinaux en cas d’atteinte du canal anal
- les métastases ganglionnaires autres que celles listées ci-dessus sont classées comme métastases à distance (ganglions obturateurs ou iliaques externes). Le curage iliaque externe et interne (hypogastrique) systématique n’est pas recommandé car il augmente les séquelles et n’améliore pas la survie après traitement néo-adjuvant (Nagawa, 2001).
- TX Renseignements insuffisants pour classer la tumeur primitive
- T0 Pas de signe de tumeur primitive
- Tis Carcinome in situ : intra-épithélial ou envahissant la lamina propria
- T1 Tumeur envahissant la sous-muqueuse
- T2 Tumeur envahissant la musculeuse
- T3 Tumeur envahissant la sous-séreuse ou les tissus péri-rectaux non péritonisés
- T4 Tumeur envahissant directement les autres organes ou structures et/ou perforant le péritoine viscéral
- T4a Tumeur perforant le péritoine viscéral
- T4b Tumeur envahissant directement les autres organes ou structures2-3
Notes. (Nagtegaal I., 2011)
- 1 Tis inclut les cas de cellules cancéreuses localisées dans la lamina propria (intra-muqueuses) sans extension à travers la musculaire muqueuse à la sous-muqueuse.
- 2 L’invasion directe d’un stade T4b comprend l’invasion des autres segments du côlon ou du rectum par la voie de la séreuse, prouvée par l’examen microscopique ou comprend, pour les tumeurs survenant sur une localisation rétro ou sous-péritonéale, l’extension directe à des autres organes ou structures du fait de l’extension au-delà du mésorectum et du fascia recti.
- 3Une tumeur qui est adhérente macroscopiquement à d’autres organes ou structures est classée cT4b. Toutefois, si microscopiquement aucune tumeur n'est présente dans la zone d'adhésion à l'examen microscopique elle sera classée pT1-3, en fonction de la profondeur de l'invasion pariétale.
- NX Renseignements insuffisants pour classer les adénopathies régionales
- N0 Pas de métastase ganglionnaire régionale
- N1 Métastase dans 1 à 3 ganglions lymphatiques régionaux
- N1a Métastases dans 1 ganglion lymphatique régional
- N1b Métastases dans 2-3 ganglions lymphatiques régionaux
- N1c Nodule(s) tumoral, satellite(s)* dans la sous-séreuse, ou dans les tissus non-péritonisés péri-coliques ou péri-rectaux sans métastase ganglionnaire régionale
- N2 Métastase dans ≥ 4 ganglions lymphatiques régionaux
- N2a Métastase dans 4-6 ganglions lymphatiques régionaux
- N2b Métastase dans ≥ 7 ganglions lymphatiques régionaux
Notes :
* Les nodules tumoraux (satellites), macroscopiques ou microscopiques, situés dans le tissu adipeux péri-colique ou péri-rectal de la zone de drainage lymphatique de la tumeur primitive sans signe histologique de ganglion lymphatique résiduel ou de structure vasculaire ou nerveuse identifiable. Si une paroi vasculaire est identifiable par les colorations de routine H et HE, fibres élastiques ou autres, le nodule sera classé comme une invasion veineuse (V1/V2) ou lymphatique (L1). Si des structures nerveuses sont identifiables, le nodule sera classé comme une invasion péri-neurale (Pn1). La présence d’un nodule ne modifie pas la catégorie T, mais change le statut (N) en pN1c si tous les ganglions régionaux sont indemnes à l’examen anatomopathologique
- M0 : pas de métastase
- M1 : présence de métastase(s) à distance
- M1a Métastase(s) localisée(s) à un seul organe (foie, poumon, ovaire, ganglion(s) lymphatique(s) autre que régional) sans métastase péritonéale
- M1b Métastases dans plusieurs organes
- M1c Métastases péritonéales avec ou sans métastases dans les d’autres organes
L’examen d’au moins 12 ganglions régionaux est nécessaire à l’évaluation correcte du statut ganglionnaire. Si ce nombre n’est pas atteint, une deuxième recherche de ganglions dans le tissu adipeux péri-rectal peut être effectuée. Même si le nombre de 12 ganglions habituellement examinés n’est pas atteint, la lésion sera classée N0 et non Nx. Le nombre de ganglions est souvent diminué après traitement néoadjuvant. Par conséquent le nombre de 12 ganglions habituellement requis peut parfois ne pas être atteint malgré une recherche minutieuse.
En cas de traitement préopératoire, le stade TNM sur la pièce opératoire sera exprimé en ypTNM.
| Stade 0 | Tis | N0 | M0 |
| Stade I | T1, T2 | N0 | M0 |
| Stade II | T3, T4 | N0 | M0 |
| Stade IIA | T3 | N0 | M0 |
| Stade IIB | T4a | N0 | M0 |
| Stade IIC | T4b | N0 | M0 |
| Stade III | tous T | N1, N2 | M0 |
| Stade IIIA | T1, T2 T1 | N1 N2a | M0 |
| Stade IIIB | N1 N2a N2b | T3, T4a T2, T3 T1, T2 | M0 |
| Stade IIIC | T4a T3, T4a T4b | N2a N2b N1,N2 | M0 |
| Stade IVA | tous T | tous N | M1a |
| Stade IVB | tous T | tous N | M1b |
| Stade IVC | tous T | tous N | M1c |
L’examen anatomo-pathologique doit préciser l'état de la marge distale et de la marge circonférentielle (clairance), ainsi que le degré d’intégrité macroscopique du mésorectum selon la classification (grade) de Quirke (Quirke, 2009) : mésorectum complet, presque complet, incomplet. Une marge circonférentielle < 1 mm est considérée comme R1.
5.2.3. Réponse histologique au traitement néoadjuvant
l est nécessaire de préciser le degré de réponse histologique en plus de la marge circonférentielle et du stade ypTNM.
La régression tumorale correspond à la destruction des cellules tumorales par le traitement néoadjuvant ou d’induction. Elle est différente de l’évaluation du stade ypTNM et s’évalue de façon semi-quantitative en appréciant le pourcentage de cellules viables et le pourcentage de territoires fibreux ou colloïdes résultant de la destruction de la tumeur. Elle s’appuie sur différentes classifications ou grades de reproductibilité variable, dont la plus ancienne est celle de Dworak (Dworak, 1997) et celle de Ryan modifiée est proposée par l’AJCC. Ces classifications comportent 3 à 5 grades et vont des réponses complètes à l’absence de réponse. Elles fournissent un bon témoin de radiosensibilité et de chimiosensibilité de la tumeur. Il est recommandé de prélever au minimum 5 blocs au site tumoral et pour les tumeurs mesurant moins de 3 cm, ou en cas d’absence de tumeur résiduelle, d’inclure la totalité de la lésion ou de la cicatrice. Une réponse histologique complète sur la tumeur primitive sera définie par l’absence de cellules tumorales viables.
Grade de Dworak
Dworak 0 : Absence de signe de régression
Dworak 1 : Tumeur majoritaire avec fibrose et/ou mucine
Dworak 2 : Fibrose ou mucine majoritaire, quelques cellules ou structures tumorales
Dworak 3 : Très rares cellules tumorales avec fibrose et/ou mucine majoritaire
Dworak 4 : Réponse complète : absence de cellules tumorales, fibrose et/ou mucine uniquement
Selon le score de régression modifié de Ryan, AJCC 2017 8ème édition
TRG0, réponse complète, absence de cellules carcinomateuses viables
TRG1, réponse presque complète, présence de cellules isolées ou de rares amas tumoraux
TRG2, réponse partielle, cancer résiduel avec des signes évidents d’une régression tumorale
TRG3, peu ou pas de réponse, cancer résiduel sans signes évidents de régression
5.3. Explorations pré-thérapeutiques
RÉFÉRENCES
- Il faut, par l’interrogatoire, chercher des antécédents familiaux pouvant évoquer un syndrome de Lynch (Bibeau, 2011), non seulement les antécédents familiaux de cancer colorectal, mais aussi les cancers associés du spectre, particulièrement les cancers de l’endomètre, de l’ovaire, du duodénum, du grêle ou des voies urinaires excrétrices. Une consultation d’oncogénétique devra être proposée si test MSI+ associé à l’absence de mutation BRAF ou patient < 40 ans (quel que soit le statut MSI), ou famille avec 3 cas de cancer colorectal dont 1 avant 50 ans (quel que soit le statut MSI).
- Un avis oncogériatrique doit être demandé chez les patients de plus de 75 ans avec score G8≤14.
- Une consultation pour préservation de la fertilité chez la femme et l’homme doit être proposée à tout(e) patient(e) en âge de procréer.
- Avis cardiologique avant chirurgie et avant chimiothérapie par capécitabine ou 5-fluorouracile, en particulier si âge de plus de 60 ans, en particulier si facteurs de risque tels que diabète, obésité, tabagisme, artérite etc.
- Le toucher rectal (TR) est le temps primordial de l’examen clinique. Il est réalisé si possible sur un rectum vide, en décubitus dorsal, cuisses fléchies ou en décubitus latéral gauche ou en position genu-pectorale. Il évalue la distance de la tumeur par rapport à la marge anale et à la sangle pubo-rectale (pôle supérieur du canal anal), la taille de la tumeur mesurée en cm ; si possible on mesure les 2 plus grands diamètres, l’aspect macroscopique polypoïde sessile, parfois pédiculé, ulcéré, ulcéro-bourgeonnant ou purement infiltrant. Le TR apprécie la mobilité de la tumeur par rapport aux plans pariétaux profonds, une fixation pariétale (parois pelviennes ou organes pelviens antérieurs) évoquant un risque de résection R2, l’extension circonférentielle, les tumeurs circonférentielles ayant un pronostic plus défavorable, la consistance de la tumeur molle, ferme ou indurée. Le TR peut également détecter l’existence de nodules indurés secondaires dans le mésorectum classés cN1. Il est enfin un examen clé pour apprécier la réponse clinique et notamment une réponse clinique complète.
- Le poids et la taille sont renseignés ainsi que l’état général OMS.
Les examens complémentaires indispensables sont la coloscopie, l’IRM rectale et le TDM TAP :
- La coloscopie sous anesthésie générale est dans l’immense majorité des cas le 1er examen réalisé pour le diagnostic étiologique de rectorragies.
- Elle peut être complétée, éventuellement pendant le même temps anesthésique, par une rectoscopie rigide permettant d’éviter les erreurs dans la mesure de la distance du pôle inférieur de la tumeur à la marge anale.
- Pour les tumeurs d’allure superficielle, une analyse endoscopique fine avec chromoendoscopie classique (à l’indigo carmin) ou virtuelle (par exemple : système NBI, BLI, IScan, EO.) est désormais incontournable pour prédire l’histologie et le degré d’invasion tumorale (Recommandation ESGE 2017, Ferlitsch) en utilisant les classifications validées : JNET et CONECCT (Iwatate, 2018 ; Fabritius, 2019 ; Bonniaud, 2022).
- Dans tous les cas, une coloscopie complète doit être pratiquée pour dépister les localisations métachrones de cancer ou de lésions néoplasiques superficielles.
- Pour les lésions non résécables endoscopiquement uniquement (JNET 3, CONECCT 3), des biopsies seront faites en nombre suffisant (au moins 6) afin de disposer, pour la suite de l’évolution, de tissu non nécrotique accessible pour les études de biologie moléculaire (cf. infra).
- La coloscopie est à refaire dans les 6 mois après l’intervention si elle a été incomplète en préopératoire.
- L’IRM pelvienne doit être systématique sauf contre-indication. L’IRM conditionne le choix du traitement néoadjuvant. Elle est basée essentiellement sur une imagerie pondérée en T2, des coupes dans les 3 plans de l’espace et notamment des coupes axiales perpendiculaires à l’axe de la tumeur et dans l’axe du canal anal en cas de tumeur du bas rectum. Les séquences de diffusion sont indispensables lors du bilan de réévaluation tumorale post chimioradiothérapie néoadjuvante. Par contre, cet examen surestime considérablement l’invasion profonde des tumeurs superficielles T1 et ne doit pas entrer en compte dans la prédiction de l’invasion pariétale lorsque l’échoendoscopie prédit une lésion superficielle.
Le compte rendu de l’IRM doit comporter au moins les éléments suivants :
- La localisation du pôle inférieur de la tumeur par rapport à la marge anale, au bord supérieur du sphincter interne, du bord supérieur du muscle puborectal et à la ligne de réflexion péritonéale.
- La dimension de la tumeur et sa position dans le pelvis par rapport aux pièces sacrées et aux organes de voisinage.
- Le staging T et N
- Pour les tumeurs T3, l’extension extramurale en mm permettant la classification mrT3a/b/c/d :
- T3a-b : graisse du mésorectum infiltrée sur 5 mm ou moins
- T3c-d : localement avancée infiltrant la graisse sur plus de 5 mm ou avec extension au contact du fascia recti.
- La marge circonférentielle : distance la plus courte en mm du bord externe de la tumeur ou d’une adénopathie/nodule tumoral/embol vasculaire extramural et le fascia recti.
- L’extension ou non au fascia recti
- Pour les tumeurs haut situées, l’envahissement de la ligne de réflexion péritonéale par la tumeur
- La présence ou absence d'invasion vasculaire extra-murale, un important facteur pronostique (Chand, 2015)
- Rapport entre la tumeur et les muscles releveurs de l’anus, le muscle puborectal et les sphincters externe/interne pour les tumeurs basses pour lesquelles une résection intersphinctérienne est envisageable. La hauteur de l’envahissement potentiel du sphincter interne est également à préciser dans le cadre d’une possibilité de résection intersphinctérienne.
- La présence d’adénopathies extramésorectales, en particulier adénopathies latérales.
Sa fiabilité est en revanche imparfaite pour déterminer les envahissements ganglionnaires pelviens (Patel, 2011).
Après traitement néo-adjuvant, elle permet d’évaluer la réponse tumorale, avec une corrélation encore imparfaite avec la réponse histologique (Patel, 2011 ; Nougaret, 2013).
L’examen avec séquence de diffusion est en faveur d’une poursuite évolutive s’il montre la persistance d’une restriction de diffusion (Beets Tan, 2015). La disparition d’une adénopathie ayant fait classer initialement N1 la tumeur serait en faveur d’une « tumeur en réalité N0 ».
L’examen clinique par toucher rectal et rectoscopie est l’examen le plus précis pour identifier une réponse clinique complète. L’IRM avec séquence de diffusion permet de renforcer ce diagnostic de réponse clinique complète (Maas, 2015).
En pratique aucun examen d’imagerie n’est fiable pour détecter les adénopathies périrectales métastatiques, avec une concordance radio-histologique d’au mieux 60 %. (Roman, 2004 ; Hermanek, 2010 ; Patel, 2011). Les ganglions lymphatiques régionaux avec un diamètre dont le plus petit diamètre est de plus de 9 mm et ceux de plus petit diamètre de 5 à 9 mm et répondant à au moins deux critères morphologiques (bordures irrégulières, intensité du signal hétérogène ou forme ronde) en IRM sont habituellement considérés comme métastatiques (Horvat, 2019).
- Le bilan à distance comporte la recherche des métastases hépatiques et pulmonaires par une TDM thoracoabdominale avec injection de produit de contraste ou, en cas d’insuffisance rénale, par TDM thoracique sans injection associé à une IRM hépatique.
- Recherche d’un déficit en DPD par phénotypage (dosage de l'uracilémie) avec ajustement des doses de 5FU et capécitabine en cas de déficit partiel et contre-indication du 5FU et de la capécitabine en cas de déficit complet si un traitement à base de 5-FU est indiqué (accord d’experts).
- Ce bilan minimum associant IRM rectale et TDM TAP doit être renouvelé après le traitement néoadjuvant et avant la chirurgie (au plus près de la chirurgie) pour évaluer la réponse locale au traitement néoadjuvant et s’assurer de l’absence d’évolution métastatique durant le traitement néoadjuvant (accord d’experts).
OPTIONS
- La rectoscopie au tube rigide, qui permet la réalisation de biopsies multiples, est réalisée sans anesthésie en position genu-pectorale ou en décubitus latéral gauche sur un rectum vide. Elle apprécie comme la coloscopie l’extension circonférentielle, la taille et l’aspect de la lésion, et mesure avec précision la distance entre le pôle inférieur de la tumeur et la marge anale.
- L’EER permet un bilan d’extension précis notamment pour les tumeurs limitées à la paroi rectale. Elle utilise une classification uTN dérivée du TNM (uT1 : muqueuse et sous muqueuse ; uT2 : musculeuse ; uT3 : graisse périrectale ; uT4 : organe de voisinage). Sa précision diagnostique est évaluée à 87,5 % pour l’extension pariétale. Les sondes de hautes fréquences (15, 20, voire 30 Mhz), permettant de d’évaluer les tumeurs intra-muqueuses (m) des cancers envahissant la sous-muqueuse (sm), et parmi celles-ci d’établir une subdivision en 3 degrés (sm1, 2, 3) selon la profondeur de l’atteinte sont actuellement très peu utilisées et remplacées plus efficacement par l’évaluation endoscopique avec chromoendoscopie et/ou NBI (Harewood, 2004). Pour les tumeurs de stade précoce (T1/2), mobiles au toucher rectal, l'EER est plus efficace que les autres examens dans la différentiation T1 vs T2 (atteinte de la musculeuse) notamment que l’IRM.
- L'IRM hépatique et le TEP-scan FDG : en cas de doute sur la nature métastatique d’une lésion.
- L’ACE (avis d'experts) Il peut avoir un intérêt pronostique, et faire suspecter une extension métastatique (taux très élevé). En cas d’augmentation pré-opératoire, sa normalisation sera à vérifier en post-opératoire.
- Le TEP-scan FDG avec fusion d’images avec l’IRM et/ou la TDM pour faciliter le contourage de la tumeur (GTV) lors de la préparation de la radiothérapie conformationnelle.
- Le génotypage du gène DPYD si phénotype DPD (uracilémie) anormal (avis d'experts).
Biopsies pré-thérapeutiques et biomarqueurs indispensables :
- Une preuve anatomopathologique est indispensable avant tout traitement.
- Elle met le plus souvent en évidence un adénocarcinome de type NOS (Not Otherwise Specified, selon la classification OMS 2019).
- Le nombre de biopsies à recommander est idéalement de 6 minimum pour une tumeur non résécable en endoscopie (accord experts). Cette recommandation s’appuie sur la demande croissante de biomarqueurs à réaliser dans le cadre de la médecine de précision par immunohistochimie et/ou biologie moléculaire.
Les biomarqueurs indispensables sont les suivants :
Statut dMMR/MSI (deficient MisMatchRepair/Microsatellite Instability) (cf. TNCD chapitre 20.5. Evaluation du statut MMR tumoral https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Evaluation-du-statut-MMR-tumoral-synthese-2021)
- La détermination des statuts RAS et BRAF est indispensable en cas de maladie métastatique (INCa 2022).
- Les mutations RAS représentent un facteur de résistance aux anticorps anti-EGFR et contre indiquent leur utilisation (INCa 2022).
- Les mutations BRAF sont pronostiques et prédictives dans les CCR métastatiques (CCRm) proficient (p)MMR et sous-tendent respectivement un traitement intensifié et un ciblage thérapeutique avec un anticorps anti-BRAF en deuxième ligne (INCa 2022).
- En cas de réponse histologique complète ou majeure, ces statuts pourront être déterminés sur les biopsies pré-thérapeutiques afin d’éviter des faux négatifs par biologie moléculaire, compte tenu du caractère pauci-cellulaire du matériel.
5.4. Traitements
5.4.1. Méthodes
5.4.1.1. Traitements endoscopiques des lésions superficielles
RÉFÉRENCES
Pour les tumeurs rectales à risque de contenir un cancer superficiel (CONECCT IIC, IIC+), une exérèse locale endoscopique ou chirurgicale doit être privilégiée car elle peut être curative tout en préservant l’organe.
Sur le plan carcinologique, une résection locale d’adénocarcinome rectal peut être considérée curative lorsque la tumeur a été réséquée complètement avec des marges de sécurité latérales et profondes (résection R0) et qu’elle présente les critères suivants :
- Adénocarcinomes intra-muqueux purs (T1a) car le risque d’évolution métastatique ganglionnaire est inférieur à 1 % pour les tumeurs bien à moyennement différentiées.
- Adénocarcinomes à envahissement sous-muqueux superficiel (sm1) lorsque l’invasion sous-muqueuse est inférieure à 1000 microns et qu’aucun embol vasculonerveux ni Budding de grade ≥2 ni composantes indifférenciées n’est détecté par l’anatomo-pathologiste. Le risque de métastases ganglionnaires est alors inférieur à 1 % (recommandation ESGE 2017, Ferlitsch) et la résection locale R0 de la lésion est alors curative.
- Adénocarcinomes à envahissement sous-muqueux profond (> sm1) lorsque l’invasion sous-muqueuse est supérieure à 1000 microns et qu’aucun embol vasculonerveux ni Budding de grade ≥2 ni composantes indifférenciées n’est détecté par l’anatomo-pathologiste. Le risque de métastases ganglionnaires est alors inférieur à 4 % (recommandation ESGE 2022, Pimentel) et la résection locale R0 de la lésion est alors curative sous réserve d’une surveillance renforcée du risque de récidive métastatique ganglionnaire.
En cas de facteurs histologiques de risque ganglionnaire (Budding de grade ≥2 et/ou embols vasculonerveux et/ou composants indifférenciées), ou de résection R1 en profondeur, il est recommandé de réaliser une chirurgie radicale avec curage ganglionnaire sur le mésorectum.
OPTIONS
Pour les patients à risque opératoire élevé ou refusant la chirurgie complémentaire en cas d’indication chirurgicale après résection endoscopique, une CRT peut être proposée en alternative à la chirurgie radicale complémentaire (accord experts).
La difficulté réside dans le fait de prédire la présence ou non de cancer dans la pièce et son degré d’invasion avant de débuter la résection pour adapter la qualité d’exérèse au risque carcinologique principalement d’envahissement ganglionnaire. La présence potentielle de cancer dans la lésion doit faire choisir une technique de permettant d’obtenir une résection en monobloc avec des marges de sécurité (résection dite R0) soit par dissection sous-muqueuse (lésion CONECCT IIC), soit par dissection inter-musculaire (CONECCT IIC+).
Evaluation diagnostique préalable à une exérèse locale :
L’exploration endoscopique minutieuse avec chromoendoscopie est incontournable pour guider la prise en charge thérapeutique des tumeurs du rectum. En effet, la méthode diagnostique la plus performante de prédiction histologique et de la profondeur d’invasion tumorale est la caractérisation endoscopique basée sur l’aspect macroscopique de la lésion (Classification de Paris ; Kudo 2001), et l’aspect du relief muqueux et vasculaire de surface (classification NICE, Hayashi 2013, classification de Sano, Uraoka 2011) en chromoendoscopie virtuelle ou classique. Une lésion (colo)rectale doit systématiquement être évaluée par un examen minutieux en utilisant la chromoendoscopie virtuelle (ou classique si virtuelle non disponible) (recommandations ESGE 2017, Ferlitsch). L’examen endoscopique avec chromoendoscopie est l’examen le plus performant pour différentier les lésions superficielles (intra-muqueux ou sous-muqueux < 1000 microns) des lésions invasives profondes (> 1000 microns). Pour les lésions superficielles (CONECCT IIC, JNET 2 a et 2b, Kudo Vi), l’exérèse locale endoscopique ou chirurgicale par voie basse transanale est recommandée et permettra de confirmer l’invasion par l’analyse histologique de la pièce de résection étalée.
Pour les lésions borderline (CONECCT IIC+), il existe une place pour une résection endoscopique à visée diagnostique par dissection diagnostique (place de la dissection intermusculaire à préciser) (Patenote, 2023 ; Moons, 2022). Au contraire, en cas de tumeur invasive profonde (JNET 3, CONNECCT III, Sano IIIB, KUDO VN), une évaluation par IRM (+/- échoendoscopie en cas de petite tumeur mobile) permettra de prédire le stade pariétal et l’extension ganglionnaire (Pimentes-Nunes, 2022).
L’écho-endoscopie rectale est indispensable pour les tumeurs suspectes d’invasion profonde sur l’examen endoscopique avant exérèse locale car elle permet de sélectionner avec précision les tumeurs uTis et uT1 candidates à un traitement local contrairement aux tumeurs uT2 (recommandation : grade B). En effet, après exérèse locale d’une tumeur ayant des facteurs histopronostiques défavorables, la chirurgie rectale radicale de rattrapage peut être rendue difficile par la cicatrice fibreuse et le défect de paroi de l’exérèse locale préalable et semble être plus à risque d’amputation abdominopérinéale qu’une chirurgie rectale radicale d’emblée, sans toutefois compromettre le pronostic oncologique (Bach, 2009 ; Morino, 2013 ; Levic, 2013).
Résultats oncologiques :
L’exérèse locale d’un cancer du rectum peut être considérée comme sûre sur le plan carcinologique, c’est-à-dire avec un faible risque d’envahissement ganglionnaire, lorsque tous les critères suivants sont réunis : adénocarcinome pTis ou pT1sm1, moyennement ou bien différencié, absence d’embols vasculaires ou lymphatiques, absence de budding tumoral, et absence de contingent mucineux ou à cellules indépendantes (Morino, 2011). Une extension aux lésions sm profondes sans aucun critère péjoratif est de plus en plus courante depuis la démonstration de l’absence de lien clair entre risque ganglionnaire et profondeur d’invasion en l’absence de Budding, d’embols et de composante indifférenciée (Zwager, 2022).
En dehors de ces critères (présence de Budding significatif (Bd 2 et plus), d’invasion lymphovasculaire, de composantes indifférenciées), le risque ganglionnaire devient significatif et les exérèses locales ne sont alors pas curatives. Il est alors nécessaire de discuter une chirurgie rectale de rattrapage avec exérèse totale du mésorectum dans un délai court < à 1 mois (Issa, 2018). Cette intervention de rattrapage peut être réalisée par laparoscopie (Ortenzi M, 2018). La place d’un traitement adjuvant par CRT pour traitement du risque ganglionnaire à la place d’une chirurgie avec TME reste à évaluer (Etude TESAR Néerlandaise en cours), mais peut-être une option chez les patients fragiles (accord experts).
Choix de la technique d’exérèse locale :
Les deux techniques validées avec de bons résultats carcinologiques en termes de qualité d’exérèse (exérèse monobloc et résection complète) sont :
- l’exérèse endoscopique par dissection sous-muqueuse (ESD) ;
- la microchirurgie transanale endoscopique (TEM).
Une étude multicentrique française (GRECCAR 13-MUCEM) comparant la résection par dissection sous-muqueuse à la technique de chirurgie trans-anale et visant à déterminer si les deux approches sont d’efficacité comparable ou si l’une doit être privilégiée est actuellement en cours de publication. Dans l’attente des résultats les 2 techniques sont utilisables.
Résection endoscopique :
Lorsque la caractérisation endoscopique prédit un risque d’adénocarcinome superficiel (CONECCT IIC), la technique de résection doit viser le R0 (monobloc et marges profondes et latérales saines).
Pour une lésion borderline (CONECCT IIC+, une dissection intermusculaire pourrait augmenter les chances de R0 profond sans pour autant générer une perforation et inflammation périrectale comme la chirurgie transmurale. La taille entre alors en compte pour choisir la technique optimale ; en effet, jusqu’à 20 mm, il est possible d’obtenir une résection R0 par la technique courante de mucosectomie à l’anse diathermique (peu coûteuse et à risque faible de perforation). Au-delà de 20 mm, l’issue de la mucosectomie est plus hasardeuse et lorsqu’une résection R0 est nécessaire, la dissection sous-muqueuse est alors la technique endoscopique de référence pour obtenir une résection en un fragment avec marges de sécurité (recommandations ESGE actualisée, Pimentel-Nunes, 2022). Cette dissection sous-muqueuse permet d’emporter la lésion avec une marge profonde de sous-muqueuse saine afin de prédire avec précision le risque d’atteinte métastatique ganglionnaire. Si la résection n’est finalement pas curative, elle n’empêche pas la chirurgie ultérieure de rattrapage et ne génère pas de fibrose péri-rectale comme peut le faire la chirurgie transanale qui emporte le muscle sous lésionnel.
L’exérèse chirurgicale transanale par micro-chirurgie endoscopique transanale (TEM) est la technique chirurgicale de référence.
L’exérèse par voie transanale conventionnelle (parachute ou lambeau tracteur) n’est pas la technique de choix pour les tumeurs rectales relevant de l’exérèse locale car plus à risque de résection incomplète et fragmentée (Clancy, 2015) et ne devrait être utilisée qu’en cas de tumeur distale localisée à moins de 5 cm de la marge anale (recommandation : grade A).
L’exérèse monobloc doit comporter toute l’épaisseur de la paroi rectale en regard de la tumeur, avec une marge de résection périphérique de 1 cm.
La pièce d’exérèse doit être adressée épinglée et orientée au laboratoire d’anatomo-pathologie.
5.4.1.2. Chirurgie
5.4.1.2.1. Opérabilité
- L’âge : l’âge physiologique est à considérer, plus que l’âge chronologique. Une évaluation gériatrique peut s’imposer en fonction de l’âge et des comorbidités. L’utilisation de la grille Oncodage G8 permet de sélectionner les patients dont l’évaluation oncogériatrique spécialisée est indispensable. La prise en charge de patients de plus en plus âgés conduit à adapter les stratégies thérapeutiques à cette population particulière. Au-delà de 85 ans, le traumatisme chirurgical doit être limité au maximum (Rutten, 2008).
- Le sexe et la morphologie du patient : l’abord chirurgical du rectum peut être difficile chez l’homme en raison de l’étroitesse du pelvis. Une surcharge pondérale peut également être source de difficultés opératoires.
- Les comorbidités : elles sont appréciées en collaboration avec l’anesthésiste et l’oncogériatre pour les patients âgés. En ce qui concerne le bilan préanesthésique il est recommandé d’utiliser la classification de l’American Society of Anaesthesiology (ASA) :
- patient en bonne santé
- atteinte modérée d’une grande fonction
- atteinte sévère d’une grande fonction
- atteinte sévère de plusieurs grandes fonctions
- patient moribond ayant une espérance de vie inférieure à 24 heures
- Les fonctionnalités : le bilan clinique évalue la fonction sphinctérienne anorectale notamment le degré de continence et la sexualité chez la femme et chez l’homme (les dysfonctions érectiles chez l’homme).
En cas d’opérabilité compromise, des stratégies alternatives à la chirurgie radicale doivent être discutées en RCP (cf. infra).
5.4.1.2.2. Résécabilité
En pré-opératoire : l’examen de référence pour la résécabilité est l’IRM pelvienne qui montre avec précision l’envahissement du fascia recti, de l’espace intersphinctérien et/ou des organes périrectaux.
Une tumeur est considérée comme non résécable cliniquement ou à risque de résection R1 (facteur pronostique péjoratif) si elle est fixée à un organe ou une structure de voisinage au toucher rectal et radiologiquement si la marge circonférentielle est < 1 mm en IRM. La non résécabilité de type R1 (résidu microscopique probable) ou R2 (résidu macroscopique probable) est temporaire ou définitive en fonction de la réponse au traitement néoadjuvant et de l’avis chirurgical. Il est essentiel que le chirurgien examine le patient avant le début du traitement néoadjuvant pour pouvoir évaluer ultérieurement la réponse tumorale, généralement 6 à 8 semaines après la fin de la RT. Il peut ainsi juger au mieux de la résécabilité de la tumeur et des possibilités de conservation sphinctérienne, voire rectale.
En peropératoire : l’exploration peut mettre en évidence une extension imprévue aux organes de voisinage interdisant la résection. Si le patient n’a pas eu de traitement préopératoire, il est conseillé d’interrompre l’acte chirurgical en vue d’un traitement néoadjuvant, éventuellement sous couvert d’une colostomie. Chez un patient ayant reçu un traitement préopératoire et en cas d’extension pelvienne résiduelle postérieure (sacrum), latérale (vasculaire, urétérale, nerveuse), antérieure (vessie, prostate chez l’homme, utérus, vagin chez la femme), une exérèse macroscopiquement incomplète (R2) ne doit pas être envisagée. Les conditions doivent alors être réunies pour qu’un geste d’exérèse élargie à visée curative (exérèse monobloc) puisse être réalisé. Ces conditions comprennent une information au patient, la préparation de l’équipe chirurgicale à ce type de geste (centre de recours), le repérage d’un site de stomie urinaire et digestive éventuelle.
5.4.1.2.3. Règles d’exérèse carcinologique chirurgicale
L’exérèse du rectum (proctectomie) est entreprise après un bilan complet de la cavité abdominale. La biopsie de toute lésion suspecte est recommandée pour guider la prise en charge ultérieure.
La découverte peropératoire d’une carcinose péritonéale doit faire renoncer au geste d’exérèse et soumettre le dossier à un centre expert de traitement de la carcinose après description précise des lésions (distribution des lésions et index de carcinose péritonéale (PCI) de Sugarbaker).
L’exérèse du mésorectum
L’exérèse extrafasciale du mésorectum (Heald, 1986) réduit significativement les récidives locorégionales et le respect de l’innervation pelvienne limite les séquelles urinaires et sexuelles des résections rectales. En l’absence d’atteinte du fascia recti, la préservation des nerfs autonomes pelviens permet une amélioration des résultats génito-urinaires. Les lésions les plus fréquentes surviennent au niveau du plexus hypogastrique inférieur (recommandation : grade C).
Dans le cas des tumeurs du tiers supérieur, la section du mésorectum doit passer 5 cm sous la limite inférieure de la tumeur. Il est recommandé de réséquer la totalité du mésorectum des tumeurs des tiers moyen et inférieur. Le caractère complet et sans effraction de l’exérèse du méso-rectum doit être mentionné dans le compte-rendu opératoire et anatomopathologique standardisé (Quirke, 2009). Une photographie de la pièce opératoire est réalisée de principe. La mesure des marges chirurgicales (distale et circonférentielle) est indispensable pour définir le caractère complet de la résection et a un rôle pronostique. La marge de sécurité distale (distance entre le pôle inférieur de la tumeur et la recoupe distale du rectum) doit être ≥ 1 cm, distance mesurée sur une pièce non fixée et sans traction (Moore, 2003). Une marge < 1 cm, après traitement néoadjuvant, pourrait cependant être compatible avec un bon contrôle local (Pahlman, 2013). La valeur de la marge circonférentielle reste un facteur pronostique indépendant en termes de récidive et de survie après chirurgie optimale avec ou sans CRT néoadjuvante (recommandation : grade B).
Le curage ganglionnaire
Le curage ganglionnaire mésentérique inférieur est justifié sans toutefois lier l’artère mésentérique inférieure au ras de l’aorte. Une ligature à 1 cm de l’aorte donne des résultats carcinologiques comparables et épargne les nerfs à destinée pelvienne qui cheminent à ce niveau. La section de l’artère mésentérique inférieure haute ou basse par rapport à l’aorte ne modifie pas le taux de fistules, le nombre de ganglions prélevés, et le taux de survie à 5 ans (Yang, 2018) (recommandation : grade A).
Le curage ganglionnaire pelvien latéral.
Les cancers du moyen et bas rectum situés en dessous de la ligne de réflexion péritonéale ont tendance à se propager en dehors du plan standard chirurgical d’Exérèse Totale du Mesorectum (ETM) c’est-à-dire plutôt latéralement vers les ganglions lymphatiques entourant les vaisseaux iliaques et obturateurs. Avant l’ère des traitements premiers par chimioradiothérapie (CRT) de ces cancers du moyen et bas rectum associés à une ETM, les récidives locales se produisaient fréquemment et étaient majoritairement situées au centre du bassin. Cependant, depuis la CRT et l’ETM pour les patients aux stades les plus avancés (stade II/stade III), le risque absolu de récidive locale (RL) a diminué, alors qu'environ 50 % des RL se produisent maintenant dans les compartiments latéraux, probablement en raison des ganglions lymphatiques latéraux (GLL) qui ne sont toujours pas traités de manière appropriée.
Chez 30 à 40 % des patients présentant des ganglions principalement hypertrophiés (> 10 mm, petit axe [PA]) traités par CRT et ETM, une récidive locale latérale survient dans les 5 ans (Schaap, 2018). L’étude de cohorte récente internationale (Ogura, 2019) de 1216 patients avec réexamen standardisé de toutes les images IRM a révélé que les patients avec des ganglions augmentés de taille (≥ 7 mm [PA]) avant la (C)RT avaient un taux de récidives locales latérales (RLL) à 5 ans de 19,5 %. Les ganglions ≥ 7 mm avant CRT dans le compartiment iliaque interne, qui restaient > 4 mm (PA) à la restadification, avaient un taux de RLL à 5 ans de 52,3 %. Les ganglions lymphatiques obturateurs avaient un risque de RLL à 5 ans de 17,8 % lorsqu'ils restaient > 6 mm (PA). Seulement 22 % des ganglions lymphatiques iliaques internes ont diminué significativement de taille (< 4 mm) lors de la restadification, contre 63 % pour les ganglions lymphatiques obturateurs. Cela suggère des différences oncologiques entre les localisations anatomiques, pouvant s'expliquer par des avancées distinctes de la maladie ou la proportion de GGL hypertrophiés de manière réactionnelle (Shaap, 2021 ; Ogura, 2019). En revanche, les ganglions élargis dans le compartiment iliaque externe n'ont pas entraîné d'augmentation de la RLL, quelle que soit leur taille, mais ont entraîné une multiplication par deux des métastases à distance (Shaap, 2021 ; Ogura, 2019). Les ganglions iliaques externes peuvent être plus révélateurs d'une maladie avancée, tandis que les ganglions iliaques internes et obturateurs se comportent comme une maladie régionale. Cependant, ces résultats proviennent d'une seule grande étude et doivent être vérifiés.
Malgré l'augmentation des preuves de l'importance des ganglions, les recommandations internationales sont rares (Peacock, 2020). Pour certains patients, la (C)RT et l’ETM peuvent être insuffisantes et ce groupe pourrait bénéficier d'une dissection latérale des ganglions lymphatiques (DLGL), au cours de laquelle tout le tissu lymphatique des compartiments latéraux est retiré. Une DLGL a été associée à une diminution des taux de RLL, mais à des risques accrus de saignement et/ou de lésions nerveuses (Williamson, 2020 ; Ito, 2018) ce qui signifie qu'une DLGL ne doit être effectuée que pour les patients « à haut risque » par des chirurgiens ayant une expertise suffisante.
Une collaboration étroite est nécessaire entre la radiologie, la radio-oncologie et la chirurgie afin d'optimiser le traitement des ganglions.
En effet, même au sein d’équipes entraînées à l’analyse radiologique de l’envahissement GLL et à la DLGL comme les équipes asiatiques, une récente méta-analyse (Christou, 2021)a pu mettre en évidence une faible proportion de patients (environ 17%) avec envahissement métastatique ganglionnaire du compartiment latéral lorsque était effectué le geste de chirurgie rectale avec ETM et DLGG : qu’il s’agisse de DLGG prophylactique (taille du petit axe des GGL < 7 mm) ou curatrice (taille du petit axe des GGL > 7mm). D’autre part, la méta-analyse de Gao et al., (Gao 202) intégrant seulement des équipes asiatiques (12 études avec 4458 patients) a pu mettre en évidence que lors de l’absence de (C)RT néoadjuvante, le geste de chirurgie rectale avec ETM et DLGG (systématique/prophylactique ou curatrice) permettait de diminuer significativement le taux de RL à 5 ans (p=0.004) mais avec des taux de RLL à 5 ans non statistiquement significativement différents (analyse faite seulement sur 3 études, p=0.14) et des taux de complications plus élevés qu’en l’absence de DLGG (p=0.02).
Une étude prospective internationale LaNoReC est en cours et inclut tous les patients atteints d'un cancer du rectum avec au moins 1 GLL ≥ 7 mm (PA). Ces patients reçoivent une CRT standardisée et toutes les images IRM et les délimitations d'irradiation sont examinées de manière centralisée par des experts. Il est conseillé aux patients présentant des GLL hypertrophiés de manière persistante après CRT (iliaque interne PA > 4 mm ou obturateur PA > 6 mm) d’être traités par DLGL. L'objectif principal est de rendre le taux de RLL à < 6 %.
En attendant les résultats de cette étude, il semble nécessaire de correctement évaluer ces GLL avec une IRM dédiée en pondération T2 de haute résolution avant puis après CRT (Beets-Tan, 2018 ; Brown, 2014). Cette restadification réalisée après le traitement néoadjuvant doit être discutée lors des RCP.
Les décisions chirurgicales doivent être basées sur la réponse des GLL : les preuves actuelles suggèrent que les ganglions iliaques internes > 4 mm (PA) et les GGL obturateurs > 6 mm (PA) après CRT tirent bénéfice d’une DLGL. A l’inverse, lorsque les patients atteints de GLL connaissent une réponse clinique complète (cCR) de la tumeur primitive et des GLL après CRT, ceux-ci doivent être soigneusement évalués par IRM et faire l'objet d'un suivi fréquent.
Au vu des risques du geste de DLGL, celle-ci doit être réalisée dans des centres tertiaires experts pour assurer une haute qualité chirurgicale et limiter la morbidité. Il est important de souligner qu’il existe de rares preuves disponibles suggérant que le « picking ganglionnaire » est insuffisant pour réduire les taux de RLL (Kim, 2020).
La voie d’abord
L’exérèse rectale par laparoscopie peut être recommandée (recommandation : grade A). Elle assure un résultat oncologique au moins équivalent à l’exérèse par laparotomie pour les tumeurs T1, T2 et T3 faibles. Cet abord apporte également un bénéfice en termes de durée d’hospitalisation et de pertes sanguines au prix d’une durée opératoire plus longue (Kang, 2010 ; Bonjer, 2015 ; Lujan, 2009).
Elle doit cependant être réservée à des centres experts, comme le montrent les études randomisées récentes ACOZOG et ALACART (Stevenson, 2015 ; Fleshman, 2015).
L’abord robotique donne des résultats au moins équivalents à l’abord cœlioscopique en termes de risques de complications post-opératoires, de séquelles nerveuses, de qualité de la pièce opératoire (marges distales et circonférentielles, qualité du mésorectum et nombre de ganglions) ou de qualité de vie. L’abord robotique peut donc être recommandé au même titre que l’abord cœlioscopique (Jeong, 2014 ; Bonjer 2015 ; Deijen, 2016 ; Jayne 2017).
Deux études récentes asiatiques randomisées montrent des bénéfices en termes de suites opératoires ou de qualité de l’exérèse en faveur de l’approche robotique. Les données oncologiques à long terme sont en attente. La première, l’étude chinoise REAL a randomisée 1240 patients entre une approche laparoscopique et robotique pour des cancers du bas et moyen rectum (Q Feng, 2022). Cette étude rapportait une diminution significative du taux de conversion en laparotomie, de la durée de séjour, de la reprise du transit, de la morbidité post-opératoire, du taux de marge circonférentielle positive, du taux de mésorectum incomplet à l’examen anatomopathologique en faveur de l’approche robotique. La 2ème étude, l’étude coréenne COLRAR a randomisée 295 patients entre laparoscopie et chirurgie robotique (JS Park, 2023) et rapportait un bénéfice de l’approche robotique en termes de risque de marge circonférentielle positive et de consommation d’opioïdes en postopératoire. (Recommandations : grade A)
L’exérèse rectale associée à l’exérèse totale du mésorectum par laparoscopie (LapTME) peut être difficile chez les patients présentant des caractéristiques défavorables : tumeurs du bas rectum, anatomie pelvienne étroite, sexe masculin ou obésité. Une visualisation difficile de l'anatomie pelvienne ainsi que la limitation des instruments laparoscopiques rigides peuvent affecter la qualité des marges de résection, augmenter les risques de lésions neurovasculaires pendant la chirurgie et augmenter le risque de conversion en laparotomie (Bell, 2018).
L’abord périnéal premier sur 5-6 cm peut être recommandé à chaque fois qu’il est nécessaire de réaliser une anastomose colo-anale manuelle, notamment dans les situations difficiles (bassin étroit, sexe masculin, obésité, tumeurs volumineuses) (recommandation : grade B).
Dans le but de limiter ces difficultés liées à LapTME, un concept nouveau d’exérèse totale du mesorectum par voie transanale «down to up» (TaTME) a été proposé par plusieurs auteurs (Tuech, 2015; Lacy, 2015 ; Penna, 2016). Les résultats de ces études non randomisées montrent que les taux de complications, la qualité d’exérèse du mésorectum et des marges carcinologiques sont équivalents à la laparoscopie avec une diminution de la durée opératoire.
Cette nouvelle technique reste en cours d’évaluation dans plusieurs études randomisées dont une française (GRECCAR 11 (B. Lelong, IPC Marseille)). Des doutes subsistent sur un surrisque de récidive locale après cette approche par TaTME si bien que la Norvège a imposé un moratoire sur cette technique tant que des études bien conduites n’ont pas démontré l’équivalence oncologique par rapport aux techniques de références (Wasmuth 2020).
5.4.1.2.4. Indications des types d’exérèse chirurgicale
RÉFÉRENCES
Les facteurs essentiels de choix sont le siège, l'extension locorégionale du cancer, la marge latérale en IRM, et le morphotype du patient. En cas de doute sur la conservation sphinctérienne, l'avis d'un chirurgien expert devra être demandé avant tout traitement préopératoire, puis après traitement néoadjuvant.
- Cancer du haut rectum : exérèse du rectum et du mésorectum jusqu'à 5 cm sous le pôle inférieur de la lésion, anastomose colorectale mécanique ou manuelle plus ou moins protégée.
- Cancer du moyen rectum : exérèse complète du mésorectum, rétablissement de continuité par anastomose colo-anale protégée. L'adjonction d'un réservoir colique en J de 5 à 6 cm de longueur est recommandée (recommandation : grade A). Si la confection d’un réservoir est impossible, une anastomose latéro-terminale est recommandée (Fazio, 2007).
- Cancers du bas rectum : exérèse complète du rectum et du mésorectum. Si une marge distale macroscopique de 1 cm au moins (recommandation : grade B). Niveau de preuve 2) et une marge latérale supramillimétrique sont obtenues d'emblée ou après dissection inter-sphinctérienne (centres expérimentés) : anastomose colo-anale protégée avec réservoir colique (recommandation : grade B). Si la tumeur envahit le muscle strié (sphincter externe ou releveur) ou si une marge supramillimétrique avec les muscles striés ne peut pas être obtenue : amputation abdomino-périnéale. Une classification des tumeurs du bas rectum permet d’évaluer les possibilités de préservation sphinctérienne et doit être utilisée (recommandation : grade B). (Rullier, 2013).
Classification de Rullier des cancers du bas rectum :
- Type I : tumeurs supra-anales >1 cm du sphincter (traitement conservateur possible avec anastomose colo-anale)
- Type II : tumeurs juxta-anales < 1 cm du sphincter (traitement conservateur possible avec résection intersphinctérienne partielle)
- Type III : tumeurs intra-anales : atteinte du sphincter interne (traitement conservateur possible avec résection intersphincterienne totale)
- Type IV : tumeurs trans-anales : atteinte du sphincter externe (pas de traitement conservateur possible, amputation abdomino-périnéale)
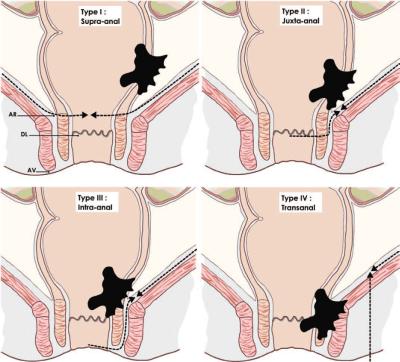
AR = anal ring (bord supérieur du sphincter)
DL = dentate line (ligne pectinée)
AV = anal verge (marge anale).
Les pointillés représentent le plan de dissection chirurgical.
5.4.1.2.5. Résection du rectum avec rétablissement de continuité
- Une dérivation temporaire du flux fécal est recommandée en cas d’anastomose sous douglassienne (sous péritonéale). L’iléostomie semble préférable à la colostomie (moins de complications péristomiales et rétablissement de la continuité digestive plus facile à réaliser) (Rapport AFC 2009 : cancer du rectum. (JL. Faucheron/E. Rullier) : La fermeture de la stomie par voie élective se fait au 2ème-3ème mois postopératoire, après contrôle radiologique et/ou rectoscopique de l’anastomose (recommandation : grade C).
- Après proctectomie et exérèse totale du mésorectum, la réalisation d'un réservoir colique en J de 5 à 6 cm de longueur est recommandée sur la base de plusieurs études randomisées (recommandation : grade A). Si la confection d’un réservoir est impossible, une anastomose latéro-terminale est recommandée (Fazio, 2007). Cependant, une étude récente randomisée évaluant les résultats fonctionnels chez 336 patients comparant l’anastomose directe, l’anastomose latéro-terminale et le réservoir en J ne montrait aucune différence entre ces 3 modalités de reconstructions à 6,12 et 24 mois relançant le débat sur l’utilité des réservoirs (Marti, 2019).
OPTIONS
- En cas d’incompétence sphinctérienne avec incontinence anale préopératoire ne semblant pas liée à la taille de la tumeur, notamment chez les personnes âgées, une anastomose colo-anale n’est pas recommandée. L’opération de Hartmann, respectant les règles carcinologiques précédemment décrites, peut-être une alternative à l’amputation abdomino-périnéale (accord d’experts).
- Proctectomie avec anastomose colo-anale différée au 7ème jour évitant la stomie temporaire mais ne permettant pas la confection d’un réservoir (Baulieux, 2004) (recommandation : grade C).
5.4.1.2.6. Amputation abdomino-périnéale
En cas d’amputation abdomino-périnéale (AAP), l’exérèse tant pelvienne que périnéale doit éviter une dissection en cône séparant la tumeur des muscles releveurs. En effet, l’essai hollandais a montré que le risque de perforation rectale et de marge circonférentielle envahie était trois fois plus élevé après AAP qu’après chirurgie conservatrice sphinctérienne, ce qui justifie une exérèse extra-lévatorienne pour certains (West, 2008). Les données de la littérature ne sont toutefois pas assez solides pour émettre des recommandations sur le type d’AAP à réaliser. La morbidité périnéale après AAP en particulier après AAP extra-lévatorienne est élevée et augmentée par les traitements néoadjuvants.
La fermeture première du périnée avec drainage est la technique de référence (recommandation : grade C).
Le patient doit être prévenu et préparé à une colostomie définitive dont le site aura été localisé en préopératoire. Le concours d’une stomathérapeute est essentiel.
OPTIONS
Après amputation abdomino-périnéale extra-lévatorienne, le comblement du défect pelvipérinéal peut utiliser un lambeau musculocutané de grand droit ou de grand fessier (Devulapalli, 2016), afin de diminuer la morbidité et la durée de cicatrisation périnéales (recommandation : grade A). L’utilisation d’une prothèse biologique de collagène peut-être une alternative (recommandation : grade C) et une étude randomisée multicentrique est en cours (Etude GRECCAR 9, Buscail, 2021).
Une reconstruction périnéale par colostomie périnéale irriguée peut être proposée. Elle diminue la morbidité périnéale immédiate et permet une qualité de vie comparable aux interventions conservatrices du sphincter (Farroni, 2007) (recommandation : grade C).
5.4.1.3. Radiothérapie (RT) et chimioradiothérapie (RCT)
Les adénocarcinomes rectaux sont modérément radiosensibles. L’ensemble des études portant sur l'augmentation des doses de radiothérapie au-delà de 35 puis 45 Gy montre clairement deux phénomènes : 1) l'augmentation de dose augmente la réponse tumorale clinique et histopathologique et améliore le contrôle local (Wiltshire, 2006 ; Appelt, 2013). Cependant, l’adénocarcinome rectal doit être considéré comme relativement radiorésistant, une dose de 92 Gy étant nécessaire pour stériliser les tumeurs T3 dans 50 % des cas ; 2) l'irradiation de grands volumes pelviens (> 1 500 cm3) augmente la toxicité précoce et tardive. Les progrès à venir reposent sur des irradiations plus précises, dans des volumes réduits et à des doses plus fortes en fonction du contexte clinique (Thariat, 2012).
La RT ou CRT préopératoire est préférée à la radiothérapie postopératoire en raison d’une meilleure observance, d’une plus faible toxicité et d’une plus grande efficacité sur le contrôle local (Sauer, 2004 et 2012). La radiothérapie préopératoire diminue la fréquence des récidives locales, y compris en cas d’exérèse optimale du mésorectum (Kapiteijn, 2001 ; Sebag-Montefiore, 2009 ; van Gijn, 2011). La supériorité de la CRT concomitante par rapport à la radiothérapie préopératoire longue a été démontrée par deux essais multicentriques de phase III (Gérard, 2006 ; Bosset, 2006). Elle augmente le taux de réponse histologique et diminue de moitié le taux de récidive locale à 5 ans par rapport à la radiothérapie seule (8 % vs 16 %), au prix d’une majoration de la toxicité dans ces 2 études où l’exérèse du mésorectum n’était pas systématique. L’association d’une irradiation préopératoire et d’une chimiothérapie concomitante est recommandée. L’essai CRO7 (Sebag-Montefiore, 2009) montre que le schéma court 25 Gy/5 fractions (25/5) en préopératoire est plus efficace qu’une CRT postopératoire de nécessité en cas de marge envahie et réduit le taux de rechute locale, même pour les tumeurs T2 et celles du haut rectum. Avec les techniques de radiothérapie moderne, la CRT postopératoire présente une toxicité acceptable (Park, 2011).
5.4.1.3.1. Efficacité
Efficacité sur la survie globale (SG) comparativement à la chirurgie seule
La radiothérapie préopératoire et la CRT préopératoire n’apportent pas de gain en termes de SG. Une méta-analyse rapporte un Hazard Ratio de 0,93 (IC 95% [0,86 – 1,01], p = 0,09) pour la radiothérapie préopératoire et de 0,83 (IC 95% = [0,62 – 1,11], p = 0,22) pour la CRT préopératoire (Ma, 2017).
Efficacité sur la survie sans récidive (SSR) comparativement à la chirurgie seule
La radiothérapie préopératoire a démontré un bénéfice significatif en termes de SSR mais pas la CRT préopératoire : HR = 0,87 (IC 95% [0,77 – 0,98], p = 0,02) et HR = 0,98 (IC 95% [0,66 – 1,45], p = 0,91) (Ma, 2017).
Concernant la radiothérapie préopératoire, une analyse en sous-groupe retrouve une amélioration de la SSR dans les études pour lesquelles la radiothérapie délivre une dose biologique efficace (DBE) ≥ 35 Gy : HR = 0,89 (IC 95% [0,79 – 0,99], p = 0,03). Cette amélioration n‘est pas retrouvée dans les essais délivrant une DBE < 35 Gy.
Efficacité sur la survie sans récidive locale (SRL) comparativement à la chirurgie seule
Radiothérapie et CRT préopératoire ont démontré une forte amélioration de la SRL avec HR = 0,53 (IC 95% [0.46 – 0.62], p<0.01) et HR = 0,63 (IC 95% [0,42 – 0,97], p = 0,04) respectivement (Ma, 2017).
Efficacité sur la survie sans récidive métastatique (SRM) comparativement à la chirurgie seule
La radiothérapie et la CRT préopératoire n’ont pas démontré d’efficacité statistiquement significative sur la SRM : HR = 1,05 (IC 95% [0,85 – 1,28], p = 0,67) et 0,97 (IC 95% [0,76 – 1,24], p = 0,81) respectivement (Ma, 2017).
Il est important de noter que ces données sur l’efficacité sont basées sur une méta-analyse chinoise issue de données publiées et non de données individuelles. Les conclusions des analyses en sous-groupes sont donc à prendre avec précaution et ne sont pas présentées ici.
Efficacité comparativement à la chimiothérapie péri-opératoire
Un essai chinois (FOWARC) chez 495 patients a comparé deux schémas de CRT préopératoire (avec et sans oxaliplatine) avec poursuite de la même chimiothérapie en post-opératoire, à une chimiothérapie pré- et postopératoire par FOLFOX (Deng Y, 2016). A trois ans, aucun bras n’est supérieur aux autres (Deng Y,2019) en termes de récidive locale, survie sans récidive et survie globale. Ainsi, est confirmée l’inutilité de l’adjonction d’oxaliplatine à la 5-fluoropyrimidine en pré-, voire postopératoire, mais aussi est suggérée l’efficacité de la chimiothérapie périopératoire (recommandation : grade C). Ces résultats ouvrent la porte à d’autres essais comparant chimiothérapie pré-opératoire à la CRT.
5.4.1.3.2. Tolérance de la radiothérapie ou de la chimioradiothérapie
Effets secondaires
Les effets secondaires sur les suites postopératoires les plus souvent rapportés sont les infections de paroi, les fistules anastomotiques et les occlusions digestives.
Dans la récente méta-analyse colligeant plus de 40000 patients (Ma, 2017), la radiothérapie et la CRT préopératoire augmentaient le risque d’infection de paroi : OR = 1,43 (IC 95% [1,17 – 1,74], p<0,01) et OR = 1,52 (IC 95% [1,08 – 2,16], p = 0,02) respectivement.
Seule la CRT préopératoire semblait augmenter le risque de fistule anastomotique avec un OR = 1,22 (IC 95% [1,00 – 1,50], p = 0,05], particulièrement en cas de chirurgie ouverte : OR = 1,25 (IC 95% [1,01 – 1,55], p = 0,04), ce qui n’était en revanche pas retrouvé après en cas de chirurgie cœlioscopique malgré un OR similaire de : OR = 1,3 (IC 95% [0,44 – 3,91], p = 0,63). En revanche, il n’existait pas d’augmentation statistiquement significative du risque d’occlusion digestive après la radiothérapie et la CRT préopératoire.
Le risque de mortalité post-opératoire était augmenté en cas de radiothérapie pré-opératoire avec un OR = 1,60 (IC 95% [1,04 – 2,47], p = 0,03) ; néanmoins, une analyse en sous-groupe (même réserve) révèle que cette augmentation du risque ne concernait que les patients âgés de plus de 65 ans, les plus fréquemment rencontrés en France : OR = 2,12 (IC 95% [1,31 – 3,43], p <0,01). Deux autres facteurs semblaient influer négativement sur la mortalité postopératoire : une DEB < 35 et un régime « short-course » de radiothérapie courte (≤ 5 fractions).
Cette augmentation de la mortalité postopératoire était aussi retrouvée en cas de CRT préopératoire : OR = 1,65 (IC 95% [1,04 – 2,59], p = 0,03) (Ma, 2017).
Il est à noter que dans le contexte de la CRT, l’utilisation de fluoropyrimidines induit une toxicité digestive de grade ≥ 3 chez 10–40 % des patients, et même d’exceptionnelles toxicités létales. 5,3% de ses toxicités de grade 3-4 semblent être liées à un déficit enzymatique en dihydropyrimidine déshydrogénase (DPD) (Deenen 2016; Loriot, 2018). Cela a motivé une recommandation de l’ANSM et de l’INCa diffusée en décembre 2018 de réaliser un dépistage systématique d’un déficit en DPD par dosage d’uracilémie (phénotypage) avant de débuter un traitement par 5-FU ou capecitabine.
Qualité de vie et toxicités tardives
La radiothérapie a un impact négatif sur les fonctions sexuelle et digestive (Stephens, 2010), le risque d’impuissance, de dyspareunie et d’incontinence anale étant plus élevé en cas de radiothérapie associée à la chirurgie. Ce risque de toxicité accrue est cependant modéré si l’on utilise de petits volumes d’irradiation (Marsh, 1994) ne dépassant pas vers le haut l’interligne S2-S3 et protégeant le canal anal notamment pour les cancers du moyen rectum. Dans l’essai hollandais, les récidives au-dessus de S3 étaient exceptionnelles pour les patients N0 avec résection en marges saines (Nijkamp, 2011). Cette approche de « petit pelvis » permet une réduction du volume recevant au moins 15 Gy (V15) sur l’intestin grêle de 65% en utilisant une technique 3D conformationnelle, et une réduction du V15 du grêle de 78% en RCMI. Similairement, Joye et al. proposent de descendre la limite supérieure du volume irradié à la hauteur de S1-S2 chez des patients N0 sans atteinte du fascia mésorectal (Joye, IJROBP 2015).
Dans l’essai ACCORD 12, la fréquence des toxicités tardives de grade ≥3 était inférieure à 3% à 5 ans (Azria, 2017). Le groupe CAPOX 50 présentait cependant une moins bonne fonction sphinctérienne comparativement au groupe CAP 45. La radiothérapie de contact associée comme complément de dose à la CRT est responsable de rectorragies de grade 1-2 (63 % contre 12 % dans le bras contrôle, p<0,0001 dans l’essai OPERA) qui disparaissent dans les 3 ans suivant le traitement (Gérard, 2023).
5.4.1.3.3. Indication de la radiothérapie ou de la chimioradiothérapie préopératoire
L’essai hollandais qui comportait une chirurgie de type TME a inclus des cancers des trois tiers du rectum et de stade I à III. L’analyse rétrospective de ces sous-groupes a suggéré l’inutilité de la radiothérapie pour les tumeurs du haut rectum (Kapiteijn, 2001). A l’inverse, l’essai CR07 montre une diminution significative des rechutes locales après radiothérapie courte préopératoire (25 Gy/5 fractions) pour tous les cancers du rectum, y compris ceux situés dans le haut rectum (Sebag-Montefiore, 2009). La CRT est recommandée en cas de tumeur non résécable du haut rectum. Elle peut rendre résécables des tumeurs qui ne l’étaient pas initialement (Braendengen, 2008) (recommandation : grade B).
Une CRT préopératoire est recommandée pour les cancers T3-T4 et/ou N+ du moyen et bas rectum ou pour toutes les tumeurs qui à l’IRM sont à 1 mm ou moins du fascia recti quel qu’en soit le siège et le stade. Elle doit être discutée en réunion de concertation pluridisciplinaire (recommandation : grade A).
5.4.1.3.4. Choix du type de radiothérapie ou de chimioradiothérapie préopératoire
Les derniers essais randomisés publiés permettent les constatations suivantes :
- L’oxaliplatine associée à la capécitabine ou au 5 FU (et concomitante d’une radiothérapie normofractionnée) augmente la toxicité précoce de grade 3 ou plus et n’améliore ni la stérilisation des pièces opératoires ni le contrôle local (Aschele, 2011 ; Gérard, 2010 et 2012 ; Schmoll, 2013 ; Allegra, 2015 ; Azria, 2017 ; Schmoll, 2021). La CRT ne doit pas comporter d’oxaliplatine concomitant à la radiothérapie. L’oxaliplatine en cours de radiothérapie peut toutefois se discuter en cas de maladie métastatique.
- La capécitabine donne des résultats équivalents à ceux du 5FU (Allegra, 2015 ; Gérard, 2010 ; Schmoll, 2014 ; Hofheinz, 2012).
- La dose de 45 Gy (1,8 Gy par fraction) semble donner, dans deux populations différentes, des taux de stérilisation tumorale (ypCR) inférieurs à ceux obtenus avec une dose de 50 Gy (2 Gy par fraction) avec 11,3 % de ypCR dans l’essai PETACC 6 (CAPOX 45) vs 16-19% dans les études ACCORD 12 (Azria, 2017) et STAR-01 (Aschele, 2011). En cas de dose de 50 Gy, il est proposé de réduire les volumes d’irradiation après 44 Gy pour n’inclure que la (les) tumeur(s) macroscopique(s). Après 75 ans, la dose de radiothérapie peut éventuellement être réduite à 45 Gy (1,8 Gy/F) (Wiltshire, 2006 ; Appelt, 2013 ; François, 2014 et 2016).
Radiothérapie conformationnelle avec modulation d’intensité (RCMI) : il est possible d’envisager un traitement par radiothérapie conformationnelle avec modulation d’intensité (45 Gy sur le pelvis, 1,8 Gy par fraction et 50 Gy sur le volume réduit, 2 Gy par fraction) (Tey, 2017). Cette technique n’est cependant pas recommandée par l'HAS à ce jour. Les avantages dosimétriques de la RCMI ont été démontrés, avec une diminution de la dose d’irradiation aux têtes fémorales, à l’intestin grêle et à la vessie (Zhao, 2015) ; une diminution des doses au bulbe pénien et à l’appareil génital féminin sont aussi envisageables avec cette technique. Des études rétrospectives ont déjà rapporté des résultats encourageants à court/moyen terme (Lupatelli, 2017) avec même un avantage clinique démontré sur la RC3D, pour les toxicités aiguës digestive et urinaire, dans une méta-analyse d’études rétrospectives (Wee, 2018). L’utilisation de la RCMI pourrait aussi permettre d’augmenter la dose d’irradiation à la tumeur et ainsi d’augmenter les possibilités de stérilisation tumorale (Appelt 2015). La RCMI permet également l’utilisation d’un boost intégré ce qui limite le nombre de fractions par patient, et pourrait améliorer la protection des tissus sains par rapport à une RCMI simple (Lupatelli, 2017). Toutefois, elle pourrait augmenter le risque de lymphopénie lié à la multiplication des angulations de faisceaux, et une diminution de la réponse immune anti-tumorale. Des données comparatives prospectives seraient intéressantes à rassembler pour mieux évaluer ces nouvelles techniques.
Quels volumes ?
Les indications d’irradiation des différents volumes ganglionnaires et pararectaux sont décrites dans les recommandations françaises de radiothérapie et ont fait l’objet d’un consensus international (Vendrely, 2022 ; Valentini, 2016).
Ces volumes sont les suivants :
| Mésorectum | Présacrés | Latéraux | Iliaques externes | Fosses ischioanales | Inguinaux | Complexe sphinctérien | ||
Pelviens | Abdominaux | Postérieurs | Antérieurs | ||||||
cT3 | + | + |
| + |
|
|
|
|
|
cT4 | + | + |
| + | Atteinte antérieure | Atteinte antérieure | Sphincter externe, fosses ischioanales | Vagin (tiers inférieur), Sphincters (atteinte massive) | Sphincter externe |
N2 | + | + |
| + | + |
|
|
|
|
N+ présacré abdominal | + | + | + | + |
|
|
|
|
|
N+ latéraux postérieurs -iliaques internes) | + | + |
| + | + |
|
|
|
|
N+ latéraux antérieurs (ilio-obturateurs) | + | + |
| + | + | + |
|
|
|
L’irradiation inguinale et iliaque externe n’est respectivement indiquée que dans des cas rares d’envahissement du sphincter externe du canal anal ou de tumeur T4 antérieure avec envahissement massif de la prostate ou du vagin. Elle a été réalisée de cette manière dans les deux dernières études américaines et italiennes (Allegra 2015 ; Aschele 2011) et les techniques actuelles permettent d’irradier ces niveaux sans augmenter de façon excessive l’irradiation des autres tissus sains.
Chimioradiothérapie ou radiothérapie seule accélérée ?
Le choix entre CRT longue ou radiothérapie courte 25/5 n’est pas tranché de façon nette. Un essai polonais (Bujko, 2004) ne montrait pas de différence mais rapportait un taux inhabituel de récidive locale de 16 % avec la CRT longue. Un essai australien, qui a inclus seulement 326 patients (Ngan, 2012), ne montre pas de différence significative en termes de tolérance immédiate et de taux de rechute locale à 3 ans de 7,5 % après 25 /5 et 4,4 % après CRT (50,4 Gy /25 fr) et 5-FU. Toutefois, pour les tumeurs distales, le taux de rechute locale a été de 12,5% pour les tumeurs traitées par 25/5 versus 0 % pour celles traitées par CRT préopératoire. Avec de petits volumes irradiés, le protocole court 25/5 présente une tolérance acceptable à 3 ans (Sebag-Montefiore, 2009). Il est possible que le taux de contrôle local soit meilleur avec la CRT, notamment pour les patients avec une petite tumeur cT1-2N0M0 ou cT2/T3N0M0 < 4 cm : un essai randomisé ayant inclus peu de patients a montré un taux de rechute locale et de survie globale inférieurs après 25/5 versus un traitement long (respectivement 5% vs 35% et 47% vs 86 %) (Wawok, 2018). Des données d’un essai de phase 3 ont montré par contre que les résultats de survie sans récidive tumorale pourraient être améliorés après un 25/5, si la tumeur est initialement cT4 ou cT3 fixée (73 % vs 65 %) (Bujko, 2016). Dans cette étude, les schémas de chimiothérapie néoadjuvante et adjuvante étaient complexes et différents entre les 2 bras, rendant l’interprétation difficile. Enfin, l’étude randomisée d’Erlandsson et al. (Erlandsson, 2017) a montré que le schéma court était équivalent au schéma long (étude Stockholm III) en termes de contrôle local. La survie sans rechute métastatique et la survie globale n’étaient également pas différentes. Dans cette étude, étaient toutefois inclus des stades très différents (notamment des patients avec tumeur ne justifiant pas de traitement néoadjuvant), sur une période de plus de 10 ans, ce qui laisse supposer une certaine hétérogénéité dans la stadification et les pratiques thérapeutiques (radiothérapie et chirurgie). Par ailleurs, la chimiothérapie néoadjuvante concomitante n’était pas administrée, rendant les résultats de cet essai ininterprétable au vu des standards actuels.
Le standard français reste donc la CRT longue (accord d’experts), mais le schéma court 5x5 peut également être proposé en RCP en particulier dans certaines situations :
- patients âgés : l’étude NACRE qui comparait la radiothérapie courte 5x5 à la CRT CAP50 chez le sujet de plus de 75 ans, PS 0-2, avec un ADK du rectum T3-T4 (<12 cm de la marge anale) ou T2 du très bas rectum montrait que le schéma court était associé à une meilleure tolérance et observance et une meilleure survie globale et spécifique que le schéma long, sans différence significative du taux de résection R0 ou de downstaging sous réserve d’un nombre limité de patients analysés par défaut de recrutement (François, 2021) ;
- patients métastatiques ayant des symptômes rectaux invalidants pour limiter la durée sans chimiothérapie efficace sur la maladie métastatique.
Techniques de radiothérapie associées à la radiothérapie externe ou utilisées seules :
- Radiothérapie de contact endocavitaire (50 KV). Son service médical rendu est reconnu par la HAS (2008) et les autorités sanitaires anglaises (National Institute for Health and Care Excellence, 2015) pour les lésions T1-2-3. Une étude randomisée montre avec un long recul que, associée à la radiothérapie externe, elle augmente les réponses cliniques complètes, augmente significativement (70 % vs 40 %) le taux de conservation sphinctérienne et permet parfois de conserver le rectum soit après exérèse locale soit après une simple surveillance minutieuse (« watch and wait ») en cas de réponse clinique complète (Ortholan, 2012). La RT endocavitaire peut être délivrée avant (tumeur < 5 cm), ou après CRT concomitante (tumeurs ≥ 5 cm). Les dernières études rétrospectives retrouvent des résultats encourageants (Frin 2017; Dhadda 2017; Sun Myint 2017). L’étude randomisée de phase III OPERA a montré qu’elle augmentait de façon significative le taux de préservation rectale comparée à la chimioradiothérapie pour des tumeurs T2-3 inférieures à 5 cm du bas et moyen rectum (Gérard, 2023).
- Curiethérapie à l’iridium, soit interstitielle soit endocavitaire, elle peut être utilisée après radiothérapie externe. Lors de la curiethérapie endocavitaire, la source radioactive se déplace en différentes positions à l’intérieur de l’applicateur positionné dans la cavité rectale. Il s’agit d’un traitement ambulatoire, ne nécessitant pas d’anesthésie générale qui permet de délivrer un complément de dose de 30 Gy en 3 séances de 10 Gy à une semaine d’intervalle après CRT externe. Dans une population de patients âgés inopérables traités par RT exclusive pour des tumeurs T1 à T4, la curiethérapie (30 Gy) après RT externe (40 Gy) permettait un taux de réponse complète de 86 % avec un taux de contrôle local à 2 ans de 71 % (80 % pour les T1T2, 67,1% pour les T3-4). Les toxicités consistaient en une rectite aiguë de grade 1 ou 2 pour tous les patients dans les 6 à 8 semaines suivant le traitement, et une rectite tardive de grade 3 pour 12 % des patients (Garant, 2019). Son efficacité en préopératoire (endocavitaire) montre qu’un petit volume d’irradiation < à 0,5 litre est efficace et très bien toléré (Vuong, 2007 ; Breugom, 2015).
5.4.1.3.5. Délai entre radiothérapie et chirurgie
Un délai prolongé augmente le taux de pièces opératoires stérilisées mais ne modifie pas la survie globale (François, 1999 ; Cotte, 2016).
Le délai standard après radiothérapie courte était inférieur à une semaine (Folkesson, 2005). Des données du registre colorectal néerlandais semblent indiquer un risque de fistule majorée en cas de chirurgie avant un délai de 4 jours (Sparreboom, 2018). Après un protocole court 25/5, une chirurgie différée à 6 semaines semble possible sans toxicité accrue (Petterson, 2015 ; François, 2021). L’essai Stockhlolm III évoque même une toxicité réduite dans ce cas. (Erlandsson, 2017).
L’essai GRECCAR 6 n’a pas montré de différence en termes de taux de réponse complète après un délai de 11 semaines versus 7 semaines après CRT longue. Au contraire, la morbidité était significativement majorée et la qualité de la résection moins bonne (Lefèvre, 2016).
Une étude espagnole rétrospective de 2023 avec score de propension sur plus de 1500 patients confirme qu’un délai d’attente prolongé au-delà de 12 semaines comparativement à un délai entre 8 et 12 semaines majore les risques de complications postopératoires Dindo I-II (OR=1,43 (1,04-1,97), p=0,03), d’exérèse du mésorectum incomplète (OR=1,89 (1,02-3,50), p=0,04) et de conversion en laparotomie (OR=3,14 (1,62-6,07), p=0,001), probablement à cause de la fibrose induite par la radiothérapie et majorée par l’allongement du délai d’attente. Dans cette étude par contre, un délai d’attente prolongé au-delà de 12 semaines comparativement à un délai entre 8 et 12 semaines était associé à une diminution du risque de mauvaise réponse histologique (i.e.TRG 2-3) (OR=0,47 (0,24-0,91), p=0,03), sans toutefois augmenter le taux de réponse complète et à une diminution du risque de récidive métastatique (HR=0,59 (0,36-0,96), p=0,04) mais sans modifier la survie globale à 5 ans (Guzman Y, 2023)
Une analyse rétrospective des essais coréens KROG 14-12, KROG 10-01 et KROG 11-02 semble indiquer un pic de la réponse complète histologique et du downstaging à 6-7 semaines pour la CRT longue tandis que le taux de réponse continuait à augmenter après 8 semaines pour les radiothérapies courtes (Lee, 2017).
Tous ces arguments semblent indiquer un délai optimal de la chirurgie entre 6 et 8 semaines après CRT longue et à au moins 6 semaines pour la radiothérapie courte.
5.4.1.3.6. Conservation du sphincter et radiothérapie
La conservation du sphincter n’est problématique que pour les tumeurs du bas rectum dans les situations suivantes :
- marge distale macroscopique prévisible < 1 cm
- marge latérale prévisible infra-millimétrique
- tumeur juxta-anale sans envahissement du sphincter interne
- envahissement du sphincter interne
- envahissement du sphincter externe
Le type de chirurgie est discuté en fonction de ces situations et de l’expertise du centre chirurgical : une résection antérieure du rectum peut être proposée dans les cas 1 et 2 alors que l’atteinte du sphincter externe impose la réalisation d’une amputation abdomino-périnéale. Pour les tumeurs juxta-anales ou envahissant le sphincter interne, une résection intersphinctérienne partielle ou totale peut être proposée. La discussion doit tenir compte de l’expertise de l’équipe chirurgicale et des risques de séquelles fonctionnelles qui restent importants (Rullier, 2013).
La La CRT préopératoire peut-elle augmenter les chances de conservation sphinctérienne ? Plusieurs essais de phase 2 suggèrent qu’elle pourrait modifier, en cas de bonne réponse, l’indication chirurgicale initialement retenue, et augmenter le taux de conservation sphinctérienne (Marks, 1993 ; Rouanet, 2002 ; Crane, 2003 ; Luna-Perez, 2003 ; Kim DW, 2006 ; Weiser, 2009). Néanmoins, les études randomisées et les méta-analyses ne confirment pas ces données issues de centres experts (Bujko, 2006 ; Gérard, 2012). La radiothérapie ou la CRT préopératoire n’ont pas démontré la possibilité d’augmenter la conservation sphinctérienne, mais le manque de standardisation de la chirurgie comme de la réévaluation sont des défauts dans ces études.
RÉFÉRENCES
strong>Le schéma actuel des bras témoins dans les essais randomisés est, en France, le protocole « CAP 50 » :
- strong>50 Gy en 25 fractions étalées sur 5 semaines (2 Gy par fraction) ou 28 fractions de 1,8 Gy
- strong>Chimiothérapie concomitante : capécitabine (1 600 mg/m2 réparties en 2 doses de 800 mg/m2 matin et soir de 800 mg/m2 les jours de radiothérapie), après contrôle de l’absence de déficit en DPD, à demander dès la première consultation.
- strong>Délai de la résection chirurgicale : 7 ± 1 semaines après la fin de la RT.
strong>* Règles de qualité de la radiothérapie : qu’elle soit utilisée en préopératoire ou en postopératoire, la RT doit être pratiquée avec les normes de qualité suivantes :
- Technique de RT conformationnelle 3D après acquisition d’images par TDM avec fusion IRM et/ou Tepscan, avec protection adaptée des organes critiques (anses intestinales, vessie, canal anal, sacrum et bassin). La radiothérapie conformationnelle avec modulation d’intensité (RCMI) permet de mieux protéger le grêle et la vessie.
- Il est exceptionnel d’inclure dans les volumes traités les ganglions iliaques externes ou obturateurs sauf extension tumorale antérieure. La limite antérieure du CTV reste en général en arrière des uretères.
OPTIONS
- CRT CAP 45 : 45 Gy et capécitabine 825 mg/m2 matin et soir les jours de radiothérapie, qui est la référence dans beaucoup de pays (Europe, USA).
- Chimiothérapie concomitante par 5FU continu IV.
- Radiothérapie préopératoire seule en cas de contre-indication à la chimiothérapie notamment chez les patients âgés et fragiles. Le schéma court 25/5 (dans un volume limité) est bien adapté à cette population âgée et permet d’éviter des déplacements nombreux.
- CRT postopératoire (à base de 5FU continu ou de capécitabine) en cas de chirurgie sans traitement préopératoire et de tumeur R1. La technique d’irradiation est voisine de celle utilisée en préopératoire. Elle englobe largement l’anastomose en cas de résection antérieure et la cicatrice périnéale en cas d’AAP (Park, 2011).
- Radiothérapie de contact endocavitaire (50 Kv) : seule pour les lésions T1N0 bien différenciées, toujours associée à la (chimio) radiothérapie externe en cas de lésion T2-3 < 5 cm dans une stratégie de préservation rectale chez des patients opérables ou non.
- Curiethérapie à l’iridium, interstitielle ou endocavitaire. Cette dernière peut être utilisée après radiothérapie externe en cas de lésion T2-3 <5cm dans une stratégie de préservation rectale.
5.4.1.4. Chimioradiothérapie (CT)
5.4.1.4.1. Chimiothérapie néoadjuvante
Une chimiothérapie première par capécitabine et oxaliplatine ne réduit pas l’efficacité d’une CRT seconde (Fernandez-Martos, 2010, Fernandez-Martos, 2019) et améliore l’observance par rapport à une chimiothérapie adjuvante. Par contre, elle n’augmente pas le taux de réponse complète histologique et ne réduit pas le taux d’évolutions métastatiques (Fernandez-Martos, 2019). D’autres études de phase II randomisées ont confirmé l’absence d’augmentation du taux de réponse complète histologique avec des chimiothérapies de type Capox ou Folfox (Maréchal 2012, Dewdney 2012, Borg 2019).
L’étude randomisée PRODIGE 23 (Conroy, 2020 ; Bascoul-Mollevi, 2023 ; Conroy, 2023) a évalué l’intérêt d’un traitement néoadjuvant total (TNT : chimiothérapie d’induction par FOLFIRINOX puis CRT CAP50) pour les ADK du rectum T3-4Nx, <15 cm de la marge anale. Dans cette étude, 231 patients recevant ce TNT ont été comparés à 230 patients recevant le traitement standard par CRT CAP50. Seulement 9,5 % des patients avaient une tumeur classée cT3N0 au bilan initial et 90 % étaient cN+. Dans les 2 bras, les patients recevaient obligatoirement un traitement adjuvant après la chirurgie par 6 cycles de mFOLFOX6 (ou 4 cycles de capecitabine) pour le bras expérimental et 12 cycles de mFOLFOX6 (ou 8 cycles de capecitabine) pour le bras standard. Les patients étaient opérés à 7 semaines de la fin de leur traitement néoadjuvant. Le TNT s’est avéré un traitement sûr avec des toxicités gérables. Il n’a affecté ni la faisabilité de l’ensemble du traitement, ni sa tolérance, ni la qualité de vie globale, plutôt meilleure dans le du bras TNT (mais différence non significative, p=0.076). La chimiothérapie adjuvante était mieux tolérée dans le groupe TNT (toxicités grade 3-4 : 44,4 % vs 74,1, p<0,001 ; neuropathie périphérique 11,7 % vs 20,7 %, p=0,033), bien que la dose cumulée médiane d’oxaliplatine administrée ait été supérieure dans le groupe TNT (808 mg/m2 vs 745 mg/m2, p=0,009). Il y avait plus de chirurgies non curatives (découverte per-opératoire de métastases, tumeur non-résécable ou résection R2) dans le groupe standard (3,7 % vs 0 %, p=0,007). Les résultats anatomopathologiques montraient des taux de réponses complètes (ypT0N0) nettement supérieurs dans le groupe TNT (27,8 % vs 12,1 %, p<0,001). Les résultats oncologiques à 5 ans sont en faveur du groupe TNT avec une amélioration de la survie sans rechute (73,1% vs 65,5 %; p=0,048) et une amélioration de la survie sans métastase (77,6% vs 67,7%; p=0,011). Il n’y a pas de différence significative sur le taux de récidive locale (4,7 % vs 6,4%). La survie globale est significativement supérieure dans le groupe TNT (86,9% vs 80,0% ; p=0,033). Après récidive métastatique, la survie n'est pas réduite dans le bras TNT (médiane de survie de 44,4 vs 39,4 mois, ns).
Le traitement néoadjuvant total peut donc être considéré comme une option thérapeutique pour les ADK du rectum T3-T4Nx (recommandation : grade A). Toutefois, en l'absence de validation formelle de la chimiothérapie adjuvante après CRT dans les stades ypN0, et compte tenu du pronostic favorable des patients en réponse complète histologique, il n’y a pas lieu de réaliser une chimiothérapie adjuvante pour les stades ypCR ou ypT1-2N0 (accord experts).
L’essai RAPIDO (van der Valk, 2020 ; Bahadoer, 2021 ; Bahadoer 2022 ; Dijkstra, 2023 ; Bahadoer, 2023) a également évalué l’intérêt d’un TNT. Dans cet essai randomisé, étaient inclus les patients considérés à haut risque de récidive : ADK <16 cm de la marge anale avec au minimum 1 facteur de risque sur l’IRM pelvienne initiale parmi les facteurs suivants : cT4, envahissement veineux extramural, CRM ≤1mm, envahissement des ganglions latéraux (cN2 ou métastatiques). Les patients étaient randomisés entre le bras expérimental TNT (radiothérapie courte 5x5 Gy suivie d’une chimiothérapie de « consolidation » par 6 cycles de « consolidation » par CAPOX ou 9 cycles de FOLFOX4 puis chirurgie à 40 semaines, 4 semaines après le dernier cycle de chimiothérapie, sans chimiothérapie adjuvante) et le bras contrôle (CRT CAP50 suivie d’une chirurgie après 6 à 10 semaines d’attente puis chimiothérapie optionnelle selon les centres par 8 cycles de CAPOX ou 12 cycles de FOLFOX4). Dans le bras expérimental, 85% des patients ont pu recevoir la totalité de la chimiothérapie préopératoire, les toxicités de grade 3-4 étaient de 47,6 % pendant la chimiothérapie de consolidation, et la morbidité de grade 4-5 significativement augmentée.
La tolérance globale des traitements semble similaire.
Parmi les 398 patients opérés dans le bras standard, 46,9% ont reçu une chimiothérapie adjuvante et 63 % d’entre eux ont reçu tous les cycles programmés, 53% n’en ont pas reçu. Parmi ces derniers, la chimiothérapie n’était pas programmée par le centre dans 75% des cas, pour 14%, existait une contre-indication (complications, toxicité ou évolution métastatique) et pour 11% une absence d’indication (bonne réponse histologique). Dans une actualisation parue dans ESMO Open, les investigateurs évoquent un bénéfice de 20 à 25% en DFS pour les patients ayant reçu une chimiothérapie adjuvante postopératoire (Dijkstra, 2023).
Le critère principal d’évaluation était l’échec du traitement lié à la maladie définie par la survenue d’un des évènements suivants : récidive locorégionale, métastase à distance, nouveau cancer colorectal, décès lié au traitement. Le taux de réponse complète anatomopathologique était plus important dans groupe TNT (28 % vs 14 %, p<0,0001). Alors que les résultats étaient statistiquement significatifs à 3 ans pour l'objectif principal, la probabilité d’échec du traitement lié à la maladie, les résultats ne sont plus significatifs avec 5 ans de recul. La survie sans métastases reste significativement améliorée (77 % versus 69,6 % ; P = 0,01) mais l'augmentation des récidives locales dans le bras TNT est significative (10,2 % versus 6,1 % ; HR 1,61 [1,04 – 2,5] ; p = 0,027). Le risque cumulé à 5 ans de récidive locorégionale atteint 25 % dans le bras expérimental contre 13 % dans le bras CRT préopératoire (p=0,03). Ceci est dû en partie à des mesorectums plus souvent incomplets dans le bras expérimental (44/441 versus 26/428) ; l’excès significatif de récidives locales dans le bras expérimental est également observé en cas de chirurgie R0 (7.2% vs 3.9%, p=0,049). Le risque cumulé à 5 ans d’apparition de métastases à distance est réduit dans le groupe TNT (23,0 % vs 30,4 %, HR=0,73 [0,57-0,93]; p=0,011)). À partir du diagnostic de métastase, la survie est réduite de 6 mois dans le bras expérimental (p = 0,04). La survie globale à 5 ans n’était pas impactée par le bras de traitement (81,7 % pour le groupe TNT vs 80,2 % pour le groupe contrôle, HR=0,91 [0,70-1,19], p=0,50). Ceci confirme les limitations de l'étude : progressions sous traitement avant chirurgie chez les mauvais répondeurs à la TNT (taux de pT4 sur pièce opératoire plus élevé dans bras TNT), taux de résection complète du mésorectum inférieur dans le bras TNT (78 % versus 85 %, P = 0,03), analyse non effectuée en intention de traiter. De ce fait, l'objectif principal de l'étude, échec du traitement liés à la maladie, n'est plus atteint à 5 ans (27,8 % versus 34 %, HR 0,79 [0,63 – 1.00], p=0,048. En effet, d'une analyse intermédiaire en cours d’étude, l'analyse finale devait atteindre p < 0,0424. Il faut par ailleurs rappeler les 2 changements de critère d’évaluation et les 3 changements d’hypothèses statistiques en cours d’étude, l’absence de relecture centralisée des IRM à l’inclusion et de contrôle qualité, et le déséquilibre des bras en termes de chimiothérapie. L'augmentation significative du taux de récidives locales, associée à l'absence d'atteinte de l'objectif principal, ne permet plus aujourd'hui de recommander cette stratégie thérapeutique pour l’ensemble des patients.
L'essai PROSPECT a comparé une chimiothérapie néoadjuvante par FOLFOX avec utilisation sélective d’une CRT à une CRT préopératoire avant TME pour des patients atteints de cancers du rectum de bon pronostic (Schrag, 2023 ; Basch, 2023.
Les critères d'éligibilité ont compris : tumeur entre 5 et 12 centimètres de la marge anale en rectoscopie, classée T2N1, T3N0 ou T3N1 (par IRM, TDM ou écho endoscopie) justifiant une CRT préopératoire, marge circonférentielle ≥ 3 mm, éligible à une conservation sphinctérienne, et prise en charge par un chirurgien accrédité en TME. Les tumeurs T4, celles du bas rectum et celles ayant plus de 4 ganglions périrectaux > 10 mm ou des ganglions latéraux sur l'imagerie étaient exclues. Les tumeurs étaient considérées comme N0 s'il n'y avait aucun ganglion périrectal ≥ 5 mm. Globalement, les patients inclus sont des tumeurs de bon pronostic ou de pronostic intermédiaire selon la classification de l'ESMO.
Les patients ont été randomisés (1:1) entre une CRT de 50,4 Gy sensibilisée par du 5-FU ou de la capécitabine puis chirurgie, et une stratégie expérimentale associant 6 cycles de mFOLFOX6 suivis d'une nouvelle évaluation. Si la régression tumorale dans un axe était > 20 %, la TME était réalisée d’emblée ; si la régression était < 20 %, une CRT préopératoire était administrée. Dans les deux bras, une chimiothérapie adjuvante avec 8 cures de Folfox était suggérée aux investigateurs.
La DFS (événements définis comme un décès de toute cause ou une rechute) était l’objectif principal. Les critères d'évaluation secondaires comprenaient entre autres la survie globale, le temps jusqu'à récidive locale, la résection R0, la réponse pathologique complète (ypCR), la qualité de vie et la toxicité.
Au total, 1194 pts ont été randomisés et 1128 ont initié un traitement protocolaire. Seuls les patients ayant initié un traitement sont analysés (analyse per protocol). L'âge médian était de 57 ans, 65,5% étaient des hommes et 61,8% avaient des tumeurs N+. La distance moyenne par rapport à la marge anale était de 8 cm, avec 64 % de tumeurs du tiers moyen, 21% de haut rectum et 15 % de bas rectum. 85 % des tumeurs ont été classées par IRM, les autres par TDM ou écho endoscopie. La marge radiale à l'inclusion et l'extension veineuse extramurale ne sont pas décrits. 9% des patients du groupe expérimental ont reçu une CRT préopératoire et 1,4 % une CRT postopératoire. Une chimiothérapie adjuvante a été administrée à 74,9 % des patients du bras expérimental et 77,9 % des patients du bras CRT. Le suivi médian a été de 58 mois. Les taux de résection R0 ont été de 90,4 % dans le bras expérimental et de 91,2 % dans le bras CRT. Les taux de réponse pathologique complète étaient de 21,9% et 24,3% dans les bras expérimental et CRT respectivement. Ces taux de réponse complète sont les plus élevés de la littérature à la fois pour la chimiothérapie de type Folfox et pour une CRT préopératoire. Les taux de survie sans récidive à 5 ans sont de 80,8% et 78,6% dans les bras expérimental et CRT d'emblée respectivement [HR 0,92 (0,74 ;1,14)], p= 0,005 pour la non infériorité. Les résultats en intention de traiter sont similaires. Les taux de survie globale à 5 ans sont de 89,5% et 90,2% dans les bras expérimental et CRT respectivement [HR 1,04 (0,74 ;1,44)]. La stratégie de chimiothérapie à la place d’une radiochimiothérapie ne peut toutefois être conseillée après 70 ans, où la DFS apparait inférieure dans le bras FOLFOX [HR 1,82 (0,96 ; 3,47)], dépassant la marge de non-infériorité de 1,29.
Une analyse des PRO (Patient Reported Outcomes) de cette étude a été publié dans le JCO en 2023 (Basch, 2023). Dans cette analyse, les patients rapportaient durant le traitement néoadjuvant significativement moins de diarrhées et une meilleure fonction digestive globale dans le bras FOLFOX mais moins d’anxiété, d’anorexie, constipation, dépression, dysphagie, dyspnée, œdème, fatigue, mucite, nausées et vomissements, et de neuropathie et dans le bras CRT. A 12 mois après la chirurgie, les patients du bras FOLFOX rapportaient mois de fatigue, neuropathie et une meilleure fonction sexuelle comparativement aux patients du bras CRT (p<0,05).
Au total, pour les patients atteints de cancers du moyen ou du haut rectum sans aucun critère de pronostic défavorable (dont marge circonférentielle ≥ 3 mm et moins de quatre ganglions envahis) une chimiothérapie préopératoire de trois mois par FOLFOX peut remplacer une CRT préopératoire, et donc être une option thérapeutique chez les patients de moins de 70 ans trop fragiles pour recevoir un traitement néoadjuvant total (TNT) de type PRODIGE 23, ou chez les femmes en âge de procréer si l’on souhaite préserver la fertilité (recommandation : grade B).
Une étude chinoise (essai FOWARC) ne montre pas de supériorité de la CRT avec oxaliplatine, avec poursuite du FOLFOX en postopératoire, sur une chimiothérapie péri-opératoire par FOLFOX, qui peut donc être proposée aux patients ayant un antécédent d’irradiation pelvienne ou une autre contre-indication à la radiothérapie (Deng Y, 2019) (recommandation : grade B).
5.4.1.4.2. Chimiothérapie adjuvante
Actuellement, malgré la diminution du risque de récidive locale, le risque de récidive métastatique après exérèse d’un cancer du rectum reste de l’ordre de 20 % à 60 % en fonction du stade TNM initial. Dans les essais thérapeutiques récents (Sauer, 2004 ; Kapiteijn, 2001 ; Gérard, 2006 ; Bosset, 2006 ; Sebag-Montefiore, 2009 ; Gérard, 2012) ce risque pour les cancers du rectum T3 ou T4 restait de 32 à 38 %.
Chimiothérapie par 5FU monothérapie
Parmi les études randomisées historiques, peu ont démontré le bénéfice d’une chimiothérapie adjuvante par 5FU et acide folinique (AF) dans le cancer du rectum. Il existe des arguments dans la littérature en faveur de la chimiothérapie adjuvante par fluoropyrimidines mais, en raison de l’étalement des études sur de nombreuses années, de l’hétérogénéité des patients inclus, de la chirurgie réalisée (exérèse ou non du mésorectum), des protocoles de CRT et de chimiothérapie adjuvante utilisés, de l’observance médiocre, toute conclusion avec des niveaux de preuve élevés est impossible. Les données des « essais historiques » publiés avant 1990 de chimiothérapie adjuvante (Bachet, 2010), les méta-analyses des essais de chimiothérapie adjuvante (Petersen, 2012) et surtout l’étude QUASAR (QUASAR Collaborative Group, 2007) suggèrent cependant qu’une chimiothérapie adjuvante par fluoropyrimidines (5-FU par voie intraveineuse ou capécitabine), diminue le risque de récidive métastatique et améliore la survie après chirurgie à visée curative d’un cancer du rectum de stade II ou III, y compris après RT préopératoire. Ce bénéfice semble similaire à celui observé dans le cancer du côlon.
La méta-analyse Cochrane de 2012 a analysé 21 essais randomisés (dont 11 essais occidentaux et 10 essais japonais) publiés entre 1981 et 2011 avec un total de 16 215 CCR dont 9 785 cancers du rectum (Peterson, 2012). Toutes comprenaient dans le bras traitement adjuvant une chimiothérapie à base de fluoropyrimidine. Dans 20 de ces essais, les patients n’avaient pas reçu de traitement néoadjuvant. En termes de SG, la chimiothérapie adjuvante permettait de diminuer significativement le risque relatif de décès de 17 % par rapport à une surveillance simple (HR = 0,83 ; IC 95 % : 0,76-0,91), mais avec une hétérogénéité entre les études (p = 0,09 pour un risque alpha fixé à 10 %). Le risque de récidive locale ou métastatique était également diminué de 25 % (HR = 0,75 ; IC 95 % : 0,68-0,83) mais avec aussi une hétérogénéité entre les études (p = 0,03) qui ne permettait pas de conclusion claire.
L’étude 22921 de l’EORTC n’a pas montré d’amélioration de la survie globale pour les patients recevant, après radiothérapie ou CRT préopératoire suivie de chirurgie, 4 cures de chimiothérapie adjuvante par 5FU et AF. Dans cet essai, seulement 43 % des patients ont reçu la totalité de la chimiothérapie prévue par le protocole et 28 % des patients n’ont jamais débuté la chimiothérapie adjuvante (Bosset, 2006), les difficultés d’observance étant fréquentes pour les stratégies postopératoires. Avec un recul de 10 ans cette chimiothérapie adjuvante n’a procuré aucun gain de survie sans rechute ou globale (Bosset, 2014).
Quatre essais, dont celui de l’EORTC, ont été réunis dans une méta-analyse récente. (Breugom, 2015). Elle regroupait les données individuelles de 1 196 patients avec une tumeur située à moins de 15 cm de la marge anale, classée de stade II-III et opérée avec résection R0 après radiothérapie ou CRT néoadjuvante, avec ou sans chimiothérapie adjuvante postopératoire par fluoropyrimidines. Avec un suivi médian de 7 ans, la chimiothérapie adjuvante ne permettait d’augmenter ni la SG (HR = 0,97 ; IC 95 % : 0,81-1,17 ; p = 0,77) ni la SSR (HR = 0,91 ; IC 95 % : 0,77-1,07 ; p = 0,23). Il n’existait pas de différence pour la SSR à 5 ans avec ou sans chimiothérapie (35,5 % vs 36,5 %, p = 0,523). Cependant, en analyse de sous-groupes, les auteurs mettaient en évidence un bénéfice du traitement adjuvant chez les patients avec une tumeur située entre 10 et 15 cm de la marge anale (haut rectum) en ce qui concerne la SSR (HR = 0,59 ; IC 95 % : 0,40-0,85 ; p = 0,005) et la SSR à distance (HR = 0,61 ; IC 95 % : 0,40-0,94 ; p = 0,025). Cette méta-analyse a entrainé plusieurs lettres, discutant sa méthodologie. Seuls les patients avec un cancer du rectum ypTNM stade II et III ont été inclus, les patients avec un stade I ou en réponse complète histologique ont été exclus de l’analyse. Ainsi les patients les plus sensibles à la CRT ont été exclus et les patients les plus résistants gardés dans cette analyse. Il faut noter la faible observance de la chimiothérapie postopératoire avec seulement 48 à 73 % de patients ayant reçu la chimiothérapie adjuvante prévue.
Chimiothérapie par 5FU et oxaliplatine
Les essais MOSAIC et C07 du NASBP ayant établi les standards de chimiothérapie pour le cancer du côlon autorisaient l’inclusion des cancers du haut rectum (tumeur débutant à 12 ou 15 cm de la marge anale, pas de radiothérapie préopératoire). Trois autres essais randomisés ont étudié l’intérêt de l’ajout de l’oxaliplatine à une fluoropyrimidine. (Hong, 2014 ; Rodel, 2015 ; Schmoll, 2021).
L’essai de phase II sud-coréen ADORE (ADjuvant Oxaliplatin in REctal cancer) chez 321 patients stades II et III, dont 20 % âgés de plus de 65 ans réséqués R0 (TME après CRT) a comparé un traitement postopératoire de 4 mois par 5-FU + AF à FOLFOX 6 modifié (ou FOLFOX 4s, avec oxaliplatine à 85 mg/m2). La SSR à 3 ans était significativement plus importante dans le bras FOLFOX 6m (72 % vs 63 %, p = 0,047) et cela a été confirmé à 6 ans (Hong YX,2019). La SG à 3 ans était supérieure dans le bras FOLFOX 6m dans la première publication des données à 3 ans, mais elle n’est pas supérieure, à 6 ans, à celle observée sous 5FU-acide folinique. En analyse de sous-groupes, le bénéfice relatif du FOLFOX 6m pour la SSR était plus important et n’était significatif que pour les stades III : 67 % vs 57 % (HR 0,60 ; IC 95 % : 0,37-0,98 ; p = 0,04). Dans le sous-groupe des patients ypN2, la survie globale était améliorée par le FOLFOX (H= 0,42 ; IC 95% 0,18-0,96 ; p=0,004) mais chez un nombre réduit de patients (n=63). L’essai chinois FORWARC chez 495 patients, n’a pas montré de supériorité du FOLFOX pendant la radiothérapie et poursuivi en post-opératoire6par rapport à l’association LV5FU2-radiothérapie préopératoire, avec poursuite du LV5FU2 en postopératoire (Deng Y,2019).
Enfin, deux essais de phase III, CAO/ARO/AIO-04 et PETACC 6, ont évalué l’ajout d’oxaliplatine à la chimiothérapie néoadjuvante et à la chimiothérapie adjuvante chez des patients avec un cancer du rectum cT3-T4 ou cN+M0 publiés avec des conclusions discordantes (Rodel, 2015 ; Schmoll 2021).
Le critère principal de jugement était dans ces 2 essais la SSR à 3 ans. Les patients étaient opérés avec TME et la durée de la chimiothérapie adjuvante était de 4 mois. L’étude CAO/ARO/AIO-04 a inclus 1 265 patients entre 2006 et 2010 et a évalué le 5-FU (continu pendant la RCT, bolus en postopératoire) versus un schéma avec oxaliplatine pendant la CRT, puis FOLFOX 6 après la résection pendant 4 mois (100 mg/m² d’oxaliplatine) (Rodel, 2015). Le traitement postopératoire a été reçu par 80 % des patients. Dans le bras FOLFOX 6, la SSR à 3 ans était significativement plus importante que dans le bras 5-FU (76 % vs 71 %, HR 0,79 ; p = 0,03). Les courbes de survie globale étaient strictement identiques. Il est difficile de faire la part de la responsabilité de l’intensification du traitement préopératoire et de l’adjonction de l’oxaliplatine au traitement postopératoire. (Rodel, 2015).
L’étude PETACC-6 (Pan European Trial Adjuvant Colon Cancer) a inclus 1 094 patients et utilisé la capécitabine seule ou associée à l’oxaliplatine (XELOX) pour 6 cycles (Schmoll, 2014). A l’analyse intermédiaire avec un suivi médian de 31 mois, les patients dans le bras capecitabine avaient une SSR à 3 ans similaire à celle des patients du bras XELOX (75 %, vs 74 % p = 0,78 ; HR 1,04 ; IC 95 % : 0,81-1,33). Dans le sous-groupe des patients ypTxN+ sur la pièce (n = 283), les résultats n’étaient pas meilleurs (IC 95 % : 0,67-1,42). Les résultats finaux à plus de 5 ans (Schmoll, 2021) ne montrent pas de différence de survie sans maladie (critère principal de l’étude) pour les ypN+ comme pour les ypN-, du taux de récidive à 5 ans et de la survie globale.
Au total sur 4 études associant à l’oxaliplatine du 5FU intraveineux, dont deux de phase III, deux seulement sont positives sur la SSR, sans effet sur la survie globale, dont une étude de phase III qui a introduit l’oxaliplatine dès le traitement préopératoire. Une étude associant l’oxaliplatine à la capécitabine en population occidentale est négative. L’étude coréenne, sans oxaliplatine dans la CRT préopératoire, permettrait de retenir une présomption d’efficacité de l’adjonction de l’oxaliplatine au 5FU intraveineux dans le traitement adjuvant avec un niveau de preuve 2, mais elle n’est pas confirmée par l’étude chinoise qui a introduit l’oxaliplatine dès le traitement préopératoire. L’association Xelox ne peut pas être recommandée. Il reste donc difficile de conclure sur l’intérêt ou non de l’adjonction de l’oxaliplatine au 5FU dans cette situation.
Les anticorps anti-EGFr (cetuximab) et les anti-angiogéniques (bevacizumab) testés en association avec la radiothérapie et/ou la CRT n'ont pas démontré d’intérêt et ne doivent pas être utilisés. Le bevacizumab ou le cetuximab n’ont plus de place dans le traitement adjuvant du cancer du rectum, en raison de l'absence de données dans le rectum (pas d'essai randomisé évaluant la SSM à 3 ans) et de l'absence d'efficacité en traitement adjuvant des cancers du côlon (de Gramont, 2012 ; Taieb, 2012).
Cas particulier des patients en réponse complète après CRT
Aucune étude n’a à ce jour clairement conclu sur le bénéfice d’une chimiothérapie adjuvante pour les patients en réponse complète après CRT. En 2015, Maas et al. dans une analyse poolée de 13 études colligeant plus de 3300 patients ne retrouvaient pas d’impact de la chimiothérapie adjuvante pour le sous-groupe de patients en réponse complète après CRT (290 patients avec chimiothérapie vs 608 patients sans chimiothérapie) (Maas M, 2015). Plus récemment une analyse de cohorte américaine sur 2764 patients en réponse complète après CRT avec utilisation de score de propension et comparant 741 patients avec chimiothérapie adjuvante et 741 patients sans chimiothérapie adjuvante retrouvait un impact favorable de la chimiothérapie adjuvante sur la survie globale (HR=0,50 ; 95% IC : 0,32-0,79 ; p=0,005) (survie à 5 ans : 94,7% avec chimiothérapie vs 88,4% sans chimiothérapie, p=0,005) , en particulier pour les patients initialement cT3/T4N+ (Polanco, 2018). Cette dernière étude semble plus puissante que la précédente mais reste une étude rétrospective dont les résultats sont à prendre avec précautions. La chimiothérapie dans le cas particulier des patients en réponse complète après CRT peut être considérée comme une option à discuter en RCP.
5.4.1.4.3 Chimiothérapie à visée palliative
Dans un essai de phase II non randomisé de la FFCD chez 65 patients présentant un adénocarcinome rectal métastatique, la trichimiothérapie par FOLFIRINOX (Bachet JM, ASCO 2017) a montré un taux de contrôle de la maladie à 4 mois de 94 % (revue indépendante), une réduction des rectorragies présentes initialement dans 42 % des cas, à 3 % après 8 cycles, tandis que la prévalence du syndrome rectal passait de 60% à 7 %. Ce type de traitement peut donc être proposé, chez les patients qui peuvent la supporter, à visée symptomatique (recommandation : grade C).
5.4.1.4.4. Cas particulier des adénocarcinomes rectaux dMMR/MSI
Une étude américaine de phase II dirigée par le Memorial Sloan Kettering Cancer Center a évalué l’efficacité d’un traitement exclusif par immunothérapie (dostarlimab, anticorps monoclonal anti PD) chez une cohorte prospective de 18 patients (12 dans la publication) tous atteints d’un adénocarcinome rectal stade II ou III (staging avec IRM et pet-scan) dMMR en immunohistochimie. Le traitement consistait en 9 injections de 500 mg de dostarlimab toutes les 3 semaines soit 6 mois de traitement qui devait initialement être suivi par une radiochimiothérapie puis une chirurgie avec exérèse du mesorectum. En cas de réponse clinique complète définie par une disparition de la tumeur au toucher rectal, à l’examen endoscopique (examens réalisés à 6 semaines, 3 mois et 6 mois sous immunothérapie) et en IRM rectale (examens réalisés à 3 mois et 6 mois), il a été proposé une surveillance et de ne pas passer à l’étape thérapeutique ultérieure. Les objectifs de cette phase II étaient doubles : taux de réponse clinique complète 12 mois après la fin de l’immunothérapie ou taux de réponse complète pathologique chez les patients opérés ET taux de réponse clinique à l’immunothérapie. Sur les 12 premiers patients ayant complété l’immunothérapie avec un médiane de 12 mois de suivi depuis l’inclusion, le taux de réponse clinique complète était de 100 % sans aucun patient irradié ou opéré. Tous les patients ayant complété l’immunothérapie présentaient également une réponse complète métabolique au pet-scan. Aucune toxicité de grade 3 ou 4 n’a été enregistrée. Aucune différence de réponse n’était observée entre les dMMR/MSI sporadiques ou ceux associés à un syndrome de Lynch (Cercek, 2022).
Les résultats préliminaires d’une phase II randomisée chinoise non comparative ont également été publiés. Dans cette étude en cours, les patients avec adénocarcinome rectal dMMR/MSI T3-T4 ou tout T N1 étaient randomisés entre 3 mois de toripalimab (anticorps anti PD1) avec ou sans celecoxib pendant 3 mois puis opérés. Sur les 34 patients opérés, le taux de réponse complète pathologique, objectif principal de l’étude était de 88% dans les 17 patients du bras combiné et 65 % dans le bras monothérapie. Le taux de toxicité grade 3-4 était de 3 % (Hu, 2022)
Enfin une cohorte prospective de 19 patients chinois dont 16 traités en première intention par immunothérapie retrouve également une réponse clinique complète chez tous les patients (Wang, 2022).
Malgré le manque de suivi et les faibles effectifs de ces cohortes, tout patient atteint d’adénocarcinome rectal dMMR/MSI doit être discuté en RCP pour une proposition d’immunothérapie soit en essai clinique (PRODIGE 90 – PREDIR-NEOREC) soit hors essai. Un monitorage soigneux de la réponse clinique doit être mis en place et le patient prévenu du caractère préliminaire de cette approche thérapeutique. Il doit être informé de la nécessité d’enchainer sur un traitement standard (traitement néoadjuvant puis chirurgie) en cas d’absence de réponse complète (accord d’experts).
Rappelons qu’en cas d’adénocarcinome rectal métastatique dMMR/MSI, le traitement standard de première ligne est également l’immunothérapie (pembrolizumab IV 200 Mg tous les 21 jours) après les résultats de l’étude KEYNOTE177 montrant la supériorité de cette approche sur la chimiothérapie. (André, 2020).
5.4.1.5. Stratégie de conservation rectale
Si l’association de CRT préopératoire suivie de chirurgie avec TME a réduit les récidives locales à des taux inférieurs à 5 %, elle s’accompagne d’une morbidité importante et de séquelles fonctionnelles anorectales, urinaires et sexuelles.
Dans la littérature, la CRT permet une stérilisation complète pour 10 à 20 % des patients et jusqu’à 28 % des patients si on y associe une chimiothérapie néoadjuvante (RAPIDO, Prodige 23). De plus, les patients bons répondeurs à la CRT ont un pronostic plus favorable (Caprici, 2008). Ainsi la chirurgie pourrait être évitée pour les bons répondeurs après traitement néoadjuvant amenant au développement de stratégies de préservation d’organe opportuniste ou programmée.
Deux stratégies de préservation d’organe sont proposées aujourd’hui. D’une part, la stratégie du Watch and Wait consiste à sursoir à la chirurgie et à proposer aux patients en réponse complète après TNT (total neodjuvant treatment) une surveillance attentive, quel que soit le stade initial de leur maladie. D’autre part, la stratégie définie d’emblée pour les petites tumeurs (T2 ou T3 de moins de 4 cm) propose une exérèse de la cicatrice tumorale après CRT selon les modalités de l’essai GRECCAR 2 (Rullier, 2017 et 2020).
Stratégie « Watch and wait »
Une première approche opportuniste, également appelée Watch and Wait (W&W), consiste en une surveillance des patients considérés en réponse complète après CRT ou traitement néoadjuvant total, quel que soit le stade initial. Cette approche a été développée par Habr-Gama et al. au Brésil et publiée dans 18 articles différents, soit une cohorte de 361 patients, avec des taux de réponse complète variant de 20 à 30 %. Les taux de récidive locale étaient de 5 à 25 % selon les articles et le délai d’évaluation de la réponse clinique complète, tout en gardant une survie sans maladie à 5 ans de 52 % et une survie globale de 85 %. Ces séries incluaient principalement des tumeurs cT2 ou cT3 mais également des tumeurs cT4. La réponse clinique complète était définie comme l’absence de résidu tumoral clinique (absence de tumeur, d’ulcère et biopsie négative) et les patients étaient surveillés de façon mensuelle. Néanmoins, le délai d’évaluation de la réponse complète variait selon les articles de 8 semaines à 14 mois. D’autres équipes ont publié des taux de récidives locales plus importants, avec une hétérogénéité importante parmi les séries publiées quant aux stades initiaux des tumeurs, aux traitements (doses et chimiothérapie associée), à la définition de la réponse complète et aux stratégies de surveillance (Glynne-Jones, 2012). Par ailleurs, ces patients en réponse complète ont après chirurgie rectale traditionnelle un pronostic excellent (94 % de survie globale et 85 % de survie sans récidive à 8 ans sur une série de 527 patients dans l’étude de Caprici et al.), avec des complications fonctionnelles éventuelles mais une surveillance probablement moins astreignante (Caprici, 2008).
L’analyse de la cohorte internationale de watch and wait (international watch and wait database) montre que plus de 25% des patients considérés en réponse complète et suivi dans le cadre d’une stratégie W&W vont réévoluer localement dans les 3 ans avec un risque qui se prolonge même au-delà des 3 ans (Fernandez, 2023). Par ailleurs cette étude montre que les patients en récidive locale après réponse complète présentent un risque élevé de développer des métastases à distance (24,1% chez les patients en récidive local vs 5,8% chez les patients sans récidive locale, p>0,001.
La séquence entre chimiothérapie et CRT (induction ou consolidation) est également discutée en vue d’augmenter le taux de conservation rectale. L’essai OPRA a randomisé 324 patients avec des tumeurs rectales T3-4, N+, entre CRT précédée ou suivie de chimiothérapie par Folfox. Ce traitement néoadjuvant était suivi de TME ou surveillance en fonction de la réponse tumorale. L’objectif principal de cet essai, défini comme une survie sans maladie à 3 ans de 85 % en comparaison avec une cohorte historique, n’a pas été atteint. Par contre, la survie sans TME à 3 ans (objectif secondaire) était de 41 % (IC95% : 33-50) dans le groupe chimiothérapie d’induction contre 53 % (IC95% : 45-62) dans le groupe chimiothérapie de consolidation (Garcia-Aguillar, 2022). Il n’y avait pas de différence de survie sans récidive locale, survie sans métastase ou survie global entre les 2 groupes. Enfin, il n’y avait pas de différence de survie sans récidive entre les patients traités par TME d’emblée ou par TME en cas de récidive. Les taux de « regrowth » étaient respectivement de 40% et 27%, p=0,03 dans les bras induction et consolidation. Le recul de cette étude reste pour le moment faible (3 ans), avec un risque de voir apparaitre des récidives locales tardives ne permettant pas de conclure définitivement sur les résultats de cette étude. Par ailleurs le taux important de patients refusant la chirurgie de rattrapage (14%) dans cette étude doit alerter sur ce mode de stratégie opportuniste. Enfin il y a dans cette étude un taux important d’amputation abdominopérinéale lors des chirurgies de rattrapage dans le bras consolidation (56% vs 45%) laissant présager des difficultés opératoires lors de ces chirurgies faites très à distance de la fin de la CRT.
Même si les études récentes suggèrent que la préservation rectale est possible pour 30 à 50 % des patients traités par TNT, l’évaluation de la réponse reste un challenge et les modalités de surveillance restent mal définies. L’enjeu est de laisser le temps nécessaire à l’obtention d’une réponse complète sans prendre le risque d’une évolution métastatique ou de compliquer une chirurgie de rattrapage en cas de récidive locale. Une stratégie de surveillance clinique, IRM (TRG) et métabolique (TEP-TDM) répétée tous les 2 mois sur une période de 6 mois a été évaluée dans une série rétrospective. Parmi 314 patients, 50 patients ont ainsi été sélectionnés en programme de watch and wait, avec un taux de préservation rectale de 88 % et une survie sans maladie à 3 ans de 67 % (Boubaddi, 2022), mais un taux de rechute local de 26%.
Stratégie d’exérèse locale après chimioradiothérapie
L’essai GRECCAR 2 est le seul essai randomisé comparant une exérèse locale (EL) à la TME chez les patients bons répondeurs après CRT (Rullier, 2017 et 2020).
De mars 2007 à septembre 2012, 186 patients ont été traités par CRT (CAP50), 148 bons répondeurs ont été randomisés, 3 patients exclus et 145 patients ont été analysés : 74 dans le groupe EL et 71 dans le groupe TME. Dans le groupe EL, 26 patients ont eu une TME complémentaire en raison d’une réponse histologique insuffisante (pT2-3 ou R1). En intention de traiter, il n’y avait pas de différence significative sur tous les composants du critère principal d’évaluation composite (décès, récidives, complications chirurgicales sévère, séquelles fonctionnelles) entre les groupes EL et TME. Cependant, les analyses complémentaires ont montré l’influence du type de chirurgie complémentaire (EL vs. TME vs. EL suivie de TME), sur la morbidité chirurgicale (12 % vs 22 % vs 46 %, p=0,003) et les effets secondaires (19 % vs 30 % vs 59 %, p=0,001). Les résultats histologiques ont montré 61 % de bonne réponse (ypT0-1) ainsi qu’une association entre les réponses ganglionnaire et tumorale avec 0 %, 0 %, 8 % et 40 % ypN1 chez les ypT0, T1, T2 et T3, respectivement. L’analyse de l’essai suggère qu’il aurait été possible de ne pas réopérer les patients pT2, qui étaient N0 au bilan initial. En effet ces patients ont été réopérés en raison du risque ganglionnaire mais seuls 2 patients avaient des ganglions envahis dans le mésorectum. De plus, dans le bras TME, seuls 2 % des patients pT2 (cN0 au diagnostic) avaient des ganglions envahis dans le mésorectum. Enfin, à 5 ans, il n’y avait pas de différence significative entre les deux groupes concernant les taux de récidives locales (7 % vs 7 %), la probabilité de survie sans maladie (70 % vs 72 %) et la survie globale (84 % vs 82 %).
Les conclusions de cet essai sont que les petites tumeurs sont de bonnes candidates pour les stratégies de conservation rectale, que cette stratégie est sûre sur le plan oncologique (pas plus de récidives locales ni à distance à 5 ans) mais que les TME complémentaires (prévues en cas de tumeur T2) induisaient une morbidité importante, ce qui oblige à affiner la sélection des patients et l’évaluation de la réponse.
Les études actuelles incluent des patients avec tumeurs rectales limitées (moins de 4 ou 5 cm) et testent différentes modalités d’intensification thérapeutique avec un objectif de préservation rectale. Parmi ces études, 2 études françaises randomisées (OPERA et GRECCAR 12) ont évalué deux modalités d’intensification du traitement différentes avec un objectif de taux de préservation rectale à un ou trois ans. L’étude OPERA (NCT02505750) a évalué une intensification de la radiothérapie chez des patients avec tumeur rectale cT2T3N0N1 (moins de 5 cm) grâce à l’utilisation de la contact-thérapie (randomisation entre CRT avec et sans contact-thérapie 90 Gy). Pour les tumeurs inférieures à 3 cm, la contact-thérapie était réalisée avant la CRT. Dans cette étude, une stratégie de surveillance (watch and wait) ou une excision locale, n’étaient envisagées que s’il y avait une réponse clinique complète ou subcomplète respectivement (Gérard, 2023). Entre juin 2015 et juin 2020, 148 patients ont été inclus et 141 analysés avec une suivi médian de 38 mois. Les résultats sont significativement en faveur du bras intensification par contact-thérapie avec survie avec préservation d’organe à 3 ans de 81 % (IC95% : 72-91) versus 59 % (IC95% : 48-72) dans le bras contrôle (HR=0,36 ; IC95% : 0,19-0,7 ; p=0,0026). Cette différence est encore plus importante dans le groupe des patients avec tumeur < 3 cm qui atteint 97 % (IC95% : 91-100) de préservation d’organe à 3 ans contre 63 % (IC95% : 47–84) (HR=0,07, IC95% 0,01–0,57; p=0,012). Le taux de réponse clinique complète ou subcomplète à 14 semaines était de 81 % avec contact-thérapie comparé à 58 % dans le bras contrôle (p=0,0006).
La toxicité aiguë n’était pas différente entre les 2 bras, cependant les patients traités par contact-thérapie présentaient plus de rectorragies de grade 1-2 (63 % contre 12 % dans le bras contrôle, p<0,0001) dans les 3 ans suivant le traitement. Ces rectorragies étaient dues à des télangiectasies apparaissant 6 mois après la fin du traitement et qui s’estompaient après 3 ans. L’incidence de métastases à distance à 3 ans était de 9 % (IC95% : 4–13) sans différence significative entre les 2 bras. De même, la survie globale à 3 ans était de 98 % (IC95% 96–100) sans différence significative entre les 2 bras. Pour les tumeurs de mois de 3 cm le taux de récidive locale cumulée à 3 ans était de 5% dans le bras contact-thérapie contre 27 % dans le bras contrôle (p=0,051). Pour les tumeurs entre 3 et 5 cm, les taux de récidives locales cumulées étaient respectivement de 20% et 26% (p=0,76). La stratégie avec contact-thérapie parait donc particulièrement intéressante pour les tumeurs de moins de 3cm.
Une étude comparable canadienne évalue la même stratégie avec un complément de dose réalisé par curiethérapie endocavitaire rectale (MORPHEUS, NCT04336202). Les critères d’inclusion sont les mêmes que ceux de l’étude OPERA. Les premiers résultats de l’analyse intérimaire des 40 premiers patients montrent une tendance similaire avec 90 % de réponse clinique complète dans le bras curiethérapie comparé à 50 % dans le bras contrôle.
L’étude TRESOR faisant suite à l’étude OPERA actuellement en cours compare un bras contrôle avec traitement néoadjuvant total (4 FOLFIRINOX + CRT CAP 50) avec un bras expérimental incluant la contact thérapie (4 FOLFIRINOX associés à 3 séances de contact thérapie (CXB 90 Gy/3f) puis CAP50) et évalue le potentiel de conservation d’organe de la stratégie avec W&W ou exérèse locale en cas de résidu tumoral, pour les ADK du bas et moyen rectum T2-T3 de 3,5 à 6 cm de grand diamètre N0-N1 (<8mm).
L’étude GRECCAR 12 (NCT02514278) évalue une intensification de la chimiothérapie en randomisant, avant la CRT préopératoire, une chimiothérapie néoadjuvante par 4 cycles de FOLFIRINOX chez des patients cT2T3N0N1 (moins de 4 cm). La réponse est évaluée par examen clinique et IRM (TRG) et l’exérèse locale est proposée aux patients bons répondeurs. Compte tenu des résultats de l’essai GRECCAR2, les patients avec tumeur pT2 mais cN0 au bilan initial ne sont pas réopérés. Seuls les patients avec résultat histologique pT2 mais cN1 au bilan initial, pT3 ou R1 ont une TME complémentaire. L’objectif principal est de passer de 60 % à 80 % de préservation rectale à 2 ans. Les résultats sont en attente.
Une étude de phase III polonaise a randomisé la radiothérapie courte (5 x 5 Gy) et la chimioradiothérapie longue (50,4 Gy+5FU-leucovorine) en traitement néoadjuvant avant exérèse locale pour les adénocarcinomes du rectum cT1-2N0M0 ou cT3N0M0 de moins de 4 cm (Wawok, 2018). Les effectifs de cette étude sont faibles (29 patients bras RT courte et 22 patients bras CRT longue). Les patients comme dans GRECCAR 2 étaient réopérés avec une proctectomie avec TME en cas de mauvaise réponse histologique sur la pièce d’exérèse locale (ypT1R1/T2-3). Cette étude montre une tendance non significative à une meilleure réponse histologique dans le groupe CRT longue (86 % vs 66 % de ypT0-1R0, p=0,11). Elle démontre par ailleurs la supériorité à long terme du bras CRT longue avec des taux de récidives locales et de survie à 10 ans en faveur de la CRT longue : 35 % (RT) vs 5 % (CRT) pour les récidives (p=0,036) et 47 % (RT) vs 86 % (CRT) pour la survie (p=0,009). On notait par ailleurs un taux élevé de patients nécessitant et refusant la chirurgie de rattrapage (46 % des ypT1R1/T2-3 après exérèse locale) avec dans ce groupe des taux de récidive ou progression locales élevés : 79 % à 10 ans. Les résultats de cette étude sont à prendre avec précaution compte tenu des faibles effectifs. Ils suggèrent toutefois que dans le cadre de la conservation d’organe, la CRT semble plus efficace pour le contrôle local que la radiothérapie courte. Ils mettent par ailleurs en avant le danger du refus des patients pour la chirurgie de rattrapage conduisant à de mauvais résultats oncologiques. Il est donc impératif d’améliorer la sélection des patients pouvant bénéficier d’un traitement conservateur du rectum pour limiter les chirurgies de rattrapage et de bien prévenir le patient de la nécessité de cette chirurgie de rattrapage en cas de mauvaise réponse histologique.
Au total, la stratégie de préservation rectale après réponse complète ou quasi-complète après CRT ou TNT peut être proposée en centre expert chez des patients sélectionnés :
- patients porteurs de petites tumeurs T2-T3 de moins de 4 cm, N0 ou N1 limité (≤3 adénopathies inférieures à 8 mm dans le mésorectum) ;
- présence d’importantes comorbidités, empêchant une chirurgie radicale plus lourde ;
- refus par le patient d’une chirurgie plus radicale ;
- excellente réponse à la CRT pour des tumeurs très bas situées nécessitant initialement une amputation abdomino-périnéale.
L’exérèse locale par TEM (GRECCAR 2) pour confirmation histologique de la réponse tumorale après traitement néoadjuvant doit être privilégiée compte tenu des difficultés persistantes d’évaluation clinique (IRM + TR + endoscopie +/- echoendoscopie) objective de cette réponse.
En cas d’impossibilité technique (lésion en partie intra-péritonéale), de lésion initialement au contact de l’appareil sphinctérien, d’absence de résidu visible sur l’ensemble des examens (IRM et endoscopie) une stratégie de type W&W peut être proposée en centre expert (accord experts).Pour les tumeurs de moins de 3 cm, une alternative peut être l’utilisation de contact thérapie selon les modalités de l’étude OPERA (recommandation : grade B).
Compte tenu des risques de difficulté chirurgicale avec majoration des risques de complications et dégradation de la qualité du mésorectum (GRECCAR 6 et RAPIDO), l’évaluation de la réponse tumorale pour envisager une stratégie de conservation rectale doit être faite dans un délai permettant d’envisager si besoin une chirurgie de rattrapage dans les standards habituels à 8 semaines après la fin de la radiothérapie.
Les possibilités d’évaluation de la réponse tumorale intégrant la décision médicale partagée à différents temps vont être prochainement évaluées dans une étude acceptée au PHRC 2023 : GRECCAR 20-EVAREC.
Les modalités de surveillance restent discutées et nécessitent d’être harmonisées.
Pour les tumeurs localement évoluées (T3-4 >4 cm ou N1), le traitement chirurgical de référence reste la proctectomie avec exérèse totale du mésorectum quelle que soit la réponse aux traitements néoadjuvants mais l’amputation abdomino-périnéale en cas de réponse clinique complète doit être rare et discutée en RCP.
5.4.2. Stratégie thérapeutique
La stratégie thérapeutique dépend du siège de la tumeur, de son classement par l’échoendoscopie (tumeurs T1 et T2) et/ou par l’IRM (tumeurs T3 T4) et du bilan d’extension préthérapeutique. Elle repose aussi sur l’opérabilité du patient et son souhait plus ou moins affirmé d’éviter une éventuelle chirurgie mutilante. Elle est systématiquement décidée en réunion de concertation pluridisciplinaire (RCP) après que le chirurgien référent ait examiné le patient pour apprécier les différentes possibilités de techniques chirurgicales. Une évaluation de la réponse tumorale clinique par le chirurgien après traitement néoadjuvant est recommandée. Elle peut aboutir à une modification du geste chirurgical initialement envisagé. (Glimelius, 2013 et RPC 2015 ; Lakkis, 2015).
5.4.2.1. Tumeurs T1, N0 (cf. ARBRE DECISIONNEL 5.7.1.)
Ces tumeurs dont la biopsie simple est parfois imprécise quant au degré de malignité et d’infiltration sont considérées comme « de petites lésions de très bon pronostic » avec un risque d’envahissement ganglionnaire < 10 % (Société Européenne d’Endoscopie Digestive ; Morino, 2014).
N.B. : Le traitement des adénomes avec cancer in situ ou intra-muqueux est décrit dans le chapitre 3 « cancer du côlon » du TNCD.
RÉFÉRENCES
Exérèse locale :
- Exérèse locale chirurgicale par voie trans-anale (recommandation : grade C).
- Ou dissection sous-muqueuse endoscopique (mieux que la mucosectomie) par un gastroentérologue expert (recommandation : grade C).
Il est essentiel d’éviter toute fragmentation de la tumeur lors de l’exérèse et de l’adresser bien orientée pour l’examen anatomopathologique.
En cas d’exérèse incomplète (marge ≤ 1 mm par rapport à l’adénocarcinome) ou de facteur péjoratif (Budding de grade ≥2 et/ou embols vasculo-nerveux et/ou composantes indifférenciées) la résection du rectum avec curage ganglionnaire est recommandée, sans délai (recommandation : grade B).
OPTIONS
- Pour les patients à risque opératoire élevé ou refusant la chirurgie complémentaire en cas d’indication chirurgicale après résection endoscopique, une CRT peut être proposée en alternative à la chirurgie radicale complémentaire (accord experts).
- Résection du rectum avec conservation sphinctérienne réalisée selon les modalités décrites précédemment (cf. 5.5.1.1) ; elle est un traitement standard lorsque l’exérèse locale n’est pas possible (recommandation : grade C).
- Amputation abdomino-périnéale : elle doit être exceptionnelle pour une tumeur T1, une marge d’exérèse supra-millimétrique devant toujours pouvoir être obtenue par une technique chirurgicale adéquate (recommandation : grade A).
- Radiothérapie de contact (+/- CRT) chez des patients pour lesquels une chirurgie de résection n’est pas retenue. (recommandation : grade C).
5.4.2.2. Tumeurs T2, N0 (cf. ARBRE DECISIONNEL 5.7.2.)
La chirurgie radicale avec TME reste la référence, mais une stratégie de préservation d’organe peut être proposée chez des patients sélectionnés en centre expert.
RÉFÉRENCES
- La résection antérieure du rectum sans traitement néoadjuvant est le traitement standard pour les T2 (recommandation : grade B).
- Si la lésion T2 présente une marge circonférentielle sur l’IRM<2mm, une CRT de type CAP 50 peut être proposée en préopératoire (accord d’experts).
- En cas de classement pN1-2 ou R1, un traitement postopératoire est indiqué (cf. 5.4.2.3.2).
- Pour les tumeurs < 4cm de grand axe du bas et moyen rectum, une stratégie de conservation d’organe en centre expert peut être envisagée, un traitement néoadjuvant par CRT CAP50 doit alors être proposé (recommandations : grade A).
OPTIONS
- Chez des personnes âgées ou fragiles, si un traitement néoadjuvant par CRT est indiqué, une RT préopératoire seule avec un protocole court (25/5) dans un petit volume est possible ainsi qu’une RT seule à la dose de 45 ou 50 Gy/5 semaines.
- Si un traitement néoadjuvant est indiqué et en cas de contre-indication à la radiothérapie ou de femme en âge de procréer pour préserver la fertilité (uniquement pour les lésions du moyen rectum avec CRM>3mm), une chimiothérapie périopératoire par FOLFOX peut être proposée (recommandation : grade B).
- Pour les tumeurs < 3cm de grand axe du bas et moyen rectum (canal anal exclu), un traitement par radiothérapie de contact puis CRT CAP50 peut-être proposé dans un objectif de conservation d’organe (recommandation : grade B).
- En cas de réponse complète à l’IRM et à l’endoscopie (aucun résidu visible) après traitement néoadjuvant, une stratégie de type Watch&Wait peut être discutée en centre expert (accord d’experts).
- Pour les tumeurs dMMR/MSI : immunothérapie (accord d’experts)
5.4.2.3. Tumeurs T1-2N+ ou T3Nx
Ces tumeurs définies par l’IRM représentent un risque intermédiaire tant sur le plan local que métastatique. Une possibilité de conservation d’organe reste possible mais la chirurgie radicale représente le traitement essentiel généralement précédé par un traitement néoadjuvant.
5.4.2.3.1. Traitement préopératoire (cf. ARBRE DECISIONNEL 5.7.3.)
RÉFÉRENCES
- Moyen et bas rectum : traitement néoadjuvant total (TNT) puis chirurgie avec exérèse complète du mésorectum :
traitement néoadjuvant total : 6 cycles de FOLFIRINOX puis CRT chimioradiothérapie CAP50 associé à une chimiothérapie adjuvante par 6 cycles de mFOLFOX6 (ou 4 cycles de capecitabine) pour les T3 chez des patients en bon état général (PS 0-1) âgés de 18 à 75 ans (recommandation : grade A). - Pour les tumeurs < 4cm de grand axe du bas et moyen rectum (avec envahissement ganglionnaire du mésorectum ≤ 3 ganglions de moins de 8 mm), une stratégie de conservation d’organe en centre expert peut être envisagée, un traitement néoadjuvant total par 6 cycles de FOLFIRINOX puis CRT CAP50 doit également être proposé (accord d’experts).
- Haut rectum : chirurgie d’emblée avec exérèse du rectum et du mésorectum jusqu'à 5 cm sous le pôle inférieur de la tumeur (accord d’experts).
OPTIONS
- Pour les tumeurs du rectum moyen et inférieur : CRT préopératoire. Protocole CAP 50 (recommandation : grade A) ou CAP 45 (45 Gy + capecitabine 825 mg/m2 les jours de radiothérapie (recommandation : grade A).
- Chez des personnes âgées trop fragiles pour recevoir une CRT type CAP50, une RT préopératoire seule avec un protocole court (25/5) dans un petit volume est possible ainsi qu’une RT seule à la dose de 45 ou 50 Gy/5 semaines.
- En cas de patients de moins de 70 ans trop fragiles pour recevoir un traitement néoadjuvant total (TNT), de contre-indication à la radiothérapie, ou de femme en âge de procréer pour préserver la fertilité (uniquement pour les lésions du moyen rectum avec une CRM> 3mm et moins de 4 ganglions significatifs dans le mésorectum), une chimiothérapie péri-opératoire par FOLFOX peut être proposée (recommandation : grade B).
- Moyen rectum : en cas d’envahissement limité du mésorectum, avec marge circonférentielle avec le fascia recti > 1mm en IRM, la toxicité de l’association CRT (en fait modérée avec les techniques conformationnelles 3D et de petits volumes) et le moindre risque de résection R1 peuvent faire discuter la radiothérapie seule (éventuellement selon le schéma court 25 Gy en 5 séances). La chirurgie seule avec exérèse totale du mésorectum est du domaine de la recherche clinique et discutée en RCP seulement si la lésion ne présente pas d’envahissement ganglionnaire majeur (N0) et est localisée en région postérieure sans aucun signe péjoratif : pas d’EMVI (extra mural vascular invasion), CRM (marge circonférentielle avec le fascia recti ≥ 2 mm), N0 en IRM (accord d’experts).
- Haut rectum : traitement préopératoire par CRT ou RT seule de type 25/5 si fascia recti menacé (accord d’experts).
- Pour les tumeurs < 3cm de grand axe du bas et moyen rectum (canal anal exclu) avec moins de 4 ganglions (< 8mm) dans le mésorectum, un traitement par radiothérapie de contact puis CRT CAP50 peut-être proposé dans un objectif de conservation d’organe (recommandation : grade B).
- En cas de réponse complète à l’IRM et à l’endoscopie (aucun résidu visible) après traitement néoadjuvant, une stratégie de type Watch&Wait peut être discutée en centre expert (accord d’experts).
- Pour les tumeurs dMMR/MSI : immunothérapie (accord d’experts).
ESSAIS CLINIQUES
- Etude NORAD01 : Phase III, cT3N0 ou cT1T3N+, tumeurs résécables d’emblée (CRM≥2mm) : chimiothérapie néoadjuvante FOLFIRINOX vs chimiothérapie néoadjuvante FOLFIRINOX puis chimioradiothérapie néoadjuvante CAP 50. Coordonnateur : A Brouquet (APHP) (antoine.brouquet@aphp.fr).
https://www.e-cancer.fr/Professionnels-de-sante/Le-registre-des-essais-cliniques/Le-registre-des-essais-cliniques/Etudes-cliniques/Etude-NORAD01-etude-de-phase-3-randomisee-comparant-l-efficacite-d-une-chimiotherapie-seule-a-celle-d-une-radio-chimiotherapie-preoperatoire-chez-des-patients-ayant-un-cancer-du-rectum-localement-evolue-d-emblee-resecable - Etude GRECCAR 14 : Phase III : tumeur localement avancée : CRM < 2mm ; T3c-d N0–N2 ; T4a-b ; envahissement extramural veineux : traitement personnalisé en fonction de la réponse tumorale : 6 cures de FOLFIRINOX puis en fonction de la réponse : chirurgie d’emblée, CAP50 puis chirurgie ou CAP60 puis chirurgie. Coordonnateur : P Rouanet (Montpellier) (Philippe.Rouanet@icm.unicancer.fr).
https://classic.clinicaltrials.gov/ct2/show/NCT04749108?term=NCT04749108 - Etude TRESOR : Phase III, T3b-c-d de 3,5 à 6 cm (<2/3 circonférence) N0 ou N1, patients de moins de 75 ans : Traitement néoadjuvant total (4 FOLFIFIRINOX +CAP 50) vs Traitement néoadjuvant total (4 FOLFIFIRINOX +CAP 50) + 3 séances de contact-thérapie (CBX 90Gy/3f) avant la CRT. Réévaluation à 5 semaines de la fin du TNT pour Watch&Wait, exérèse locale, chirurgie radicale ou radiothérapie de contact. Coordonnateur Jérome Durand Labrunie (Villejuif).
- Etude PRODIGE 90 – PREDIR-NEOREC : Phase II randomisé dostarlimab néoadjuvant seul versus associé à radiothérapie de courte durée en stratégie watch and wait pour cancer localement avancé MSI/dMMR. Coordonnateur : A Drouillard (Dijon), M Karoui et J Taieb (APHP HEGP)
ramdam.ffcd.fr/CUSTOM/GED/20241011/8b395b622a.pdf - Etude PRODIGE 101-GRECCAR 20 -EVAREC : phase III randomisé, programme de surveillance de réponse tumorale avec prise de décision partagée, versus évaluation standard dans stratégies de préservation d’organe pour cancer < 4 cm et < 8 cm de marge anale. Coordonnateur : A Drouillard (Dijon), Q Denost et V Vendrely (Bordeaux)
https://ramdam.ffcd.fr/CUSTOM/GED/20240920/58bc417c7e.pdf
5.4.2.3.2. Traitement postopératoire (cf ARBRE DECISIONNEL 5.7.6.)
Le traitement postopératoire dépend de l’analyse de la pièce opératoire et du traitement reçu en préopératoire. Dans tous les cas, le dossier d’un patient ayant un cancer du rectum doit être présenté en réunion de concertation pluridisciplinaire (RCP), en pré- puis en postopératoire. Le rapport toxicité/efficacité doit être expliqué, compris et accepté par le(a) patient(e).
- Cancers du rectum sus-péritonéal (haut rectum) : ils doivent être considérés comme des cancers du côlon et pris en charge de la même manière pour l’indication d’une chimiothérapie adjuvante (recommandation : grade B). (cf. TNCD chapitre 3)
- Cancers du moyen et du bas rectum : le traitement adjuvant sera discuté en fonction du stade pTNM sur la pièce de résection, de la présence d’une résection R1 et de l’administration ou non d’une radiothérapie ou CRT néoadjuvante : après CRT et chirurgie, la survie des patients semble mieux corrélée au stade yp ou pTNM sur la pièce opératoire qu’au cTNM établi sur le bilan morphologique préthérapeutique.
1) Patient ayant reçu une CRT ou RT préopératoire
REFERENCES
Après traitement néoadjuvant total (TNT) type PRODIGE 23 :
- Tumeur en réponse histologique complète (ypT0N0) : Pas de traitement adjuvant (accord d’experts)
- Tumeur ypT1-T2N0 : Pas de traitement adjuvant (recommandation : grade accord d’experts).
- Tumeurs ypT3-T4N0 ou ypN1-2 après traitement néoadjuvant total type PRODIGE 23 : chimiothérapie adjuvante : 6 cycles de mFOLFOX6 (ou 4 cycles de capecitabine)(recommandation : grade A).
- ypTxN0 : pas de chimiothérapie adjuvante (accord d’experts).
Après CRT ou RT seule (hors traitement néoadjuvant total) :
- Tumeur en réponse histologique complète (ypT0N0) : Pas de traitement adjuvant(recommandation accord d’experts).
- Tumeur ypT1-T2N0 : Pas de traitement adjuvant (recommandation : grade A).
- ypT3-4N0 : aucun consensus ne peut être obtenu après analyse de la littérature (accord d’experts).
- ypTxN0 : pas de chimiothérapie adjuvante (accord d’experts).
- Patient < 70 ans et ypN+ : FOLFOX 4s (6m) pendant 3 (si chimio néoadjuvante) à 6 mois (accord d’experts).
Le faible niveau de preuve de l’efficacité de l’oxaliplatine doit faire interrompre ce médicament dès l’apparition d’une toxicité neurologique sensitive persistante entre deux cures, et poursuivre le LV5FU2.
Tumeurs avec une résection R1 quel que soit le traitement néoadjuvant : L’AAP de sauvetage n’est pas recommandée en cas de marge distale R1.
- Patient < 70 ans : FOLFOX 4s (6m) pendant 6 mois (accord d’experts).
- Patient ≥ 70 ans : FOLFOX 4s (6m) à discuter après évaluation onco-gériatrique (avis d’experts divergents).
Le faible niveau de preuve de l’efficacité de l’oxaliplatine doit faire interrompre ce médicament dès l’apparition d’une toxicité neurologique sensitive persistante entre deux cures, et poursuivre le LV5FU2.
2) Patient n’ayant pas reçu de CRT ou RT préopératoire
REFERENCES
- Tumeur pT3-T4 N0 R0
Pas de traitement postopératoire (recommandation : grade A). - Tumeurs avec une résection R1 ou tumeur perforée
CRT 50,4Gy associée à une fluoropyrimidine (recommandation : grade A).
L’AAP de sauvetage n’est pas recommandée en cas de marge distale R1. - Tumeurs pN1-2
- Patient < 70 ans : CRT (recommandation : grade A) ou chimiothérapie adjuvante 6 mois de type FOLFOX 4s (6m) ou XELOX (accord d’experts).
- Patient ≥ 70 ans : CRT (recommandation : grade A) ou chimiothérapie adjuvante 6 mois à discuter après évaluation oncogériatrique (accord d’experts).
OPTIONS
En cas de contre-indication à la CRT postopératoire, chimiothérapie postopératoire par analogie avec le cancer du côlon par LV5FU2 simplifié ou capécitabine ou FOLFOX 4s (6m) ou XELOX pendant 6 mois ou radiothérapie postopératoire seule (accord d’experts).
5.4.2.4. Tumeurs T4 à risque de résection R1 ou R2 ou certaines T3 N2 avec marges circonférentielles à risque d’envahissement (stade TNM radiologique ± biopsie) (cf. ARBRE DECISIONNEL 5.7.4.)
Elles correspondent à des tumeurs T4 fixées au TR à la paroi pelvienne et adhérentes aux organes de voisinage à l’IRM. On les décrit souvent comme "localement avancées". Elles exposent à un risque majoré de rechute locale mais aussi de métastases à distance.
RÉFÉRENCES
- Traitement néoadjuvant total : 6 cycles de FOLFIRINOX puis chimioradiothérapie CAP50 associé à une chimiothérapie adjuvante par 6 cycles de mFOLFOX6 (ou 4 cycles de capecitabine) chez des patients en bon état général (PS 0-1) âgés de 18 à 75 ans (recommandation : grade A).
- En cas d’extension régionale chez un sujet jeune, en l'absence d'adénopathie à distance, une exérèse élargie mutilante (organes génito-urinaires ou sacrum) doit être discutée au cas par cas si une résection R0 peut être espérée (recommandation : grade C).
- Si l’exérèse s’avère impossible, la RT sera poursuivie jusqu'à 60 Gy (45 Gy pelvis et boost 60 Gy tumeur), associée à des traitements endoscopiques (prothèse ou hémostase) ou à une colostomie d’amont si nécessaire.
- Traitement postopératoire en cas d’exérèse R1 ou R2 et/ou pN1-2 :
- En l’absence de traitement préopératoire, une CRT est recommandée (accord d’experts) suivie d’une chimiothérapie (FOLFOX ou XELOX pendant 6 mois) (accord d’experts).
- Si un traitement néoadjuvant a été reçu, une CT par FOLFOX pendant 3 mois (6 mois si CAP50 seul en néoadjuvant) est recommandée (accord d’experts).
- L’AAP de sauvetage n’est pas recommandée en cas de marge distale R1.
OPTIONS
- Chimioradiothérapie préopératoire CAP 50.
- CRT à la dose de 60 Gy (pelvis 45 Gy et boost jusqu’à 60 Gy sur la tumeur)
- Alternatives de chimiothérapies associées à la radiothérapie : 5FU-acide folinique (FUFOL), 5FU en perfusion continue (accord d’experts)
- RT peropératoire en cas de reliquat tumoral macroscopique (résection R2) si technique disponible
- Pour des patients inopérables pour raison médicale, la CRT ou la RT exclusive peuvent être proposées dans un esprit palliatif
- En cas de tumeur pT4 et/ou pN1-N2 n’ayant pas été classée T4 en préopératoire et n’ayant pas reçu de traitement préopératoire, une CRT est recommandée (accord d’experts). En cas de contre-indication à la CRT postopératoire, une radiothérapie ou chimiothérapie postopératoire, voire l’abstention thérapeutique peuvent être retenues (accord d’experts)
- En cas de réponse complète ypT0N0 : chimiothérapie adjuvante possible à discuter en RCP (accord d’experts)
- Pour les tumeurs dMMR/MSI : immunothérapie (accord d’experts) si non incluable dans l’essai PRODIGE 20-PREDIR-NEOREC.
ESSAI CLINIQUE
- Etude GRECCAR 14 : Phase III : tumeur localement avancée : CRM < 2mm ; T3c-d N0–N2 ; T4a-b ; envahissement extramural veineux : traitement personnalisé en fonction de la réponse tumorale : 6 cures de FOLFIRINOX puis en fonction de la réponse : chirurgie d’emblée, CAP50 puis chirurgie ou CAP60 puis chirurgie. Coordonnateur : P Rouanet (Montpellier) (Philippe.Rouanet@icm.unicancer.fr).
https://classic.clinicaltrials.gov/ct2/show/NCT04749108?term=NCT04749108 - Etude PRODIGE 90 – PREDIR-NEOREC : Phase II randomisé dostarlimab néoadjuvant seul versus associé à radiothérapie de courte durée en stratégie watch and wait pour cancer localement avancé MSI/dMMR. Coordonnateur : A Drouillard (Dijon), M Karoui et J Taieb (APHP HEGP)
https://ramdam.ffcd.fr/CUSTOM/GED/20241011/8b395b622a.pdf
5.4.2.5. Tumeurs avec métastase(s) synchrone(s) résécable(s) d’emblée (cf. ARBRE DECISIONNEL 5.7.5.)
Le traitement de ces formes avec métastases résécables d’emblée est individualisé en fonction du stade TN, du siège des métastases et du contexte général du patient. L’objectif est double : traiter au mieux la tumeur rectale et aux mieux la ou les métastases.
RÉFÉRENCES
Il n’existe pas de standard reconnu de façon unanime. Ce type de présentation clinique doit toujours être discuté en RCP.
Pour les tumeurs dMMR/MSI, la référence est l’immunothérapie (accord d’experts).
OPTIONS
Plusieurs options stratégiques sont possibles :
- Traitement chirurgical en un temps après CRT néoadjuvante de la tumeur primitive et de la (ou des) métastase(s)
- Traitement séquentiel après CRT, avec chirurgie première de la (ou des) métastase(s) puis chirurgie de la tumeur primitive
- Peuvent également se discuter :
- une chimiothérapie néoadjuvante 4 à 6 cycles
- une radiothérapie courte (25/5) permettant de débuter rapidement une chimiothérapie plus active sur les métastases, puis 3 mois plus tard chirurgie rectale et des métastases, suivie d’une reprise de la chimiothérapie jusqu’à un total de 6 mois
- une chimiothérapie périopératoire de la (ou des) métastase(s) suivie du traitement de la tumeur rectale.
5.4.2.6. Tumeurs avec métastase(s) synchrone(s) non résécable(s) d’emblée
RÉFÉRENCES
- Certaines extensions métastatiques limitées peuvent devenir résécables après chimiothérapie et les dossiers devront être discutés, initialement et après chimiothérapie, en réunion de concertation pluridisciplinaire en présence d’un chirurgien spécialisé en chirurgie hépatique.
- Dans l’ensemble, pour ces tumeurs de pronostic défavorable à court terme, le traitement aura pour but de maintenir la qualité de vie des patients en évitant si possible à la fois une évolutivité pelvienne douloureuse et une chirurgie mutilante (Conférence de Consensus sur le cancer du rectum 1994).
Aucune étude prospective randomisée ne permet de guider les choix thérapeutiques, qui ne peuvent être faits qu’après discussion de chaque cas en RCP, initialement et au cours de la chimiothérapie. Le pronostic repose le plus souvent sur l’évolutivité des métastases et la CT systémique prime sur le traitement du primitif rectal. Mais la résection et ou la radiothérapie de ce dernier peuvent être proposées après traitement médical notamment si les métastases deviennent résécables ou si la tumeur rectale reste symptomatique. Si après chimiothérapie la (les) métastase(s) deviennent résécable(s), une chimiothérapie périopératoire peut-être proposée et suivie, notamment si les métastases sont contrôlées, d’une chirurgie sur la tumeur rectale éventuellement précédée d’une radiothérapie préopératoire selon un schéma court (25/5).
De nombreuses publications de séries non randomisées rapportent une meilleure survie des patients présentant un cancer colorectal avec métastases non résécables lorsque la résection du primitif a été réalisée (Faron M, 2015 ; Ishihara, 2014). Cependant à ce jour aucune étude randomisée n’a pu être menée à terme en particulier pour le cancer du rectum. La résection du primitif en cas de métastases non résécables bien contrôlées sous chimiothérapie peut être une option discutée en RCP et avec le patient en prenant en compte les risques de complications chirurgicales et de séquelles postopératoires digestives et génito-urinaires.
En cas de symptômes gênants liés à la présence de la tumeur primitive (rectorragies, symptômes pelviens), une chimiothérapie intensive par FOLFIRINOX pendant 6 mois si possible peut-être proposée (recommandation : grade C).
Pour les tumeurs MSI, la référence est l’immunothérapie.
5.5. Surveillance post-thérapeutique
5.5.1. Les moyens diagnostiques disponibles sont :
- L’examen clinique, en particulier les touchers pelviens et la rectoscopie rigide en cas de traitement ayant conservé le sphincter (ou le rectum). (Jeffery M, 2016)
- Le bilan biologique hépatique. Le dosage des phosphatases alcalines peu spécifique n’est pas recommandé (conférence consensus 1998).
- L’ACE est le principal marqueur biologique utilisable. Sa sensibilité pour la détection des récidives est meilleure pour les métastases hépatiques que pour les récidives locorégionales. Sa spécificité est mauvaise et l’impact sur la survie de son dosage répété n’est pas démontré (Jeffery M, 2016).
- L’échographie abdominale reste l’examen ayant le meilleur rapport coût/bénéfice pour le dépistage de métastases hépatiques. La sensibilité de détection voisine de 85% peut être diminuée par des difficultés d’ordre technique ou par certaines caractéristiques de la tumeur (caractère isoéchogène, taille < 10 mm, situation périphérique, sous capsulaire ou dans le dôme). La spécificité est voisine de 95%. Elle peut également montrer des adénopathies ou une carcinose péritonéale.
- La radiographie de thorax est un examen peu sensible mais peu coûteux, et peu irradiant pour la recherche des métastases pulmonaires. La TDM est plus sensible pour détecter les métastases pulmonaires. Il n’est toutefois pas établi que le dépistage et le traitement précoces des récidives pulmonaires aient un impact sur la survie dans le cancer du rectum.
- La coloscopie dépiste les lésions rectocoliques métachrones, mais elle n’a pas d’intérêt pour le diagnostic précoce des récidives locales qui sont extraluminales dans la majorité des cas.
- L’EER avec éventuelle cytoponction écho-guidée est utile pour confirmer une récidive locorégionale suspectée. Elle permet également la détection d’adénopathies, ou de récidives précoces à un stade encore asymptomatique. En cas de radiothérapie préalable, l’interprétation des images est parfois difficile. Après amputation du rectum chez la femme, l’échographie endo-vaginale remplace l’EER.
- Les autres examens morphologiques (TDM, IRM) peuvent être utilisés en cas de diagnostic difficile.
- Le TEP scan peut permettre de différencier, devant une masse pelvienne, une fibrose d’une récidive postopératoire.
5.5.2. Stratégie de surveillance (cf. arbre décisionnel 5.7.7.)
La surveillance n’a d’intérêt que pour les malades capables de supporter une réintervention, une chimiothérapie ou un traitement par radiothérapie. L’essai PRODIGE 13 (surveillance du cancer colique ou rectal stade II ou III opéré à visée curative. Double randomisation : R1 suivi ou non de l’ACE et R2 suivi avec ou sans TDM TAP) présenté en 2020 à l’ESMO (Lepage, 2020) n’a pas retrouvé de différence significative entre les 4 stratégies de surveillance en terme de survie globale à 5 ans ou de survie sans récidive. On notait des courbes de survie globale et sans récidive parfaitement superposables comparant les stratégies de surveillance avec ou sans ACE. Pour le sous-groupe des patients traités pour un cancer colorectal avec récidive, les résultats montraient un taux plus important de chirurgie curative des récidives dans le groupe surveillance intensive par TDM et ACE mais sans traduction à ce stade sur la survie globale entre les 4 modalités de surveillance. Des études complémentaires sont nécessaires sur des populations plus homogènes et intégrant de nouveaux biomarqueurs comme l’ADN circulant avant de proposer une modification des modalités de surveillance du cancer du rectum. Ces résultats confirment ceux obtenus dans les précédentes études et ceux de la dernière méta-analyse sur cette question [Jeffery, 2019]
5.5.2.1. Dans les 5 premières années
RÉFÉRENCE (accord d’experts)
La surveillance ne doit intéresser que les patients qui pourront bénéficier d’un traitement de la récidive.
- Examen clinique tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans
- Echographie abdomino-pelvienne tous les 3 mois pendant 3 ans puis tous les 6 mois pendant 2 ans
- Radiographie de thorax tous les 6 mois pendant 3 ans puis annuel pendant 2 ans
- Coloscopie selon les modalités décrites ci-dessous.
- Compte tenu des données récentes rapportées, la surveillance de l’ACE, d’intérêt non démontré, n’est plus recommandée (niveau de la recommandation : grade B). En cas d’élévation préopératoire, sa normalisation doit être évaluée par un dosage à réaliser dans le 6 à 8 semaines après la chirurgie. Son élévation persistante indique la persistance d’un reliquat tumoral nécessitant à un bilan morphologique.
Les éléments de surveillance cités ci-dessus s’appliquent aux cancers rectaux de stade II et III (non indiqués pour les cancers rectaux de stade I).
Le rythme de la surveillance peut être modulé dans le sens d’un espacement des intervalles de surveillance à tous les 6 mois en cas de stade II à faible risque de récidive (niveau de la recommandation : avis d’experts).
- Coloscopie selon les recommandations de l’ESGE 2019 et 2020 et celles de la SFED 2021 [Hassan, 2019; Hassan, 2020; Recommandations SFED 2021] - En cas d’antécédent personnel de cancer colorectal traité par exérèse endoscopique ou chirurgicale :
- si incomplète ou de mauvaise qualité avant l'intervention, coloscopie à faire dans les 6 mois post-opératoires (niveau de la recommandation : grade C) puis à 1 an (niveau de la recommandation : grade B), à 3 ans et à 5 ans, si la coloscopie précédente est normale (niveau de la recommandation : grade C) ;
- si complète et de bonne qualité en préopératoire, elle sera à réaliser à 1 an (niveau de la recommandation : grade B), à 3 ans et à 5 ans (niveau de la recommandation : grade C), si la coloscopie précédente est normale (niveau de la recommandation : grade C).
- Au-delà, en l’absence de syndrome de prédisposition génétique au cancer colorectal, le rythme de surveillance par coloscopie sera fonction :
- du résultat de la dernière coloscopie
- de l’espérance de vie du patient du fait de son âge et/ou de comorbidité
Particularités liées aux syndromes génétiques :
- si syndrome de Lynch : contrôle tous les 1 à 2 ans avec chromoscopie par indigo-carmin à partir de l’âge de 20 ans (recommandation GENMAD 2009) ;
- si PAF contrôle endoscopique avec chromo-endoscopie du réservoir après anastomose iléo-anale tous les 2 ans (1 fois par an en cas d’anastomose iléo-rectale) (recommandation GENMAD 2009) ;
- si polypose MYH contrôle endoscopique avec chromo-endoscopie annuel du côlon restant (recommandation GENMAD 2009).
Les éléments de surveillance endoscopique cités ci-dessus s’appliquent aux cancers rectaux quel que soit leur stade (I, II et III).
OPTIONS
Les éléments de surveillance cités ci-dessus s’appliquent aux cancers coliques de stade II et III (non indiqués pour les cancers rectaux de stade I).
- TDM thoraco-abdominopelvienne en remplacement de l’échographie et de la radiographie de thorax en cas de patient peu échogène (obèse), ou de patient à risque élevé de récidive (CRM+, ypT4, ypN+). (accord experts)
- EER peut être proposée en l’absence d’amputation (écho transvaginale possible chez la femme) en cas de doute sur une récidive.
- IRM pelvienne si AAP ou si conservation du rectum et de l’anus après traitement néoadjuvant (habituellement CRT) et exérèse locale ou doute sur une récidive.
- TEP TDM : la TEP-FDG est indiquée pour la localisation des récidives en cas d’élévation isolée de l’ACE chez un patient déjà opéré d’un cancer colorectal sans récidive visible sur les examens standard (en pratique sur la TDM TAP). En revanche la TEP TDM n’a pas montré son intérêt dans la surveillance systématique des patients non métastatiques après chirurgie curatrice pour cancer colorectal.
5.5.2.2. Après 5 ans
RÉFÉRENCE
- Le risque de récidive entre 5 et 10 ans est faible mais non nul de 7,6 % à 10,7 % (Cottet V, 2015 ; Frontali A, 2020). Il n’y a toutefois aucune preuve que la surveillance prolongée au-delà de 5 ans améliore le pronostic des patients. Une surveillance au-delà de 5 ans n’est donc pas indiquée (accord experts).
5.6. Traitement des récidives loco-régionales
RÉFÉRENCES
- Les récidives loco-régionales des cancers du rectum peuvent être accessibles à une exérèse curative surtout après exérèse locale ou résection antérieure. Il s’agit de la seule chance d’assurer une survie prolongée : lorsqu’une exérèse curative est réalisée, elle peut offrir un taux de survie à 5 ans de l’ordre de 20 %.
- La douleur, problème majeur au cours de l’évolution des récidives locorégionales des cancers du rectum, doit être combattue par l’utilisation adaptée des traitements antalgiques. En cas de difficulté à contrôler les douleurs, le recours à des spécialistes algologues est recommandé.
OPTIONS
- Les résections palliatives, laissant de la tumeur en place contre les parois du pelvis ou le sacrum sont discutables. Dans ces circonstances, la survie globale est inférieure à 3 ans avec une survie médiane de 12 mois. Elles sont cependant indiquées lorsqu’elles sont susceptibles d’améliorer le confort du patient en cas d’invasion vésicale symptomatique ou de fistules surinfectées. Les traitements combinés peuvent améliorer le pronostic de ces exérèses palliatives.
- La colostomie peut être rendue nécessaire en raison de l’obstruction intestinale ou de l’importance du syndrome rectal.
- Les traitements palliatifs endocavitaires (laser, radiothérapie, électrocoagulation) et les prothèses expansives mises par voie endoscopique peuvent éviter la colostomie dans les cas favorables ou en retarder l’échéance.
- La radio +/- chimiothérapie peut être le seul traitement palliatif des récidives loco-régionales ou être indiquée avant une réintervention si le patient n’a pas été irradié lors du traitement initial.
- La chimiothérapie par oxaliplatine ou irinotécan associés au 5FU en perfusion continue peut avoir un impact sur les symptômes. Son influence sur la survie n’a pas été étudiée. Une trichimiothérapie par FOLFIRINOX peut être proposée si l’état général du patient le permet, comme pour les tumeurs métastatiques (accord d’experts).
- Chirurgie d’exérèse +/- CHIP (chimiothérapie hyperthermie intra-péritonéale) avec mitomycine en cas de récidive péritonéale.
5.7. Arbres décisionnels
5.7.1. Stratégie thérapeutique pour tumeurs T1N0
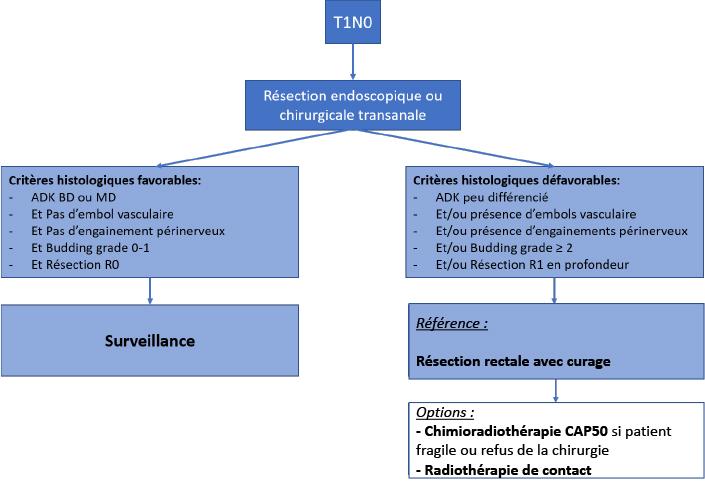
5.7.2. Stratégie thérapeutique pour tumeurs T2N0
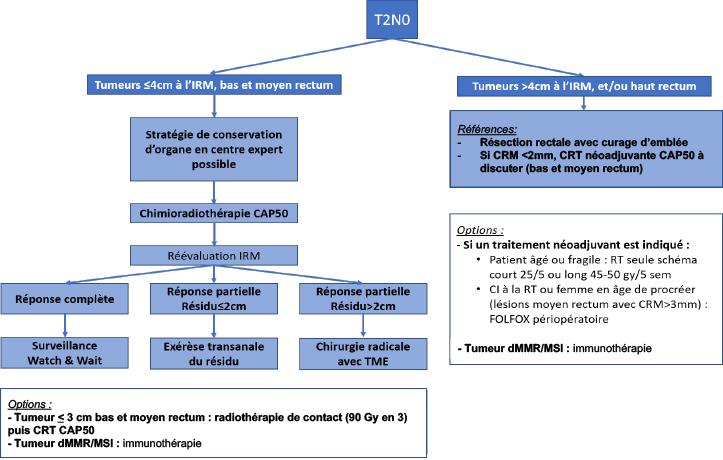
5.7.3. Stratégie thérapeutique pour tumeurs T1-2N+ ou T3Nx
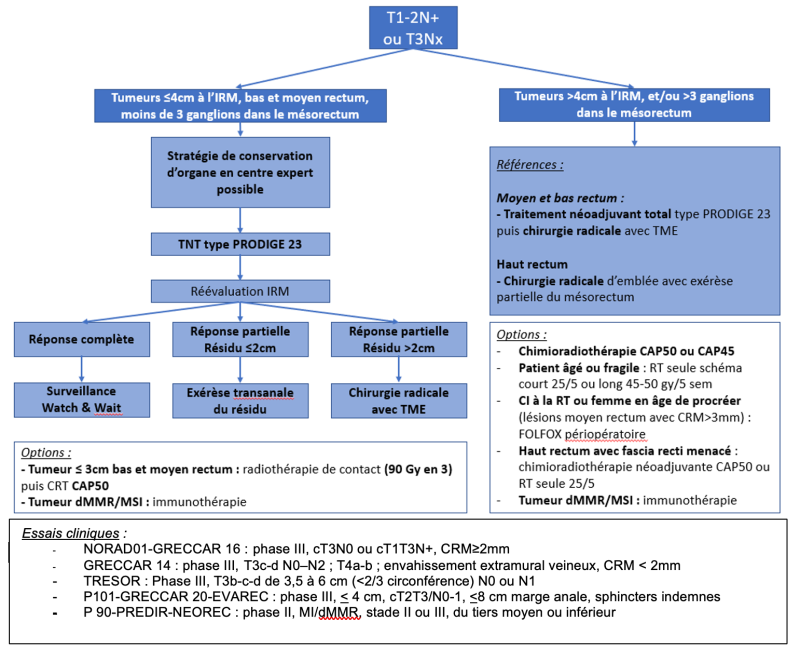
5.7.4. Stratégie thérapeutique pour tumeurs T3N2 ou T4Nx à risque R1 ou R2
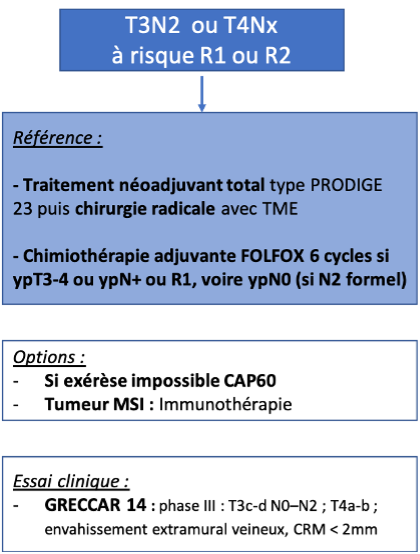
5.7.5. Stratégie thérapeutique si métastases synchrones
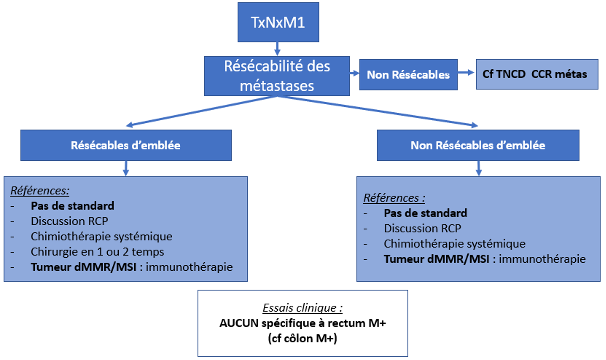
5.7.6. Indications des traitements postopératoires
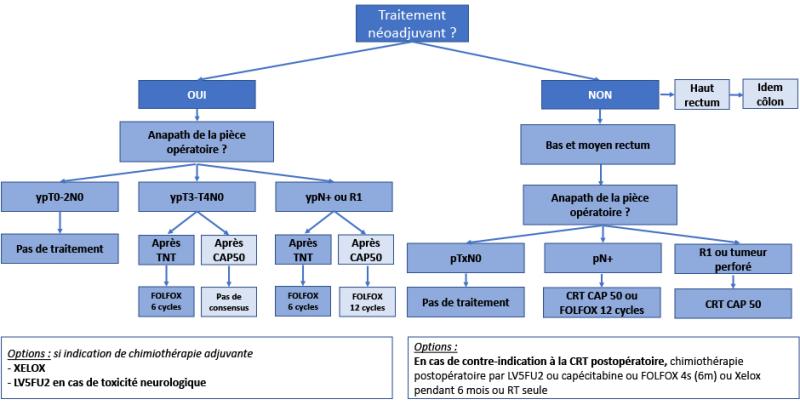
5.7.7. Stratégie de surveillance
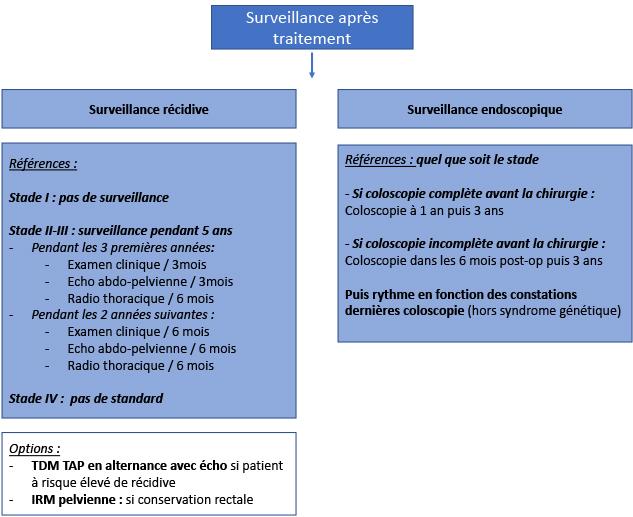
5.8. Annexes
Annexe 1. Schémas de chimiothérapie
FOLFOX4 simplifié (aussi appelé FOLFOX 6 modifié)
Oxaliplatine 85 mg/m² administré en perfusion IV de deux heures dans 250 mL de glucosé à 5 % de façon concomitante (via une connexion en Y) avec acide folinique (400 mg/m² forme dl ou 200 mg/m² forme l) IV sur deux heures, dans 250 ml de glucosé à 5 % suivi par 5-FU 400 mg/m² en bolus (injection IV d’approximativement 2 minutes) suivi par 5-FU 2 400 mg/m² en perfusion IV sur 46 heures. Cycles de 2 semaines.
XELOX
Oxaliplatine 130 mg/m² en perfusion IV de deux heures (Jour 1 toutes les 3 semaines) en association avec capécitabine 1000 mg/m² deux fois par jour (soit une dose journalière de 2000 mg/m²), la première prise ayant lieu le soir du Jour 1 et la dernière prise le matin du jour 15. Cycles de 3 semaines comprenant 2 semaines de traitement suivi d’une semaine sans traitement.
FOLFIRINOX
Oxaliplatine 85 mg/m² administré en perfusion IV de deux heures dans 250 mL de glucosé à 5 % de façon concomitante (via une connexion en Y) avec acide folinique (400 mg/m² forme dl ou 200 mg/m² forme l) IV sur deux heures, dans 250 mL de glucosé à 5% suivi par irinotécan 180 mg/m² en perfusion IV de 90 minutes suivi par 5-FU 2 400 mg/m² en perfusion IV sur 46 heures. Cycles de 2 semaines.
Annexe 2. Niveaux de preuve
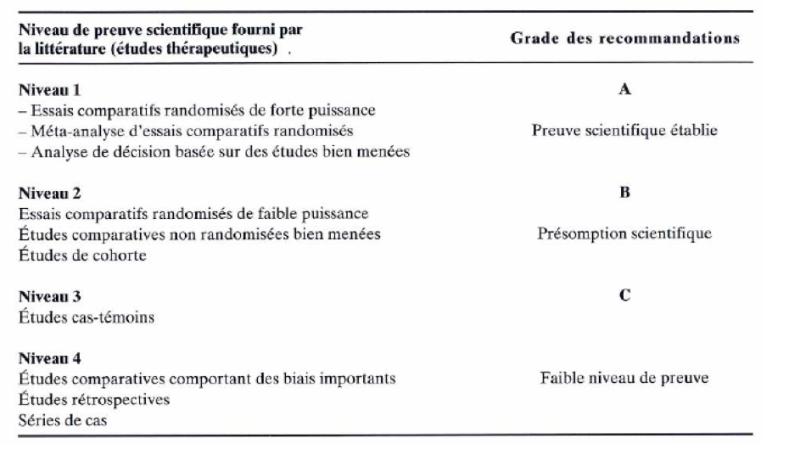
Références bibliographiques
- Allegra CJ, Jessup JM, Somerfield MR, Hamilton SR, Hammond EH, Hayes DF, McAllister PK, Morton RF, Schilsky RL. American Society of Clinical Oncology provisional clinical opinion: testing for KRAS gene mutations in patients with metastatic colorectal carcinoma to predict response to anti-epidermal growth factor receptor monoclonal antibody therapy. J Clin Oncol. 2009;27(12):2091-6.
- Allegra CJ, Yothers G, O'Connell MJ et al. Neoadjuvant 5-FU or Capecitabine Plus Radiation With or Without Oxaliplatin in Rectal CancerPatients: A Phase III Randomized Clinical Trial. J Natl CancerInst. 2015 Sep 14;107(11).
- Andre T, K.-K. Shiu, T.W. Kim, B.V. Jensen, L.H. Jensen, C. Punt, D. Smith, R. Garcia‑Carbonero, M. Benavides, P. Gibbs, C. de la Fouchardiere, F. Rivera, E. Elez, J. Bendell, D.T. Le, T. Yoshino, E. Van Cutsem, P. Yang, M.Z.H. Farooqui, P. Marinello, and L.A. Diaz, Jr., for the KEYNOTE-177 Investigators* Pembrolizumab in Microsatellite-Instabilitystabilitythi S, Li Y, Cai J, Kong N Engl J Med 2020d Medediaz, Jr.,
- Appelt AL, Pløen J, Vogelius IR, Bentzen SM, Jakobsen A. Radiation dose-response model for locally advanced rectal cancerafter preoperative chemoradiation therapy. Int J Radiat Oncol Biol Phys. 2013 Jan 1;85(1):74-80.
- Appelt AL, Vogelius IR, Pløen J, Rafaelsen SR, Lindebjerg J, Havelund BM, Bentzen SM, Jakobsen A. Long-term results of a randomized trial in locally advanced rectal cancer: no benefit from adding a brachytherapy boost. Int J Radiat Oncol Biol Phys. 2014 Sep 1;90(1):110-8
- Appelt AL, Pløen J, Harling H, Jensen FS, Jensen LH, Jørgensen JC, Lindebjerg J, Rafaelsen SR, Jakobsen A. High-dose chemoradiotherapy and watchful waiting for distal rectal cancer: a prospective observational study. Lancet Oncol. 2015 Aug;16(8):919-27.
- David Archampong, David Borowski, Peer Wille-Jørgensen, Lene H Iversen. Workload and surgeon's specialty for outcome after colorectal cancersurgery. Cochrane Database Syst Rev. 2012 Mar 14;(3):CD005391.
- Aschele C, Cionini L, Lonardi S, Pinto C, Cordio S, Rosati G et al. Primary Tumor Response to Preoperative Chemoradiation With or Without Oxaliplatin in Locally Advanced Rectal Cancer: Pathologic Results of the STAR-01 Randomized Phase III Trial. J Clin Oncol. 2011 Jul 10;29(20):2773-80.
- Azria D, Doyen J, Jarlier M, Martel-Lafay I, Hennequin C, Etienne P, Vendrely V, François E, de La Roche G, Bouché O, Mirabel X, Denis B, Mineur L, Berdah J, Mahé M, Bécouarn Y, Dupuis O, Lledo G, Seitz J, Bedenne L, Gourgou-Bourgade S, Juzyna B, Conroy T, Gérard J. Late toxicities and clinical outcome at 5 years of the ACCORD 12/0405-PRODIGE 02 trial comparing two neoadjuvant chemoradiotherapy regimens for intermediate-risk rectal cancer. Ann Oncol. 2017 Oct 1;28(10):2436-2442.
- Bachet JB, Rougier P, Gramont AD, André T. Rectal cancerand adjuvant chemotherapy : which conclusions ? Bull Cancer2010;97:107-22.
- Bachet JB, Lucidarme O, Levache CB, Barbier E, Raoul JL, Lecomte T, Desauw C, Brocard F, Pernot S, Breysacher G, Lagasse JP, Di Fiore F, Etienne PL, Dupuis OJM, Aleba A, Lepage C, Taieb J; for FFCD 1102 investigators. FOLFIRINOX as induction treatment in rectal cancerpatients with synchronous metastases: Results of the FFCD 1102 phase II trial. Eur J Cancer. 2018 Nov;104:108-116
- Bach SP, Hill J, Monson JR, Simson JN, Lane L, Merrie A, Warren B, Mortensen NJ; Association of Coloproctology of Great Britain and Ireland Transanal Endoscopic Microsurgery (TEM) Collaboration. A predictive model for local recurrence after transanal endoscopic microsurgery for rectal cancer. Br J Surg. 2009 Mar;96(3):280-90.
- Bahadoer RR, Dijkstra EA, van Etten B, et al. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer(RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol. 2021 Jan;22(1):29-42.
- Bahadoer RR, Hospers GAP, Marijnen CAM, Peeters KCMJ, Putter H, Dijkstra EA, Kranenbarg EM, Roodvoets AGH, van Etten B, Nilsson PJ, Glimelius B, van de Velde CJH; collaborative investigators. Risk and location of distant metastases in patients with locally advanced rectal cancerafter total neoadjuvant treatment or chemoradiotherapy in the RAPIDO trial. Eur J Cancer. 2023;185:139-149.
- Bahadoer R, Dijkstra E. Patterns of locoregional failure and distant metastases in patients treated for locally advanced rectal cancerin the RAPIDO trial. Eur J Surg Oncol 2022 ; 48 (2), E34. https://doi.org/10.1016/j.ejso.2021.12.439
- Basch E, Dueck AC, Mitchell SA, Mamon H, Weiser M, Saltz L, et al. Patient-Reported Outcomes During and After Treatment for Locally Advanced Rectal Cancerin the PROSPECT Trial (Alliance N1048). J Clin Oncol. 2023 Jul 20;41(21):3724-3734.
- Bascoul-Mollevi C, Gourgou S, Borg C, Etienne PL, Rio E, Rullier E Juzyna B, Castan F, Conroy T. Neoadjuvant Chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer(UNICANCER PRODIGE 23): Health-Related Quality of Life longitudinal analysis. Eur J Cancer2023 ;186:151-65.
- Baulieux J, Mabrut JY, Adham M, de La Roche E, Olagne E, Ducerf C et al. Excision of low rectal carcinomas with sphincter preservation. Multimodal strategy using neoadjuvant radiotherapy and "delayed" coloanal anastomosis. Bull Acad Natl Med 2004 ;188 :1509-1524.
- Beets-Tan RGH, Lambregts DMJ, Maas M, Bipat S, Barbaro B, Curvo-Semedo L, et al. Magnetic resonance imaging for clinical management of rectal cancer: Updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting. Eur Radiol. avr 2018;28(4):1465‑75.
- Bell S, Kong JC, Wale R, Staples M, Olivia K, Wilkins S, Mc Murrick P, Warrier SK. The effect of increasing body mass index on laparoscopic surgery for colon and rectal cancer. Colorectal Dis 2018 mar 25.
- Bhangu A, Brown G, Nicholls RJ, Wong J, Darzi A, Tekkis P. Survival outcome of local excision versus radical resection of colon or rectal carcinoma: a Surveillance, Epidemiology, and End Results (SEER) population-based study. Ann Surg. 2013 Oct;258(4):563-9.
- Bibeau F, Boissiere F, Laurent-Puig P. Formes familiales des cancers colorectaux : techniques diagnostiques. Colon Rectum 2011 ;5 :179-184.
- Bonjer HJ, Deijen CL, Haglind E; COLOR II Study Group. A Randomized Trial of Laparoscopic versus Open Surgery for Rectal Cancer. N Engl J Med. 2015 Jul 9;373(2):194.
- Bonnetain F, Bosset JF, Gerard JP et al. What is the clinical benefit of preoperative chemoradiotherapy with 5FU/leucovorin for T3-4 rectal cancerin a pooled analysis of EORTC 22921 and FFCD 9203 trials: surrogacy in question? Eur J Cancer. 2012 Aug;48(12):1781-90.
- Bonniaud P, Jacques J, Lambin T, Gonzalez JM, Dray X, Coron E, Leblanc S, Chevaux JB, Léger-Nguyen F, Hamel B, Lienhart I, Rivory J, Ponchon T, Saurin JC, Monzy F, Legros R, Lépilliez V, Subtil F, Barret M, Pioche M. Endoscopic characterization of colorectal neoplasia with different published classifications: comparative study involving CONECCT classification. Endosc Int Open. 2022 Jan 14;10(1):E145-E153
- Bosset JF, Collette L, Calais G, Mineur L, Maingon P, Radosevic-Jelic L, et al. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med 2006 ;355 :1114-1123.
- Bosset JF, Calais G, Mineur L et al. Fluorouracil-based adjuvant chemotherapy after preoperative chemoradiotherapy in rectal cancer: long-term results of the EORTC 22921 randomised study. Lancet Oncol. 2014 Feb;15(2):184-90.
- Borg C, Mantion G, Boudghène F, et al. Efficacy and safety of two neoadjuvant strategies with bevacizumab in MRI-defined locally advanced T3 resectable rectal cancer: final results of a randomized, noncomparative phase 2 INOVA study. Clin Colorectal Cancer2019; 18: 200–8.
- Boubaddi M, Fleming C, Vendrely V, Frulio N, Salut C, Rullier E, Denost Q. Feasibility study of a Response Surveillance Program in locally advanced mid and low rectal cancerto increase organ preservation. Eur J Surg Oncol. 2023 Jan;49(1):237-243. doi: 10.1016/j.ejso.2022.08.031. Epub 2022 Aug 31. PMID: 36114048
- Boustani J, Caubet M, Bosset JF. Adjuvant Chemotherapy in Rectal Cancerafter Chemoradiotherapy. Clin Oncol (R Coll Radiol). 2016 Feb;28(2):140-5
- Bouvier AM, Launoy G. Epidémiologie du cancercolorectal. Rev Prat 2015 ; 65 :767-773.
- Braendengen M, Tveit KM, Berglund A, Birkemeyer, Frykholm G, Pahlman L, et al. Randomized phase III study comparing preoperative radiotherapy with chemoradiotherapy in nonresectable rectal cancer. J Clin Oncol 2008;26:3687-3694.
- Breugom AJ, van Gijn W, Muller EW et al. Adjuvant chemotherapy for rectal cancerpatients treated with preoperative (chemo)radiotherapy and total mesorectal excision: a Dutch Colorectal CancerGroup (DCCG) randomized phase III trial. Ann Oncol. 2015 Apr;26(4):696-701.
- Breugom AJ, Vermeer TA, van den Broek CB, Vuong T, Bastiaannet E, Azoulay L, Dekkers OM, Niazi T, van den Berg HA, Rutten HJ, van de Velde CJ. Effect of preoperative treatment strategies on the outcome of patients with clinical T3, non-metastasized rectal cancer: A comparison between Dutch and Canadian expert centers. Eur J Surg Oncol. 2015 Aug;41(8):1039-44.
- Breugom AJ, Swets M, Bosset JF, Collette L, Sainato A, Cionini L, Glynne-Jones R, Counsell N, Bastiaannet E, van den Broek CB, Liefers GJ, Putter H, van de Velde CJ. Adjuvant chemotherapy after preoperative (chemo)radiotherapy and surgery for patients with rectal cancer: a systematic review and meta-analysis of individual patient data. Lancet Oncol. 2015 Feb;16(2):200-7.
- Breugom AJ, Swets M, van de Velde CJ. Adjuvant chemotherapy for rectal cancer- authors' reply. Lancet Oncol. 2015 Apr;16(4):e155.
- Brown GR M, Williams S. Recommendations for Cross-Sectional Imaging in CancerManagement. 2nd Edition. London, UK: The Royal College of Radiologists; 2014.
- Bujko K, Nowacki MP, Nasierowska-Guttmejer A. Sphincter preservation following preoperative radiotherapy for rectal cancer: report of a randomised trial comparing short-term radiotherapy vs. conventionally fractionated radiochemotherapy. Radiother Oncol 2004;72:15-24.
- Bujko K, Kepka L, Michalski W, Nowacki MP. Does rectal cancershrinkage induced by preoperative radio(chemo)therapy increase the likelihood of anterior resection? A systematic review of randomised trials. Radiother Oncol. 2006 Jul;80(1):4-12.
- Bujko K, Wyrwicz L, Rutkowski A, Malinowska M, Pietrzak L, Kryński J, Michalski W, Olędzki J, Kuśnierz J, Zając L, Bednarczyk M, Szczepkowski M, Tarnowski W, Kosakowska E, Zwoliński J, Winiarek M, Wiśniowska K, Partycki M, Bęczkowska K, Polkowski W, Styliński R, Wierzbicki R, Bury P, Jankiewicz M, Paprota K, Lewicka M, Ciseł B, Skórzewska M, Mielko J, Bębenek M, Maciejczyk A, Kapturkiewicz B, Dybko A, Hajac Ł, Wojnar A, Leśniak T, Zygulska J, Jantner D, Chudyba E, Zegarski W, Las-Jankowska M, Jankowski M, Kołodziejski L, Radkowski A, Żelazowska-Omiotek U, Czeremszyńska B, Kępka L, Kolb-Sielecki J, Toczko Z, Fedorowicz Z, Dziki A, Danek A, Nawrocki G, Sopyło R, Markiewicz W, Kędzierawski P, Wydmański J; Polish Colorectal Study Group. Long-course oxaliplatin-based preoperative chemoradiation versus 5 × 5 Gy and consolidation chemotherapy for cT4 or fixed cT3 rectal cancer: results of a randomized phase III study. Ann Oncol. 2016 May;27(5):834-42
- Buscail E, Canivet C, Ghouti L, Kirzin S, Carrere N, Molinier L, Rosillo A, Lauwers-Cances V, Costa N; French Research Group of Rectal CancerSurgery (GRECCAR Group). Randomised clinical trial for the cost-utility evaluation of two strategies of perineal reconstruction after abdominoperineal resection in the context of anorectal carcinoma: biological mesh repair versus primary perineal wound closure, study protocol for the GRECCAR 9 Study..BMJ Open. 2021 Apr 1;11(4):e043333. doi: 10.1136/bmjopen-2020-043333.PMID: 33795299
- Capirci C, Valentini V, Cionini L, De Paoli A, Rodel C, Glynne-Jones R, Coco C, Romano M, Mantello G, Palazzi S, Mattia FO, Friso ML, Genovesi D, Vidali C, Gambacorta MA, Buffoli A, Lupattelli M, Favretto MS, La Torre G. Prognostic value of pathologic complete response after neoadjuvant therapy in locally advanced rectal cancer: long-term analysis of 566 ypCR patients. Int J Radiat Oncol Biol Phys. 2008 Sep 1;72(1):99-107.
- Cardone C, Martini G, Troiani T et al. Genetic landscape of primary versus metastatic coloRCTal cancer: to what extent are they concordant ? Curr Colorectal CancerRep 2015;11:217-224.
- Cercek A et al. PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med. 2022 Jun 23;386(25):2363-2376.
- Chalabi et al.Neoadjuvant immune checkpoint inhibition in locally advanced MMR-deficient colon cancer: the NICHE-2 study LBA 7. Annals of Oncology (2022)
- Chand M, Evans J, Swift RI, Tekkis PP, West NP, Stamp G, Heald RJ, Brown G.The prognostic significance of postchemoradiotherapy high-resolution MRI and histopathology detected extramural venous invasion in rectal cancer. Ann Surg. 2015 Mar;261(3):473-9.
- Christou N, Meyer J, Combescure C, Balaphas A, Robert-Yap J, Buchs NC, et al. Prevalence of Metastatic Lateral Lymph Nodes in Asian Patients with Lateral Lymph Node Dissection for Rectal Cancer: A Meta-analysis. World J Surg. mai 2021;45(5):1537‑47.
- Chua YJ, Barbachano Y, Cunningham D, Oates JR, Brown G, Wotherspoon A, Tait D, Massey A, Tebbutt NC, Chau I. Neoadjuvant capecitabine and oxaliplatin before chemoradiotherapy and total mesorectal excision in MRI-defined poor-risk rectal cancer: a phase 2 trial. Lancet Oncol. 2010 Mar;11(3):241-8.
- Clancy C, Burke JP, Albert MR, O’Connell PR, Winter DC. Transanal endoscospic microsurgery versus standard transanal excision for the removal of rectal neoplasms: a systematic review and meta-analysis. Dis Colon Rectum. 2015; 58(2):254-61
- Conroy T, Lamfichekh N, Etienne P-L, et al. Total neoadjuvant therapy with mFOLFIRINOX versus preoperative chemoradiation in patients with locally advanced rectal cancer: final results of PRODIGE 23 phase III trial, a UNICANCER GI trial. Lancet Oncol 2021
- Conroy T, Etienne P-L., Rio E, Evesque L, Mesgouez-Nebout N, Vendrely V, Artignan X, Bouché O, Boilève A, Delaye M, Gargot D, Boige V, Bonichon-Lamichhane N, Louvet C , de la Fouchardière C, Morand C, Pezzella V, Rullier E, Castan F, Borg C. Total neoadjuvant therapy with mFOLFIRINOX versus preoperative chemoradiation in patients with locally advanced rectal cancer: 6-year results of PRODIGE 23 phase III trial, a UNICANCER GI trial. J Clin Oncol 2023 ;41, Suppl, abstr 3504.
- Cotte E, Passot G, Decullier E, Maurice C, Glehen O, François Y, Lorchel F, Chapet O, Gerard JP. Pathologic Response, When Increased by Longer Interval, Is a Marker but Not the Cause of Good Prognosis in Rectal Cancer: 17-year Follow-up of the Lyon R90-01 Randomized Trial. Int J Radiat Oncol Biol Phys. 2016 Mar 1;94(3):544-53.
- Cottet V, Bouvier V, Rollot F, Jooste V, Bedenne L, Faivre J, Launoy G, Bouvier AM. Incidence and patterns of late recurrences in rectal cancerpatients. Ann Surg Oncol. 2015 Feb;22(2):520-7.
- Crane CH, Skibber JM, Feig BW, Vauthey JN, Thames HD, Curley SA, Rodriguez-Bigas MA, Wolff RA, Ellis LM, Delclos ME, Lin EH, Janjan NA. Response to preoperative chemoradiation increases the use of sphincter-preserving surgery in patients with locally advanced low rectal carcinoma. Cancer. 2003 Jan 15;97(2):517-24.
- de Gramont A, Van Cutsem E, Schmoll HJ. Bevacizumab plus oxaliplatin-based chemotherapy as adjuvant treatment for colon cancer(AVANT): a phase 3 randomised controlled trial. Lancet Oncol. 2012 Dec;13(12):1225-33.
- Deijen CL, Velthuis S, Tsai A, Mavroveli S, de Lange-de Klerk ES, et al. COLOR III: a multicentre randomised clinical trial comparing transanal TME versus laparoscopic TME for mid and low rectal cancer. Surg Endosc 2016; 30: 3210-3215.
- Deenen MJ, Meulendijks D, Cats A, Sechterberger MK, Severens JL, Boot H, et al. Upfront Genotyping of DPYD*2A to Individualize Fluoropyrimidine Therapy: A Safety and Cost Analysis. J Clin Oncol. 2016;34:227-34.
- Deng Y, Chi P, Ping Lan P, et al. : Modified FOLFOX6 With or Without Radiation VersusFluorouracil and Leucovorin With Radiation in Neoadjuvant Treatment of Locally Advanced Rectal Cancer: Initial Results of the Chinese FOWARC Multicenter, Open-Label, Randomized Three-Arm Phase III Trial. J Clin Oncol 2016 ;34:3300-3307.
- Deng Y, Chi P, Lan P, Wang L, Chen W, Cui L, Chen D, Cao J, Wei H, Peng X, Huang Z, Cai G, Zhao R, Huang Z, Xu L, Zhou H, Wei Y, Zhang H, Zheng J, Huang Y, Zhou Z, Cai Y, Kang L, Huang M, Wu X, Peng J, Ren D, Wang J. Neoadjuvant Modified FOLFOX6 With or Without Radiation Versus Fluorouracil Plus Radiation for Locally Advanced Rectal Cancer: Final Results of the Chinese FOWARC Trial. J Clin Oncol. 2019 Dec 1;37(34):3223-33.
- Devulapalli C, Jia Wei AT, DiBiagio JR, Baez ML, Baltodano PA, Seal SM, Sacks JM, Cooney CM, Rosson GD. Primary versus Flap Closure of Perineal Defects following Oncologic Resection: A Systematic Review and Meta-Analysis. Plast Reconstr Surg. 2016 May;137(5):1602-13
- Dewdney A, Cunningham D, Tabernero J et al. Multicenter randomized phase II clinical trial comparing neoadjuvant oxaliplatin, capecitabine, and preoperative radiotherapy with or without cetuximab followed by total mesorectal excision in patients with high-risk rectal cancer(EXPERT-C). J Clin Oncol. 2012 May 10;30(14):1620-7.
- Dhadda AS, Martin A, Killeen S, Hunter IA. Organ Preservation Using Contact Radiotherapy for Early Rectal Cancer: Outcomes of Patients Treated at a Single Centre in the UK. Clin Oncol (R Coll Radiol). 2017 Mar;29(3):198-204.
- J Diers , J Wagner , P Baum , S Lichthardt , C Kastner , N Matthes 1, H Matthes , C-T Germer , S Löb , A Wiegering. Nationwide in-hospital mortality rate following rectal resection for rectal canceraccording to annual hospital volume in Germany. BJS Open. 2020 Apr;4(2):310-319.
- Dijkstra EA, Nilsson PJ, Hospers GAP, Bahadoer RR, Meershoek-Klein Kranenbarg E, Roodvoets AGH, Putter H, Berglund Å, Cervantes A, Crolla RMPH, Hendriks MP, Capdevila J, Edhemovic I, Marijnen CAM, van de Velde CJH, Glimelius B, van Etten B; and collaborative investigators. Locoregional Failure During and After Short-course Radiotherapy followed by Chemotherapy and Surgery Compared to Long-course Chemoradiotherapy and Surgery - A Five-year Follow-up of the RAPIDO Trial. Ann Surg. 2023 Jan 20.
- Dijkstra EA, Zwart WH, Nilsson PJ, Putter H, Roodvoets AGH, Meershoek-Klein Kranenbarg E, Frödin JE, Nygren P, Østergaard L, Kersten C, Verbiené I, Cervantes A, Hendriks MP, Capdevila J, Edhemovic I, van de Velde CJH, Marijnen CAM, van Etten B, Hospers GAP, Glimelius B; collaborative investigators. The value of post-operative chemotherapy after chemoradiotherapy in patients with high-risk locally advanced rectal cancer-results from the RAPIDO trial. ESMO Open. 2023 ;8(2):101158.
- Dworak O, Keilholz L, Hoffmann A. Pathological features of rectal cancerafter preoperative radiochemotherapy. Int J Colorectal Dis 1997;12:19-23.
- Elliot AH, Martling A, Glimelius B, Nordenvall C, Johansson H, Nilsson PJ. Preoperative treatment selection in rectal cancer: a population-based cohort study. Eur J Surg Oncol. 2014 Dec;40(12):1782-8.
- Emmertsen KJ, Laurberg S. Low anterior resection syndrome score: development and validation of a symptom-based scoring system for bowel dysfunction after low anterior resection for rectal cancer. Ann Surg. 2012 May;255(5):922-8.
- Erlandsson J, Holm T, Pettersson D, Berglund Å, Cedermark B, Radu C, Johansson H, Machado M, Hjern F, Hallböök O, Syk I, Glimelius B, Martling A. Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer(Stockholm III): a multicentre, randomised, non-blinded, phase 3, non-inferiority trial. Lancet Oncol. 2017 Mar;18(3):336-346.
- Martin Fabritius , Jean-Michel Gonzalez, Aymeric Becq , Xavier Dray , Emmanuel Coron , Lucie Brenet-Defour, Julien Branche, Romain Gerard, Côme Lepage, Laurent Poinclou, Isabelle Lienhart, Paul Bonniaud , Mohamed Tayeb Bounnah, Jérôme Rivory, Vincent Lépilliez, Fabien Subtil, Jean-Christophe Saurin, Thierry Ponchon, Jérémie Jacques, Mathieu Pioche. A simplified table using validated diagnostic criteria is effective to improve characterization of colorectal polyps: the CONECCT teaching program. Endosc Int Open. 2019 Oct;7(10):E1197-E1206.
- Faron M, Pignon JP, Malka D, Bourredjem A, Douillard JY, Adenis A, Elias D, Bouché O, Ducreux M. Is primary tumour resection associated with survival improvement in patients with colorectal cancerand unresectable synchronous metastases? A pooled analysis of individual data from four randomised trials. Eur J Cancer. 2015 Jan;51(2):166-76.
- Farroni N, Van den Bosch A, Haustermans K, Van Cutsem E, Moons P, D'hoore A, Penninckx F. Perineal colostomy with appendicostomy as an alternative for an abdominal colostomy: symptoms, functional status, quality of life, and perceived health. Dis Colon Rectum. 2007 Jun;50(6):817-24.
- Faucheron JL, Rullier E. Cancerdu rectum. Rapport du 111ème congrès français de chirurgie. Monographies de l’association française de chirurgie. 2009 ; Edition Arnette
- Fazio VW, Zutshi M, Remzi FH, Parc Y, Ruppert R, Fürst A, Celebrezze J Jr, Galanduik S, Orangio G, Hyman N, Bokey L, Tiret E, Kirchdorfer B, Medich D, Tietze M, Hull T, Hammel J. A randomized multicenter trial to compare long-term functional outcome, quality of life, and complications of surgical procedures for low rectal cancers. Ann Surg. 2007 Sep;246(3):481-8; discussion 488-90.
- Feng Q, Yuan W, Li T, Tang B, Jia B, Zhou Y, Zhang W, Zhao R, Zhang C, Cheng L, Zhang X, Liang F, He G, Wei Y, Xu J; REAL Study Group. Robotic versus laparoscopic surgery for middle and low rectal cancer(REAL): short-term outcomes of a multicentre randomised controlled trial. Lancet Gastroenterol Hepatol. 2022 Nov;7(11):991-1004. doi: 10.1016/S2468-1253(22)00248-5. Epub 2022 Sep 8.
- Fernandez, Laura M. M.D.1; São Julião, Guilherme P. M.D.2,3,4; Renehan, Andrew G. M.D., Ph.D.5,6; Beets, Geerard L. M.D., Ph.D.7,8; Papoila, Ana L. Ph.D.9; Vailati, Bruna B. M.D.2,3,4; Bahadoer, Renu R. M.D.10; Kranenbarg, Elma Meershoek-Klein M.Sc.10; Roodvoets, Annet G. H. M.D.10; Figueiredo, Nuno L. M.D., Ph.D.1,10; Van De Velde, Cornelis J. H. M.D., Ph.D.7,10; Habr-Gama, Angelita M.D., Ph.D.2,4,12; Perez, Rodrigo O. M.D., Ph.D.2,3,4,13; On behalf of the International Watch & Wait Database (IWWD) Consortium. The Risk of Distant Metastases in Patients With Clinical Complete Response Managed by Watch and Wait After Neoadjuvant Therapy for Rectal Cancer: The Influence of Local Regrowth in the International Watch and Wait Database. Diseases of the Colon & Rectum 66(1):p 41-49, January 2023. | DOI: 10.1097/DCR.0000000000002494
- Fernández-Martos C, Pericay C, Aparicio J et al. Phase II, randomized study of concomitant chemoradiotherapy followed by surgery and adjuvant capecitabine plus oxaliplatin (CAPOX) compared with induction CAPOX followed by concomitant chemoradiotherapy and surgery in magnetic resonance imaging-defined, locally advanced rectal cancer: Grupo cancerde recto 3 study. J Clin Oncol. 2010 Feb 10;28(5):859-65.
- Fernández-Martos C, Pericay C, Losa F, et al. Effect of aflibercept plus modified FOLFOX6 induction chemotherapy before standard chemoradiotherapy and surgery in patients with high-risk rectal adenocarcinoma: the GEMCAD 1402 randomized clinical trial. JAMA Oncol 2019; 5: 1566–73.
- Ferlitsch M, Moss A, Hassan C, Bhandari P, Dumonceau J-M, Paspatis G, et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2017;49:270–97. doi:10.1055/s-0043-102569.
- Folkesson J, Birgisson H, Pahlman L, Cedermark B, Glimelius B, Gunnarsson U. Swedish Rectal CancerTrial: long lasting benefits from radiotherapy on survival and local recurrence rate. J Clin Oncol. 2005;23 (24):5644-50.
- Fleshman J, Branda M, Sargent DJ, Boller AM, George V, Abbas M, Peters WR Jr, Maun D, Chang G, Herline A, Fichera A, Mutch M, Wexner S, Whiteford M, Marks J, Birnbaum E, Margolin D, Larson D, Marcello P, Posner M, Read T, Monson J, Wren SM, Pisters PW, Nelson H. Effect of Laparoscopic-Assisted Resection vs Open Resection of Stage II or III Rectal Canceron Pathologic Outcomes: The ACOSOG Z6051 Randomized Clinical Trial. JAMA. 2015 Oct 6;314(13):1346-55. doi: 10.1001/jama.2015.10529.
- François E, Azria D, Gourgou-Bourgade S, Jarlier M, Martel-Laffay I, Hennequin C, Etienne PL, Vendrely V, Seitz JF, Conroy T, Juzyna B, Gerard JP. Results in the elderly with locally advanced rectal cancerfrom the ACCOR12/PRODIGE 2 phase III trial: tolerance and efficacy. 2014 Jan;110(1):144-9.
- François E, Gourgou-Bourgade S, Azria D et al. ACCORD12/0405-Prodige 2 phase III trial neoadjuvant treatment in rectal cancer: Results after 5 years of follow-up. J Clin Oncol 34, 2016 (suppl 4S; abstr 490)
- François E, Pernot M, Ronchin P, Nouhaud E, Martel-Lafy I, Artru P, Clavere P, Vendrely V, Boige V, Thamphya B, Nenan S, Magné N. NACRE : A randomized study comparing short course radiotherapy with radiochimiotherapy for locally advanced recatl cancerin the elderly. ASCO-GI 2021
- Francois Y, Nemoz CJ, Baulieux J, Vignal J, Grandjean JP, Partensky C, Souquet JC, Adeleine P, Gerard JP. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial. J Clin Oncol. 1999 Aug;17(8):2396.
- Frin AC, Evesque L, Gal J, Benezery K, François E, Gugenheim J, Benizri E, Château Y, Marcié S, Doyen J, Gérard JP. Organ or sphincter preservation for rectal cancer. The role of contact X-ray brachytherapy in a monocentric series of 112 patients.Eur J Cancer. 2017 Feb;72:124-136
- Frontali A, Benichou B, Valcea I, et al. Is follow-up still mandatory more than 5 years after surgery for colorectal cancer? Updates Surg. 2020 Mar;72(1):55-60.
- Gao X, Wang C, Yu Y, Singh D, Yang L, Zhou Z. Lateral lymph node dissection reduces local recurrence of locally advanced lower rectal cancerin the absence of preoperative neoadjuvant chemoradiotherapy: a systematic review and meta-analysis. World J Surg Oncol. 23 nov 2020;18(1):304.
- Garant A, Magnan S, Devic S, Martin AG, Boutros M, Vasilevsky CA, Ferland S, Bujold A, DesGroseilliers S, Sebajang H, Richard C, Vuong T. Image Guided Adaptive Endorectal Brachytherapy in the Nonoperative Management of Patients With Rectal Cancer. Int J Radiat Oncol Biol Phys. 2019 Dec 1;105(5):1005-1011.
- Galon J, Binedea G, Mlecnik B, Angell H, Lagorce C, Todosi AM, Berger A, Pages F. Intratumoral immune microenvironment and survival : the immunoscore. Med Sci 2014;30:439-44.
- Garcia-Aguilar J, Shi Q, Thomas CR Jr, Chan E, Cataldo P, Marcet J, Medich D, Pigazzi A, Oommen S, Posner MC. A phase II trial of neoadjuvant chemoradiation and local excision for T2N0 rectal cancer: preliminary results of the ACOSOG Z6041 trial. Ann Surg Oncol. 2012 Feb;19(2):384-91.
- Garcia-Aguilar J, Chow OS, Smith DD et al. Timing of Rectal CancerResponse to Chemoradiation Consortium. Effect of adding mFOLFOX6 after neoadjuvant chemoradiation in locally advanced rectal cancer: a multicentre, phase 2 trial. Lancet Oncol. 2015 Aug;16(8):957-66.
- Garcia-Aguilar J, Renfro LA, Chow OS, Shi Q, Carrero XW, Lynn PB, Thomas CR Jr, Chan E, Cataldo PA, Marcet JE, Medich DS, Johnson CS, Oommen SC, Wolff BG, Pigazzi A, McNevin SM, Pons RK, Bleday R. Lancet Oncol. 2015 Nov;16(15):1537-46.
- Garcia-Aguilar J, Patil S, Gollub MJ, Kim JK, Yuval JB, Thompson HM, Verheij FS, Omer DM, Lee M, Dunne RF, Marcet J, Cataldo P, Polite B, Herzig DO, Liska D, Oommen S, Friel CM, Ternent C, Coveler AL, Hunt S, Gregory A, Varma MG, Bello BL, Carmichael JC, Krauss J, Gleisner A, Paty PB, Weiser MR, Nash GM, Pappou E, Guillem JG, Temple L, Wei IH, Widmar M, Lin S, Segal NH, Cercek A, Yaeger R, Smith JJ, Goodman KA, Wu AJ, Saltz LB. Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy. J Clin Oncol. 2022 Aug 10;40(23):2546-2556. doi: 10.1200/JCO.22.00032. Epub 2022 Apr 28. PMID: 35483010; PMCID: PMC9362876.
- Gerard JP, Romestaing P, Chapet O. Radiotherapy alone in the curative treatment of rectal carcinoma. Lancet Oncol 2003;4:158-66.
- Gerard JP, Chapet O, Nemoz C, Hartweig J, Romestaing P, Coquard R, Barbet N, Maingon P, Mahe M, Baulieux J, Partensky C, Papillon M, Glehen O, Crozet B, Grandjean JP, Adeleine P. Improved sphincter preservation in low rectal cancerwith high-dose preoperative radiotherapy: the lyon R96-02 randomized trial. J Clin Oncol. 2004;22 (12):2404-9.
- Gérard JP, Conroy T, Bonnetain F, Bouché O, Chapet O, Closon-Dejardin MT, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203. J Clin Oncol. 2006;24:4620-5.
- Gérard JP, Azria D, Gourgou-Bourgade S, Martel-Laffay I, Hennequin C, Etienne PL, Vendrely V, François E, de La Roche G, Bouché O, Mirabel X, Denis B, Mineur L, Berdah JF, Mahé MA, Bécouarn Y, Dupuis O, Lledo G, Montoto-Grillot C, Conroy T. Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol. 2010;28(10):1638-44.
- Gérard JP, Azria D, Gourgou-Bourgade S et al. Clinical Outcome of the ACCORD 12/0405 PRODIGE 2 Randomized Trial in Rectal Cancer. J Clin Oncol. 2012 Dec 20;30(36):4558-65.
- Gerard JP, Rostom Y, Gal J, Benchimol D, Ortholan C, Aschele C, Levi JM. Can we increase the chance of sphincter saving surgery in rectal cancerwith neoadjuvant treatments: lessons from a systematic review of recent randomized trials. Crit Rev Oncol Hematol. 2012 Jan;81(1):21-8
- Gérard JP, Chamorey E, Gourgou-Bourgade S, Benezery K, de Laroche G, Mahé MA, Boige V, Juzyna B. Clinical complete response (cCR) after neoadjuvant chemoradiotherapy and conservative treatment in rectal cancer. Findings from the ACCORD 12/PRODIGE 2 randomized trial. Radiother Oncol. 2015 May;115(2):246-52.
- Gerard JP, Frin AC, Doyen J, Zhou FX, Gal J, Romestaing P, Barbet N, Coquard R, Chapet O, François E, Marcié S, Benezery K. Organ preservation in rectal adenocarcinoma (T1) T2-T3 Nx M0. Historical overview of the Lyon Sud – Nice experience using contact x-ray brachytherapy and external beam radiotherapy for 120 patients. Acta Oncol. 2015 Apr;54(4):545-51.
- Gerard JP, Barbet N, Schiappa R, Magné N, Martel I, Mineur L, Deberne M, Zilli T, Dhadda A, Myint AS; ICONE group. Neoadjuvant chemoradiotherapy with radiation dose escalation with contact x-ray brachytherapy boost or external beam radiotherapy boost for organ preservation in early cT2-cT3 rectal adenocarcinoma (OPERA): a phase 3, randomised controlled trial. Lancet Gastroenterol Hepatol. 2023 Feb 16:S2468-1253(22)00392-2.
- Glimelius B, Tiret E, Cervantes A, Arnold D; ESMO Guidelines Working Group. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013 Oct;24 Suppl 6:vi81-8.
- Glynne-Jones R, Hughes R. Critical appraisal of the 'wait and see' approach in rectal cancerfor clinical complete responders after chemoradiation. Br J Surg. 2012 Jul;99(7):897-909.
- Gunderson LL, Jessup JM, Sargent DJ, Greene FL, Stewart A. Revised tumor and node categorization for rectal cancerbased on surveillance, epidemiology, and end results and rectal pooled analysis outcomes. J Clin Oncol. 2010 ;28 (2):256-63.
- Guzmán Y, Ríos J, Paredes J, Domínguez P, Maurel J, González-Abós C, Otero-Piñeiro A, Almenara R, Ladra M, Prada B, Pascual M, Guerrero MA, García-Granero Á, Fernández L, Ochogavia-Seguí A, Gamundi-Cuesta M, González-Argente FX, Pons LV, Centeno A, Arrayás Á, de Miguel A, Gil-Gómez E, Gómez B, Martínez JG, Lacy AM, de Lacy FB. Time Interval Between the End of Neoadjuvant Therapy and Elective Resection of Locally Advanced Rectal Cancerin the CRONOS Study. JAMA Surg. 2023 Jul 12:e232521. doi: 10.1001/jamasurg.2023.2521.
- Habr-Gama A, Perez RO, Nadalin W, Sabbaga J, Ribeiro U Jr, Silva e Sousa AH Jr, Campos FG, Kiss DR, Gama-Rodrigues J. Operative versus nonoperative treatment for stage 0 distal rectal cancerfollowing chemoradiation therapy: long-term results. Ann Surg. 2004 Oct;240(4):711-7
- Habr-Gama A, Perez RO, Sabbaga J, Nadalin W, São Julião GP, Gama-Rodrigues J. Increasing the rates of complete response to neoadjuvant chemoradiotherapy for distal rectal cancer: results of a prospective study using additional chemotherapy during the resting period. Dis Colon Rectum. 2009;52:1927-34.
- Habr-Gama A, Gama-Rodrigues J, São Julião GP, Proscurshim I, Sabbagh C, Lynn PB, Perez RO. Local recurrence after complete clinical response and watch and wait in rectal cancerafter neoadjuvant chemoradiation: impact of salvage therapy on local disease control. Int J Radiat Oncol Biol Phys. 2014 Mar 15;88(4):822-8.
- Harewood GC. Assessment of clinical impact of endoscopic ultrasound on rectal cancer. Am J Gastroenterol 2004;99:623-627.
- Hassan C, Wysocki PT, Fuccio L, et al. Endoscopic surveillance after surgical or endoscopic resection for colorectal cancer: European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Digestive Oncology (ESDO) Guideline. Endoscopy. 2019;51:266-77.
- Hassan C, Antonelli G, Dumonceau JM, et al. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy. 2020;52:687-700.
- Hayashi N, Tanaka S, Hewett DG, Kaltenbach TR, Sano Y, Ponchon T, et al. Endoscopic prediction of deep submucosal invasive carcinoma: validation of the narrow-band imaging international colorectal endoscopic (NICE) classification. Gastrointest Endosc 2013;78:625–32. doi:10.1016/j.gie.2013.04.185.
- Heald RJ, Ryall D. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet 1986;1(8496):1479-82.
- Hermanek P, Merkel S, Fietkau R, Rödel C, Hohenberger W. Regional lymph node metastasis and locoregional recurrence of rectal carcinoma in the era of TME surgery. Implications for treatment decisions. Int J Colorectal Dis 2010,25:359-368.
- Hofheinz RD, Wenz F, Post S, Matzdorff A, Laechelt S, Hartmann JT, Müller L, Link H, Moehler M, Kettner E, Fritz E, Hieber U, Lindemann HW, Grunewald M, Kremers S, Constantin C, Hipp M, Hartung G, Gencer D, Kienle P, Burkholder I, Hochhaus A. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol. 2012 Jun;13(6):579-88.
- Hong YS, Nam BH, Kim KP et al. Oxaliplatin, fluorouracil, and leucovorin versus fluorouracil and leucovorin as adjuvant chemotherapy for locally advanced rectal cancerafter preoperative chemoradiotherapy (ADORE): an open-label, multicentre, phase 2, randomised controlled trial. Lancet Oncol. 2014 Oct;15(11):1245-53.
- Hong YS, Kim SY, Lee JS, et al. Oxaliplatin-based adjuvant chemotherapy for rectal cancerafter preoperative chemoradiotherapy (ADORE): long-term results of a randomized controlled trial. J Clin Oncol 2019; 37: 3111–23.
- Horvat N, Carlos Tavares Rocha C, Clemente Oliveira B, Petkovska I, Gollub MJ. MRI of Rectal Cancer: Tumor Staging, Imaging Techniques, and Management.Radiographics. 2019 Mar-Apr;39(2):367-87.
- Hu H, Kang L, Zhang J, Wu Z, Wang H, Huang M, Lan P, Wu X, Wang C, Cao W, Hu J, Huang Y, Huang L, Wang H, Shi L, Cai Y, Shen C, Ling J, Xie X, Cai Y, He X, Dou R, Zhou J, Ma T, Zhang X, Luo S, Deng W, Ling L, Liu H, Deng Y. Neoadjuvant PD-1 blockade with toripalimab, with or without celecoxib, in mismatch repair-deficient or microsatellite instability-high, locally advanced, colorectal cancer(PICC): a single-centre, parallel-group, non-comparative, randomised, phase 2 trial. Lancet Gastroenterol Hepatol 2022 ;7 :38-48.
- Hutchins G, Southward K, Handley K, Magill L, Beaumont C, Stahlschmidt J, Richman S, Chambers P, Seymour M, Kerr D, Gray R, Quirke P. Value of mismatch repair, KRAS, and BRAF mutations in predicting recurrence and benefits from chemotherapy in colorectal cancer. J Clin Oncol 2011;29:1261-70.
- IJspeert JEG, Bastiaansen BAJ, van Leerdam ME, Meijer GA, van Eeden S, Sanduleanu S, et al. Development and validation of the WASP classification system for optical diagnosis of adenomas, hyperplastic polyps and sessile serrated adenomas/polyps. Gut 2016;65:963–70. doi:10.1136/gutjnl-2014-308411.
- INCA. Recommandations INCa statut MMR tumoral Évaluation du statut MMR tumoral, Collection Recommandations et référentiels, Institut national du cancer, novembre 2021
- INCA. Patients atteints d’un adénocarcinome colorectal / Indications des tests moléculaires en vue de la prescription de traitements de précision, Collection Recommandations et référentiels, Institut national du cancer, juin 2022
- Ishihara S, Hayama T, Yamada H, Nozawa K, Matsuda K, Miyata H, Yoneyama S, Tanaka T, Tanaka J, Kiyomatsu T, Kawai K, Nozawa H, Kanazawa T, Kazama S, Yamaguchi H, Sunami E, Kitayama J, Hashiguchi Y, Sugihara K, Watanabe T. Prognostic impact of primary tumor resection and lymph node dissection in stage IV colorectal cancerwith unresectable metastasis: a propensity score analysis in a multicenter retrospective study. Ann Surg Oncol. 2014 Sep;21(9):2949-55
- Issa N, Fenig Y, Gingold-Belfer R, Khatib M, Khoury W, Wolfson L, Schmilovitz-Weiss H, laparoscopic total mesorectal excision following transanal endoscopic microsurgery for rectal cancer, J Laparoendosc Adv Surg Tech A, Apr 2018.
- Ito M, Kobayashi A, Fujita S, Mizusawa J, Kanemitsu Y, Kinugasa Y, et al. Urinary dysfunction after rectal cancersurgery: Results from a randomized trial comparing mesorectal excision with and without lateral lymph node dissection for clinical stage II or III lower rectal cancer(Japan Clinical Oncology Group Study, JCOG0212). Eur J Surg Oncol. avr 2018;44(4):463‑8.
- Iwatate M et al; Japan NBI Expert Team (JNET). Validation study for development of the Japan NBI Expert Team classification of colorectal lesions. Dig Endosc. 2018 Sep;30(5):642-651. doi: 10.1111/den.13065. Epub 2018 Jun 26.
- Jansen RL, Beets GL. Which way is forward in the treatment of rectal cancer? Nat Rev Clin Oncol. 2013 Jan;10(1):12-3.
- Jayne D, Pigazzi A, Marshall H, Croft J, Corrigan N, Copeland J, Quirke P, West N, Rautio T, Thomassen N, Tilney H, Gudgeon M, Bianchi PP, Edlin R, Hulme C, Brown J. Effect of Robotic-Assisted vs Conventional Laparoscopic Surgery on Risk of Conversion to Open Laparotomy Among Patients Undergoing Resection for Rectal Cancer: The ROLARR Randomized Clinical Trial. JAMA. 2017 Oct 24;318(16):1569-1580.
- Jeffery M, Hickey BE, Hider PN, See AM. Follow-up strategies for patients treated for non-metastatic colorectal cancer. Cochrane Database Syst Rev. 2016 Nov 24;11
- Jeong SY, Park JW, Nam BH, Kim S, Kang SB, Lim SB, Choi HS, Kim DW, Chang HJ, Kim DY, Jung KH, Kim TY, Kang GH, Chie EK, Kim SY, Sohn DK, Kim DH, Kim JS, Lee HS, Kim JH, Oh JH. Open versus laparoscopic surgery for mid-rectal or low-rectal cancerafter neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label, non-inferiority, randomised controlled trial. Lancet Oncol. 2014 Jun;15(7):767-74.
- Joye I, Haustermans K. Clinical target volume delineation for rectal cancerradiation therapy: time for updated guidelines? Int J Radiat Oncol Biol Phys. 2015 Mar 15;91(4):690-1.
- Kang SB, Park JW, Jeong SY, Nam BH, Choi HS, et al. Open versus laparoscopic surgery for mid or low rectal cancerafter neoadjuvant chemoradiotherapy (COREAN trial): short-term outcomes of an open-label randomised controlled trial. Lancet Oncol 2010; 11: 637-645.
- Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T, Rutten HJ, Pahlman L, Glimelius B, van Krieken JH, Leer JW, van de Velde CJ; Dutch Colorectal CancerGroup. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med. 2001;345(9):638-46.
- Kim DW, Lim SB, Kim DY, Kim TH, Jung KH, Kim DH, Chang HJ, Sohn DK, Hong CW, Choi HS, Jeong SY, Park JG. Pre-operative chemo-radiotherapy improves the sphincter preservation rate in patients with rectal cancerlocated within 3 cm of the anal verge. Eur J Surg Oncol. 2006 Mar;32(2):162-7.
- Kim YI, Jang JK, Park IJ, Park SH, Kim JB, Park JH, et al. Lateral lymph node and its association with distant recurrence in rectal cancer: A clue of systemic disease. Surg Oncol. déc 2020;35:174‑81.
- Konishi K, Akita Y, Kaneko K, Kurahashi T, Yamamoto T, Kusayanagi S, et al. Evaluation of endoscopic ultrasonography in colorectal villous lesions. Int J Colorectal Dis 2003;18:19–24. doi:10.1007/s00384-002-0423-6.
- Kudo S, Rubio CA, Teixeira CR, Kashida H, Kogure E. Pit pattern in colorectal neoplasia: endoscopic magnifying view. Endoscopy 2001;33:367–73. doi:10.1055/s-2004-826104.
- Kudo S, Tamura S, Nakajima T, Yamano H, Kusaka H, Watanabe H. Diagnosis of colorectal tumorous lesions by magnifying endoscopy. Gastrointest Endosc 1996;44:8–14.
- Lacy AM, Tasende MM, Delgado S, Fernandez-Hevia M, Jimenez M, De Lacy B, Castells A, Bravo R, Wexner SD, Heald RJ. Transanal Total Mesorectal Excision for Rectal Cancer: Outcomes after 140 Patients. J Am Coll Surg. 2015 Aug;221(2):415-23.
- Lakkis Z, Barthet M, Koch S, Lelong B, Rouanet P, Gérard JP. Recommandations pour la pratique Clinique Cancerdu rectum. Colon Rectum 2015
- Lee SW, Lee JH, Lee IK, Oh ST, Kim DY, Kim TH, Oh JH, Baek JY, Chang HJ, Park HC, Kim HC, Chie EK, Nam TK, Jang HS. The Impact of Surgical Timing on Pathologic Tumor Response after Short Course and Long Course Preoperative Chemoradiation for Locally Advanced Rectal Adenocarcinoma. CancerRes Treat. 2018 Jul;50(3):1039-1050.
- Lefevre JH, Mineur L, Kotti S, Rullier E, Rouanet P, de Chaisemartin C, Meunier B, Mehrdad J, Cotte E, Desrame J, Karoui M, Benoist S, Kirzin S, Berger A, Panis Y, Piessen G, Saudemont A, Prudhomme M, Peschaud F, Dubois A, Loriau J, Tuech JJ, Meurette G, Lupinacci R, Goasgen N, Parc Y, Simon T, Tiret E. Effect of Interval (7 or 11 weeks) Between Neoadjuvant Radiochemotherapy and Surgery on Complete Pathologic Response in Rectal Cancer: A Multicenter, Randomized, Controlled Trial (GRECCAR-6). J Clin Oncol. 2016 Nov 1;34(31):3773-3780.
- C. Lepage. J.M. Phelip. L. Cany. E. Barbier. S. Manfredi. P. Deguiral. R. Faroux. M. Baconnier. D. Pezet. J. Duchmann. E. Terrebonne. A. Adenis. M. Benabdelghani. J. Ain. G. Breysacher. I. Boillot-Benedetto. A. Pelaquier. P. Prost. A. Lièvre. O. Bouché Effect of 5 years of imaging and CEA follow-up to detect recurrence of colorectal cancer(CRC) PRODIGE 13 an FFCD phase III trial. ESMO congress 2020
- Levic K, Bulut O, Hesselfeldt P, Bülow S. The outcome of rectal cancerafter early salvage TME following TEM compared with primary TME: a case-matched study. Tech Coloproctol.2013; 17:397–403.
- Lezoche E, Baldarelli M, Lezoche G, Paganini AM, Gesuita R, Guerrieri M. Randomized clinical trial of endoluminal locoregional resection versus laparoscopic total mesorectal excision for T2 rectal cancerafter neoadjuvant therapy. Br J Surg. 2012 Sep;99(9):1211-8.
- Loriot MA, Ciccolini J, Thomas F, Barin-Le-Guellec C, Royer B, Milano G, Picard N, Becquemont L, Verstuyft C, Narjoz C, Schmitt A, Bobin-Dubigeon C, Harle A, Paci A, Poinsignon V, Quaranta S, Evrard A, Hennart B, Broly F, Fonrose X, Lafay-Chebassier C, Wozny AS, Masskouri F, Boyer JC, Etienne-Grimaldi MC. Dihydropyrimidine déhydrogenase (DPD) deficiency screening and securing of fluoropyrimidine-based chemotherapies: Update and recommendations of the French GPCO-Unicancer and RNPGx networks.Bull Cancer. 2018 Apr;105(4):397-407.
- Lujan J, Valero G, Hernandez Q, Sanchez A, Frutos MD, et al. Randomized clinical trial comparing laparoscopic and open surgery in patients with rectal cancer. Br J Surg. 2009 ; 96: 982-989.
- Luna-Pérez P, Rodríguez-Ramírez S, Hernández-Pacheco F, Gutiérrez De La Barrera M, Fernández R, Labastida S. Anal sphincter preservation in locally advanced low rectal adenocarcinoma after preoperative chemoradiation therapy and coloanal anastomosis. J Surg Oncol. 2003 Jan;82(1):3-9.
- Lupattelli M, Matrone F, Gambacorta MA, Osti M, Macchia G, Palazzari E, Nicosia L, Navarria F, Chiloiro G, Valentini V, Aristei C, De Paoli A. Preoperative intensity-modulated radiotherapy with a simultaneous integrated boost combined with Capecitabine in locally advanced rectal cancer: short-term results of a multicentric study. Radiat Oncol. 2017 Aug 22;12(1):139.
- Ma B, Gao P, Wang H, Xu Q, Song Y, Huang X, Sun J, Zhao J, Luo J, Sun Y, Wang Z. What has preoperative radio(chemo)therapy brought to localized rectal cancerpatients in terms of perioperative and long-term outcomes over the past decades? A systematic review and meta-analysis based on 41,121 patients. Int J Cancer. 2017 Sep 1;141(5):1052-1065.
- Maas M, Nelemans PJ, Valentini V, Crane CH, Capirci C, Rödel C, Nash GM, Kuo LJ, Glynne-Jones R, García-Aguilar J, Suárez J, Calvo FA, Pucciarelli S, Biondo S, Theodoropoulos G, Lambregts DM, Beets-Tan RG, Beets GL. Adjuvant chemotherapy in rectal cancer: defining subgroups who may benefit after neoadjuvant chemoradiation and resection: a pooled analysis of 3,313 patients. Int J Cancer. 2015 Jul 1;137(1):212-20.
- Maas M, Nelemans PJ, Valentini V, Das P, Rödel C, Kuo LJ, et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol. 2010;11:835-44.
- Maas M, Beets-Tan RG, Lambregts DM et al. Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer. J Clin Oncol. 2011 Dec 10;29(35):4633-40.
- Maas M, Lambregts DM, Nelemans PJ, Heijnen LA, Martens MH, Leijtens JW, Sosef M, Hulsewé KW, Hoff C, Breukink SO, Stassen L, Beets-Tan RG, Beets GL. Assessment of Clinical Complete Response After Chemoradiation for Rectal Cancerwith Digital Rectal Examination, Endoscopy, and MRI: Selection for Organ-Saving Treatment. Ann Surg Oncol. 2015 Jul 22.
- Maréchal R, Vos B, Polus M, et al. Short course chemotherapy followed by concomitant chemoradiotherapy and surgery in locally advanced rectal cancer: a randomized multicentric phase II study. Ann Oncol 2012; 23: 1525–30
- Marks G, Mohiuddin M, Masoni L. The reality of radical sphincter preservation surgery for cancerof the distal 3 cm of rectum following high-dose radiation. Int J Radiat Oncol Biol Phys. 1993 Nov 15;27(4):779-83.
- Marsh PJ, James RD, Schofield PF. Adjuvant preoperative radiotherapy for locally advanced rectal carcinoma. Dis Colon Rectum 1994;37:1205-14.
- Moons LMG, Bastiaansen BAJ, Richir MC, Hazen WL, Tuynman J, Elias SG, Schrauwen RWM, Vleggaar FP, Dekker E, Bos P, Fariña Sarasqueta A, Lacle M, Hompes R, Didden P. Endoscopic intermuscular dissection for deep submucosal invasive cancerin the rectum: a new endoscopic approach. Endoscopy. 2022 Oct;54(10):993-998.
- Moore HG, Riedel E, Minsky B, Saltz L, Paty P, Wong D et al. Adequacy of 1-cm distal margin after restorative rectal cancerresection with sharp mesorectal excision and preoperative combined-modality therapy. Ann. Surg. Oncol. 2003;10:80-85.
- Morino M, Allaix ME, Caldart M, Scozzari G, Arezzo A. Risk factors for recurrence after transanal endoscopic microsurgery for rectal malignant neoplasm. Surg Endosc. 2011 Nov;25(11)
- Morino M, Risio M, Bach S, Beets-Tan R, Bujko K, Panis Y, Quirke P, Rembacken B, Rullier E, Saito Y, Young-Fadok T, Allaix ME; European Association for Endoscopic Surgery; European Society of Coloproctology. Early rectal cancer: the European Association for Endoscopic Surgery (EAES) clinical consensus conference. Surg Endosc. 2015 Apr;29(4):755-73.
- Morino M, Allaix ME, Arolfo S, Arezzo A. Previous transanal endoscopic microsurgery for rectal cancerrepresents a risk factor for an increased abdominoperineal resection rate. Surg Endo. 2013; 27:3315-21
- Nagawa H, Muto T, Sunouchi K, Higuchi Y, Tsurita G, Watanabe T, Sawada T. Randomized, controlled trial of lateral node dissection vs. nerve-preserving resection in patients with rectal cancerafter preoperative radiotherapy. Dis Colon Rectum. 2001 Sep;44(9):1274-80.
- Nagtegaal I, Tot T, Jayne D, McShane P, Nihlberg A, Marshall H et al. Lymph nodes, tumor deposits, and TNM : are we getting better ? J Clin Oncol 2011;29:2487-2492.
- Ngan SY, Burmeister B, Fisher RJ et al. Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04. J Clin Oncol. 2012 Nov 1;30(31):3827-33.
- Nijkamp J, Kusters M, Beets-Tan RG, Martijn H, Beets GL, van de Velde CJ, Marijnen CA. Three-dimensional analysis of recurrence patterns in rectal cancer: the cranial border in hypofractionated preoperative radiotherapy can be lowered. Int J Radiat Oncol Biol Phys. 2011;80 (1):103-10.
- Nilsson PJ, van Etten B, Hospers GA, Påhlman L, van de Velde CJ, Beets-Tan RG, Blomqvist L, Beukema JC, Kapiteijn E, Marijnen CA, Nagtegaal ID, Wiggers T, Glimelius B. Short-course radiotherapy followed by neo-adjuvant chemotherapy in locally advanced rectal cancer--the RAPIDO trial. BMC Cancer. 2013 Jun 7;13:279.
- Nougaret S, Reinhold C, Mikhael HW, Rouanet P, Bibeau F, Brown G. The use of MR imaging in treatment planning for patients with rectal carcinoma: have you checked the "DISTANCE"? Radiology. 2013 Aug;268(2):330-44.
- O’Connel MJ, Martenson JA, Wieand HS, Krook JE, Macdonald JS, Haller DG et al. Improving adjuvant therapy for rectal cancerby combining protracted-infusion fluorouracil with radiation theraopy after curative surgery. N Engl J Med 1994;331:502-507.
- Ogura A, Konishi T, Cunningham C, Garcia-Aguilar J, Iversen H, Toda S, et al. Neoadjuvant (Chemo)radiotherapy With Total Mesorectal Excision Only Is Not Sufficient to Prevent Lateral Local Recurrence in Enlarged Nodes: Results of the Multicenter Lateral Node Study of Patients With Low cT3/4 Rectal Cancer. Journal of Clinical Oncology. janv 2019;37(1):33‑43.
- Ogura A, Konishi T, Beets GL, Cunningham C, Garcia-Aguilar J, Iversen H, et al. Lateral Nodal Features on Restaging Magnetic Resonance Imaging Associated With Lateral Local Recurrence in Low Rectal CancerAfter Neoadjuvant Chemoradiotherapy or Radiotherapy. JAMA Surg. 1 sept 2019;154(9):e192172.
- Ortenzi M, Ghiselli R, Paolucci A, Guerrieri M, the feasibility of laparoscopic rectal resction in patients undergoing reoperoration after transanl endoscopic microsurgery ; Surg Endosc 2018 Apr, 32(4) :2020-2025
- Ortholan C, Romestaing P, Chapet O, Gerard JP. Correlation in rectal cancerbetween clinical tumor response after neoadjuvant radiotherapy and sphincter or organ preservation: 10-year results of the Lyon R 96-02 randomized trial. Int J Radiat Oncol Biol Phys. 2012 Jun 1;83(2):e165-71.
- Pahlman L, Bujko K, Rutkowski A, Michalski W. Altering the therapeutic paradigm towards a distal bowel margin of less than 1 cm in patients with low-lying rectal cancer: a systematic review and commentary. Colorectal Dis 2013;15(4):e166-74.
- Park JH, Yoon SM, Yu CS, Kim JH, Kim TW, Kim JC. Randomized phase 3 trial comparing preoperative and postoperative chemoradiotherapy with capecitabine for locally advanced rectal cancer. Cancer. 2011 Aug 15;117(16):3703-12
- Park JS, Lee SM, Choi GS, Park SY, Kim HJ, Song SH, Min BS, Kim NK, Kim SH, Lee KY. Comparison of Laparoscopic Versus Robot-Assisted Surgery for Rectal Cancers: The COLRAR Randomized Controlled Trial. Ann Surg. 2023 Jul 1;278(1):31-38. doi: 10.1097/SLA.0000000000005788. Epub 2023 Jan 3.
- Patel UB, Taylor F, Blomqvist L, George C, Evans H, Tekkis P, Quirke P, Sebag-Montefiore D, Moran B, Heald R, Guthrie A, Bees N, Swift I, Pennert K, Brown G. Magnetic Resonance Imaging-Detected Tumor Response for Locally Advanced Rectal CancerPredicts Survival Outcomes: MERCURY Experience. J Clin Oncol 2011;29:3753-60.
- Patenotte A, Yzet C, Wallenhorst T, Subtil F, Leblanc S, Schaefer M, Walter T, Lambin T, Fenouil T, Lafeuille P, Chevaux JB, Legros R, Rostain F, Rivory J, Jacques J, Lépilliez V, Pioche M. Diagnostic endoscopic submucosal dissection for colorectal lesions with suspected deep invasion. Endoscopy. 2023 Feb;55(2):192-197.
- Peacock O, Chang GJ. The Landmark Series: Management of Lateral Lymph Nodes in Locally Advanced Rectal Cancer. Ann Surg Oncol. août 2020;27(8):2723‑31.
- Penna M, Hompes R, Arnold S, Wynn G, Austin R, Warusavitarne J, Moran B, Hanna GB, Mortensen NJ, Tekkis PP; TaTME Registry Collaborative. Transanal Total Mesorectal Excision: International Registry Results of the First 720 Cases. Ann Surg. 2017 Jul;266(1):111-117.
- Perkins G, Laurent-Puig L. Biologie des cancers colorectaux. Rev Prat 2015 ; 65 ;802-806.
- Petersen SH et al. Cochrane Data Base Sys Rev 2012; 3 : CD0040078.
- Pettersson D, Lörinc E, Holm T, Iversen H, Cedermark B, Glimelius B, Martling A. Tumour regression in the randomized Stockholm III Trial of radiotherapy regimens for rectal cancer. Br J Surg. 2015 Jul;102(8):972-8.
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, Repici A, Vieth M, De Ceglie A, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015;47:829–54. doi:10.1055/s-0034-1392882.
- Pimentel-Nunes P, Libânio D, Bastiaansen BAJ, Bhandari P, Bisschops R, Bourke MJ, Esposito G, Lemmers A, Maselli R, Messmann H, Pech O, Pioche M, Vieth M, Weusten BLAM, van Hooft JE, Deprez PH, Dinis-Ribeiro M. Endoscopic submucosal dissection for superficial gastrointestinal lesions: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2022. Endoscopy. 2022 Jun;54(6):591-622.
- Polanco PM, Mokdad AA, Zhu H, Choti MA, Huerta S. Association of Adjuvant Chemotherapy With Overall Survival in Patients With Rectal Cancerand Pathologic Complete Response Following Neoadjuvant Chemotherapy and Resection. JAMA Oncol. 2018 Jul 1;4(7):938-943.
- Pucciarelli S, De Paoli A, Guerrieri M, La Torre G, Maretto I, De Marchi F, Mantello G, Gambacorta MA, Canzonieri V, Nitti D, Valentini V, Coco C. Local excision after preoperative chemoradiotherapy for rectal cancer: results of a multicenter phase II clinical trial. Dis Colon Rectum. 2013 Dec;56(12):1349-56.
- QUASAR Collaborative Group. Adjuvant versus observation in patients with colorectal cancer: a randomised study. Lancet 2007;370:2020-2029.
- Quirke P, Steele R, Monson J, Grieve R, Khanna S, Couture J, O'Callaghan C, Myint AS, Bessell E, Thompson LC, Parmar M, Stephens RJ, Sebag-Montefiore D; MRC CR07/NCIC-CTG CO16 Trial Investigators; NCRI Colorectal CancerStudy Group. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: a prospective study using data from the MRC CR07 and NCIC-CTG CO16 randomised clinical trial. Lancet 2009;373:821-8.
- Renehan AG, Malcomson L, Emsley R et al. Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer(the OnCoRe project): a propensity-score matched cohort analysis. Lancet Oncol. 2015 Dec 16. pii: S1470-2045(15)00467-2.
- Rödel C, Liersch T, Becker H et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol. 2012 Jul;13(7):679-87.
- Rödel C, Graeven U, Fietkau R et al. Oxaliplatin added to fluorouracil-based preoperative chemoradiotherapy and postoperative chemotherapy of locally advanced rectal cancer(the German CAO/ARO/AIO-04 study): final results of the multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2015 Aug;16(8):979-89.
- Roman S, Cenni JC, Roy P. Pujol B, Napoleon B, Kerriven-Souquet O et al. Value of rectal ultrasound in predicting staging and outcome in patients with rectal adenocarcinoma. Dis. Colon Rectum 2004;47(9):1323-1330.
- Rouanet P, Saint-Aubert B, Lemanski C, Senesse P, Gourgou S, Quenet F, Ycholu M, Kramar A, Dubois J. Restorative and nonrestorative surgery for low rectal cancerafter high-dose radiation: long-term oncologic and functional results. Dis Colon Rectum. 2002 Mar;45(3):305-13
- Rullier E. Transanal Mesorectal Excision: The New Challenge in Rectal Cancer. Dis Colon Rectum. 2015 Jul;58(7):621-2.
- Rullier E, Rouanet P, Tuech JJ, Valverde A, Lelong B, Rivoire M, Faucheron JL, Jafari M, Portier G, Meunier B, Sileznieff I, Prudhomme M, Marchal F, Pocard M, Pezet D, Rullier A, Vendrely V, Denost Q, Asselineau J, Doussau A. Organ preservation for rectal cancer(GRECCAR 2): a prospective, randomised, open-label, multicentre, phase 3 trial. Lancet. 2017 Jul 29;390(10093):469-479.
- Rullier E, Vendrely V, Asselineau J, Rouanet P, Tuech JJ, Valverde A, de Chaisemartin C, Rivoire M, Trilling B, Jafari M, Portier G, Meunier B, Sieleznieff I, Bertrand M, Marchal F, Dubois A, Pocard M, Rullier A, Smith D, Frulio N, Frison E, Denost Q. Organ preservation with chemoradiotherapy plus local excision for rectal cancer: 5-year results of the GRECCAR 2 randomised trial. Lancet Gastroenterol Hepatol. 2020 May;5(5):465-474
- Rutten HJ, den Dulk M, Lemmens VE, van de Velde CJ, Marijnen CA. Controversies of total mesorectal excision for rectal cancerin elderly patients. Lancet Oncol. 2008 ;9 (5):494-501.
- Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, et al; German Rectal CancerStudy Group. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004;351:1731-40.
- Sauer R, Liersch T, Merkel S et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol. 2012 Jun 1;30(16):1926-33.
- Schaap DP, Ogura A, Nederend J, Maas M, Cnossen JS, Creemers GJ, et al. Prognostic implications of MRI-detected lateral nodal disease and extramural vascular invasion in rectal cancer. Br J Surg. déc 2018;105(13):1844‑52
- Schaap DP, Boogerd LSF, Konishi T, Cunningham C, Ogura A, Garcia-Aguilar J, et al. Rectal cancerlateral lymph nodes: multicentre study of the impact of obturator and internal iliac nodes on oncological outcomes. Br J Surg. 12 mars 2021;108(2):205‑13.
- Schmoll HJ, Haustermans K, Price TJ et al. Preoperative chemoradiotherapy and postoperative chemotherapy with capecitabine and oxaliplatin versus capecitabine alone in locally advanced rectal cancer: first results of the PETACC-6 randomized phase III trial. J Clin Oncol 2014: abstract 3501.
- Schmoll HJ, Stein A, Van Cutsem E, Price T, Hofheinz RD, Nordlinger B, Daisne J-F, Janssens J, Brenner B, Reinel H, Hollerbach S, Caca K, Fauth F, Hannig CV, Zalcberg J, Niall Tebbutt N, Murielle E. Mauer, Marreaud S, Lutz MP, and Karin Haustermans K, Pre- and Postoperative Capecitabine Without or With Oxaliplatin in Locally Advanced Rectal Cancer: PETACC 6 Trial by EORTC GITCG and ROG, AIO, AGITG, BGDO, and FFCD. J Clin Oncol 2021
- Schmoll HJ, Twelves C, Sun W, O'Connell MJ, Cartwright T, McKenna E, Saif M, Lee S, Yothers G, Haller D. Effect of adjuvant capecitabine or fluorouracil, with or without oxaliplatin, on survival outcomes in stage III colon cancerand the effect of oxaliplatin on post-relapse survival: a pooled analysis of individual patient data from four randomised controlled trials. Lancet Oncol. 2014 Dec;15(13):1481-92.
- Schrag D, Weiser MR, Goodman KA, Gonen M, Hollywood E, Cercek A, Reidy-Lagunes DL, Gollub MJ, Shia J, Guillem JG, Temple LK, Paty PB, Saltz LB. Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer: a pilot trial. J Clin Oncol. 2014 Feb 20;32(6):513-8.
- Schrag D, Shi Q, Weiser MR, Gollub MJ, Saltz LB, Musher BL, et al. Preoperative Treatment of Locally Advanced Rectal Cancer. N Engl J Med. 2023 Jul 27;389(4):322-334.
- Sebag-Montefiore D, Stephens RJ, Steele R, Monson J, Grieve R, Khanna S, et al. Lancet. 2009 ;373 (9666):811-20.
- Shia J, McManus M, Guillem JG, Leibold T, Zhou Q, Tang LH, Riedel ER, Weiser MR, Paty PB, Temple LK, Nash G, Kolosov K, Minsky BD, Wong WD, Klimstra DS. Significance of acellular mucin pools in rectal carcinoma after neoadjuvant chemoradiotherapy. Am J Surg Pathol. 2011;35(1):127-34.
- Sparreboom CL, Wu Z, Lingsma HF, Menon AG, Kleinrensink GJ, Nuyttens JJ, Wouters MW, Lange JF; Dutch ColoRectal Audit Group. Anastomotic Leakage and Interval between Preoperative Short-Course Radiotherapy and Operation for Rectal Cancer. J Am Coll Surg. 2018 Mar 31.
- Stephens RJ, Thompson LC, Quirke P, Steel R, Grieve R, Couture J et al. Impact of short-course preoperative radiotherapy for rectal canceron patients’quality of life : data from the medical research coucinl CR07/National CancerInstitute of Canada clinical trials Group C016 randomized clinical trial. J Clin Oncol 2010;28:4233-4239.
- Stevenson AR, Solomon MJ, Lumley JW, Hewett P, Clouston AD, Gebski VJ, Davies L, Wilson K, Hague W, Simes J; ALaCaRT Investigators. Effect of Laparoscopic-Assisted Resection vs Open Resection on Pathological Outcomes in Rectal Cancer: The ALaCaRT Randomized Clinical Trial. JAMA. 2015 Oct 6;314(13):1356-63.
- Sun Myint A, Smith FM, Gollins SW, Wong H, Rao C, Whitmarsh K, Sripadam R, Rooney P, Hershman MJ, Fekete Z, Perkins K, Pritchard DM. Dose escalation using contact X-ray brachytherapy (Papillon) for rectal cancer: does it improve the chance of organ preservation? Br J Radiol. 2017 Dec;90(1080)
- Taieb J, Taberno J, Mini E, et al. Ajduvant FOLFOX-4 with and without cetuximab in KRAS wildtype patients with resected stage III colon cancer. Results from PETACC8 Intergroup trail. Ann Oncol 2012,23 (Sup 4) : IV17.
- Thariat J, Hannoun-Levi JM, Sun Myint A, Vuong T, Gérard JP. Past, present, and future of radiotherapy for the benefit of patients. Nat Rev Clin Oncol. 2012 Dec 11;10(1):52-60.
- Tey J, Leong CN, Cheong WK, Sze TG, Yong WP, Tham IWK, Lee KM. A phase II trial of preoperative concurrent chemotherapy and dose escalated intensity modulated radiotherapy (IMRT) for locally advanced rectal cancer. J Cancer. 2017 Sep 6;8(16):3114-3121.
- Tilly C, Lefèvre JH, Svrcek M, Shields C, Fléjou JF, Tiret E, Parc Y. R1 rectal resection: look up and don't look down. Ann Surg. 2014 Nov;260(5):794-9.
- Tournigand C, André T, Bonnetain F et al. Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer: subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancertrial. J Clin Oncol. 2012 Sep 20;30(27):3353-60.
- Tuech JJ, Karoui M, Lelong B, De Chaisemartin C, Bridoux V, Manceau G, Delpero JR, Hanoun L, Michot F. A step toward NOTES total mesorectal excision for rectal cancer: endoscopic transanal proctectomy. Ann Surg. 2015 Feb;261(2):228-33.
- Ueno H, Mochizuki H, Hashiguchi Y, Shimazaki H, Aida S, Hase K, Matsukuma S, Kanai T, Kurihara H, Ozawa K, Yoshimura K, Bekku S. Risk factors for an adverse outcome in early invasive colorectal carcinoma. Gastroenterology. 2004 Aug;127(2):385-94.
- Uraoka T, Saito Y, Ikematsu H, Yamamoto K, Sano Y. Sano’s capillary pattern classification for narrow-band imaging of early colorectal lesions. Dig Endosc Off J Jpn Gastroenterol Endosc Soc 2011;23 Suppl 1:112–5. doi:10.1111/j.1443-1661.2011.01118.x.
- Valentini V, Gambacorta MA, Barbaro B, Chiloiro G, Coco C, Das P, Fanfani F, Joye I, Kachnic L, Maingon P, Marijnen C, Ngan S, Haustermans K. International consensus guidelines on Clinical Target Volume delineation in rectal cancer. Radiother Oncol. 2016 Aug;120(2):195-201.
- van Gijn W, Marijnen CA, Nagtegaal ID, Kranenbarg EM, Putter H, Wiggers T, Rutten HJ, Påhlman L, Glimelius B, van de Velde CJ; Dutch Colorectal CancerGroup. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol. 2011 Jun;12(6):575-82.
- van der Valk MJM, Marijnen CAM, van Etten B et al. Compliance and tolerability of short-course radiotherapy followed by preoperative chemotherapy and surgery for high-risk rectal cancer- Results of the international randomized RAPIDO-trial. Radioth Oncol 2020; 147: 75–83.
- Vendrely V, Rivin Del Campo E, Modesto A, Jolnerowski M, Meillan N, Chiavassa S, Serre AA, Gérard JP, Créhanges G, Huguet F, Lemanski C, Peiffert D. Rectal cancerradiotherapy. CancerRadiother. 2022 Feb-Apr;26(1-2):272-278. doi: 10.1016/j.canrad.2021.11.002. Epub 2021 Dec 23. PMID: 34953708
- Vuong T, Devic S, Podgorsak E. High dose rate endorectal brachytherapy as a neoadjuvant treatment for patients with resectable rectal cancer. Clin Oncol 2007;19:701-705.
- Wang QX, Xiao BY, Cheng Y, Wu AW, Zhang T, Wang H, Zhang X, Huang WX, Tang JH, Jiang W, Steele SR, Krishnamurthi S, Li Y, Cai J, Kong LH, Li DD, Pan ZZ, Zhang XS Ding PR. Anti-PD-1-based immunotherapy as curative-intent treatment in dMMR/MSI-H rectal cancer: A multicentre cohort study. Eur J Cancer2022 ; 174 :176-84.
- Wawok P, Polkowski W, Richter P, Szczepkowski M, Olędzki J, Wierzbicki R, Gach T, Rutkowski A, Dziki A, Kołodziejski L, Sopyło R, Pietrzak L, Kryński J, Wiśniowska K, Spałek M, Pawlewicz K, Polkowski M, Kowalska T, Paprota K, Jankiewicz M, Radkowski A, Chalubińska-Fendler J, Michalski W, Bujko K; Polish Colorectal CancerStudy Group. Preoperative radiotherapy and local excision of rectal cancer: Long-term results of a randomised study. Radiother Oncol. 2018 Jun;127(3):396-403.
- Wasmuth HH, Faerden AE, Myklebust TÅ, Pfeffer F, Norderval S, Riis R, Olsen OC, Lambrecht JR, Kørner H, Larsen SG; Norwegian TaTME Collaborative Group, on behalf of the Norwegian Colorectal CancerGroup, Forsmo HM, Baekkelund O, Lavik S, Knapp JC, Sjo O, Rashid G. Transanal total mesorectal excision for rectal cancerhas been suspended in Norway. Br J Surg. 2020 Jan;107(1):121-130.
- Wee CW, Kang HC, Wu HG, Chie EK, Choi N, Park JM, Kim JI, Huang CM, Wang JY, Ng SY, Goodman KA. Intensity-modulated radiotherapy versus three-dimensional conformal radiotherapy in rectal cancertreated with neoadjuvant concurrent chemoradiation: a meta-analysis and pooled-analysis of acute toxicity. Jpn J Clin Oncol. 2018 May 1;48(5):458-466.
- Weiser MR, Quah HM, Shia J, Guillem JG, Paty PB, Temple LK, Goodman KA, Minsky BD, Wong WD. Sphincter preservation in low rectal canceris facilitated by preoperative chemoradiation and intersphincteric dissection. Ann Surg. 2009 Feb;249(2):236-42.
- West NP, Finan PJ, Anderin C, Lindholm J, Holm T, Quirke P. Evidence of the oncologic superiority of cylindrical abdominoperineal excision for low rectal cancer. J Clin Oncol. 2008;26(21):3517-22.
- Williamson JS, Quyn AJ, Sagar PM. Rectal cancerlateral pelvic sidewall lymph nodes: a review of controversies and management. Br J Surg. nov 2020;107(12):1562‑9.
- Wiltshire KL, Ward IG, Swallow C et al. Preoperative radition with concurrent chemotherapy for resectable rectal cancer: effect of dose escalation on pathologic complete response, local recurrence-free survival, disease-free survival, and overall survival. Int J Radiat Oncol Biol Phys 2006,3:709-16.
- Yang Y, Wang G, He J, Zhang J, Xi J, Wang F. High tie versus low tie of the inferior mesenteric artery in colorectal cancer: A meta-analysis. Int J Surg. 2018 Apr;52:20-24
- Zhao J, Hu W, Cai G, Wang J, Xie J, Peng J, Zhang Z. Dosimetric comparisons of VMAT, IMRT and 3DCRT for locally advanced rectal cancerwith simultaneous integrated boost. Oncotarget. 2016 Feb 2;7(5):6345-51.
- Zwager LW, Bastiaansen BAJ, Montazeri NSM, Hompes R, Barresi V, Ichimasa K, Kawachi H, Machado I, Masaki T, Sheng W, Tanaka S, Togashi K, Yasue C, Fockens P, Moons LMG, Dekker E. Deep Submucosal Invasion Is Not an Independent Risk Factor for Lymph Node Metastasis in T1 Colorectal Cancer: A Meta-Analysis. Gastroenterology. 2022 Jul;163(1):174-189.

