7. Carcinome hépatocellulaire (cancer primitif du foie)
(Dernière mise à jour le : )Principaux changements de la mise à jour du 18/10/2025
Mise à jour des tableaux, figures et algorithme
7.1. Dépistage : place d’AFP et autres marqueurs tumoraux (algorithme chapitre 7.2)
7.2. Bilan pré-traitement :
7.2.2.1. absence de place du TEP-scan
7.2.2.2. ajout évaluation de l’hypertension portale
7.2.2.4. reformulation éléments nécessaires à la décision thérapeutique
7.3. Traitement :
7.3.1.1.3. Destruction percutanée : ajout d’un tableau comparant différentes méthodes
7.3.1.1.4. refonte du paragraphe SBRT (radiothérapie stéréotaxique)
7.3.1.1.5. Traitement adjuvant : étude négative IMBRAVE 050, mise à jour antiviraux
7.3.1.2. Traitements palliatifs :
7.3.1.2.1. Chimio-embolisation artérielle : essais d’association (EMERALD1 et LEAP012)
7.3.1.2.2. SIRT : refonte du chapitre en 5 parties (mise en œuvre pratique, sélection des patients, situation précoce, stades intermédiaires, stades avancés avec invasion vasculaire macroscopique, intégration nouveau libellé d’indication HAS
7.3.1.2.3. discussion essais CM 9DW, mono-immunothérapie (durvalumab, tislelizumab) en 1ère ligne, de 2ème ligne post-immunothérapie, ajout paragraphe cirrhose CHILD B / C
7.3.2. Indications thérapeutiques : mise à jour algorithme thérapeutique, tableau choix thérapeutique entre chirurgie et destruction percutanée
7.3.2.1.2.
• CHC non accessible à traitement curateur : modification REFERENCES et OPTIONS (SIRT et tableau d’orientation entre chimio-embolisation et SIRT)
• Traitement 1ère ligne : ajout association ipilimumab + nivolumab et nouvel algorithme
• Traitement 2ème ligne : pas de REFERENCES mais uniquement OPTIONS avec intégration d’immunothérapie en seconde ligne après 1ère ligne par immunothérapie
Groupe de travail et relecteurs
Recommandations communes avec l'AFEF
Groupe de travail :
Jean-Frédéric BLANC, coordonnateur, (Bordeaux), Eric ASSENAT (Montpellier), Anne-Sophie BAUMANN (Nancy), Valérie BOIGE (Villejuif), Karim BOUDJEMA (Rennes), Mohamed BOUATTOUR (Clichy), Gilles CREHANGE (Paris), Barbara DAUVOIS (Orléans), Thomas DECAENS (Grenoble), François DEWAELE (Nantes), Julien EDELINE (Rennes), Olivier FARGES (Clichy), Boris GUIU (Montpellier), Antoine HOLLEBECQUE (Villejuif), Philippe MERLE (Lyon), Valérie PARADIS (Clichy) Gaël ROTH (Grenoble), Isaac RUIZ (Créteil).
Relecteurs :
A ABERGEL (Clermont-Ferrand), T APARICIO (Paris), O BOUCHE (Reims), JP BRONOWICKI (Nancy), E BUC (Clermont-Ferrand), JF CADRANEL (Creil), T DE BAERE (Villejuif), M DUCREUX (Villejuif), A HEURGUE (Reims), F HUGUET (Paris), A LANDAU (Dreux), M LAPEYRE (Toulouse), JY MABRUT (Lyon), B MENAHEM (Caen), I OLLIVIER-HOURNAUD (Caen), JM PERON (Toulouse), L QUINTANE (Valence), F DARLOY (Douai), JM REGIMBEAU (Amiens), C SILVAIN (Poitiers), B SUC (Toulouse).
Comment citer ce chapitre du TNCD :
Blanc JF, Debaillon-Vesque A, Roth G, Barbare JC, Baumann AS, Boige V, Boudjema K, Bouattour M, Crehange G, Dauvois B, Decaens T, Dewaele F, Farges O, Guiu B, Hollebecque A, Merle P, Selves J, Aparicio T, Ruiz I, Bouché O; Thésaurus National de Cancérologie Digestive (TNCD); (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, AFEF, SIAD, SFR/FRI). Clin Res Hepatol Gastroenterol. 2021 Mar;45(2):101590. doi: 10.1016/j.clinre.2020.101590. Epub 2021 Mar 26. PMID: 33780876.
Et mise à jour 2025 :
JF Blanc, E Assenat, AS Baumann, V Boige, K Boudjema, M Bouattour, G Crehange, B Dauvois, T Decaens, F Dewaele, J Edeline, O Farges, B Guiu, A Hollebecque, P Merle, V Paradis, G Roth, I Ruiz. « Carcinome hépatocellulaire ». Thésaurus National de Cancérologie Digestive, octobre 2025, en ligne [http://www.tncd.org]
7.1. Introduction
Le carcinome hépatocellulaire (CHC) se développe généralement sur une cirrhose (75 à 80 % des cas), plus rarement sur une hépatopathie chronique non cirrhotique, et exceptionnellement sur un foie sain. Dans les cas de CHC développés sur cirrhose, le pronostic et l’approche thérapeutique sont conditionnés à la fois par le stade du cancer et par la fonction hépatique. En France, l'incidence annuelle en 2018 était de 12,5/100000 chez l’homme et de 2,5/100000 chez la femme (rapport InVS 2020 http://lesdonnees.e‑cancer.fr/). Comme dans d’autres pays occidentaux, une forte augmentation d'incidence a été observée au cours des 20 dernières années probablement due à plusieurs facteurs, notamment l’augmentation des cas liés au virus de l’hépatite C (VHC), et aux stéatopathies métaboliques, l’amélioration des méthodes de diagnostic, ainsi qu’une meilleure prise en charge des autres complications de la cirrhose (Trinchet 2009). L’InVS et l’INCa ont estimé que le nombre de nouveaux cas de cancer primitif du foie en France était passé de 1800 en 1980 à 8723 en 2012 puis à 10580 en 2018.
Le dépistage du CHC chez les malades atteints de cirrhose CHILD A/B (ou CHILD C en attente de transplantation) par échographies semestrielles (Trinchet, Chaffaut et al. 2011, EASL2018). Le programme de dépistage permet de diagnostiquer le CHC à un stade accessible à un traitement à visée curative dans plus de 70 % des cas (EASL-EORTC 2012). Des études plus récentes ont également montré que le dépistage semestriel correctement réalisé chez les patients avec cirrhose virale permet d’améliorer significativement la survie globale des patients (cohorte française CIRVIR, Costentin, Layese 2018). La détection précoce permet un accès plus fréquent à des traitements à visée curative avec un rapport coût-efficacité très favorable (Cadier, Bulsei 2017). La place de l’α-fœtoprotéine (aFP) dans le dépistage est encore controversée. Néanmoins des publications récentes (Tzartzeva , Obi 2018 ; Ningarhari , Mourad 2022) tendent à montrer une amélioration de la sensibilité en association à l’échographie dans le dépistage du CHC sans dégradation du rapport coût – efficacité. Le dosage semestriel de l’aFP est recommandé par l’ASLD et plus récemment par l’AFEF. L’algorithme de diagnostic du chapitre 7.2 prend en compte l’utilisation possible de l’aFP dans le dépistage. De nouveaux scores avec plusieurs biomarqueurs tels que le score GALAD (genre, âge, α-fœtoprotéine [aFP] L3, aFP, et des-carboxyprothrombin) semblent améliorer la sensibilité par rapport à l’aFP (62 vs 42 %) et pourraient entrer dans la pratique clinique dans les prochaines années (Marsh TL, Parikh ND 2024).
7.2. Diagnostic - Explorations pré-thérapeutiques
7.2.1. Diagnostic
7.2.1.1. Evaluation du foie non tumoral
- Le diagnostic de la cirrhose peut être fortement évoqué sur des critères cliniques, biologiques (TP, plaquettes, albuminémie, marqueurs de fibrose), endoscopiques (varices œsophagiennes), et morphologiques (dysmorphie hépatique et signes d’hypertension portale en échographie ou scanner).
- En l’absence d’argument clinique, radiologique ou biologique pour une cirrhose, une biopsie du foie non tumoral est indispensable pour faire la preuve de la cirrhose ou d’une hépatopathie chronique sous-jacente. Elle permet en effet d’évaluer la sévérité de l’atteinte hépatique (activité) et aide à l’identification de son étiologie. La valeur des tests non invasifs de fibrose (Fibrotest®, Fibromètre®, Hepascore®, Fibroscan®) n’est pas établie en présence d’une tumeur hépatique.
- De plus, la biopsie en foie non-tumoral peut aider à porter le diagnostic de CHC sur la partie tumorale grâce à la comparaison de la morphologie du tissu (notamment en cas de tumeur très bien différenciée).
7.2.1.2. Diagnostic du CHC
Le diagnostic du CHC est généralement envisagé suite à la découverte d’une lésion hépatique à l’échographie, ou à l’occasion de symptômes lorsque la tumeur est à un stade évolué. La preuve histologique doit être la référence pour le diagnostic de CHC, sauf en cas de contre-indication à une biopsie percutanée. Étant donné que plusieurs options thérapeutiques, y compris à visée curative, sont désormais disponibles, le recours systématique aux critères non invasifs expose au risque d’erreur diagnostique, en particulier pour les nodules de moins de 3 cm de diamètre (Compagnon, Grandadam et al. 2008). Des études indiquent par ailleurs que des cholangiocarcinomes intra-hépatiques (y compris pour des tailles de 2,0 à 3,5 cm) - qui partagent les principaux facteurs de risque de CHC - peuvent avoir une cinétique de rehaussement identique à celle des CHC aussi bien en TDM (Mendiratta-Lala, Park et al. 2016) qu’en IRM (Huang, Wu et al. 2016). Le diagnostic des petits nodules découverts lors de la surveillance des cirrhoses par échographie est souvent difficile ; la sensibilité des critères non invasifs est faible pour les tumeurs de moins de 10 mm (Lee, Lee et al. 2015) pour lesquelles le diagnostic de CHC ne peut être affirmé que dans environ un tiers des cas (Trinchet, Chaffaut et al. 2011).
L’utilisation des critères non invasifs - valables uniquement en cas de cirrhose sous-jacente - doit se faire avec rigueur sur le plan technique et dans leur interprétation, en particulier en ce qui concerne les examens d’imagerie. Cette démarche nécessite une discussion en réunion de concertation pluridisciplinaire (RCP). En l’absence de ces conditions, la biopsie est indispensable.
Par ailleurs, le manque d’examen histologique pénalise la recherche dans la mesure où l’étude de la tumeur, de même celle du foie non tumoral, sont essentielles aux progrès des connaissances sur les mécanismes de carcinogenèse et la détermination de biomarqueurs pronostiques et prédictifs de la réponse aux traitements (intérêt des tumorothèques).
7.2.1.3. Examens complémentaires
7.2.1.3.1. Imagerie
La caractérisation du ou des nodule(s) repose sur l’examen de leur vascularisation. La standardisation de l’imagerie (technique et interprétation) est un enjeu important qui a conduit à la création du système LI-RADS (Liver Imaging Reporting and DataSystem) (Santillan, Cherniayk et al, 2017) qui propose une classification radiologique des nodules hépatiques, selon leur probabilité d’être un carcinome hépatocellulaire, allant de lésions bénignes à des nodules hautement évocateurs de CHC. Les critères (CT/MRI LIRADSVR v2018, CT/MRI LI-RADSVR v2018 et gradés en 5 stades : 1 (définitivement bénin - en imagerie) au 5 (définitivement malin - en imagerie) (https://www.acr.org/-/media/ACR/Files/RADS/LI-RADS/LI-RADS-2018-Core.pdf?la=en) qui prennent en compte le rehaussement à la phase artérielle, la taille tumorale, le lavage et la croissance sur des examens successifs améliorent le diagnostic en particulier pour les petits nodules. Il est à noter que l’AASLD, l’EASL et l’AFEF ont adopté officiellement le système LI-RADS (Marrero JA, Kulik LM 2018). L’utilisation de ces critères est hautement recommandée pour permettre une meilleure standardisation des comptes-rendus radiologiques et un suivi optimal des malades.
Il est important de souligner que les critères de diagnostic non invasifs utilisant LI-RADS n'ont été validés que dans les populations de patients atteints de cirrhose ou d’une infection chronique par le virus de l’Hépatite B (VHB). En dehors de ce cadre, une biopsie à visée diagnostique histologique est nécessaire même si la cinétique semble typique en imagerie (Mitchell DG, Bruix J, 2015).
- Le scanner hélicoïdal et l’IRM avec triple acquisition artérielle, portale et tardive sont les deux examens de référence ; le signe le plus évocateur de CHC est l’existence d’un nodule hypervascularisé au temps artériel précoce (wash-in) avec lavage (wash-out : hypodensité ou hypointensité par rapport au parenchyme hépatique non tumoral) à la phase portale ou à la phase tardive par rapport au parenchyme non-tumoral (EASL2018); cet aspect correspond à des nodules « déportalisés » ayant un apport artériel exclusif ; cette diminution du rehaussement au temps portal par rapport au foie non-tumoral est à distinguer d’une simple diminution du signal par rapport au temps artériel, qui peut être observée dans presque toutes les tumeurs hépatiques bénignes et malignes.
- L’IRM semble être légèrement supérieure au scanner en termes de sensibilité pour la détection et la caractérisation des nodules, permettant notamment de distinguer les nodules de régénération des nodules cancéreux (Colli, Fraquelli et al. 2006).
- L’échographie de contraste est le plus récent des examens permettant de caractériser la vascularisation d’un nodule. Sa sensibilité pour dépister l’hypervascularisation à la phase artérielle est supérieure à celle du scanner (Bolondi, Gaiani et al. 2005). La cinétique du wash-out en échographie de contraste est d’autant plus lente que le CHC est bien différencié. Cependant, des cholangiocarcinomes peuvent avoir en échographie de contraste de type SonoVue une dynamique de remplissage et de lavage identiques à celle d’un CHC (Rimola, Forner et al. 2009). De ce fait, l’échographie avec produit de contraste n’est pas recommandée pour le diagnostic non invasif de CHC.
Par ailleurs, l’échographie de contraste est peu accessible et n’est pas adaptée au bilan d’extension du fait de son incapacité à étudier l’ensemble du foie. Par définition, un wash-out suppose l’existence d’une hypervascularisation à la phase artérielle, qui peut être fugace et survenir entre 15 et 30 secondes après le début de l’injection intraveineuse. Cependant les nodules hypodenses à toutes les phases sont a priori des macronodules cirrhotiques, qui doivent être particulièrement surveillés en raison de leur risque de transformation en CHC. Une étude ayant comporté un suivi longitudinal rapporte l’apparition d’une prise de contraste dans 60% des cas (Vullierme, Paradis et al. 2010). - Le TEP-scan au 18F-FDG et/ou à la choline n'ont pas leur place dans le diagnostic du CHC. En effet, la captation du FDG-PET est observée dans moins de 40% des cas (Chalaye, Costentin 2018) et la plupart des CHC bien différenciés sont négatifs. Un autre traceur, la 11C-choline, pourrait être utile pour détecter des tumeurs bien différenciées. Cependant, le taux global de détection de la TEP/CT est inférieur à celui de la TDM et de l'IRM (Chotipanich, Kunawudhi 2016). Enfin, une étude récente évaluant l’utilisation systématique de la TEP-TDM au 18FDG et à la Choline, n’a pas retrouvé d’amélioration significative par rapport à l’utilisation de l’imagerie en coupe par TDM et IRM.
7.2.1.3.2. Ponction biopsie du foie tumoral
La biopsie est utile au diagnostic
La valeur prédictive positive des résultats d'imagerie est directement proportionnelle à la taille de la tumeur, avec une précision sensiblement plus faible pour les lésions plus proches du seuil de 1 cm (Roberts LR, 2018). Les critères secondaires parfois utilisés tels que le rehaussement concentrique progressif, le rehaussement périphérique à la phase artérielle sont associés à une tumeur maligne dans plus de 90 % des cas, mais seulement 36 % sont des CHC. Il est donc recommandé de classer tous les cas présentant des caractéristiques douteuses dans la catégorie LR-M au lieu de LR-5 et de procéder à une biopsie pour établir un diagnostic définitif. (Fowler KJ, Tang AN 2018). La distinction précise des observations LR-5 et LR-M peut être difficile, en particulier pour les lecteurs non experts, ce qui peut conduire à un sur-diagnostic de CHC (Fowler KJ, Tang AN 2018).
Dans 10-15 % des cas le CHC est d’aspect infiltrant à l’imagerie sans lésion focale évidente. Une biopsie en foie tumoral et non tumoral est alors recommandée.
Par ailleurs, un certain nombre de nodules correspondent, après examen histologique, à des nodules bénins hépatocytaires (régénératifs ou non), à des hémangiomes, à des lésions malignes (cholangiocarcinomes ou tumeurs mixtes de type hépato-cholangiocarcinomes). Des études récentes ont montré qu’il existait un taux d’erreur diagnostique, même en centre expert, de 5 à 17 %, ce qui ne semble pas acceptable vu les modalités thérapeutiques très différentes de ces tumeurs (Brusset B, Jacquemin M 2023).
Enfin, la cirrhose peut être considérée comme un environnement pré-néoplasique dans lequel se développent des nodules cirrhotiques dont certains évoluent en nodules dysplasiques, présentant un risque de transformation maligne allant d’environ 20 % (nodules dysplasiques de bas grade de malignité) à 60 % (nodules dysplasiques de haut grade de malignité). Leur caractérisation et le diagnostic différentiel entre nodule dysplasique de haut grade et CHC bien différencié est possible par la biopsie en combinant une analyse histologique standard et une analyse immunohistochimique (Park YN. 2011; Di Tommaso L, Destro A, 2009). La caractérisation précise de ces nodules (de moins de 2 cm) est importante pour la prise en charge. La coexistence possible de nodules de CHC et de nodule de cholangiocarcinome sur foie cirrhotique peut conduire à réaliser des biopsies sur plusieurs nodules chez le même patient si ceux-ci ont des comportements différents en imagerie.
La biopsie est utile pour la caractérisation des tumeurs à visée thérapeutique
La caractérisation des tumeurs devient un élément indispensable pour la prise en charge. En effet, de plus en plus de données démontrent que les CHC présentent une grande hétérogénéité tant sur les plans histologiques que moléculaires, se répartissant en différents sous-types patho-moléculaires caractérisés par des anomalies génétiques et des profils d’expression moléculaire qui permettent d’établir des classifications transcriptomiques du CHC (Zucman-Rossi, Villanueva et al. 2015). UnUn groupe français a proposé une classification identifiant 6 sous-types basés sur des critères cliniques, histologiques, génétiques et moléculaires (Calderaro, Couchy et al. 2017). L’ensemble de ces connaissances permettront dans un futur proche un diagnostic plus précis ouvrant la voie à une stratégie thérapeutique personnalisée, adaptée à chaque groupe de patients. À l'heure actuelle, il semble judicieux que chaque patient potentiellement candidat à un traitement dispose d'un prélèvement tant de la tumeur que du tissu hépatique non tumoral, afin d’anticiper les avancées futures dans ce domaine. La biopsie est également utile pour l’évaluation pronostique dans la mesure où le grade de différenciation tumorale est un facteur pronostique du CHC (Sia, Villanueva et al. 2017) et qu’il a été montré que les sous-types moléculaires (G1 à G6) identifiables sur l’histologie sont associés à des profils évolutifs différents (Calderaro, Couchy et al. 2017). Ainsi, le sous-type « macrotrabéculaire massif », souvent associé à des mutations p53 et représentant environ 12 % des CHC, est de mauvais pronostic (Ziol et al. 2017). Les sous-types de CHC de mauvais pronostic (macro-trabéculaire massif et peu différenciés), sont de plus moins souvent typiques en imagerie selon les critères LI-RADS (Brusset et al. 2023). D’autres marqueurs prédictifs sont en cours d’étude (par exemple, VETC pour l’association atezolizumab-bevacizumab), mais n’ont pas encore atteints le stade de validation clinique (CO AFEF 2025). Ceci renforce l’intérêt de disposer d’une biopsie pour informer les décisions thérapeutiques dans le futur.
Conditions techniques de réalisation et risques de la biopsie
La biopsie utilisant des aiguilles de 14 à 18 G, qui fournit un matériel tissulaire permettant une analyse histologique, doit être préférée à la ponction aspiration à l’aiguille fine de 20 à 25 G qui ne permet qu’une analyse cytologique, insuffisante en particulier pour le diagnostic différentiel entre les nodules dysplasiques et le CHC reposant sur des critères architecturaux. Il est essentiel, de comparer des fragments de foie tumoral et non tumoral (Vullierme, Paradis et al. 2010).
La biopsie doit être faite au travers d’une épaisseur notable de parenchyme non tumoral et avec une protection du trajet pariétal (aiguille coaxiale). Cette technique limite le risque d’essaimage sur le trajet de ponction (1,3 % contre 3,1 % sans protection) (Fotiadis N, De Paepe KN 2020). Du fait de ce risque, même mineur, lorsqu’une transplantation est envisagée, la biopsie ne doit pas être faite avant d’avoir contacté le centre référent même si la réalisation d’une biopsie ne semble pas affecter l’évolution oncologique des patients avec un CHC en indication de transplantation (Fuks, Cauchy et al. 2014).
En cas de traitement percutané, une biopsie peut être faite soit avant la séance soit par l’aiguille introductrice lors de la première séance.
Performances diagnostiques de la biopsie hépatique
Une étude prospective a évalué la performance de la biopsie dans le diagnostic des nodules solitaires de diamètre inférieur à 2 cm, détectés par échographie. Le diagnostic de CHC est confirmé à la première biopsie dans 70 % des cas et, en cas de première biopsie négative, le taux de faux négatifs atteint encore 39 % à la seconde biopsie (Forner, Vilana et al. 2008). Il est probable que la performance de la biopsie sera augmentée par l’utilisation de marqueurs moléculaires de CHC, d’autant que certains sont applicables sur tissu inclus en paraffine (Di Tommaso L Destro A 2007).
Parmi ceux-ci, la présence des mutations du promoteur de TERT permet d’affirmer que le nodule est déjà engagé dans le processus de malignité et doit être considéré comme un CHC (Nault JC, Martin Y 2020, Beaufrère A Paisley S 2023).
En pratique, une biopsie « négative » n’élimine pas le diagnostic de CHC
Selon les recommandations de l'AASLD, les biopsies des nodules de petite taille doivent être examinées par des anatomopathologistes experts. En cas de résultat non concluant ou discordant avec l’imagerie (par exemple description de tissu cirrhotique uniquement alors qu’il existe un nodule hyperartérialisé en imagerie), une deuxième biopsie est conseillée. Après deux biopsies négatives, les malades doivent être suivis par échographie et/ou scanner ou IRM tous les 3 à 6 mois jusqu'à ce que le nodule disparaisse, augmente de taille ou remplisse les critères diagnostiques de CHC ; si le nodule augmente de taille et reste atypique, une nouvelle biopsie est recommandée.
7.2.1.3.3. Marqueurs tumoraux
- Une élévation de l’ α-fœtoprotéine (aFP), même supérieure à 400 ng/ml, n’est pas en elle-même assez spécifique pour poser le diagnostic de CHC, celle-ci pouvant être augmentée en cas de tumeurs germinales ou d’autres tumeurs digestives (Bruix and Sherman 2011, 2012). Un tel résultat doit néanmoins faire activement rechercher un CHC avec la réalisation d’une imagerie en coupes hépatique, notamment en contexte d’hépatopathie chronique.
7.2.1.4. Critères de diagnostic du CHC
REFERENCES
Analyse histologique d’un fragment tumoral obtenu par ponction biopsie dirigée sous échographie ou scanner, comparée à un fragment de foie non tumoral prélevé simultanément (niveau de recommandation : accord d’experts).
OPTIONS
Lorsqu'un nodule est détecté chez un patient atteint de cirrhose confirmée, l’utilisation de critères non invasifs (suivant la classification LIRADS) est proposée, particulièrement chez les patients non accessibles à la biopsie.
Il est indispensable de respecter les recommandations techniques concernant la réalisation des examens d’imagerie, décrites sur le site de la Société française de radiologie et de faire valider le diagnostic non invasif par une RCP « spécialisée », c’est-à-dire comportant au moins les compétences en hépato-gastroentérologie/hépatologie, radiologie diagnostique et interventionnelle, chirurgie hépatique et transplantation, oncologie médicale et oncologie radiothérapie.
Les nodules de moins de 1 cm doivent être surveillés par échographie (et/ou TDM ou IRM) tous les 3 mois. S’il n’y a pas d’augmentation du diamètre avec un recul de 2 ans, on peut revenir à la périodicité habituelle de la surveillance échographique (niveau de recommandation : grade C).
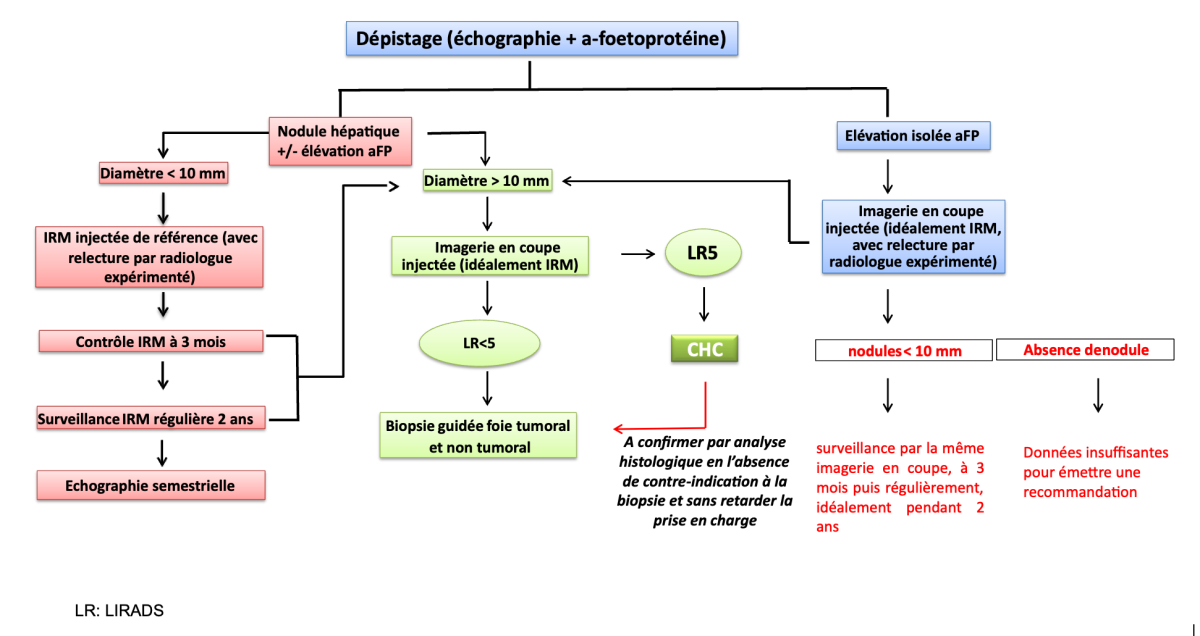
7.2.2. Eléments nécessaires à la discussion thérapeutique
Contrairement aux autres tumeurs solides, dont la prise en charge est guidée par la classification TNM, il n’y a pas de système pronostique universellement consensuel pour le CHC (Olthoff, Forner et al. 2011). De nombreuses système de classifications ou scores pronostiques ont été proposés (Okuda, CLIP, GRETCH, TNM-AJCC…) ou le BCLC qui est plus un algorithme décisionnel qu’un score strictement pronostique. Toutefois, les études comparatives entre ces classifications ont rapporté des résultats hétérogènes La classification BCLC est le plus souvent utilisée dans les recommandations internationales.
En pratique, ces classifications ont en commun trois paramètres indispensables à la prise de décision thérapeutique : l’extension tumorale (nombre, taille des tumeurs, extension vasculaire / extra-hépatique), l’état du foie sous-jacent (fonction hépatique, hypertension portale) et l’état général du patient.
7.2.2.1. Bilan d'extension tumorale
Il comporte, outre l’examen clinique et l’AFP (intérêt dans le pronostic et le suivi), une imagerie adaptée par IRM abdominale + scanner thoracique ou scanner thoraco-abdominal (avec injection de produit de contraste). L’imagerie correctement réalisée permet de préciser la morphologie tumorale (localisation, nombre et taille des lésions, présence d’une capsule et/ou de tumeurs « filles »), la vascularisation portale et sus-hépatique, l’existence d’adénopathies ou de métastases viscérales (poumons, os, surrénales…), et le retentissement sur les voies biliaires. Le scanner permet le calcul des volumes hépatiques Un scanner cérébral et une scintigraphie osseuse seront réalisés en cas de point d’appel clinique.
- Certaines études ont évalué l’utilisation du TEP-scan (Sharma, Martin et al. 2013) avec de nouveaux traceurs telle que la choline qui semble améliorer la détection des lésions extra-hépatiques (Lopci, Torzilli 2015) et pourrait modifier certains choix thérapeutique (Chalaye, Costentin 2018). La captation du 18-FDG pourrait être associée à des formes histologiques de plus mauvais pronostic (HU S, 2023), à l’invasion tumorale (Hong, Suh 2016) et à un risque accru de récidive post-opératoire (Lim C 2019). Cependant, l’étude prospective PET-HCC01, n’a pas permis de montrer l’intérêt de l’utilisation d’une double TEP (18FDG et Choline) lors de l’évaluation pré-thérapeutique des patients (Nault, Boubaya 2025). Il n’est donc pas recommandé de faire une TEP-scanner dans le bilan pré-thérapeutique d’un CHC.
7.2.2.2. L’évaluation du foie non tumoral est essentielle
L’aspect histologique du foie non tumoral, incluant le degré de l’atteinte en termes de fibrose, doit être connue.
Un bilan étiologique de l'hépatopathie est également nécessaire, car les indications thérapeutiques peuvent varier en fonction de l'étiologie sous-jacente.
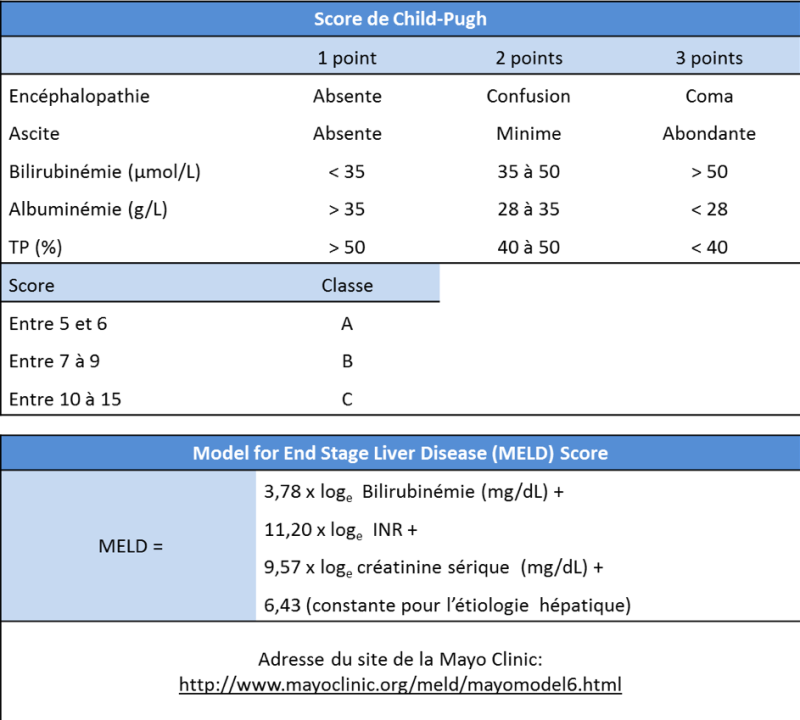
En cas de fibrose sévère (score F3) ou cirrhose (score F4), il est essentiel d’évaluer la sévérité de l’hépatopathie. Cela implique un bilan clinique, biologique (TP, albuminémie, bilirubinémie, ALAT/ASAT), détermination du score de Child-Pugh, du score MELD (Model for end-stage liver disease), du score ALBI (Johnson PJ, Berhane S. 2015) et la recherche de signes d’hypertension portale. Lorsqu’une résection est envisagée, le volume de foie restant est évalué par volumétrie. D’autres analyses ne sont pas recommandées de façon systématique mais peuvent être faites au cas par cas avant résection chirurgicale (tests « fonctionnels » mesure de la pression portale par cathétérisme sus-hépatique…)
Le Fibroscan® est recommandé pour l’évaluation de la fibrose ou de l’hypertension portale. Dans le contexte de CHC, il y a peu de données concernant l’interprétation ou la faisabilité du Fibroscan®. Le CHC est un facteur associé à l’échec des mesures (Cescon,M; Colecchia, A 2012 ; Dong J, Qing S, 2014) avec des variations importantes des valeurs seuil optimales selon la localisation du CHC (Huang TH, Lin MT 2021)
La présence d’une hypertension portale conditionne la prise en charge. Les recommandations sur la gestion de l’HTP ont été fortement révisées lors de la dernière conférence de Baveno VII, redéfinissant le dépistage et élargissant les indications de prophylaxie.
Dans le contexte de CHC, les critères de BAVENO posent plusieurs problèmes d’utilisation dont l’incertitude sur l’interprétation de l’élastométrie (Grgurevic I, Bokun T 2018) ou une augmentation du taux de plaquettes liée à l’inflammation et au CHC (Thabut, D, Kudo M 2023) avec des risques de faux négatifs.
L’endoscopie digestive haute à la recherche de signe d’HTP est donc recommandée avant prise en charge de CHC.
La fonction hépatique est évaluée par les scores suivants ci-dessous : Child-Pugh, MELD et ALBI.
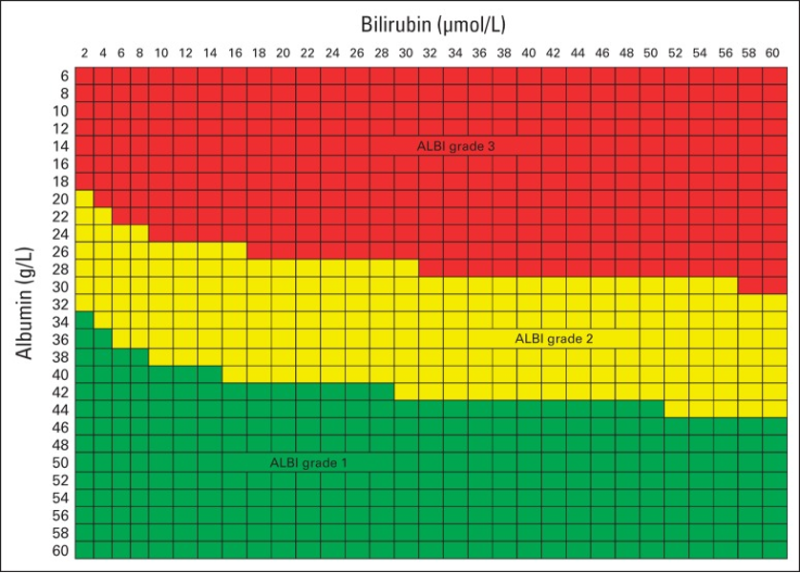
(log10bilirubine (µmol/L)*0,66) + (Albumine (g/L)*-0,085) (Johnson. J Clin Oncol 2015).
7.2.2.3. Bilan général
- L’état général et d’activité doit être évalué (grade OMS), selon les recommandations de l’EORTC c’est-à-dire en tenant compte de l’état général induit par le cancer.
- Les comorbidités et cancers liés au terrain doivent être recherchés, en particulier en cas de cirrhose alcoolique et/ou de tabagisme associé, notamment si une transplantation est envisagée : insuffisance cardiaque et respiratoire, cancers broncho-pulmonaires, ORL et du tractus digestif supérieur.
- Les éléments du syndrome dysmétabolique (HTA, diabète, dyslipidémie) et ses complications (en particulier les coronaropathies), doivent être recherchés car fréquemment associés au CHC et sources possibles de difficultés dans la prise en charge (risque opératoire, traitement par anti-agrégants plaquettaires, stents actifs…).
- Un bilan pré-opératoire en concertation avec l’anesthésiste (EFR, gazométrie, ECG, échocardiographie, scintigraphie myocardique…) doit être effectué si la chirurgie est envisagée.
- Si un traitement systémique est envisagé des contre-indications à l’immunothérapie et aux traitement anti-angiogéniques seront recherchées.
7.2.2.4. Au terme du bilan, plusieurs éléments doivent impérativement être renseignés :
- L’évaluation de la fonction hépatique sous-jacente
- La confirmation diagnostique, ou à défaut une forte probabilité de CHC
- L’analyse de l’extension tumorale
- L’identification de critères de mauvais pronostic tumoral tels que l’extension vasculaire tumoral, le caractère infiltrant à l’imagerie, une élévation de l’AFP > 1 000 μg/L, ou une évolutivité rapide jugée sur l’imagerie et/ ou biologique
- L’évaluation l’état général et des comorbidités du patient
7.3. Traitement
7.3.1. Traitements à visée curative
7.3.1.1. Transplantation
Elle est indiquée chez les patients atteints de CHC sur cirrhose, et elle est considérée comme le traitement théorique « idéal » car traitant la tumeur et sa cause. L’indication consensuelle au niveau international est le CHC strictement localisé au foie, soit unique et mesurant de 2 à 5 cm de diamètre, soit sous forme de 2 ou 3 nodules ne dépassant pas 3 cm de diamètre, en l’absence de thrombose portale ou hépatique, y compris segmentaire (= critères de Milan = « petit CHC ») (Mazzaferro , Regalia et al. 1996). Dans ces conditions, la transplantation hépatique (TH) guérit 2/3 des malades avec des résultats comparables à ceux de la TH pour cirrhose sans tumeur (Bruix and Sherman 2005) ; (Clavien, Lesurtel et al. 2012). Des études rétrospectives ont montré à 5 ans des taux de survie globale de 63 à 80 % et des taux de récidive de 4 à 20%. Cependant, de fréquentes contre-indications (âge, état physiologique, comorbidités, alcoolisme actif, refus d'un traitement au long cours), et la pénurie de greffons en limitent les indications.
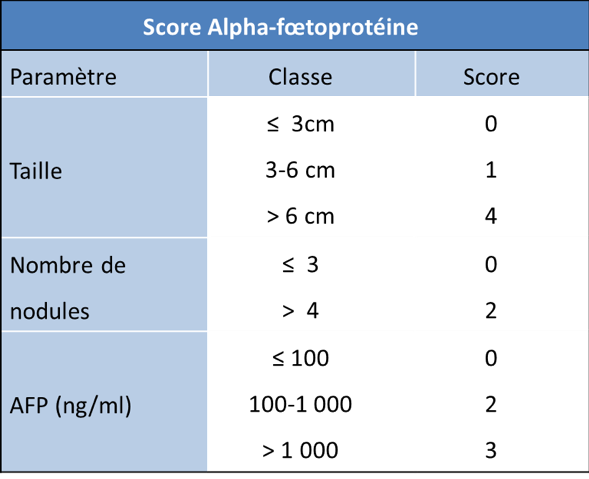
Le CHC représente en France 30 % des 1000 transplantations réalisées chaque année. En pratique, une indication de TH est discutée chez 10% des patients atteints de CHC, et elle est réalisée chez 3 à 4 %. Cette autolimitation est la conséquence de la pénurie de greffons et l’on observe deux tendances pour optimiser les résultats de la transplantation. La première est de privilégier la résection ou la destruction per-cutanée pour les CHC uniques. La seconde, à l’inverse, est d’élargir, de façon prudente, les indications de TH au-delà des critères de Milan. Plusieurs équipes ont rapporté de bons résultats chez des malades rentrant dans des critères plus larges que ceux de Milan : critères de San Francisco, critères 55-5, critères « up-to seven », score AFP même s’il n’a pas été trouvé de consensus international sur l’utilisation de ces critères étendus (Mehta N, Bhangui P et al. 2020). En France, cet élargissement des critères n’a pas été associé à une aggravation du pronostic, le taux de survie à 5 ans semblant identique à celui d’autres pays ayant conservé des critères restrictifs. Les critères d’attribution des greffons ont donc changé en 2013 avec l’adoption par l’Agence de la BioMédecine du score alpha-fœtoprotéine (aFP). En effet, il a été montré que jusqu’à un score de 2, les résultats de la greffe pour CHC sont excellents (Duvoux, Roudot-Thoraval et al. 2012). Ces résultats français ont été confirmés par une étude sud-américaine (Piñero, TisiBaña etet al. 2016) et italienne (Notarpaolo, Layese etet al. 2017).
- En pratique, pour les patients ayant un CHC au-delà des critères de Milan et pas de contre-indication à la TH, il est conseillé d’en référer à un centre de TH et de discuter cette option en RCP de recours.
En raison de l’allongement du délai avant TH, qui est passé pour les CHC de 3 mois dans la période 2003-2005 à 12 à 18 mois en 2014, il existe un risque de progression tumorale qui pose le problème d’un traitement « d’attente ». Son intérêt et ses modalités ne sont pas clairement définis. - En pratique, la plupart des centres décident soit d’effectuer un traitement d’attente par chimioembolisation (CE) artérielle, ou par radiothérapie interne sélective (SIRT) soit d’opter pour un « premier traitement curatif », résection ou destruction percutanée.
Un down-staging par ces traitements ramène parfois dans les critères de transplantation des tumeurs initialement au-delà de ces critères conduisant à rediscuter une transplantation. Un essai de phase 2, bien qu’interrompu précocement montre clairement le bénéfice en termes de survie sans récidive et de survie globale de la transplantation chez les patients initialement hors critères de Milan ayant pu être « downstagés » (Mazzaferro V, Citterio D et al. 2020). Il est donc capital de penser à la transplantation hépatique à chaque nouvelle évaluation tumorale des malades et de ne pas hésiter à demander un avis en centre de transplantation.
En pratique, compte-tenu de l’ensemble de ces données, l’inscription et le maintien sur la liste de transplantation en France se fait actuellement en fonction du score (aFP) élaboré par les centres de transplantation, réévalué tous les 3 mois en liste d’attente (cf. tableau).
Il n’y a pas d’accès à la greffe autrement que selon de score MELD en cas de tumeur unique de moins de 2 cm. Ces malades doivent donc en premier lieu être traités de manière curative par chirurgie ou destruction percutanée. Ce n’est que lors de la récidive du CHC, que des points spécifiques peuvent être obtenu pour un accès à la greffe.
De nombreuses composantes expert existent et permettent certains accès à la greffe. Celles-ci évoluent régulièrement et il est nécessaire de prendre contact avec un centre de greffe pour ne pas méconnaitre une possibilité d’accès pour un malade en âge d’être transplanté.
La transplantation hépatique avec donneur vivant pourrait être envisagée si le délai d’attente prévisible parait excessif, mais sa place reste actuellement très marginale en France.
En résumé, la transplantation hépatique s’inscrit dans une stratégie globale de prise en charge du CHC. De ce fait, le choix de réaliser des traitements en attente de greffe et le type de traitements doivent être établis en collaboration avec le centre de transplantation. Les patients potentiellement éligibles à une transplantation doivent donc être discutés dès le diagnostic initial de CHC, avant tout traitement, afin de définir avec le centre la meilleure stratégie. De même, des malades initialement inéligibles qui le deviennent, doivent être adressés à un centre de transplantation.
7.3.1.2. Résection
Pour les CHC sur cirrhose, elle est discutée chez les patients ayant une fonction hépatique préservée (Child-Pugh A) et en tenant compte du degré d’hypertension portale (Bruix and Sherman 2005, Bruix and Sherman 2011). Le volume du futur foie restant doit représenter au moins 40 % du volume hépatique total. Lorsqu’une hépatectomie droite est envisagée, celle-ci ne doit être réalisée que si une embolisation portale droite préalable a hypertrophié le foie gauche.
Dans ces conditions, la mortalité post-opératoire est < 5 %, et les taux à 5 ans de survie globale et sans récidive sont respectivement d’environ 50 % et 30 % (Bruix and Sherman 2005). Du fait de l’amélioration du bilan préopératoire, de la technique chirurgicale et du contrôle de la maladie hépatique sous-jacente, des séries récentes ont rapporté un taux de survie sans récidive à 5 ans de 65 % (Cherqui, Laurent et al. 2009) voire plus (Lim, Chow et al. 2012).
On admet actuellement que candidat idéal à la résection hépatique est un patient présentant un seul nodule un CHC unique de moins de 5 cm. Cependant plusieurs centres spécialisés ont rapporté de bons résultats en termes de survie après résection de tumeurs de plus grande taille et/ou multiples (Regimbeau, Farges et al. 1999, Delis, Bakoyiannis et al. 2010).
L’existence d’une thrombose portale néoplasique homolatérale à la tumeur n’est pas une contre-indication absolue à la résection si elle n’atteint ni la convergence ni le tronc de la veine porte (Shi, Lai et al. 2010). Cependant, dans cette situation, la chirurgie ne semble pas apporter de bénéfice en survie globale par rapport au sorafénib (Costentin C, Decaens T et al 2017). Avec l’arrivée des immunothérapies plus efficaces et mieux tolérées que le sorafénib, et le développement de la SIRT pour les invasions portales non tronculaires (cf. chapitres spécifiques), la chirurgie ne peut plus être considérée comme le traitement de référence dans les cas d’invasions vasculaires macroscopiques portale ou sus-hépatiques.
Idéalement, la résection d’un CHC doit consister en une résection anatomique comportant des marges de 2 cm (Shi, Guo et al. 2007, Slim, Blay et al. 2009).
En l’absence de fibrose importante (< F3) du foie non tumoral, la résection est le traitement de référence, même pour les tumeurs volumineuses.
7.3.1.3. Destruction per-cutanée
Cette méthode simple et habituellement bien tolérée, qui a l'avantage de préserver le parenchyme non tumoral, est une alternative à la chirurgie. Un traitement par radiofréquence monopolaire est envisageable :
- si la tumeur mesure moins de 3 cm, est accessible à la ponction sous échographie ou scanner, et se situe à distance du hile et des grosses voies biliaires ;
- en l’absence d’une anastomose bilio-digestive, d’un stent trans-papillaire ou d’une ascite importante qui sont des contre-indications.
Les durées de survie les plus longues sont observées chez les malades en rémission complète après traitement d’un CHC ≤ 3 cm de diamètre (Camma, Di Marco et al. 2005).
Il est admis qu’une destruction percutanée doit être proposée aux malades ne relevant pas d’une résection ; en fait, cette hiérarchie entre les 2 méthodes ne repose pas sur un niveau de preuve suffisant pour les petits CHC.
A ce jour, les données les plus nombreuses concernent la destruction par radiofréquence. Nous disposons ainsi de 6 études randomisées (Chen, Li et al. 2006, Lü, Kuang et al. 2006, Huang, Yan et al. 2010, Feng, Yan et al. 2012, Fang, Chen et al. 2014, Liu, Wang et al. 2016) et de 6 études rétrospectives (avec score de propension) ayant comparé la résection hépatique à la radiofréquence (Peng, Lin et al. 2012, Pompili, Saviano et al. 2013, Zhou, Lei et al. 2014, Kim, Shim et al. 2016, Liu, Hsu et al. 2016, Song, Wang et al. 2016). L’ensemble de ces études présente une puissance statistique limitée du fait d’effectifs de malades restreints. Parmi les études randomisées, seulement 2 études sont positives en survie globale et 3 en survie sans récidive en faveur de la chirurgie. Parmi les études rétrospectives, 2 études sont positives en survie globale en faveur de la chirurgie et deux en survie sans récidive en faveur de la chirurgie. La majorité des études montre un nombre de complications majeures significativement inférieur après la radiofréquence par rapport à la chirurgie.
Les deux approches semblent donner des résultats équivalents pour les nodules de CHC < 3 cm, le choix de la thérapeutique la plus adaptée au patient, doit se faire en tenant compte de la taille, de la localisation de la tumeur, du stade de l’hépatopathie sous-jacente, du projet thérapeutique global (attente de transplantation hépatique ou non…), de la disponibilité des outils, des techniques et de l’expérience des opérateurs (chirurgie et radiologie interventionnelle), ainsi que) et des souhaits du patient après une information éclairée des 2 options.
- D’autres techniques de destruction percutanée sont disponibles :
L’utilisation de sondes multipolaires permettrait de traiter de façon curative des tumeurs plus volumineuses, en particulier celles mesurant entre 3 et 5 cm et d’avoir un taux de récidive local inférieur à la radiofréquence monopolaire (Seror, N'Kontchou et al. 2008) (Hocquelet, Aubé et al. 2017). - La destruction par micro-ondes semble donner des résultats similaires à ceux obtenus par une ablathermie par radiofréquence selon une méta-analyse récente (Wicks JS, Dale BS et al.2023).
- L’électroporation irréversible est une technique non thermique qui pourrait trouver une place dans le traitement des tumeurs non ablatables par la chaleur (centrales proches du hile, contact avec structures digestives...) par son mode action intrinsèque. Mais plus de données sont nécessaires pour diffuser plus largement son utilisation.
Les intérêts, indications et performances relatives des différentes techniques sont résumés dans le tableau ci-dessous.
| Techniques d'ablation | Indications/Intérêts | Performances |
|---|---|---|
| Radiofréquence monopolaire | - Lésions moins de 3 cm | - Pas de différence de performance (récidive, survie globale) radiofréquence monopolaire et micro-onde |
| Micro-onde | - Lésions moins de 3 cm - Proximité vaisseaux car moins sensible au heat sign effect (théorique) | - Pas de différence de performance (récidive, survie globale) entre radiofréquence monopolaire et micro-onde - Diminution du taux de récidive pour les lésions proche des gros vaisseaux |
| Radiofréquence multipolaire multi-aiguilles | - Lésions jusqu’à 5 cm - Lésion sous capsulaire - Proximité des vaisseaux (dépose de plus d’énergie) | - Diminution du taux de récidive par rapport à radiofréquence monopolaire et micro-onde |
| Ablation monopolaire multi-aiguilles | - Lésions moins de 3 cm - Lésion sous capsulaire | - Diminution du taux de récidive par rapport à radio fréquence ou micro-onde monopolaire – mono-aiguille |
| Electroporation irréversible | - Moins de complication - Respect des structures vasculaires et biliaires | - A valider |
7.3.1.4. SBRT : la radiothérapie stéréotaxique (6 à 20 Gy/séance)
Ce traitement a été évalué depuis le début des années 90. Des études de phase I et II ont montré la faisabilité et la reproductibilité de la technique à plus grande échelle grâce aux accélérateurs de dernière génération, avec des complications rares. Le contrôle local à 1 et 2 ans est entre 90 et 100 %, avec des taux de survie globale à 1 et 2 ans respectivement de 80-90 % et 70 %. Cette technique est réalisable même pour de gros CHC, qui ne sont pas une contre-indication à la radiothérapie stéréotaxique (Andolino, 2011 ; Kwon, 2010 ; Bujold, 2013).
Il n’existe pas de comparaison directe entre les différents fractionnements de radiothérapie utilisés pour le traitement des CHC. Cependant, la plupart des études modernes ont utilisé des protocoles stéréotaxiques à dose curative (ablative) et les résultats obtenus sont basé principalement sur ce type de fractionnement (Bordeau K, Michalet M 2022). La dosimétrie est une étape cruciale et doit tenir compte des organes à risque dont le foie. La toxicité hépatique se limite le plus souvent à une cytolyse et/ou une cholestase anictérique (RILD : radio-induced-liver-toxicity), et une dégradation du score de Child pour certains patients cirrhotiques.
Un essai randomisé de phase III a montré la non-infériorité d’une radiothérapie stéréotaxique à base de protons versus radiofréquence pour les récidives de CHC de taille inférieure à 3 cm (Kim TH, Koh YH et al 2021).
Les résultats d’un essai randomisé réalisé en Chine comparant radiofréquence et radiothérapie stéreotaxique pour des tumeurs de moins de 5 cm ont récemment été publiés (XI M, Yang Z 2024). 166 patients ont été randomisés (83 dans chaque bras) avec des taux de contrôle local à deux ans en faveur de la radiothérapie (75,8 % dans le groupe radiofréquence vs 92,7 % dans le groupe radiothérapie, p=0,014), mais des survies sans progression/globale comparables.
Un essai randomisé de phase 2, clôturé prématurément suggèrerait l’intérêt de la radiothérapie stéréotaxique, même en cas d’invasion vasculaire VP3-4, (Dawson LA, Winter KA 2023) sous réserve de d’un bras contrôle par sorafénib sub-optimal à l’heure des immunothérapies.
Ce traitement peut être offert dans des centres expérimentés, disposant des équipements dédiés. Elle nécessite des accélérateurs de particules de dernière génération avec système d’imagerie intégré pour réaliser un gating respiratoire (synchronisation de la radiothérapie avec les mouvements respiratoires) ou du tracking hépatique (déplacement du faisceau en fonction des mouvements de la cible tumorale) pendant les séances. Ces méthodes permettent une meilleure tolérance en autorisant la respiration libre du patient, et peuvent ainsi être réalisées chez des patients plus fragiles notamment sur le plan cardio-respiratoire. Des systèmes de contention dédiés peuvent également être nécessaires.
La radiothérapie stéréotaxique est réservée aux patients avec CHC unique ou pauci-nodulaire non accessibles à la résection chirurgicale, à la transplantation et à l’ablation per-cutanée. Elle s'applique aux lésions < 10 cm, bien qu’au-delà de 5 cm, il semble exister un risque plus important d’hépatite radique. Cependant il n’existe pas de consensus sur le nombre maximal de lésions que l’on peut traiter dans la même séquence thérapeutique. Ce nombre est dépendant de la taille tumorale, de la localisation des lésions et de la technique utilisée. Il apparaît cependant peu raisonnable et non recommandable de traiter plus de 3 lésions dans la même séquence thérapeutique. Il est par ailleurs recommandé de ne pas considérer comme une contre-indication absolue pour la SBRT le volume tumoral sous réserve de respecter les contraintes dosimétriques.
Pour les CHC de plus grande taille (5-10 cm), les études initiales de cohorte montraient l’importance de l’associer à la CE (Merle, 2014). Cependant, l’intérêt d’associer radiothérapie et CE n'a pas été démontré dans une étude randomisée française, l’essai TACERTE (Féray C, Campion L 2023).
7.3.1.5. Traitement adjuvant
Traitement systémique
Après un traitement à visée curative par résection ou destruction percutanée, il y a un risque élevé de récidive locale (échec du traitement) ou à distance (nouveau CHC). Cela pose la question d’un traitement adjuvant. Plusieurs essais conduits en Asie (essentiellement sur des CHC développés sur cirrhose virale B) suggèrent l’intérêt d’une immunothérapie adoptive (Wang, Liu et al. 2016) mais cette stratégie reste difficile à mettre en place. Le sorafénib en traitement adjuvant après résection ou destruction percutanée a fait l’objet de plusieurs études dont une étude de phase III randomisée (Étude Storm) mais n’a pas montré de bénéfice en termes de survie sans récidive (Bruix, Takayama et al. 2015).
Plusieurs essais de phase III randomisés évaluent l’intérêt d’un traitement adjuvant par immunothérapie ou association immunothérapie - bevacizumab après résection ou destruction percutanée
Les résultats de l’étude internationale de phase III IMbrave050 comparant après résection ou destruction percutanée l’association d’atézolizumab 1200 mg et bevacizumab 15 mg/kg toutes les 3 semaines pendant 1 an, à la surveillance active ont été publiés en 2023 ( Qin S, Chen M,2023) Cette étude incluait des patients considérés comme à haut risque de récidive après résection ((i) ≤ 3 tumeurs dont une > 5 cm ou (ii) ≥ 4 tumeurs de moins de 5 cm ou (iii) présence d’invasion vasculaire et/ou d’une faible différenciation (grade 3-4)) ou des patients traités par radiofréquence (≤ 4 tumeurs entre 2 et 5 cm).
Cette étude comportait une majorité de patients asiatiques (83 %) avec hépatite B (62 %). Les tumeurs réséquées étaient le plus souvent uniques (90 %). 10 % des patients ont reçu une chimio-embolisation adjuvante dans chaque bras. La première analyse intermédiaire était positive pour l’objectif principal de survie sans récidive : 78 % vs 65 % à 1 an (HR 0.72 (0.56-0.93) p = 0.012). Cependant l’analyse finale ne confirmait pas ce résultat (ESMO 2024) et l’étude doit donc être considérée comme négative. Les résultats d’autres essais cliniques évaluant en situation (néo-)adjuvante l’immunothérapie seule ou en association avec un anti-angiogéniques sont encore en attente.
Actuellement aucun traitement adjuvant ne peut être recommandé après chirurgie ou résection percutanée de CHC (quel que soit le degré de risque de récidive).
Traitement de l’hépatopathie sous-jacente
La prise en charge concomitante de l’hépatopathie chronique améliore son pronostic et pourrait réduire le risque de récidive tumorale. Cette prise en charge concerne le traitement étiologique, les comorbidités et, en cas de cirrhose, la prévention des complications de l’hypertension portale.
Le seul intérêt potentiel d’utiliser des antiviraux ciblant le VHB, VHD et/ou VHC, est de prévenir l’évolution naturelle de dégradation progressive des fonctions hépatiques par l’infection virale chronique et de prévenir du risque de décompensation hépatocellulaire.
Pour le VHB, les recommandations internationales préconisent de traiter de façon systématique tous les patients cirrhotiques porteurs de l’AgHBs, quel que soit le niveau de la charge virale. Il en est de même en cas de CHC, même en l’absence de cirrhose.
Pour le VHC et le VHD, il n’existe aucune recommandation préconisant ou au contraire interdisant le traitement virologique en cas de traitement anticancéreux systémique du CHC par ICI ou ITK.
7.3.2. Traitements palliatifs
7.3.2.1. "Chimio"embolisation artérielle (CE)
Deux essais de phase III et deux méta-analyses ont rapporté en 2002 une prolongation de survie (+ 20 % de survie à 2 ans) chez les malades traités par CE (Llovet and Bruix 2003, Bruix and Sherman 2011). La différence avec les essais négatifs précédents était que seuls les malades ayant une fonction hépatique conservée avaient été inclus et d’autre part que les malades étaient atteints principalement de CHC sur hépatopathie chronique virale.
L’indication consensuelle pour la CE est « le traitement palliatif de première ligne des CHC évolués (en pratique multinodulaires), en l’absence de métastase et d’anomalie significative du flux portal, chez les malades Child-Pugh A ou B7, asymptomatiques et en bon état général (OMS 0) ».
Les obstructions tumorales portales non tronculaires (stade C de la classification BCLC) ne constituent pas une bonne indication pour la chimioembolisation, en raison de résultats décevants, et d’un bénéfice non démontré par rapport au traitement systémique.
Plusieurs scores ont été développés pour aider à identifier les bons candidats à la CE. Aucun n'est clairement validé et consensuel, mais certains critères utilisés dans ces scores sont associés à une faible efficacité de la CE tels que le caractère hypovasculaire et/ou infiltratif, la taille maximale des lésions et le caractère multinodulaire (score up-to-seven, score six and twelve…), l’élévation de l’AFP ou de la CRP. Chez ces patients, le choix entre CE et le traitement systémique doit être discuté au cas par cas en RCP spécialisée.
Modalités de chimio-embolisation
- Les modalités de la CE (type de chimiothérapie, agent d’embolisation, avec ou sans lipiodol, répétition systématique ou à la demande des séances) et de surveillance après traitement ne sont pas consensuelles. Néanmoins, l’attitude actuelle dans la plupart des centres est de privilégier des CEs sélectives ou hyper-sélectives permettant une épargne plus importante du parenchyme non tumoral, ce qui est en accord avec les recommandations de l’ESMO 2018 (Vogel A, Cervantes A 2019). Une étude rétrospective suggère que la CE hypersélective est plus efficace que la CE conventionnelle en termes de nécrose tumorale chez des malades en attente de TH (Dharancy, Boitard et al. 2007). Il pourrait s’agir d’une option pour des CHC de petite taille en cas d’impossibilité du traitement chirurgical ou percutané, même si les résultats dans cette situation sont inférieurs à ceux attendus après destruction per-cutanée (Hocquelet, Seror et al. 2016). Pour être réalisable la CE hypersélective doit s’adresser à une tumeur mono- ou pauci pédiculée, étant donc plus souvent périphérique que centro-hépatique, et d’une taille inférieure à 7-10 cm. L’état du foie non tumoral ne semble pas être un facteur limitant dans ce cas puisque le parenchyme non tumoral n’est pas concerné ; des résultats préliminaires suggèrent qu’une nécrose complète est obtenue dans plus de 50 % des cas.
- D’autres modalités de CE utilisant des microsphères chargées de cytotoxiques sont disponibles ; elles ont l’avantage d’une meilleure standardisation de la technique, mais, bien qu’un meilleur profil pharmacocinétique systémique du cytotoxique ait été constaté, leur supériorité sur la CE conventionnelle n’a pas été démontrée en termes de survie (Lammer, Malagari et al. 2010). Les billes chargées présentent par ailleurs une toxicité hépato-biliaire supérieure au lipiodol sur le foie non tumoral (Guiu, Deschamps et al. 2012, Monnier, Guiu et al. 2017).
Association chimio-embolisation et traitement systémique
- Il existe un rationnel scientifique en faveur de l’association de la CE avec des anti-angiogéniques et/ou des immunothérapies. Cependant une telle association, quel que soit le TKI ou l’anti-angiogénique (tel que le sorafénib (Lencioni R 2012) ou le brivanib (Kudo M 2013)) n’a pas montré d’allongement de la survie globale dans les études cliniques de phase II et III et ne doit donc pas être utilisée en pratique.
- La place de l’association de la CE avec une immunothérapie seule ou en association avec un anti-angiogénique a été évaluée dans plusieurs études de phase III dont 2 publiées ; l’étude EMERALD-1 étudiant l’intérêt du durvalumab en induction suivi de durvalumab +/- bevacizumab post-CE et l’étude LEAP 012 évaluant l’intérêt d’associer lenvatinib et pembrolizumab à la chimioembolisation.
- L’étude EMERALD-1 (Sangro B, Kudo M, 2025) était une phase 3 internationale, randomisée, en double aveugle et contrôlée par placebo ayant évalué l'efficacité et la sécurité du durvalumab, avec ou sans bevacizumab, en combinaison avec la chimioembolisation. Les données de l’analyse intermédiaire ont montré que l’ajout du durvalumab et du bevacizumab à la chimioembolisation améliorait de manière significative la survie sans progression (objectif principal) par rapport à la chimioembolisation seule. La SSP médiane était de 15 mois dans le groupe durvalumab + bevacizumab contre 8,2 mois dans le groupe placebo. L'ajout de durvalumab seul à la TACE n'a pas amélioré significativement la SSP par rapport à la TACE seule. La toxicité était essentiellement marquée par le syndrome post-embolisation (de manière similaire dans les 3 bras), et par les toxicités vasculaires (Hypertension, protéinurie) dans le bras bevacizumab. 24,7 % des patients du bras durvalumab + bevacizumab arrêtaient le traitement pour toxicité, vs 7 % dans le bras double placebo. Les données de survie globale sont immatures. Par ailleurs, le traitement était randomisé dès le début de la séquence, et certains patients en non-réponse à la CEL ont été traités par placebo, alors qu’ils relevaient d’un traitement systémique. L’utilisation de l’immunothérapie dès ce stade pose question pour un risque d’inefficacité secondaire au stade avancé, et les résultats actuels ne permettent pas de comparer les différentes séquences.
- L’étude de phase 3 LEAP 012 ( Kudo M, Ren Z 2025) multicentrique, randomisée, en double aveugle, a comparé la CEL combinée au lenvatinib et au pembrolizumab versus double placebo (LEAP-012) avec un co-objectif principal : la SSP et la SG. L'étude a montré une amélioration significative de la SSP avec lenvatinib plus pembrolizumab plus TACE par rapport au placebo plus TACE (SSP médiane de 14,6 mois contre 10,0 mois ; HR 0,66 ; p=0,0002). Il n’existe pas d’amélioration significative de la survie globale (HR 0,80 ; p=0,087) dans la première analyse. Les événements indésirables liés au traitement de grade 3 ou supérieur étaient plus fréquents dans le groupe lenvatinib plus pembrolizumab (71 %) que dans le groupe placebo (32 %). L’intérêt formel de l’association est difficile à déterminer en l’absence données plus matures de survie globale. Les études CARES-05 (TEG ASCO GI 2025) et TALENTACE (ESMO GI 2025) ont été présentées en congrès en 2025 et confirment ces informations : amélioration de la SSP, immaturité des données de SG, augmentation de la toxicité.
En résumé, bien que les essais d’association de la chimio-embolisation aux traitements systémiques (durvalumab/bevacizumab, lenvatinib/pembrolizumab) donnent des signaux encourageants (augmentation de la survie sans progression), les données sont encore immatures (en particulier pour la survie globale) pour recommander ces associations en routine clinique.
Transition chimio-embolisation vers traitement systémique
Compte tenu de la disponibilité de plusieurs thérapies systémiques efficaces, le choix du bon moment pour passer de la CE au traitement systémique est crucial. La poursuite d’un traitement inefficace par CE peut en effet être délétère en retardant voire empêchant l’utilisation de traitements systémiques en cas de dégradation de la fonction hépatique. L'échec de la CE peut être défini par l'apparition d'une invasion macrovasculaire, d'une dissémination extra-hépatique, ou de façon moins consensuelle par une augmentation de l'AFP après CE, l’absence de réponse radiologique objective après deux CE ou l'apparition de nouvelles lésions dans le territoire traité moins de six mois après la réalisation de la CE. La CE doit être également considérée comme en échec en cas de décompensation hépatique secondaire, et le passage aux traitements systémiques doit être discutés en cas de récupération de la fonction hépatique.
7.3.2.2. La radiothérapie interne sélective (Radioembolisation)/SIRT (selective internal radiotherapy)
La radiothérapie interne sélective repose sur l’injection intra-artérielle de microsphères de verre ou de résine marqués à l’Yttrium-90. Cette technique permet d’administrer de manière ciblée des radiations bêta à forte dose aux tumeurs hépatiques et de limiter l’exposition aux radiations du parenchyme hépatique normal. Le terme de « radiothérapie interne sélective » est plus adapté que le terme « radioembolisation » car le traitement repose sur l’irradiation, l’effet emboligène des microsphères utilisées étant peu marqué (Weber M, Lam M 2022).
La procédure se déroule en 2 temps réalisés au maximum à 2 semaines d’intervalle. La première partie consiste en une artériographie hépatique avec injection de macro-agrégats d’albumine marqués au technétium, avec scintigraphie au décours qui permet de vérifier l’absence de contre-indication (shunts digestifs ou pulmonaires). Cette phase « de simulation » permet également de quantifier la dose de radiation absorbée par la tumeur et de calculer l’activité à administrer lors de la 2ème phase. Cette première étape déterminante est un outil prédictif de la réponse tumorale et de la survie globale (Garin E, Guiu B 2022).
La 2ème artériographie, correspond au traitement, avec l’injection des microsphères marquées à l’Yttrium 90, le point d’injection étant nécessairement identique à celui de la 1re artériographie. L’Yttrium n’irradiant pas au-delà de 1 cm de chaque sphère, il n’y a pas de mesure de radioprotection particulière et le traitement peut être organisé en ambulatoire.
Sélection des patients pour la SIRT
Les critères de sélection des patients pour la SIRT sont basés sur la simulation du traitement (angiographie et scintigraphies au MAA) et la fonction hépatique (Weber M, Lam M 2022).
Les contre-indications en lien avec la fonction hépatique sont un score de Child-Pugh > 7, une hyperbilirubinémie > 35 µmol/L, une ascite, même uniquement radiologique.
Les contre-indications en lien avec une sur-irradiation d’organe à risques sont les shunts digestifs excessifs ou les shunts hépato-pulmonaires responsables d’une dose pulmonaire > 30 Gy (50 Gy en dose cumulative).
Les mauvaises indications ou contre-indications relatives sont :
- Les envahissements hépatiques majeurs (> 50 % du foie si cirrhose ; > 70 % du foie sans cirrhose ; maladie diffuse sur foie résiduel post hépatectomie) avec risque de toxicité hépatique trop important.
- Un état général altéré (ECOG > 1).
- Les patients avec maladie extra-hépatique significative
- Sur les données de la simulation de la SIRT, les patients avec un mauvais ciblage des tumeurs (avec dosimétrie insuffisante) ou un mauvais ciblage d’une thrombose porte lors de la simulation, ou les patients dont une particularité anatomique artérielle ne permettant pas de traiter l’ensemble de l’atteinte tumorale.
La SIRT en situation précoce (BCLC A)
Cette approche est apparue après la description de traitements hypersélectifs, appelés « segmentectomie radique » (Vouche M, Habib A 2014). Le principe est la concentration de l’irradiation dans un ou deux segments, permettant une forte dose tumorale, sans crainte de toxicité sur le foie sain car la majeure partie du parenchyme est épargnée. Les résultats ont été confirmés dans la large étude rétrospective multicentrique LEGACY (Salem R, Johnson GE 2021) réalisée chez 162 patients avec lésion unique ≤ 8 cm (taille médiane 2,3cm) traités en première intention par SIRT avec une approche curatrice de segmentectomie radique avec une survie sans progression à 24 mois de 78 %, un taux de survie globale à 3 ans de 86.6 % (IC 95% : 89.5-97.5). Le taux de réponse histologique complet était de 86 % pour une dose > 190 Gy vs 65 % pour une dose < 190 Gy, p=0.0001 (Gabr A, Riaz A 2021). Cette étude a mis en évidence que maximiser la dose au segment en dépassant une dose de 400 Gy entrainait 100 % de réponse histologique complète.
Par ailleurs, des études anatomopathologiques chez des patients secondairement réséqués ou transplantés ont montré des taux de réponse complète histologiques élevés lorsque la dose à la tumeur était supérieure à certains seuils (53 % si > 190 Gy, 75 % si > 500 Gy dans une étude avec microsphères de verre (Toskich B, Vidal LL 2021). L’essai de phase II monobras RASER (Kim E, Sher A 2022) confirme ces résultats rétrospectifs. Ces résultats peuvent faire discuter la place de la SIRT comme une option de traitement au stade A de la classification BCLC en cas de contre-indication à la résection ou à une ablation per-cutanée.
La SIRT dans les stades intermédiaires et en comparaison à la CE (BCLC A et B)
Plusieurs études ont comparé la CE et la RIS. Dans les études rétrospectives et de cohortes, le taux de réponse était de 40 à 50 %, le temps à progression de 13 mois et la médiane de survie globale de 20 mois (Salem, Lewandowski et al. 2011). Dans deux études rétrospectives comparatives, la RIS permettait un temps à progression supérieur à la CE pour un taux de complications moindre, mais sans différence de survie globale (Hilgard, Hamami et al. 2010, Salem, Lewandowski et al. 2011).
Deux études prospectives randomisées monocentriques de faible effectif ont suggéré une supériorité de la SIRT par rapport à la CE.
La première étude (Salem R, Gordon AC 2016) a comparé SIRT (n=24) et chimioembolisation (n=21) dans une population comportant 78 % de patients BLCC A et 22 % de BLCC B. Il s’agissait d’une approche à visée curatrice, soit en attente de transplantation, soit de downstaging vers la transplantation. Dans le bras SIRT, 54% des patients ont été transplantés, contre 33 % dans le bras chimioembolisation. La survie sans progression médiane était non atteinte à 26 mois dans le bras SIRT vs 6.8 mois pour la chimioembolisation, HR= 0,122 (IC 95%: 0,023-0,56), p=0.007.
La seconde étude (Dhondt E, Lambert B 2022) a comparé SIRT (n=38) et DCBeads (n=34) dans une population comportant 15 % de patients BCLCBLCC A et 85 % de BCLCBLCC B. Cette étude a été stoppée dès son analyse intermédiaire pré-planifiée (initialement prévue sur 136 patients) en raison de la positivité de son objectif principal de survie sans progression (17,1 mois dans le bras SIRT contre 9,5 mois dans le bras DCBeads (HR=0,36 ; p=0,02). La survie globale est de 27,6 mois dans le bras SIRT contre 15,6 mois dans le bras DCBeads (HR=0,49 ; p=0,01). Un down-staging avec transplantation a été obtenu dans 33 % dans le bras SIRT vs 10 % dans le bras chimioembolisation.
L’amélioration du temps à progression et la proportion significative de down-staging est d’un intérêt particulier dans le contexte de transplantation hépatique.
Ces études relancent le débat de l’avantage de la SIRT en comparaison avec la CE en particulier dans une stratégie de down-staging ou d’attente de transplantation.
En comparaison ou en association avec les traitements systémiques (BCLC B et C)
Trois essais de phase III randomisés ont évalué la RIS chez des patients ayant échappé à la CE et en indication théorique de traitement par sorafénib.
- L’essai français SARAH (Vilgrain, Pereira et al. 2017) comparant la RIS au traitement par sorafénib a inclus 459 patients. L’objectif principal de l’étude (amélioration de la survie globale) n’était pas atteint (8 mois pour le bras RIS vs 9,9 mois pour le bras sorafénib, HR = 1,15 (IC 95 % : 0,94-1,41) Log-rank p = 0,18). De même il n’existait pas d’amélioration de la survie sans progression (4,1 vs 3,7 mois, p=0,256, HR = 1,03 (IC 95% : 0,85-1,25) Log-rank P = 0,76). Même si les effets indésirables -notamment fatigue et diarrhée- sont moins fréquents dans le groupe RIS (76 % versus 94 %) et que l’analyse de la qualité de vie en faveur de ce groupe, cette étude négative ne permet pas de positionner définitivement la RIS comme une alternative au traitement par sorafénib.
- L’essai SIRveNIB (Chow, Ghandi. 2018) est un essai similaire dans sa conception à l’essai SARAH, mené en Asie. 360 patients (182 Y90, 178 sorafénib) ont été inclus dont 30,6 % avec présence d’une thrombose portale. Cette étude est aussi négative, avec un critère de jugement principal de survie globale de 8,8 mois dans le groupe RIS versus 10,0 mois dans le bras sorafénib (HR 1,1), mois). et une survie sans progression de 5,8 vs 5,1 mois (HR 0,89).
- L’essai SORAMIC (Ricke, Sangro 2018) a inclus 424 patients atteints d'un CHC inopérable qui ont été randomisés pour recevoir un traitement par RIS avec des microsphères de résine d'yttrium-90 (SIR-Sphères®) et sorafénib ou du sorafénib seul. La médiane de survie globale était de 12,1 mois dans le bras radioembolisation + sorafénib (n = 216) et à 11,5 mois dans le bras sorafénib (n = 208) ce qui n’était pas significatif.
Deux facteurs majeurs peuvent contribuer aux résultats négatifs de ces études randomisées : l’absence de dosimétrie personnalisé et le taux élevé de non-réalisation de SIRT à l’issue de la première phase suggérant une sélection sous-optimale des patients.
Les études avec dosimétrie personnalisés et meilleure sélection des patients (Child Pugh A, absence d’ascite radiologique, bilirubine < 35 µmol/mL, peu de thrombose tumorale tronculaire VP4, < 50 % d’envahissement tumoral), incluant une sélection des patients sur les données de simulation (dosimétrie/ciblage tumeur et ciblage thrombose), ont permis de relancer l’intérêt de la SIRT dans les CHC localement avancés.
L’étude DOSISPHERE 01 (Garin A, Tselikas L 2021) a comparé dosimétrie personnalisée (basée sur la dose tumoricide de 205 Gy, 250-300 Gy si possible avec les microbilles de verre) et dosimétrie standard (120 Gy au lobe traité) chez 60 patients (31 dans le bras dosimétrie personnalisée, 29 dans le bras dosimétrie standard) ayant des lésions très volumineuses (moyenne 10.5 cm), et avec un envahissement portal dans 68 % des cas. Le taux de réponse était de 71 % dans le bras dosimétrie personnalisé contre 36 %, p=0.0074, pour le bras dosimétrie standard et la survie globale de 26,6 mois dans le bras dosimétrie personnalisée vs 10,7mois HR=0.22 (IC95% : 0,21-0,82), p=0.0096.
Pour les patients avec invasion portale, la survie globale (ITT) était de 22,9 mois (IC95% : 9,1-NA) dans le bras dosimétrie personnalisée vs 9,5 mois HR=0.39 (IC95% : 0,17-0,92), p=0.023. Enfin une relation dose effet forte est démontrée pour le seuil de dose tumoricide ≥ 205 Gy (microbilles de verre) avec une survie globale médiane de 26,6 mois (IC95% : 13,5-NA) pour une dose 205 Gy vs 7,1 mois (IC95% : 4,6-14,8) mois pour une dose < 205 Gy, HR =0,33 (IC95% : 0,15-0,71), p=0,0029.
L’analyse rétrospective des résultats de SARAH en fonction de la dosimétrie reproduit des résultats similaires avec un seuil de 100 Gy (microsphères de résine, SIRsphere®) (Hermann AL, Dieudonné A et al 2020). Les résultats sont encourageants et ont conduit à des recommandations précises de réalisation technique du traitement permettant d‘améliorer significativement les résultats (Salem R, Padia SA 2019).
Néanmoins, des études prospectives et comparatives de phase 3 restent souhaitables pour positionner la place de la SIRT par rapport aux traitements systémiques actuels d’immunothérapie.
Cas particuliers des envahissements portaux
La possibilité de downstager des CHC avec thrombose porte a été rapporté dans 3 séries observationnelles avec accès à un traitement curateur dans environ 1/3 des cas et dans cette situation des survies 5 ans > 50 % (Serenari M, Cappelli 2021 ; Meerun MA, Allimant C 2023 ; Garin E, Tselikas L 2024).
Enfin, il existe un rationnel pour l’association de la SIRT avec l’immunothérapie. Des premiers essais de phase 1/2 ont montré la faisabilité mais il n’existe pas d’étude randomisée à l’heure actuelle permettant de mieux préciser l’articulation entre la RIS et l’immunothérapie en situation avancée.
La place de la SIRT dans la stratégie thérapeutique est progressivement mieux définie avec une importance majeure de la sélection des patients et de la réalisation d’une phase de simulation avec dosimétrie personnalisée.
Il existe des arguments forts pour un bénéfice de ce traitement à tous les stades de la maladie chez des patients avec une fonction hépatique préservée : BCLC A (en cas de contre-indication à résection, destruction per-cutanée ou SBRT), BCLC B (pour des lésions unilobaires en particulier dans une stratégie de down-staging) ou BCLC C (avec invasion vasculaire ciblable et < VP4).
Si une SIRT est envisagée, une dosimétrie personnalisée cherchant à obtenir une dose seuil délivrée à la tumeur suffisante (205 Gy si sphères de verre, 100 Gy si sphères de résine) doit être utilisée tout en préservant au moins 30 % de réserve hépatique.
7.3.2.3. Traitements médicamenteux
Traitement de première ligne
Association atézolizumab-bévacizumab
Les résultats de l’étude de phase III IMbrave 150 comparant l'association de l'atézolizumab 1200 mg toutes les 3 semaines (immunothérapie anti-PD-L1) et du bevacizumab 15 mg/kg toutes les 3 semaines (anticorps monoclonal ciblant le VEGF) au traitement par sorafénib ont été publiés en 2020 (Finn R, Qin S et al, 2020) avec une mise à jour en janvier 2021 (Finn R, Qin S et al, 2021). Les patients inclus avaient un état général conservé (OMS 0/1) et un score de CHILD A. L’association montre un bénéfice significatif en survie globale (19,2 vs 13,4 mois, HR : 0,66, p < 0.0009), en survie sans progression (6,9 contre 4,3 mois, HR : 0,65, p=0.0001) en taux de réponse selon RECIST 1.1 (30 vs 11 %, p <0.001%). L’étude ne rapporte pas de de suivi à long terme des patients. Le pourcentage d’effets indésirables de grade 3-4 imputables au traitement était similaire entre les 2 bras (43 vs 46 %), néanmoins les effets indésirables imputables à la combinaison expérimentale (HTA, protéinurie, cytolyse) ayant un impact moindre sur la qualité de vie, le temps à détérioration de la qualité de vie était significativement allongé par l’association atézolizumab-bevacizumab. L’analyse des résultats met en évidence un risque accru de saignement par hypertension portale sous bevacizumab (11 % vs 2 % de saignement par rupture de varices œsophagiennes). Ce risque hémorragique semble supérieur en données de vraie vie avec 14 % d’évènements hémorragiques dans la cohorte rétrospective de 216 patients avec CHC avancé traité par atézolizumab-bevacizumab de d’Alessio et al (d’Alessio Hepatology 2020). Un bilan endoscopique est donc justifié avant la mise en route de ce traitement et une prévention efficace de la rupture des varices doit être instaurée, idéalement par béta-bloquants.
L’association a obtenu une AMM en France en 2021 dans le traitement de première ligne des patients atteints de carcinome hépatocellulaire avancé ou non résécable, n’ayant pas reçu de traitement systémique antérieur, avec une fonction hépatique préservée (stade Child-Pugh A), un score ECOG 0 ou 1, et non éligibles aux traitements locorégionaux ou en échec à l’un de ces traitements.
Association durvalumab-trémélimumab
L’étude HIMALAYA publiée en Juin 2022 (Abou-Alfa GK, Lau G 2022) est un essai randomisé de phase III comparant en première ligne de traitement le sorafénib (389 patients) au schéma STRIDE (393 patients) associant une injection unique initiale de trémélimumab à la dose de 300 mg (anti-CTLA4) et des injections de durvalumab à la dose de 1500 mg (anti-PDL1) toutes les 4 semaines jusqu’à progression ou intolérance. Les patients inclus étaient en bon état général (OMS 0/1) avec une fonction hépatique préservée (CHILD A, 50 % ALBI 1). Contrairement à l’étude précédente, l’invasion tronculaire portale (VP4) était un critère d’exclusion. Une infection virale B ou C était présente dans 30 et 37 % des cas respectivement. L’étude est positive dans son objectif principal avec une amélioration significative de la survie globale (16,4 vs 13,8 mois, HR 0,78 (0,65-0,92)). Les taux de survie à 24 mois (40,5 % vs 32,6 %), 36 mois (30,7 vs 20,2 %) et 48 mois (25,2 vs 15,1 %) étaient également augmentés. La médiane de survie sans progression n’était pas différente entre les deux groupes. Le pourcentage d’effets indésirables de grade 3-4 était similaire dans les deux groupes (50 % pour le schéma Stride, 52,4% pour le sorafénib). Les taux de réponse étaient de 20,1% dans le bras bi-immunothérapie vs 5,1% dans le bras sorafénib. On note 35,8 % d’effets immunomédiés dont 12,7 % de grade 3-4 conduisant à un traitement par corticostéroïdes dans 20% des cas et un arrêt du traitement dans 5,7 % des cas. Aucun cas de rupture de varice œsophagienne n’a été rapporté pendant l’étude. Enfin, l’association durvalumab - trémélimumab était associée à une détérioration plus tardive de la qualité de vie. Le suivi au long court des patients de cette étude a permis de montrer qu’à 60 mois de l’inclusion, 19,6% des malades du bras STRIDE étaient encore en vie par rapport à 9,4 % dans le bras sorafénib (Rimassa L,Chan SL 2025).
L’association durvalumab-trémélimumab a obtenu une AMM en France en traitement supplémentaire de 1ère ligne chez les patients adultes atteints d'un CHC avancé ou non résécable, n’ayant pas reçu de traitement systémique antérieur, avec une fonction hépatique préservée (stade Child-Pugh A), un score ECOG 0 ou 1, et non éligibles aux traitements locorégionaux ou en échec à l’un d’eux.
Association ipilimumab-nivolumab
L’étude CHECKMATE 9DW publiée en 2025 (Yau T, Galle PR 2025) était un essai de phase 3, ouvert et randomisé, qui a inclus des patients atteints d'un carcinome hépatocellulaire non résécable sans thérapie systémique antérieure, avec un score de Child A et score OMS de 0 ou 1, et sans envahissement tronculaire de la veine porte. Les patients ont reçu nivolumab (1 mg/kg) plus ipilimumab (3 mg/kg) par voie intraveineuse toutes les 3 semaines jusqu'à un maximum de quatre doses, suivi de nivolumab 480 mg toutes les 4 semaines (335 patients) ou, au choix de l'investigateur, soit lenvatinib oral (8 mg ou 12 mg par jour selon le poids corporel) soit sorafénib oral (400 mg deux fois par jour (n=333). Le lenvatinib a été choisi dans 85 % des cas.
Un croisement précoce des courbes de Kaplan-Meier de la survie globale a reflété un nombre plus élevé de décès au cours des 6 premiers mois après la randomisation dans le bras nivolumab plus ipilimumab (hazard ratio 1,65 [IC à 95 % 1,12–2,43]) (11/18 décès reliés au traitement dans le bras immunothérapie versus 1 dans le bras ITK), mais a été suivi d'une séparation soutenue des courbes par la suite en faveur de nivolumab plus ipilimumab (HR 0,61 [0,48–0,77]). Après un suivi médian de 35,2 mois (IQR 31,1–39,9), la survie globale a été significativement améliorée avec nivolumab plus ipilimumab (médiane 23,7 mois [IC à 95 % 18,8–29,4] vs 20,6 mois [17,5–22,5] ; hazard ratio 0,79 [0,65–0,96] ; p =0,018) ; les taux de survie globale respectifs étaient de 49 % (IC à 95 % 44-55) versus 39 % (34-45) à 24 mois et de 38 % (32-43) versus 24 % (19-30) à 36 mois. Le taux de réponse selon RECIST 1.1 était de 36 % (dont 7 % de réponses complètes) dans le bras nivolumab-ipilimumab vs 13 % dans le bras sorafénib/lenvatinib. Des effets indésirables de grade 3-4 ont été observés dans 41 % des cas sous nivolumab-ipilimumab dont 29% ont nécessité une corticothérapie, et 42 % des cas dans le bras lenvatinib/sorafénib. L’association nivolumab-ipilimumab a obtenu l’AMM européenne, mais n’est pas encore remboursée en France dans cette indication à l’heure de l’écriture de ce référentiel.
Les inhibiteurs de tyrosine kinase
Sorafénib
L’essai randomisé de phase 3 SHARP (N inclus = 602), comparant sorafénib et placebo chez des malades atteints de CHC évolué, montrait un allongement significatif de la survie globale (médiane : 10,7 mois vs 7,9 mois) et de la survie sans progression (5,5 mois vs 2,8 mois) dans le bras sorafénib, mais sans amélioration de la survie sans progression clinique, et avec un taux de réponse tumorale faible selon les critères RECIST 1.1 % (réponses partielles : 2,3 %).
Des effets indésirables sévères (grade ≥3) étaient observés chez 8 % des malades traités (diarrhée et syndrome mains-pieds) (Llovet, Ricci et al. 2008). Des résultats identiques ont été constatés dans un essai de phase III avec les mêmes critères d’inclusion dans la zone Asie-Pacifique (Cheng, King et al. 2009).
A la suite de ces essais, le sorafénib (Nexavar®) a bénéficié d’une extension d’AMM en octobre 2007 avec le libellé « indiqué dans le traitement du carcinome hépatocellulaire ». Considérant cette indication comme insuffisamment précise, compte tenu des critères d’inclusion et des résultats de l’essai SHARP, un groupe de travail PRODIGE-AFEF a retenu comme indication du sorafénib (Nexavar®) : « Traitement palliatif du CHC non éligible pour un traitement spécifique (TH, résection chirurgicale, destruction per-cutanée, CE), ou en récidive après traitement spécifique, chez les malades en état général conservé (OMS 0 à 2) et Child-Pugh A » (Boige, Barbare et al. 2008). Cette recommandation a été reprise par la Commission de transparence de la HAS en 2008. Plus récemment l’étude de phase II prodige 21 comparant chez les patients CHILD B un traitement par sorafénib vs soins de support a confirmé l’absence de bénéfice d’un traitement par sorafénib en cas de cirrhose CHILD-Pugh B8/9 et un bénéfice modeste en cas de score B7 (Blanc, Khemissa 2021). Chez ces patients la décision de traitement par sorafénib doit être prise après discussion du rapport bénéfice/risque en tenant compte de l’état général du patient et des comorbidités.
Lenvatinib
Le lenvatinib (un inhibiteur des récepteurs 1 à 3 du VEGF, des récepteurs 1 à 4 du FGF, du récepteur α du PDGF, de RET et de KIT) a montré une efficacité équivalente à celle du sorafénib (Kudo, Finn 2018) dans une étude de phase III de non-infériorité chez des patients avec un CHC au stade B ou C de la classification BCLC, un stade A de Child-Pugh, et un indice ECOG PS ≤ 1. La SG médiane dans le bras lenvatinib était non inférieure à celle du bras sorafénib avec respectivement 13,6 vs 12,3mois (HR 0,92). La durée médiane du traitement était de 5,7 mois pour le lenvatinib et de 3,7 mois (0,1-38,7) pour le sorafénib. La survie sans progression médiane (7,4 vs 3,7 mois) était significativement augmentée dans le bras lenvatinib (HR 0.66, p<0.0001) ainsi que le taux de réponse objective selon les critères RECIST modifiés (24 % vs 9 %, p<0.0001). Les effets indésirables les plus courants pour le lenvatinib étaient l’hypertension (42 %), la diarrhée (39 %), la diminution de l'appétit (34 %), la perte de poids (31 %) et la fatigue (30 %). Le lenvatinib est donc une alternative au sorafénib en traitement de première ligne. Une extension d’AMM Européenne a été obtenue en 2018 mais le remboursement dans l’indication de CHC n’a pas été accordé en France.
Autres inhibiteurs de tyrosine kinase
D’autres inhibiteurs de tyrosine kinase ont été étudiés en traitement de première ligne du CHC en phase II et III sans efficacité supérieure ou équivalente à celle du sorafénib en phase II ou III, que ce soit en comparaison directe au sorafénib pour le sunitinib ou le brivanib (Johnson, Qin et al. 2013) ou en association avec une thérapie ciblée (erlotinib) ou une chimiothérapie (étude GONEXTt/PRODIGE 10).
Immunothérapie en monothérapie
Trois études de phase III randomisées ont évalué l’intérêt d’une immunothérapie en monothérapie versus sorafénib en traitement de première ligne de CHC chez des patients avec fonction hépatique préservée (CHILD A) et état général conservé (OMS 0-1).
- L’essai CheckMate 459 a étudié le nivolumab (anti-PD1) (Yau T, Park JW 2022). Cette étude de supériorité est négative dans son objectif principal avec une médiane de survie à 16.4 mois pour le bras nivolumab contre 14.7 mois pour le bras sorafénib (HR 0.85 (0.72-1.02), p=0.075). La survie sans progression n’était pas non plus significativement différente. Les taux de réponse étaient de 15 % dans le bras nivolumab vs 7 % sous sorafénib.
- L’essai HIMALAYA comportait un bras durvalumab en monothérapie (Anti-PDL1) comparé au sorafénib avec un objectif de non-infériorité (Abou-Alfa GK; Lau G 2022). Cette étude est positive sur son objectif principal en survie globale de 16,6 mois dans le bras durvalumab vs 13,8 mois (HR 0,86 (0,73-1,03)). Le taux de réponse était de 17 % vs 5.1 % pour le sorafénib. Les effets secondaires immunomédiés étaient moins fréquents qu’avec l’association durvalumab-trémélimumab 16,5 vs 35.8 %, dont 6,4 vs 12.6% de grade 3-4, 9,5 vs 20,1 % d’utilisation de corticoïdes et 2,6 vs 5,7 % d’arrêt de traitement.
- L’essai Rationale-301 étudiant le tislelizumab (anti-PD1) est positive pour son objectif principal de non-infériorité en survie globale (15,9 mois pour le tislelizumab vs 14,1 mois pour le sorafénib HR 0,85 (0,712-1,019)) (Qin S, Kudo M 2022). Le taux de réponse sous tislelizumab était de 14,3 % vs 5,4 % sous sorafénib. On notait 17 % d’effets indésirables immunomédiés dont 12 % ayant nécessité un traitement par corticoïdes.
Combinaison d’immunothérapie et d’inhibiteurs de tyrosine-kinases
Plusieurs études de phase III ont comparé l’association d’inhibiteurs de tyrosine kinase et d’immunothérapie vs sorafénib ou lenvatinib en première ligne chez des patients en bon état général (OMS 0-1) et avec une fonction hépatique préservée (CHILD A).)
- Cabozantinib-atézolizumab (COSMIC 312). Cette étude de phase III a inclus 432 patients traités par cabozantinib (40 mg/j) et atézolizumab 1200 mg IV toutes les trois semaines et 217 patients traités par sorafénib avec un co-objectif principal : survie globale et survie sans progression (Kelley RK, Rimassa L 2022). La survie sans progression était améliorée dans le bras cabozantinib-atézolizumab (6,8 vs 4,2 mois HR 0,63 (0,44-0,91)) ainsi que le taux de réponse (13 % vs 5 %) mais sans bénéfice en survie globale (15,4 vs 15,5 mois HR 0,90 (0,69-1,18)). Les effets secondaires de grade 3-4 étaient plus fréquents dans le groupe atézolizumab-cabozantinib (64 % vs 46 %).
- Lenvatinib-pembrolizumab (LEAP 002). Après une étude de phase I encourageante cette association (lenvatinib 8 ou 12 mg selon le poids – pembrolizumab 200 mg toutes les 3 semaines) a été comparée chez 295 patients au lenvatinib (8 ou 12 mg selon le poids) en monothérapie (399 patients). Même si les résultats de la phase I ont été confirmés avec une médiane de survie supérieure à 20 mois dans le bras lenvatinib -pembrolizumab (21,2 mois), cette étude est négative, avec une médiane de survie élevée dans le bras lenvatinib (19 mois, HR 0,84 (0,708-0,997, p= 0,0227 pour un seuil de significativité à 0,0185). La survie sans progression n’était pas non plus significativement améliorée. Le taux de réponse selon les critères RECIST était de 26,1 % pour la combinaison vs 17,5 % pour le lenvatinib. Le taux d’effets secondaires de grade 3-5 était de 62,2 % pour la combinaison vs 57,5 % pour le lenvatinib.
- Rivoceranib-camrelizumab. Cette étude comportant une majorité de patients asiatiques (82,7 %) avec infection virale B (75 %) a comparé l’association rivoceranib (inhibiteur et tyrosine kinase plus spécifique du VEGFR2, donné à 250 mg/j) et camrelizumab (anti-PD1 200 mg toutes les 2 semaines) au sorafénib (Qin S, Chan LS 2022). L’étude est positive pour ses 2 co-objectifs principaux : la survie sans progression (5,6 vs 3,7 mois HR 0,52 (0,41-0,65) p < 0,0001) et la survie globale (22,1 mois vs 15,2 mois HR 0,62 (0,49-0,8) p < 0,0001). Les taux de réponse étaient de 25,4 % pour la combinaison vs 5,9% pour le sorafénib selon les critères RECIST 1.1. Les effets secondaires de grade 3-4 étaient plus fréquents avec la combinaison (80,5 % vs 52 %). La transposabilité de ces résultats à la population non asiatique reste cependant incertaine.
Traitement de seconde ligne
Après échec d’une première ligne comportant une immunothérapie
La séquence thérapeutique optimale pour les patients atteints de CHC avancé reste à définir. Bien qu’il existe un besoin croissant de recommandations claires, l’absence d’étude randomisée rend difficile l’établissement de celles-ci.
La prescription d’un ITK en seconde ligne est une option proposée par la plupart des sociétés savantes. Une étude de phase 2 évaluant le cabozantinib (Chan SL, Ryoo BY 2024) en deuxième ligne après traitement basé sur l’immunothérapie, a montré une SSP médiane de 4,4 mois et une SG médiane de 9,9 mois, résultats proches de ceux rapportés après sorafénib. Une seconde étude de phase 2 utilisant le lenvatinib (n=50) rapporte un taux de réponse de 14%, une médiane de SG de 9,8 mois (Kim HD, Sym J 2025). Ces observations nécessitent toutefois confirmation dans des essais de plus grande ampleur pour confirmer le choix de ITK après immunothérapie. D’autres études de cohortes rétrospectives doivent être interprétées avec prudence mais montrent dans l’ensemble des taux de réponses et des survie globales similaires à celles observées avec des TKI en première ligne suggérant que la première ligne d’immunothérapie n’impacte pas défavorablement l’efficacité des TKI.
Le tableau ci-dessous synthétise les publications disponibles (études de phase II ou de cohorte) d’utilisation de TKI après atezolizumab et bevacizumab.
N | TKI | RR | SSP | SG | |
|---|---|---|---|---|---|
| Yano S et al. 2023 | 24 | Lenvatinib | 33 % | 4 | 15,3 |
| Persano et al. 2023 | 84 | Lenvatinib |
|
| 17 |
| Marell et al. 2024 | 62 | Lenvatinib |
|
| 10,7 |
| Hirakoa A, 2023 | 101 | Lenvatinib | 15,40 % | 4,4 | 15,7 |
| Chen YH et al. 2023 | 14 | Lenvatinib | 21 % | 6,7 | 10,5 |
| Yoo C et al. 2021 | 19 | Lenvatinib | 15,80 % | 6,1 | 16,6 |
| Muto H et al. 2023 | 20 | Lenvatinib | 25 % | 6 | 10,5 |
| Mohri K et al 2024 | 21 | Lenvatinib | 45 % | 3,5 | 24,2 |
| Falette-Puisieux et al. 2023 | 8 | Lenvatinib |
| 4,4 | 5,7 |
| Cheon J et al. 2025 | 56 | Lenvatinib | 12 % | 4,9 | 13,2 |
| Persano et al. 2024 | 160 | Lenvatinib | 26 % | 3,5 | 18,9 |
| Lee et al. 2024 | 154 | Lenvatinib | 6 % | 4 | 8 |
| Persano et al. 2023 | 43 | Sorafénib |
|
| 14,2 |
| Yoo C et al. 2021 | 29 | Sorafénib | 0 % | 2,5 | 11,2 |
| Falette-Puisieux et al. 2023 | 41 | Sorafénib |
| 2,6 | 7 |
| Cheon J et al. 2025 | 67 | Sorafénib | 8 % | 3,3 | 11,5 |
| Tovoli et al. 2024 | 54 | Sorafénib | 0 % | 3,3 | 6,9 |
| Persano et al. 2024 | 95 | Sorafénib | 20 % | 4,3 | 14,3 |
| Lee et al. 2024 | 324 | Sorafénib | 4,5 % | 2,3 | 6,3 |
| Falette-Puisieux et al. 2023 | 29 | Régorafénib |
| 2,6 | 15,8 |
| Lee et al. 2024 | 36 | Régorafénib | 11,4 % | 3,6 |
|
| Persano et al. 2023 | 23 | Cabozantinib |
|
| 12,4 |
| Marell et al. 2024 | 10 | Cabozantinib |
|
| 12,8 |
| Lee et al. 2024 | 12 | Cabozantinib | 0 % | 5,4 | 11,2 |
| Falette-Puisieux et al. 2023 | 4 | Cabozantinib |
| 2,8 | 9,2 |
Trois études rétrospectives ont évalué l’intérêt d’une seconde immunothérapie après échec d’une première ligne comportant soit un anti-PD1/PD-L1L1PDL1 seul, soit une association atezolizumab-bevacizumab (Wong JSL, Kwok GGW 2021 ; Scheiner B, Roessler D 2022 ; Alden SL, Lim M 2023). Les faibles effectifs et l’hétérogénéité des traitements reçus doivent rendre prudent dans l’interprétation de ces données. Néanmoins, une seconde ligne d’immunothérapie comportant une classe thérapeutique absente en première ligne (anti-CTLA4 ou anti VEGF) semble associée à des taux de réponse tumorale significatifs (16 à 26 %; y compris chez des patients ayant progressé d’emblée en première ligne) et des survies globales de 6 à plus de 14 mois. Les données de tolérance étaient sensiblement analogues à celles rapportées en première ligne d’immunothérapie. Des patients ayant présenté des effets secondaires immuno-médiés en première ligne ont pu recevoir une seconde ligne d’immunothérapie sans sur-toxicité manifeste.
Le tableau ci-dessous regroupe les données disponibles d’utilisation d’immunothérapie après première ligne par atezolizumab et bevacizumab.
1ère ligne | N | Combinaison | RR | SSP | SG | |
|---|---|---|---|---|---|---|
| Mori N et al. 2024 | Atezo-beva | (85) | Durva-treme | 5 % | 2,35 | |
| Miura R et al. 2024 | Atezo-beva | 16 | Durva-treme | 0 % |
| |
| Sho T et al. 2022 | Atezo-beva | 25 | Durva-treme | 14 % |
| |
| Rossler D et al. 2022 | AB 7 Nivo-lenva 3 | 10 | Nivo-ipi | 30 % | 2,9 | 7,4 |
| Lim JS et al. 2024 | Atezo-beva | 49 | Nivo-ipi | 15 % | 1,4 | 5,8 |
| Lee et. al 2024 | Atezo-beva | 50 | ICI + TKI | 13 % | 5,4 | 12,6 |
| El Khoureiry et al. 2024 | Atezo-beva | 68 | Rego-Pembro | 6 % | 2,8 | NE > 14 |
Après échec d’une première ligne par ITK
Plusieurs essais cliniques de phase II et III ont évalué l’intérêt d’un traitement de seconde ligne après échec (ou intolérance) du sorafénib. Ces études ont testé - contre placebo - des inhibiteurs de tyrosine kinase ciblant les voies du VEGF, de l’EGF et c-met, des anticorps monoclonaux (anti-VEGF) et des immunothérapies. A ce jour, quatre études de phase III sont positives après échec (progression ou intolérance) du sorafénib.
Régorafénib
L’étude RESORCE (Bruix, Qin et al. 2017) randomisée contre placebo, en double aveugle a montré une efficacité du régorafenib (un inhibiteur de VEGFR1-3, c-Kit, TIE-2, PDGFR-β, FGFR-1, RAF-1, BRAF, p38) à la dose de 160 mg/jour trois semaines sur quatre, chez des patients CHILD A après progression sous sorafénib. Le régorafenib augmente significativement la survie globale par rapport au placebo (10,6 versus 7,8 mois). Les principaux effets indésirables sont représentés par l’hypertension artérielle le syndrome pied-main et la diarrhée. Le régorafenib est donc un traitement validé de seconde ligne après échec du sorafénib chez des patients ayant une fonction hépatique préservée (CHILD A) et sans intolérance préalable au sorafénib.
Cabozantinib
Les résultats de l’étude CELESTIAL (Abou-Alfa, Meyer, 2018) de phase III randomisée et randomisée en double aveugle comparant le cabozantinib au placebo en deuxième ou troisième ligne ont été publiés en juillet 2018. Les patients en bon état (PS 0-1), présentant une fonction hépatique préservée (CHILD A) et un échec (progression ou intolérance) sous sorafénib ont été inclus. La survie globale médiane était de 10,2 mois avec le cabozantinib contre 8 mois avec le placebo (HR 0,76). La survie sans progression était de 5,2 mois avec le cabozantinib comparativement à 1,9 mois avec le placebo (HR 0,44). Les principaux effets indésirables sont représentés par le syndrome pied-main, la diarrhée, l’hypertension artérielle et l’asthénie. Le cabozantinib peut donc être utilisé en traitement de seconde ligne après échec du sorafénib (progression ou intolérance).
Ramucirumab
Le ramucirumab est un anticorps humanisé inhibant l’activation des ligands du récepteur VEGF-2, testé dans le traitement de deuxième ligne du CHC dans une étude de phase III randomisée versus placebo (étude REACH) (Zhu, Park et al. 2015). Bien que la survie globale médiane n’était pas augmentée de façon significative par rapport au placebo (9,2 vs 7,6 mois), un bénéfice significatif était observé dans le sous-groupe prédéfini de patients présentant une AFP > 400 ng /ml. Une deuxième étude de phase III (REACH-2) spécifiquement dédiée aux patients présentant une AFP > 400 a donc été conduite (Zhu, Kang, 2019) et a montré une amélioration significative de ; la survie globale (SG médiane de 8,5 vs 7,3 mois ; HR 0,710) et de la survie sans progression avec le ramucirumab. L’analyse poolée des études REACH2 et REACH (avec patients ayant une AFP > 400) confirment ces résultats (Zhu, Finn 2018) et montrent que le profil de tolérance du ramucirumab semble être meilleur que celui des inhibiteurs de la tyrosine kinase avec un délai avant détérioration clinique augmenté chez les patients recevant le ramucirumab (Zhu, Finn 2018). Le ramucirumab n’a pas reçu d’extension d’AMM en France.
Apatinib
Cet inhibiteur du VEGF-R2 a été étudié à la dose de 750 mg/j en phase III versus placebo réalisée en Chine en seconde ligne (après échec du sorafénib ou de traitements à base d’oxaliplatine) chez des patients CHILD ≤ ouB7. La survie médiane était significativement allongée dans le bras apatinib (8,7 vs 6,8 mois, HR 0,785 p=0,0476) (Li, Quin et al 2020). Il n’existe pas de données sur l’efficacité de ce traitement dans une population occidentale.
Pembrolizumab
L’intérêt du pembrolizumab après échec du sorafénib a été évalué versus placebo dans deux études de phase III randomisées : une en population majoritairement non asiatique à 75% (Finn RS, Ryoo BY 2020) et une en population asiatique (Qin S, Chen Z 2022).
La première étude est négative pour son objectif principal avec une médiane de survie de 13,,9 mois pour le pembrolizumab versus 10,6 mois pour le placebo (HR 0,78 (0,611-0,998). La survie sans progression était de 3 mois pour le pembrolizumab vs 2,,8 mois pour le placebo et le taux de réponse de 18,4 % vs 4,4 % pour le placebo. L’étude en population asiatique est par contre positive avec une amélioration significative de la survie globale (14,6 vs 13,0 mois ; HR 0,79 (0,63-0,99) p = 0,0180) et de la survie sans progression (2,6 vs 2,3 mois ; HR 0,74; (0,60-0,92) p = 0,0032). Le taux de réponse était de 12,7 % vs 1,3 % dans le groupe placebo.
Traitement systémique en cas de cirrhose CHILD B
Les patients avec fonction hépatique Child B représentent 20-25 % des patients traités pour un carcinome hépatocellulaire (CHC) avancé, mais sont exclus des essais cliniques de phase 3 en raison de leur pronostic plus réservé et du risque accru d’effets indésirables.
Le traitement par inhibiteur de tyrosine kinase de type sorafénib semble faisable sans augmentation significative des effets indésirables, mais avec une survie globalement plus faible par rapport à la population Child A. Une étude (PRODIGE 21) a comparé sorafénib, pravastatine, leur association, et les soins de support, chez des patients avec cirrhose CHILD B sans différence notable en terme de progression ou de survie globale, bien que certains résultats suggèrent un bénéfice potentiel du sorafénib chez les patients Child-Pugh B7 ou ALBI grade 1 ou 2 (médiane de survie globale de 6,5 mois vs 3,0 mois pour Child-Pugh B7 vs B8-9 et 6,1 mois vs 3,1 mois pour ALBI grade 1 ou 2 vs grade 3). ( Blanc JF, Khemissa F 2021).
Pour l’immunothérapie, les données rétrospectives indiquent une faisabilité avec une survie plus faible, un taux de réponse d’environ 14 % et une médiane de survie globale autour de 5,5 mois. La cohorte du nivolumab dans l’étude Checkmate-040 a montré une réponse de 12 % et une médiane de survie globale de 7,6 mois, avec un profil de tolérance acceptable. Cependant, il n’existe pas encore d’études prospectives sur les associations d’immunothérapies dans cette population.
7.3.3. Indications thérapeutiques
7.3.3.1. CHC sur cirrhose
La discussion se fait à partir de 2 critères principaux, l’extension tumorale et l’état anatomique et fonctionnel du foie non tumoral. D’autre part, les indications de résection, destruction per-cutanée et traitements loco-régionaux sont limitées aux malades en bon état général (OMS 0-1) et celles des traitements systémiques aux malades en état général « conservé » (OMS ≤ 2). Un diagramme d’aide à la décision thérapeutique prenant en compte ces différents paramètres est proposé.
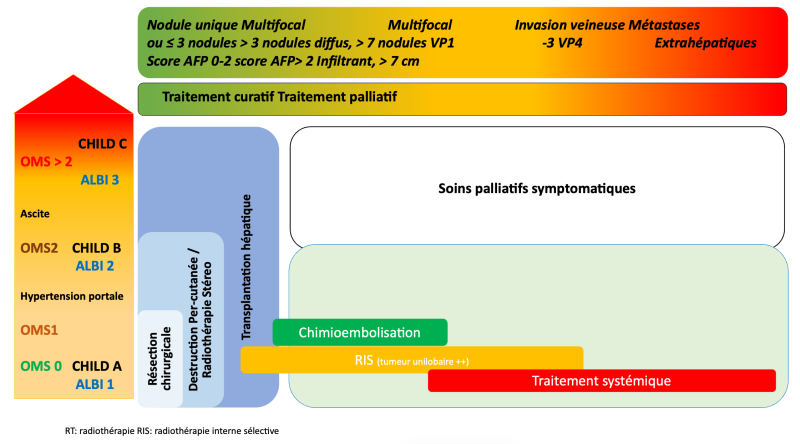
En pratique, en RCP, la stratégie thérapeutique est orientée par le bilan d’extension et le score de CHILD.
Trois situations sont schématiquement possibles :
- CHC sans extension vasculaire ou extra-hépatique avec un score AFP< 2 et/ou entrant dans les classiques critères de Milan (« petits CHC ») : un traitement curatif doit être envisagé de principe. Le choix du traitement est influencé par le score de CHILD.
- En cas d’extension vasculaire macroscopique segmentaire ou tronculaire et/ou d’extension extra-hépatique un traitement palliatif doit être envisagé et discuté selon le score de CHILD et le statut de performance OMS. Cependant, compte-tenu des traitements disponibles (SIRT en cas d’invasion vasculaire, immunothérapie) associés à des taux de réponse supérieurs à 30%, un down-staging vers une situation curative peut être obtenu et les dossiers doivent dans ce cas être re-discutés en RCP.
- Dans certains cas, chez les malades Child-Pugh A, l’option curative ou palliative peut ne pas être évidente et justifier la discussion du dossier en RCP de recours afin de bénéficier, en particulier, de l’expertise d’équipes de transplantation, et de radiologie interventionnelle (niveau de recommandation : accord d’experts). Il s’agit par exemple des patients avec nodule unique volumineux relevant éventuellement d’une résection ou d’un traitement endovasculaire, ou de malades avec CHC multifocal au-delà des critères de transplantation mais pouvant bénéficier d’une stratégie de down-staging.
7.3.3.1.1. CHC accessible à un traitement curatif
Il s’agit des CHC qui sont potentiellement éligibles à une transplantation hépatique (d’emblée ou après down-staging efficace), définis par un score AFP ≤ 2 et incluant le groupe des CHC entrant dans les critères de Milan.
7.3.3.1.1.1. Cirrhose Child-Pugh A
Recherche de contre-indication à la transplantation hépatique (TH) : âge > 70 ans, métastase extra-hépatique y compris ganglionnaire, comorbidités contre-indiquant la transplantation, infection VIH non contrôlée, obstruction portale néoplasique, refus ou non compliance du patient.
7.3.3.1.1.1.1. En l'absence de contre-indication à la TH :
REFERENCES
- Référer à un centre de transplantation (niveau de recommandation : grade B).
- Discussion d’un traitement local ou loco-régional dit d’attente (résection hépatique, destruction per-cutanée, chimioembolisation, radiothérapie interne sélective)). Selon les équipes, trois OPTIONS peuvent être discutées :
a) mise sur liste sans traitement d’attente si le délai d’attente prévisible est court
b) traitement local et inscription sur liste d’attente
c) traitement local à visée curative (destruction per-cutanée ou résection), puis transplantation « de sauvetage » discutée en cas de récidive, option à privilégier en cas de CHC inférieur à 2-3 cm de diamètre. La stratégie thérapeutique doit être d’emblée discutée avec le centre de transplantation (niveau de recommandation : grade C).
7.3.3.1.1.1.2. En présence de contre-indication à la TH :
REFERENCES
- Discussion entre résection et destruction per-cutanée (niveau de recommandation : grade B).
- En cas de contre-indication à la résection ou à une destruction per-cutanée, discussion de radiothérapie stéréotaxique dans un centre régional de référence (niveau de recommandation : grade B) ou de chimioembolisation hypersélective (avis d’experts) ou de radiothérapie interne sélective (niveau de recommandation : grade C).

(aucun critère n’est en lui-même décisif)
Traitement néo-adjuvant ou adjuvant après résection ou radiofréquence :
REFERENCES
- Pas de traitement néo-adjuvant hors essai clinique (niveau de recommandation : grade A).
- Pas de traitement adjuvant recommandé à ce jour (niveau de recommandation : grade A).
- Prise en charge de l’hépatopathie chronique : arrêt de l’alcool, contrôle du VHB, éradication du VHC en cas de traitement curatif (discutable en cas de traitement palliatif du CHC)…
- Prise en charge des comorbidités : alcool, surpoids, diabète…
- En cas de cirrhose, recherche d’une hypertension portale cliniquement significative et mise en place si nécessaire d’un traitement par carvedilol.
ESSAIS CLINIQUES
- AB-LATE 02 : Atézolizumab neoadjuvant et atézolizumab + bévacizumab en adjuvant après ablation percutanée par radiofréquence de CHC : essai de phase II randomisé multicentrique. Coordonnateurs : Boris Guiu/Eric Assenat (Montpellier)
- La liste des essais de traitement adjuvant est disponible sur le site de l’INCa :
https://www.e-cancer.fr/Professionnels-de-sante/Le-registre-des-essais-cliniques/Le-registre-des-essais-cliniques
7.3.3.1.1.2. Cirrhose Child-Pugh B et C
REFERENCES
- Transplantation hépatique (TH) pour cirrhose grave, à discuter avec un centre de référence (niveau de recommandation : grade C).
- Si contre-indication à la TH : destruction per-cutanée pour les malades avec un score ≤ 7 de Child-Pugh ≤ B7 en l’absence d’ascite importante (niveau de recommandation : grade C).
- Lorsqu’un traitement étiologique est possible (sevrage alcoolique, éradication virale C, contrôle de la réplication virale B…), la cirrhose peut s’améliorer et la discussion thérapeutique vis-à-vis du CHC peut être réévaluée.
7.3.3.1.2. CHC non accessible à un traitement curatif
7.3.3.1.2.1. Cirrhose Child-Pugh A
7.3.3.1.2.1.1 CHC sans extension extra-hépatique ni envahissement portal tronculaire (VP4) avec fonction hépatique préservée, OMS 0-2
REFERENCE
- Traitement endovasculaire : chimio-embolisation artérielle ou radiothérapie interne sélective (SIRT) (niveau de recommandation : grade A). Le choix entre les deux traitements peut être orienté en prenant en compte les critères indiqués dans le tableau ci-dessous (niveau de recommandation : grade B).
Critères influençant la discussion entre chimio-embolisation ou radiothérapie interne sélective | ||
| Chimio-embolisation | Radiothérapie interne sélective | |
| Invasion macrovasculaire | Non | Possible en cas d’invasion Vp1 à Vp3 ou de thrombose des veines hépatiques |
| Taille maximale des nodules | < 7 – 10 cm | Pas de taille maximale, selon étude dosimétrique et réserve hépatique |
| Distribution des nodules | Possible si bilobaire ; si approche sélective possible | Unilobaire, avec réserve hépatique > 30 % |
| Caractère infiltrant | Non | Possible |
OPTIONS
- Certaines caractéristiques tumorales (atteinte ne permettant ni CEL ni SIRT (distribution bilobaire pour la SIRT, taille tumorale >7cm pour la CEL, nombre de nodules >7…)), caractère infiltrant / hypovasculaire) limitent le bénéfice des traitements intra-artériels. Ces patients pourraient être orientés préférentiellement vers des traitements systémiques (avis d’expert) ou vers les essais cliniques dédiés. ( https://www.e-cancer.fr/Professionnels-de-sante/Le-registre-des-essais-cliniques/Le-registre-des-essais-cliniques)
- En cas d’échec de chimioembolisation/ SIRT, pour des raisons techniques (sténose du tronc coeliaque ou de l’artère hépatique, Shunts vasculaires), work up négatif (Dosimétrie, réserve hépatique, shunt pulmonaire) un traitement systémique est indiqué. (niveau de recommandation grade A)
7.3.3.1.2.1.2. CHC avec invasion vasculaire portale tronculaire (VP4) ou extra-hépatique ou en échec de la chimio-embolisation chez un patient à l’état général conservé (OMS ≤ 2) avec une fonction hépatique préservée
Traitement de première ligne
REFERENCES
- Atézolizumab (1200 mg) et bévacizumab (15 mg/kg) toutes les 3 semaines (niveau de recommandation : grade A).
- Trémélimumab 300 mg J1 - durvalumab 1500 mg toutes les 4 semaines (niveau de recommandation : grade A).
- Nivolumab (1 mg/kg) et ipilimumab (3 mg/kg) par voie intraveineuse toutes les 3 semaines quatre fois, suivi de nivolumab 480 mg toutes les 4 semaines (pas de remboursement en France dans cette indication en 2025) (niveau de recommandation : grade A).
- Si contre-indication ou sur-risque hémorragique, rénal, cardiovasculaire pressenti sous bévacizumab, privilégier l’association tremelimumab-durvalumab
Si contre-indication à l’immunothérapie
- Sorafénib : 800 mg par jour en deux prises en continu (niveau de recommandation : grade A).
- Lenvatinib : 12 mg par jour si > 60 kg et 8 mg par jour si poids < 60 kg (niveau de recommandation : grade A / en attente de remboursement). Son utilisation en cas d’intolérance (toxicité grade 3-4) non contrôlable précoce au sorafénib pourra être discutée.
OPTION
- En cas de d’atteinte hépatique prédominante et d’extension extra-hépatique non menaçante (micro-nodule pulmonaire, adénomégalies < 15 mm.) un traitement loco-régional hépatique peut être discuté (avis d’experts).
ESSAIS CLINIQUES
La liste des essais cliniques disponibles en traitement de première ligne est disponible sur le site de l’INCa :
https://www.e-cancer.fr/Professionnels-de-sante/Le-registre-des-essais-cliniques/Le-registre-des-essais-cliniques
- PRODIGE 81 - (FFCD 2101) - TRIPLET CHC : Etude évaluant l’intérêt de l’ajout de l’Ipilimumab à la combinaison Atézolizumab-Bévacizumab chez des patients atteints d’un carcinome hépatocellulaire en première ligne de traitement systémique. Coordonnateur : P Merle (Lyon)
https://ramdam.ffcd.fr/CUSTOM/GED/20230104/24498_160448.pdf - http://hector-essais-cliniques.fr/essais-clinique/2994
- TERTIO : Evaluation of the Interest to Combine a CD4 Th1-inducer Cancer Vaccine Derived From Telomerase and Atézolizumab Plus Bévacizumab in Unresectable Hepatocellular Carcinoma (Phase II). Coordonnateur : C Borg (CHU Besancon)
http://hector-essais-cliniques.fr/essais-clinique/2853
Traitement de deuxième ligne
REFERENCES
Après traitement par sorafénib :
- Régorafenib à 160mg/jour trois semaines sur 4 (niveau de recommandation : grade A) : chez des patients ayant une fonction hépatique préservée (CHILD A), un index OMS <2, progressifs (et non intolérants) sous sorafénib.
- Cabozantinib : 60 mg/jour en continu (niveau de recommandation : grade A). Le cabozantinib peut être utilisé après échec du sorafénib en deuxième ou troisième ligne et chez les patients intolérants au sorafénib.
OPTIONS
Après traitement par immunothérapie en première ligne :
- Inhibiteur de tyrosine kinases : sorafénib, lenvatinib, regorafénib, cabozantinib (avis d’experts).
- Immunothérapie selon un autre schéma que la première ligne (avis d’experts).
ESSAIS CLINIQUES
La liste des essais cliniques disponibles en traitement de seconde ligne est disponible sur le site de l’INCa :
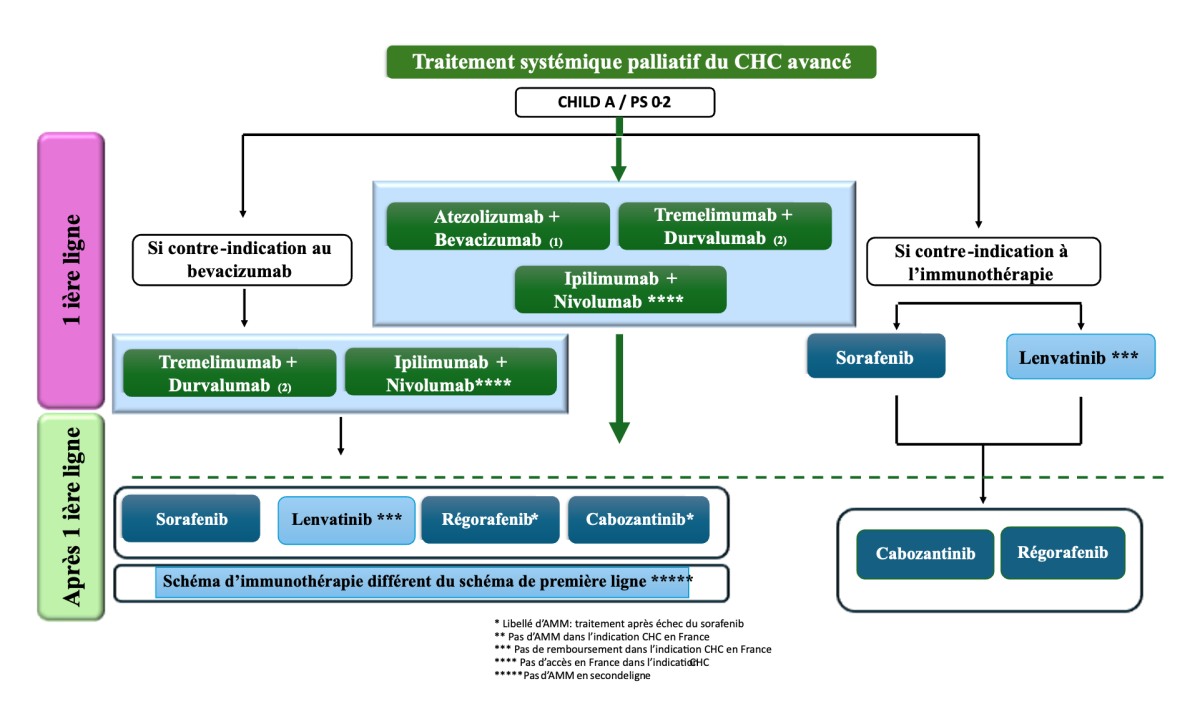
7.3.3.1.2.2. Cirrhose Child-Pugh B ou C
REFERENCE
- Traitement symptomatique (niveau de recommandation : grade C).
OPTION
- Traitement systémique (Immunothérapie ou inhibiteur de tyrosine kinase) à discuter chez les patients en bon état général (OMS 0-2) CHILD B7 ou CHILD B avec score ALBI 1-2. (niveau de recommandation : avis d’experts).
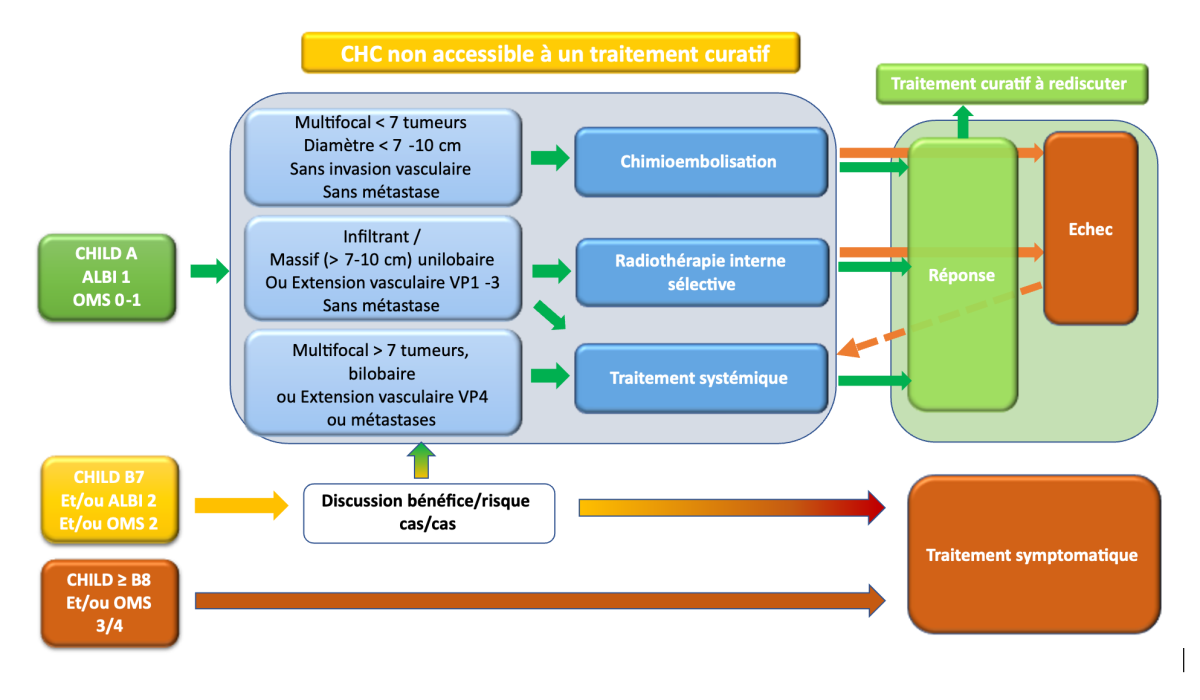
7.3.3.2. CHC sur foie non cirrhotique
REFERENCE
- Résection (niveau de recommandation : grade C) Les indications sont plus larges que lorsqu’il existe une cirrhose. L’examen histologique du foie non tumoral est donc indispensable et doit être disponible au moment de la discussion en RCP. La résection donne de bons résultats lorsqu’il n’y a pas d’envahissement portal.
OPTIONS
- Si une résection n’est pas retenue, la discussion des autres traitements se fait selon les mêmes critères que lorsqu’il existe une cirrhose (niveau de recommandation : accord d’experts).
7.4. Surveillance (niveau de recommandation : avis d'experts)
Il n’existe pas de données dans la littérature permettant de recommander une surveillance optimale, notamment en ce qui concerne sa durée ; il est probable, mais pas démontré, que le risque de cancer soit plus élevé chez les patients ayant déjà eu un CHC que chez les patients « naïfs » de tumeur.
REFERENCE
Pas de référence.
OPTIONS (avis d’experts)
- L’IRM - non irradiant - est la modalité de choix pour la surveillance post-thérapeutique du foie. Lorsque l’IRM n’est pas disponible, un scanner hépatique injecté peut être réalisé. Il n’y a pas lieu de surveiller le poumon avec la radiographie pulmonaire : le scanner thoracique est la modalité de choix.
Les critères de jugement sont les critères RECIST modifiés c’est-à-dire appliqués à la partie de la tumeur prenant le contraste à la phase artérielle (considérée comme tumeur « viable ») :
- réponse complète, si disparition des lésions cibles ;
- réponse partielle, si diminution d’au moins 30 % de la somme des diamètres des tumeurs « viables » ;
- progression, si apparition d’une nouvelle lésion « viable » ou augmentation d’au moins 20 % de la somme des diamètres des tumeurs « viables », en prenant comme référence la plus petite somme de ces diamètres depuis le début du traitement ;
- stabilisation, dans tous les autres cas (Llovet, Di Bisceglie et al. 2008, Vilgrain 2010).
Lorsque la concentration sérique d’AFP était élevée avant traitement, sa normalisation après traitement curatif est un autre argument important pour évaluer l’efficacité thérapeutique. Dans ce cas, le dosage périodique de l’AFP est également recommandé pour dépister une récidive. En cas d’hépatopathie chronique « active », la concentration basale de l’AFP sérique (qui peut être modérément élevée) doit être prise en compte dans l’interprétation des résultats.
7.4.1. Après transplantation
Les modalités seront discutées avec le centre de transplantation.
- Il convient de surveiller les patients de manière étroite durant les 2 premières années durant lesquelles le taux de récidive est le plus élevé.
- Les sites extra-hépatiques (en particulier les poumons) sont les plus fréquemment atteints lors d’une récidive.
- Les modalités de surveillance pourront être adaptées selon le risque individuel de récidive (taille et nombre de tumeurs, envahissement vasculaire, degré de différenciation tumorale, AFP).
7.4.2. Après résection
Le taux élevé de récidive sous forme essentiellement hépatique uni- ou pauci-nodulaire justifie une surveillance étroite :
- Clinique + biologie (test hépatiques et AFP) tous les 3 mois la première année puis tous les 6 mois.
- Scanner thoracique tous les 6 mois pendant 2 ans.
- Imagerie hépatique : on distingue deux périodes successives :
- Surveillance post-thérapeutique : imagerie en coupe hépatique (IRM ou à défaut TDM) du foie par un opérateur entraîné en alternance tous les 3 mois pendant 2 (à 3) ans.
- Après cette surveillance : détection de nouveaux CHC : deux options possibles :
a/ IRM (ou à défaut TDM) hépatique tous les 6 mois à vie.
b/ Echographie hépatique tous les 6 mois à vie.
7.4.3. Après destruction per-cutanée
Le suivi doit se faire idéalement dans le centre ayant pratiqué le geste par IRM (ou TDM) et échographie en fonction des habitudes des centres selon un rythme trimestriel pendant 2 à 3 ans puis semestriel. En l’absence de consensus, et compte-tenu des contraintes d’accessibilité aux équipements de radiologie, il pourra être proposé au minimum le schéma de surveillance suivant :
- Clinique + biologie (test hépatiques et AFP) tous les 3 mois la première année puis tous les 6 mois.
- Scanner thoracique tous les 6 mois pendant 2 ans.
- Imagerie hépatique : on distingue deux périodes successives :
- Surveillance post-thérapeutique : IRM (ou à défaut TDM) hépatique à M1 puis IRM (ou à défaut TDM) hépatique et échographie du foie par un opérateur entraîné en alternance tous les 3 mois pendant 2 (à 3) ans.
- Après cette surveillance : détection de nouveaux CHC : deux options possibles :
a/ IRM (ou à défaut TDM) hépatique tous les 6 mois à vie.
b/ Echographie hépatique tous les 6 mois à vie.
7.4.4. Après radiothérapie stéréotaxique ou de conformation
Une IRM est souhaitable.
- Ne doit pas être programmée trop précocement (plutôt 3 mois après la fin de l'irradiation).
- La sémiologie radiologique doit être affinée car il est souvent difficile de différencier la persistance de tissu tumoral viable avec une réaction d'hépatite post-radique péri-lésionnelle.
- La poursuite de la surveillance n’est pas standardisée mais pourrait être identique à celle préconisée après destruction percutanée (avis d’experts).
7.4.5. Après chimioembolisation (avis d'experts)
- Contrôle 4 à 6 semaines après une séance.
- Evaluation clinique et biologique (tests hépatiques et aFP).
- IRM hépatique (+ scanner sans injection en cas de chimioembolisation lipiodolée) ou TDM triphasique à défaut.
- Étant donné l’hétérogénéité des pratiques, les modalités de surveillance seront adaptées au cas par cas et en fonction du rythme des sessions.
7.4.6. Après Radiothérapie Interne Sélective (avis d’experts)
Une IRM est souhaitable.
- Ne doit pas être programmée trop précocement (plutôt 3 mois après la fin de l'irradiation).
- La sémiologie radiologique doit être affinée car il est souvent difficile de différencier la persistance de tissu tumoral viable avec une réaction d'hépatite post-radique péri-lésionnelle.
- La poursuite de la surveillance n’est pas standardisée mais pourrait être identique à celle préconisée après destruction percutanée (avis d’experts).
7.4.7. En cas de traitement systémique (avis d’experts)
- Une surveillance clinique + biologie (test hépatiques et aFP) est recommandée tous les mois.
- Imagerie tous les 2 à 3 mois par TDM thoraco-abdomino-pelvienne triphasique ou association IRM hépatique avec injection de produit de contraste et scanner thoracique.
- En cas de progression sous immunothérapie, une imagerie en coupe à 1 mois est conseillée pour confirmer la progression.
7.4.8. Dépistage d’autres cancers (absence de consensus d’experts)
Liés à l’intoxication alcoolo-tabagique éventuelle.
7.5 Bibliographie
- Abou-Alfa GK, Meyer T, Cheng AL, El-Khoueiry AB, Rimassa L, Ryoo BY, Cicin I, Merle P, Chen Y, Park JW, Blanc JF, Bolondi L, Klümpen HJ, Chan SL, Zagonel V, Pressiani T, Ryu MH, Venook AP, Hessel C, Borgman-Hagey AE, Schwab G, Kelley RK. (2018). “Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma”. N Engl J Med. 2018 Jul 5;379(1):54-63.
- Abou-Alfa GK; Lau G; Kudo M, Chan SL. Trémélimumab Plus Durvalumab in Unresectable Hepatocellular Carcinoma. NEJM Evid 2022; 1 (8). https://doi.org/10.1056/EVIDoa2100070 ; Andolino, DL., Johnson CS. Et al. (2011).” Stereotactic body radiotherapy for primary hepatocellular carcinoma.” Int J RadiatOncolBiol Phys. 15;81(4):447-53.
- Alden SL, Lim M, Kao C, Shu D, Singal AG, Noonan A, Griffith P, Baretti M, Ho WJ, Kamel I, Yarchoan M, Hsiehchen D. Salvage Ipilimumab plus Nivolumab after Anti-PD-1/PD-L1 Therapy in Advanced Hepatocellular Carcinoma. Cancer Res Commun. 2023 Jul 20;3(7):1312-1317.
- Beaufrère A, Paisley S, Ba I, Laouirem S, Priori V, Cazier H, Favre L, Cauchy F, Lesurtel M, Calderaro J, Kannengiesser C, Paradis V. Differential diagnosis of small hepatocellular nodules in cirrhosis: surrogate histological criteria of TERT promoter mutations. Histopathology. 2024 Feb;84(3):473-481. PMID: 37903649.
- Blanc JF, Khemissa F, Bronowicki JP, Monterymard C, Perarnau JM, Bourgeois V, Obled S, Abdelghani MB, Mabile-Archambeaud I, Faroux R, Seitz JF, Locher C, Senellart H, Villing AL, Audemar F, Costentin C, Deplanque G, Manfredi S, Edeline J; PRODIGE 21 collaborators. Phase 2 trial comparing sorafénib, pravastatin, their combination or supportive care in HCC with Child-Pugh B cirrhosis. Hepatol Int. 2021 Feb;15(1):93-104.
- Boige, V., J. C. Barbare and O. Rosmorduc (2008). "[Use of sorafénib (Nexavar) in the treatment of hepatocellular carcinoma: PRODIGE AFEF recommendations]." Gastroenterol Clin Biol32(1 Pt. 1): 3-7.
- Bordeau K, Michalet M, Keskes A, Debrigode C, Azria D, Riou O. [Stereotactic body radiotherapy of primary liver tumours: Indications and new techniques]. Cancer Radiother 2022;26:851–7. https://doi.org/10.1016/j.canrad.2022.06.031
- Bruix J, Takayama T, Mazzaferro V, Chau GY, Yang J, Kudo M, Cai J, Poon RT, Han KH, Tak WY, Lee HC, Song T, Roayaie S, Bolondi L, Lee KS, Makuuchi M, Souza F, Berre MA, Meinhardt G, Llovet JM; STORM investigators (2015). Adjuvant sorafénib for hepatocellular carcinoma after resection or ablation (STORM): a phase 3, randomised, double-blind, placebo-controlled trial.Lancet Oncol. Oct;16(13):1344-54..
- Bruix J, Qin S, Merle P, Granito A, Huang YH, Bodoky G, Pracht M, Yokosuka O, Rosmorduc O, Breder V, Gerolami R, Masi G, Ross PJ, Song T, Bronowicki JP, Ollivier-Hourmand I, Kudo M, Cheng AL, Llovet JM, Finn RS, LeBerre MA, Baumhauer A, Meinhardt G, Han G; RESORCE Investigators (2017). Régorafénib for patients with hepatocellular carcinoma who progressed on sorafénib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. Jan 7;389(10064):56-66
- Brusset B, Jacquemin M, Teyssier Y, Roth GS, Sturm N, Roustit M, Bône A, Ghelfi J, Costentin CE, Decaens T. Radiological diagnosis of hepatocellular carcinoma does not preclude biopsy before treatment. JHEP Rep. 2023 Nov 3;6(1):100957.
- Cadier B, Bulsei J, Nahon P, Seror O, Laurent A, Rosa I, Layese R, Costentin C, Cagnot C, Durand-Zaleski I, Chevreul K; ANRS CO12 CirVir and CHANGH groups (2017)."Early detection and curative treatment of hepatocellular carcinoma: A cost-effectiveness analysis in France and in the United States". Hepatology.
Apr;65(4):1237-1248.. - Calderaro J, Couchy G, Imbeaud S, Amaddeo G, Letouzé E, Blanc JF, Laurent C, Hajji Y, Azoulay D, Bioulac-Sage P, Nault JC, Zucman-Rossi J (2017)."Histological subtypes of hepatocellular carcinoma are related to gene mutations and molecular tumour classification".J Hepatol. Oct;67(4):727-738.
- Camma, C., V. Di Marco, A. Orlando, L. Sandonato, A. Casaril, P. Parisi, S. Alizzi, E. Sciarrino, R. Virdone, S. Pardo, D. Di Bona, A. Licata, F. Latteri, G. Cabibbo, G. Montalto, M. A. Latteri, N. Nicoli and A. Craxi (2005). "Treatment of hepatocellular carcinoma in compensated cirrhosis with radio-frequency thermal ablation (RFTA): a prospective study." J Hepatol42(4): 535-540.
- Cescon,M; Colecchia, A; Cucchetti, A; Peri, E; Montrone, L; Ercolani, Giorgio M; Festi, Davide M; Pinna, AD. Value of Transient Elastography Measured With Fibroscan in Predicting the Outcome of Hepatic Resection for Hepatocellular Carcinoma. Annals of Surgery 256(5):p 706-713, November 2012.
- Chalaye J, Costentin CE, Luciani A, Amaddeo G, Ganne-Carrié N, Baranes L, Allaire M, Calderaro J, Azoulay D, Nahon P, Seror O, Mallat A, Soussan M, Duvoux C, Itti E, Nault JC (2018). "Positron emission tomography/computed tomography with 18F-fluorocholine improve tumor staging and treatment allocation in patients with hepatocellular carcinoma". J Hepatol. Aug;69(2):336-344.
- Chan SL, Ryoo BY, Mo F, Chan LL, Cheon J, Li L, Wong KH, Yim N, Kim H, Yoo C. Multicentre phase II trial of cabozantinib in patients with hepatocellular carcinoma after immune checkpoint inhibitor treatment. J Hepatol. 2024 Aug;81(2):258-264.
- Chen, M. S., J. Q. Li, Y. Zheng, R. P. Guo, H. H. Liang, Y. Q. Zhang, X. J. Lin and W. Y. Lau (2006). "A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma." Ann Surg243(3): 321-328.
- Cheng A.L., R.S. Finn, S.Qin, K-H.Han, K.Ikeda, F.Piscaglia, A.D. Baron, J.W. Park, G.Han, J.Jassem, J.F. Blanc, A.Vogel, D.Komov, T.R.J. Evans, C. López-López, C.E. Dutcus, M. Ren, S.Kraljevic, T.Tamai, M.Kudo. (2017) Phase III trial of lenvatinib (LEN) vs sorafénib (SOR) in first-line treatment of patients (pts) with unresectable hepatocellular carcinoma (uHCC).Journal of Clinical Oncology 35,(15)_suppl 4001-4001.
- Cherqui, D., A. Laurent, N. Mocellin, C. Tayar, A. Luciani, J. T. Van Nhieu, T. Decaens, M. Hurtova, R. Memeo, A. Mallat and C. Duvoux (2009). "Liver resection for transplantable hepatocellular carcinoma: long-term survival and role of secondary liver transplantation." Ann Surg250(5): 738-746.
- Cho, Y. K., J. K. Kim, M. Y. Kim, H. Rhim and J. K. Han (2009). "Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies." Hepatology49(2): 453-459.
- Chotipanich C, Kunawudhi A, Promteangtrong C, Tungsuppawattanakit P, Sricharunrat T, Wongsa P (2016). "Diagnosis of Hepatocellular Carcinoma Using C11 Choline PET/CT: Comparison with F18 FDG, ContrastEnhanced MRI and MDCT." Asian Pac J Cancer Prev;17(7):3569-73.
- Chow PKH, Gandhi M, Tan SB, Khin MW, Khasbazar A, Ong J, Choo SP, Cheow PC, Chotipanich C, Lim K, Lesmana LA, Manuaba TW, Yoong BK, Raj A, Law CS, Cua IHY, Lobo RR, Teh CSC, Kim YH, Jong YW, Han HS, Bae SH, Yoon HK, Lee RC, Hung CF, Peng CY, Liang PC, Bartlett A, Kok KYY, Thng CH, Low AS, Goh ASW, Tay KH, Lo RHG, Goh BKP, Ng DCE, Lekurwale G, Liew WM, Gebski V, Mak KSW, Soo KC; Asia-Pacific Hepatocellular Carcinoma Trials Group. (2018) SIRveNIB: Selective Internal Radiation Therapy Versus Sorafénib in Asia-Pacific Patients With Hepatocellular Carcinoma."J Clin Oncol". 36(19):1913-1921.
- Clavien, P. A., M. Lesurtel, P. M. Bossuyt, G. J. Gores, B. Langer and A. Perrier (2012). "Recommendations for liver transplantation for hepatocellular carcinoma: an international consensus conference report." Lancet Oncol13(1): e11-22.
- Colli, A., M. Fraquelli, G. Casazza, S. Massironi, A. Colucci, D. Conte and P. Duca (2006). "Accuracy of ultrasonography, spiral CT, magnetic resonance, and alpha-fetoprotein in diagnosing hepatocellular carcinoma: a systematic review." Am J Gastroenterol101(3): 513-523.
- Costentin CE, Layese R, Bourcier V, Cagnot C, Marcellin P, Guyader D, Pol S, Larrey D, De Lédinghen V, Ouzan D, Zoulim F, Roulot D, Tran A, Bronowicki JP, Zarski JP, Riachi G, Calès P, Péron JM, Alric L, Bourlière M, Mathurin P, Blanc JF, Abergel A, Serfaty L, Mallat A, Grangé JD, Attali P, Bacq Y, Wartelle C, Dao T, Thabut D, Pilette C, Silvain C, Christidis C, Nguyen-Khac E, Bernard-Chabert B, Zucman D, Di Martino V, Sutton A, Letouzé E, Imbeaud S, Zucman-Rossi J, Audureau E, Roudot-Thoraval F, Nahon P; ANRS CO12 CirVir Group (2018). "Compliance With Hepatocellular Carcinoma Surveillance Guidelines Associated With Increased Lead-Time Adjusted Survival of Patients With Compensated Viral Cirrhosis: A Multi-Center Cohort Study". Gastroenterology. 2018 Aug;155(2):431-442.
- Costentin CE, Decaens T, Laurent A, Nault JC, Paule B, Letoublon C, Luciani A, Calderaro J, Adam R, Bricault I, Amaddeo G, Cherqui D, Mallat A, Samuel D, Duvoux C, Ganne-Carrié N, Roudot-Thoraval F, Vibert E (2017) . Sorafénib vs surgical resection for hepatocellular carcinoma with macrovascular invasion: A propensity score analysis. Liver Int. 2017 Jun 13
- Dawson LA, Winter KA, Knox J, Zhu A, Krishnan S et al. NRG/RTOG 1112: Randomized phase III study of sorafénib vs. stereotactic body radiation therapy (SBRT) followed by sorafénib in hepatocellular carcinoma (HCC). Journal of Clinical Oncology 41, no. 4_suppl (February 01, 2023) 489-489.
- Delis, S. G., A. Bakoyiannis, N. Tassopoulos, K. Athanassiou, D. Kelekis, J. Madariaga and C. Dervenis (2010). "Hepatic resection for hepatocellular carcinoma exceeding Milan criteria." Surg Oncol19(4): 200-207.
- Dharancy, S., J. Boitard, T. Decaens, G. Sergent, E. Boleslawski, C. Duvoux, C. Vanlemmens, C. Meyer, J. Gugenheim, F. Durand, O. Boillot, N. Declerck, A. Louvet, V. Canva, O. Romano, O. Ernst, P. Mathurin and F. R. Pruvot (2007). "Comparison of two techniques of transarterial chemoembolization before liver transplantation for hepatocellular carcinoma: a case-control study." Liver Transpl13(5): 665-671.
- Dhondt E, Lambert B, Hermie L, Huyck L, Vanlangenhove P, Geerts A, Verhelst X, Aerts M, Vanlander A, Berrevoet F, Troisi RI, Van Vlierberghe H, Defreyne L. 90Y Radioembolization versus Drug-eluting Bead Chemoembolization for Unresectable Hepatocellular Carcinoma: Results from the TRACE Phase II Randomized Controlled Trial. Radiology. 2022 Jun;303(3):699-710.
- Di Tommaso L, Destro A, Seok JY, Balladore E, Terracciano L, Sangiovanni A, et al. The application of markers (HSP70 GPC3 and GS) in liver biopsies is useful for detection of hepatocellular carcinoma. J Hepatol. 2009 Apr;50(4):746–54)
- Dong J, Qing S, Ping H, Fan L, Bing Li, Hong Z, Xiaoxia N, Zhongbin L, Shaojie X, Guofeng C The frequency and determinants of liver stiffness measurement failure: a retrospective study of "real-life" 38,464 examinations. PLoS One. 2014 Aug 14;9(8):e105183.
- Duffy AG, Ulahannan SV, Makorova-Rusher O, Rahma O, Wedemeyer H, Pratt D, Davis JL, Hughes MS, Heller T, ElGindi M, Uppala A, Korangy F, Kleiner DE, Figg WD, Venzon D, Steinberg SM, Venkatesan AM, Krishnasamy V, Abi-Jaoudeh N, Levy E, Wood BJ, Greten TF (2017). Trémélimumab in combination with ablation in patients with advanced hepatocellular carcinoma. J Hepatol. 2017 Mar;66(3):545-551.
- Duvoux C, Roudot-Thoraval F, Decaens T, Pessione F, Badran H, Piardi T, Francoz C, Compagnon P, Vanlemmens C, Dumortier J, Dharancy S, Gugenheim J, Bernard PH, Adam R, Radenne S, Muscari F, Conti F, Hardwigsen J, Pageaux GP, Chazouillères O, Salame E, Hilleret MN, Lebray P, Abergel A, Debette-Gratien M, Kluger MD, Mallat A, Azoulay D, Cherqui D; Liver Transplantation French Study Group (2012). Liver transplantation for hepatocellular carcinoma: a model including α-fetoprotein improves the performance of Milan criteria. Gastroenterology. Oct;143(4):986-94.
- EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. European Association for the Study of the Liver. J Hepatol. 2018 Jul;69(1):182-23
- Edeline J, Crouzet L, Campillo-Gimenez B, Rolland Y, Pracht M, Guillygomarc'h A, Boudjema K, Lenoir L, Adhoute X, Rohou T, Boucher E, Clément B, Blanc JF, Garin E. (2016). " Selective internal radiation therapy compared with sorafénib for hepatocellular carcinoma with portal vein thrombosis". Eur J Nucl Med Mol Imaging. Apr;43(4):635-43
- El-Khoueiry AB, Sangro B, Yau T, Crocenzi TS, Kudo M, Hsu C, Kim TY, Choo SP, Trojan J, Welling T Rd, Meyer T, Kang YK, Yeo W, Chopra A, Anderson J, Dela Cruz C, Lang L, Neely J, Tang H, Dastani HB, Melero I (2017). Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet. Jun 24;389(10088):2492-250
- Fang, Y., W. Chen, X. Liang, D. Li, H. Lou, R. Chen, K. Wang and H. Pan (2014). "Comparison of long-term effectiveness and complications of radiofrequency ablation with hepatectomy for small hepatocellular carcinoma." J Gastroenterol Hepatol29(1): 193-200.
- Feng B, Shukui Q, Shanzhi G, Yuxian B, Zhendong C, Zishu W et al, Donafenib versus sorafénib as first-line therapy in advanced hepatocellular carcinoma: An open-label, randomized, multicenter phase II/III trial. Journal of Clinical Oncology 38, no. 15_suppl (May 20, 2020) 4506-4506.
- Feng, K., J. Yan, X. Li, F. Xia, K. Ma, S. Wang, P. Bie and J. Dong (2012). "A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma." J Hepatol57(4): 794-802.
- Féray C, Campion L, Mathurin P, Archambreaud I, Mirabel X, Bronowicki JP, Rio E, Perret C, Mineur L, Oberti F, Touchefeu Y, Gournay J, Regnault H, Edeline J, Rode A, Hillion P, Blanc JF, Khac EN, Azoulay D, Luciani A, Preglisasco AG, Faurel-Paul E, Auble H, Mornex F, Merle P. TACE and conformal radiotherapy vs. TACE alone for hepatocellular carcinoma: A randomised controlled trial. JHEP Rep. 2023 Jan 29;5(4):10068
- Finn RS, Qin S, Ikeda M, et al. Atézolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med 2020;382(20):1894—90
- Finn RS, Qin S, Ikeda M, Galle P, Ducreux M et al. Mbrave150: Updated overall survival (OS) data from a global, randomized, open-label phase III study of atézolizumab (atezo) + bevacizumab (bev) versus sorafénib (sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC). Journal of Clinical Oncology 39, no. 3_suppl (January 20, 2021) 267-267.
- Finn RS, Ryoo BY, 2, Merle P, Kudo M, Bouattour M et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. J Clin Oncol. 2020 Jan 20;38(3):193-202
- Finn RS, Kudo M,. Merle P, Meyer T, Qin S, Ikeda M,et al. Primary results from the phase III LEAP-002 study: Lenvatinib plus pembrolizumab versus lenvatinib as first-line (1L) therapy for advanced hepatocellular carcinoma (aHCC). Annals of Oncology (2022) 33 (suppl_7): S808-S869.
- Forner, A., R. Vilana, C. Ayuso, L. Bianchi, M. Sole, J. R. Ayuso, L. Boix, M. Sala, M. Varela, J. M. Llovet, C. Bru and J. Bruix (2008). "Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma." Hepatology47(1): 97-104.
- Fotiadis N, De Paepe KN, Bonne L, Khan N, Riddell A, Turner N, Starling N, Gerlinger M, Rao S, Chau I, Cunningham D, Koh DM. Comparison of a coaxial versus non-coaxial liver biopsy technique in an oncological setting: diagnostic yield, complications and seeding risk Eur Radiol. 2020 Dec;30(12):6702-6708
- Fowler KJ, Potretzke TA, Hope TA, Costa EA, Wilson SR. LI-RADS M (LR-M): definite or probable malignancy, not specific for hepatocellular carcinoma. Abdom Radiol (NY). 2 018 ;4 3 (1) :14 9 – 5 7.
- Fowler KJ, Tang AN, Santillan C, Bhargavan-Chatfield M, Heiken J, Jha RC, et al. Interreader reliability of LI-RADS ver-sion 2014 algorithm and imaging features for diagnosis of he-patocellular carcinoma: a large international multireader study. Radiology. 2018;286(1):173– 85.
- Fuks D, Cauchy F, Fusco G, Paradis V, Durand F, Belghiti J.(2014). "Preoperative tumour biopsy does not affect the oncologic course of patients with transplantable HCC". J Hepatol. Sep;61(3):589-93.
- Gabr A, Riaz A, Johnson GE, Kim E, Padia S, Lewandowski R, Salem R. Correlation of Y90-absorbed radiation dose to pathological necrosis in hepatocellular carcinoma: confirmatory multicenter analysis in 45 explants. Eur J Nucl Med Mol Imaging . 2021 Feb;48(2):580-583.
- Garin E, Guiu B, Edeline J, Rolland Y, Palard X. Trans-arterial Radioembolization Dosimetry in 2022. Cardiovasc Intervent Radiol. 2022 Nov;45(11):1608-1621.
- Garin E, Tselikas L, Guiu B, Chalaye J, Edeline J, De Baere T et al. DOSISPHERE-01 Study Group. Personalised versus standard dosimetry approach of selective internal radiation therapy in patients with locally advanced hepatocellular carcinoma (DOSISPHERE-01): a randomised, multicentre, open-label phase 2 trial. Lancet Gastroenterol Hepatol . 2021 Jan;6(1):17-29.
- Garin E, Tselikas L, Guiu B, Chalaye J, Rolland Y, de Baere T, Assenat E, Tacher V, Palard X, Déandreis D, Mariano-Goulart D, Amaddeo G, Boudjema K, Hollebecque A, Meerun MA, Regnault H, Vibert E, Campillo-Gimenez B, Edeline J. Long-Term Overall Survival After Selective Internal Radiation Therapy for Locally Advanced Hepatocellular Carcinomas: Updated Analysis of DOSISPHERE-01 Trial. J Nucl Med. 2024 Feb 1;65(2):264-269.
- Grgurevic I, Bokun T, Salkic MN, Brkljacic B, Vukelić-Markovic M, et al. Liver elastography malignancy prediction score for noninvasive characterization of focal liver lesions. Liver Int . 2018 Jun;38(6):1055-1063
- Guiu B, Deschamps F, Aho S, Munck F, Dromain C, Boige V, Malka D, Leboulleux S, Ducreux M, Schlumberger M, Baudin E, de Baere T (2012). Liver/biliary injuries following chemoembolisation of endocrine tumours and hepatocellular carcinoma: lipiodol vs. drug-eluting beads. J Hepatol. Mar;56(3):609-17
- Hermann AL, Dieudonné A, Ronot M, Sanchez M, Pereira H, Chatellier G, Garin E, Castera L, Lebtahi R, Vilgrain V; SARAH Trial Group. Relationship of Tumor Radiation-absorbed Dose to Survival and Response in Hepatocellular Carcinoma Treated with Transarterial Radioembolization with (90)Y in the SARAH Study. Radiology. 2020 Sep;296(3):673-684
- Hilgard, P., M. Hamami, A. E. Fouly, A. Scherag, S. Muller, J. Ertle, T. Heusner, V. R. Cicinnati, A. Paul, A. Bockisch, G. Gerken and G. Antoch (2010). "Radioembolization with yttrium-90 glass microspheres in hepatocellular carcinoma: European experience on safety and long-term survival." Hepatology52(5): 1741-1749.
- Hocquelet A, Aubé C, Rode A, Cartier V, Sutter O, Manichon AF, Boursier J, N'kontchou G, Merle P, Blanc JF, Trillaud H, Seror O (2017). Comparison of no-touch multi-bipolar vs. monopolar radiofrequency ablation for small HCC. J Hepatol. 2017 Jan;66(1):67-74
- Hocquelet A, Seror O, Blanc JF, Frulio N, Salut C, Nault JC, Trillaud H (2017)."Transarterial chemoembolization for early stage hepatocellular carcinoma decrease local tumor control and overall survival compared to radiofrequency ablation". Oncotarget. 2017 May8(19):32190-3220
- Hong G, Suh KS, Suh SW, Yoo T, Kim H, Park MS, Choi Y, Paeng JC, Yi NJ, Lee KW(2016). "Alpha-fetoprotein and (18)F-FDG positron emission tomography predict tumor recurrence better than Milan criteria in living donor liver transplantation." J Hepatol. ;64(4):852-9.
- Hu S, Xie Y, Yang T, Yang Y, Zou Q, Jiao J, Zhang Y Tumor metabolism derived from 18F-FDG PET/CT in predicting the macrotrabecular-massive subtype of hepatocellular carcinoma.
.Quant Imaging Med Surg. 2023 Jan 1;13(1):309-319 - Huang, B., L. Wu, X. Y. Lu, F. Xu, C. F. Liu, W. F. Shen, N. Y. Jia, H. Y. Cheng, Y. F. Yang and F. Shen (2016). "Small Intrahepatic Cholangiocarcinoma and Hepatocellular Carcinoma in Cirrhotic Livers May Share Similar Enhancement Patterns at Multiphase Dynamic MR Imaging." Radiology281(1): 150-157.
- Huang TH, Lin MT ,Wang J, Chang K, Yen YH, et al. Clinical and novel application of FibroScan, FIB-4 and aspartate aminotransferase-to-platelet ratio index in liver fibrosis evaluation in patients with hepatocellular carcinoma and their roles in oesophageal variceal prediction. Int J Clin Pract. 2021 Apr;75(4):e13945
- Huang, J., L. Yan, Z. Cheng, H. Wu, L. Du, J. Wang, Y. Xu and Y. Zeng (2010). "A randomized trial comparing radiofrequency ablation and surgical resection for HCC conforming to the Milan criteria." Ann Surg252(6): 903-912.
- Johnson, P. J., S. Qin, J. W. Park, R. T. Poon, J. L. Raoul, P. A. Philip, C. H. Hsu, T. H. Hu, J. Heo, J. Xu, L. Lu, Y. Chao, E. Boucher, K. H. Han, S. W. Paik, J. Robles-Avina, M. Kudo, L. Yan, A. Sobhonslidsuk, D. Komov, T. Decaens, W. Y. Tak, L. B. Jeng, D. Liu, R. Ezzeddine, I. Walters and A. L. Cheng (2013). "Brivanib Versus Sorafénib As First-Line Therapy in Patients With Unresectable, Advanced Hepatocellular Carcinoma: Results From the Randomized Phase III BRISK-FL Study." J Clin Oncol31(28): 3517-3524.
- Johnson PJ, Berhane S, Kagebayashi C, Satomura S, Teng M, Reeves HL, O'Beirne J, Fox R, Skowronska A, Palmer D, Yeo W, Mo F, Lai P, Iñarrairaegui M, Chan SL, Sangro B, Miksad R, Tada T, Kumada T, Toyoda H. Assessment of liver function in patients with hepatocellular carcinoma: a new evidence-based approach-the ALBI grade. J Clin Oncol. 2015 Feb 20;33(6):550-8
- Kelley RK, Rimassa L, Cheng AL, Kaseb A, Qin S, Zhu AX et al. Cabozantinib plus atézolizumab versus sorafénib for advanced hepatocellular carcinoma (COSMIC-312): a multicentre, open-label, randomised, phase 3 trial. Lancet 2022 (23) 995-1008
- Kim, G. A., J. H. Shim, M. J. Kim, S. Y. Kim, H. J. Won, Y. M. Shin, P. N. Kim, K. H. Kim, S. G. Lee and H. C. Lee (2016). "Radiofrequency ablation as an alternative to hepatic resection for single small hepatocellular carcinomas." Br J Surg103(1): 126-135.
- Kim TH, Koh YH, Kim BH, Kim MJ, Lee JH, Park B, Park JW. Proton beam radiotherapy vs. radiofrequency ablation for recurrent hepatocellular carcinoma: A randomized phase III trial. J Hepatol. 2021 Mar;74(3):603-612
- Kim E, Sher A, Abboud G, Schwartz M, Facciuto M, Tabrizian P,et al. Radiation segmentectomy for curative intent of unresectable very early to early stage hepatocellular carcinoma (RASER): a single-centre, single-arm study. Lancet Gastroenterol Hepatol. 2022 Sep;7(9):843-850. doi: 10.1016/S2468-1253(22)00091-7. Epub 2022 May 23. PMID: 35617978.
- Hyung-Don Kim, Sun Jin Sym, Hong Jae Chon, Moonho Kim, Jung Hun Kang, Baek-Yeol Ryoo, Choong-kun Lee, Joohyun Hong, Hyewon Ryu, Woo Kyun Bae, Hyeyeong Kim, Hyunho Kim, Jin Won Kim, Tae-Yong Kim, Changhoon Yoo, Multicenter phase II trial of lenvatinib in patients with advanced hepatocellular carcinoma after progression on first-line atezolizumab plus bevacizumab,Journal of Hepatology,Sep 2025,
- Kudo M, Finn RS, Qin S, Han KH, Ikeda K, Piscaglia F, Baron A, Park JW, Han G, Jassem J, Blanc JF, Vogel A, Komov D, Evans TRJ, Lopez C, Dutcus C, Guo M, Saito K, Kraljevic S, Tamai T, Ren M, Cheng AL.(2018) " Lenvatinib versus sorafénib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial". Lancet. Mar 24;391(10126):1163-117
- Kudo M, Han G, Finn RS, Poon RT, Blanc JF, Yan L, Yang J, Lu L, Tak WY, Yu X, Lee JH, Lin SM, Wu C, Tanwandee T, Shao G, Walters IB, Dela Cruz C, Poulart V, Wang JH (2014). Brivanib as adjuvant therapy to transarterial chemoembolization in patients with hepatocellular carcinoma: A randomized phase III trialHepatology. Nov;60(5):1697-707
- Kudo M, Ren Z, Guo Y, Han G, Lin H, Zheng J, Ogasawara S, Kim JH, Zhao H, Li C, Madoff DC, Ghobrial RM, Kawaoka T, Gerolami R, Ikeda M, Kumada H, El-Khoueiry AB, Vogel A, Peng X, Mody K, Dutcus C, Dubrovsky L, Siegel AB, Finn RS, Llovet JM; LEAP-012 investigators. Transarterial chemoembolisation combined with lenvatinib plus pembrolizumab versus dual
placebo for unresectable, non-metastatic hepatocellular carcinoma (LEAP-012): a multicentre, randomised, double-blind, phase 3 study. Lancet. 2025 Jan 18;405(10474):203-215. - Lammer, J., K. Malagari, T. Vogl, F. Pilleul, A. Denys, A. Watkinson, M. Pitton, G. Sergent, T. Pfammatter, S. Terraz, Y. Benhamou, Y. Avajon, T. Gruenberger, M. Pomoni, H. Langenberger, M. Schuchmann, J. Dumortier, C. Mueller, P. Chevallier and R. Lencioni (2010). "Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: results of the PRECISION V study." Cardiovasc Intervent Radiol33(1): 41-52.
- Lee YJ, Lee JM, Lee JS, Lee HY, Park BH, Kim YH, Han JK, Choi BI (2015). "Hepatocellular carcinoma: diagnostic performance of multidetector CT and MR imaging-a systematic review and meta-analysis". Radiology. Apr;275(1):97-109.
- Lencioni R, Llovet JM, Han G, Tak WY, Yang J, Guglielmi A, Paik SW, Reig M, Kim DY, Chau GY, Luca A, Del Arbol LR, Leberre MA, Niu W, Nicholson K, Meinhardt G, Bruix J (2016). Sorafénib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC: The SPACE trial. J Hepatol. May;64(5):1090-1098
- Li Q, Qin S, Gu S, Chen X, Lin L, Wang Z et al. Apatinib as second-line therapy in Chinese patients with advanced hepatocellular carcinoma: A randomized, placebo-controlled, double-blind, phase III study. Journal of Clinical Oncology 38, no. 15_suppl (May 20, 2020) 4507-4507.
- Lim C, Salloum C, Chalaye J, Lahat E, Costentin CE, Osseis M, Itti E, Feray C, Azoulay D.
18F-FDG PET/CT predicts microvascular invasion and early recurrence after liver resection for hepatocellular carcinoma: A prospective observational study. HPB (Oxford). 2019 Jun;21(6):739-747 - Lim, K. C., P. K. Chow, J. C. Allen, F. J. Siddiqui, E. S. Chan and S. B. Tan (2012). "Systematic review of outcomes of liver resection for early hepatocellular carcinoma within the Milan criteria." Br J Surg99(12): 1622-1629.
- Liu, H., Z. G. Wang, S. Y. Fu, A. J. Li, Z. Y. Pan, W. P. Zhou, W. Y. Lau and M. C. Wu (2016). "Randomized clinical trial of chemoembolization plus radiofrequency ablation versus partial hepatectomy for hepatocellular carcinoma within the Milan criteria." Br J Surg103(4): 348-356.
- Liu, P. H., C. Y. Hsu, C. Y. Hsia, Y. H. Lee, Y. H. Huang, Y. Y. Chiou, H. C. Lin and T. I. Huo (2016). "Surgical Resection Versus Radiofrequency Ablation for Single Hepatocellular Carcinoma </= 2 cm in a Propensity Score Model." Ann Surg263(3): 538-545.
- Llovet, J. M. and J. Bruix (2003). "Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival." Hepatology37(2): 429-442.
- Llovet, J. M., A. M. Di Bisceglie, J. Bruix, B. S. Kramer, R. Lencioni, A. X. Zhu, M. Sherman, M. Schwartz, M. Lotze, J. Talwalkar and G. J. Gores (2008). "Design and endpoints of clinical trials in hepatocellular carcinoma." J Natl Cancer Inst100(10): 698-711.
- Llovet, J. M., S. Ricci, V. Mazzaferro, P. Hilgard, E. Gane, J. F. Blanc, A. C. de Oliveira, A. Santoro, J. L. Raoul, A. Forner, M. Schwartz, C. Porta, S. Zeuzem, L. Bolondi, T. F. Greten, P. R. Galle, J. F. Seitz, I. Borbath, D. Haussinger, T. Giannaris, M. Shan, M. Moscovici, D. Voliotis and J. Bruix (2008). "Sorafénib in advanced hepatocellular carcinoma." N Engl J Med359(4): 378-390.
- Lopci, E., G. Torzilli, D. Poretti, L. J. de Neto, M. Donadon, L. Rimassa, E. Lanza, J. G. Sabongi, R. Ceriani, N. Personeni, A. Palmisano, V. Pedicini, T. Comito, M. Scorsetti and A. Chiti (2015). "Diagnostic accuracy of (1)(1)C-choline PET/CT in comparison with CT and/or MRI in patients with hepatocellular carcinoma." Eur J Nucl Med Mol Imaging42(9): 1399-1407.
- Lü, M., M. Kuang, L. Liang, X. Xie, B. Peng, G. Liu, D. Li, J. Lai and S. Li (2006). "[Surgical resection versus percutaneous thermal ablation for early-stage hepatocellular carcinoma: a randomized clinical trial]." Zhonghua Yi Xue Za Zhi86(12): 801-805.
- Marrero JA, Kulik LM, Sirlin CB, Zhu AX, Finn RS, Abecassis M, Roberts LR, Heimbach J. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology . 2018 Aug;68(2):723-750.
- Marsh TL, Parikh ND, Roberts LW, Schwartz ME , Nguyen MH, Befeler A, Page-Lester , Tayob N, Srivastava S, Ann Rinaudo JA, Singal AG, Reddy KR, Marrero JA. A Phase 3 Biomarker Validation of GALAD for the Detection of Hepatocellular Carcinoma in Cirrhosis Gastroenterology
. 2024 Sep 16: S0016-5085(24)05460-X - Mazzaferro V, Citterio D, Bhoori S, Bongini M, Miceli R, De Carlis L, Colledan M, Salizzoni M, Romagnoli R, Antonelli B, Vivarelli M, Tisone G, Rossi M, Gruttadauria S, Di Sandro S, De Carlis R, Lucà MG, De Giorgio M, Mirabella S, Belli L, Fagiuoli S, Martini S, Iavarone M, Svegliati Baroni G, Angelico M, Ginanni Corradini S, Volpes R, Mariani L, Regalia E, Flores M, Droz Dit Busset M, Sposito C. Liver transplantation in hepatocellular carcinoma after tumour downstaging (XXL): a randomised, controlled, phase 2b/3 trial. Lancet Oncol. 2020 Jul;21(7):947-956.
- Mazzaferro , V., E. Regalia , R. Doci , S. Andreola , A. Pulvirenti , F. Bozzetti , F. Montalto , M. Ammatuna , A. Morabito and L. Gennari (1996). "Liver Transplantation for the Treatment of Small Hepatocellular Carcinomas in Patients with Cirrhosis." New England Journal of Medicine334(11): 693-700.
- Meerun MA, Allimant C, Rivière B, Herrero A, Panaro F, Assenat E, Cassinotto C, Mariano-Goulart D, Guiu B. Large, multifocal or portal vein-invading hepatocellular carcinoma (HCC) downstaged by Y90 using personalized dosimetry: safety, pathological results and outcomes after surgery. Hepatobiliary Surg Nutr. 2023 Jun 1;12(3):351-365.
Mendiratta-Lala, M., H. Park, N. Kolicaj, V. Mendiratta and D. Bassi (2016). "Small intrahepatic peripheral cholangiocarcinomas as mimics of hepatocellular carcinoma in multiphasic CT." Abdom Radiol (NY). - Mehta N, Bhangui P, Yao FY, Mazzaferro V, Toso C, Akamatsu N, Durand F, Ijzermans J, Polak W, Zheng S, Roberts JP, Sapisochin G, Hibi T, Kwan NM, Ghobrial M, Soin A. Liver Transplantation for Hepatocellular Carcinoma. Working Group Report from the ILTS Transplant Oncology Consensus Conference. Transplantation. 2020 Jun;104(6):1136-1142
- Mitchell DG, Bruix J, Sherman M, Sirlin CB. LI-RADS (Liver Imaging Reporting and Data System): summary, discussion, and consensus of the LI-RADS Management Working Group and future directions. Hepatology. 2015;61(3):1056–65
- Monier A, Guiu B, Duran R, Aho S, Bize P, Deltenre P, Dunet V, Denys A (2017). Liver and biliary damages following transarterial chemoembolization of hepatocellular carcinoma: comparison between drug-eluting beads and lipiodol emulsion. Eur Radiol. Apr;27(4):1431-1439
- Nault JC, Martin Y, Caruso S, Hirsch TZ, Bayard Q, Calderaro J, Charpy C, Copie-Bergman C, Ziol M, Bioulac-Sage P, Couchy G, Blanc JF, Nahon P, Amaddeo G, Ganne-Carrie N, Morcrette G, Chiche L, Duvoux C, Faivre S, Laurent A, Imbeaud S, Rebouissou S, Llovet JM, Seror O, Letouzé E, Zucman-Rossi J. Clinical Impact of Genomic Diversity From Early to Advanced Hepatocellular Carcinoma. Hepatology. 2020 Jan;71(1):164-182
- Nault JC, Boubaya M, Wartski M, Dohan A, Pol S, Pop G, Soussan M et al. [18F]fluorodeoxyglucose and [18F]fluorocholine PET-CT for staging optimisation and treatment modification in hepatocellular carcinoma (PET-HCC01): a prospective multicentre study. Lancet Gastroenterol Hepatol. 2025 Apr;10(4):306-314.
- Ningarhari M, Mourad A, Delacôte C ,Ntandja Wandji LC, Lassailly G, Louvet, Dharancy S, Mathurin M, Sylvie Deuffic-Burban S. Benefits of tailored hepatocellular carcinoma screening in patients with cirrhosis on cancer-specific and overall mortality: A modeling approach Hepatol Commun 2022 Oct;6(10):2964-2974.
- Notarpaolo A, Layese R, Magistri P, Gambato M, Colledan M, Magini G, Miglioresi L, Vitale A, Vennarecci G, Ambrosio CD, Burra P, Di Benedetto F, Fagiuoli S, Colasanti M, Maria Ettorre G, Andreoli A, Cillo U, Laurent A, Katsahian S, Audureau E, Roudot-Thoraval F, Duvoux C (2017). Validation of the AFP model as a predictor of HCC recurrence in patients with viral hepatitis-related cirrhosis who had received a liver transplant for HCC. J Hepatol. Mar;66(3):552-559.
- Olthoff, K. M., A. Forner, S. Hubscher and J. Fung (2011). "What is the best staging system for hepatocellular carcinoma in the setting of liver transplantation?" Liver Transpl17 Suppl 2: S26-33.
- Park YN. Update on precursor and early lesions of hepatocellular carcinomas.Arch Pathol Lab Med. 2011 Jun;135(6):704-15.
- Peng, Z.-W., X.-J. Lin, Y.-J. Zhang, H.-H. Liang, R.-P. Guo, M. Shi and M.-S. Chen (2012). "Radiofrequency Ablation versus Hepatic Resection for the Treatment of Hepatocellular Carcinomas 2 cm or Smaller: A Retrospective Comparative Study." Radiology262(3): 1022-1033.
- Piñero F, Tisi Baña M, de Ataide EC, Hoyos Duque S, Marciano S, Varón A, Anders M, Zerega A, Menéndez J, Zapata R, Muñoz L, Padilla Machaca M, Soza A, McCormack L, Poniachik J, Podestá LG, Gadano A, Boin IS, Duvoux C, Silva M; Latin American Liver Research, Education and Awareness Network (LALREAN) (2016) Liver transplantation for hepatocellular carcinoma: evaluation of the alpha-fetoprotein model in a multicenter cohort from Latin America. Liver Int. Nov;36(11):1657-1667.
- Pompili, M., A. Saviano, N. de Matthaeis, A. Cucchetti, F. Ardito, B. Federico, F. Brunello, A. D. Pinna, A. Giorgio, S. M. Giulini, I. De Sio, G. Torzilli, F. Fornari, L. Capussotti, A. Guglielmi, F. Piscaglia, L. Aldrighetti, E. Caturelli, F. Calise, G. Nuzzo, G. L. Rapaccini and F. Giuliante (2013). "Long-term effectiveness of resection and radiofrequency ablation for single hepatocellular carcinoma </=3 cm. Results of a multicenter Italian survey." J Hepatol59(1): 89-97.
- Qin S, Kudo M ,Meyer T, Finn RS, Vogel A, Bai Y, Guo Y, Meng Z, Zhang T, et al. Final analysis of RATIONALE-301: Randomized, phase III study of tislelizumab versus sorafénib as first-line treatment for unresectable hepatocellular carcinoma. Annals of Oncology (2022) 33 (suppl_7): S808-S869.
- Qin S, Chan LS, Gu S, Bai Y, Ren Z, Lin X, Chen Z, et al. Camrelizumab (C) plus rivoceranib (R) vs. sorafénib (S) as first-line therapy for unresectable hepatocellular carcinoma (uHCC): A randomized, phase III trial. Annals of Oncology (2022) 33 (suppl_7): S808-S869.
- Qin S, Chen M, Cheng AL, Kaseb AO, Kudo M, Lee HC, et al. Atezolizumab plus bevacizumab versus active surveillance in patients with resected or ablated high-risk hepatocellular carcinoma (IMbrave050): a randomised, open-label, multicentre, phase 3 trial. The Lancet. 2023;402(10415):1835‑47.
- Qin S, Chen Z, Fang W, Ren Z, Xu R, Ryoo BY et al. Pembrolizumab Versus Placebo as Second-Line Therapy in Patients From Asia With Advanced Hepatocellular Carcinoma.A Randomized, Double-Blind, Phase III Trial. J Clin Oncol (2022) 41:1434-1443
- Regimbeau, J. M., O. Farges, B. Y. Shen, A. Sauvanet and J. Belghiti (1999). "Is surgery for large hepatocellular carcinoma justified?" J Hepatol31(6): 1062-1068.
- Reig M, Mariño Z, Perelló C, Iñarrairaegui M, Ribeiro A, Lens S, Díaz A, Vilana R, Darnell A, Varela M, Sangro B, Calleja JL, Forns X, Bruix J (2016). "Unexpected high rate of early tumor recurrence in patients with HCV-related HCC undergoing interferon-free therapy".J Hepatol. Oct;65(4):719-26
- Ricke J, Sangro B, Amthauer H, Bargellini I, Bartenstein P, De Toni E, et al (2018) "The impact of combining Selective Internal Radiation Therapy (SIRT) with Sorafénib on overall survival in patients with advanced hepatocellular carcinoma: The Soramic trial palliative cohort". J Hepatol.;68(Suppl 1):S102..
- Rimassa L, Chan SL, Sangro B, Lau G, Kudo M, Reig M, Breder V, Ryu MH, Ostapenko Y, Sukeepaisarnjaroen W, Varela M, Tougeron D, Crysler OV, Bouattour M, Van Dao T, Tam VC, Faccio A, Furuse J, Jeng LB, Kang YK, Kelley RK, Paskow MJ, Ran D, Xynos I, Kurland JF, Negro A, Abou-Alfa GK. Five-year overall survival update from the HIMALAYA study of tremelimumab plus durvalumab in unresectable HCC. J Hepatol. 2025 Apr 11 PMID: 40222621.
- Rimola, J., A. Forner, M. Reig, R. Vilana, C. R. de Lope, C. Ayuso and J. Bruix (2009). "Cholangiocarcinoma in cirrhosis: absence of contrast washout in delayed phases by magnetic resonance imaging avoids misdiagnosis of hepatocellular carcinoma." Hepatology50(3): 791-798.
- Roberts LR, Sirlin CB, Zaiem F, Almasri J, Prokop LJ, Heimbach JK, et al. Imaging for the diagnosis of hepatocellular carci-noma: a systematic review and meta-analysis. Hepatology. 2018;67(1):401– 21.
- Rosmorduc, O., C. Chevreau, P. Dielenseger, S. Ederhy, F. Goldwasser, J. D. Grange, L. Mortier, M. E. Neidhardt-Berard, C. Robert, F. Scotte and J. F. Seitz (2010). "[Use of sorafénib in patients with hepatocellular or renal carcinoma]." Gastroenterol Clin Biol34(3): 161-167.
- Salem R, Johnson GE, Kim E, Riaz A, Bishay V, Boucher E, Fowers K, Lewandowski R, Padia SA. Yttrium-90 Radioembolization for the Treatment of Solitary, Unresectable HCC: The LEGACY Study. Hepatology. 2021 Nov;74(5):2342-2352
- Salem, R., R. J. Lewandowski, L. Kulik, E. Wang, A. Riaz, R. K. Ryu, K. T. Sato, R. Gupta, P. Nikolaidis, F. H. Miller, V. Yaghmai, S. M. Ibrahim, S. Senthilnathan, T. Baker, V. L. Gates, B. Atassi, S. Newman, K. Memon, R. Chen, R. L. Vogelzang, A. A. Nemcek, S. A. Resnick, H. B.
Chrisman, J. Carr, R. A. Omary, M. Abecassis, A. B. Benson, 3rd and M. F. Mulcahy (2011). "Radioembolization results in longer time-to-progression and reduced toxicity compared with chemoembolization in patients with hepatocellular carcinoma." Gastroenterology 2016 140(2): 497-507 e492. - Salem R, Padia SA, Lam M, Bell J, Chiesa C, Fowers K, Hamilton B, Herman J, Kappadath SC, Leung T, Portelance L, Sze D, Garin E. Clinical and dosimetric considerations for Y90: recommendations from an international multidisciplinary working group. Eur J Nucl Med Mol Imaging. 2019 Jul;46(8):1695-1704
- Salem R, Gordon AC, Mouli S, Hickey R, Kallini J, Gabr A, Mulcahy MF, Baker T, Abecassis M, Miller FH, Yaghmai V, Sato K, Desai K, Thornburg B, Benson AB, Rademaker A, Ganger D, Kulik L, Lewandowski RJ. Y90 Radioembolization Significantly Prolongs Time to Progression Compared With Chemoembolization in Patients With Hepatocellular Carcinoma.
Gastroenterology. 2016 Dec;151(6):1155-1163 - Sangro B, Gomez-Martin C, de la Mata M, Iñarrairaegui M, Garralda E, Barrera P, Riezu-Boj JI, Larrea E, Alfaro C, Sarobe P, Lasarte JJ, Pérez-Gracia JL, Melero I, Prieto J (2013). A clinical trial of CTLA-4 blockade with trémélimumab in patients with hepatocellular carcinoma and chronic hepatitis C. J Hepatol. Jul;59(1):81-8
- Sangro B, Park J, Finn R, et al. CheckMate 459: Long-term (minimum follow-up 33.6 months) survival outcomes with nivolumab versus sorafénib as first-line treatment in patients with advanced hepatocellular carcinoma. ESMO World Congress on Gastrointestinal Cancer 2020 Virtual (1-4 July).
- Sangro B, Kudo M, Erinjeri JP, Qin S, Ren Z, Chan SL, Arai Y, Heo J, Mai A, Escobar J, Lopez Chuken YA, Yoon JH, Tak WY, Breder VV, Suttichaimongkol T, Bouattour M, Lin SM, Peron JM, Nguyen QT, Yan L, Chiu CF, Santos FA, Veluvolu A, Thungappa SC, Matos M, Żotkiewicz M, Udoye SI, Kurland JF, Cohen GJ, Lencioni R; EMERALD-1 Investigators. Durvalumab with or without bevacizumab with transarterial chemoembolisation in hepatocellular carcinoma (EMERALD-1): a multiregional, randomised, double-blind, placebo-controlled, phase 3 study.
Lancet. 2025 Jan 18;405(10474):216-232. - Santillan C, Chernyak V, Sirlin C. 2017. LI-RADS categories: concepts, definitions, and criteria.
Abdom Radiol (NY). 2017 Oct 16 - Serenari M, Cappelli A, Cucchetti A, Mosconi C, Strigari L, Monari F, Ravaioli M, Rizzini EL, Fanti S, Golfieri R, Cescon M. Deceased Donor Liver Transplantation After Radioembolization for Hepatocellular Carcinoma and Portal Vein Tumoral Thrombosis: A Pilot Study. Liver Transpl. 2021 Dec;27(12):1758-1766.
- Seror, O., G. N'Kontchou, M. Ibraheem, Y. Ajavon, C. Barrucand, N. Ganne, E. Coderc, J. C. Trinchet, M. Beaugrand and N. Sellier (2008). "Large (>or=5.0-cm) HCCs: multipolar RF ablation with three internally cooled bipolar electrodes--initial experience in 26 patients." Radiology248(1): 288-296.
- Sharma, B., A. Martin and I. Zerizer (2013). "Positron emission tomography-computed tomography in liver imaging." Semin Ultrasound CT MR34(1): 66-80.
- Shi, J., E. C. Lai, N. Li, W. X. Guo, J. Xue, W. Y. Lau, M. C. Wu and S. Q. Cheng (2010). "Surgical treatment of hepatocellular carcinoma with portal vein tumor thrombus." Ann Surg Oncol17(8): 2073-2080.
- Shi, M., R. P. Guo, X. J. Lin, Y. Q. Zhang, M. S. Chen, C. Q. Zhang, W. Y. Lau and J. Q. Li (2007). "Partial hepatectomy with wide versus narrow resection margin for solitary hepatocellular carcinoma: a prospective randomized trial." Ann Surg245(1): 36-43.
- Sia D, Villanueva A, Friedman SL, Llovet JM (2017) . "Liver Cancer Cell of Origin, Molecular Class, and Effects on Patient Prognosis".Gastroenterology. 2017 Mar;152(4):745-761.
- Slim, K., J. Y. Blay, A. Brouquet, D. Chatelain, M. Comy, J. R. Delpero, C. Denet, D. Elias, J. F. Flejou, P. Fourquier, D. Fuks, O. Glehen, M. Karoui, N. Kohneh-Shahri, M. Lesurtel, C. Mariette, F. Mauvais, J. Nicolet, T. Perniceni, G. Piessen, J. M. Regimbeau, P. Rouanet, A. sauvanet, G.
Scheiner B, Roessler D, Phen S, Lim M, Pomej K, Pressiani T, Cammarota A, Fründt TW, von Felden J, Schulze K, Himmelsbach V, Finkelmeier F, Deibel A, Siebenhüner AR, Shmanko K, Radu P, Schwacha-Eipper B, Ebert MP, Teufel A, Djanani A, Hucke F, Balcar L, Philipp AB, Hsiehchen D, Venerito M, Sinner F, Trauner M, D'Alessio A, Fulgenzi CAM, Pinato DJ, Peck-Radosavljevic M, Dufour JF, Weinmann A, Kremer AE, Singal AG, De Toni EN, Rimassa L, Pinter M. Efficacy and safety of immune checkpoint inhibitor rechallenge in individuals with hepatocellular carcinoma. JHEP Rep. 2022 Oct 27;5(1):100620. - Schmitt, C. Vons, P. Lasser, J. Belghiti, S. Berdah, G. Champault, L. Chiche, J. Chipponi, P. Chollet, T. De Baere, P. Dechelotte, J. M. Garcier, B. Gayet, C. Gouillat, R. Kianmanesh, C. Laurent, C. Meyer, B. Millat, S. Msika, B. Nordlinger, F. Paraf, C. Partensky, F. Peschaud, M. Pocard, B. Sastre, J. Y. Scoazec, M. Scotte, J. P. Triboulet, H. Trillaud and P. Valleur (2009). "[Digestive oncology: surgical practices]." J Chir (Paris)146 Suppl 2: S11-80.
- Song, J., Y. Wang, K. Ma, S. Zheng, P. Bie, F. Xia, X. Li, J. Li, X. Wang and J. Chen (2016). "Laparoscopic hepatectomy versus radiofrequency ablation for minimally invasive treatment of single, small hepatocellular carcinomas." Surg Endosc30(10): 4249-4257.
- Thabut, D, Kudo M.Treatment of portal hypertension in patients with HCC in the era of Baveno VII. J Hepatol 2023 Mar;78(3):658-662.
- Toskich B, Vidal LL, Olson MT, Lewis JT, LeGout JD, Sella DM, Montazeri SA, Devcic Z, Lewis AR, Frey GT, Ritchie CA, Paz-Fumagalli R, Croome KP, Patel TC. Pathologic Response of Hepatocellular Carcinoma Treated with Yttrium-90 Glass Microsphere Radiation Segmentectomy Prior to Liver Transplantation: A Validation Study. J Vasc Interv Radiol. 2021 Apr;32(4):518-526
- Trinchet, J. C., C. Chaffaut, V. Bourcier, F. Degos, J. Henrion, H. Fontaine, D. Roulot, A. Mallat, S. Hillaire, P. Cales, I. Ollivier, J. P. Vinel, P. Mathurin, J. P. Bronowicki, V. Vilgrain, G. N'Kontchou, M. Beaugrand and S. Chevret (2011). "Ultrasonographic surveillance of hepatocellular carcinoma in cirrhosis: a randomized trial comparing 3- and 6-month periodicities." Hepatology54(6): 1987-1997.
- Tzartzeva K, Obi J , Rich NE, Parikh ND , Marrero JA, Yopp A , Waljee AK, Singal AG. Surveillance Imaging and Alpha Fetoprotein for Early Detection of Hepatocellular Carcinoma in Patients With Cirrhosis: A Meta-analysis. Gastroenterology
. 2018 May;154(6):1706-1718 - Vilgrain, V. (2010). "Advancement in HCC imaging: diagnosis, staging and treatment efficacy assessments: hepatocellular carcinoma: imaging in assessing treatment efficacy." J Hepatobiliary Pancreat Sci17(4): 374-379.
- Vilgrain V, Pereira H, Assenat E, Guiu B, Ilonca AD, Pageaux GP, Sibert A, Bouattour M, Lebtahi R, Allaham W, Barraud H, Laurent V, Mathias E, Bronowicki JP, Tasu JP, Perdrisot R, Silvain C, Gerolami R, Mundler O, Seitz JF, Vidal V, Aubé C, Oberti F, Couturier O, Brenot-Rossi I, Raoul JL, Sarran A, Costentin C, Itti E, Luciani A, Adam R, Lewin M, Samuel D, Ronot M, Dinut A, Castera L, Chatellier G; SARAH Trial Group (2017). "SARAH: a randomised controlled trial comparing efficacy and safety of selective internal radiation therapy (with yttrium-90 microspheres) and sorafénib in patients with locally advanced hepatocellular carcinoma". Lancet Oncol. Dec;18(12):1624-1636
- Vullierme, M. P., V. Paradis, M. Chirica, D. Castaing, J. Belghiti, O. Soubrane, J. C. Barbare and O. Farges (2010). "Hepatocellular carcinoma--what's new?" J Visc Surg147(1): e1-12.
- Vogel A, Cervantes A, Chau I, Daniele B, Llovet JM, Meyer T, Nault JC, Neumann U, Ricke J, Sangro B, Schirmacher P, Verslype C, Zech CJ, Arnold D, Martinelli E (2019), "Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Ann Oncol. Jan 31.
- Vouche M, Habib A, Ward TJ, Kim E, Kulik L, Ganger D, Mulcahy M, Baker T, Abecassis M, Sato KT, Caicedo JC, Fryer J, Hickey R, Hohlastos E, Lewandowski RJ, Salem R. Unresectable solitary hepatocellular carcinoma not amenable to radiofrequency ablation: multicenter radiology-pathology correlation and survival of radiation segmentectomy. Hepatology. 2014 Jul;60(1):192-201
- Wang H, Liu A, Bo W, Feng X, Hu Y, Tian L, Zhang H, Tang X. (2016)"Adjuvant immunotherapy with autologous cytokine-induced killer cells for hepatocellular carcinoma patients after curative resection, a systematic review and meta-analysis”.Dig Liver Dis. Nov;48(11):1275-1282.
- Weber M, Lam M, Chiesa C, Konijnenberg M, Cremonesi M, et al. EANM procedure guideline for the treatment of liver cancer and liver metastases with intra-arterial radioactive compounds. Eur J Nucl Med Mol Imaging . 2022 Apr;49(5):1682-1699.
- Wicks JS, Dale BS, Ruffolo L, Pack LJ, Dunne R, Laryea MA, Hernandez-Alejandro R, Sharma AK. Comparable and Complimentary Modalities for Treatment of Small-Sized HCC: Surgical Resection, Radiofrequency Ablation, and Microwave Ablation. J Clin Med. 2023 Jul 29;12(15):5006
- Wong JSL, Kwok GGW, Tang V, Li BCW, Leung R, Chiu J, Ma KW, She WH, Tsang J, Lo CM, Cheung TT, Yau T. Ipilimumab and nivolumab/pembrolizumab in advanced hepatocellular carcinoma refractory to prior immune checkpoint inhibitors. J Immunother Cancer. 2021 Feb;9(2):e001945.
- Yau T, Galle PR, Decaens T, Sangro B, Qin S, da Fonseca LG, Karachiwala H, Blanc JF, Park JW, Gane E, Pinter M, Peña AM, Ikeda M, Tai D, Santoro A, Pizarro G, Chiu CF, Schenker M, He A, Chon HJ, Wojcik-Tomaszewska J, Verset G, Wang QQ, Stromko C, Neely J, Singh P, Jimenez Exposito MJ, Kudo M; CheckMate 9DW investigators. Nivolumab plus ipilimumab versus lenvatinib or sorafénib as first-line treatment for unresectable hepatocellular carcinoma (CheckMate 9DW): an open-label, randomised, phase 3 trial. Lancet. 2025 May 24;405(10492):1851-1864.
- Yau T, Park JW, Finn RS, Cheng AL, Mathurin P, Edeline J et al Nivolumab versus sorafénib in advanced hepatocellular carcinoma (CheckMate 459): a randomised, multicentre, open-label, phase 3 trial. Lancet Oncology 2022; 23:77-90
- Xi M, Yang Z, Hu L, Fu Y, Hu D, Zhou Z, Liu M, Zhao J, Shen J, Li Q, Chen B, Xu L, Fang A, Chen M, Liu S, Zhang Y. Radiofrequency Ablation Versus Stereotactic Body Radiotherapy for Recurrent Small Hepatocellular Carcinoma: A Randomized, Open-Label, Controlled Trial. J Clin Oncol. 2025 Mar 20;43(9):1073-1082. doi: 10.1200/JCO-24-01532. Epub 2024 Dec 18. PMID: 39693584.
- Zhou, Z., J. Lei, B. Li, L. Yan, W. Wang, Y. Wei and K. Cheng (2014). "Liver resection and radiofrequency ablation of very early hepatocellular carcinoma cases (single nodule <2 cm): a single-center study." European Journal of Gastroenterology & Hepatology26(3): 339-344.
- Zhu AX, Park JO, Ryoo BY, Yen CJ, Poon R, Pastorelli D, Blanc JF, Chung HC, Baron AD, Pfiffer TE, Okusaka T, Kubackova K, Trojan J, Sastre J, Chau I, Chang SC, Abada PB, Yang L, Schwartz JD, Kudo M; REACH Trial Investigators (2015).Ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafénib (REACH): a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol. Jul;16(7):859-70
- Zhu AX, Kang YK, Yen CJ, Finn RS, Galle PR, Llovet JM, Assenat E, Brandi G, Pracht M, Lim HY, Rau KM, Motomura K, Ohno I, Merle P, Daniele B, Shin DB, Gerken G, Borg C, Hiriart JB, Okusaka T, Morimoto M, Hsu Y, Abada PB, Kudo M; REACH-2 study investigators (2019); "Ramucirumab after sorafénib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial".Lancet Oncol. 2019 Feb ;20(2):282-296
- Zhu AX, Finn RS, Galle PR, Llovet JM, Blanc JF, Okusaka T, et al (2018). "Ramucirumab as second-line treatment in patients with advanced hepatocellular carcinoma (HCC) and elevated alpha-fetoprotein (AFP) following first-line sorafénib: Pooled efficacy and safety across two global randomized Phase 3 studies (REACH-2 and REACH)". Annals of Oncology.;29(suppl_5, 1 June 2018,).
- Zhu AX, Finn RS, Galle PR, Llovet JM, Blanc JF, Okusaka T, et al. (2018). "Ramucirumab as second-line treatment in patients with advanced hepatocellular carcinoma (HCC) and elevated alpha-fetoprotein (AFP) following first-line sorafénib: patient reported outcome results across two phase 3 studies (REACH-2 and REACH) ". Annals of Oncology;29(Issue suppl 8):A 1812.
- Zhu AX, Finn RS, Edeline J, Cattan S, Ogasawara S, Palmer D, Verslype C, Zagonel V, Fartoux L, Vogel A, Sarker D, Verset G, Chan SL, Knox J, Daniele B, Webber AL, Ebbinghaus SW, Ma J, Siegel AB, Cheng AL, Kudo M; KEYNOTE-224 investigators (2018). "Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafénib (KEYNOTE-224): a non-randomised, open-label phase 2 trial". Lancet Oncol. Jul;19(7):940-952.
- Ziol M, Poté N, Amaddeo G, Laurent A, Nault JC, Oberti F, Costentin C, Michalak S, Bouattour M, Francoz C, Pageaux GP, Ramos J, Decaens T, Luciani A, Guiu B, Vilgrain V, Aubé C, Derman J, Charpy C, Zucman-Rossi J, Barget N, Seror O, Ganne-Carrié N, Paradis V, Calderaro J. Macrotrabecular-massive hepatocellular carcinoma: A distinctive histological subtype with clinical relevance Hepatology. 2018 Jul;68(1):103-112.
- Zucman-Rossi J, Villanueva A, Nault JC, Llovet JM (2015). "Genetic Landscape and Biomarkers of Hepatocellular Carcinoma". Gastroenterology. Oct;149(5):1226-1239.

