24. Métastases hépatiques ou péritonéales de site primitif inconnu
(Dernière mise à jour le : )Groupe de travail et relecteurs
Groupe de travail :
Sarah Watson (Paris, Institut Curie), coordonnateur,
Frédéric Bibeau (Besançon), Ivan Bièche (Paris), Damien Botsen (Reims), Nicolas Dereval (Paris), Frédéric Di Fiore (Rouen), Manel Djelouah (Paris), Jean-Marc Gornet (Paris), Marc Pocard (Paris
Relecteurs :
Arnaud Alves (Caen), Koceila Amroun (Reims), Thomas Aparicio (Paris), Olivier Bouché (Reims), Stéphane Cattan (Lille), Véronique Dalstein (Reims), Thérèse Delebecq (Roubaix), Michel Ducreux (Villejuif), Sébastien Gaujoux (Paris), Vincent Hautefeuille (Amiens), Nicola Jacquin (Reims), Thierry Lecomte (Tours), Frédéric Marchal (Nancy), William Mina (Reims), Jean-Baptiste Pinaquy (Bordeaux), Nicolas Pirro (Marseille), Abdelkader Taibi (Limoge), Vincent Tassetti (Troyes), Laurent Villeneuve (Lyon)
Comment citer ce chapitre ?
Watson S, Bibeau F, Bièche I, Botsen D, Dereval N, Di Fiore F, Djelouah M, Gornet JM, Pocard M, Ducreux M, Bouché O. « Métastases hépatiques et péritonéales de site primitif inconnu ». Thésaurus National de Cancérologie Digestive, mars 2025, en ligne [http://www.tncd.org]
24.1. Méthodologie, recherche bibliographique
Ce travail repose sur les recommandations de la Fédération Francophone de Cancérologie Digestive (FFCD), du Groupe Coopérateur multidisciplinaire en Oncologie (GERCOR), de la Société Française de Chirurgie Digestive (SFCD), de la Société Française d’Endoscopie Digestive (SFED), de l’Association de Chirurgie Hépato-Bilio-Pancréatique et de Transplantation (ACHBT), de l’Association Française de Chirurgie (AFC), du réseau National de prise en charge des tumeurs rares du péritoine (RENAPE), de l’European Society of Medical Oncology (ESMO) et du National Comprehensive Cancer Network (NCCN) et sur leur actualisation par une recherche bibliographique.
La recherche bibliographique a reposé sur l’extraction à partir de la base de données PubMed interrogée en mai 2024 des méta-analyses sur données individuelles ou publiées, revues systématiques, essais randomisés, essais contrôlés (rétrospectifs ou prospectifs), études prospectives ou rétrospectives non comparatives, recommandations pour la pratique clinique avec les principaux mots-clés « Cancer of unknown primary» et « Liver metastasis » ou « Peritoneal carcinomatosis » , et les autres : « Metastases », « Unknown Primary Site » « Liver », « Peritoneal Carcinomatosis », « Metastatic », « Diagnostic », « Palliative », « Treatment », « Chemotherapy », « Clinical trial », « Follow-up ».
Les présentes recommandations ont été gradées selon le niveau des preuves disponibles dans la littérature, ou en cas de preuves insuffisantes selon l'accord ou avis d'experts. Les grades des recommandations suivent les critères de la HAS pour les niveaux de preuve scientifique fournis par la littérature (source : www.has-sante.fr - avril 2013) :
A : Preuve scientifique établie
Niveau 1
- essais comparatifs randomisés de forte puissance ;
- méta-analyse d’essais comparatifs randomisés ;
- analyse de décision fondée sur des études bien menées.
B : Présomption scientifique
Niveau 2
- essais comparatifs randomisés de faible puissance ;
- études comparatives non randomisées bien menées ; - études de cohortes.
Niveau 3
- études cas-témoins.
C : Faible niveau de preuve scientifique
Niveau 4
- études comparatives comportant des biais importants ;
- études rétrospectives ;
- séries de cas ;
- études épidémiologiques descriptives (transversale, longitudinale).
Accord d’experts
Approbation d’au moins 80 % des membres du groupe de travail.
Avis d’experts
Les recommandations non gradées sont implicitement des avis d’experts ou des accords professionnels.
24.2. Introduction et épidémiologie
24.2.1. Introduction
Les cancers de primitif inconnu (CAPI) désignent un groupe hétérogène de cancers diagnostiqués à un stade métastatique pour lesquels la tumeur primitive ne peut pas être identifiée par les approches diagnostiques standards. Les mécanismes biologiques suspectés déterminant l’existence de ces cancers incluent l’involution de la tumeur primitive par une réponse immunitaire ou un défaut d’angiogénèse, et/ou un haut potentiel métastatique de la tumeur primitive permettant aux lésions métastatiques de se développer alors même que la lésion primitive n’est pas détectable (Rassy, Assi et al., 2020). L'analyse de la littérature est rendue difficile par l'ancienneté de certaines études. En effet, un primitif identifiable pourrait désormais être retrouvé dans un nombre significatif de cas notamment en raison des progrès de l'imagerie, de l'immunohistochimie et de la biologie moléculaire.
Ces maladies posent des problèmes diagnostiques et thérapeutiques majeurs, la grande majorité des traitements en oncologie étant basés sur l’origine tissulaire du cancer. La relative rareté des CAPI et leur présentation polymorphe ne permettant pas de faire des essais de phase 3 randomisés, leur prise en charge demeure souvent empirique avec un faible niveau de preuve. Quelle que soit leur prise en charge, les CAPI restent caractérisés par un pronostic défavorable, avec une médiane de survie globale inférieure à un an (Varadhachary and Raber, 2014).
Compte-tenu de la complexité de la prise en charge des patients, les stratégies diagnostiques et thérapeutiques doivent être discutées par des équipes pluridisciplinaires associant oncologues médicaux, chirurgiens, spécialistes d’organe, anatomopathologistes et biologistes moléculaires. Certaines situations cliniques placent parfois les oncologues digestifs en première ligne.
- Le recours à la Réunion de Concertation Pluridisciplinaire nationale « Cancers d’Origine Inconnue » (RCP nationale CUP RCPmolCurieSeqoia@curie.fr) est recommandé pour guider la stratégie diagnostique anatomopathologique et moléculaire et orienter le traitement systémique (cf. infra 24.9.1. ANNEXES : RCP nationale CUP). Cette RCP, réalisée en visioconférence deux fois par mois, rassemble un groupe d’experts cliniciens, pathologistes et biologistes moléculaires pour aider à identifier l’origine tissulaire possible des CAPI. Elle assure et coordonne l’orientation des prélèvements tumoraux disponibles en cas d’indication à la réalisation d’analyses supplémentaires (immunohistochimies complémentaires et examens de séquençage de nouvelle génération (NGS)), et détermine les indications de séquençage dans le cadre du Plan France Médecine Génomique 2025 (pré-indication CAPI). Les résultats des examens complémentaires réalisés sont discutés en RCP d’aval et donnent lieu à un compte-rendu écrit transmis au médecin demandeur, avec comme objectif l’identification de l’origine tissulaire possible et l’orientation thérapeutique (traitement selon le primitif potentiellement identifié et/ou selon l’identification d’altération moléculaire ciblable).
- Dans le cas des métastases péritonéales isolées de primitif inconnu, le recours à une RCP spécialisée (RCP RENAPE) pour la prise en charge des tumeurs du péritoine est également recommandé pour optimiser les possibilités de détection d’une tumeur primitive (cf. infra 24.9.2. ANNEXES : RCP RENAPE).
24.2.2. Epidémiologie
Les CAPI sont classiquement divisés en deux groupes principaux de pronostic différent :
- Environ 15 à 20% des patients atteints de CAPI présentent des maladies différenciées, pour lesquelles une origine tissulaire peut être suspectée sur la base des analyses anatomopathologiques, et un contrôle tumoral atteint dans 30 à 60 % des cas sous traitement systémique adapté.
- A l’inverse, la majorité des patients présentent des tumeurs très indifférenciées pour lesquelles l’origine tissulaire ne peut être identifiée après examen anatomopathologique approfondi. Dans ces cas, la survie globale est généralement inférieure à 6 mois en dépit de l’administration de schémas de chimiothérapie variés (Pavlidis and Pentheroudakis, 2012).
Dans les séries historiques, la présence de métastases hépatiques et/ou péritonéales constitue un facteur de mauvais pronostic dans les CAPI (Qi, Sun et al., 2023). Malgré les difficultés thérapeutiques, les CAPI représentent un modèle expérimental de choix pour développer une médecine personnalisée basée sur le ciblage moléculaire.
La prise en charge thérapeutique constitue donc une urgence thérapeutique relative, la recherche du primitif par des explorations diagnostiques multiples ne devant en aucun cas retarder l’initiation du traitement.
Ce chapitre traitera de la prise en charge diagnostique et thérapeutique des métastases péritonéales et hépatiques de site primitif inconnu. Si certaines explorations diagnostiques et stratégies thérapeutiques sont communes à l’ensemble des sites métastatiques potentiels de CAPI, les localisations péritonéales et hépatiques présentent également des spécificités qui seront détaillées dans ce texte.
24.3. Explorations diagnostiques (cf. infra 24.8.1. et 24.8.2. Algorithmes 1 et 2)
Le bilan pré-thérapeutique d’un CAPI repose sur la réalisation :
- d’un examen clinique complet avec interrogatoire à la recherche d’antécédents ;
- d’un bilan biologique standard ;
- d’un bilan radiologique ;
- et d’un prélèvement tumoral pour la réalisation d’examens anatomopathologiques et de biologie moléculaire (Kramer, Bochtler et al., 2023).
24.3.1. Biologie
La réalisation d’un bilan biologique standard est impérative avec dosage des marqueurs tumoraux :
- ACE et CA19-9 : en cas de suspicion d’origine digestive ;
- CA-125 : en cas de lésions péritonéales et/ou gynécologiques ;
- NSE et Chromogranine A : en cas de suspicion de néoplasie neuroendocrine.
Les marqueurs sériques n’ont pas de valeur diagnostique spécifique mais peuvent être utiles pour le suivi sous traitement et avoir une valeur pronostique (Choi, Nahm et al., 2017).
24.3.2. Imagerie
24.3.2.1. Bilan initial : scanner conventionnel thoraco-abdomino-pelvien injecté :
La réalisation d’un scanner thoraco-abdomino-pelvien (scanner TAP) avec injection intraveineuse de produit de contraste iodé est recommandée au cours du bilan diagnostique initial (Kramer, Bochtler et al. 2023).
L’exploration cervicale est recommandée en cas d’adénopathies cervicales cliniques et/ou d’histologies de type carcinome épidermoïde ou carcinome peu différencié afin d’écarter un primitif de la sphère oto-rhino-laryngée (O.R.L.) (accord d’experts).
Le scanner TAP permet une approche initiale et peut orienter, selon la distribution des métastases vers un primitif sus- ou sous-diaphragmatique.
- Les primitifs sous-diaphragmatiques sont plus fréquemment impliqués dans la maladie métastatique hépatique, alors que les métastases pulmonaires sont plus souvent associées à un primitif sus-diaphragmatique.
En l’absence d’orientation clinique évidente, l’analyse globale de la maladie métastatique doit juger si l'une des lésions visibles est susceptible de représenter la tumeur primaire. Plusieurs éléments radiologiques aideront à l’approche diagnostique tels que la taille et la localisation des lésions et leurs caractéristiques à l'imagerie, les signes associés, les modes d'infiltration des structures adjacentes et la distribution des métastases.
- Ainsi, l’aire ganglionnaire au plus proche du site primitif sera la plus atteinte en termes de nombre ou de volume des adénopathies, à contrario, une maladie ganglionnaire multifocale épargnant le site de drainage d’un organe en particulier permet d’en exclure l’origine.
- Les cancers d’origine gynécologique ou testiculaire peuvent donner des métastases ganglionnaires rétropéritonéales épargnant les premiers relais inguinaux et pelviens (Thelissen, Jurgenliemk-Schulz et al., 2022; Yu, Wang et al., 2023).
- Cependant dans le cas des CAPI, la distribution de métastases peut être inhabituelle. Par exemple, les métastases osseuses deviennent plus fréquentes dans le cas d'un primitif pancréatique et moins fréquentes dans le cas d'un primitif pulmonaire (Neumann and Nystrom, 1982).
Le scanner TAP permet également de quantifier l’étendue de l’atteinte métastatique et d’identifier les rares formes de CAPI oligo-métastatiques, accessibles à un traitement local ou loco-régional.
24.3.2.2. Examens radiologiques conventionnels de seconde intention :
Les examens radiologiques de seconde intention auront pour but d’écarter un primitif occulte. Ils sont discutés au cas par cas et ne doivent pas retarder l’obtention d’un diagnostic histologique par voie radiologique, endoscopique ou chirurgical.
Les examens radiologiques suivants seront réalisés en fonction de l’orientation suggérée par la distribution des lésions tumorales métastatiques sur le scanner. Les orientations sémiologiques radiologiques suivantes sont à prendre en compte afin de proposer une probabilité du site tumoral primitif :
24.3.2.2.1. Angioscanner abdominal :
L’angioscanner abdominal permet, grâce aux acquisitions au temps artériel après injection de contraste, en plus du temps veineux portal, de sensibiliser la détection et la caractérisation des tumeurs hyper-vasculaires.
- En cas de suspicion d’origine pancréatique ou de néoplasie neuroendocrine digestive, la réalisation d’une exploration scanographique triphasique, comprenant une phase sans et après injection intraveineuse de contraste iodée au temps artériel tardif à 40-50 secondes suivie d’une phase portale à 65-70 secondes est recommandée (Neuzillet, Gaujoux et al., 2018; de Mestier, Lepage et al., 2020).
- En cas de suspicion de carcinome hépato-cellulaire (CHC), l’acquisition au temps artériel sera faite plus précocément à 30-35 secondes et un temps veineux tardif afin de sensibiliser la détection des CHC iso-vasculaires au foie au temps portal et donc plus difficilement détectables sur le scanner TAP conventionnel (European Association for the Study of the 2018).
24.3.2.2.2. Imagerie par résonnance magnétique (IRM) hépato-pancréatique :
Devant des nodules hépatiques multiples au scanner avec doute sur le caractère malin, l’IRM est l’imagerie de référence pour confirmer ou écarter des tumeurs bénignes et guider les prélèvements. Elle permet aussi d’établir la cartographie précise de l’atteinte hépatique.
- L’injection de gadolinium hépato-spécifique, lorsque celui-ci est disponible, améliore la détection des tumeurs non-hépatocytaires et les hépatocarcinomes de plus petite taille (European Association for the Study of the 2016 ; Neri, Bali et al., 2016 ; Zech, Ba-Ssalamah et al., 2020).
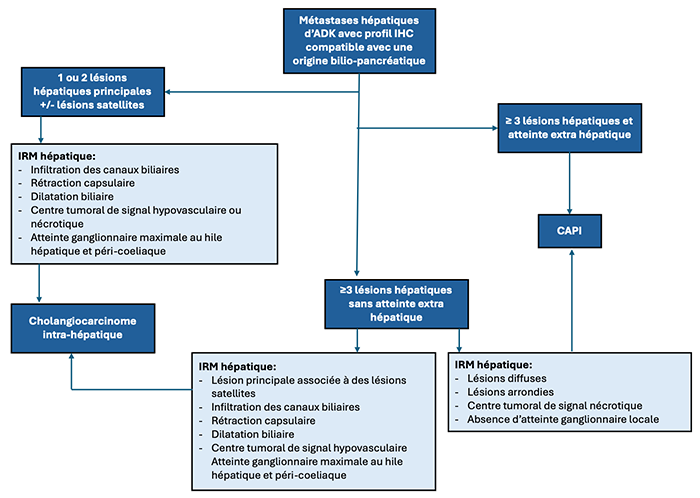
- Devant une ou de plusieurs masses hépatiques avec un diagnostic histologique d’adénocarcinome sans primitif identifié, la question d’un cholangiocarcinome versus une ou des métastases hépatiques se pose fréquemment. Dans ce contexte, la réalisation d’une IRM hépatique est recommandée.
- Le cholangiocarcinome intra-hépatique se présente essentiellement sous forme d’une masse prenant le contraste faiblement au centre qui est fibreux avec une périphérie hypo- ou hyper-vasculaire par rapport au parenchyme hépatique. A l’IRM, la composante fibreuse centrale est décelable en hyposignal sur les séquences pondérées T2 avec un rehaussement faible mais possible sur les séquences injectées au temps tardif, contrastant avec le centre en hypersignal T2 et non rehaussé des métastases nécrotiques. Les formes péri-canalaires intra-hépatiques distales sont, elles, moins fréquentes et détectées essentiellement par la dilatation biliaire de type moniliforme en amont sur les séquences T2 et du cholangiogramme hyperpondérées T2 ou bili-RM (Kim, Yeom et al., 2021 ; Kovac, Jankovic et al., 2022).
La séquence diffusion et wirsungo-IRM permettent la détection des petites tumeurs pancréatiques peu contrastées au scanner et avec peu de retentissement canalaire.
24.3.2.2.3. IRM péritonéale :
En cas d’atteinte péritonéale isolée, la réalisation d’une IRM abdominopelvienne est recommandée, afin d’identifier un potentiel primitif occulte et de réaliser une cartographie précise des lésions (Villeneuve, Passot et al., 2017).
Le protocole de préparation des patients et d’acquisition des images est détaillé par le groupe RENA-RAD/RENAPE.
https://www.renape-online.fr/wp-content/uploads/2020/11/protocole-irm-crinose-rena-rad.pdf
L’IRM permet de cartographier les localisations péritonéales difficiles et les atteintes mucineuses et peu nodulaires (Vandecaveye, Rousset et al., 2024).
24.3.2.2.4. IRM pelvienne :
Les métastases ovariennes comptent pour 3 à 30 % des tumeurs malignes ovariennes et peuvent révéler une tumeur primitive extra-gynécologique, pouvant être synchrone ou métachrone dans les proportions décroissantes suivantes dans la plus grande série de 177 cas : colorectale (38,4 %), gastrique (34,5 %), pancréato-biliaire (8 %), appendiculaire (6,8 %), mammaire (3,4 %), de primitif inconnu (3,4 %), de l’intestin grêle (2,8 %), pulmonaire et vésical (< 2 %) (Zhang, Cao et al., 2020). Dans deux séries chirurgicale et anatomopathologique de 2007 et 2017, les métastases ovariennes révélaient un primitif extra-gynécologique dans 18 % des cas (Skirnisdottir, Garmo et al., 2007 ; Lobo, Machado et al., 2017).
Du fait de sa haute capacité de caractérisation tissulaire rendant possible des corrélations radio-histologiques, l’IRM pelvienne est recommandée quand l’atteinte ovarienne est au premier plan d’une infiltration péritonéale, et aura pour but d’écarter une atteinte primitive ovarienne et de soulever la possibilité d’une ou de localisations secondaires (Taylor, Irshaid et al., 2021, Bourgioti ; Konidari et al., 2023). Réciproquement, un scanner thoraco-abdomino-pelvien est indiqué devant toute suspicion de métastase ovarienne à l’IRM pelvienne. Les métastases ovariennes sont correctement classées en lésions malignes O-rads 4 ou 5 selon la stratification du risque de malignité de l’ACR (American College of Radiology) (Thomassin-Naggara, Belghitti et al., 2021). Le challenge est donc de les différencier d’une tumeur primitive ovarienne borderline ou infiltrante.
- Les métastases ovariennes, contrairement aux tumeurs mucineuses primitives ovariennes, sont plus fréquemment bilatérales, de taille moins importante (< 10-13 cm), présentant un signal plus uniforme des loculations kystiques, un contour externe plus irrégulier comportant plus souvent des nodules de surface, un rehaussement des portions tissulaires plus modéré que celui des cancers primitifs ovariens (Xu, Yang et al., 2015 ; Ackroyd, Goetsch et al., 2019 ; Taylor, Irshaid et al., 2021).
- Les métastases ovariennes des primitifs gastriques et mammaires sont de phénotype solide à l’imagerie.
- Les métastases des primitifs appendiculaires, colorectaux et biliopancréatiques sont plus fréquemment de phénotype kystique : mucineux ou endométrioïde (Lobo, Machado et al., 2017; Kato, Shida et al., 2020).
- Le signe du « mille-feuille », reflet d’une prolifération importante intra-tumorale et d’une haute densité de cloisons, serait plus fréquemment associé aux métastases colorectales (Kurokawa, Nakai et al., 2020).
- Les métastases ovariennes de primitifs biliopancréatiques sont d’aspect plus fréquemment mucineux avec une portion tissulaire modérée, simulant parfois macroscopiquement des cystadénomes mucineux borderlines (Ackroyd, Goetsch et al., 2019).
24.3.2.2.5. Bilan sénologique :
- La mammographie est recommandée chez toutes les femmes avec diagnostic de CAPI, indépendamment de l’atteinte métastatique (Kramer, Bochtler et al., 2023).
- Elle est complétée d’une échographie mammaire et ganglionnaire complète selon la densité mammaire.
- L’IRM mammaire est recommandée si le bilan écho/mammographique retrouve uniquement une atteinte ganglionnaire axillaire sans lésion glandulaire.
24.3.3. Place de l’imagerie nucléaire
La réalisation d’une tomographie par émission de positrons au 18-fluorodésoxyglucose (TEP-TDM au 18-FDG) reste non recommandée en routine dans le bilan pré-thérapeutique des CAPI dans les dernières recommandations internationales (Salaun, Abgral et al., 2019 ; Kramer, Bochtler et al., 2023).
Elle est très utilisée pour évaluer l’étendue de l’atteinte métastatique et présente une sensibilité plus élevée que le scanner conventionnel pour la détection des métastases osseuses et ganglionnaires.
Dans une méta-analyse récente, la sensibilité d’une TEP-TDP au 18-FDG pour la détection d’un primitif occulte est :
- de 54 % pour les présentations métastatiques avec une atteinte prédominante hépatique (primitif occulte colorectal, broncho-pulmonaire et oeso-gastrique)
- de 38 % dans le cas des métastases à prédominance péritonéale (primitif occulte colorectal, gynécologique et oeso-gastrique) (Willemse, Lambregts et al., 2024).
Les performances limitées dans la détection d’un primitif à l’origine de métastases péritonéales, peuvent être expliquées par le faible volume de la lésion primitive et son faible contraste métabolique avec la captation physiologique du 18-FDG du côlon, notamment en cas de diabète, et du système urinaire et la faible avidité de certains types histologiques (tumeurs mucineuses, cellules en bague à chaton, tumeurs neuroendocrines de bas grade).
- La TEP-TDM au 18-FDG est toujours recommandée dans le cas d’un CAPI avec atteinte oligo-métastatique pouvant bénéficier d’un traitement locorégional pour s’assurer de l’absence de lésion à distance non détectée au scanner conventionnel (Kramer, Bochtler et al,. 2023).
- Dans le cas particulier de néoplasie neuroendocrine de primitif inconnu, bien différenciée à l’analyse histologique du site métastatique ou si fortement suspectée sur l’imagerie, la TEP-TDM au 68Ga-DOTATOC est indiquée en 1ère intention, permet d’identifier le primitif occulte dans 60 % des cas (Ma, Kan et al., 2021) et de réaliser le bilan d’extension et évaluer l’avidité tumorale pour le 68Ga-DOTATOC en vue d’une éventuelle future radiothérapie interne vectorisée.
- Lorsqu'une origine primitive neuroendocrine bien différenciée de l'intestin moyen est suspectée et que la TEP-TDM au 68Ga-DOTATOC est négative, la TEP-TDM à la 18F-DOPA peut-être proposée (Bozkurt, Virgolini et al., 2017).
24.3.4. Endoscopie
L’apport diagnostique des endoscopies digestives en cas de métastases hépatiques et péritonéales de CAPI est peu connu. Elle doit être discutée au cas par cas en prenant en compte la présentation clinique et biologique (marqueurs tumoraux ACE et CA19-9) et les caractéristiques anatomopathologiques de la tumeur.
- La réalisation d’une endoscopie oeso-gastro-duodénale (EOGD) est classiquement recommandée en cas de métastases de carcinome ou d’adénocarcinome de profil immunohistochimique compatible avec une origine digestive haute (profil CK7+ CK20+).
- Une écho-endoscopie gastrique avec biopsies profondes doit être réalisée en cas d’aspect morphologique de cellules indépendantes à l’analyse microscopique, les linites gastriques pouvant passer inaperçues à l’EOGD et au bilan radiologique (Zhou, Pan et al., 2015).
- La coloscopie est généralement recommandée devant des métastases hépatiques ou péritonéales d’adénocarcinome de profil CK7- CK20+ CDX2+. Elle doit être complète autant que possible et mentionner la visualisation de l’appendice.
La négativité des explorations digestives ne doit pas remettre en question le diagnostic de CAPI d’origine colorectale en cas de profil anatomopathologique typique, ces patients devant bénéficier d’un traitement orienté sur l’origine colorectale (Varadhachary, Raber et al., 2008).
24.3.5. Indications bilan : clinique, biologie, imagerie, endoscopie
REFERENCES (accord d’experts)
- Examen clinique
- Bilan biologique avec marqueurs tumoraux
- ACE et CA19-9 : en cas de suspicion d’origine digestive ;
- CA-125 : en cas de lésions péritonéales et/ou gynécologiques ;
- NSE et Chromogranine A : en cas de suspicion de néoplasie neuroendocrine.
- Scanner thoraco-abdomino-pelvien injecté
- Mammographie bilatérale chez la femme
OPTION (accord d’experts)
- Scanner TAP avec hélice cervicale si histologie de carcinome épidermoïde ou carcinome indifférencié
- IRM abdominopelvienne si métastase péritonéale isolée selon le protocole RENARAD
- IRM pelvienne si métastases ovariennes
- IRM hépatique si métastases hépatiques isolées avec histologie compatible avec un cholangiocarcinome
- TEP-TDM au 18FDG si CAPI oligo-métastatique accessible à un traitement local, ou métastases osseuses et/ou ganglionnaires
- EOGD si métastases d’adénocarcinome CK7+ / CK20+
- Echo-endoscopie gastrique si métastases CK7+ / CK20+ d’adénocarcinome à cellules indépendantes
- Coloscopie si métastases d’adénocarcinome CK7- / CK20+ / CDX2+
24.3.6. Biopsie et explorations chirurgicales
La réalisation d’un prélèvement tumoral d’un site métastatique est indispensable pour guider l’orientation diagnostique par les analyses anatomopathologiques et moléculaires. Celui-ci s’obtient le plus souvent par la biopsie d’une lésion métastatique, le choix de la lésion à biopsier devant être déterminé par son accessibilité et ses caractéristiques morphologiques.
- Le matériel tumoral doit être inclus en partie en paraffine pour la réalisation des analyses anatomopathologiques.
- La cryopréservation d’un fragment tumoral devrait être réalisée autant que possible pour permettre la réalisation des techniques de biologie moléculaire optimales.
- En cas de maladie non accessible à une biopsie percutanée, une biopsie chirurgicale doit être envisagée, voir l’exérèse d’une lésion métastatique.
- Dans tous les cas, les prélèvements doivent être de quantité suffisante et leur gestion optimisée du fait de la nécessité de réaliser des analyses immunohistochimiques souvent multiples et des techniques complémentaires de biologie moléculaire.
24.3.6.1. Métastases hépatiques
La faisabilité de la réalisation d’une biopsie hépatique doit être évaluée par les examens radiologiques qui prendront en compte la taille des lésions, leur localisation et leur aspect morphologique.
- Elle est le plus souvent réalisée par voie percutanée sous contrôle radiologique.
- Une biopsie chirurgicale ou l’exérèse d’une lésion hépatique sous cœlioscopie sont recommandées en deuxième intention en cas de lésion non accessible à une biopsie percutanée.
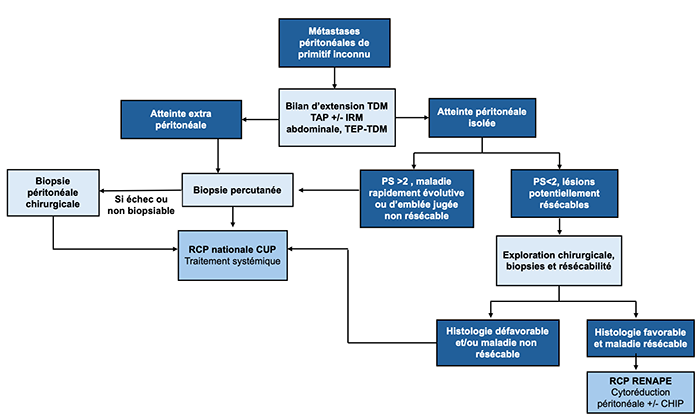
Concernant les métastases péritonéales de CAPI, deux grandes situations cliniques sont observées :
- Dans le premier cas, les métastases sont diffuses, associées à d’autres localisations métastatiques et/ou à une dégradation de l’état général. La biopsie doit être alors être réalisée sur le site le plus accessible et par voie percutanée (Spencer, Weston et al., 2010) pour permettre l’initiation rapide d’un traitement systémique.
- Dans d’autres cas, l’atteinte péritonéale est isolée et modérément symptomatique, voire lentement évolutive. Dans cette situation la réalisation de biopsies chirurgicales par cœlioscopie ou par laparotomie doit être privilégiée et permet dans le même temps d’évaluer l’étendue de l’atteinte à visée pronostique, et la résécabilité potentielle de l’atteinte tumorale.
La cœlioscopie doit être réalisée en limitant les risques d’envahissement par la tumeur des orifices de trocart et donc en plaçant tous les trocarts sur la ligne médiane, ce qui induit une contrainte pour le chirurgien ; toutefois si un diagnostic de mésothéliome est finalement retenu l’envahissement des orifices de trocart dans les flancs est si fréquent et si rapide qu’il peut à lui seul rendre la chirurgie de cytoréduction irréalisable et faire basculer la survie du patient.
- Il est donc impératif de placer les trocarts uniquement sur la médiane.
- L’utilisation d’une incision de trois centimètres sur la médiane peut permettre une exploration par un dispositif de monotrocart qui permet également de dérouler l’intestin grêle.
La visualisation des lésions et leur description est reportée dans le compte-rendu opératoire (CRO). Au mieux sont réalisés des photographies et films vidéo, permettant d’avoir recours à des expertises complémentaires. L’aspect et le volume de l’ascite doit être renseignés.
- En cas d’ascite chyleuse, ceci peut traduire une gêne au retour lymphatique de l’intestin grêle et non à une pathologie tumorale.
- En cas d’ascite celle-ci doit être prélevée et adressée rapidement au laboratoire de pathologie.
- Au moins trois biopsies doivent être réalisées en zone suspecte. La réalisation d’une biopsie du péritoine pariétal d’aspect normal est recommandée. Les biopsies de l’épiploon nécessitent une coagulation de qualité.
- Il est important de ne pas ouvrir le plan rétropéritonéal, et de ne pas biopsier la paroi grêlique et le muscle du diaphragme.
- La visualisation de l’appendice doit faire partie de l’exploration du fait du caractère inconnu du primitif, d’autant plus que l’aspect de la carcinose est de type mucineux (Sugarbaker, 2020). La découverte d’une tumeur de l’appendice méconnue malgré le scanner et l’endoscopie est plus fréquente que la découverte d’une carcinose de cause inconnue.
- Du fait de la recherche d’une lésion primitive, si l’appendice est normal, il est utile d’essayer de dérouler tout l’intestin grêle.
- La visualisation des ovaires doit faire partie de l’exploration du fait du caractère inconnu du primitif, d’autant plus en cas d’augmentation des marqueurs tumoraux ACE et CA-125. L’analyse des lésions péritonéales peut identifier un carcinome papillaire séreux, avec des ovaires normaux ce qui correspond à une tumeur primitive du péritoine dénommée aussi carcinome primitif séreux du péritoine (Bereder, Classe et al., 2007).
La réalisation d’une quantification de l’étendue de la maladie va orienter sur le pronostic et sur les choix thérapeutiques. La classification retenue quelle que soit la pathologie est le calcul de l’index de Carcinose Péritonéale (PCI) qui évalue l’étendue de la carcinose en 13 régions et va de 0 pour une absence de lésion à 3, aboutissant à un score maximal de 39.
La réalisation d’une chirurgie de cytoréduction pourra être discutée dans la prise en charge, idéalement après discussion en RCP spécialisée RENAPE.
La présence de certains éléments rendant la résécabilité complète impossible ou peu probable, comme le caractère figé du mésentère lié à son envahissement, peut être reportée dans le compte rendu opératoire, si le chirurgien connaît la carcinose péritonéale.
Cette résécabilité ou non résécabilité immédiate est importante pour orienter la prise en charge (Bereder, Classe et al., 2007).
Un Compte-Rendu Opératoire décrivant une carcinose péritonéale doit comporter :
- une description de la carcinose quadrant par quadrant, prouvée par une biopsie ;
- la présence ou non d’une ascite ;
- des photographies ou un enregistrement vidéo ;
- la description de l’atteinte de l’intestin grêle et la présence ou non d’une rétraction du mésentère ;
- l’atteinte de la coupole droite et son caractère mobile ou non.
Ces cinq items sont fondamentaux pour pouvoir adresser un patient à un centre spécialisé dans la prise en charge des carcinoses péritonéales.
24.3.6.3. Indications de biopsies et explorations chirurgicales
REFERENCES
- Biopsie d’une lésion métastatique par voie percutanée pour analyses anatomopathologiques et moléculaires (accord d’experts).
OPTION
- Biopsie chirurgicale sous coelioscopie ou laparotomie et exploration péritonéale complète en cas de carcinose péritonéale isolée et patient pouvant relever d’un traitement locorégional (accord d’experts).
- En coelioscopie, il est impératif de placer les trocarts uniquement sur la médiane.
- Le Compte-Rendu Opératoire décrivant une carcinose péritonéale doit comporter :
1. Description de carcinose quadrant par quadrant, selon le score de carcinose péritonéale (PCI), prouvée par une biopsie ;
2. Présence ou non d’une ascite ;
3. Des photographies ou un enregistrement vidéo ;
4. Description de l’atteinte de l’intestin grêle et la présence ou non d’une rétraction du mésentère ;
5. L’atteinte de la coupole droite et son caractère mobile ou non.
24.3.7. Anatomopathologie
24.3.7.1. Examens morphologiques et immunohistochimiques
Le but essentiel de la démarche diagnostique est d‘identifier des entités anatomo-cliniques de CAPI pouvant bénéficier d’un traitement spécifique. Il est nécessaire de fournir un diagnostic histopathologique précis et étayé par une étude immunohistochimique car il appuie le choix thérapeutique et permet d’individualiser les quelques cas de meilleur pronostic (Bahrami, Truong et al., 2008 ; Kramer, Bochtler et al., 2023).
- L’immunohistochimie (IHC) apporte une orientation diagnostique dans environ 90 % des tumeurs malignes indifférenciées, mais parfois au prix d’un algorithme décisionnel morphologique et immunohistochimique fastidieux et coûteux.
- En pratique, il convient de rechercher en priorité les sites primitifs impliquant un traitement spécifique et un meilleur pronostic, en particulier le sein, l’ovaire, la prostate et la thyroïde.
- Enfin, les CAPI posent au pathologiste une problématique difficile car il doit porter le diagnostic le plus précis possible sur un matériel généralement exigu.
Lorsque la morphologie n’est pas suffisante, la première étape de l’algorithme diagnostique repose sur l’immunohistochimie avec une batterie restreinte d’anticorps dirigés respectivement contre des antigènes épithéliaux (cytokératines à large spectre), lymphoïdes (CD45, ou CD20 et CD3), et mélanique (protéine S100, MELANA, HMB45).
Dans cette première démarche diagnostique, il est essentiel d’être rigoureux et d’éliminer un lymphome, un mélanome ou un sarcome, qui peuvent présenter un aspect épithélioïde simulant un carcinome, ou se présenter sous forme d’une tumeur peu différenciée. Dans ce cadre, il faut encore souligner l’importance des renseignements cliniques et des antécédents, pour éviter un nomadisme diagnostique au plan anatomopathologique.
Parmi les métastases d'une tumeur d'origine épithéliale, qui se caractérisent le plus souvent par l’expression des cytokératines sans l’expression conjointe des marqueurs lymphoïdes et mélaniques, l’étude immunohistochimique permettra de distinguer trois sous-types histopathologiques :
- un adénocarcinome (50 % des cas) ;
- un carcinome peu différencié (30 % des cas) ;
- un carcinome épidermoïde (15 % des cas).
Le profil observé avec les cytokératines CK7 et CK20 permet ensuite au sein des adénocarcinomes et des carcinomes peu différenciés, une orientation globale vers une origine primitive. Cette approche est utile mais imparfaite, les tumeurs pouvant présenter un profil variable.
En fonction de l’expression des cytokératines 7 et 20 on peut distinguer quatre profils :
- CK7+/CK20– ;
- CK7–/CK20+ ;
- CK7+/CK20+ ;
- CK7–/CK20–.
Les principaux diagnostics à évoquer en fonction des résultats des immunomarquages CK7 et CK 20 sont résumés dans le Tableau 1.
CK7 + / CK20 – | CK7 + / CK 20 + | CK7-/CK20+ | CK7 – / CK 20 – |
|---|---|---|---|
| • Sein • Ovaire (non mucineux) • Endomètre • Poumon • Mésothéliome • Thyroïde • Glandes salivaires • Rein (carcinome papillaire) | • Pancréas-voies biliaires • Ovaire (mucineux) • Estomac • Œsophage • Vessie • Poumon (mucineux & entérique) • Carcinome de ligne médiane | • Colorectal • K à cellules de Merkel | • Foie (CHC) • Rein (K cellules claires) • Prostate • Cortex surrénalien • Colorectal dMMR/MSI (perte des marqueurs habituels) • Tumeur germinale |
Lorsque le profil CK7/CK20 d’une tumeur épithéliale maligne est défini, certains anticorps notamment dirigés contre des facteurs de transcription, peuvent permettre de définir plus précisément l’origine du carcinome (Conner and Hornick 2015) :
GATA3 est un marqueur pouvant orienter vers une origine mammaire lorsque la tumeur exprime le couple CK7+/CK20–. GATA 3 est aussi exprimé dans les tumeurs urothéliales.
PAX8 est un marqueur sensible et spécifique des tumeurs müllériennes, rénales et thyroïdiennes.
WT1 (N-Terminal) est un marqueur exprimé dans un groupe de tumeurs hétérogènes incluant le mésothéliome malin, le carcinome ovarien séreux ou la tumeur desmoplastique à petites cellules.
TTF1 est marqueur exprimé dans les cancers de thyroïde, les adénocarcinomes du poumon, mais également dans les carcinomes neuroendocrines peu différenciés, notamment à petite cellules indépendamment de leur origine.
CDX2 est un facteur de transcription de différenciation intestinale qui peut être exprimé dans tous les carcinomes avec une différenciation intestinale : adénocarcinome du côlon, du grêle, certains cancers gastriques ou œsophagiens, pancréatiques, ovariens, de l’ouraque, naso-sinusiens. L’expression de CDX2 peut être diminuée dans les cancers coliques proximaux, peu différenciés et de statut dMMR (Olsen, Eiholm et al. 2016).
SATB2 (special AT-rich sequence-binding protein 2) est un régulateur de la transcription, restreint au tractus digestif bas. Son expression est maintenue dans quasiment tous les adénocarcinomes de l’appendice (y compris les adénocarcinomes ex-carcinome à cellules en gobelet) et dans plus de 85 % des cancers coliques (Dragomir, de Wit et al., 2014).
Marqueurs prostatiques.
- L’utilisation des anticorps anti-PSA et anti-PSAP permet la confirmation de l’origine prostatique dans la majorité des cas (Molinie, 2008).
- D’autres marqueurs décrits comme très spécifiques de l’origine prostatique peuvent également être utilisés seuls ou en association pour déterminer l’origine prostatique : p501s (prostein), PSAM (prostate-specific membrane antigen), et NKX3.1 (Queisser, Hagedorn et al., 2015).
Cancer du rein.
Un panel d’anticorps associant CK7 et CK20, vimentine, RCC marker, CD10 et CAIX permet le plus souvent de confirmer l’origine rénale (Skinnider and Amin, 2005).
24.3.7.3. Cas particulier des carcinoses péritonéales
Devant une carcinose péritonéale, l’immunohistochimie est souvent utile. Les principaux diagnostics différentiels de carcinose à envisager sont les suivants :
- carcinose d’un carcinome séreux primitif du péritoine/ovarien/tubaire ;
- carcinose du tractus gastrointestinal incluant l’appendice ;
- carcinose moins fréquemment d’origine pulmonaire, mammaire ou utérine.
De plus, il ne faut pas méconnaître le diagnostic de mésothéliome malin épithélioïde. Dans ce cadre il est préconisé d’utiliser des marqueurs dits « positifs » (Calrétinine, CK5/6…) et « négatifs (BerP4, B72.3…) (cf. chapitre TNCD 15. Mésothéliome péritonéal).
24.3.7.4. Cas particulier des tumeurs hépatiques d’origine inconnue
Une tumeur maligne hépatique d’aspect épithélial peut correspondre à un carcinome primitif hépatique (CHC ou cholangiocarcinome) ou une métastase d’un carcinome ou d’autre origine.
L’approche morphologique simple permet une première orientation :
- adénocarcinome évident compatible avec une origine digestive, mammaire, broncho-pulmonaire, gynécologique ou autres, voire un cholangiocarcinome ;
- morphologie non adénocarcinomateuse évidente pourra faire discuter un CHC, une métastase hépatique d’un cancer du rein, du cortex surrénalien, une tumeur neuro-endocrine et plus rarement la métastase de tumeurs non épithéliales (Choi, Ramachandran et al., 2017).
Le contexte clinique, l’approche morphologique rigoureuse et l’utilisation d’un panel simple d’anticorps permet généralement d’orienter le diagnostic.
L’hypothèse et le diagnostic de tumeur hépatique doit se faire en connaissance du contexte radiologique, clinique, en particulier d’antécédent de tumeur ou d’hépatopathie avec la réalisation d’une biopsie en foie non tumoral pour s’assurer de l’état du foie sous-jacent.
Il faut souligner qu’une partie des CAPI a été reclassée en cholangiocarcinome intrahépatique notamment par la mise en évidence d’anomalies moléculaires telles que les fusions de FGFR2 et les mutations d’IDH1 représentant des anomalies ciblables. Dans ce cadre la bonne gestion du matériel est essentielle pour éviter l’épuisement tissulaire et permettre de réaliser des techniques de biologie moléculaire.
24.3.7.5. Indications de l’anatomopathologie
REFERENCES
- Analyse morphologique systématique (accord d’experts)
- Analyse immunohistochimique guidée par le contexte clinique et l’analyse morphologique (accord d’experts)
OPTION
- Algorithme décisionnel IHC basé sur le profil CK7 / CK20 (accord d’experts)
24.3.8. Biologie moléculaire
La réalisation d’analyses de biologie moléculaire est désormais recommandée en routine dans la prise en charge diagnostique des CAPI afin d’identifier de potentielles altérations spécifiques d’une origine tissulaire ou des anomalies moléculaires actionnables (Kramer, Bochtler et al., 2023).
Ces analyses peuvent être limitées par le matériel tumoral disponible le plus souvent issu de micro-biopsies et souvent restreint après les analyses anatomopathologiques. Le matériel tumoral doit être cryo-préservé autant que possible afin de permettre une caractérisation moléculaire optimale.
24.3.8.1. Analyses génomiques
Les analyses génomiques ont pour objectif de rechercher des mutations et des altérations de nombre de copies qui pourraient orienter sur le tissu d’origine ou guider la prise en charge thérapeutique.
- La réalisation d’un panel DNAseq « large » (contenant au moins une centaine de gènes d’intérêt) en séquençage nouvelle génération est recommandée et peut être effectuée à partir de matériel cryo-préservé ou issu de paraffine, mais également à partir d’ADN tumoral circulant (Kato, Krishnamurthy et al., 2017).
- L’évaluation de la charge mutationnelle et du statut des microsatellites est également recommandée pour identifier les patients à même de bénéficier d’une immunothérapie (Gatalica, Xiu et al., 2018).
- Dans le cas de métastases hépatiques ou péritonéales avec un doute sur une origine biliaire ou pancréatique primitive, l’évaluation du statut mutationnel des gènes BAP1, KRAS, ou SMAD4, peut orienter l’origine tissulaire.
- Dans le cas de métastases de profil compatible avec une origine digestive gastrique ou colorectale, les recherches de mutations KRAS, NRAS et BRAF et l’amplification de HER2 doivent au minimum être réalisées pour orienter le traitement systémique.
- Dans le cas particulier des carcinoses péritonéales de primitif inconnu, l’évaluation du statut HRD et la recherche de mutations BRCA1/BRCA2 peuvent aider à identifier une origine gynécologique primitive (Moschetta, George et al., 2016).
24.3.8.2. Analyses transcriptomiques
Les analyses transcriptomiques (RNAseq) permettent de rechercher des transcrits de fusion à impact diagnostique et thérapeutique.
- Elles peuvent être réalisées sur matériel inclus en paraffine ou cryo-préservé,
- soit par des techniques de panel RNAseq (par exemple ARCHER),
- soit par analyse pantranscriptomique RNAseq.
- La recherche de transcrit de fusion impliquant les gènes FGFR doit être réalisée dans tout cas de CAPI compatible avec une origine biliaire primitive, du fait du bénéfice des inhibiteurs de FGFR dans cette situation (Goyal, Meric-Bernstam et al,. 2023; Katoh, Loriot et al., 2024).
- Les analyses de pantranscriptomique RNAseq permettent également l’accès au profil d’expression de la tumeur et l’utilisation de classifiers diagnostiques pour identifier le tissu d’origine. Ces techniques permettent d’orienter les décisions thérapeutiques dans les cas de CAPI pouvant bénéficier d’un traitement basé sur le tissu d’origine (Zhao, Pan et al., 2020; Vibert, Pierron et al., 2021; Mohrmann, Werner et al., 2022).
24.3.8.3. Profil moléculaire dans le cadre du Plan France Médecine Génomique (PFMG) 2025 (cf. infra 24.9.1. ANNEXE : RCP national CUP)

La réalisation d’un profil moléculaire complet associant séquençage du génome tumoral et constitutionnel, séquençage de l’exome, et séquençage du transcriptome complet par RNAseq est accessible à tous les patients atteints de CAPI sur le territoire national dans le cadre du Plan France Médecine Génomique 2025, pré-indication CAPI.
- La réalisation de ce profil moléculaire passe par la présentation du dossier en RCP nationale CUP et par la validation de l’indication CAPI, puis les analyses sont réalisées sur les deux plateformes nationales Seqoia et Auragen à partir de matériel tumoral cryo-préservé.
- Le classifier diagnostique TransCUPtomics basé sur l’analyse du profil d’expression par RNAseq a été intégré aux analyses standards effectuées dans le cadre du PFMG.
- Depuis 2024, certaines analyses peuvent également être réalisées à partir de matériel conservé en paraffine.
- Les résultats des analyses moléculaires sont discutés en RCP nationale CUP, intégrés aux caractéristiques cliniques et anatomopathologiques et rendus au médecin référent afin d’orienter le diagnostic et la stratégie thérapeutique (Jacquin, Kamal et al., 2022).
REFERENCES
- Panel NGS DNAseq large contenant au moins une centaine de gènes d’intérêt, réalisé sur matériel archivé en paraffine ou cryo-préservé (niveau de recommandation grade B).
OPTION
- Séquençage de l’exome, du génome, et du transcriptome complet dans le cadre du PFMG 2025 accessible via la RCP nationale CUP et réalisable sur matériel tumoral archivé en paraffine ou cryo-préservé (accord d’experts).
- Panel NGS DNAseq large sur ADN tumoral circulant (accord d’experts).
- Panel RNAseq ciblé ou RNAseq total (transcriptome) sur matériel tumoral archivé en paraffine ou cryo-préservé (accord d’experts).
24.4. Traitements (cf. 24.8.3. Algorithmes 3)
24.4.1. Traitements systémiques non spécifiques
Tout traitement systémique doit reposer sur une évaluation préalable de l’état général du patient (statut PS ECOG ≤ 1) et de ses comorbidités.
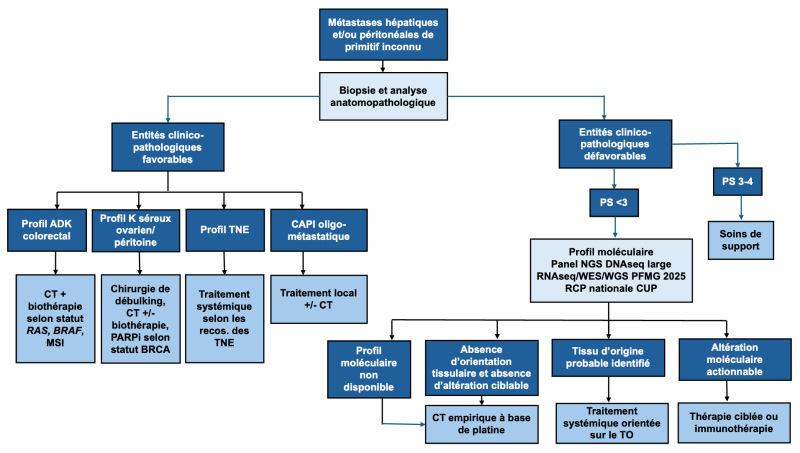
Exceptés les CAPI de pronostic dit « favorable » correspondant à des sous-ensembles clinico-pathologiques bien définis (10-15 % des CAPI) et dont le traitement doit reposer par analogie sur celui des carcinomes de primitifs « connus », le traitement systémique non spécifique de première ligne des CAPI dit « non favorables » est toujours débattu.
24.4.1.1. Association doublet à base de platine
- L’association d’un doublet de chimiothérapie à base de sels de platines avec gemcitabine ou un taxane a été établi comme une option de choix des CAPI métastatiques sur la base notamment d’études de phase II (Greco, Erland et al., 2000 ; Culine, Lortholary et al., 2003; Kramer, Bochtler et al., 2023). La médiane de survie sans progression (SSP) estimée, dans ces études, à 5 mois reste décevante (Culine, Lortholary et al., 2003).
- D’autres associations de chimiothérapie ont été explorées avec là encore des données de SSP décevantes alors que la toxicité était parfois plus importante (Dowell, Garrett et al., 2001, Hainsworth, Spigel et al. 2010, Holtan, Steen et al. 2012).
- La seule méta-analyse disponible et publiée en 2009 a, par ailleurs, démontré l’absence de bénéfice significatif en survie d’une association particulière de chimiothérapie avec cependant une tendance non significative en survie à l’utilisation des sels de platines et/ou taxanes (Golfinopoulos, Pentheroudakis et al., 2009).
- L’association d’un doublet de chimiothérapie à base de sels de platines avec gemcitabine ou un taxane reste donc le standard de traitement de première ligne métastatique d’un CAPI, en dehors de situation clinique particulière pouvant bénéficier de traitement orienté sur une origine probable (Kramer, Bochtler et al,. 2023).
Le niveau de preuve concernant la seconde ligne de chimiothérapie apparaît encore plus faible que pour la première ligne. Ce traitement n’est indiqué qu’en cas de conservation de l’état général du patient (PS ECOG ≤ 2).
- L’utilisation des taxanes ou des sels de platines s’ils n’ont pas été utilisés en première ligne est une option. L’association de chimiothérapies avec la gemcitabine est une autre possibilité si cette molécule n’a pas déjà été utilisée précédemment.
- L’immunothérapie par nivolumab a montré une PFS de 4 mois en deuxième ligne dans une série de CAPI non sélectionnés (Tanizaki, Yonemori et al., 2022).
- Enfin, dans une phase II randomisée, l’association d’un anti-VEGF (bevacizumab) et d’anti-EGFR (erlotinib) s’est montrée être une association prometteuse en 2nd ligne avec une toxicité gérable (Hainsworth, Spigel et al., 2007).
Cependant, il n’y a actuellement aucun accès au remboursement de ces traitements dans cette indication.
24.4.2. Traitement systémique spécifique guidé par l’anatomopathologie
Une minorité (15 %) des CAPI appartient à des sous-ensembles clinico-pathologiques spécifiques dont l’identification préalable permet de guider les stratégies thérapeutiques (Fizazi 2006 ; Massard, Loriot et al., 2011 ; Kramer, Bochtler et al., 2023).
- Le traitement de ces différentes sous-catégories de CAPI repose sur l’analogie avec le traitement des primitifs correspondant (tumeurs germinales extra-gonadiques, adénocarcinome de localisation ganglionnaire axillaire, adénocarcinome de localisation osseuse avec PSA élevé, et carcinome épidermoïde de localisation cervicale ganglionnaire).
- Le diagnostic de ces pathologies n’est que dans de très rares cas fait sur une atteinte hépatique et/ou péritonéale. Nous avons pris le parti de ne pas les aborder et leur prise en charge se base sur les référentiels connus.
D’autres entités spécifiques ont un mode de révélation fréquent par métastases hépatiques et/ou péritonéales comme les CAPI de profil colorectal, les carcinomes neuroendocrines peu différenciés, les adénocarcinomes papillaires séreux ovariens ou adénocarcinome de l’endomètre et les mésothéliomes péritonéaux.
24.4.2.1. CAPI de profil colorectal
Les métastases hépatiques et/ou péritonéales sont un mode de révélation relativement classique de CAPI de profil colorectal. Ces tumeurs se caractérisent par une histologie d’adénocarcinome plus ou moins différencié avec un profil IHC CK7- CK20+ CDX2+, et/ou une signature moléculaire similaire à celle des adénocarcinomes colorectaux métastatiques (CCRm).
- Il faut souligner que les cancers coliques dMMR/MSI sont souvent peu différenciés, perdant les marqueurs de différenciation intestinale tels que CK20 et CDX2 (Lugli, Tzankov et al., 2008).
- Plusieurs séries rétrospectives suggèrent que ces patients bénéficient d’une chimiothérapie par FOLFOX ou FOLFIRI orientée sur l’origine colorectale, avec des survies comparables à celles de patients atteints de CCRm.
- Pour les patients présentant une tumeur avec statut microsatellitaire stable (pMMR/MSS), l’ajout d’une thérapie ciblée par bevacizumab ou anti-EGFR selon le statut KRAS et BRAF est classiquement recommandée par analogie avec la prise en charge classique des CCRm mais n’a pas été évaluée prospectivement.
- De même, la détection d’un phénotype microsatellitaire instable (dMMR/MSI) doit orienter vers une prise en charge par immunothérapie (Trullas, Delgado et al., 2021).
24.4.2.2. Carcinomes neuroendocrines peu différenciés
L’amélioration de la connaissance clinico-pathologique des tumeurs et carcinomes neuroendocrines permet d’orienter spécifiquement les traitements des carcinomes neuro-endrocrines de primitifs inconnus pouvant se révéler volontiers par la présence de métastases hépatiques sans primitif retrouvé.
- Une association de chimiothérapie à base de sel de platine avec étoposide est donc recommandée avec des taux de réponse de l’ordre de 50 à 70 % avec 25 % de réponse complète et 10 à 15 % de longs survivants (Spigel, Hainsworth et al., 2009).
- L’étude PRODIGE 69-FOLFIRINEC évaluant le FOLFIRINOX vs carboplatine étoposide chez les patients présentant un carcinome neuroendocrine peu différencié de grade 4 métastatique de primitif digestif ou inconnu est ouverte aux inclusions en France.
24.4.2.3. Adénocarcinomes papillaires séreux péritonéaux
Les adénocarcinomes papillaires séreux péritonéaux de primitif inconnu doivent être traités comme des carcinomes ovariens, cette entité ayant une chimio-sensibilité accrue (Hainsworth and Fizazi, 2009).
- Le traitement repose sur une association de chimiothérapie avec carboplatine et paclitaxel par analogie avec le traitement spécifique des carcinomes séreux de primitif ovarien.
- Une chirurgie de cytoréduction associée ou non à une Chimiothérapie Hyperthermique Intra-Péritonéale (CHIP) doit être discutée à chaque évaluation.
- L’avènement des thérapies ciblées anti-PARP et de l’immunothérapie a profondément bousculé la stratégie thérapeutique chez les patientes BRCA muté ou non (tests recherchant des mutations somatiques et germinales) (Gonzalez-Martin, Pothuri et al., 2019).
24.4.2.4. Mésothéliomes péritonéaux
Leur prise en charge spécifique est décrite dans le chapitre 15 du TNCD (« Mésothéliome péritonéal ». Thésaurus National de Cancérologie Digestive, avril 2020, en ligne [http://www.tncd.org]).
24.4.3. Traitements systémiques spécifiques guidés par la biologie moléculaire
Des altérations moléculaires peuvent être identifiées chez la majorité des patients présentant un CAPI (Ross, Wang et al., 2015 ; Kato, Krishnamurthy et al., 2017. Varghese, Arora et al., 2017 ; Ross, Sokol et al., 2021 ; Losa, Fernández et al., 2022). La caractérisation moléculaire des CAPI permet dans un nombre significatif de cas d’orienter la prise en charge thérapeutique et de proposer des stratégies thérapeutiques personnalisées, basées soit sur l’identification du tissu d’origine probable de la maladie, soit sur la mise en évidence d’altérations moléculaires actionnables indépendamment du tissu d’origine (Massard, Loriot et al., 2011).
- Ces approches ont très récemment montré leur bénéfice en survie dans le cadre de la prise en charge des CAPI (tableau 2) (Rassy and Andre, 2024).
- La réalisation et l’analyse des résultats des examens de biologie moléculaire pour guider le traitement systémique peuvent être coordonnées par la RCP nationale CUP (cf. infra 24.9.1. ANNEXES : RCP nationale CUP RCPmolCurieSeqoia@curie.fr) pour tous les patients sur le territoire national.
| Type d'approche | Essai clinique | Design | Test moléculaire | Critère de jugement principal |
|---|---|---|---|---|
| Approche tissu-gnostique | Phase 2 randomisée Lancet Oncol 2024 (Liu et al., 2024) | • Chimio. empirique vs chimio. tissu-spécifique • N=182 patients | Signature d’expression de 90 gènes pour prédire le tissu d’origine | • PFS : 9,6 mois (tissu-spécifique) vs 6,6 mois • HR 0,68, p=0,017 |
| Approche tissu-agnostique | Phase 2 randomisée Lancet 2024 (Kramer et al., 2024) | • Chimio. empirique vs traitement guidé par le profil moléculaire • N=436 patients | Panel Foundation One CDx (Foundation Medicine) | • PFS : 6,1 mois (traitement guidé par biologie moléculaire) vs 4,4 mois • HR : 0,72 ; p=0,0079 |
24.4.3.1. Traitements basés sur l’origine tissulaire probable (approche tissu-gnostique)
Plusieurs essais cliniques ont évalué l’intérêt de l’utilisation de profils transcriptomiques ou de méthylation de l’ADN pour guider le traitement des CAPI en se basant sur leur tissu d’origine probable.
- Les premiers essais cliniques randomisés n’ont pas montré de bénéfice d’un traitement orienté sur l’origine tissulaire comparativement à une chimiothérapie empirique (Ding, Jiang et al., 2022).
- L’essai Fudan CUP-001 publié en 2024 a démontré une augmentation de la survie sans progression de 6,6 mois à 9,6 mois (HR 0,68, p=0,017) chez les patients traités avec une chimiothérapie « site-spécifique » déterminée par la réalisation d’un test transcriptomique, comparativement aux patients traités par chimiothérapie empirique (Liu, Zhang et al., 2024). Dans cet essai qui a inclus 182 patients, les origines tissulaires les plus fréquemment identifiées par le test moléculaire étaient les carcinomes oeso-gastriques, bronchiques, ovariens et gynécologiques, et les carcinomes mammaires. Cet essai randomisé est le premier à démontrer le bénéfice des approches tissus-gnostiques dans la prise en charge des CAPI.
En France, la réalisation d’un profil transcriptomique pour identifier le tissu d’origine est accessible via le PFMG2025 et la RCP nationale CUP (cf. infra 24.9.1. ANNEXES : RCP nationale CUP).
24.4.3.2 Traitements basés sur le profil génomique indépendamment de l’origine tissulaire (approche tissu-agnostique)
En dehors des traitements basés sur l’origine tissulaire probable, les CAPI bénéficient également de traitements basés sur leurs profils moléculaires indépendamment de leur tissu d’origine dans le cadre d’une approche tissu-agnostique. Si le profil moléculaire des CAPI est très hétérogène, des altérations moléculaires potentiellement actionnables ont été rapportées chez près de la moitié des patients (Kato, Alsafar et al., 2021).
Le bénéfice d’une stratégie thérapeutique tissu-agnostique dans les CAPI vient d’être démontré par l’essai clinique de phase 2 randomisé CUPISCO, qui a évalué l’efficacité d’un traitement guidé par la biologie moléculaire versus une chimiothérapie empirique en première ligne de traitement dans les CAPI de pronostic défavorable (Kramer, Bochtler et al., 2024).
- Le design de l’essai recommandait l’initiation d’un traitement par doublet de sel de platine pendant 3 cycles, temps pendant lequel un profil génomique par panel DNAseq large était réalisé.
- Les patients présentant une maladie stable ou en réponse après la chimiothérapie d’induction étaient ensuite randomisés entre la poursuite de la chimiothérapie empirique ou l’administration d’un traitement basé sur leur profil génomique (PG).
- Pour les patients ne présentant pas d’altération ciblable et randomisés dans le groupe PG, la chimiothérapie empirique était poursuivie avec ajout d’une immunothérapie par atezolizumab à partir du 4ème cycle.
- Un total de 436 patients a été randomisés entre les deux groupes, et la PFS était significativement augmentée chez les patients du groupe PG (6,1 versus 4,4 mois, HR 0.72, p=0,0079), et particulièrement chez ceux ayant une altération moléculaire actionnable (8,1 versus 4,7 mois, HR 0,65).
Cet essai démontre pour la première fois le bénéfice de la réalisation d’un profil moléculaire précoce et d’une prise en charge thérapeutique personnalisée pour les patients atteints de CAPI de pronostic défavorable.
En France, la réalisation d’un profil génomique étendu à la recherche d’altérations actionnables peut être disponible en local sur les plateformes de génétique somatique, et également via la RCP nationale CUP et le PFMG2025 (cf. infra 24.9.1. ANNEXE : RCP nationale CUP).
24.4.4. Traitements loco-régionaux
Les possibilités et indications de traitements loco-régionaux des CAPI ne concernent qu’une minorité de patients et doivent être discutés au cas par cas en RCP spécialisée.
24.4.4.1. Métastases péritonéales (cf., Algorithme 24.8.2)
Le traitement local des métastases péritonéales de CAPI ne doit s’envisager qu’en cas de maladie péritonéale isolée et résécable, chez les patients avec un état général et nutritionnel conservé, et de préférence après validation en RCP spécialisée RENAPE.
Les patients atteints de métastases péritonéales isolées et résécables sont potentiellement éligibles à une cytoréduction péritonéale complète associée ou non à une CHIP. Cependant, le bénéfice d’une telle approche dans les CAPI repose essentiellement sur des analogies avec d’autres entités tumorales comme les cancers colorectaux et de l’ovaire.
- Dans une série historique, un primitif occulte appendiculaire était identifié en per-opératoire dans un tiers des cas de patients présentant des métastases péritonéales de CAPI (Sugarbaker, 2020). Dans cette situation, une chirurgie d’exérèse de la tumeur primitive associée à une cytoréduction péritonéale et à une CHIP doit être proposée (Delhorme, Villeneuve et al., 2022).
- En cas d’absence de primitif retrouvé, y compris en examinant l’intestin grêle à la recherche d’une petite lésion, il faut réaliser une cytoréduction des sites de carcinoses, y associer une omentectomie totale et discuter de l’ovariectomie bilatérale car il existe un risque difficilement quantifiable) de lésion intra ovarienne.
- L’utilisation d’une CHIP doit être discutée selon les gestes réalisés, en contrôlant la morbidité et avec un protocole mitomycine, puisque cette drogue a le plus large spectre d’utilisation en pathologie péritonéale et ne génère habituellement pas de risque spécifique.
- En cas de traitement à but palliatif :
- l’utilisation d’une association de chimiothérapie intra péritonéale et systémique peut être discutée, par KT intra-péritonéal ou PIPAC, mais aucune recommandation ne peut être formulée par absence de cas rapporté ;
- une annexectomie bilatérale peut être proposée à visée symptomatique.
24.4.4.2. Métastases hépatiques
Il n’existe aucune donnée concernant le bénéfice d’une approche chirurgicale ou d’un traitement par radiofréquence ou radiothérapie stéréotaxique dans cette situation, ni sur l’intérêt d’un traitement systémique néoadjuvant dans les métastases hépatiques de CAPI.
- Cependant, il est reconnu que certains patients présentant une maladie oligo-métastatique (< 5 métastases et absence d’atteinte des séreuses) accessible à un traitement chirurgical ou ablatif de l’ensemble des lésions peuvent bénéficier de ce type d’approche (Pavlidis, Petrakis et al., 2012; Pouyiourou, Wohlfromm et al., 2021).
- Dans tous les cas, le traitement local des métastases hépatiques devra être précédé d’un bilan pré-thérapeutique étendu associant PET-TDM au 18-FDG et IRM cérébrale pour éliminer toute localisation métastatique pouvant remettre en cause la stratégie thérapeutique locorégionale (Kramer, Bochtler et al., 2023).
24.5. Indications thérapeutiques (cf. 24.8.3. Algorithme 2)
24.5.1. Indications thérapeutiques des traitements systémiques
REFERENCE
- Chimiothérapie à base de sel de platine en l’absence d’orientation diagnostique pathologique ou moléculaire (niveau de recommandation grade B)
OPTIONS
- Traitement systémique orienté sur le tissu d’origine ou une altération moléculaire actionnable après validation en RCP « nationale » CUP ou RCP « locale » moléculaire (niveau de recommandation grade B)
- Si dMMR/MSI-H ou TMB> 10/Mb : immunothérapie anti-PD1 après validation en RCP « nationale » CUP ou RCP « locale » moléculaire (avis d’experts)
- PS 3-4 : soins de supports exclusifs (accord d’experts)
ESSAI CLINIQUE
- FOLFIRINEC (PRODIGE 69) : Essai de phase II randomisé du FOLFIRINOX versus platine-étoposide en 1ère ligne de traitement des carcinomes neuroendocrines peu différenciés de grade 3 métastatiques gastro-entéro-pancréatiques et de primitif inconnu associé à l'établissement d'un profil moléculaire (Coordonnateur Dr Julien Hadoux, Villejuif). https://www.reseau-gte.org/protocole/folfiri-nec/
24.5.2. Indications thérapeutiques des traitements loco-régionaux
REFERENCE
- Aucune
OPTIONS
- Si maladie péritonéale isolée résécable après validation en RCP RENAPE : cytoréduction péritonéale +/- CHIP (avis d’experts)
- Si atteinte oligo-métastatique hépatique isolée et accessible à un traitement local de toutes les lésions : chirurgie ou radiothérapie stéréotaxique ou radiofréquence (avis d’experts)
ESSAI CLINIQUE
- Aucun
24.6. Surveillance post-thérapeutique
Peu de données sont disponibles sur les modalités de surveillance des CAPI.
- Pour les patients sous traitement systémique, une évaluation de l’efficacité du traitement tous les deux à trois mois par examen clinique et imagerie (tomodensitométrie ou IRM) est le plus souvent recommandée, sous réserve que l’état général et les critères biologiques soient compatibles avec la poursuite d’un traitement anti-cancéreux (Kramer, Bochtler et al., 2023).
Certains patients présentant des CAPI oligo-métastatiques ou de forme histologique au pronostic favorable ont parfois des survies prolongées, mais cette situation est rare dans le cas des métastases hépatiques et péritonéales, classiquement associées à un pronostic défavorable (Culine, Kramar et al., 2002). - Pour les patients ayant pu bénéficier d’un traitement loco-régional à visée curative d’une maladie oligo-métastatique, il n’existe pas de consensus sur les modalités et la durée de la surveillance. Une évaluation radiologique trimestrielle pendant au moins 5 ans est cependant classiquement recommandée.
REFERENCE
- Aucune
OPTIONS
- Surveillance radiologique TDM ou IRM tous les 2 à 3 mois sous traitement (accord d’experts)
- Après thérapie à visée curative, évaluation radiologique trimestrielle pendant au moins 5 ans (accord d’experts)
24.7. Protocoles de traitements systémiques
CISGEM (cisplatine-gemcitabine)
- J1 et J8 cisplatine 25 mg/m² en 1 h dans 1 litre de sérum physiologique + 20 mmol de chlorure de potassium, et 8 mmol de sulfate de magnésium à J1 et J8
- puis hydratation réduite (500 ml de sérum physiologique).
- puis gemcitabine 1000 mg/m2 en perfusion de 30 min dans 250 ml de sérum physiologique
Traitement reproduit tous les 21 jours ( J1 = J21).
GEMOX (gemcitabine-oxaliplatine)
- J1 gemcitabine 1000 mg/m2 en perfusion de 100 min dans 250 ml de sérum physiologique
- J2 oxaliplatine 100 mg/m2 en 2 h dans 250 ml de G5%
Traitement reproduit tous les 14 jours.
GEMOX modifié (gemcitabine-oxaliplatine)
- J1 gemcitabine 1000 mg/m2 en perfusion de 30 min dans 250 ml de sérum physiologique
- puis oxaliplatine 100 mg/m2 en 2 h dans 250 ml de G5%
Traitement reproduit tous les 14 jours.
24.8. Arbres décionnels (Algorithmes)
24.8.1. Algorithme 1 : Distinction de métastases hépatiques de site primitif inconnu d’un cholangiocarcinome intra-hépatique
24.8.2. Algorithme 2 : Conduite à tenir diagnostique devant des métastases péritonéales de site primitif inconnu
24.8.3. Algorithme 3 : Prise en charge médicale des métastases péritonéales/hépatiques de site primitif inconnu
24.9. Annexes : RCP
24.9.1. RCP nationale CUP
L’objectif de la RCP nationale CUP est l’organisation de la prise en charge des patients atteints d’un cancer métastatique d’emblée dont l’origine primitive n’a pu être déterminée sur les marqueurs histologiques indépendamment de l’avancement du cancer et des traitements reçus. Cette préindication est limitée aux nouveaux cas incidents.
La RCP nationale CUP est une RCP d’amont FMG 2025 pour valider des indications d’examens complémentaires et notamment la possibilité d’examens pan-génomiques selon les critères définis par le plan FMG 2025. Elle constitue aussi une RCP d’aval FMG 2025 pour discuter le rendu du résultat ainsi qu’une éventuelle prise en charge thérapeutique.

La RCP nationale CUP est bimensuelle, |
|---|
|
24.9.2. RCP RENAPE
https://www.renape-online.fr/rcp/
Les Réunions de Concertation Pluridisciplinaire « cancers rares » (RCPCR) suprarégionales et dédiées aux maladies primitives et métastatiques du péritoine sont organisées au sein du réseau RENAPE. Ces temps d’échanges, pluridisciplinaires, regroupent chirurgiens, oncologues médicaux, pathologistes et radiologues, tous spécialisés dans la prise en charge de ces cancers.
Tout médecin référent a la possibilité de saisir une RCPCR « RENAPE » dès lors qu’un choix médical pour un patient nécessite, de son point de vue, une analyse pluridisciplinaire de la situation. Dans ce contexte peuvent être abordées :
- une validation de proposition thérapeutique ;
- une validation d’un changement significatif de la thérapeutique ;
- une demande d’avis ou confirmation diagnostique.
La discussion en RCPCR peut s’effectuer soit par adressage direct par le médecin référent en premier examen, soit après un examen préalable par une autre RCP ou une RCP de recours en cas de doute préalable sur la classification du cancer du patient.
| RCP RENAPE Angers / Nantes Référent : Dr Frédéric DUMONT | 02 40 67 99 88 |
| RCP RENAPE Lyon Référent : Pr Olivier GLEHEN | 04 78 86 45 36 |
| RCP RENAPE Montpellier Référente : Dr Olivia SGARBURA | 04 67 61 30 90 |
| RCP RENAPE Nice Référente : Dr Anissa ABDERRAHIM-FERKOUNE | 04 92 03 63 36 |
| RCP RENAPE Océan Indien Référents : Pr Marc POCARD et Dr Marco NUNZIANTE | 01 42 17 56 12 |
RCP RENAPE Paris Institut Gustave Roussy APHP Hôpital Saint Louis |
01 42 17 56 12
|
24.10. Bibliographie
- Abbruzzese, J. L., M. C. Abbruzzese, K. R. Hess, M. N. Raber, R. Lenzi and P. Frost (1994). "Unknown primary carcinoma: natural history and prognostic factors in 657 consecutive patients." J Clin Oncol 12(6): 1272-1280.
- Ackroyd, S. A., L. Goetsch, J. Brown, K. Houck, C. Wang and E. Hernandez (2019). "Pancreaticobiliary metastasis presenting as primary mucinous ovarian neoplasm: A systematic literature review." Gynecol Oncol Rep 28: 109-115.
- Ayoub, J. P., K. R. Hess, M. C. Abbruzzese, R. Lenzi, M. N. Raber and J. L. Abbruzzese (1998). "Unknown primary tumors metastatic to liver." J Clin Oncol 16(6): 2105-2112.
- Bahrami, A., L. D. Truong and J. Y. Ro (2008). "Undifferentiated tumor: true identity by immunohistochemistry." Arch Pathol Lab Med 132(3): 326-348.
- Bereder, J. M., J. M. Classe, M. Ducreux, D. Elias, G. Ferron, F. Gilly, O. Glehen, G. Lorimier, P. Morice, S. Msika, M. Pocard and F. Quenet (2007). "[Expert agreement on the minimal descriptive surgical report for peritoneal cancer]." J Chir (Paris) 144(5): 463.
- Blaszyk, H., A. Hartmann and J. Bjornsson (2003). "Cancer of unknown primary: clinicopathologic correlations." APMIS 111(12): 1089-1094.
- Bourgioti, C., M. Konidari and L. A. Moulopoulos (2023). "Manifestations of Ovarian Cancer in Relation to Other Pelvic Diseases by MRI." Cancers (Basel) 15(7).
- Bozkurt, M. F., I. Virgolini, S. Balogova, M. Beheshti, D. Rubello, C. Decristoforo, V. Ambrosini, A. Kjaer, R. Delgado-Bolton, J. Kunikowska, W. J. G. Oyen, A. Chiti, F. Giammarile, A. Sundin and S. Fanti (2017). "Guideline for PET/CT imaging of neuroendocrine neoplasms with (68)Ga-DOTA-conjugated somatostatin receptor targeting peptides and (18)F-DOPA." Eur J Nucl Med Mol Imaging 44(9): 1588-1601.
- Choi, J., J. H. Nahm and S. K. Kim (2017). "Prognostic clinicopathologic factors in carcinoma of unknown primary origin: a study of 106 consecutive cases." Oncotarget 8(37): 62630-62640.
- Choi, W. T., R. Ramachandran and S. Kakar (2017). "Immunohistochemical approach for the diagnosis of a liver mass on small biopsy specimens." Hum Pathol 63: 1-13.
- Conner, J. R. and J. L. Hornick (2015). "Metastatic carcinoma of unknown primary: diagnostic approach using immunohistochemistry." Adv Anat Pathol 22(3): 149-167.
- Culine, S., A. Kramar, M. Saghatchian, R. Bugat, T. Lesimple, A. Lortholary, Y. Merrouche, A. Laplanche, K. Fizazi and P. French Study Group on Carcinomas of Unknown (2002). "Development and validation of a prognostic model to predict the length of survival in patients with carcinomas of an unknown primary site." J Clin Oncol 20(24): 4679-4683.
- Culine, S., A. Lortholary, J. J. Voigt, R. Bugat, C. Theodore, F. Priou, M. C. Kaminsky, T. Lesimple, X. Pivot, B. Coudert, J. Y. Douillard, Y. Merrouche, J. Allouache, A. Goupil, S. Negrier, J. Viala, P. Petrow, J. Bouzy, A. Laplanche, K. Fizazi and P. Trial for the French Study Group on Carcinomas of Unknown (2003). "Cisplatin in combination with either gemcitabine or irinotecan in carcinomas of unknown primary site: results of a randomized phase II study--trial for the French Study Group on Carcinomas of Unknown Primary (GEFCAPI 01)." J Clin Oncol 21(18): 3479-3482.
- de Mestier, L., C. Lepage, E. Baudin, R. Coriat, F. Courbon, A. Couvelard, C. Do Cao, E. Frampas, S. Gaujoux, R. Gincul, P. Goudet, C. Lombard-Bohas, G. Poncet, D. Smith, P. Ruszniewski, T. Lecomte, O. Bouche, T. Walter, G. Cadiot and D. Thesaurus National de Cancerologie (2020). "Digestive Neuroendocrine Neoplasms (NEN): French Intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, GTE, RENATEN, TENPATH, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SFR)." Dig Liver Dis 52(5): 473-492.
- Delhorme, J. B., L. Villeneuve, O. Bouche, G. Averous, A. Dohan, J. M. Gornet, B. You, F. Bibeau, P. Dartigues, C. Eveno, J. Fontaine, V. Kepenekian, M. Pocard, P. Rousset, F. Quenet, P. Mariani, O. Glehen and D. Goere (2022). "Appendiceal tumors and pseudomyxoma peritonei: French Intergroup Clinical Practice Guidelines for diagnosis, treatments and follow-up (RENAPE, RENAPATH, SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, SFR)." Dig Liver Dis 54(1): 30-39.
- Ding, Y., J. Jiang, J. Xu, Y. Chen, Y. Zheng, W. Jiang, C. Mao, H. Jiang, X. Bao, Y. Shen, X. Li, L. Teng and N. Xu (2022). "Site-specific therapy in cancers of unknown primary site: a systematic review and meta-analysis." ESMO Open 7(2): 100407.
- Dowell, J. E., A. M. Garrett, Y. Shyr, D. H. Johnson and K. R. Hande (2001). "A randomized Phase II trial in patients with carcinoma of an unknown primary site." Cancer 91(3): 592-597.
- Dragomir, A., M. de Wit, C. Johansson, M. Uhlen and F. Ponten (2014). "The role of SATB2 as a diagnostic marker for tumors of colorectal origin: Results of a pathology-based clinical prospective study." Am J Clin Pathol 141(5): 630-638.
- European Association for the Study of the, L. (2016). "EASL Clinical Practice Guidelines on the management of benign liver tumours." J Hepatol 65(2): 386-398.
- European Association for the Study of the, L. (2018). "EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma." J Hepatol 69(1): 182-236.
- Fizazi, K. (2006). "Treatment of patients with specific subsets of carcinoma of an unknown primary site." Ann Oncol 17 Suppl 10: x177-180.
- Flanagan, M., J. Solon, K. H. Chang, S. Deady, B. Moran, R. Cahill, C. Shields and J. Mulsow (2018). "Peritoneal metastases from extra-abdominal cancer - A population-based study." Eur J Surg Oncol 44(11): 1811-1817.
- Gatalica, Z., J. Xiu, J. Swensen and S. Vranic (2018). "Comprehensive analysis of cancers of unknown primary for the biomarkers of response to immune checkpoint blockade therapy." Eur J Cancer 94: 179-186.
- Golfinopoulos, V., G. Pentheroudakis, G. Salanti, A. D. Nearchou, J. P. Ioannidis and N. Pavlidis (2009). "Comparative survival with diverse chemotherapy regimens for cancer of unknown primary site: multiple-treatments meta-analysis." Cancer Treat Rev 35(7): 570-573.
- Gonzalez-Martin, A., B. Pothuri, I. Vergote, R. DePont Christensen, W. Graybill, M. R. Mirza, C. McCormick, D. Lorusso, P. Hoskins, G. Freyer, K. Baumann, K. Jardon, A. Redondo, R. G. Moore, C. Vulsteke, R. E. O'Cearbhaill, B. Lund, F. Backes, P. Barretina-Ginesta, A. F. Haggerty, M. J. Rubio-Perez, M. S. Shahin, G. Mangili, W. H. Bradley, I. Bruchim, K. Sun, I. A. Malinowska, Y. Li, D. Gupta, B. J. Monk and P. E.-O. G.-. Investigators (2019). "Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer." N Engl J Med 381(25): 2391-2402.
- Goodman, M. T. and Y. B. Shvetsov (2009). "Incidence of ovarian, peritoneal, and fallopian tube carcinomas in the United States, 1995-2004." Cancer Epidemiol Biomarkers Prev 18(1): 132-139.
- Goyal, L., F. Meric-Bernstam, A. Hollebecque, J. W. Valle, C. Morizane, T. B. Karasic, T. A. Abrams, J. Furuse, R. K. Kelley, P. A. Cassier, H. J. Klumpen, H. M. Chang, L. T. Chen, J. Tabernero, D. Y. Oh, A. Mahipal, M. Moehler, E. P. Mitchell, Y. Komatsu, K. Masuda, D. Ahn, R. S. Epstein, A. B. Halim, Y. Fu, T. Salimi, V. Wacheck, Y. He, M. Liu, K. A. Benhadji, J. A. Bridgewater and F.-C. S. Investigators (2023). "Futibatinib for FGFR2-Rearranged Intrahepatic Cholangiocarcinoma." N Engl J Med 388(3): 228-239.
- Greco, F. A., J. B. Erland, L. H. Morrissey, H. A. Burris, 3rd, R. C. Hermann, R. Steis, D. Thompson, J. Gray and J. D. Hainsworth (2000). "Carcinoma of unknown primary site: phase II trials with docetaxel plus cisplatin or carboplatin." Ann Oncol 11(2): 211-215.
- Hainsworth, J. D. and K. Fizazi (2009). "Treatment for patients with unknown primary cancer and favorable prognostic factors." Semin Oncol 36(1): 44-51.
- Hainsworth, J. D., D. R. Spigel, H. A. Burris, 3rd, D. Shipley, C. Farley, I. M. Macias-Perez, J. Barton and F. A. Greco (2010). "Oxaliplatin and capecitabine in the treatment of patients with recurrent or refractory carcinoma of unknown primary site: a phase 2 trial of the Sarah Cannon Oncology Research Consortium." Cancer 116(10): 2448-2454.
- Hainsworth, J. D., D. R. Spigel, C. Farley, D. S. Thompson, D. L. Shipley, F. A. Greco and N. Minnie Pearl Cancer Research (2007). "Phase II trial of bevacizumab and erlotinib in carcinomas of unknown primary site: the Minnie Pearl Cancer Research Network." J Clin Oncol 25(13): 1747-1752.
- Holtan, S. G., P. D. Steen, N. R. Foster, C. Erlichman, F. Medeiros, M. M. Ames, S. L. Safgren, D. L. Graham, R. J. Behrens and M. P. Goetz (2012). "Gemcitabine and irinotecan as first-line therapy for carcinoma of unknown primary: results of a multicenter phase II trial." PLoS One 7(7): e39285.
- Jacquin, N., M. Kamal, C. Le Tourneau and S. Watson (2022). "Cancer of unknown primary: a national multidisciplinary consultation board for diagnostic and therapeutic orientation." Innovations & Thérapeutiques en Oncologie 8(6): 295-298.
- Kato, M. K., D. Shida, Y. Yoneoka, H. Yoshida, N. Miyasaka, Y. Kanemitsu and T. Kato (2020). "Novel classification of ovarian metastases originating from colorectal cancer by radiological imaging and macroscopic appearance." Int J Clin Oncol 25(9): 1663-1671.
- Kato, S., A. Alsafar, V. Walavalkar, J. Hainsworth and R. Kurzrock (2021). "Cancer of unknown primary in the molecular era." Trends in cancer 7(5): 465-477.
- Kato, S., N. Krishnamurthy, K. C. Banks, P. De, K. Williams, C. Williams, B. Leyland-Jones, S. M. Lippman, R. B. Lanman and R.
- Kurzrock (2017). "Utility of Genomic Analysis In Circulating Tumor DNA from Patients with Carcinoma of Unknown Primary." Cancer Res 77(16): 4238-4246.
- Katoh, M., Y. Loriot, G. Brandi, S. Tavolari, Z. A. Wainberg and M. Katoh (2024). "FGFR-targeted therapeutics: clinical activity, mechanisms of resistance and new directions." Nat Rev Clin Oncol 21(4): 312-329.
- Kim, Y. Y., S. K. Yeom, H. Shin, S. H. Choi, H. Rhee, J. H. Park, E. S. Cho, S. Park, S. S. Lee and M. S. Park (2021). "Clinical Staging of Mass-Forming Intrahepatic Cholangiocarcinoma: Computed Tomography Versus Magnetic Resonance Imaging." Hepatol Commun 5(12): 2009-2018.
- Kovac, J. D., A. Jankovic, A. Dikic-Rom, N. Grubor, A. Antic and V. Dugalic (2022). "Imaging Spectrum of Intrahepatic Mass-Forming Cholangiocarcinoma and Its Mimickers: How to Differentiate Them Using MRI." Curr Oncol 29(2): 698-723.
- Kramer, A., T. Bochtler, C. Pauli, G. Baciarello, S. Delorme, K. Hemminki, L. Mileshkin, H. Moch, K. Oien, T. Olivier, A. Patrikidou, H. Wasan, G. Zarkavelis, G. Pentheroudakis, K. Fizazi and E. G. C. E. a. clinicalguidelines@esmo.org (2023). "Cancer of unknown primary: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up." Ann Oncol 34(3): 228-246.
- Kramer, A., T. Bochtler, C. Pauli, K. K. Shiu, N. Cook, J. J. de Menezes, R. A. Pazo-Cid, F. Losa, D. G. Robbrecht, J. Tomasek, C. Arslan, M. Ozguroglu, M. Stahl, F. Bigot, S. Y. Kim, Y. Naito, A. Italiano, N. Chalabi, G. Duran-Pacheco, C. Michaud, J. Scarato, M. Thomas, J. S. Ross, H. Moch and L. Mileshkin (2024). "Molecularly guided therapy versus chemotherapy after disease control in unfavourable cancer of unknown primary (CUPISCO): an open-label, randomised, phase 2 study." Lancet 404(10452): 527-539.
- Kurokawa, R., Y. Nakai, W. Gonoi, H. Mori, T. Tsuruga, N. Makise, T. Ushiku and O. Abe (2020). "Differentiation between ovarian metastasis from colorectal carcinoma and primary ovarian carcinoma: Evaluation of tumour markers and "mille-feuille sign" on computed tomography/magnetic resonance imaging." Eur J Radiol 124: 108823.
- Le Chevalier, T., E. Cvitkovic, P. Caille, J. Harvey, G. Contesso, M. Spielmann and J. Rouesse (1988). "Early metastatic cancer of unknown primary origin at presentation. A clinical study of 302 consecutive autopsied patients." Arch Intern Med 148(9): 2035-2039.
- Lin, F., J. Shi, S. Zhu, Z. Chen, A. Li, T. Chen, H. L. Wang and H. Liu (2014). "Cadherin-17 and SATB2 are sensitive and specific immunomarkers for medullary carcinoma of the large intestine." Arch Pathol Lab Med 138(8): 1015-1026.
- Liu, X., X. Zhang, S. Jiang, M. Mo, Q. Wang, Y. Wang, L. Zhou, S. Hu, H. Yang, Y. Hou, Y. Chen, X. Lu, Y. Wang, X. Zhou, W. Li, C. Chang, X. Yang, K. Chen, J. Cao, Q. Xu, Y. Sun, J. Luo, Z. Luo and X. Hu (2024). "Site-specific therapy guided by a 90-gene expression assay versus empirical chemotherapy in patients with cancer of unknown primary (Fudan CUP-001): a randomised controlled trial." Lancet Oncol 25(8): 1092-1102.
- Lobo, J., B. Machado, R. Vieira and C. Bartosch (2017). "The challenge of diagnosing a malignancy metastatic to the ovary: clinicopathological characteristics vary and morphology can be different from that of the corresponding primary tumor." Virchows Arch 470(1): 69-80.
- Losa, F., I. Fernández, O. Etxaniz, A. Giménez, P. Gomila, L. Iglesias, F. Longo, E. Nogales, A. Sánchez and G. Soler (2022). "SEOM—GECOD clinical guideline for unknown primary cancer (2021)." Clinical and Translational Oncology 24(4): 681-692.
- Lugli, A., A. Tzankov, I. Zlobec and L. M. Terracciano (2008). "Differential diagnostic and functional role of the multi-marker phenotype CDX2/CK20/CK7 in colorectal cancer stratified by mismatch repair status." Mod Pathol 21(11): 1403-1412.
- Ma, H., Y. Kan and J. G. Yang (2021). "Clinical value of (68)Ga-DOTA-SSTR PET/CT in the diagnosis and detection of neuroendocrine tumors of unknown primary origin: a systematic review and meta-analysis." Acta Radiol 62(9): 1217-1228.
- Massard, C., Y. Loriot and K. Fizazi (2011). "Carcinomas of an unknown primary origin--diagnosis and treatment." Nat Rev Clin Oncol 8(12): 701-710.
- Massard, C., Y. Loriot and K. Fizazi (2011). "Carcinomas of an unknown primary origin—diagnosis and treatment." Nature reviews Clinical oncology 8(12): 701-710.
- Mohrmann, L., M. Werner, M. Oles, A. Mock, S. Uhrig, A. Jahn, S. Kreutzfeldt, M. Frohlich, B. Hutter, N. Paramasivam, D. Richter, K. Beck, U. Winter, K. Pfutze, C. E. Heilig, V. Teleanu, D. B. Lipka, M. Zapatka, D. Hanf, C. List, M. Allgauer, R. Penzel, G. Ruter, I. Jelas, R. Hamacher, J. Falkenhorst, S. Wagner, C. H. Brandts, M. Boerries, A. L. Illert, K. H. Metzeler, C. B. Westphalen, A. Desuki, T. Kindler, G. Folprecht, W. Weichert, B. Brors, A. Stenzinger, E. Schrock, D. Hubschmann, P. Horak, C. Heining, S. Frohling and H. Glimm (2022). "Comprehensive genomic and epigenomic analysis in cancer of unknown primary guides molecularly-informed therapies despite heterogeneity." Nat Commun 13(1): 4485.
- Molinie, V. (2008). "[The role of the pathologist in the diagnosis of metastases from urological malignancies]." Prog Urol 18 Suppl 7: S178-195.
- Moschetta, M., A. George, S. B. Kaye and S. Banerjee (2016). "BRCA somatic mutations and epigenetic BRCA modifications in serous ovarian cancer." Ann Oncol 27(8): 1449-1455.
- Neri, E., M. A. Bali, A. Ba-Ssalamah, P. Boraschi, G. Brancatelli, F. C. Alves, L. Grazioli, T. Helmberger, J. M. Lee, R. Manfredi, L. Marti-Bonmati, C. Matos, E. M. Merkle, B. Op De Beeck, W. Schima, S. Skehan, V. Vilgrain, C. Zech and C. Bartolozzi (2016). "ESGAR consensus statement on liver MR imaging and clinical use of liver-specific contrast agents." Eur Radiol 26(4): 921-931.
- Neumann, K. H. and J. S. Nystrom (1982). "Metastatic cancer of unknown origin: nonsquamous cell type." Semin Oncol 9(4): 427-434.
- Neuzillet, C., S. Gaujoux, N. Williet, J. B. Bachet, L. Bauguion, L. Colson Durand, T. Conroy, L. Dahan, M. Gilabert, F. Huguet, L. Marthey, J. Meilleroux, L. de Mestier, B. Napoleon, F. Portales, A. Sa Cunha, L. Schwarz, J. Taieb, B. Chibaudel, O. Bouche, P. Hammel, D. Thesaurus National de Cancerologie, (2018). "Pancreatic cancer: French clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, AFC)." Dig Liver Dis 50(12): 1257-1271.
- Olsen, J., S. Eiholm, L. T. Kirkeby, M. L. Espersen, P. Jess, I. Gogenur, J. Olsen and J. T. Troelsen (2016). "CDX2 downregulation is associated with poor differentiation and MMR deficiency in colon cancer." Exp Mol Pathol 100(1): 59-66.
- Ozcan, A., S. S. Shen, C. Hamilton, K. Anjana, D. Coffey, B. Krishnan and L. D. Truong (2011). "PAX 8 expression in non-neoplastic tissues, primary tumors, and metastatic tumors: a comprehensive immunohistochemical study." Mod Pathol 24(6): 751-764.
- Pavlidis, N. and G. Pentheroudakis (2012). "Cancer of unknown primary site." Lancet 379(9824): 1428-1435.
- Pavlidis, N., D. Petrakis, V. Golfinopoulos and G. Pentheroudakis (2012). "Long-term survivors among patients with cancer of unknown primary." Crit Rev Oncol Hematol 84(1): 85-92.
- Pouyiourou, M., T. Wohlfromm, B. Kraft, T. Hielscher, D. Stichel, A. von Deimling, S. Delorme, V. Endris, O. Neumann, A. Stenzinger, A. Kramer and T. Bochtler (2021). "Local ablative treatment with surgery and/or radiotherapy in single-site and oligometastatic carcinoma of unknown primary." Eur J Cancer 157: 179-189.
- Qi, P., Y. Sun, X. Liu, S. Wu, Y. Wo, Q. Xu, Q. Wang, X. Hu and X. Zhou (2023). "Clinicopathological, molecular and prognostic characteristics of cancer of unknown primary in China: An analysis of 1420 cases." Cancer Med 12(2): 1177-1188.
- Queisser, A., S. A. Hagedorn, M. Braun, W. Vogel, S. Duensing and S. Perner (2015). "Comparison of different prostatic markers in lymph node and distant metastases of prostate cancer." Mod Pathol 28(1): 138-145.
- Rassy, E. and F. Andre (2024). "New clinical trials in CUP and a novel paradigm in cancer classification." Nat Rev Clin Oncol.
- Rassy, E., T. Assi, S. Boussios, J. Kattan, J. Smith-Gagen and N. Pavlidis (2020). "Narrative review on serous primary peritoneal carcinoma of unknown primary site: four questions to be answered." Ann Transl Med 8(24): 1709.
- Rassy, E., T. Assi and N. Pavlidis (2020). "Exploring the biological hallmarks of cancer of unknown primary: where do we stand today?" Br J Cancer 122(8): 1124-1132.
- Rassy, E. and N. Pavlidis (2019). "The currently declining incidence of cancer of unknown primary." Cancer Epidemiol 61: 139-141.
- Ross, J. S., E. S. Sokol, H. Moch, L. Mileshkin, G. Baciarello, F. Losa, A. Beringer, M. Thomas, J. A. Elvin and N. Ngo (2021). "Comprehensive genomic profiling of carcinoma of unknown primary origin: retrospective molecular classification considering the CUPISCO study design." The oncologist 26(3): e394-e402.
- Ross, J. S., K. Wang, L. Gay, G. A. Otto, E. White, K. Iwanik, G. Palmer, R. Yelensky, D. M. Lipson, J. Chmielecki, R. L. Erlich, A. N.
- Rankin, S. M. Ali, J. A. Elvin, D. Morosini, V. A. Miller and P. J. Stephens (2015). "Comprehensive Genomic Profiling of Carcinoma of Unknown Primary Site: New Routes to Targeted Therapies." JAMA Oncol 1(1): 40-49.
- Roy, S., M. A. Smith, K. M. Cieply, M. B. Acquafondata and A. V. Parwani (2012). "Primary bladder adenocarcinoma versus metastatic colorectal adenocarcinoma: a persisting diagnostic challenge." Diagn Pathol 7: 151.
- Salaun, P. Y., R. Abgral, O. Malard, S. Querellou-Lefranc, G. Quere, M. Wartski, R. Coriat, E. Hindie, D. Taieb, A. Tabarin, A. Girard, J. F. Grellier, I. Brenot-Rossi, D. Groheux, C. Rousseau, D. Deandreis, J. L. Alberini, C. Bodet-Milin, E. Itti, O. Casasnovas, F. Kraeber-Bodere, P. Moreau, A. Philip, C. Balleyguier, A. Lucian and F. Cachin (2019). "[Update of the recommendations of good clinical practice for the use of PET in oncology]." Bull Cancer 106(3): 262-274.
- Sheridan, T., M. Herawi, J. I. Epstein and P. B. Illei (2007). "The role of P501S and PSA in the diagnosis of metastatic adenocarcinoma of the prostate." Am J Surg Pathol 31(9): 1351-1355.
- Skinnider, B. F. and M. B. Amin (2005). "An immunohistochemical approach to the differential diagnosis of renal tumors." Semin Diagn Pathol 22(1): 51-68.
- Skirnisdottir, I., H. Garmo and L. Holmberg (2007). "Non-genital tract metastases to the ovaries presented as ovarian tumors in Sweden 1990-2003: occurrence, origin and survival compared to ovarian cancer." Gynecol Oncol 105(1): 166-171.
- Spencer, J. A., M. J. Weston, S. A. Saidi, N. Wilkinson and G. D. Hall (2010). "Clinical utility of image-guided peritoneal and omental biopsy." Nat Rev Clin Oncol 7(11): 623-631.
- Spigel, D. R., J. D. Hainsworth and F. A. Greco (2009). "Neuroendocrine carcinoma of unknown primary site." Semin Oncol 36(1): 52-59.
- Sugarbaker, P. H. (2020). "Peritoneal carcinomatosis of unknown primary site, a study of 25 patients over 30 years." Eur J Surg Oncol 46(10 Pt A): 1908-1911.
- Tanizaki, J., K. Yonemori, K. Akiyoshi, H. Minami, H. Ueda, Y. Takiguchi, Y. Miura, Y. Segawa, S. Takahashi, Y. Iwamoto, Y. Kidera, K. Fukuoka, A. Ito, Y. Chiba, K. Sakai, K. Nishio, K. Nakagawa and H. Hayashi (2022). "Open-label phase II study of the efficacy of nivolumab for cancer of unknown primary." Ann Oncol 33(2): 216-226.
- Taylor, E. C., L. Irshaid and M. Mathur (2021). "Multimodality Imaging Approach to Ovarian Neoplasms with Pathologic Correlation." Radiographics 41(1): 289-315.
- Thelissen, A. A. B., I. M. Jurgenliemk-Schulz, F. van der Leij, M. Peters, C. G. Gerestein, R. P. Zweemer and P. S. N. van Rossum (2022). "Upstaging by para-aortic lymph node dissection in patients with locally advanced cervical cancer: A systematic review and meta-analysis." Gynecol Oncol 164(3): 667-674.
- Thomassen, I., R. H. Verhoeven, Y. R. van Gestel, A. J. van de Wouw, V. E. Lemmens and I. H. de Hingh (2014). "Population-based incidence, treatment and survival of patients with peritoneal metastases of unknown origin." Eur J Cancer 50(1): 50-56.
- Thomassin-Naggara, I., M. Belghitti, A. Milon, C. Abdel Wahab, E. Sadowski, A. G. Rockall and E. s. group (2021). "O-RADS MRI score: analysis of misclassified cases in a prospective multicentric European cohort." Eur Radiol 31(12): 9588-9599.
Trullas, A., J. Delgado, A. Genazzani, J. Mueller-Berghaus, C. Migali, S. Muller-Egert, H. Zander, H. Enzmann and F. Pignatti (2021). "The EMA assessment of pembrolizumab as monotherapy for the first-line treatment of adult patients with metastatic microsatellite instability-high or mismatch repair deficient colorectal cancer." ESMO Open 6(3): 100145. - Vandecaveye, V., P. Rousset, S. Nougaret, A. Stepanyan, M. Otero-Garcia, O. Nikolic, M. Hameed, K. Goffin, I. H. J. de Hingh, M. J. Lahaye, G. European Society of, R. Abdominal, R. European Society of Urogenital, I. Peritoneal Surface Oncology Group and M. European Association of Nuclear (2024). "Imaging of peritoneal metastases of ovarian and colorectal cancer: joint recommendations of ESGAR, ESUR, PSOGI, and EANM." Eur Radiol.
- Varadhachary, G. R. and M. N. Raber (2014). "Cancer of unknown primary site." N Engl J Med 371(8): 757-765.
Varadhachary, G. R., M. N. Raber, A. Matamoros and J. L. Abbruzzese (2008). "Carcinoma of unknown primary with a colon-cancer profile-changing paradigm and emerging definitions." Lancet Oncol 9(6): 596-599. - Varghese, A. M., A. Arora, M. Capanu, N. Camacho, H. H. Won, A. Zehir, J. Gao, D. Chakravarty, N. Schultz, D. S. Klimstra, M. Ladanyi, D. M. Hyman, D. B. Solit, M. F. Berger and L. B. Saltz (2017). "Clinical and molecular characterization of patients with cancer of unknown primary in the modern era." Ann Oncol 28(12): 3015-3021.
- Vibert, J., G. Pierron, C. Benoist, N. Gruel, D. Guillemot, A. Vincent-Salomon, C. Le Tourneau, A. Livartowski, O. Mariani, S. Baulande, F. C. Bidard, O. Delattre, J. J. Waterfall and S. Watson (2021). "Identification of Tissue of Origin and Guided Therapeutic Applications in Cancers of Unknown Primary Using Deep Learning and RNA Sequencing (TransCUPtomics)." J Mol Diagn 23(10): 1380-1392.
- Villeneuve, L., G. Passot, O. Glehen, S. Isaac, F. Bibeau, P. Rousset, F. N. Gilly and R. Network (2017). "The RENAPE observational registry: rationale and framework of the rare peritoneal tumors French patient registry." Orphanet J Rare Dis 12(1): 37.
- Willemse, J. R. J., D. M. J. Lambregts, S. Balduzzi, W. Schats, P. Snaebjornsson, S. Marchetti, M. A. Vollebergh, L. W. van Golen, Z. Cheung, W. V. Vogel, Z. Bodalal, S. Rostami, O. Gerke, T. Sivakumaran, R. G. H. Beets-Tan and M. J. Lahaye (2024). "Identifying the primary tumour in patients with cancer of unknown primary (CUP) using [(18)F]FDG PET/CT: a systematic review and individual patient data meta-analysis." Eur J Nucl Med Mol Imaging 52(1): 225-236.
- Xu, Y., J. Yang, Z. Zhang and G. Zhang (2015). "MRI for discriminating metastatic ovarian tumors from primary epithelial ovarian cancers." J Ovarian Res 8: 61.
- Yu, H., J. Wang, B. Wu, J. Li and R. Chen (2023). "Prognostic significance and risk factors for pelvic and para-aortic lymph node metastasis in type I and type II ovarian cancer: a large population-based database analysis." J Ovarian Res 16(1): 28.
- Zech, C. J., A. Ba-Ssalamah, T. Berg, H. Chandarana, G. Y. Chau, L. Grazioli, M. J. Kim, J. M. Lee, E. M. Merkle, T. Murakami, J. Ricke, B. S. C, B. Song, B. Taouli, K. Yoshimitsu and D. M. Koh (2020). "Consensus report from the 8th International Forum for Liver Magnetic Resonance Imaging." Eur Radiol 30(1): 370-382.
- Zhang, J. J., D. Y. Cao, J. X. Yang and K. Shen (2020). "Ovarian metastasis from nongynecologic primary sites: a retrospective analysis of 177 cases and 13-year experience." J Ovarian Res 13(1): 128.
- Zhao, Y., Z. Pan, S. Namburi, A. Pattison, A. Posner, S. Balachander, C. A. Paisie, H. V. Reddi, J. Rueter, A. J. Gill, S. Fox, K. P. S. Raghav, W. F. Flynn, R. W. Tothill, S. Li, R. K. M. Karuturi and J. George (2020). "CUP-AI-Dx: A tool for inferring cancer tissue of origin and molecular subtype using RNA gene-expression data and artificial intelligence." EBioMedicine 61: 103030.
- Zhou, X. X., H. H. Pan, A. Usman, F. Ji, X. Jin, W. X. Zhong and H. T. Chen (2015). "Endoscopic ultrasound-guided deep and large biopsy for diagnosis of gastric infiltrating tumors with negative malignant endoscopy biopsies." World J Gastroenterol 21(12): 3607-3613.

