19. Tumeurs de l'ampoule de Vater
(Dernière mise à jour le : )Groupe de travail et relecteurs
GROUPE DE TRAVAIL :
Vincent HAUTEFEUILLE (Coordonnateur, Amiens)
Sébastien GAUJOUX (Cornac, Paris)
Anne Laure BIGNON (Caen), Marine CAMUS (Paris), Jean-Baptiste CHEVAUX (Nancy), Romain CORIAT (Paris), Jérome CROS (Clichy), Aurélien DUPRE (Lyon), Julien EDELINE (Rennes), Florence HUGUET (Paris), Stéphane KOCH (Besançon), Bertrand NAPOLEON (Lyon), Cindy NEUZILLET (Saint Cloud), Géraldine PERKINS (Rennes), Jean Marc REGIMBEAU (Amiens), David SEFRIOUI (Rouen), Anthony TURPIN (Lille), Carole VITELLIUS (Angers), Marie Pierre VUILLERME (Clichy), Nicolas WILLIET (Saint Etienne)
RELECTEURS :
Thomas APARICIO (Paris), Olivier BOUCHE (Reims), Thierry CONROY (Nancy), Thierry LECOMTE (Tours), Marie MULLER (Nancy), Alain SAUVANET (Paris), Benoit TERRIS (Paris), Thomas WALTER (Lyon), Jean-Baptiste BACHET (Paris), Bachir ELIAS (Le Creusot), Bogdan BADIC (Brest), Louise BARBIER (Clichy), Julien CAHAIS (Rouen), Pierre-Emmanuel HENNERESSE (Flers), Radwan KASSIR (Sant Denis), Dine KORICHE (Fontainebleau), Sophie NAMBOT (Dijon), Stéphanie TRUANT (Lille)
Comment citer ce chapitre :
Hautefeuille V, Williet N, Turpin A, Napoleon B, Dupré A, Huguet F, Bignon AL, Camus M, Chevaux JB, Coriat R, Cros J, Edeline J, Koch S, Neuzillet C, Perkins G, Regimbeau JM, Sefrioui D, Vitellius C, Vullierme MP, Bouché O, Gaujoux S; Ampullary tumors: French Intergroup Clinical Practice Guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, UNICANCER, GERCOR, SFCD, SFED, ACHBT, AFC, SFRO, RENAPE, SNFCP, AFEF, SFP, SFR). Dig Liver Dis. 2024 Sep;56(9):1452-1460. doi: 10.1016/j.dld.2024.04.027. Epub 2024 Jun 6. PMID: 38845233.
19. 1. INTRODUCTION
19.1.1. Préambule
Il ne sera abordé dans ce chapitre que les adénomes et les adénocarcinomes de l’ampoule, en excluant de fait les cholangiocarcinomes distaux intrapancréatiques (cf. TNCD chapitre 8 Cancers des voies biliaires), les adénocarcinomes du pancréas envahissant l’ampoule (cf. TNCD chapitre 9 Cancer du pancréas), les tumeurs neuroendocrines et les MiNEN de l’ampoule (cf. TNCD chapitre 11 Tumeurs neuroendocrines digestives), les GIST (cf. TNCD chapitre 12 Tumeurs stromales gastro-intestinales) ainsi que les adénocarcinomes duodénaux pouvant envahir l’ampoule (cf. TNCD chapitre 13 Adénocarcinome de l’intestin grêle) ou autres tumeurs ampullaires rares comme les paragangliomes gangliocytiques.
19.1.2. Méthodologie
Ce travail est le fruit d’une synthèse issue des données de la littérature faite par un groupe de travail représentant plusieurs sociétés savantes : la Fédération Francophone de Cancérologie Digestive (FFCD), la Fédération Nationale des Centres de Lutte Contre le Cancer (UNICANCER), le Groupe Coopérateur multidisciplinaire en Oncologie (GERCOR), la Société Française de Chirurgie Digestive (SFCD), la Société Française d’Endoscopie Digestive (SFED), l’Association de Chirurgie Hépato-Bilio-Pancréatique et de Transplantation (ACHBT), de la Société Française de Chirurgie Digestive (SFCD), la Société Française de Radiothérapie Oncologique (SFRO), la Société Française de Pathologie (SFP), la Société Française de Pathologie (SFP), l'Association Française pour l’Etude du Foie (AFEF), le Réseau National de Référence des Tumeurs Rares du Péritoine (RENAPE), la Société Nationale Française de Gastroentérologie (SNFGE), et la Société Française de Radiologie (SFR). Il s’appuie sur les dernières recommandations publiées de l’European Society of Gastrointestinal Endoscopy (ESGE, Vanbiervliet G et al. 2021), du National Comprehensive Cancer Network (www.nccn.org, Chiorean E et al. Ampullary Carcinoma v1.2023), du réseau régional de Cancérologie OncoBFC et NEON (www.oncologik.fr, 2021) ainsi que sur une actualisation des données par une recherche bibliographique.
Celle-ci a reposé sur l'extraction, à partir de la base de données PubMed interrogée en juin 2023, des études cliniques et essais randomisés, méta-analyses et recommandations de pratique clinique avec les mots-clés « ampullary cancer », «ampullary tumor», « ampullary carcinoma », sans limitation de date.
Les présentes recommandations ont été gradées selon le niveau des preuves disponibles dans la littérature, correspondant à la présentation retenue pour le TNCD selon 4 niveaux (A, B, C, accord ou avis d’experts) résumés dans le tableau 1.
Tableau 1
Système de gradation des recommandations utilisé dans ce chapitre
| GRADE | NIVEAU DE PREUVE CORRESPONDANT |
|---|---|
| A | Recommandation forte basée par exemple sur un/des essai(s) comparatif(s) randomisé(s) de forte puissance, une/des méta-analyse d’essai(s) comparatif(s) randomisé(s), ou une analyse de décision fondée sur des études bien menées. |
| B | Recommandation basée sur une présomption scientifique à partir d’essais comparatifs randomisés de faible puissance, d’études comparatives non randomisées bien menées ou d’études de cohortes. |
| C | Recommandation basée sur un faible niveau de preuve à partir d’études cas-témoins, d’études comparatives comportant des biais importants, d’études rétrospectives, de séries de cas, d’études épidémiologiques descriptives (transversale, longitudinale). |
| Accord ou Avis d’experts | Recommandation basée sur un accord d’experts ou un avis d’experts en l’absence de données suffisantes de la littérature |
19.1.3. Terminologie
Le terme d’ampullome, largement utilisé, est imprécis car il englobe les lésions dysplasiques et les lésions adénocarcinomateuses. Par conséquent, le groupe de travail propose son abandon au profit des termes « adénome de l’ampoule » pour les lésions dysplasiques non invasives et « adénocarcinome de l’ampoule », terminologie que nous utiliserons dans ce chapitre, en précisant s’il s’agit de la papille duodénale majeure (ampoule de Vater) ou mineure. Cette évolution est également proposée par les recommandations américaines du NCCN qui intitule son chapitre « Ampullary adenocarcinoma ». De même, par souci de simplification, la classification asiatique d0/d1 doit être remplacée par la classification TNM (T1a/T1b).
Dans ce chapitre, l’adénome ampullaire sera abrégé en ADa et l’adénocarcinome ampullaire en ADKa.
19.1.4. Epidémiologie
- Les cancers de l’ampoule sont rares (0,06 % à 0,2 % des cancers digestifs sur des séries autopsiques). Dans la base de données américaine SEER (n=6803), l’incidence annuelle est de 0,59 pour 100 000 personnes, en légère augmentation (+0,9 %/an) avec une prédominance masculine (0,74 contre 0,48). L’incidence augmente après 50 ans et l’âge médian au diagnostic est de 71 ans. En France, des résultats similaires ont été observés à partir du registre bourguignon et après un suivi de 34 ans. Les ADKa représentent 0,6 % des cancers digestifs chez l’homme et 0,8 % chez la femme avec un taux d’incidence annuel de 0,83 et 0,75 pour 100 000 personnes, respectivement (Rostain F et al. 2014).
- Le diagnostic d’ADa ou d’ADKa peut être fait à un stade asymptomatique, de façon fortuite lors d’une endoscopie faite pour une autre indication ou lors d’un dépistage (polypose adénomateuse familiale, syndrome de Lynch). Cette lésion ampullaire peut aussi être symptomatique et se révéler par des signes obstructifs (ictère, angiocholite, pancréatite aiguë) ou un saignement digestif.
19.1.5. Anatomie de l’ampoule de Vater
De par sa localisation anatomique dans le duodénum, l’ampoule de Vater est un site anatomique complexe, avec une intrication de 3 épithelia : celui de la muqueuse duodénale et de l’épithelium ductal bordant les canaux pancréatiques et le canal biliaire principal.
- Elle est le plus souvent située à la face interne du 2ème duodénum, mais parfois dans le genu inferius ou le début du 3ème duodénum, au niveau d’une zone de faiblesse de la paroi sans musculeuse (musculaire propre du duodénum) laissant passer le conduit pancréatique (canal de Wirsung) et le canal biliaire terminal (cholédoque) pour fusionner et donner l’ampoule de Vater, entourée par le sphincter d’Oddi.
- L’absence de musculaire propre de la paroi duodénale à ce niveau explique la possibilité d’un diverticule au contact avec une ampoule intra ou para diverticulaire qui peut compliquer le diagnostic et la prise en charge.
- Les branches artérielles destinées à la papille sont les artères pancréatico-duodenales supérieures et inférieures et les artères communicantes.
- Les relais ganglionnaires locorégionaux sont les mêmes que pour la tête du pancréas (face antérieure et face postérieure).
- A noter que des ADa et ADKa peuvent avoir une topographie périampullaire, ampullaire ou endoampullaire ; ils peuvent exister au niveau de la papille mineure où se jette le canal de Santorini.
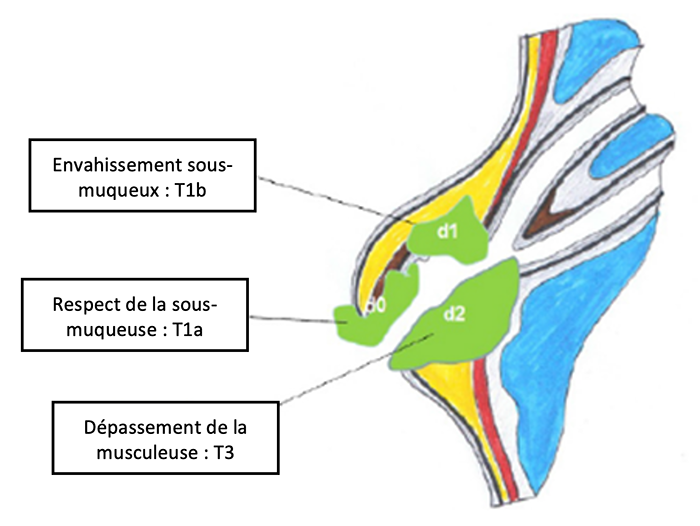
19.1.5.1. Nouvelle terminologie et classification
Comme il n’est pas toujours facile de savoir où se trouve la tumeur, l’ADK sera dit ampullaire s’il est centré par les canaux bilio-pancréatiques et dans le mur duodénal.
La précédente classification TNM n’était pas adaptée aux petits ADKa pT1 dont le risque ganglionnaire dépend principalement de l’envahissement de la sous-muqueuse.
- La classification asiatique dx séparait les ADKa pT1 d0 (pas d’envahissement de la sous-muqueuse) qui ne présentent pas de risque d’envahissement ganglionnaire (0 %) et les ADKa pT1 d1 (avec envahissement de la sous-muqueuse) qui présentent un risque d’envahissement ganglionnaire de 24 % (Kim SJ et al. 2018).
- Cette sous-classification est dorénavant incluse dans la 8ème classification AJCC de 2017.
- Le groupe de travail propose donc d’utiliser exclusivement la dernière classification AJCC.
- La terminologie pT1 d0 est ainsi à remplacer par pT1a et pT1 d1 par pT1b.
Tableau 2
Equivalence classification dx / AJCC 2017
| Critères dx | AJCC 2017 | |
|---|---|---|
| Atteinte muqueuse | d0 | pT1a |
| Envahissement de la sous-muqueuse | d1 | pT1b |
| Envahissement +/- franchissement de musculeuse | d2 | pT2-T3 |
NB : la structure histologique pour l’évaluation du stade T2 est la musculeuse ou musculaire propre (couche rouge du schéma), correspondant à la 4ème couche hypoéchogène en écho-endoscopie. Elle ne doit pas être confondue avec la musculaire muqueuse (couche noire sur le schéma) entre la muqueuse et la sous-muqueuse.
19.1.5.2. Classification TNM et stade
Tableau 3
Classification TNM-UICC-AJCC (8ème édition 2017) des cancers de l’ampoule
| T | Critères |
| Tx | Non évaluable |
| T0 | Pas de tumeur primitive |
| Tis | Carcinome in situ / dysplasie de haut grade |
T1a T1b | Tumeur limitée à l'ampoule de Vater ou au sphincter d'Oddi Tumeur dépassant le sphincter d'Oddi (invasion péri-sphnictérienne) |
| T2 | Tumeur envahissant la musculeuse (muscularis propria) du duodénum |
T3 T3a T3b | Tumeut envahissant le pancréas Envahissement ≤ 5 mm dans le pancréas Envahissement > 5 mm dans le pancréas, ou envahissant le tissu péri-pancréatique ou la séreuse duodénale mais sans extension à l’axe cœliaque ou à l’artère mésentérique supérieure |
| T4 | Atteinte du tronc cœliaque, de l’artère mésentérique supérieure et/ou de l’artère hépatique commune |
| N | |
| Nx | Non évaluable |
| N0 | Pas de métastase ganglionnaire régionale |
| N1 | 1 à 3 métastases ganglionnaires régionales |
| N2 | ≥ 4 métastases ganglionnaires régionales |
| M | |
| M0 | Pas de métastase à distance |
| M1 | Métastase(s) à distance |
Tableau 4
Stades pronostiques de l’AJCC (8ème édition 2017) des cancers de l’ampoule
| Stades | T | N | M |
| 0 | Tis | N0 | M0 |
| IA | T1a | N0 | M0 |
| IB | T1b-T2 | N0 | M0 |
| IIA | T3a | N0 | M0 |
| IIB | T3b | N0 | M0 |
| IIIA | T1a-T1b-T2-T3 | N1 | M0 |
| IIIB | Tout T T4 | N2 Tout N | M0 M0 |
| IV | Tout T | Tout N | M1 |
- Les données de survie à 5 ans sont significativement différentes avec cette classification selon le stade T (83 % pour pT1a, 71 % pour pT1b, 46 % pour pT2, 48 % pour pT3a, 28 % pour pT3b et 7 % pour pT4).
- Les taux de survie à 5 ans diffèrent également selon le stade N (45 % pour N0, 20 % pour N1 et 4 % pour N2) (Kim SJ et al. 2018).
- Plusieurs études suggèrent une différence de survie sans récidive et de survie globale entre les tumeurs pT1a et pT1b (Kim SJ et al. 2018; Imamura T et al. 2019) mais pas entre les tumeurs pT1b et pT2 (numériquement mais non statistiquement différentes), ce qui explique possiblement leur regroupement dans le stade IB. Dans l’étude de Stiles et al, le pronostic des stades I était excellent (Stiles Z et al. 2018).
19.1.6. Caractéristiques histologiques et moléculaires des tumeurs de l’ampoule
La carcinogénèse des tumeurs de l’ampoule suit la séquence épithélium normal-dysplasie-cancer comme les néoplasies coliques (Kaiser A et al. 2002).
De par leur présentation clinique et endoscopique, les ADa sont généralement identifiés dès l’endoscopie initiale. Néanmoins, les remaniements inflammatoires de la papille peuvent faire porter à tort le diagnostic d’ADa, avec des biopsies montrant de façon trompeuse un aspect dystrophique pris pour de la dysplasie de bas ou de haut grade (13-15% d’ampullectomie ne retrouvaient pas d’ADa ou ADKa (Laleman W et al. 2013; Napoléon B et al. 2014).
- Par exemple, une migration lithiasique récente peut générer un aspect inflammatoire pseudo-tumoral de l’ampoule.
- En cas de doute diagnostique (histoire de migration lithiasique, ampoule non bourgeonnante, non ulcérée, absence de dilatation des canaux bilio-pancréatiques), il convient de refaire l’endoscopie à 6-12 semaines avec un duodénoscope à vision latérale couplée à une nouvelle série de biopsies et à une écho-endoscopie avant de décider de la séquence thérapeutique.
19.1.6.1 Sous-type histologique
Pour les ADKa, la différenciation histologique entre sous-type intestinal (INT), bilio-pancréatique (BP) ou mixte (MT) est importante à considérer car leur pronostic est différent (Shin DW et al. 2023). Pour distinguer ces sous-types, l’aspect morphologique est l’élément le plus important. Néanmoins, certaines tumeurs sont difficiles à classer (formes mixtes ou non classables) et l’immunohistochimie peut parfois aider dans ces cas litigieux bien que des controverses persistent sur ce sujet dans la littérature (Ang D et al. 2014; Xue Y et al. 2017).
Dans une étude sur 105 ADKa, 23 % des cas n’étaient pas classés consensuellement par un panel de pathologistes lorsque la morphologie était uniquement utilisée (K=0,53). La concordance interobservateur était très bonne (K=0,89) pour le caractère mucineux (K=0.72 et 0.89) (très souvent associé au sous-type INT), bonne pour les sous-types INT (K =0,48) et BP (K=0,57 et 0,48) mais très mauvaise pour les lésions mixtes (K=0.09) (Ang D et al. 2014).
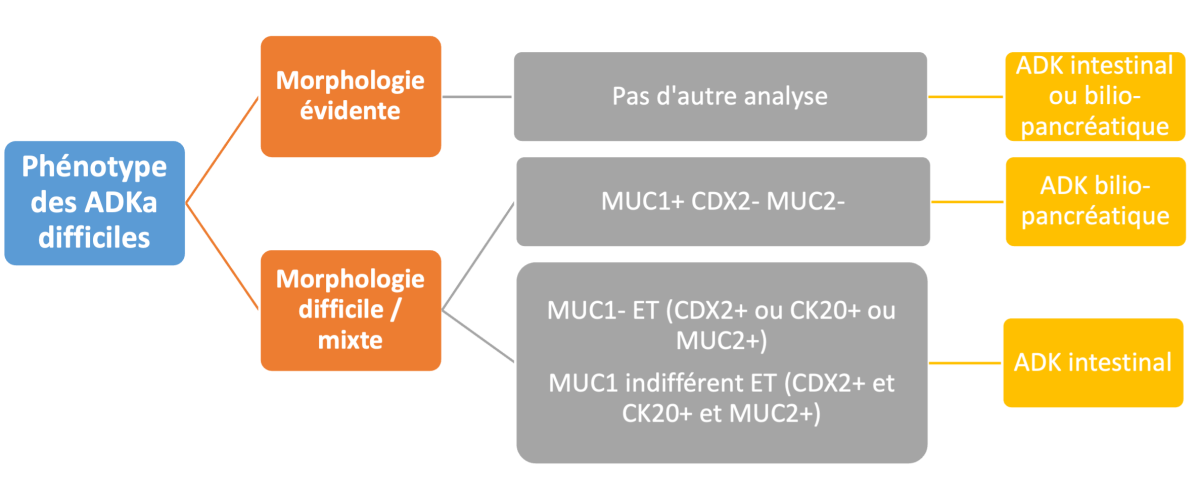
- Deux principaux algorithmes ont été proposés sur la base de 5 marqueurs immunohistochimiques (CK7, CK20, CDX2, MUC1 et MUC2).
- Le 1er algorithme proposé par Chang et al. n’utilise que CDX2 et MUC1 qui avaient une valeur pronostique, à l’inverse de CK7, CK20 et MUC2 (Chang D et al. 2013).
- Le 2ème algorithme par Ang et al. montre que le marqueur CK7 n’était pas utile car positif dans les 2 sous-types, alors que les marqueurs CK20, CDX2, MUC1 et MUC2 l’étaient (Ang D et al. 2014).
L’utilisation de cette classification permettait de diminuer les cas ambigus à 8 %, notamment dans les formes peu différenciées et mixtes. Néanmoins, ces anticorps ne sont pas tous disponibles en routine. Enfin, l’impact pronostic des marqueurs CK7/CK20/MUC1/CDX2 est débattu (Xue Y et al. 2017).
D’après cet algorithme, les 2 sous-types INT et BP pourraient ainsi être définis comme suit :
Algorithme 1
IHC utile pour l’aide à la détermination du phénotype intestinal
et bilio-pancréatique dans les ADKa de détermination difficile
- Compte tenu de la variabilité des définitions, le pourcentage d’ADKa de sous-type BP varie entre 45 et 60 %, celui de sous-type INT entre 30 et 40 % et celui de sous-type mixte entre 10 et 20 % (Zimmermann C et al. 2019; Perkins G et al. 2019).
- La détermination du phénotype INT ou BP pourrait orienter le clinicien dans le choix du traitement et en particulier des chimiothérapies compte tenu du plus mauvais pronostic des formes BP (Shin DW et al. 2023), en rapport avec des formes BP plus avancées (tumeurs plus petites mais plus souvent pT3/T4, N+, peu différenciées, R1/R2 et avec plus d’envahissement lymphovasculaire et périnerveux). A noter que les formes mixtes semblent avoir un pronostic proche du sous-type BP et que le pronostic des ADKa BP est meilleur que celui des adénocarcinomes pancréatiques (Reid M et al. 2016).
- La détermination du sous-type est recommandée dans les guidelines américains du NCCN. Ce bénéfice clinique de la modulation du type de chimiothérapie selon le sous-type d’ADKa reste cependant à formellement démontrer.
19.1.6.2. Autres facteurs pronostiques
Pour les ADa, le principal facteur à considérer est le caractère complet ou non de la résection endoscopique ou chirurgicale.
Pour les ADKa réséqués, les principaux facteurs pronostiques sont :
- La différenciation (Radojkovic M et al. 2018) et le phénotype
- Le statut T avec notamment l’envahissement sous-muqueux pT1a/pT1b (cf. 19.1.4.1)
- Le budding tumoral (Ohike N et al. 2010)
- L’invasion lymphovasculaire
- Le statut pN
- Le statut R (R0/R1)
Pour les ADKa pT1, l’envahissement de la sous-muqueuse duodénale est l’élément central à déterminer car il définit le risque ganglionnaire et les indications de duodénopancréatectomie céphalique (DPC) complémentaire (cf. paragraphe 19.1.5.1) :
- Pour les ADKa pT1a (anciennement sm- ou d0), le risque ganglionnaire est quasi nul.
- Pour les ADKa pT1b (anciennement sm+ ou d1), le risque ganglionnaire est nettement supérieur, de l’ordre de 24 % (Kim SJ et al. 2018). Enfin, dans la série de Amini et al, parmi 421 patients pT1, on retrouvait 22 % de N+, avec un envahissement plus important selon la différenciation : 10 % des formes bien différenciées et 27% des formes peu différenciées (Amini A et al. 2015).
Certains éléments pronostiques permettent d’apprécier la survie attendue après chirurgie et le choix de la chimiothérapie adjuvante.
- Dans la série de Moekkotte et al. (n=1107), le pronostic (survie globale) était influencé par l’âge, la résection R0/R1, la différenciation, le stade pT et le pN. La survie à 5 ans était de 81 % pour les risques faibles, de 57 % pour les risques intermédiaires de 22 % pour les risques élevés et de 14 % pour les patients avec un score à « très haut risque de récidive ». Ce score est disponible en ligne sur le site www.pancreascalculator.com (Moekotte A et al. 2020). A noter que l’âge a un poids important dans la prédiction de la survie globale dans ce nomogramme et pourrait fausser son interprétation car il n’évalue pas le risque de survie sans récidive.
- Dans la série française de Colussi et al (n=152), les facteurs associés à une mauvaise survie sans récidive en analyse multivariée étaient un âge > 75 ans, une altération de l’état général, un ADKa moyennement ou peu différencié, un stade IIb ou III, mais pas le sous-type histologique ni la réalisation d’une chimiothérapie adjuvante. La SSM était de 73,5 % pour les ADKa à bas risque et 20 % pour ceux à haut risque (Colussi O et al. 2015).
19.1.6.3. Altérations moléculaires d’intérêt
- Concernant le statut microsatellitaire, la perte d’expression des protéines du système mismatch repair (MMR) (phénotype déficient MMR (dMMR) ou avec microsatellite instable (MSI) : perte de MLH1, MSH2, MSH6 ou PMS2 en immunohistochimie) est présente dans 2 à 18 % des tumeurs ampullaires.
- La cohorte française de l’AGEO (Perkins G et al. 2019) retrouvait 2 % d’ADKa dMMR/MSI (n = 2/85) et la cohorte d’Agaram 6 % (Agaram N et al. 2016). Dans la cohorte de Xue Y et al, ce taux était de 18 % (23/127) avec une prédominance d’ADKa dMMR/MSI dans le sous-type intestinal (23 % vs 16 %) et chez les hommes avec un sex ratio de 4.7 (Xue Y et al. Cancer 2020), allant dans le même sens que l’étude de Heby : 17 % (7/42) de lésion dMMR/MSI dans le sous-groupe des ADKa INT contre 12 % (2/17) dans le sous-type BP (Heby M et al. 2018).
- Vu l’efficacité probable des inhibiteurs de point de contrôle immunitaires sur les tumeurs MSI traités dans l’étude KEYNOTE-158 (Maio M et al. 2022), il semble licite de rechercher le statut MMR pour discuter un traitement par immunothérapie anti PD(L)1 en staff moléculaire.
- Elle doit être confirmée en biologie moléculaire (tumeur MSI-H) avant prescription de l’immunothérapie (faux positifs de l’IHC).
- Cette recherche est également utile dans un contexte de suspicion de syndrome de Lynch s’il y a des antécédents familiaux évocateurs, même si les tumeurs de l’ampoule sont rares dans ce syndrome (cf. 19.2.2).
- Concernant les autres altérations moléculaires, le type et la fréquence sont résumés dans le tableau 3. Dans la série française de l’AGEO, des mutations impliquant les gènes KRAS (47 %, rarement une p.G12C), TP53, APC et PIK3CA (14 %) ont été retrouvées. Les mutations KRAS étaient plus fréquentes dans le sous type BP et les mutations APC dans le sous type INT. L’amplification HER2 était retrouvée dans 1 % des cas, et jusqu’à 13 % dans la série de Hechtman et al. (Hechtman JF et al. 2015). A noter également quelques mutations/fusions de FGFR qui pourraient être ciblées en thérapeutique.
Tableau 5
Altérations moléculaires des adénocarcinomes de l’ampoule
| Altération moléculaire | Publication | n | Détail |
| Her2 | Perkins G - Br J Cancer 2019 Wong W - Cancer 2019 Hechtman JF - Mod Pathol 2015 Yachida S - Cancer Cell 2016 Gingras MC - Cell Rep 2016 | 91 44 32 172 98 | 1 Her2 3+ et amplification ERBB2, 11 % amplification de Her2 chez 13% 12 % (surtout ADKa INT) environ 5 % |
| FGFR | Perkins G - Br J Cancer 2019 Wong W - Cancer 2019 | 91 45 | 1 mutation FGFR2 5 % (une fusion, une mutation) |
| NTRK | Wong W - Cancer 2019 | 44 | 1 fusion |
| RAS | Perkins G - Br J Cancer 2019 Wong W - Cancer 2019 Hechtman JF - Mod Pathol 2015 Yachida S - Cancer Cell 2016 | 91 45 32 60 | 47 % (dont 1 G12C) 53 % 47 % 48 % |
| BRAF | Perkins G - Br J Cancer 2019 Wong W - Cancer 2019 | 91 44 | 8 % (aucune V6000E) 11 % |
| BRCA | Wong W - Cancer 2019 Pinto P - PloS One 2016 | 44 16 | 11 % 13 % |
19.1.6.4. Synthèse des éléments à mentionner sur le compte rendu histologique pour la PEC des tumeurs de l’ampoule
REFERENCES
Pour les ADa : il faut au minimum préciser (grade A)
- Grade maximal de la dysplasie
- Taille
- Envahissement des limites d’exérèse (statut R). Une attention toute particulière doit être portée à la lecture anatomopathologique de marges latérales et profonde.
Pour les ADKa : il faut au minimum préciser (grade A)
- Taille de la lésion invasive
- Différenciation
- Sous type histologique avec détermination de CDX2, CK20 et MUC1 en cas de situation difficile
- Engainement périnerveux, emboles vasculaires, budding tumoral
- Envahissement des limites d’exérèse et marges si saines,
- Statut pTNM selon la classification AJCC (8ème édition)
OPTIONS
- Statut MMR en IHC (grade C)
- Recherche d’une altération moléculaire ciblable pour les stades avancés, notamment en cas d’échec d’un traitement de 1ère ligne (accord d’experts)
19. 2. DEPISTAGE : FORMES FAMILIALES
L’association des ADa et ADKa à des maladies génétiques constitutionnelles est connue mais mal évaluée. La principale association connue est la polypose adénomateuse familiale (PAF), les ADa et ADKa n’étant pas ou peu décrits pour les autres syndromes de prédisposition génétique (notamment dans le syndrome de Lynch ou dans les polyposes avec mutation de MUTYH par exemple).
19.2.1. Polypose adénomateuse familiale
La polypose adénomateuse familiale est une maladie génétique autosomique dominante liée à une variation délétère constitutionnelle du gène suppresseur de tumeur APC avec une pénétrance de la maladie proche de 100% à 40 ans (Bisgaard ML et al. 1994). Même si l’atteinte colorectale est prédominante, l’atteinte digestive haute est très fréquente et caractérisée par de nombreux polypes gastriques (de type glandulo-kystiques dans le fundus et de type adénome dans l’antre), par des adénomes duodénaux et peut s’associer à un adénome ampullaire (Half E et al. 2009).
- Le dépistage de la PAF débute vers 12-15 ans, les recommandations pour la première endoscopie œso-gastroduodénale sont discordantes, il est proposé de la faire lors de la première coloscopie (recommandation du GENMAD - 2021) ou vers 25 ans (recommandations européennes de l’ESGE). La surveillance ultérieure recommandée est à adapter selon la sévérité de l’atteinte endoscopique.
- L’atteinte duodénale est la 2ème cause de mortalité par cancer chez ces patients. La sévérité de l’atteinte duodénale, sa surveillance et sa prise en charge sont basées sur la classification de Spigelman (Syngal S et al. 2015). L’atteinte ampullaire fait partie du spectre de la PAF, avec un risque relatif multiplié par 120 par rapport à la population générale. Néanmoins, l’évolution en ADKa semble faible car la prévalence dans les séries historiques de l’ADKa sur PAF est rare (0,2 % dans la série d’Offenhaus et al. ; 0,4 % dans la série de Latchford et al. (Offenhaus GJ et al.; Latchford A et al. 2009)).
- Souvent de petite taille et infracentimétrique, l’ADa sur PAF est de croissance lente. Dans une série de 143 patients atteints d’ADa sur PAF (médiane de suivi de 7.8 ans), 16 % des ADa avaient une taille au-delà de 1 cm et 1,4 % développaient un ADKa (Singh A et al. 2022). Dans la série de Latchford et al., les ADKa survenaient sur les lésions ampullaires > 1 cm (Latchford A et al. 2009).
- La prise en charge de l’ADa supracentimétrique sur PAF doit tenir compte de l’atteinte duodénale : si les adénomes duodénaux sont contrôlables endoscopiquement, elle peut être exclusivement endoscopique. Si l’atteinte duodénale n’est pas traitable endoscopiquement (certains stade IV de Spigelman), la prise en charge à discuter est la DPC. Il semble alors licite de demander un avis auprès d’un centre expert afin de choisir au mieux entre traitement endoscopique et chirurgie.
- Enfin, en cas d’ADKa sur PAF, la prise en charge optimale sera la DPC sans discussion d’ampullectomie endoscopique et chirurgicale. Techniquement, la conservation pylorique est préférable chez ces patients ayant souvent une coloproctectomie.
Tableau 6
Score de Spigelman
| Polypes | 0 point | 1 point | 2 points | 3 points |
|---|---|---|---|---|
| Nombre | 0 | ≤ 4 | 5-20 | > 20 |
| Taille | - | ≤ 4 mm | 5-10 mm | > 10 mm |
| Histologie | - | Tubuleux | Tubulo-villeux | Villeux |
| Dysplasie | - | Légère | Modérée | Sévère |
| Score de Spigelman | Points | Fréquence de surveillance |
|---|---|---|
| 0 | 0 | Tous les 4 ans |
| I | 1-4 | Tous les 2-3 ans |
| II | 5-6 | Tous les 1-3 ans |
| III | 7-8 | Tous les 6-12 mois |
| IV | 9-12 | Tous les 3-6 mois, discuter mucosectomie ou DPC selon la faisabilité du contrôle endoscopique |
- La surveillance duodénale doit être faite sous anesthésie, en décubitus dorsal, débute par une duodénoscopie, ou à défaut avec un gastroscope haute définition équipé d’un cap distal (Shi X et al. 2019), puis une endoscopie axiale longue avec un coloscope et l’utilisation d’aspersion de solution de bleu indigo pour améliorer la détection des polypes. L’ampullectomie doit être faite par un opérateur entrainé (cf. 19.4.3).
19.2.2. Syndrome de Lynch
Très peu de données sont disponibles sur l’atteinte ampullaire dans le syndrome de Lynch, notamment dans la base de données européenne ERISCAM.
- Dans la série de Hammoudi et al. qui évaluait le risque duodénal chez 154 patients avec syndrome de Lynch, il était rapporté une atteinte duodénale chez 7 patients correspondant à 12 lésions dont seulement 1 atteinte ampullaire (Hammoudi N et al. 2019).
- Dans d’autres séries, il n’est pas fait mention de tumeur ampullaire (Engel C et al. 2012; Bonadona V et al. 2011; Win AK et al. 2013).
- Une méta-analyse récente rapportait un taux d’atteinte adénomateuse duodénale ou ampullaire chez 2,7 % des patients et un cancer duodénal chez 1,4 % à partir d’un total de 9 études et 2356 patients avec syndrome de Lynch (Vedantam S et al. 2023)
- A noter enfin la faible prévalence du statut MSI dans les séries récentes ayant étudié les caractéristiques moléculaires des ADKa (cf 19.1.6.4). Le syndrome de Lynch ne semble ainsi pas associé à un sur risque significatif de tumeur de l’ampoule.
19.2.3. Autres syndromes de prédisposition génétique
Les données sur les autres syndromes de prédisposition génétique sont peu nombreuses.
- Dans la polypose atténuée avec mutation biallélique de MUTYH, l’incidence de l’atteinte duodénale semble de moindre importance que dans la PAF et l’atteinte ampullaire est rare (Hurley JJ et al. 2018; Collaborative Group on Duodenal Polyposis in MAP et al. 2021). Dans la série de Walton et al. portant sur 92 patients avec polypose à MUTYH, 34 % avaient une atteinte duodénale tandis que 2 patients avaient une lésion ampullaire (Walton SJ et al. 2016). Dans une cohorte internationale prospective des polyposes liées à MUTYH, le taux d’atteinte duodénale était de 24,1 % (n = 95/394 patients avec polypose à MUTYH) et 7 cas (1,8 %) était rapporté pour l’atteinte ampullaire (Thomas L et al. 2021).
- Enfin, on citera la neurofibromatose de type I (maladie de Recklinghausen) qui peut s’associer à des tumeurs ampullaires qui sont habituellement de type neuroendocrine ampullaire ou périampullaire et exprimant la somatostatine. Ces lésions peuvent être prises pour des lésions ampullaires adénomateuses et ne seront pas traitées dans ce chapitre.
19.3. BILAN INITIAL DES TUMEURS DE L’AMPOULE
19.3.1. Bilan diagnostic initial
19.3.1.1. Clinique
La découverte d’une tumeur de l’ampoule doit surtout faire rechercher des signes obstructifs biliaires (douleur biliaire, ictère, prurit, pancréatite ou angiocholite) afin de discuter un drainage endoscopique biliaire, qui doit toujours être fait, sauf urgence, après une imagerie spécifique et une échoendoscopie, ceux-ci pouvant être gênés par la sphincterotomie et la présence d’une prothèse.
Par ailleurs, une évaluation de l’état général et nutritionnel ainsi qu’une recherche d’antécédents personnels et familiaux de cancer du spectre du syndrome de Lynch (colorectal, endomètre, ovaire, voies urinaires…) sont recommandées.
19.3.1.2. Biologie
Un bilan biologique est nécessaire comprenant un bilan hépatique à la recherche d’une cholestase. Un dosage des marqueurs tumoraux ACE et CA19.9 (après drainage biliaire) pourra être réalisé en présence ou suspicion d’un d’ADKa notamment pour leur intérêt pronostique (Schiergens T et al. 2017) et la recherche de maladie résiduelle au cours du suivi.
REFERENCE
- Pas de référence
OPTIONS
- Pas de dosage spécifique en dehors de la biologie habituelle et d’un bilan nutritionnel (grade B)
- Pour les ADa, pas de dosage des marqueurs tumoraux
- Pour les ADKa, le dosage des marqueurs tumoraux ACE et CA19.9 (après drainage biliaire) peut être utile en cas d’élévation initiale au suivi des patients au cours du traitement (grade C)
19.3.1.3. Endoscopie œso-gastro-duodénale et duodénoscopie
Le diagnostic endoscopique peut être fait avec un gastroscope à vision axiale (au mieux équipé d’un cap distal) et/ou un duodénoscope à vision latérale lorsque l’ampoule n’est pas bien vue (20 à 50 % de faux négatif avec l’EOGD (Kim MH et al. 2001)). Les tumeurs ampullaires sont représentées pour 25 % par des formes extra-ampullaires (lésion polypoïde ou dégénérée visible dans la lumière duodénale), pour 16 % par des formes endo-ampullaires (papille bombante sans lésion luminale) de diagnostic parfois difficile et pour 59 % par des formes mixtes (Sivak M et al. 1988).
- Lors de la découverte d’une tumeur ampullaire, il est recommandé de faire des biopsies sans sphinctérotomie (grade C). Par ailleurs, il est utile de préciser l’aspect de la lésion (notamment aspect dégénéré, présence d’une ulcération), sa taille et son extension latérale au duodénum, de la présence d’un diverticule. Les photos sont utiles et permettent une relecture en RCP.
- Une attention particulière doit être apportée aux ADa de découverte fortuite. Même si les ADa sont souvent asymptomatiques, le risque de faux positif est réel, notamment lorsque l’ampoule a un aspect inflammatoire, dans un contexte de migration lithiasique ou de calcul enclavé par exemple. Il est parfois difficile de différencier une muqueuse inflammatoire d’un ADa en dysplasie de bas grade tant sur le plan macroscopique qu’histologique. Le contexte clinique est important à considérer, notamment chez les patients asymptomatiques avec suspicion de tumeur de l’ampoule, où l’aspect d’ampoule hypertrophiée avec des biopsies retrouvant un adénome en DBG n’est pas suffisant. Dans cette situation, un contrôle endoscopique est indispensable entre 6 et 12 semaines avec de nouvelles biopsies au duodénoscope ainsi qu’une double lecture avec un pathologiste entrainé à l’interprétation des ADa.
- Enfin, la présence d’un calcul du cholédoque ne permet pas d’éliminer une lésion, car 16% des tumeurs ampullaires peuvent s’associer à un calcul du cholédoque (Ponchon T et al. 1989).
19.3.1.4. Echo-endoscopie et CPRE
L’écho-endoscopie a une place centrale dans le bilan initial d’une tumeur de l’ampoule localisée. Elle permet de déterminer le statut usT et usN, la longueur de l’atteinte des conduits biliaire et pancréatique, une atteinte diffuse du cholédoque de type polypose de la voie biliaire principale. C’est un examen néanmoins difficile. Il est possible d’utiliser aussi bien un écho-endoscope radial que linéaire, l’évaluation sera facilitée par l’instillation d’eau dans la lumière duodénale.
- Dans une méta-analyse de 14 études ayant inclus 422 patients, la sensibilité et la spécificité de l’écho-endoscopie étaient de 77 % et 78 % pour le staging T1 et de 70 % et 74 % pour le staging N (Trikudanathan G et al. 2014). Les recommandations de l’ESGE précisent que l’écho-endoscopie est meilleure pour le staging T que la TDM et l’échographie ; et comparable à l’IRM. Pour le staging N, la valeur prédictive négative de l’atteinte ganglionnaire en écho-endoscopie est cependant insuffisante pour évaluer précisément le risque ganglionnaire, l’IRM ayant une meilleure performance diagnostique (Vanbiervliet G et al. 2021).
- En conclusion,
- L’évaluation écho-endoscopique du T est bonne mais imparfaite, notamment pour la différence entre adénome et cancer invasif T1, elle ne permet pas de différencier le T1a et le T1b.
- L’évaluation du N est parfois prise en défaut par la visualisation de ganglions dont le caractère pathogène n’est pas certain. Il semble utile de bien décrire le ganglion lors de l’examen : caractère peu suspect avec une taille < 1 cm de petit axe, différenciation réniforme avec hile graisseux central hyperéchogène, forme oblongue ou plate en comparaison au ganglion suspect avec un aspect rond, hypoéchogène de taille > 1 cm de petit axe.
- Enfin, il peut être utile de corréler en RCP le statut usN à l’évaluation morphologique au TDM et à l’IRM de même que de réaliser une cytoponction ganglionnaire en cas de doute diagnostique si la tumeur ampullaire ne fait pas poser l’indication chirurgicale d’emblée. Dans les formes endoampullaires pures, une ponction sous écho-endoscopie +/- brossage biliaire pourra être proposé.
La place de la CPRE lors du diagnostic de tumeur ampullaire est limitée à la nécessité d’un drainage endoscopique en cas d’angiocholite ou d’hyperbilirubinémie notamment. En cas d’angiocholite sur ADa, la pose d’une prothèse biliaire plastique sans sphinctérotomie est préférable pour ne pas gêner la résection endoscopique monobloc qui sera programmée dans un second temps.
- En cas d’ADKa, le drainage biliaire se fait selon les mêmes conditions et les mêmes indications que celui de l’adénocarcinome pancréatique :
- angiocholite ou retentissement important sur l’état général
- et/ou de bilirubine > 200 µmol/L
- et/ou délai opératoire > 3 semaines
- et/ou patient inopérable ou traitement néoadjuvant nécessaire
- En cas de biopsies négatives avec un obstacle ampullaire probant, un avis en centre compétent pour l’endoscopie thérapeutique est indiqué. Un contrôle endoscopique 2 à 4 semaines après est conseillé afin de ne pas méconnaitre une lésion non diagnostiquée lors de la CPRE initiale. La décision de réaliser soit une courte sphinctérotomie avec biopsies, soit une ampullectomie diagnostique, en cas de lésion obstructive ayant nécessité la mise en place d’une prothèse plastique biliaire, doit être discutée en RCP.
19.3.1.5. Coloscopie
Jusqu’alors, la coloscopie était recommandée dans le bilan initial des ADa et des ADKa sur des bases théoriques. Plusieurs études rétrospectives sont disponibles sur le sujet et montrent des résultats contradictoires.
- Deux études rétrospectives hollandaises ne semblent pas montrer d’intérêt systématique à sa réalisation. Dans une première série de 287 patients avec ADKa opérés par DPC, seuls 11 % avaient une coloscopie et il n’y avait pas de différence d’incidence entre la population opérée et la population générale concernant la présence de polypes et de cancer colorectal à 1 an du diagnostic (Olthof P et al. 2020). Dans une autre étude ayant inclus 26 patients avec ADa ou ADKa, appariée avec 104 patients contrôle, il n’y avait pas de différence significative en terme de fréquence de polypes coliques (Schneider AR et al. 2005).
- Une étude chinoise récente va cependant à l’encontre de ces résultats, elle a inclus 95 patients avec ADKa sporadiques comparés à 380 patients asymptomatiques ayant eu une coloscopie. Une différence était observée entre les patients du groupe ADKa vs le groupe contrôle (60 % vs 35 %, p=0,001) (Zhou F et al. 2023).
- De façon pragmatique, une coloscopie est indiquée en cas d’adénomes duodénaux associés, d’âge < 50 ans ou d’histoire familiale de polypes ou cancers digestifs, de tumeur de phénotype intestinal MSI/dMMR afin de ne pas méconnaitre une polypose adénomateuse familiale ou un syndrome de Lynch, de même qu’en cas de signes d’alarmes coliques (rectorragie, méléna, anémie, trouble récent du transit…).
19.3.1.6. Recommandations de bilan endoscopique initial
REFERENCES (accord d’experts)
- Endoscopie œso-gastro-duodénale pour bien visualiser s’il y a une atteinte duodénale associée
- Duodénoscopie à vision latérale afin de bien visualiser la papille principale et la papille accessoire avec biopsies de la tumeur idéalement à distance de l’orifice papillaire, description de la lésion (taille, diverticule, aspect)
- Echo-endoscopie diagnostique avec détermination du stade usT et usN pour les formes localisées
- Ampullectomie rapide plutôt que pose de prothèse si ictère sur ADa
- CPRE + biopsies +/- brossage cytologique ou ponction sous écho-endoscopie si pas d’espoir d’ampullectomie R0
- En cas d’angiocholite :
- prothèse plastique sans sphinctérotomie si suspicion d’ADa
- prothèse métallique couverte précédée ou non d’une sphinctérotomie si forte suspicion d’ADKa.
- Biopsies systématiques +/- brossage et/ou ponction sous EE
A noter que l’écho-endoscopie n’a pas d’intérêt dans la prise en charge des ADKa métastatiques
OPTION
- Coloscopie pour éliminer une atteinte colorectale associée surtout si (avis d’experts) :
- Histoire familiale
- Présence d’adénomes duodénaux
- ADa ou ADKa de phénotype MSI/dMMR
- Signes d’alarmes coliques habituels
19.3.2. Bilan d’extension
Les recommandations en rapport avec le bilan d’extension sont classiques et se rapprochent de celle du cancer du pancréas. On rappelle que le bilan d’extension doit être récent, de préférence 4-6 semaines maximum avant une discussion en RCP.
19.3.2.1. TDM
La TDM TAP injectée est à faire si possible avant tout geste endoscopique et en particulier avant pose de prothèse biliaire, notamment dans le cas d’un ictère. La TDM n’est pas recommandée pour les ADa, et est indispensable en cas d’ADKa.
- Le protocole d’acquisition est de type « pancréas », avec étude multispectrale, coupes fines millimétriques jointives au temps artériel et portal.
- Il est recommandé de faire un remplissage duodénal à l’eau (Alessandrino F et al. 2015).
19.3.2.2. IRM
L’IRM hépatique et pancréato-biliaire est utile comme dans les adénocarcinomes pancréatiques avant chirurgie afin de ne pas méconnaitre des métastases hépatiques et pour mieux caractériser l’atteinte ganglionnaire.
- Elle est à faire dans le bilan préthérapeutique des ADKa, si possible avant tout geste endoscopique et en particulier avant pose d’une prothèse biliaire.
- Elle comporte des séquences T1 (avec séquences in/out phase), T1 avec injection de gadolinium, T2, séquences de diffusion et séquence T2 de cholangio-pancréatographie 3D au minimum. Il est recommandé de faire un remplissage duodénal à l’eau, jus de myrtille ou ananas (éléments en hyposignal T2, permettant de limiter l’effet bol alimentaire).
- Elle permet aussi d’avoir une imagerie canalaire pancréatique précise (papille mineure, divisum) qui peut avoir son importance avant tout geste d’ampullectomie.
19.3.2.3. TEP-FDG, scintigraphies et autres imageries
Les imageries métaboliques ne doivent pas être prescrites de façon systématique mais lorsqu’il y a un doute diagnostique sur le bilan d’extension initial (TDM TAP +/- IRM hépatique) ou des signes cliniques d’orientation (douleur osseuse, image tissulaire à distance non caractérisée, signe neurologique, etc…), en accord avec les recommandations françaises de l’INCa (Salaün PY et al. 2019).
19.3.2.4. Recommandations de bilan d’extension
REFERENCES (accord d’experts)
- En cas d’ADa, il n’y a pas de nécessité de réaliser d’examen complémentaire de type TDM ou IRM
- Pour les ADKa, une TDM TAP injectée est l’examen de référence
- IRM hépatique avant chirurgie d’un ADKa si pas de métastase sur le TDM
- Pas d’IRM ou de TEP-FDG en cas de maladie métastatique évidente en TDM
OPTION (avis d’experts)
- TEP-FDG si doute sur des lésions secondaires
19.4. PRISE EN CHARGE DES FORMES LOCALISEES DES TUMEURS DE L’AMPOULE
19.4.1. Déterminants du choix de la technique de prise en charge
Au terme du bilan initial, les éléments qui vont impacter le choix de la PEC thérapeutique sont :
- Pour les ADa :
- Difficulté technique d’une résécabilité R0 endoscopique (anatomie locale, notamment localisation de l’ampoule, présence d’un diverticule duodénal)
- Atteinte duodénale périampullaire
- Longueur de l’atteinte sur les canaux bilio-pancréatiques.
- Importance de l’atteinte duodénale dans la PAF (stade de Spigelman)
- Notion et nature de gestes thérapeutiques ampullaires antérieurs
- Pour les ADKa :
- Stade pT (lésion dépassant ou non la sous-muqueuse pT1a/pT1b) conditionnant le risque ganglionnaire
- Atteinte ganglionnaire sur les examens d’imagerie
- Présence ou absence de métastase sur le bilan d’extension
- Etat général/comorbidités du patient
Dans les formes difficiles à déterminer (notamment pour les lésions de malignité incertaine ou avec une écho-endoscopie non concluante), il est acceptable de débuter la prise en charge par une ampullectomie endoscopique qui peut être considérée comme une macrobiopsie ou un pont avant chirurgie. La différence en préopératoire entre le stade T1a et T1b n’est en pratique pas réalisable avec les seuls examens morphologiques. Selon les résultats histologiques (ADa ou ADKa, stade pT, qualité de la résection R0/R1), un traitement de chirurgical de rattrapage pourra être proposé, idéalement dans le même bloc si l’extemporané est non satisfaisante (R1/R2 sur les canaux, tumeur plus avancée qu’initialement déterminé) ou rapidement (dans les 7 jours) si une DPC complémentaire est nécessaire après un geste de résection locale.
19.4.2. Prise en charge endoscopique, drainage biliaire
Dans certaines situations, l’indication de drainage est aisée : angiocholite, prurit, hyperbilirubinémie > 200 µM, avant chirurgie ou chimiothérapie, elle est sinon à éviter à titre systématique si une résection endoscopique est possible.
19.4.3. Techniques de prise en charge thérapeutique
19.4.3.1. Ampullectomie endoscopique
La place de l’ampullectomie endoscopique est bien définie et précisée dans les recommandations européennes de l’ESGE (Vanbiervliet G et al. 2021), les adénomes en dysplasie de bas grade et de haut grade < 3 cm étant l’indication reine d’une résection se devant d’être monobloc et surtout R0 en latéral et en profondeur.
- Efficacité de l’ampullectomie endoscopique : le taux de résection R0 est estimé à 90% avec un taux de succès de 80% dans la série de Kang et al (n=104, Kang SH et al. 2017), similaire à la série française (Napoléon B et al. 2014) et celle de Ridtitid et al (n=182) avec une résection endoscopique complète dans 94 % des cas, une résection endoscopique curative dans 87 %, la résection en bloc (82 %) étant le seul facteur affectant la résection curative avec un OR=3,55 (Ridtitid W et al. 2014). La probabilité de résection R0 monobloc diminue avec la taille de lésion et devient moindre pour les lésions entre 2 et 3 cm. Une attention toute particulière doit être portée à la lecture anatomopathologique des marges latérale et profonde.
- La résection endoscopique est considérée comme curative lorsqu’elle est R0 pour les ADa (Bohnacker S et al. 2005). Elle peut également suffire pour les ADKa pTis et pT1a R0. En cas d’ADa R1, le traitement endoscopique peut être suffisant et une surveillance simple peut être proposé (accord d’experts).
En cas de découverte d’un adénocarcinome pT1 ou plus, un traitement chirurgical complémentaire doit être discuté (cf indication du paragraphe 19.4.3.5). Néanmoins, pour les ADKa pT1a, le risque ganglionnaire est quasi nul. L’ampullectomie endoscopique pourrait donc être curative. Dans une étude rétrospective unicentrique française sur 173 ampullectomies, 28 patients présentaient un adénocarcinome sur la pièce de résection (Alvarez-Sanchez MV et al. 2017). Une chirurgie complémentaire était indiquée en cas de résection R1 d’un ADKa, d’invasion sous-muqueuse (tumeur ≥ pT1b), d’envahissement canalaire ou de présence d’emboles lymphovasculaires. Sur les 28 adénocarcinomes, 16 étaient sm+ (pT1b) dont 9 présentaient un envahissement ganglionnaire. L'ampullectomie était curative pour les ADKa pTis et pT1a R0 sans emboles lymphovasculaires (Napoleon B et al. 2017).
- Contre-indications à l’ampullectomie endoscopique : une taille de 3 cm est habituellement considérée comme la limite supérieure pour une résection endoscopique (Gracient A et al. 2020). Elle est également non indiquée en cas de risque ganglionnaire (ADKa au-delà de pT1a).
- Retraitement endoscopique : dans les grandes séries rétrospectives récentes, l'efficacité du retraitement endoscopique après une lésion résiduelle ou récidivante varie de 38 à 100 %, et nécessite plusieurs séances (Recommandations ESGE 2021). Une étude portant sur 49 patients ayant une maladie résiduelle ou récidivante non invasive avait montré un succès du traitement endoscopique dans 86% des cas (Tringali A et al. 2020). Si la lésion n’est pas re-résécable ou non indiquée sur les données histologiques, une prise en charge chirurgicale par ampullectomie ou DPC est indiquée.
Dans la série d’Alali et al. (n=103), la résection en bloc est préférable à la résection en piecemeal, cette dernière étant plus souvent associée à une récidive locale (54 % versus 26 %). La récidive reste généralement traitable endoscopiquement (Alali A et al. 2020)
- Les complications aiguës les plus fréquentes de l’ampullectomie endoscopique sont l’hémorragie digestive (15-20 %), la pancréatite aiguë (10-15 %) et la perforation rétropéritonéale (3 %). A long terme, on observe 9 % de complications, principalement de type sténose (obstruction de la voie biliaire principale) et pancréatite chronique (Napoléon B et al. 2014). Une revue systématique plus large (n=1751) retrouvait un taux global d'événements indésirables de 25% : pancréatite 12 %, hémorragies 11 %, perforations et cholangites 3 %, sténose papillaire 2 %. La mortalité était de 0,3 % (Spadaccini M et al. 2020).
- Technique indiquée pour l’ampullectomie endoscopique : il est conseillé de prévenir la pancréatite aiguë avec un suppositoire d’AINS et la pose d’un stent pancréatique, de réaliser le geste sous CO2 plutôt qu’à l’air, d’avoir un plateau technique complet à disposition (radiologie interventionnelle, chirurgie, réanimation) afin de pouvoir gérer les complications et de réaliser ce geste par un opérateur entrainé. Le remplissage vasculaire systématique n’est pas recommandé car il n’a pas montré de supériorité par rapport aux AINS seuls dans la prévention de la pancréatite aiguë (Sperna Weiland CJ et al. 2021).
Il n’y a pas de consensus sur le réglage du générateur électrique. L’injection sous-muqueuse est à éviter, sauf en cas d’adénome s’étendant vers le duodénum. La réalisation d’une exérèse monobloc à l’anse et la pose d’une prothèse pancréatique, lorsque cela est possible, sont recommandées. Un drainage complémentaire biliaire sera à envisager en cas d’obstruction biliaire persistant après la résection. Le traitement des hémorragies perprocédures pourra se faire le plus souvent avec les techniques d’hémostase habituelles (adrénaline, clips…). L’hémostase prophylactique n’a pas démontré son intérêt (Vanbiervliet G et al. 2021).
- Radiofréquence endobiliaire : l’essai prospectif de Camus et al. sur un petit effectif de 20 patients présentant un résidu ou une récidive d’ADa endobiliaire (étendue canalaire < 20 mm) histologiquement prouvé après une ampullectomie pour ADa a conclu que la radiofréquence endobiliaire peut conduire à une éradication de 70 % de la dysplasie à 12 mois après une seule séance. La dysplasie de haut grade était un facteur prédictif de mauvais résultats nécessitant une chirurgie de sauvetage chez 2 patients (10 %). La sténose biliaire est fréquente après RFA pour une extension intraductale et nécessite la pose d’une prothèse biliaire (Camus M et al. 2018).
A noter que la radiofréquence reste un traitement en cours de validation et ne peut pas être considéré comme le standard de soin des résections endoscopiques R1, mais plutôt comme un traitement complémentaire lorsque la ré-ampullectomie endoscopique ou chirurgicale ou la DPC ne sont pas faisables. En fonction de la hauteur d’atteinte de la voie biliaire principale identifiée lors du bilan initial, le traitement sera chirurgical, l’ampullectomie chirurgicale permettant une exérèse plus poussée des lésions remontant sur le cholédoque.
19.4.3.2. Ampullectomie chirurgicale
- L’ampullectomie chirurgicale peut être une ampullectomie de première intention ou complémentaire après une ampullectomie endoscopique. Elle est supérieure à cette dernière en terme de résection R0, notamment lorsque les lésions adénomateuses remontent le long des canaux bilio-pancréatiques (atteinte cholédocienne > 1 cm), d’ADa de grande taille (> 2 ou 3 cm), ou de problème technique endoscopique (papille paradiverticulaire ou avec extension importante à la paroi duodénale par exemple). Elle peut s’accompagner d’une résection monobloc de la voie biliaire principale en totalité sur son trajet intra-pancréatique et d’un curage chirurgical limité afin d’avoir une évaluation du statut N.
- L’ampullectomie chirurgicale en centre expert, est associée à un taux de complication global d’environ 28 % (8-68 %) et une mortalité inférieure à 1 %. Ses principales complications sont la pancréatite aiguë, l’hémorragie post-opératoire, les sténoses biliaires et pancréatiques et la fistule duodénale. La durée de séjour est plus importante (10 vs 3 jours) que pour l’ampullectomie endoscopique (Gracient A et al. 2020).
- Dans un contexte de ré-ampullectomie chirurgicale ou DPC post ampullectomie première, la morbidité est plus élevée (28 % de Clavien III) et avec des taux de résection R0 élevés : 85 % pour l’ampullectomie chirurgicale et 92 % pour la DPC (Karam E et al. 2023). A noter que la DPC dans le contexte de tumeur de l’ampoule se fait souvent sur un pancréas mou et un Wirsung fin et est donc à risque de fistule pancréatique plus important que la DPC pour adénocarcinome.
19.4.3.3. Duodéno-pancréatectomie céphalique
La DPC de première intention est l’intervention de référence en cas d’atteinte ganglionnaire formelle identifiée sur les examens d’imagerie préopératoire et dès le stade T1b car elle permet un traitement curatif en enlevant la tumeur primitive et les ganglions loco-régionaux.
- Elle est principalement justifiée par l’intérêt du curage au vu de la fréquence de l’envahissement ganglionnaire (15-26 %).
- Elle est plus discutable pour les ADKa pT1a car le risque ganglionnaire est alors quasi nul (cf. 19.1.6.2).
- Néanmoins, l’ADKa pT1a avec atteinte lymphovasculaire voire de morphologie peu différenciée doit faire discuter en RCP une DPC au vu du risque ganglionnaire.
- Par ailleurs, elle peut être un traitement complémentaire de l’ampullectomie endoscopique ou chirurgicale en cas de résection endoscopique incomplète ou en cas de rattrapage d’une lésion ≥ pT1b non identifiée sur les examens initiaux.
- Enfin, elle reste le traitement de choix des ADa sur PAF avec atteinte duodénale non contrôlable endoscopiquement (cf. 19.2.1).
19.4.3.4. Cas particulier des tumeurs de l’ampoule sur polypose adénomateuse familiale
- L’histoire naturelle des adénomes de l’ampoule sur PAF est différente de celle des ADa sporadiques avec des ADa (notamment ceux infracentimétriques) d’évolution plus lente. Au-delà de 1 cm, la résection endoscopique des ADa est la référence.
- Il faut cependant prendre en compte le risque évolutif des adénomes duodénaux dans ce contexte, notamment si l’atteinte duodénale est contrôlable avec un traitement endoscopique. Lorsque l’atteinte duodénale n’est pas contrôlée ou en présence de lésions adénocarcinomateuses, la prise en charge chirurgicale est à discuter.
- La DPC pour ADa avec atteinte duodénale est l’intervention de référence, le score de Spigelman pouvant guider l’indication de chirurgie. Néanmoins, les séries publiées sont de faible effectif et cette chirurgie est à réserver à des centres experts.
19.4.4. Chimiothérapie adjuvante
Il existe peu de données prospectives sur l’intérêt d’une chimiothérapie adjuvante dans les ADKa. Néanmoins, par analogie avec les cancers colorectaux, du pancréas ou des voies biliaires, il est licite d’envisager une chimiothérapie adjuvante, même si les données dans la littérature sont hétérogènes.
Il n’y a que 2 études randomisées d’intérêt étudiant la chimiothérapie adjuvante dans les ADKa. ESPAC3 est une étude prospective de phase III randomisée (chimiothérapie pendant 6 mois de type 5FU ou gemcitabine vs. surveillance) spécifiquement consacrée aux adénocarcinomes périampullaires. Elle a inclus 428 patients dont 297 avec un ADKa et montrait une mSG de 40,6 mois dans le bras surveillance, 57,8 mois dans le bras 5FU (5FU bolus, 425 mg/m²/j de J1 à J5) et 70,8 mois dans le bras gemcitabine (1000 mg/m², 3 semaines sur 4) avec un HR significatif à 0,7 pour la gemcitabine vs. surveillance (IC95% 0.51-0.97, p=0,03) et une tendance non significative pour le 5FU avec un HR à 0,79 (Neoptolemos J et al. 2012). Dans l’étude japonaise randomisée ASCOT ayant comparé le S-1 (fluoropyrimidine orale ayant une AMM en Asie) vs. surveillance dans les cancers des voies biliaires, l’analyse du sous-groupe des 73 ADKa retrouvait une tendance non significative pour la survie globale (HR=0,49, NS) et la survie sans récidive (HR=0,69, NS) en faveur du S-1 (Nakashi K et al. 2023). Ce médicament n’est néanmoins pas disponible en France et non étudié en population non asiatique. Au total, ces 2 études plaidant en faveur d’une monochimiothérapie adjuvante comme standard faible de traitement.
Plusieurs études rétrospectives sont également disponibles. L’étude rétrospective avec score de propension de Ecker BL et al. a inclus 357 patients, 56 % ayant reçu une chimiothérapie adjuvante (Ecker BL et al. 2019). Il n’y avait pas de bénéfice à une chimiothérapie adjuvante, quel que soit le sous-groupe (sous-type histologique (intestinal ou BP), type de chimiothérapie (à base de FP ou Gem) ou stade (I-II-III)).
Pour les tumeurs de stade I (pT1-2 N0), leur pronostic spontané est excellent avec des taux de survie globale à 3 ans proches de 80 %. 2 études rétrospectives ne montraient pas d’intérêt à un traitement adjuvant (Otswal V et al. 2017 ; Stiles Z et al. 2018). Ces tumeurs pourraient donc ne pas en bénéficier.
Dans l’étude de Nassour et al sur 4 190 patients, le bénéfice de la chimiothérapie adjuvante vs surveillance après appariement semble modeste (HR=0.82 avec une mSG de 47.2 mois vs 35.5 mois), avec un bénéfice de survie globale surtout pour les tumeurs pT3/T4, pN+ ou peu différenciées (Nassour I et al. 2018).
Dans l’étude de Kim ayant porté sur 646 patients, la survie globale était excellente pour les stades I, 44 mois pour les stades II et 15 mois pour les stades III. Concernant la chimiothérapie adjuvante (principalement de la monothérapie avec des fluoropyrimidines), il y avait une tendance en sa faveur mais qui n’était pas significative après appariement (HR=0.8, p=0.11), plaidant en l’absence d’intérêt d’une monothérapie adjuvante (Kim J et al. 2021). Dans l’étude de Kamarajah S appariée sur 3 440 patient avec ADKa opérés par DPC, il y avait un bénéfice faible à une chimiothérapie adjuvante (47.5 vs 39.6 mois, avec un HR après appariement de 0.83, CI95%: 0.76–0.91, p<0.001), sans lien avec le statut N et la résection R0/R1 (Kamarajah S et al. 2021). Enfin, dans l’étude de Ramaswamy A et al avec 214 patients, il n’y avait pas de bénéfice à une chimiothérapie par gemcitabine, même dans le sous-groupe bilio-pancréatique (Ramaswamy A et al. 2020).
Dans la cohorte rétrospective de Moekotte et al de 976 patients ayant eu une DPC pour un ADKa (38 % intestinaux, 54 % biliopancréatiques et 8% mixte), la survie était meilleure avec une chimiothérapie adjuvante (76 % de gemcitabine), avec une association positive en analyse multivariée en faveur d’une polychimiothérapie (HR 0.38, p=0.015) et d’une monochimiothérapie (HR 0.70, p=0.042), mais uniquement dans le groupe bilio-pancréatique/mixte et pas dans le groupe intestinal après appariement (Moekotte A et al. Br J Surg 2020). Les tests d’interaction avec le statut pN n’étaient pas significatifs. Une deuxième étude par Moekotte et al (Moekotte et al. 2020) ayant développé un nomogramme prédictif de la survie après DPC sur 1 007 patients avec validation externe sur 462 patients (disponible sur le site www.pancreascalculator.com) retrouvait un bénéfice à la chimiothérapie adjuvante uniquement dans le groupe à très haut risque de récidive avec une survie globale de 15 mois sans chimiothérapie et 22 mois dans le groupe chimiothérapie (p=0.001). Il n’y avait pas de détail sur le type de chimiothérapie.
Cette tendance était d’ailleurs retrouvée en survie sans récidive dans la cohorte française (non appariée) de l’AGEO dans le sous-groupe des haut risque (Colussi O et al. 2015).
Dans l’étude de Jin Z et al. (Jin Z et al. 2018) : bénéfice à une chimiothérapie adjuvante (91 % de gemcitabine) dans les stades avancés (IIb et supérieurs).
Synthèse des données (et cf. 19.6.2.1 et 19.9.4 Annexe 4) : Bien que fondées sur un faible niveau de preuve, ces données plaident en faveur d’une surveillance simple pour les tumeurs à bas risque, (ADKa pT1-2N0), quel que soit le sous-type histologique. Vu leur très bon pronostic, le groupe de travail a décidé de ne pas recommander de chimiothérapie pour les ADKa pT1 N0. En revanche, une chimiothérapie adjuvante pourrait se discuter pour les patients à haut / très haut risque de récidive. La décision doit être discutée avec le patient ainsi qu’en RCP et peut s’appuyer sur le score disponible sur le site www.pancreascalculator.com. Concernant le type de chimiothérapie, bien que non démontré, une polychimiothérapie semble plus efficace qu’une monochimiothérapie.
- En l’absence de détail sur les schémas de chimiothérapies utilisés, il est difficile de proposer un schéma de référence. Il semble logique de choisir un schéma peu toxique et surtout de diminuer les doses de chimiothérapie voire de l’arrêter en cas de traitement difficile à supporter ou de risque de toxicité aiguë ou résiduelle.
- Les seules données prospectives étant celles d’ESPAC3 et d’ASCOT, le groupe de travail recommande comme seul standard de chimiothérapie adjuvante une monochimiothérapie à base de gemcitabine ou de fluoropyrimidine avec un faible niveau de preuve (grade B). Pour les patients ayant un ADKa BP, une monochimiothérapie par gemcitabine pourrait être préférée, certaines analyses de sous-groupe semblant favorables dans l’étude de Moekotte et al. (Moekotte A et al. Br J Surg 2020) et de Schiergens et al. (Schiergens T et al. 2015) mais pas dans celle de Ecker BL et al. (Ecker BL et al. 2019).
- Une polychimiothérapie peut être également envisagée, notamment dans les formes à plus haut risque (tumeurs pT3/T4, pN+, peu différenciées, R1). Le pronostic des phénotypes INT étant meilleur, le groupe de travail propose de faire une chimiothérapie adjuvante par FOLFOX pour les ADKa INT, et par FOLFIRINOX pour les ADKa BP ou mixte ou indéterminés.
- Concernant la durée de la chimiothérapie adjuvante, le groupe de travail se prononce en faveur d’une durée de 6 mois (avis d’experts).
19.4.5. Radiothérapie adjuvante
La place de la radiothérapie dans la prise en charge des adénocarcinomes de l'ampoule a été étudiée essentiellement en situation adjuvante.
Deux essais de phase 3 ont randomisé des patients avec ADKa opérés entre chirurgie et chirurgie suivie d'une radiochimiothérapie (RCT) adjuvante. L’essai européen EORTC 40891 (n=207 mais ne comprenant que 92 tumeurs périampullaires) retrouvait une médiane de survie globale de 40 mois dans le bras chirurgie versus 39,5 mois dans le bras RCT adjuvante (Klinkenbijl JH et al. 1999). Ces résultats ont été actualisés à 5 ans avec des taux de survie globale similaires (Smeenk HG et al. 2007). Dans l’étude Morak et al, 120 patients dont 58 avec une tumeur péri-ampullaire étaient randomisés entre chirurgie seule versus chirurgie suivie d'une chimiothérapie intra-artérielle et radiothérapie. Le taux de survie globale à 5 ans était meilleur dans le bras avec traitement adjuvant (40 % versus 20 %), mais de manière non significative (p=0,15) (Morak MJM et al. 2008).
Enfin, de nombreuses séries rétrospectives ainsi qu’une analyse de la base de données américaine SEER ont été publiées concluant pour la majorité d'entre elles à l'absence de bénéfice d'une RCT adjuvante avec 5FU (Ecker BL et al. 2019).
En conclusion, il n'y a pas de place pour la radiothérapie adjuvante pour les adénocarcinomes de l'ampoule.
19.5. PRISE EN CHARGE DES FORMES LOCALEMENT AVANCEES OU METASTATIQUES OU NON CURABLES
19.5.1. Drainage biliaire
- Les indications du drainage biliaire sont les mêmes que pour les tumeurs bilio-pancréatiques : cholestase symptomatique (prurit, ictère, angiocholite), avant chimiothérapie palliative et si espérance de vie > 3 mois (exemple des patients non traitables mais avec tumeur anatomiquement résécable)?
- La voie d’abord (sphinctérotomie avec pose de prothèse biliaire, voie transbulbaire) dépend des conditions anatomiques.
REFERENCE
- Drainage biliaire par CPRE chez les patients avec ictère, angiocholite, prurit ou avant chimiothérapie palliative (grade A)
OPTION
- Choledoco-bulbo stomie avec prothèse d’apposition : en cas d’échec à la CPRE (accord d’experts)
19.5.2. Chimiothérapie de première ligne
Comme pour la situation adjuvante, il est difficile de tirer des conclusions solides de la littérature, les séries publiées étant de très petite taille.
La seule étude prospective non randomisée disponible est une phase II ayant étudié le CAPOX (capécitabine 750 mg/m²/12h J1-J14 + oxaliplatine 130 mg/m² à J1, J21=J1) en L1 chez 25 patients métastatiques (mais seulement 12 ADKa, les autres patients étant des ADK du grêle). Le taux de réponse objective était de 50 %, la survie sans progression de 9,4 mois et la survie globale de 15,5 mois (Overman M et al. 2009).
Dans une série rétrospective de 21 ADKa avec le même schéma, la réponse objective était de 38 %, la survie sans progression de 7,3 mois et la survie globale de 19,7 mois, avec une efficacité supérieure dans le sous-groupe intestinal (Kim HS et al. 2013).
Dans la cohorte de Ziang ZQ et al ayant inclus 64 ADKa métastatiques, dont 40 recevaient une chimiothérapie à base de 5-FU et 24 à base de gemcitabine (5-FU monothérapie (n=8), 5-FU platine (n=31), gemcitabine (n=9), gemcitabine-platine (n=9). Il ressort de ces données rétrospectives non appariées un bénéfice numérique à l’utilisation d’une chimiothérapie à base de 5-FU en terme de survie sans progression (Ziang ZQ et al. 2013).
Enfin, dans l’étude de Kim et al ayant inclus 29 patients, ayant eu une chimiothérapie en association au cisplatine (soit avec le 5-FU, soit avec la capécitabine, soit avec la gemcitabine), il n’y avait pas de différence notable en terme de survie sans progression ou de survie globale entre tous ces schémas avec des groupes de petits effectifs (Kim S et al. 2010).
L’ajout d’un anticorps anti VEGF (bevacizumab) a été étudié dans une étude de phase II, il n’y avait malheureusement que 7 ADKa sur les 30 patients inclus avec un taux réponse dans ce sous-groupe de 43 % néanmoins (Overman M et al. 2017). Aucune étude n’ayant étudié l’intérêt des antiEGFr dans les ADKa RAS sauvage, le groupe de travail ne peut se prononcer sur leur utilisation.
Par analogie avec les tumeurs biliopancréatiques, une chimiothérapie de type FOLFIRINOX étant supérieure à la gemcitabine seule en 1ère ligne des ADK pancréatiques (Conroy T et al. 2011) et d’efficacité globalement similaire à l’association gemcitabine cisplatine dans les ADK biliaires (Phelip JM et al. 2022), avec une toxicité gérable, le FOLFIRINOX pourrait donc constituer une option valide. Enfin, dans les ADK du grêle, le FOLFOX semble une option également pertinente (cf. TNCD Chapitre 13 Adénocarcinome de l’intestin grêle).
En situation avancée, une altération moléculaire peut être recherchée, néanmoins celles-ci sont rares (cf. 19.1.6.3).
19.5.3. Chimiothérapie au-delà de la première ligne
Au-delà de la 1ère ligne, plusieurs options thérapeutiques sont envisageables, en l’absence de données cliniques fiables. L’analyse de la cohorte prospective « Adénocarcinome ampullaire » de la FFCD aidera à préciser les schémas utilisés en 2ème ligne et leur efficacité, faute de données randomisées.
Il semble cependant licite de rechercher, pour les patients restant en bon état général et à même d’avoir une 2ème ligne de chimiothérapie, une altération moléculaire ciblable même si celles-ci restent rares.
Les altérations à rechercher concernent principalement l’instabilité microsatellite (IHC et biologie moléculaire) au vu des données d’efficacité rapportées pour les inhibiteurs de point de contrôle immunitaire (Marabelle A et al. 2020), la surexpression de Her2 (IHC ou biologie moléculaire par NGS) ou une anomalie de FGFR (cf. paragraphe 19.1.6.3), même s’il n’y a pas d’AMM spécifique en regard.
Ces indications de traitements sont donc à discuter en staff moléculaire où il pourra par ailleurs être proposé un séquençage multigénique dans le cadre des plans France-Médecine-Génomique 2025.
Il n’y a à l’heure actuelle aucune étude suffisante permettant de proposer un schéma de 2ème ligne, en l’absence d’essai thérapeutique ou de molécule ciblant une altération moléculaire identifiée. De façon pragmatique, elle doit être réservée aux patients en bon état général au vu de l’absence de bénéfice clinique démontré. Les schémas utilisés peuvent être à base de 5FU, d’irinotécan, de gemcitabine voire de taxanes en tenant compte des traitements précédemment reçus en L1.
19.6. INDICATIONS THERAPEUTIQUES
19.6.1. Prise en charge des tumeurs de l’ampoule localisées (cf. 19.9.3. Annexe 3)
REFERENCES (accord d’experts)
Surveillance :
- Adénome ampullaire infracentimétrique et en dysplasie de bas grade sur PAF, tous les 2 ans
Ampullectomie endoscopique :
- Adénome ampullaire sans extension intracanalaire
- Adénome ampullaire avec extension intracanalaire < 1 cm de résection R0
- Adénome ampullaire sur PAF > 1cm ou en dysplasie de haut grade
- Adénocarcinome pTis R0
Ampullectomie chirurgicale :
- Contre-indication technique à une ampullectomie endoscopique monobloc et R0 (diverticule, taille > 3 cm, extension duodénale importante)
- Adénome de l’ampoule avec extension intracanalaire non résécable R0
- Adénome de l’ampoule R1 sur la pièce d’ampullectomie endoscopique
- Récidive post-ampullectomie endoscopique non traitable endoscopiquement
Duodénopancréatectomie céphalique :
- ADKa dès le stade pT1b (anciennement d1)
- ADKa pT1a en cas de résection locale R1 ou avec critères histologiques de mauvais pronostic (peu différencié, invasion lymphovasculaires, budding élevé)
- Adénome de l’ampoule sur PAF avec score de Spigelman élevé (stade IV) et atteinte duodénale non contrôlable endoscopiquement
OPTIONS (avis d’experts)
- Radiofréquence de résidus traitables en cas d’ampullectomie endoscopique ou chirurgicale incomplète non accessible à un traitement chirurgical de rattrapage
- Ampullectomie endoscopique ou chirurgicale pour les ADKa pT1a R0 sans atteinte lymphovasculaire vu le risque ganglionnaire quasi nul
- Ampullectomie endoscopique première à visée de macrobiopsie si l’envahissement T ne pas être formellement précisé
19.6.2. Traitement adjuvant des adénocarcinomes de l’ampoule
19.6.2.1. Chimiothérapie adjuvante (cf. 19.9.4 Annexe 4)
REFERENCES
- Monochimiothérapie pendant 6 mois (grade B)
- gemcitabine 1000 mg/m² 3 semaines sur 4
- ou LV5FU2 simplifié
- ou capécitabine
- Le choix du schéma peut être guidé par le type histologique (gemcitabine à réserver aux types biliopancréatiques ou mixtes ou indéterminés) (accord d’experts).
- Phénotypage de la DPD (uracilémie) si chimiothérapie par 5FU ou capécitabine (recommandations HAS - INCa).
NB : le groupe de travail précise que cette monochimiothérapie est mise en référence car il s’agit là des seules données prospectives de la littérature, l’habitude française étant plutôt une polychimiothérapie à base de fluoropyrimidine
OPTIONS
- pT1-pT2 N0 : pas de chimiothérapie adjuvante pour les ADKa de bon pronostic (grade C).
- pT3/T4, pN+, R1, peu différenciée : vu son faible niveau de preuve et certaines tendances à un bénéfice des séries publiées, une polychimiothérapie adjuvante de 6 mois se discute pour les tumeurs de mauvais pronostic à risque élevé de récidive. Elle doit être réservée aux patients en très bon état général en étant vigilant sur la toxicité, car le bénéfice en terme de survie semblant modeste (accord d’experts) :
- Phénotype intestinal : FOLFOX ou CAPOX
- Phénotype bilio-pancréatique ou mixte ou indéterminés : mFOLFIRINOX pour les patients capable de supporter ce schéma, à adapter si toxicité
ESSAI CLINIQUE
- Essai PRODIGE - AMPIRINOX : Capecitabine ou 5FU vs mFOLFIRINOX dans les ADKa opérés (en cours d’élaboration)
19.6.2.2. Radiothérapie adjuvante
REFERENCE
- Pas de radiothérapie adjuvante dans la prise en charge des adénocarcinomes de l’ampoule opérés hors essais cliniques (grade C)
19.6.3. Chimiothérapie palliative des adénocarcinomes de l’ampoule
19.6.3.1. Chimiothérapie de 1ère ligne (cf. 19.9.5 Annexe 5)
REFERENCE
- Pas de référence
- Phénotypage de la DPD (uracilémie) si chimiothérapie par 5FU ou capécitabine (recommandation HAS - INCa).
OPTIONS
- ADKa localement avancé ou métastatique avec instabilité microsatellite (dMMR/MSI : IHC, confirmé en oncobiologie moléculaire) :
- Immunothérapie de type anti-PD-1 (grade C)
- ADKa métastatique pMMR/MSS : à adapter selon l’état général
- Si phénotype intestinal : mono ou polychimiothérapie à base de fluoropyrimidine +/- oxaliplatine :
- FOLFOX4 simplifié (avis d’experts)
- Ou CAPOX (capécitabine 1000 ou 750 mg/m²/12h J1-J14 + oxaliplatine 130 mg/m² à J1, J21=J1) (grade C)
- Ou FOLFIRINOX sans bolus (avis d’experts)
- Ou 5FU (grade C) ou FOLFIRI (avis d’experts) si contre-indication à l’oxaliplatine
- Si phénotype intestinal : mono ou polychimiothérapie à base de fluoropyrimidine +/- oxaliplatine :
- Si phénotype biliopancréatique ou mixte ou indéterminé :
- Trichimiothérapie de type FOLFIRINOX (avis d’experts)
- Ou bichimiothérapie à base de gemcitabine : GEMCIS (avis d’experts)
- Ou gemcitabine pour les patients OMS 2 (avis d’experts)
19.6.3.2. Chimiothérapie de 2ème ligne et au-delà
REFERENCE
- Aucune référence
OPTIONS
Présence d’une altération moléculaire ciblable : traitements non remboursés dont l’indication est à discuter en RCP moléculaire (recommandation INCa) et si possible dans un essai clinique
- ADKa MSI/dMMR : anticorps anti-PD-1 (grade C)
- Tumeurs Her2 3+ ou Her2 amplifiée : FOLFOX ou 5-FU + trastuzumab (accord d’experts)
- Tumeurs avec translocation de FGFR2 : inhibiteur de FGFR2 (accord d’experts)
- Rares tumeurs avec fusion de NTRK : larotrectinib, entrectinib (accord d’experts)
Absence d’une altération moléculaire ciblable : en l’absence de données prospectives, il est difficile de recommander un schéma de chimiothérapie au-delà de la première ligne. Les molécules pouvant raisonnablement être utilisées sont :
- Mono ou bichimiothérapie (avis d’experts) selon la 1ère ligne réalisée et chez les patients en bon état général à base :
- d’irinotecan : FOLFIRI
- de gemcitabine et sels de platine
- de taxanes
- de fluoropyrimidine si première ligne à base de gemcitabine
- Soins de supports exclusifs (avis d’experts)
19.7. SURVEILLANCE DES FORMES LOCALISEES DES TUMEURS DE L’AMPOULE
19.7.1. Surveillance endoscopique des ADa
Le taux de récidive est de 12 % (Spadaccini M et al. 2020) avec une médiane de récidive de 14 mois (Winter JM et al. 2010). La surveillance doit être endoscopique pour les ADa réséqués par ampullectomie, et tenir compte du terrain (notamment pour les polyposes génétiques).
REFERENCE
- Pas de référence en l’absence de d’étude
OPTIONS (accord d’experts)
- Elle doit être faite au mieux avec un duodénoscope haute définition avec des biopsies de la cicatrice et des anomalies endoscopiques.
- La chromoendoscopie au bleu peut apporter une aide à la détection.
- L’écho-endoscopie dans le cadre de la surveillance n’est pas recommandée, n’ayant pas montré d’intérêt dans l’étude prospective de Napoléon et al (Napoleon B et al. 2014), tout comme la TDM (Sakai A et al. 2019).
- Les recommandations de l’ESGE proposent un contrôle dans les 3 mois (permettant une évaluation précoce ainsi que l’ablation de la prothèse pancréatique), puis 6 mois et 12 mois après puis tous les ans pendant 5 ans.
19.7.2. Surveillance des ADKa opérés
REFERENCE
- Pas de référence en l’absence de d’étude
OPTIONS
- Une TDM TAP injecté peut être réalisé tous les 6 mois pour les patients en bon état général capable d’avoir une chimiothérapie si récidive, comme recommandé par le TNCD pour les adénocarcinomes pancréatique et biliaire. Cependant, le bénéfice de cette surveillance n’a pas été évalué. (avis d’experts)
- Au vu de l’excellent pronostic des ADKa de stade I (stade II ?), la surveillance pourrait être simplement clinique ou échographique. (avis d’experts)
- La durée de suivi proposée est de 5 ans. (accord d’experts)
- La surveillance des marqueurs (ACE, CA19.9) n’ayant pas montré d’intérêt dans le suivi du cancer colorectal opéré, leur dosage dans le cadre de la surveillance des ADKa opéré n’est pas recommandé en routine, et sera à réaliser en cas de signe clinique de récidive ou de doute diagnostique sur la TDM de surveillance. (accord d’experts)
19. 8. PROTOCOLES DE CHIMIOTHERAPIE
Gemcitabine
1000 mg/m² en perfusion de 30 min
Tous les semaines, 3 semaines sur 4 (pendant 6 mois pour l’adjuvant)
LV5FU2 simplifié
Acide folinique 400 mg/m² ou L-folinique 200 mg/m² sur 2 h dans 250 ml G5 %, rincer
puis 5FU 400 mg/m² sur 10 min dans 100 ml de G5 %, puis 5FU 2400 mg/m² en perfusion continue de 46 h dans du G5%
Tous les 15 jours
mFOLFIRINOX (adjuvant)
Oxaliplatine 85 mg/m² sur 2 h dans 250 ml de G5%, puis acide folinique 400 mg/m² ou L-folinique 200 mg/m² sur 2 h dans 250 ml G5 %, puis après 30 min débuter en Y l’irinotécan 150 mg/m² sur 1h30, puis 5FU 2400 mg/m² en perfusion continue de 46 h dans du G5%
Tous les 15 jours pendant 6 mois
FOLFIRINOX (métastatique)
Oxaliplatine 85 mg/m² sur 2 h dans 250 ml de G5%, puis acide folinique 400 mg/m² ou L-folinique 200 mg/m² sur 2 h dans 250 ml G5 %, puis après 30 min débuter en Y l’irinotécan 180 mg/m² sur 1h30, puis 5FU 2400 mg/m² en perfusion continue de 46 h dans du G5%.
Le bolus de 5FU de 400 mg/m² peut ne pas être fait car il ajoute une toxicité hématologique sans beaucoup modifier l’efficacité
FOLFOX4 simplifié (adjuvant) équivalent au FOLFOX6 modifié
Oxaliplatine 85 mg/m² sur 2 h dans 250 ml de G5%, puis acide folinique 400 mg/m² ou L-folinique 200 mg/m² sur 2 h dans 250 ml G5 %, puis 5FU 400 mg/m² sur 10 min dans 100 ml de G5 %, puis 5FU 2400 mg/m² en perfusion continue de 46 h dans du G5%
Tous les 15 jours pendant 6 mois
CAPOX
Oxaliplatine 130 mg/m² sur 2 h dans 250 ml de G5%, capécitabine 750 à 1000 mg/m²/12h de J1-J14
Tous les 21 jours
NB : dans la publication d’Overman et al (2009) la dose de capecitabine est de 750 mg/m² mais on peut raisonnablement proposer 1000 mg/m²
FOLFIRI
Irinotecan 180 mg/m² sur 1h30 dans 250 ml de G5%, puis acide folinique 400 mg/m² ou L-folinique 200 mg/m² sur 2 h dans 250 ml G5 %, puis 5FU 400 mg/m² sur 10 min dans 100 ml de G5 %, puis 5FU 2400 mg/m² en perfusion continue de 46 h dans du G5%
Tous les 15 jours
GemCis
Cisplatine 25 mg/m² en 1h dans 1000 ml d2e sérum physiologique puis hydratation réduite (500 ml de sérum physiologique) puis gemcitabine 1000 mg/m² sur 30 min dans 250 ml de sérum physiologique
Toutes les semaines, 2 semaines sur 3
Pembrolizumab
Une injection de 200 mg sur 30 min
Toutes les 3 semaines
19. 9. ANNEXES
19.9.1. Annexe 1 :
Eléments devant figurer sur le compte-rendu d’endoscopie (EOGD, écho-endoscopie) indispensables à la prise en charge des tumeurs de l’ampoule
EOGD :
- Contexte clinique, notion de syndrome génétique personnel ou familial, antécédent de geste local sur l’ampoule
- Technique : EOGD +/- CAP, duodénoscopie
- Aspect dégénéré
- Taille et extension latérale duodénale
- Ulcération
- Localisation
- Atteinte duodénale associée avec score de Spigelman si PAF
- Diverticule duodénal
- Photo de la lésion
Echo-endoscopie :
- Taille
- Envahissement de la tumeur dans la paroi et statut usT
- Présence d’ascite, d’une dilatation des canaux bilio-pancréatiques
- Atteinte canalaire : cholédocienne ou pancréatique de la tumeur, longueur > 1 cm
- Présence de ganglions et caractère pathologique avec notamment taille infra ou supracentimétrique (petit axe) et différenciation :
- plutôt bénin : < 1 cm, réniforme avec hile graisseux central hyperéchogène, oblong ou plat
- plutôt malin : > 1 cm, rond, globalement hypoéchogène
- Stade usT et usN dans la conclusion
- Photo de l’examen
19.9.2. Annexe 2 :
Eléments de pathologie indispensables à la prise en charge des ADa et ADKa
Elément indispensable du compte rendu de pathologie des ADa :
- Grade maximal de la dysplasie
- Taille
- Envahissement des limites d’exérèse (status R). Une attention toute particulière doit être portée à la lecture anatomopathologique de marges latérales et profonde.
Elément indispensable du compte rendu de pathologie des ADKa :
- Taille de la lésion invasive
- Différentiation
- Sous type histologique (INT, BP, mixte ou indéterminé) avec détermination de CDX2, CK20 et MUC1 en cas de situation difficile
- Engainement périnerveux, embols vasculaires, budding tumoral
- Envahissement des limites d’exérèse et marges
- Statut pTNM selon la classification AJCC (8ème édition)
- En option : Statut MMR en IHC (grade C)
Aide au diagnostic des ADKa de phénotype indéterminé (d’après Ang et al)
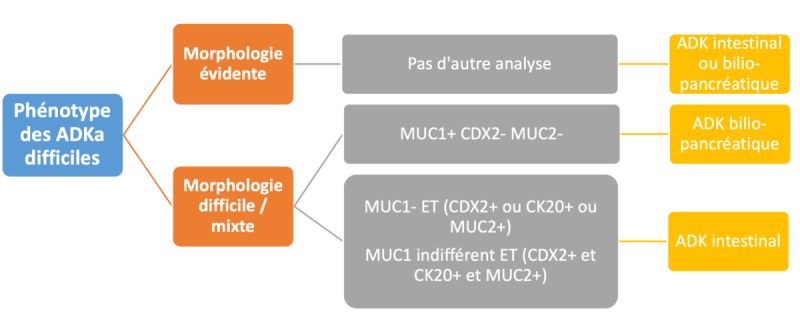
Indications de prise en charge endoscopique ou chirurgicale des formes localisées
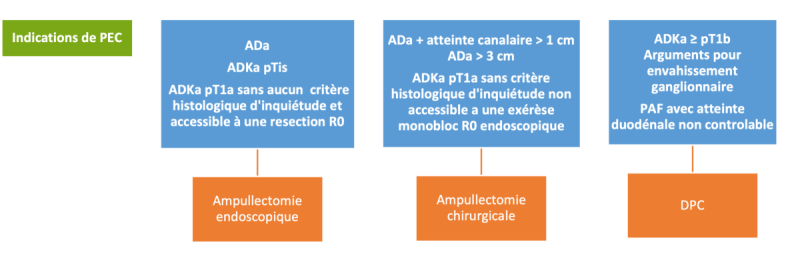
19.9.4. Annexe 4 :
Indications de chimiothérapie adjuvante après chirurgie des ADKa
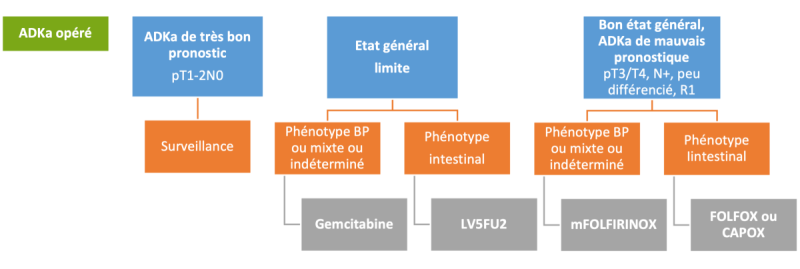
19.9.5. Annexe 5 :
Algorithme des indications de chimiothérapie palliative en 1ère ligne
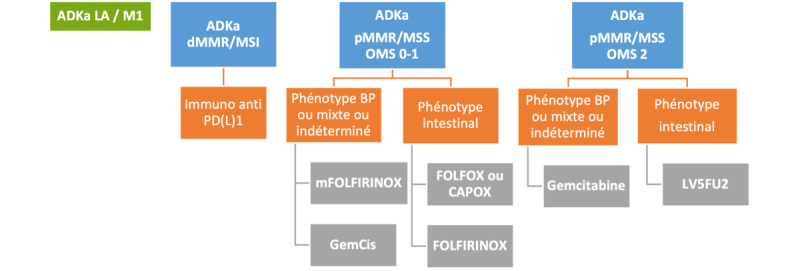
19. 10. BIBLIOGRAPHIE
- Agaram N et al – DNA mismatch repair deficiency in ampullary carcinoma: a morphologic and immunohistochemical study of 54 cases – Am J Clin Pathol 2010;133:772-80
- Alvarez-Sanchez MV et al – Can endoscopic papillectomy be curative for early ampullary adenocarcinoma of the ampulla of Vater? – Surg Endosc 2017; 31: 1564–1572
- Amini A et al – Is local resection adequate for T1 stage ampullary cancer? – HPB 2015;17:66–71
- Ang D et al – The utility of immunohistochemistry in subtyping adenocarcinoma of the ampulla of vater – Am J Surg Pathol 2014;38:1371-1379
- Bisgaard ML et al – Familial adenomatous polyposis (FAP): frequency, penetrance, and mutation rate – Hum Mutat 1994;3:121-125
- Bohnacker S et al – Endoscopic resection of benign tumors of the duodenal papilla without and with intraductal growth– Gastrointest Endosc 2005; 62:551-560
- Bonadona V et al – Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome – JAMA 2011;8 :305:2304-2310
- Camus M – Efficacy and safety of endobiliary radiofrequency ablation for the eradication of residual neoplasia after endoscopic papillectomy: a multicenter prospective study – Gastrointest Endosc 2018; 88: 511–518
- Chang D et al – Histomolecular phenotypes and outcome in adenocarcinoma of the ampulla of Vater – J Clin Oncol 2013;31:1348-56
- Chiorean E – Ampullary Adenocarcinoma, Version 1.2023 – J Natl Compr Canc Netw 2023;21:753–782
- Collaborative Group on Duodenal Polyposis in MAP; Thomas LE, Hurley JJ, Sanchez AA, et al. Duodenal Adenomas and Cancer in MUTYH-associated Polyposis: An International Cohort Study. Gastroenterology. 2021 Feb;160(3):952-954
- Colussi O et al – Prognostic score for recurrence after Whipple's pancreaticoduodenectomy for ampullary carcinomas; results of an AGEO retrospective multicenter cohort – Eur J Surg Oncol 2015;41:520-526
- Conroy T et al – FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer – NEJM 2011;364:1817-1825
- Ecker BL et al – Role of Adjuvant Multimodality Therapy After Curative-Intent Resection of Ampullary Carcinoma. JAMA Surg. 2019;154:706-714.
- Engel C – Risks of less common cancers in proven mutation carriers with lynch syndrome – J Clin Oncol 2012;30:4409–15
- Gingras MC et al – Ampullary Cancers Harbor ELF3 Tumor Suppressor Gene Mutations and Exhibit Frequent WNT Dysregulation – Cell Rep 2016;14:907-919
- Gracient A et al – Endoscopic or surgical ampullectomy for intramucosal ampullary tumor: the patient populations are not the same – J Visc Surg 2020;157:183-191
- Half E et al – Familial adenomatous polyposis – Orphanet J Rare Dis 2009;12;4:22
- Hammoudi N et al – Duodenal tumor risk in Lynch syndrome – Dig Liver Dis 2019;51:299-303
- Heby M et al – Relationship between mismatch repair immunophenotype and long-term survival in patients with resected periampullary adenocarcinoma – J Transl Med 2018
- Hechtman JF et al – Sequencing of 279 cancer genes in ampullary carcinoma reveals trends relating to histologic subtypes and frequent amplification and overexpression of ERBB2 (HER2)– Mod Pathol 2015;28:1123-1129
- Hurley JJ et al – The impact of chromoendoscopy for surveillance of the duodenum in patients with MUTYH-associated polyposis and familial adenomatous polyposis – Gastrointest Endosc. 2018;88:665-673
- Imamura T et al – The Prognostic Relevance of the New 8th Edition of the Union for International Cancer Control Classification of TNM Staging for Ampulla of Vater Carcinoma – Ann Surg Oncol 2019;26:1639-1648
- Jin Z et al – Prognostic factors and benefits of adjuvant therapy after pancreatoduodenectomy for ampullary adenocarcinoma: Mayo Clinic experience. Eur J Surg Oncol. 2018;44:677-683
- Kaiser A et al – The adenoma-carcinoma sequence applies to epithelial tumours of the papilla of Vater – Z Gastroenterol 2002;40:913-920
- Kamarajah S et al – Survival Benefit of Adjuvant Chemotherapy After Pancreatoduodenectomy for Ampullary Adenocarcinoma: a Propensity-Matched National Cancer Database (NCDB) Analysis – J Gastrointestinal Surg 2021 25:1805–1814
- Kang SH et al – Therapeutic outcomes of endoscopic papillectomy for ampullary neoplasms: retrospective analysis of a multicenter study – BMC Gastroenterol 2017;17:69
- Karam E et al – Outcomes of rescue procedures in the management of locally recurrent ampullary tumors: A Pancreas 2000/EPC study – Surgery 2023;173:1254-1262
- Klinkenbijl JH – Adjuvant radiotherapy and 5-fluorouracil after curative resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group – Ann Surg 1999
- Kim HS – Better outcome of XELOX chemotherapy in patients with advanced intestinal-type adenocarcinoma of the ampulla of Vater – Tohoku J Exp Med 2013;231:21-28
- Kim JH et al – Adjuvant Chemotherapy for Resected Ampulla of Vater Carcinoma: Retrospective Analysis of 646 Patients – Cancer Res Treat 2021;53(2):424-435
- Kim MH et al – Tumors of the major duodenal papilla – Gastrointest Endosc 2001; 54:609-620
- Kim ST et al – The efficacy of frontline platinum-based combination chemotherapy in advanced adenocarcinoma of the ampulla of Vater – Med Oncol 2010;27:1149-1154
- Kim SJ et al – Validation of the eighth edition of the American Joint Committee on Cancer staging system for ampulla of Vater cancer – Surgery 2018;163:1071-1079
- Laleman W et al – Endoscopic resection of ampullary lesions: a single-center 8-year retrospective cohort study of 91 patients with long-term follow-up – Surg Endosc 2013;27:3865-76
- Latchford A et al – Features of duodenal cancer in patients with familial adenomatous polyposis – Clin Gastroenterol Hepatol 2009;7:659-63).
- Maio M et al – Pembrolizumab in microsatellite instability high or mismatch repair deficient cancers: updated analysis from the phase II KEYNOTE-158 study– Ann Oncol 2022;33:929-938
- Marabelle A et al – Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study – J Clin Oncol 2020;38:1-10
- Moekotte A et al – Development and external validation of a prediction model for survival in patients with resected ampullary adenocarcinoma – Eur J Surg Oncol 2020;46:1717-1726
- Moekotte A et al – Gemcitabine-based adjuvant chemotherapy in subtypes of ampullary adenocarcinoma: international propensity score-matched cohort study – Br J Surg 2020;107:1171-1182
- Morak MJM et al – Adjuvant intra-arterial chemotherapy and radiotherapy versus surgery alone in resectable pancreatic and periampullary cancer: a prospective randomized controlled trial – Ann Surg 2008
- Nakashi K et al – Adjuvant S-1 compared with observation in resected biliary tract cancer (JCOG1202, ASCOT): a multicentre, open-label, randomised, controlled, phase 3 trial – Lancet 2023;401:195–203
- Napoléon B et al – Endoscopic papillectomy for early ampullary tumors: long-term results from a large multicenter prospective study – Endoscopy 2014; 46:127-34
- Napoleon B et al – Can endoscopic papillectomy be curative for early ampullary adenocarcinoma of the ampulla of Vater? – Surg Endosc 2017
- Nassour I et al – Association of Adjuvant Therapy with Improved Survival in Ampullary Cancer: A National Cohort Study – J Gastrointest Surg 2018;22:695-702
- Neoptolemos J et al – Effect of adjuvant chemotherapy with fluorouracil plus folinic acid or gemcitabine vs observation on survival in patients with resected periampullary adenocarcinoma: the ESPAC-3 periampullary cancer randomized trial – JAMA 2012
- Offenhaus GJ et al – The risk of upper gastrointestinal cancer in familial adenomatous polyposis – Gastroenterology 1992;102:1980-1982
- Ohike N et al – Tumor budding as a strong prognostic indicator in invasive ampullary adenocarcinomas – Am J Surg Pathol. 2010;34:1417–24
- Ostwal V et al – Role of adjuvant chemotherapy in T2N0M0 periampullary cancers –Asia-Pacific J Clin Oncol 2017;13,e298-e303
- Olthof P et al – Screening for colorectal cancer after pancreatoduodenectomy for ampullary cancer – Eur J Surg Oncol 2020;46:534-538
- Overman M et al – Phase II study of capecitabine and oxaliplatin for advanced adenocarcinoma of the small bowel and ampulla of Vater– J Clin Oncol 2009; 27:2598-603
- Overman M et al – Bevacizumab combined with capecitabine and oxaliplatin in patients with advanced adenocarcinoma of the small bowel or ampulla of vater: A single-center, open-label, phase 2 study– Cancer 2017;123:1011–1017
- Perkins G et al – Can we classify ampullary tumours better? Clinical, pathological and molecular features. Results of an AGEO study– Br J Cancer 2019;120:697-702
- Phelip JM et al – Modified FOLFIRINOX Versus CISGEM Chemotherapy for Patients With Advanced Biliary Tract Cancer (PRODIGE 38 AMEBICA): A Randomized Phase II Study– J Clin Oncol 2022;40:262-271
- Pinto P – Analysis of Founder Mutations in Rare Tumors Associated With Hereditary Breast/Ovarian Cancer Reveals a Novel Association of BRCA2 Mutations with Ampulla of Vater Carcinomas– PloS One 2016;17;11:e0161438
- Ponchon T et al – Contribution of endoscopy to diagnosis and treatment of tumors of the ampulla of Vater – Cancer 1989;64:161-167
- Radojkovic M, Stojanovic M, Radojković D, et al. Histopathologic differentiation as a prognostic factor in patients with carcinoma of the hepatopancreatic ampulla of Vater. J Int Med Res. 2018 Nov;46(11):4634-4639.
- Ramaswamy A et al – Clinico-pathological correlates and survival outcomes in 214 resected ampullary adenocarcinomas - are outcomes different in intestinal and pancreatobiliary subtypes with adjuvant gemcitabine? – HPB 2020;22:376-382
- Reid M et al – Ampullary carcinoma is often of mixed or hybrid histologic type: an analysis of reproducibility and clinical relevance of classification as pancreatobiliary versus intestinal in 232 cases – Mod Pathol 2016;29:1575-1585
- Ridtitid W et al – Endoscopic papillectomy: risk factors for incomplete resection and recurrence during long-term follow-up – Gastrointest Endosc 2014;79:289–296
- Rostain F et al – Trends in incidence and management of cancer of the ampulla of Vater – World J Gastroenterol 2014;20(29):10144-50
- Salaün PY et al – Update of the recommendations of good clinical practice for the use of PET in oncology – Bull Cancer 2019;106: 262–27
- Schiergens T et al – Prognostic Value of Preoperative Serum Carcinoembryonic Antigen and Carbohydrate Antigen 19-9 After Resection of Ampullary Cancer – J Gastrointest Surg 2017;21:1775–1783
- Schiergens T et al – Histomorphologic and molecular phenotypes predict gemcitabine response and overall survival in adenocarcinoma of the ampulla of Vater – Surgery 2015;158:151-61
- Schneider AR et al – Frequency of colorectal polyps in patients with sporadic adenomas or adenocarcinomas of the papilla of vater : an age-matched, controlled study – Z Gastroenterol 2005;43:1123-1127
- Shi X et al – Effect of cap-assisted esophagogastroduodenoscopy on examination of the major duodenal papilla: a noninferior, randomized controlled trial – Endoscopy 2019;51:427-35
- Shin DW et al – Impact of histopathological type on the prognosis of ampullary carcinoma: A systematic review and meta-analysis – Eur J Surg Oncol 2023;49:306-315
- Singh A et al – Natural history of ampullary adenomas in familial adenomatous polyposis: a long-term follow-up study – Gastrointest Endosc 2022;95:455-467
- Sivak M et al – Clinical and endoscopic aspects of tumors of the ampulla of Vater - Endoscopy 1988;20 suppl 1:211-217
- Smeenk HG et al – Long-term survival and metastatic pattern of pancreatic and periampullary cancer after adjuvant chemoradiation or observation: long-term results of EORTC trial 40891 – Ann Surg 2007;246:734-40
- Spadaccini M et al – Endoscopic papillectomy for neoplastic ampullary lesions: A systematic review with pooled analysis – United European Gastroenterol J 2020;8:44–51
- Stiles Z et al – Ampullary adenocarcinoma: Defining predictors of survival and the impact of adjuvant therapy following surgical resection for stage I disease – J Surg Oncol. 2018;117:1500–1508
- Syngal S et al – ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015;110:223-62
- Thomas L et al – Duodenal Adenomas and Cancer in MUTYH-associated Polyposis: An International Cohort Study – Gastroenterology 2021;160:952-954.e4
- Trikudanathan G et al – Staging accuracy of ampullary tumors by endoscopic ultrasound: meta-analysis and systematic review – Dig Endosc 2014;26:617-626
- Tringali A et al – Endoscopic snare papillectomy for adenoma of the ampulla of vater: Long-term results in 135 consecutive patients – Dig Liver Dis 2020;52:1033-1038
- Vanbiervliet G et al – Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Endoscopy 2021;53:429-448
- Vedantam S et al – Outcomes of upper endoscopy screening in Lynch syndrome: a meta-analysis – Gastrointest Endosc 2023;97:2-10.e1
- Walton SJ et al – Frequency and Features of Duodenal Adenomas in Patients With MUTYH-Associated Polyposis – Clin Gastroenterol Hepatol 2016;14:986-992
- Win AK et al – Risks of colorectal and other cancers after endometrial cancer for women with Lynch syndrome – J Natl Cancer Inst 2013;105 :274-279
- Winter JM et al – Clinicopathologic analysis of ampullary neoplasms in 450 patients: implications for surgical strategy and long-term prognosis – J Gastrointest Surg 2010;14:379-387
- Wong W et al – Ampullary cancer: Evaluation of somatic and germline genetic alterations and association with clinical outcomes – Cancer 2019;125(9):1441-144
- Xue Y et al – Immunohistochemical Classification of Ampullary Carcinomas: Critical Reappraisal Fails to Confirm Prognostic Relevance for Recently Proposed Panels, and Highlights MUC5AC as a Strong Prognosticator – Am J Surg Pathol 2017;41:865-876
- Xue Y et al – Frequency and clinicopathologic associations of DNA mismatch repair protein deficiency in ampullary carcinoma: Routine testing is indicated – Cancer 2020;126:4788-4799
- Yachida S et al – Genomic Sequencing Identifies ELF3 as a Driver of Ampullary Carcinoma – Cancer Cell 2016;29:229-40
- Zhou F et al – High frequency of colorectal neoplasia in patients with sporadic adenomas or adenocarcinomas of the papilla of Vater: The same adenoma-carcinoma sequence? – Dig Liver Dis 2023;55: 679-684
- Zimmermann C et al – The pathohistological subtype strongly predicts survival in patients with ampullary carcinoma – Sci Rep 2019;9:12676
- Ziang ZQ et al – A retrospective study of ampullary adenocarcinomas: overall survival and responsiveness to fluoropyrimidine-based chemotherapy – Ann Oncol 2013;24:2349-2353

