2. Cancer de l'estomac
(Dernière mise à jour le : )Principaux changements de la mise à jour du 12/05/2025
2.3.2.3.1. étude du curage ganglionnaire : au moins 16 ganglions doivent être analysés
2.3.2.3.2. nouveaux biomarqueurs : score TAP (Tumor Area Positivity) et recherche d’une expression de la claudin18.2
2.3.3.1. forme localisée chimio(radio)thérapie : résultats négatifs de phase III TOPGEAR
2.3.4.1.2. et 2.4.2.1.2. formes avancées 1ière ligne tumeur HER2 négative :
• phase III KN859 avec remboursement du pembrolizumab pour les tumeurs CPS≥10
• phase III RATIONALE 305 avec demande de remboursement du tislelizumab en cours d’évaluation pour les tumeurs TAP>5%
• phase III SPOTLIGHT et GLOW avec AMM du zolbetuximab et accès précoce en France pour les tumeurs HER2 négative/CPS<5
2.3.4.1.3. et 2.4.2.1.1. formes avancées 1ière ligne tumeur HER2 positive : phase III KN811 avec AMM du pembrolizumab et accès précoce en France pour les tumeurs HER2 positive/CPS≥1
2.4.2. traitement des formes avancées : algorithme actualisé
2.3.4.5. place de chirurgie en situation métastatique : phase III RENAISSANCE négative mais approche individuelle dans cas hautement sélectionnés de maladie oligométastatique et bien contrôlée sous chimiothérapie
Principaux changements de la mise à jour du 29/03/2024
Pour le traitement des adénocarcinomes œso-gastriques avancés, l’algorithme et les indications thérapeutiques (chapitre 2.4.2.) intègrent les résultats positifs de plusieurs essais de phase III :
En 1ère ligne :
• l’essai PRODIGE-FFCD GASTFOX avec le TFOX
• deux essais avec le zolbetuximab pour les tumeurs claudin 18.2 positives
• l’essai KN859 avec le pembrolizumab pour les tumeurs CPS≥1
• l’essai KN811 avec le pembrolizumab + trastuzumab et chimiothérapie pour les tumeur HER2 positives et CPS≥1
En 3ème ligne et plus :
• l’essai INTEGRATE avec le regorafenib
• AMM et remboursement du trastuzumab-deruxtecan
Groupe de travail et relecteurs
Groupe de travail :
A. ZAANAN (Paris), coordonnateur,
M. BARRET (Paris), B. BUECHER (Paris), N. CHAPELLE (Nantes), O. DUBREUIL (Paris), M. DUCREUX (Villejuif), J. DURAND-LABRUNIE (Villejuif), O. ERNST (Lille), N. FARES (Toulouse), J. GAGNIERE (Clermont-Ferrand), M. JARY (Clermont-Ferrand), A. MARIANI (Paris), F. RENAUD (Paris).
Relecture :
A. ADENIS (Montpellier), I. AL NAASAN (Chambery), O. BOUCHE (Reims), N. CARRERE (Toulouse), M. CHAUVENET (Pierre Bénite), S. DEGUELTE Sophie (Reims), F. EL HAJBI (Lille), L. ETCHECHOURY (Bayonne), F.N. GILLY (Pierre Bénite), B GUIU (Montpellier), S GAUJOUX (Paris), B. GUIU (Montpellier), F. HUGUET (Paris), T. LECOMTE (Tours), C. LOUVET (Paris), J.Y. MABRUT (Lyon), L. MAGGIORI (Paris), S. MANFREDI (Dijon), P. MARIANI (Paris), J.P. METGES (Brest), L. MOSSER (Rodez), G. PIESSEN (Lille), Y. RANCHOUP (Grenoble).
Comment citer ce chapitre du TNCD :
Zaanan A, Bouché O, Benhaim L, Buecher B, Chapelle N, Dubreuil O, Fares N, Granger V, Lefort C, Gagniere J, Meilleroux J, Baumann AS, Vendrely V, Ducreux M, Michel P. Gastric cancer: French intergroup clinical practice guidelines for diagnosis, treatments and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO). Dig Liver Dis. 2018 Aug;50(8):768-779. doi: 10.1016/j.dld.2018.04.025
Et mise à jour 2025 :
A. Zaanan, M. Barret, B. Buecher, N. Chapelle, O. Dubreuil, J. Durand-Labrunie, O. Ernst, N. Fares, J. Gagnière, V. Granger, M. Jary, A. Mariani, F. Renaud, M. Ducreux, O. Bouché. « Cancer de l’estomac ». Thésaurus National de Cancérologie Digestive, mai 2025, en ligne [http://www.tncd.org]
2.1. Introduction
Au niveau mondial, le cancer gastrique est au 4ème rang d’incidence des cancers chez les hommes et au 7e rang d’incidence des cancers chez les femmes. Il représente la 4e cause de mortalité par cancer chez les hommes et la 5ème cause de mortalité par cancer chez les femmes (Sung 2021). En France, la diminution de l’incidence des cancers gastriques est possiblement parvenue à un plateau puisque le nombre de cas incident était de 6 550 en 2012 et de 6 557 en 2018 (Defossez 2019). Le taux d’incidence standardisé du cancer gastrique (hors jonction œso-gastrique) diminue régulièrement d’environ 1,8 % par an (Defossez 2019). Cette diminution peut s’expliquer par un meilleur contrôle des facteurs de risque, au premier rang desquels l’éradication d’Helicobacter pylori qui diminue de moitié le risque de cancer gastrique (Rokkas 2017). Les autres facteurs de risque de l'adénocarcinome gastrique sont la gastrite atrophique auto-immune (maladie de Biermer), les antécédents familiaux, l’origine ethnique, la consommation excessive d'alcool, le tabagisme, l'infection à EBV, une alimentation riche en sel et l’antécédent personnel ancien (au-delà de 10 ans) de gastrectomie partielle (Smyth 2020).
Il existe classiquement une distinction anatomique entre les tumeurs gastriques et les tumeurs de la jonction œsogastrique (JOG). Bien que classées dans le même groupe pour la Classification Internationale des Maladies (CIM-10), ces deux entités se distinguent par des caractéristiques moléculaires, des facteurs de risque, des évolutions épidémiologiques, et des modalités thérapeutiques spécifiques (Bass 2014). Pour les tumeurs de la JOG, la classification topographique de Siewert permet de distinguer 3 types ; type 1 : centre de la tumeur localisé entre 1 cm et 5 cm au-dessus du cardia anatomique (ligne Z) ; type 2 : entre1 cm au-dessus et 2 cm au-dessous du cardia anatomique; type 3 : entre 2 cm et 5 cm au-dessous du cardia anatomique. Les tumeurs de la JOG de type 1 de la classification de Siewert sont classiquement traitées comme des tumeurs de l’œsophage (voir chapitre « œsophage » du TNCD). Cependant, plusieurs études dédiées au cancer gastrique incluent aussi les tumeurs de la JOG indépendamment de la classification de Siewert.
En raison des caractéristiques épidémiologiques, cliniques et pathologiques distinctes entre les populations asiatiques et non asiatiques, les résultats des données obtenues en population asiatique ne sont pas systématiquement transposables aux populations non asiatiques et doivent être interprétés avec précaution. L’analyse de la littérature a donc été limitée le plus souvent aux études ayant inclus des patients non asiatiques.
Ce chapitre concerne spécifiquement les adénocarcinomes gastriques. Les autres types histologiques de tumeurs primitives gastriques (tumeurs stromales, lymphomes, tumeurs neuroendocrines) sont traités dans des chapitres spécifiques.
Méthodologie de la recherche bibliographique : ce travail est fondé sur les versions précédentes du Thésaurus National de Cancérologie Digestive (TNCD), les recommandations de l’Institut national du cancer (INCa), la recherche des données récentes à partir de la base Medline interrogée jusqu‘en mars 2025 par le moteur de recherche PubMed en utilisant les mots-clés « gastric cancer », « gastric cancer incidence », « early gastric cancer », « gastric cancer chemotherapy», « gastric cancer surgical treatment». Ont été intégrés les résultats des études non encore publiées mais présentées en communication orale à l’« American Society of Clinical Oncology, Annual Meeting », l’« American Society of Clinical Oncology, GI symposium », ou l’« European Society of Medical Oncology »
2.1.1. Classification UICC (8ème édition)
T :
- T1 : Tumeur limitée à la muqueuse ou à la sous-muqueuse (cancer superficiel)
- T1a m1(Tis) : Tumeur intra-épithéliale sans invasion de la lamina propria, dysplasie de haut grade ou carcinome in situ
- T1a m2 : tumeur envahissant la lamina propria
- T1a m3 : tumeur envahissant la musculaire muqueuse
- T1b sm1 : tumeur envahissant la sous-muqueuse sur moins de 500 microns
- T1b sm2 : tumeur envahissant la sous-muqueuse sur plus de 500 microns
- T2 : Tumeur étendue à la musculeuse
- T3 : Tumeur envahissant la sous séreuse (y compris ligament gastro-colique ou gastro-hépatique ou grand épiploon)
- T4 : Tumeur envahissant la séreuse ou les organes adjacents
- T4a : Tumeur envahissant la séreuse (péritoine viscéral)
- T4b : Tumeur envahissant un organe ou une structure de voisinage (rate, côlon transverse, foie, diaphragme, pancréas, paroi abdominale, surrénale, rein, intestin grêle, rétropéritoine)
L’envahissement de l’œsophage ou du duodénum n’est pas considéré comme l’envahissement d’un organe adjacent.
N :
- Nx : ganglions non évaluables
- N0 : pas d’envahissement ganglionnaire (noter combien de ganglions ont été examinés)
- N1 : 1 à 2 ganglions régionaux métastatiques
- N2 : 3 à 6 ganglions régionaux métastatiques
- N3 : 7 ou plus ganglions régionaux métastatiques
- N3 a : 7 à 15 ganglions régionaux métastatiques
- N3b : 16 ou plus ganglions régionaux métastatiques
M :
- M0 : pas de métastase
- M1 : métastase à distance (dont ganglions rétro-pancréatiques, mésentériques, para-aortiques, sus-claviculaires)
Stades pTNM (8ème édition)
| Stade 0 | Tis | N0 | M0 |
| Stade IA | T1 | N0 | M0 |
| Stade IB | T1 T2 | N1 N0 | M0 M0 |
| Stade IIA | T1 T2 T3 | N2 N1 N0 | M0 M0 M0 |
| Stade IIB | T1 T2 T3 T4a | N3a N2 N1 N0 | M0 M0 M0 M0 |
| Stade IIIA | T2 T3 T4a T4b | N3a N2 N1, N2 N0 | M0 M0 M0 M0 |
| Stade IIIB | T1 T2 T3 T4a T4b | N3b N3b N3a N3a N1, N2 | M0 M0 M0 M0 M0 |
| Stade IIIC | T3 T4a T4b | N3b N3b N3a, N3b | M0 M0 M0 |
| Stade IV | Tout T | Tout N | M1 |
2.1.2. Classifications histologiques
Classification de Lauren
- Intestinal
- Diffus (incluant les carcinomes à cellules isolées)
- Mixte (approximativement 50% de chaque type)
Classification OMS 2019 (5ème édition)
- Adénocarcinome
- Adénocarcinome tubuleux
- Adénocarcinome papillaire
- Adénocarcinome mucineux (>50 % de mucus extracellulaire)
- Adénocarcinome à cellules peu cohésives (>50% de cellules peu cohésives, qui peuvent être des cellules en bague à chaton et/ou des cellules peu cohésives de type NOS (not otherwise specified)
- Adénocarcinome mixte (au moins 2 contingents distincts, l’un glandulaire, l’autre à cellules peu cohésives)
- Adénocarcinome micropapillaire
- Carcinome avec stroma lymphoïde (médullaire)
- Carcinome hépatoïde, carcinome à différenciation entéroblastique
- Carcinome adéno-squameux
- Carcinome épidermoïde
- Carcinome indifférencié
- Carcinome neuroendocrine
Degré de différenciation
- G1 : Bien différencié
- G2 : Moyennement différencié
- G3 :Peu différencié
- Gx : pas évaluable
- Non applicable
2.2. Explorations pré-thérapeutiques
2.2.1. Bilan diagnostique et pré-thérapeutique
REFERENCES (accord d'experts)
Le diagnostic du cancer de l’estomac repose sur la réalisation d’une endoscopie digestive haute avec biopsies.
- Nombre de biopsies
- Si la lésion apparait accessible à une résection endoscopique, la priorité est à la documentation photo et vidéo de la lésion, 1 ou 2 biopsies de la lésion peuvent être réalisées pour confirmer la présence de dysplasie ou de cancer, sans compromettre la résection ultérieure.
- Si la lésion ne parait pas accessible à une résection endoscopique (§ chapitre 2.3.2.1), il est nécessaire de réaliser un nombre suffisant de biopsies (au minimum 10) pour permettre un diagnostic anatomo-pathologique et la recherche de biomarqueurs).
- Dans la forme linitique, les biopsies endoscopiques ont une sensibilité de seulement 50 % (Andriulli 1990). En cas de suspicion de linite avec biopsies standard négatives, des biopsies « en puits » (en utilisant préférentiellement une pince à large mors) pour atteindre la sous-muqueuse, des macrobiopsies à l’anse ou une ponction sous écho-endoscopie peuvent être proposées.
- Dans tous les cas, l’exploration attentive de l’ensemble de la muqueuse gastrique, en utilisant une chromo-endoscopie virtuelle est indiquée à la recherche d’une atteinte du cardia ou du pylore, d’éventuelles autres lésions, ou des lésions précancéreuses gastriques associées.
- Des biopsies antrales et fundiques à la recherche d’une infection à Helicobacter pylori sont également réalisées.
- La distance de la tumeur par rapport au cardia et au pylore, ainsi qu’à l’angle de His, est renseignée, ainsi que l’existence d’une hernie hiatale ou la présence d’un œsophage de Barrett pour les lésions de la JOG.
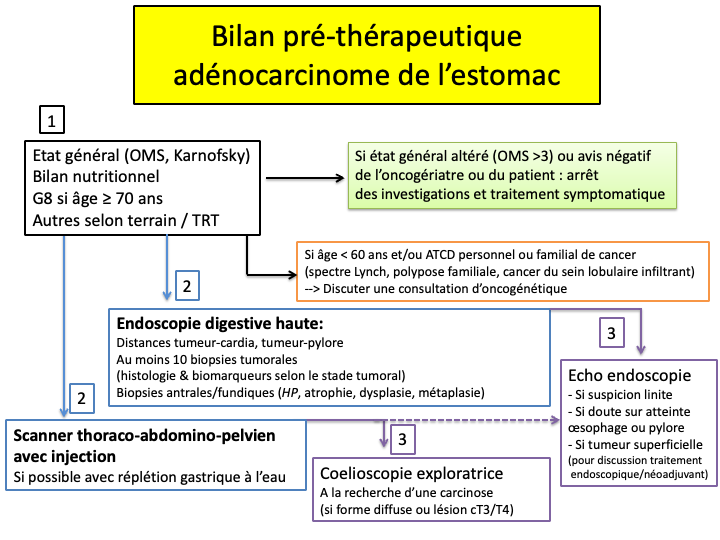
L’évaluation clinique et biologique est nécessaire avant toute prise en charge thérapeutique. Celle-ci inclut :
- L’évaluation de l’état général (échelle OMS ou Karnofsky)
- Le score G8 si âge > 70 ans
- L’évaluation onco-gériatrique (si âge > 70 ans et score G8 < 14/17)
- Le bilan nutritionnel (selon recommandation de l’HAS, https://has-sante.fr)
- L’évaluation cardiologique (ECG, et évaluation de la fraction d’éjection) selon les antécédents personnels, et si une chimiothérapie cardio-toxique est envisagée
- Un bilan pulmonaire (EFR) en fonction du terrain si une chirurgie avec thoracotomie est envisagée
- L’évaluation de la fonction rénale (clairance de la créatinine)
- La recherche d’un éventuel déficit en DPD
2.2.2. Bilan d'extension
REFERENCES (accord d'experts)
- Scanner thoraco-abdomino-pelvien :
Il est réalisé avec injection de produit de contraste en l’absence de contre-indication pour le bilan de résécabilité et la recherche de métastases à distance. Ses performances pour préciser l’extension ganglionnaire et pariétale sont inférieures à celles de l’écho-endoscopie. Cependant, la dilatation gastrique à l’eau augmente la sensibilité de l’examen pour évaluer l’infiltration tumorale pariétale et détecter des adénopathies péri-gastriques (Kumano 2005, Chen 2007). - Écho-endoscopie digestive haute, cet examen est utile :
- en cas de suspicion de linite avec hypertrophie des plis gastriques lorsque l’examen histologique des biopsies n’est pas contributif ;
- pour évaluer l’extension des lésions sur l’œsophage, le pylore et le duodénum en cas de linite ;
- pour déterminer l'infiltration pariétale et ganglionnaire d’une tumeur dont les résultats sont nécessaires à la discussion d’un traitement endoscopique ou néoadjuvant.
L’écho-endoscopie ne doit pas retarder la prise en charge. En effet, une chimiothérapie préopératoire peut être proposée pour les tumeurs cT3 ou cT4 objectivées au scanner.
- Laparoscopie exploratrice :
Elle est utile pour la recherche d’une carcinose péritonéale (Gertsen 2021) (Ramos 2016), notamment en cas de tumeur T3/T4 ou en cas de tumeurs de type diffus (accord d’experts). Un lavage péritonéal avec cytologie positive serait un facteur de mauvais pronostic (Jamel 2018).
OPTIONS (accord d'experts)
- IRM hépatique :
Elle n’est pas indiquée dans le bilan d’extension locorégional mais peut aider au diagnostic de lésions non caractéristiques au scanner, en particulier hépatiques. - Tomographie par émission de positons (TEP) :
Sa place dans la prise en charge des adénocarcinomes gastriques reste controversée (Gertsen 2021) et son indication doit être discutée au cas par cas (accord d’experts). - Marqueurs tumoraux :
Aucune étude méthodologiquement correcte n’a été réalisée sur l’utilité du dosage des marqueurs tumoraux. Néanmoins, les marqueurs ACE et CA19-9 peuvent être utiles pour le suivi de la maladie (accord d’experts).
2.2.3. Recherche d’une prédisposition familiale
En cas de suspicion de prédisposition génétique, les patients doivent être adressés en consultation d’oncogénétique. Les deux principales formes héréditaires de cancers gastriques connues correspondent au syndrome de Lynch (type intestinal le plus souvent) et aux formes associées aux mutations du gène CDH1 (type diffus).
2.2.3.1. Syndrome de Lynch (voir chapitre « cancer colorectal » du TNCD)
2.2.3.2. Cancer gastrique de type diffus associé aux mutations CDH1
Les formes héréditaires des cancers gastriques de type diffus (CGD) ont été définies arbitrairement par un consortium international (International Gastric Cancer Linkage Consortium, IGCLC) de la façon suivante :
- ≥ 2 cas de CGD chez des apparentés au 1er ou au 2nd degré, dont au moins 1 cas est diagnostiqué à un âge < 50 ans ;
ou - ≥ 3 cas de CGD chez des apparentés au 1er ou au 2nd degré, quels que soient les âges au diagnostic.
Environ 40 % des cas validant ces critères sont associées à une mutation constitutionnelle du gène CDH1. Ces mutations sont également associées à une augmentation du risque de carcinome mammaire de type lobulaire infiltrant (CLI) et de fentes labiales ou labio-palatines de telle sorte que les indications d’étude du gène CDH1, récemment actualisées (Blair 2020) sont les suivantes :
- ≥ 2 cas de cancers gastriques chez des apparentés au 1er ou au 2nd degré, dont au moins 1 correspond à un type diffus prouvé histologiquement (CGD), quels que soient les âges au diagnostic.
- ≥ 1 cas de CGD (quel que soit l’âge au diagnostic) chez un individu dont ≥ 1 apparenté au 1er ou au 2nd degré a été atteinte d’un CLI à un âge < 70 ans.
- ≥ 1 cas de CGD diagnostiqué à un âge <50 ans, quelle que soit l’histoire familiale.
- CGD diagnostiqué chez un individu d’ethnie Maori, quels que soient l’âge au diagnostic et l’histoire familiale.
- CGD diagnostiqué dans un contexte d’antécédent personnel et/ou familial de fente labiale ou palatine.
- Association, chez un même individu d’un CGD et d’un CLI, si les 2 diagnostics ont été portés à un âge < 70 ans.
- Lésions diffuses d’adénocarcinome intra-épithélial à type de foyers ou d’extensions pagétoïdes de cellules en bague à chaton (signet ring cells) diagnostiquées à un âge < 50 ans.
En l’absence d’histoire familiale de cancer gastrique, l’étude du gène CDH1 est également proposée aux femmes atteintes d’un CLI bilatéral à un âge < 70 ans ou en présence d’au moins de 2 cas de CLI diagnostiqués à des âges < 50 ans chez des apparentés au 1er ou au 2nd degré.
En pratique, l’analyse du gène CDH1 est dorénavant réalisée en France chez toute personne suspecte d’avoir une prédisposition génétique aux cancers du tube digestif ou du sein puisque ce gène a été récemment inclus dans les « panels de gènes » de prédisposition à ces cancers.
En cas de mutation constitutionnelle avérée de CDH1, une gastrectomie totale prophylactique est recommandée, entre l’âge de 20 et 30 ans, à adapter au cas par cas et en tenant compte de l’histoire familiale (§ chapitre oncogénétique du TNCD).
2.2.3.3. Mutations constitutionnelles d’autres gènes
- Des mutations d’autres gènes ont été identifiées dans le cadre de formes héréditaires de CGD non expliquées par une mutation du gène CDH1. En, particulier, une mutation du gène CTNNA1 qui code pour l’alpha-caténine est en cause dans de rares familles (Hansford 2015). Il est maintenant recommandé d’étudier systématiquement le gène CTNNA1 lorsque les critères d’indication d’étude du gène CDH1 sont validés et qu’aucune mutation constitutionnelle de ce gène n’a été identifiée.
- Le cancer gastrique fait également partie du spectre d’autres syndromes de prédisposition héréditaires aux cancers qui doivent être systématiquement évoqués lorsque le diagnostic n’est pas déjà établi : polyposes adénomateuses colorectales (liées à APC ou à MUTYH) ; polypose juvénile (liée à SMAD4 ou à BMPR1A) ; syndrome de Peutz-Jeghers (gène STK11/LKB1) ; maladie de Cowden (gène PTEN) ; syndrome de Li-Fraumeni (gène TP53). La forme héréditaire d’adénocarcinomes gastriques de type intestinal avec polypose fundique glandulo-kystique dysplasique (Gastric Adenocarcinoma and Proximal Polyposis of the Stomach, GAPPS syndrome) est une entité rare, à transmission autosomique dominante, en rapport avec une mutation de l’exon 1B du gène APC (Li 2016).
Il est important de noter que la reconnaissance de ces différentes formes génétiques est essentielle en raison des enjeux à la fois pour les « cas index » (modalités de prise en charge et de dépistage spécifiques) et pour leurs apparentés (possibilité de réaliser des tests génétiques ciblés afin d’identifier les personnes à risque).
2.2.4. Recherche d’une infection à H. Pylori
La recherche d’une infection à Helicobacter pylori suivie, le cas échéant, d’un traitement d’éradication dont l’efficacité doit être systématiquement contrôlée, est recommandée :
- chez tous les patients atteints de cancer gastrique avec projet thérapeutique curatif. L’éradication de Hp doit être envisagée avant la résection (endoscopique ou chirurgicale partielle) ou dans l’année qui suit, afin de diminuer le risque de lésion métachrone (Kim 2020) (Choi 2018)
- chez tous les sujets sains avec forme héréditaire de cancer gastrique
- chez les apparentés au 1er degré des patients atteints de formes « sporadiques » chez lesquels il existe une augmentation démontrée du risque de cancer gastrique (Brenner 2000). Cette recherche doit être proposée le plus tôt possible. Les modalités dépendent de l’âge des intéressés (https://www.has-sante.fr) :
- Pour les sujets asymptomatiques de moins de 40-45 :
- Test respiratoire à l’urée marquée au 13C ou
Sérologie Helicobacter pylori
- Pour les sujets de plus de 40-45 ans : endoscopie digestive haute avec biopsies.
- Pour les sujets asymptomatiques de moins de 40-45 :
2.3. Traitements
En février 2018, l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) a préconisé la recherche d’un déficit en dihydropyrimidinase(DPD) pour tout patient concerné par une chimiothérapie intégrant des fluoropyrimidines. En décembre 2018, l’Institut national du cancer (INCa) et la Haute Autorité de Santé (HAS) ont recommandé la recherche du déficit en DPD par la mesure de l’uracilémie :
- en cas d’uracilémie ≥ 150 ng/ml (évocatrice d’un déficit complet en DPD), le traitement par fluoropyrimidines est contre-indiqué ;
- en cas d’uracilémie comprise entre 16 ng/ml et 150 ng/ml (évocatrice d’un déficit partiel en DPD), et sur la base d’une concertation entre le laboratoire et l’équipe médicale, la posologie initiale des fluoropyrimidines doit être adaptée en tenant compte du niveau d’uracilémie mesuré, en plus des autres facteurs de risque de toxicité déjà pris en compte (protocole de traitement, âge, état général du patient…). Un réajustement thérapeutique doit être envisagé dès le deuxième cycle de chimiothérapie en fonction de la tolérance au traitement et/ou du suivi pharmacologique s’il est disponible.
REFERENCE
- Recherche d’un déficit en DPD par phénotypage (dosage de l'uracilémie) avec ajustement des doses du 5-fluorouracil (5FU) et de la capécitabine en cas de déficit partiel et contre-indication du 5FU et de la capécitabine en cas de déficit complet (accord d’experts).
OPTION
- Génotypage du gène DPYD si phénotype DPD (uracilémie) anormal (avis d'experts).
2.3.1. Traitements endoscopiques
2.3.1.1. Traitement endoscopique du cancer superficiel de l’estomac
- La méta-analyse des études rétrospectives asiatiques montre sur 2070 patients une absence de différence significative de survie globale entre les patients opérés et les patients traitées par résection endoscopique (OR 1,18 IC95% 0,76-1,82). En faveur de la résection endoscopique : une durée d’hospitalisation plus courte et un taux de complication plus faible avec un risque relatif (RR) de 0,41 (IC 95% 0,22-0,76). En défaveur de la résection endoscopique : un risque de récidive et de cancer métachrone plus important avec un RR de 5,23 (IC95% 2,43-11,27) et 5,22 (IC95% 2,40-11,34) respectivement (Meng 2016). En 2018, une étude prospective monocentrique portugaise, comparant 153 patients pris en charge endoscopiquement et 101 patients opérés d’emblée, retrouvait des durées moyennes de séjour de 3,5 contre 16,3 jours (p<0,001), un taux de complication sévère de 7.8% versus 21,8% (p=0,003), et une différence significative de qualité de vie à 1 an en faveur du traitement endoscopique, et au prix d’un taux de résection histologiquement complète de 90% vs 99% (p=0.02) dans les groupes endoscopie et chirurgie, respectivement (Libânio 2019). Le niveau de preuve reste faible en raison de l’absence d’étude randomisée.
- En France, moins de 7% des cancers gastriques sont diagnostiqués au stade de cancer superficiel. Malgré l’amélioration des matériels d’endoscopie, la proportion de cancers gastriques diagnostiqués au stade superficiel n’augmente pas au cours du temps. En population, moins de 5% des cancers superficiels sont réséqués par voie endoscopique (Chapelle 2016).
- Depuis 2015, la technique de résection endoscopique recommandée des cancers gastriques superficiels est la dissection sous muqueuse (Pimentel-Nunes 2015). En effet, trois méta-analyses incluant plus de 1000 patients chacune ont confirmé la supériorité de la dissection sous muqueuse sur la mucosectomie en termes de résection en bloc (92% vs 52% ; RR 9.69, IC95% 7.74–12.13), taux de résection R0 (82% vs 42% ; OR 5.66, IC95% 2.92–10.96), et de récidive locale (1% vs 6% ; RR 0.10, IC95% 0.06–0.18), y compris pour les lésions de moins de 10 mm. Si le taux de complications hémorragiques est proche entre les deux techniques (10%), la durée de la procédure de dissection sous muqueuse est plus longue de 59 min en moyenne, et associée à plus de perforations gastriques (4% vs 1% ; RR 4.67, IC95% 2.77–7.87) (Pimentel-Nunes 2015).
- La HAS reconnait la place de la dissection sous muqueuse endoscopique dans le traitement des cancers superficiels de l’estomac, à condition qu’elle soit réalisée en centre expert, par un opérateur qualifié, et au sein d’une équipe spécialisée (anesthésiste, chirurgien digestif, pathologiste, oncologue digestif), pour la prise en charge péri-endoscopique du patient comme pour la décision pluridisciplinaire de traitement ou de surveillance au décours de la résection
(https://www.has-sante.fr/jcms/c_2853383/fr/traitement-endoscopique-par-dissection-sous-muqueuse-des-cancers-superficiels-de-l-estomac). - Le traitement endoscopique s’applique préférentiellement aux adénocarcinomes de type intestinal ; il comporte une évaluation macroscopique de la tumeur (classification de Paris), de son extension en surface (chromo-endoscopie avec coloration à l’indigo carmin ou chromo-endoscopie virtuelle) et en profondeur (écho-endoscopie).
- La résection doit être réalisée en monobloc par dissection sous muqueuse (Pimentel-Nunes 2015).
- Des facteurs disponibles avant la résection tels que la taille de la lésion, la présence d’une ulcération, son caractère peu différencié ou avec un contingent mucineux ou des cellules peu cohésives sur les biopsies, peuvent faire renoncer à la résection. En effet, les lésions peu différenciées de plus de 2 cm ou ulcérées, et les lésions bien différenciées mais ulcérées et de plus de 3 cm ne sont pas des indications de traitement endoscopique du fait du risque élevé d’atteinte ganglionnaire associée (Ono 2021).
- Les autres lésions devront, sous réserve de la confirmation d’absence d’atteinte de la musculeuse en écho-endoscopie, faire l’objet d’une résection endoscopique première, permettant un staging optimal, et un traitement curatif dans plus de trois cas sur quatre. Le caractère curatif du geste est déterminé en RCP, au mieux à l’aide des critères « eCURA » (Hatta 2017) permettant d’estimer le risque de métastase ganglionnaire de la lésion réséquée, et de le mettre en balance avec le risque de la gastrectomie complémentaire pour chaque patient. Les principes généraux qui définissent un traitement endoscopique curatif sont les suivants :
- résection histologiquement complète en profondeur
- profondeur de l’envahissement sous muqueux < 500 micromètres pour les adénocarcinomes bien différenciés
- absence d’emboles veino-lymphatiques
- concernant les adénocarcinomes peu différenciés ou avec un contingent mucineux ou des cellules peu cohésives, la résection peut être considérée comme curative si la lésion est intramuqueuse, de résection histologiquement complète, non ulcérée, et de taille < 2 cm
- en cas de marges latérales positives, un second traitement endoscopique peut être proposé en l’absence de facteurs histologiques défavorables après discussion en RCP
- Après traitement endoscopique d’un cancer superficiel, la première endoscopie de surveillance doit être programmée 3 à 6 mois après la résection, puis l’endoscopie est renouvelée annuellement en raison du risque de cancer métachrone (Pimentel-Nunes 2022). Ces endoscopies sont réalisées avec l’aide d’une chromo-endoscopie, virtuelle ou à l’indigo carmin. Une éventuelle infection à Helicobacter pylori, doit être éradiquée, ce qui réduit le risque de cancer métachrone de moitié dans plusieurs études randomisées contrôlées (Kim 2020) (Choi 2018).
2.3.1.2. Traitement endoscopique palliatif du cancer de l’estomac
Les traitements endoscopiques palliatifs sont possibles sur des formes non opérables (accord d’experts).
- Les tumeurs sténosantes envahissant le cardia ou l’orifice antro-pylorique peuvent être traitées par prothèse métallique expansive non couverte, ou pour ces dernières par une anastomose gastro-jéjunale réalisée entre la grande courbure et le jéjunum proximal sous guidage écho-endoscopique à l’aide de prothèses d’apposition (Teoh 2023) ;
- pour les tumeurs hémorragiques, un traitement par sclérose, plasma argon ou application d’une poudre hémostatique peut-être proposé, avec toutefois un risque élevé de récidive du saignement.
2.3.2. Résection chirurgicale
Les patients dénutris doivent recevoir un support nutritionnel adapté, de préférence par voie orale ou entérale, avant chirurgie. Une « immunonutrition » avant chirurgie digestive majeure semble diminuer la morbidité surtout en cas de dénutrition per-opératoire (Weimann 2021). Suite à des résultats discordants, l’HAS n’a pas retenu l’indication d’une « immunonutrition » pré-opératoire chez les patients ayant un cancer gastrique. Cependant, l’ESPEN 2021 (Muscaritoli 2021) a conservé la recommandation de prescription péri-opératoire d’une « immunonutrition » par ORAL IMPACT® (3 briquettes par jour, à distance des repas, pendant 5 à 7 jours avant la chirurgiel) (accord d’experts) (cf. chapitre TNCD 17 « Nutrition et Activité Physique »).
Par rapport à la laparotomie, la chirurgie laparoscopique a l'avantage de réduire la morbidité opératoire et la durée d’hospitalisation avec un curage ganglionnaire et un taux de résection R0 comparables.
Concernant la gastrectomie des 4/5ème, des études asiatiques ont montré que la gastrectomie distale laparoscopique était non-inférieure à la laparotomie en termes de survie sans récidive et de survie globale (Quan 2016) (Kim 2019) (Hyung 2020) (Son 2022).
Concernant la gastrectomie totale, 2 essais randomisés de plus faibles effectifs menés en population non asiatique, l’étude STOMACH (gastrectomie totale) (van der Wielen N 2021) et l’étude LOGICA (gastrectomie totale ou subtotale) (van der Veen 2021), ont montré des résultats à court terme similaires avec une survie sans récidive non inférieure pour l’approche chirurgicale laparoscopique versus ouverte dans des centres experts. La principale limite de ces études est le recul insuffisant pour l’analyse des résultats à long terme. L’approche laparoscopique est possible dans des centres experts (accord d’experts).
2.3.2.1. Étendue de l’exérèse
REFERENCES
- Pour les cancers de l’antre non linitiques une gastrectomie des 4/5ème est la référence (recommandation : grade A). La ligne de section va du bord droit de la jonction œsogastrique sur la petite courbure à la terminaison de l’arcade gastro-épiploïque sur la grande courbure. La marge de sécurité macroscopique "sur pièce fraiche" (in situ) doit être d’au moins 5 centimètres.
- Pour les linites antrales : la gastrectomie totale est recommandée (la marge de résection duodénale doit être de 1 centimètre sur pièce fraîche) (accord d’experts). Cependant, une gastrectomie des 4/5ème peut être proposée si la marge de résection proximale est > 8 cm (Waddell 2014) (accord d'experts).
- Pour les cancers proximaux la gastrectomie totale est préférable à la gastrectomie polaire supérieure (accord d’experts).
- Pour les cancers du corps gastrique la gastrectomie totale est l’intervention de référence.
- Pour le curage ganglionnaire des cancers de la grosse tubérosité suspects d’être T3 ou T4, une splénectomie doit être discutée (accord d’experts). C’est la seule indication potentielle de splénectomie.
- Pour les cancers envahissant les organes de voisinage, l’exérèse doit être monobloc sans dissection ni rupture de la pièce.
- Rétablissement de la continuité : quelle que soit la gastrectomie il n’y a aucun standard de rétablissement de continuité. Celui-ci est laissé au choix du chirurgien.
- Pour les cancers localement évolués, lorsque la résection est macroscopiquement incomplète, les résidus macroscopiques doivent être repérés par des clips pour faciliter une éventuelle irradiation post-opératoire.
- La gastrectomie n'est pas recommandée en cas de cancer gastrique métastatique, sauf si elle est nécessaire pour soulager les symptômes chez les malades en bon état général (espérance de vie estimée supérieure à 6 mois) lorsque les alternatives thérapeutiques (hémostase endoscopique ou radiothérapie pour les tumeurs hémorragiques ; prothèse œsophagienne ou pyloro-duodénale pour les lésions obstructives) ne sont pas indiquées ou inefficaces. La gastrectomie est préférable à la dérivation lorsqu’elle est techniquement possible (Mariette 2013).
2.3.2.2. Étendue du curage
REFERENCES
- Le curage D2 sans splénectomie (=D1.5) (D1+ curage cœliaque, gastrique gauche, hépatique commune et en cas de gastrectomie proximale, splénique sans splénectomie) est recommandé.
- Un curage D1 est recommandé pour les cancers de stade I, pour les patients à risque opératoire élevé ou pour les gastrectomies prophylactiques chez les patients porteurs d’une mutation constitutionnelle de CDH1 (Norton 2007). La valeur thérapeutique de l’étendue du curage reste controversée. L’allongement de la survie par le curage D2 par rapport au curage D1, suggéré par des études non randomisées, n’est pas démontré. Un curage plus étendu au-delà de D2 ne doit pas être réalisé en dehors d’études cliniques (Hartgrink 2004, Songun 2010).
- La classification actuelle AJCC/UICC TNM (8e édition) recommande l’exérèse d'un minimum de 15 ganglions lymphatiques pour une stadification fiable (Amin 2017).
2.3.2.3. Anatomopathologie
2.3.1.3.1. Assurance qualité de l’exérèse chirurgicale
REFERENCES (accord d'experts)
- L’analyse extemporanée des marges chirurgicales impose des prélèvements sur la totalité de la circonférence gastrique, duodénale ou œsophagienne et doivent être orientés par le chirurgien.
- Études des marges proximales, distales et radiaires : la méthode de mesure des marges, proximale et distale, doit être homogène pour un même centre et précisée dans le compte rendu (mm ou cm). Les marges radiaires intéressent surtout la distance entre la tumeur et le tissu adipeux non péritonisé (ligament gastro-splénique, gastro-hépatique ou gastro-colique), elles sont analysées microscopiquement après repérage à l’encre de Chine de la limite de résection. Elles doivent être indiquées par le chirurgien.
- Étude du curage ganglionnaire : au moins 16 ganglions doivent être analysés dans un curage qu’il soit de type D1 ou D2. L’analyse du ganglion sentinelle et la recherche de micro-métastases n’ont pas actuellement de validation autorisant leur utilisation systématique ou leur prise en compte en pratique courante.
2.3.1.3.2. Compte-rendu anatomopathologique
REFERENCES (accord d'experts)
Il doit comporter au moins :
- Les données macroscopiques (type de résection, localisation, taille tumorale et présence d’une éventuelle linite)
- Le type histologique selon la classification de Lauren et/ou OMS (5ème édition)
- Le grade de différenciation
- L’extension pariétale et ganglionnaire (nombre de ganglions envahis/nombre de ganglions analysés), la classification pT et pN
- La mesure des marges de résection proximale, distale et radiaire permettant de qualifier l’exérèse de R0, R1 ou R2 avec l’aide du compte rendu opératoire
- L’existence d’emboles tumoraux vasculaires, lymphatiques, ou d’engainements péri-nerveux tumoraux
- La réponse à un éventuel traitement néo-adjuvant (TRG)
Biomarqueurs complémentaires indispensables à la prise en charge thérapeutique :
- Statut MMR : dMMR/MSI ou pMMR/MSS évalué par immunohistochimie (IHC) et/ou biologie moléculaire (https://www.cancer.fr/catalogue-des-publications/evaluation-du-statut-mmr-tumoral-argumentaire).
- La recherche d’une surexpression de HER2 par IHC +/- hybridation in situ en cas de maladie non résécable. Les modalités de standardisation de l’IHC ont été publiées (Bartley 2017). Le matériel biopsique doit être abondant, riche en cellules tumorales, et l'immunomarquage doit mettre en évidence un marquage membranaire (complet ou partiel) sur au moins 5 cellules tumorales pour une biopsie et 10 % des cellules pour une pièce opératoire. Le marquage cytoplasmique n'a pas de valeur. Au grossissement 40, l'absence de fixation membranaire est cotée 0, la fixation rare est cotée 1, modérée 2 (visible dès un grossissement 10-20) et intense 3 (visible dès un grossissement 2,5-5).
- Le niveau d’expression de PD-L1 pour les tumeurs non résécables :
- Le score CPS (Combined Positive Score) représente le ratio du nombre de cellules exprimant PD-L1 (incluant les cellules tumorales, les lymphocytes et les macrophages associés à la tumeur) par le nombre total de cellules tumorales viables (X 100). Le CPS ne peut être évalué qu’en présence d’au moins 100 cellules tumorales sur l’échantillon.
- Le score TAP (Tumor Area Positivity) est déterminé sur la lame d’IHC par estimation visuelle de la surface couverte par les cellules tumorales et les cellules immunes associées à la tumeur PD-L1 positives, par rapport à la surface totale de la tumeur, sans comptage précis des cellules.
- La recherche d’une expression de la claudine 18.2 pour les tumeurs non résécables, est réalisée par IHC, le marquage attendu est membranaire, et évalué de façon semi-quantitative en tenant compte à la fois de l'intensité du marquage (faible, modéré, intense) et du pourcentage de cellules tumorales marquées à chaque niveau d'intensité.
2.3.1.3.3. Cas particuliers
- Le diagnostic de linite gastrique est macroscopique (paroi rigide épaisse blanchâtre) avec histologiquement le plus souvent des cellules peu cohésives au sein d’un stroma desmoplasique. L’extension est volontiers sous muqueuse dans la paroi gastrique, lymphophile et péritonéale (Agnes 2017).
- Dans les essais thérapeutiques, les linites gastriques et les adénocarcinomes à cellules peu cohésives sont classiquement classés dans les types diffus par opposition aux tumeurs de type intestinal.
- La recherche d’EBV (Epstein Barr virus) peut se discuter par hybridation in situ, notamment en présence d’un stroma lymphoïde abondant (certaines données suggèrent que les tumeurs EBV positives seraient plus sensibles à l’immunothérapie).
2.3.3. Traitement des formes localisées du cancer gastrique
La résection chirurgicale est la pierre angulaire du traitement des formes localisées résécables du cancer gastrique. Néanmoins, compte tenu du haut risque de récidive, plusieurs approches thérapeutiques complémentaires ont été développées pour augmenter la survie des patients.
2.3.3.1. Protocoles de chimio(radio)thérapie
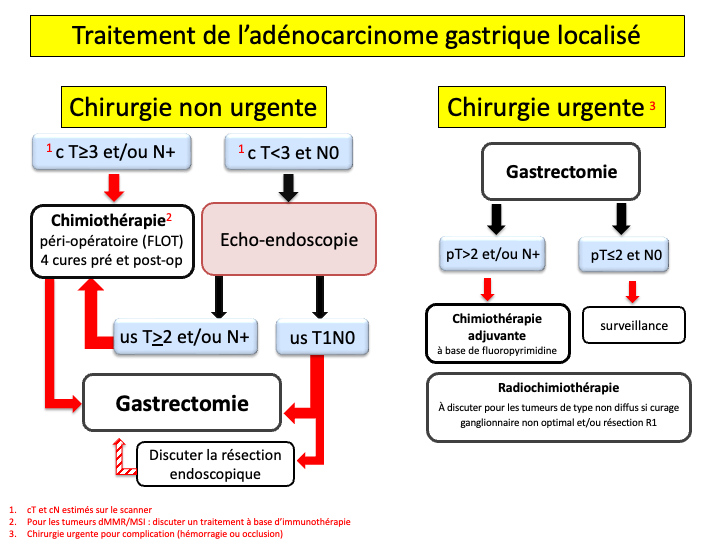
- La chimiothérapie péri-opératoire des formes résécables est le traitement de référence. L’efficacité de cette stratégie a été démontrée initialement par deux études randomisées de chimiothérapie péri-opératoire versus chirurgie seule (Cunningham 2006, Ychou 2011). Les chimiothérapies utilisées étaient, l’association épirubicine-cisplatine-5FU (protocole ECF) et l’association 5FU-cisplatine. La survie sans maladie et la survie globale étaient significativement allongées par la chimiothérapie péri-opératoire (taux de survie globale à 5 ans de 23% et 24% dans le bras chirurgie versus 36% et 38 % dans le bras chimiothérapie). Plusieurs données suggèrent que le schéma 5FU-cisplatine peut être remplacé par le 5FU-oxaliplatine (FOLFOX) (Al Batran 2008a) (Cunningham 2008) (Mary 2016). Par la suite, l’étude FLOT4 comparant l’ECF au schéma FLOT (5FU, oxaliplatine, docétaxel) avec 4 cures en pré- et post-opératoire a montré une supériorité du FLOT sur la survie sans récidive (médiane : 30 versus 18 mois) et sur la survie globale (médiane : 50 versus 35 mois), avec un taux de survie à 5 ans à 45% versus 36% (Al Batran 2019). Tous les sous-groupes bénéficiaient du FLOT péri-opératoire, notamment les tumeurs de la JOG (Siewert I-II-III) ou les formes diffuses (Al Batran 2019). Dans l’étude FLOT4, la chirurgie était réalisée selon les standards de qualité actuels (curage D2).
- La chimiothérapie post-opératoire pour les patients non traités en préopératoire a montré son efficacité. La méta-analyse des données individuelles de 3 838 patients inclus dans 17 études montre un bénéfice de la chimiothérapie post-opératoire à base de fluoropyrimidines (HR 0,82 IC 95% : 0,76-0,90, p<0,001) (Gastric Group 2010). Pour les études européennes, le bénéfice était significatif (HR 0,83 IC 95% : 0,74-0,94). Ces résultats sont confortés par deux essais randomisés asiatiques de phase III ayant comparé respectivement une chimiothérapie adjuvante par XELOX (Noh 2014) et S1 (Sakuramoto 2007) versus surveillance simple montrant un bénéfice significatif en survie globale pour des tumeurs de stades II-III (>pT2 et/ou N+). L’intensification de la chimiothérapie postopératoire par l’irinotécan puis le docétaxel associé au cisplatine n’a pas démontré de bénéfice par rapport au 5FU seul dans une étude italienne de phase III ayant randomisé 1100 patients (Bajetta 2014).
- La chimio-hyperthermie intra-péritonéale (CHIP) peropératoire n’est pas validée pour les formes résécables (résultat de l'étude GASTRICHIP PRODIGE 36 en attente).
- La chimio-radiothérapie post-opératoire, pour les patients non prétraités en préopératoire, a montré son efficacité dans une étude de phase III (MacDonald 2001). Cependant, les critiques principales de cet essai portaient sur 1) le curage ganglionnaire qui était D0 dans 54 % des cas, 2) la toxicité d’un schéma de chimiothérapie obsolète, le FUFOL (5FU en bolus), 3) la technique de radiothérapie en 2D. L’analyse de sous-groupes suggère que la radio-chimiothérapie post-opératoire n’est pas efficace pour les tumeurs à cellules indépendantes (Smalley 2012). L’étude CRITICS est un essai de phase III ayant comparé une stratégie de chimiothérapie péri-opératoire par ECX/EOX versus chimiothérapie préopératoire par ECX/EOX suivie d’une chimio-radiothérapie post-opératoire. Cette étude internationale n’a pas montré d’amélioration de la survie globale avec l’adjonction de la chimio-radiothérapie post-opératoire alors qu’il s’agissait de son objectif principal (Cats 2018). De plus, deux autres études en population asiatique n’ont pas confirmé l’intérêt de la chimio-radiothérapie post-opératoire versus chimiothérapie adjuvante seule après une chirurgie et un curage D2 (Lee 2012) (Park 2021). Par conséquent, la chimio-radiothérapie post-opératoire n’est pas recommandée en cas de résection R0 après une chirurgie et un curage ganglionnaire adéquates, mais peut-être discutée en l’absence de chimiothérapie préopératoire et en cas de chirurgie non optimale.
- La chimio-radiothérapie pré-opératoire, associée à une chimiothérapie péri-opératoire, comparée à une chimiothérapie péri-opératoire seule n’améliore pas la survie globale comme le montre les résultats de l’essai TOPGEAR (Leong 2024).
2.3.3.2. Immunothérapie
L’immunothérapie en combinaison avec la chimiothérapie péri-opératoire est en cours d’évaluation dans plusieurs études de phase III. Les résultats de l’étude Keynote 585 ont montré que l’ajout du pembrolizumab à une chimiothérapie péri-opératoire améliorait le taux de réponse histologique complète sans impact significatif sur la survie sans récidive ni sur la survie globale (Shitara, 2024). Les deux autres études randomisées évaluant pour l’une l’atézolizumab (étude DANTE) (Lorenzen, 2024), pour l’autre le durvalumab (étude MATTERHORN) (Al-Batran, ESMO 2023), en combinaison avec du FLOT péri-opératoire, ont montré une amélioration significative du taux de réponse histologique avec l’immunothérapie. Les résultats de survie pour ces 2 études sont en attente, avec notamment l’évaluation de l’efficacité en fonction du score CPS.
2.3.3.3. Thérapies ciblées
- L’ajout d’un anti-angiogénique (bévacizumab) à une chimiothérapie péri-opératoire (ECX) n’améliore pas la survie des patients.
- Les agents ciblant HER2 ont été évalués pour les tumeurs localisées HER2 positives. L’étude de phase II PETRARCA avait montré une amélioration significative du taux de réponse histologique complète (objectif principal) en cas d’association du trastuzumab+pertuzumab à une chimiothérapie péri-opératoire par FLOT (Hofheinz 2022). Cependant, l’étude n’a pas été poursuivie en phase III compte tenu des résultats négatifs de la combinaison trastuzumab+pertuzumab en situation métastatique (Tabernero 2018). L’étude de phase II INNOVATION n’a pas montré d’amélioration significative du taux de réponse histologique majeure (objectif principal) par l’ajout du trastuzumab +/- pertuzumab à une chimiothérapie péri-opératoire (Wagner, ASCO 2023).
2.3.3.4. Cas particuliers des tumeurs localisées dMMR/MSI
- Les adénocarcinomes gastriques dMMR/MSI de forme localisée semblent avoir un bon pronostic et ne pas bénéficier de la chimiothérapie péri-opératoire ou adjuvante (Pietrantonio 2019) (accord d’experts).
- L’étude NEONIPIGA est un essai de phase II ayant évalué l’intérêt d’une immunothérapie préopératoire par nivolumab + ipilimumab (6 cycles) et post-opératoire par nivolumab seul (9 cycles) chez des patients avec un adénocarcinome de l’estomac ou de la JOG classé cT2-T4Nx avec phénotype dMMR/MSI. Sur les 29 patients analysés, le taux de réponse complète histologique (objectif principal) était de 58,6 % (André 2022).
- L’étude INFINITY est un essai de phase II ayant évalué l’intérêt d’une immunothérapie pré-opératoire par durvalumab + tremelimumab montrant également un taux de réponse histologique complète de 60 % (=9/15 patients) (Pietrantonio, 2025).
- Des études sont en cours de préparation pour évaluer l’intérêt d’une stratégie de conservation d’organe en cas de réponse clinique complète à l’immunothérapie (étude phase 2 DEWI, NCT06059495).
2.3.4. Traitement des formes avancées du cancer gastrique
Les formes avancées incluent les tumeurs localement avancées non résécables et les formes métastatiques.
2.3.4.1. Traitement de première ligne
2.3.4.1.1. La chimiothérapie
- Les protocoles de bi-chimiothérapie à base de fluoropyrimidine et de sels de platine sont considérés comme des standards thérapeutiques. Plusieurs essais ont montré une équivalence en termes d’efficacité entre le 5FU et la capécitabine d’une part, entre le cisplatine et l’oxaliplatine d’autre part (Cunningham 2008) (Al-Batran2008a). Chez les patients âgés (> 65 ans), l'oxaliplatine a un meilleur profil de tolérance que le cisplatine et pourrait être associé à une meilleure survie (Al-Batran2008a). Par ailleurs, l’irinotecan associé au 5FU (FOLFIRI) a aussi montré son efficacité en première ligne de traitement dans une étude de phase III française (Guimbaud 2014) et peut constituer une option thérapeutique en cas de contre-indication aux sels de platine.
- La tri-chimiothérapie à base d’anthracycline a été considérée historiquement comme l’un des premiers standards thérapeutiques (ECF) dans le cancer gastrique métastatique (Webb 1997) (Waters 1999), sans que jamais ne soit démontré réellement l’intérêt des anthracyclines (GASTRIC Group 2013). La place des anthracyclines reste donc controversée, et ce d’autant plus qu’une étude chinoise de non-infériorité a montré récemment que le XELOX, n’était pas inférieur à l’EOX d’une part, et présentait un profil de tolérance et une qualité de vie meilleurs d’autre part (Zhu 2022).
- La tri-chimiothérapie à base de taxane, combinant le cisplatine, 5FU et le docetaxel, administrée toutes les 3 semaines (protocole DCF), a été validée dans un essai de phase III mais au prix d’une plus grande toxicité, limitant ainsi son utilisation en pratique clinique (van Cutsem 2006). Des essais de phase II ont suggéré que les schémas d’administration toutes les 2 semaines avec des doses plus faibles de cisplatine et docetaxel (protocole DCF modifié) (Shah 2015), et que l’utilisation de l’oxaliplatine en remplacement du cisplatine (schémas TEF ou TFOX ou FLOT), avaient une efficacité équivalente à celle du DCF, avec une toxicité moindre (van Cutsem 2015) (Al Batran 2008b). L’étude de phase III GASTFOX a montré une supériorité du TFOX sur le FOLFOX en termes de survie sans progression (médiane : 7,59 vs 5,98 mois), de taux de réponse objective (66,2 % vs 57,5 %), et de survie globale (médiane : 15,08 vs 12,65 mois). En analyse de sous-groupe, le bénéfice du TFOX était plus important pour les patients âgés de moins de 65 ans, ECOG PS 0, ou avec une forme histologique diffuse (Zaanan, 2025).
2.3.4.1.2. Tumeur HER2 négative
- L’étude de phase III internationale Checkmate 649 a évalué l’intérêt de l’ajout du nivolumab (anti-PD1) à une bi-chimiothérapie par XELOX ou FOLFOX en première ligne de traitement des adénocarcinomes de l’estomac et de la JOG HER2 négatifs. Pour les patients avec une tumeur CPS ≥ 5, l’ajout du nivolumab permettait d’améliorer significativement la survie sans progression (qui était l’objectif principal) (médiane : 7,7 versus 6,1 mois ; HR=0,68) et la survie globale (médiane : 14,4 versus 11,1 mois ; HR=0,71) (Janjigian 2021). Le nivolumab a obtenu une AMM et un remboursement en France dans cette indication pour les tumeurs CPS ≥ 5.
- L’étude de phase III internationale Keynote 859 a confirmé les bénéfices en termes de survie globale de l’association du pembrolizumab (anti-PD1) à une bi-chimiothérapie par fluoropyrimidine et sel de platine pour les tumeurs HER2 négatif (Rha 2023). Dans cette étude, la médiane de survie globale était améliorée de façon significative dans le bras pembrolizumab (12,9 mois vs 11,5 mois ; HR=0,78; p<0,0001), avec un bénéfice en survie plus marqué pour les sous-groupes CPS ≥ 1 (médiane SG : 13,0 mois vs 11,4 mois ; HR=0,74) et CPS ≥ 10 (médiane SG : 15,7 mois vs 11,8 mois ; HR=0,65). Ces résultats ont conduit à une AMM du pembrolizumab pour les tumeurs CPS ≥ 1, mais avec un remboursement en France accordée en 2024 uniquement pour les tumeurs CPS ≥ 10.
- Plus récemment, l’étude internationale RATIONALE 305 a également montré l’efficacité d’un autre anticorps anti-PD1, le tislelizumab en association avec une bi-chimiothérapie à base de sels de platine. La médiane de survie globale en population globale (objectif principal) passait de 12,9 à 15,0 mois (HR 0,80), avec cependant, un bénéfice plus important pour les tumeurs TAP ≥ 5 % (médiane de SG : 17,2 vs. 12,6 mois ; HR 0,74) (Qiu 2024). Une AMM pour le tislelizumab a été accordée en 2024 pour les tumeurs TAP ≥ 5 % avec une demande de remboursement en cours d’évaluation en France.
- Le zolbetuximab est un anticorps monoclonal dirigé contre l’isoforme 18.2 de la claudine qui est une protéine impliquée dans les jonctions serrées intercellulaires. Deux essais randomisés internationaux de phase III ont démontré que l’ajout du zolbetuximab à une bi-chimiothérapie à base d’oxaliplatine (FOLFOX pour l’étude SPOTLIGHT, et CAPOX pour l’étude GLOW) permettait d’améliorer de façon significative la survie sans progression (objectif principal) et la survie globale des patients avec une tumeur surexprimant en IHC de façon modérée à intense la claudine 18.2 pour ≥ 75 % des cellules tumorales (Shitara 2023) (Sha 2023). Une AMM a été obtenue en 2024 avec un accès précoce accordé en France depuis janvier 2025 pour les tumeurs HER2 négatives/CPS < 5, en attendant le remboursement.
- L’ajout d’un anti-EGFR (cetuximab ou panitumumab) ou d’un anti-angiogénique (bévacizumab ou ramucirumab) à une chimiothérapie de première ligne à base de sels de platine n’améliore pas la survie des patients.
- D’autres thérapies ciblées (anti-FGFR2, ...) sont en cours d’évaluation.
2.3.4.1.3. Tumeur HER2 positive
- L’étude de phase III ToGA a montré que l’ajout du trastuzumab (Herceptin, anticorps monoclonal ciblant HER2) à une bi-chimiothérapie par fluoropyrimidine (5FU ou capécitabine) plus cisplatine était associé à une augmentation de la survie globale chez les patients avec une tumeur HER2 positive (IHC3+ ou hybridation in situ HIS+) (médiane : 13,8 versus 11,1 mois ; p=0,0046) (Bang 2010). Le bénéfice était plus important quand la tumeur exprimait fortement HER2 (IHC3+ ou IHC2+/HIS+) (médiane : 16,0 versus 11,8 mois). Trois études rétrospectives de faibles effectifs ont évalué le remplacement du cisplatine par l’oxaliplatine. Les résultats suggèrent que cette combinaison aurait une efficacité équivalente (Ryu 2015, Soularue 2015, Gong 2016). En raison de la cardiotoxicité du trastuzumab, la surveillance de la fraction d’éjection ventriculaire gauche (FEVG) par une échographie ou une scintigraphie tous les 3 mois est recommandée par l’ANSM.
- D’autres thérapies ciblant HER2 ont été évaluées dans des essais de phase III et n’ont pas montré d’augmentation significative de la survie, telles que le lapatinib (inhibiteur tyrosine kinase anti HER1 et HER2) testé en combinaison avec le XELOX (Hecht 2016), ou le pertuzumab (anticorps monoclonal anti-HER2) testé en combinaison avec le trastuzumab et la chimiothérapie (Tabernero 2018). D’autres anti-HER2 sont en cours d’évaluation dans des essais de phase III (margetuximab, tucatinib, zanidatamab, etc.).
- L’étude Keynote 811 est un essai de phase III évaluant l’intérêt de l’ajout du pembrolizumab à l’association chimiothérapie + trastuzumab. Les résultats matures ont montré une amélioration statistiquement significative de la survie sans progression et de la survie globale (objectif principal) avec un bénéfice plus marqué pour les tumeurs CPS≥1 sur la survie sans progression (médiane : 10,8 versus 7,2 mois ; HR=0.70) et la survie globale (médiane : 20.1 versus 15.7 mois ; HR=0.79) (Janjigian 2023) (Janjigian 2024). Ces résultats ont permis une AMM européenne pour le pembrolizumab en association avec le trastuzumab + bi-chimiothérapie pour les tumeurs HER2 positives/CPS≥1 avec un accès précoce autorisé en France depuis février 2025 en attendant le remboursement.
2.3.4.2. Traitement de deuxième ligne
- La chimiothérapie cytotoxique par taxane (Ford 2014) ou irinotecan (Thuss Patience 2011) a démontré son efficacité dans des essais de phase III en permettant d’améliorer significativement la survie des patients par rapport à des soins de conforts exclusifs. Ces 2 molécules semblent d’efficacité équivalente sur la base de 2 essais randomisés asiatiques (Hironaka 2013) (Lee 2019). L’irinotecan peut être associé au 5FU (FOLFIRI) sur la base d’une étude de stratégie de phase III (Guimbaud 2014).
- Le ramucirumab, un anticorps monoclonal ciblant le récepteur 2 du VEGF (VEGFR-2), a montré son efficacité dans deux études randomisées de phase III : l’essai REGARD, comparant le ramucirumab en monothérapie aux soins de confort exclusifs (Fuchs 2014), et l’essai RAINBOW comparant l’association ramucirumab-paclitaxel au paclitaxel seul (Wilke 2014). Dans ces deux études, le ramucirumab apportait une amélioration statistiquement significative de la survie sans progression et de la survie globale en deuxième ligne de traitement. Cependant, bien que le ramucirumab ait obtenu une AMM, le Service Médical Rendu (SMR) évalué par la Haute Autorité de Santé (HAS) a été considéré comme insuffisant pour envisager un remboursement en France.
- La poursuite du trastuzumab en L2 en combinaison avec le paclitaxel versus paclitaxel seul n’a pas montré son intérêt dans une essai de phase II asiatique (Makiyama 2020).
- Le trastuzumab-deruxtecan (T-DXd) est un anticorps conjugué à un inhibiteur de topo-isomérase I, qui a été testé en L2 dans l’étude DESTINY GASTRIC-02 à la dose de 6,4 mg/kg / 3 semaines. Il s’agit d’une étude non asiatique de phase II monobras ayant inclus 79 patients présentant une tumeur gastrique métastatique avec un statut HER2 positif (IHC3+ ou IHC2+/FISH+) confirmé par une nouvelle biopsie après progression sous chimiothérapie avec trastuzumab. Le taux de réponse objective (critère d’évaluation principal) en relecture centralisée était de 38%, et les médianes de survie sans progression et de survie globale étaient de 5,6 et 12,1 mois respectivement (Van Cutsem 2023). Cette efficacité du trastuzumab-deruxtecan en L2 sera à confirmer par l’étude de phase III DESTINY GASTRIC 04 dont les résultats sont attendus pour l’ASCO 2025 (DESTINY GASTRIC 04 - NCT04704934).
2.3.4.3. Traitement de la troisième ligne (et plus)
- Le TAS-102 (Lonsurf®) est une chimiothérapie orale combinant la trifluridine/tipiracil. L'étude TAGS est un essai de phase III qui a montré une amélioration significative de la survie globale (objectif principal) en faveur de la trifluridine/tipiracil versus soins de support seuls (5,7 vs 3,6 mois ; HR=0,69 ; p<0,001) chez des patients prétraités par au moins deux lignes de chimiothérapie (Shitara 2018b). La trifluridine/tipiracil a obtenu une extension d’AMM dans cette indication et un remboursement en France.
- Le régorafenib est un inhibiteur de tyrosine kinase multi-cibles à activité anti-angiogénique. L’étude de phase III INTEGRATE IIa communiquée à l’ASCO GI 2023 a montré une amélioration significative de la survie globale (objectif principal) en faveur du régorafenib (160 mg/j, 3 semaines/4) versus soins de support seuls (4,5 versus 4 mois ; HR=0,68; p=0,006) chez des patients prétraités par au moins deux lignes de chimiothérapie (Pavlakis ASCO GI 2023). Ce médicament n’a pas d’AMM dans cette indication. L’étude de phase III INTEGRATE IIb évalue actuellement dans cette même indication un traitement par régorafenib (90 mg/j, 3 semaines/4) + nivolumab versus chimiothérapie (taxane, irinotecan ou TAS-102) (NCT 04879368).
- Une chimiothérapie cytotoxique à base de taxane ou d’irinotecan non utilisée précédemment peut être considérée comme une option thérapeutique malgré l’absence d’essai randomisé en L3 et plus (accord d’experts).
- Le trastuzumab-deruxtecan (T-DXd) a été évalué dans l’essai DESTINY GASTRIC-01 qui est une étude asiatique de phase II randomisée testant en L3 et plus le T-DXd (6,4 mg/kg / 3 semaines) versus chimiothérapie (irinotecan ou taxane) pour les tumeurs HER2 positives (IHC3+ ou IHC2+/FISH+) ayant déjà reçu du trastuzumab en L1. Le taux de réponse objective (critère d’évaluation principal) était de 51% dans le bras T-DXd (42,9% en relecture centralisée) versus 14% dans le bras chimiothérapie (p<0,0001). La survie globale était également significativement améliorée (médiane : 12.5 vs 8.3 mois) (Shitara 2020). Le trastuzumab-deruxtecan a obtenu en 2022 une AMM à partir de la deuxième ligne de traitement mais avec un remboursement en France autorisé qu’à partir de la troisième ligne.
2.3.4.4. Cas particuliers des tumeurs non résécables dMMR/MSI
- Le phénotype dMMR/MSI représente un biomarqueur prédictif majeur de réponse aux inhibiteurs des points de contrôle immunitaires. Plusieurs données issues de cohortes prospectives ou phase II ont montré que l’immunothérapie anti-PD-1 était efficace chez des patients prétraités pour une tumeur MSI/dMMR, indépendamment de la localisation tumorale (Le 2015) (Le 2017) (Marabelle 2019).
- Sur la base de ces données, le pembrolizumab a eu une AMM européenne en 2022 pour les tumeurs métastatiques MSI/dMMR (estomac, intestin grêle, voies biliaires, endomètre) prétraitées par au moins une ligne de chimiothérapie. Cependant, en France, l’immunothérapie n’est pas remboursée dans cette indication malgré le bénéfice clinique apporté.
- Dans le traitement en première ligne du cancer gastrique métastatique dMMR/MSI, les analyses de sous-groupes des essais randomisés suggèrent également une efficacité remarquable de l’immunothérapie anti-PD1 en combinaison avec la chimiothérapie (Janjigian 2021) (Rha 2023) (Qiu 2024).
- L'étude de phase II NO-LIMIT présentée à l’ESMO 2023 a évalué chez 29 patients avec un cancer gastrique métastatique dMMR/MSI une association nivolumab+ipilimumab en L1. Les résultats ont montré un taux de réponse objective de 62% et une médiane de survie sans progression de 13,8 mois (médiane de survie globale non atteinte au moment de l’analyse) (Muro, ESMO 2023).
2.3.4.5. Place de la chirurgie en situation métastatique
- La résection de la tumeur primitive n’a pas d’intérêt. En effet, l'essai randomisé de phase III REGATTA a montré que la gastrectomie sans résection des métastases pour le cancer gastrique oligométastatique n'améliorait pas la survie des patients par rapport à la chimiothérapie seule (Fujitani 2016).
- La résection des métastases ne peut pas être recommandée de manière générale, mais peut être envisagée après discussion en RCP comme approche individuelle dans des cas hautement sélectionnés présentant une maladie oligométastatique et bien contrôlée sous chimiothérapie (accord d’experts) (Al Batran 2017). L'essai de phase III « RENAISSANCE » n'a pas démontré que la résection de la tumeur primitive et résection complète des métastases en plus d'une chimiothérapie systémique améliorait la survie (Al Batran 2024). Cette approche thérapeutique continue à être explorée par l’étude française « SURGIGAST ».
- La cytoréduction chirurgicale et la chimiothérapie hyperthermique intra péritonéale (CHIP) ont montré un intérêt potentiel en cas de carcinose péritonéale limitée (Bonnot 2019) mais sans démonstration formelle de leur efficacité par des essais randomisées de phase III. Récemment, l’étude de phase III GASTRIPEC n’a pas montré de gain en survie globale de la CHIP en complément de la cytoréduction chirurgicale (Rau 2023). D’autres essais randomisés sont en cours pour mieux définir la place de la cytoréduction chirurgicale et de la CHIP dans le traitement du cancer gastrique avec carcinose.
2.3.4.6. Cas particuliers des tumeurs métastatiques symptomatiques
- Pour les tumeurs occlusives et/ou hémorragiques, évaluer la possibilité d’un traitement endoscopique (différentes techniques d’hémostase ; prothèses) ou d’une radiothérapie. A défaut (traitements non indiqués ou inefficaces), discussion d’une gastrectomie. Ne pas retarder le traitement systémique qui peut être efficace sur les symptômes (accord d’experts).
- Pour la radiothérapie palliative à visée hémostatique, un schéma hypofractionné peut être utilisé sur la base d’études rétrospectives (Tey 2017) (accord d’experts), permettant de limiter les venues en radiothérapie et de ne pas interrompre trop longtemps une chimiothérapie potentiellement efficace.
2.4. Indications thérapeutiques
2.4.1. Traitement des formes localisées du cancer gastrique
REFERENCES
- Les dossiers doivent faire l’objet d’une discussion systématique en RCP afin d’établir la stratégie thérapeutique optimale.
- Selon les recommandations européennes (ESGE), la résection endoscopique est à proposer en première intention pour les adénocarcinomes superficiels (T1) à faible risque d’envahissement ganglionnaire (recommandation : grade A). La dissection sous-muqueuse est le traitement de choix pour la plupart des adénocarcinomes à faible risque d’envahissement ganglionnaire (recommandation : grade B) (Pimentel-Nunes 2022).
- La prise en charge doit avoir lieu dans un centre d’endoscopie interventionnelle de référence (niveau 3).
- L’analyse de la pièce de résection permet de vérifier que le traitement endoscopique est curatif sur le plan carcinologique. Le caractère curatif doit être validé en RCP. Si le caractère curatif ne peut être affirmé, une gastrectomie complémentaire doit être proposée.
- Le traitement endoscopique doit s’associer à l’éradication d’Helicobacter pylori en cas de positivité (recommandation : grade A).
- La chimiothérapie péri-opératoire doit être proposée à tous les patients avec une tumeur de stade supérieur à IA (≥T2 et/ou N+) quel que soit le type histologique (recommandation : grade A). Un traitement à base d'immunothérapie est à discuter pour les tumeurs dMMR/MSI résécable (accord d’experts).
- La chimiothérapie de référence est le FLOT (Docétaxel, Oxaliplatine, Acide folinique et 5FU continu sur 24h) avec 4 cures pré et post-opératoire (recommandation : grade A). Pour les patients non éligibles au FLOT (âgés et/ou fragiles), une chimiothérapie péri-opératoire par FOLFOX (4 à 6 cures en pré- et post-opératoires) peut-être proposée (accord d’experts).
- La résection chirurgicale et le curage ganglionnaire doivent être proposés selon les modalités décrites au § 2.3.1.
OPTIONS
- Une chimiothérapie post-opératoire à base de fluoropyrimidine est recommandée chez les patients non traités en préopératoire pour les tumeurs de stade ≥ II (recommandation : grade B). La durée proposée est de 6 mois (accord d’experts). La chimiothérapie peut associer du LV5FU2 (ou capécitabine) avec l’oxaliplatine (FOLFOX, XELOX) (accord d’experts).
- Une chimio-radiothérapie post-opératoire peut être proposée aux patients non traités en pré-opératoire, si la tumeur est de stade II ou III, avec un curage ganglionnaire non optimal et/ou une résection R1, sous réserve de l’état général et nutritionnel du patient (accord d’experts). La chimio-radiothérapie ne semble pas bénéficier aux cancers gastriques de type diffus (Smalley 2012) (accord d’experts). La chimiothérapie par FUFOL du protocole MacDonald (McDonald 2001) peut être remplacée par le LV5FU2 (Dahan 2005) (accord d’experts).
ESSAI CLINIQUE
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions (www.fregat-database.org)
2.4.2. Traitement des formes avancées du cancer gastrique
2.4.2.1. En première ligne
2.4.2.1.1. Tumeur HER2 positive (IHC 3+ ou IHC 2+/FISH+)
REFERENCES
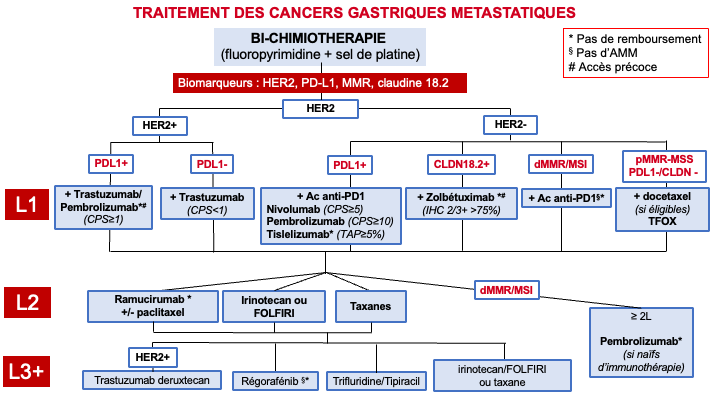
- Fluoropyrimidine + cisplatine + trastuzumab (recommandation : grade A).
- Pour les tumeurs CPS PDL1≥1 : Fluoropyrimidine + sels de platine + trastuzumab + pembrolizumab (recommandation : grade A) (AMM avec accès précoce en France depuis février 2025 en attendant le remboursement pour le moment).
⇢ Surveillance de la FEVG par échographie ou scintigraphie tous les 3 mois.
2.4.2.1.2. Tumeur HER2 négative
REFERENCES
- Pour les tumeurs CPS≥5 : bi-chimiothérapie combinant une fluoropyrimidine avec l’oxaliplatine (FOLFOX ou XELOX) + nivolumab (recommandation : grade A).
- Pour les tumeurs CPS ≥ 10 : bi-chimiothérapie combinant une fluoropyrimidine et sels de platine + pembrolizumab (recommandation : grade A) (AMM pour les tumeurs CPS≥1 mais remboursement en France uniquement pour les tumeurs CPS ≥10).
- Pour les tumeurs claudine 18.2 positives : bi-chimiothérapie combinant une fluoropyrimidine avec l’oxaliplatine (FOLFOX ou XELOX) + zolbetuximab (recommandation : grade A) (AMM avec accès précoce en France depuis janvier 2025 pour les tumeurs CPS < 5 en attendant le remboursement).
- Pour les tumeurs dMMR/MSI : bi-chimiothérapie + anticorps anti-PD1 (accord d’experts) (pas d’AMM ni de remboursement dans cette indication).
- TFOX pour les patients éligibles (âge < 70 ans et/ou ECOG PS 0) à une tri-chimiothérapie (recommandation : grade A). Sinon doublet de chimiothérapie avec une fluoropyrimidine + sels de platine pour les patients non éligibles à une intensification thérapeutique.
ESSAIS CLINIQUES EN L1
- FREGAT : une base de données nationale sur les cancers de l’estomac est ouverte aux inclusions avec pour objectif de collecter les informations de 15 000 patients
https://www.fregat-database.org/fr/ - PRODIGE 73 (LOGICAN) : essai randomisé de phase II comparant Trifluridine/Tipiracil + Oxaliplatine vs FOLFOX (avec immunothérapie dans les 2 bras selon le CPS) chez les patients non-candidats à une trichimiothérapie avec une tumeur HER2 négative/CPS PDL1<5%. Coordinateur : C. de la Fouchardière (Lyon).
https://www.unicancer.fr/wp-content/uploads/sites/2/2022/10/logican_synopsis_v1.1_11-august-2022.pdf - SURGIGAST : essai randomisé de phase III comparant la chimiothérapie seule ou associée à une chirurgie du primitif et des métastases en cas de maladie oligométastatique résécable. Coordinateur : G. Piessen (Lille).
https://clinicaltrials.gov/study/NCT03042169
2.4.2.2. En deuxième ligne
REFERENCES
- Taxane : docetaxel ou paclitaxel (recommandation : grade A)
- Irinotecan monothérapie (recommandation : grade A)
- Paclitaxel+ramucirumab (recommandation : grade A). Cependant le service médical rendu a été évalué insuffisant par la HAS pour envisager un remboursement en France.
- Pembrolizumab pour les patients avec tumeurs de phénotype dMMR/MSI naïfs d’immunothérapie (recommandation : grade B). Ce traitement a une AMM européenne mais n’est pas remboursé en France.
OPTIONS
- FOLFIRI (accord d’experts)
- Ramucirumab (recommandation : grade B). Cependant le service médical rendu a été évalué insuffisant par la HAS pour envisager un remboursement en France.
2.4.2.3. En troisième ligne et plus
REFERENCES
- Trifluridine/tipiracil (recommandation : grade A)
- Régorafénib (recommandation : grade A) (pas d’AMM ni de remboursement)
- Pembrolizumab pour les patients avec tumeurs de phénotype dMMR/MSI naïfs d’immunothérapie (recommandation : grade B). Ce traitement a une AMM européenne mais n’est pas remboursé en France.
OPTIONS
- Taxanes (paclitaxel ou docetaxel) si non utilisés précédemment (accord d’experts).
- Irinotecan monothérapie ou FOLFIRI si non utilisés précédemment (accord d’experts).
- Trastuzumab-deruxtecan en cas de tumeur HER2 positive pré-traitée par trastuzumab en L1 (accord d’experts).
2.5. Surveillance
Peu de travaux ont été publiés sur la surveillance clinique, biologique et radiologique des patients traités pour un cancer de l'estomac (Baiocchi 2015). Aucune étude randomisée n'a démontré l'impact sur la survie d'un protocole de surveillance. Ne doivent être surveillés que les malades éligibles à un traitement efficace en cas de récidive (chirurgie, radiothérapie et/ou chimiothérapie).
2.5.1. Surveillance après traitement curatif
REFERENCES (accord d'experts)
- Surveillance par scanner thoraco abdominopelvien (sans précision de rythme) pendant une durée de 5 ans
- Si gastrectomie totale : vitamine B12 1mg IM/3 à 12 mois +/- folates
- Si splénectomie :
- Vaccination anti-pneumococcique
- Vaccin pneumococcique polyosidique conjugué (VPC13) de 13 sérotypes (Prévenar 13®) puis vaccin pneumococcique polyosidique non conjugué (VPP23) de 23 séroypes (Pneumovax®, Pneumo 23®).
- Si chirurgie réglée : 15 jours avant le geste, vaccination par une dose de VPC13, suivie après un délai d’au moins 8 semaines d’une dose de vaccin VPP23.
- En cas de splénectomie en urgence, même schéma vaccinal à partir de 15 jours après la chirurgie c’est-à-dire vaccination par une dose de VPC13, suivie après un délai d’au moins 8 semaines d’une dose de vaccin VPP23.
- Rappel : Revaccination par VPP23 avec un délai d'au moins 5 ans après le dernier VPP23.
- Vaccination anti-méningocoque (vaccin conjugué tétravalent ACYW135 Nimenrix®) : une dose 15 jours avant la chirurgie réglée ou 15 jours après, si chirurgie en urgence. Rappel à 5 ans.
- Vaccination anti-Haemophilus (Act-Hib®) : une dose 15 jours avant la chirurgie réglée ou 15 jours après, si chirurgie en urgence. Rappel à 10 ans
- Antibioprophylaxie par Oracilline® 1 comprimé à 1M UI matin et soir le plus longtemps possible et au moins 2 ans. Pas d’antibioprophylaxie recommandée pour les malades allergiques aux bêta-lactamines. Conseils classiques aux splénectomisés (antibioprophylaxie avant soins dentaires, consultation rapide en cas de fièvre, carte de splénectomisé …).
- Suivi nutritionnel et dépistage des carences
- Dépistage et prise en charge du dumping syndrome
- Vaccination anti-pneumococcique
OPTIONS (accords d'experts)
- Examen clinique tous les 6 mois pendant au moins 5 ans comportant la recherche de signes de récidive potentielle et de signes de dénutrition qui peuvent imposer un avis spécialisé.
- Si splénectomie vaccination contre la grippe tous les ans.
- Bilan biologique : dosage des marqueurs tumoraux (ACE et CA 19-9) ; la possibilité d’anémie post-gastrectomie totale justifie la surveillance de la numération formule une fois par an.
- Une échographie abdominale tous les 6 mois pendant 3 ans puis tous les ans et un cliché thoracique de face tous les ans pendant 3 ans. Ces 2 dernières propositions peuvent être remplacées par un scanner spiralé thoraco-abdominal tous les 6 mois pendant 3 ans puis surveillance clinique et échographie abdominale comme décrit ci-dessus.
- En cas de gastrectomie partielle, la surveillance endoscopique du moignon gastrique peut débuter à 2 ans, avec une rythmicité à adapter en fonction des constatations endoscopiques et des biopsies (métaplasie, dysplasie) ; Une endoscopie de surveillance à plus long terme est également recommandée (à partir de 10 ans) en raison du risque de cancer du moignon gastrique sur reflux biliaire chronique (accord professionnel).
- Surveillance des récidives péri-anastomotiques (après gastrectomie totale) par échoendoscopie chez des malades sélectionnés à haut risque de récidive anastomotique (exemple : marge envahie et traitée par radiothérapie).
- Après traitement endoscopique d’un cancer superficiel, la première endoscopie de surveillance doit être programmée 3 à 6 mois après la résection, puis l’endoscopie est renouvelée annuellement en raison du risque de cancer métachrone Ces endoscopies sont réalisées avec l’aide d’une chromo-endoscopie, virtuelle ou à l’indigo carmin.
2.5.2. Surveillance après traitement palliatif
Pas de recommandations de surveillance. Le suivi doit s’adapter aux signes cliniques.
2.6. Protocoles thérapeutiques
LV5FU2 simplifié
Acide folinique 400 mg/m2 (ou l-folinique 200 mg/m2) en 2 h dans 250 ml G 5 %.
Rincer puis 5 FU 400 mg/m2 en 10 min (bolus) dans 100 ml de G 5 %
puis 5 FU 2400 mg/m2 en perfusion continue de 46 h dans G 5 % sur diffuseur portable.
Traitement reproduit tous les 14 jours.
LV5FU2s-cisplatine
LV5FU2 simplifié
Cisplatine 50 mg/m2 à J1 en 30 minutes dans 250 ml de chlorure de sodium à 0,9 %
Hydratation obligatoire avant et après le cisplatine, les volumes et l’apport ionique en NaCl, KCl et sulfate de magnésium est variable selon les équipes.
Traitement reproduit tous les 14 jours.
FOLFOX
LV5FU2 simplifié
Oxaliplatine 85 mg/m2 en 2 h dans 250 ml de G 5 % en Y de l'acide folinique à J1
Traitement reproduit tous les 14 jours.
XELOX
Capécitabine 1000 mg/m2 per os 2 fois par jour pendant 14 jours puis 1 semaine de repos
Oxaliplatine 130 mg/m2 IV à J1
Traitement reproduit tous les 21 jours.
5FU-cisplatine-trastuzumab
Trastuzumab 8mg/kg à la première cure puis 6 mg/kg
5FU 800 mg/m2 en perfusion continue de J1 à J5 sur diffuseur portable.
Cisplatine 80 mg/m2 en 1h à J2
Hydratation obligatoire avant et après le cisplatine, les volumes et l’apport ionique en NaCl, KCl et sulfate de magnésium est variable selon les équipes.
Traitement reproduit tous les 21 jours.
Capécitabine-cisplatine-trastuzumab
Trastuzumab 8mg/kg à la première cure puis 6 mg/kg
Capécitabine : 1000 mg/m2 per os 2 fois par jour du soir de J1 au matin de J15
Cisplatine : 80 mg/m2 en 1h à J2
Hydratation obligatoire avant et après le cisplatine, les volumes et l’apport ionique en NaCl, KCl et sulfate de magnésium est variable selon les équipes.
Traitement reproduit tous les 21 jours.
FOLFOX-trastuzumab
Trastuzumab 6 mg/kg à la première cure puis 4 mg/kg
FOLFOX
Traitement reproduit tous les 14 jours.
XELOX-trastuzumab
Trastuzumab 8 mg/kg à la première cure puis 6 mg/kg
Capécitabine 1000 mg/m2 per os 2 fois par jour pendant 14 jours puis 1 semaine de repos
Oxaliplatine 130 mg/m2 IV à J1
Traitement reproduit tous les 21 jours.
FOLFOX-nivolumab
Nivolumab 240 mg IV à J1
FOLFOX
raitement reproduit tous les 14 jours.
XELOX-nivolumab
Nivolumab 360 mg IV à J1
XELOX
Traitement reproduit tous les 21 jours.
XELOX-pembrolizumab
Pembrolizumab 200 mg IV à J1
XELOX
Traitement reproduit tous les 21 jours.
5FU-cisplatine-pembrolizumab
Pembrolizumab 200 mg IV à J1
5FU 800 mg/m2 en perfusion continue de J1 à J5 sur diffuseur portable.
Cisplatine 80 mg/m2 en 1h à J2
Traitement reproduit tous les 21 jours.
FOLFOX-pembrolizumab
Pembrolizumab 400 mg IV toutes les 6 semaines
FOLFOX, 1 cure toutes les 2 semaines
FOLFOX ou XELOX - zolbetuximab
Zolbetuximab 800 mg/m2 dose de charge
puis 600 mg/m2 toutes les 3 semaines ou 400 mg/m2 toutes les 2 semaines
FOLFOX, 1 cure toutes les 2 semaines ou XELOX, 1 cure toutes les 3 semaines
TFOX (ou FLOT modifié)
Docétaxel 50 mg/m2 J1
Oxaliplatine 85 mg/m2 J1
5 Fluorouracile 2400 mg/m2 sur 46h
Ac Folinique 400 mg/m2 (ou l-folinique 200 mg/m2) J1
Traitement reproduit tous les 14 jours.
FLOT
Docétaxel 50 mg/m2 J1
Oxaliplatine 85 mg/m2 J1
5 Fluorouracile 2600 mg/m2 sur 24h
Ac Folinique 400 mg/m2 (ou l-folinique 200 mg/m2) J1
Traitement reproduit tous les 14 jours.
Docétaxel monothérapie
Docétaxel 75 mg/m2 à J1
Traitement reproduit tous les 21 jours.
Paclitaxel
Paclitaxel 80 mg/m2 à J1, J8, J15
Cycle reproduit tous les 28 jours.
FOLFIRI
LV5FU2 simplifié
Irinotécan 180 mg/m2 en perfusion de 90 min dans 250 ml de G5 % en Y de l'acide folinique à J1
Traitement reproduit tous les 14 jours.
Trastuzumab-deruxtecan
Trastuzumab-deruxtecan 6,4 mg/kg en perfusion de 1h30 à la première cure puis en 30 minutes aux cures suivantes
Traitement reproduit toutes les 3 semaines (cycle de 21 jours)
Trifluridine/Tipiracil
35 mg/m2x 2 / jour per os de J1 à J5 puis de J8 à J12, puis arrêt de J13 à J28
Traitement reproduit tous les 28 jours.
Régorafénib
160 mg/j per os de J1 à J21, puis arrêt de J22 à J28 (3 semaines/4)
Traitement reproduit tous les 28 jours.
2.7. Bibliographie
- Agnes A, Estrella JS, Badgwell B. The significance of a nineteenth century definition in the era of genomics: linitis plastica. World J Surg Oncol 2017;15:123.
- Al-Batran SE, Hartmann JT, Probst S, Schmalenberg H, Hollerbach S, Hofheinz R et al. Phase III trial in metastatic gastroesophageal adenocarcinoma with fluorouracil, leucovorin plus either oxaliplatin or cisplatin: a study oft he Arbeitsgemeinschaft Internistische Onkologie. J Clin Oncol 2008;26:1435-42.
- Al-Batran SE, Hartmann JT, Hofheinz R, Homann N, Rethwisch V, Probst S, et al. Biweekly fluorouracil, leucovorin, oxaliplatin, and docetaxel (FLOT) for patients with metastatic adenocarcinoma of the stomach or esophagogastric junction: a phase II trial of the Arbeitsgemeinschaft Internistische Onkologie. Ann Oncol 2008;19(11):1882-7.
- Al Batran SE, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet. 2019;393(10184):1948-1957.
- Al Batran SE, Homann N, Pauligk C, Illerhaus G, Martens UM, Stoehlmacher J, et al. Effect of neoadjuvant chemotherapy followed by surgical resection on survival in patients with limited metastatic gastric or gastroesophageal junction cancer. The AIO-FLOT3 Trial. JAMA Oncol 2017;3(9):1237-1244.
- Al-Batran SE, Lorenzen S, Riera J, Caca K, Mueller C, Stange DE, et al. Effect of chemotherapy/targeted therapy alone vs. chemotherapy/targeted therapy followed by radical surgical resection on survival and quality of life in patients with limited-metastatic adenocarcinoma of the stomach or esophagogastric junction: The IKF-575/RENAISSANCE phase III trial. JCO.2024.42.17_suppl. LBA40.
- Amin MB, Edge S, Greene F, et al. Stomach cancer. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer; 2017:203-220.
- André T, Tougeron D, Piessen G, de la Fouchardière C, Louvet C, Adenis A et al. Neoadjuvant Nivolumab Plus Ipilimumab and Adjuvant Nivolumab in Localized Deficient Mismatch Repair/Microsatellite Instability-High Gastric or Esophagogastric Junction Adenocarcinoma: The GERCOR NEONIPIGA Phase II Study. J Clin Oncol 2023;41(2):255-265.
- Andriulli A, Recchia S, De Angelis C, Mazzucco D, Berti E, Arrigoni A et al. Endoscopic evaluation of patients with biopsy negative gastric linitisplastica. GastrointestEndosc 1990; 36: 611-4
- Bartley AN, Washington MK, Colasacco C, Ventura CB, Ismaila N, Benson AB et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol 2017 Feb;35(4):446-464.
- Baiocchi GL, D’Ugo D, Coit D, Hardwick R, Kassab P, Nashimoto A et al. Follow-up after gastrectomy for cancer: the Charter Scaligero consensus conference. GastricCancer 2016,19:15-20
- Bajetta E, Floriani I, Di Bartolomeo M, Labianca R, Falcone A, Di Costanzo F et al. Randomized tril on adjuvant treatment with FOLFIRI followed by docetaxel and cisplatin versus 5 fluorouracil and folonic acid for radically resected gastric cancer. Ann Oncol 2014;25:1373-8
- Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA) : a phase 3, open-label, randomised controlled trial. Lancet 2010;376:687-97
- Bang YJ, Ruiz EY, Van Cutsem E, Lee KW, Wyrwicz L, Schenker M, et al. Phase III, randomised trial of avelumab versus physician's choice of chemotherapy as third-line treatment of patients with advanced gastric or gastro-oesophageal junction cancer: primary analysis of JAVELIN Gastric 300. Ann Oncol 2018;29:2052-2060.
- Bass AJ, Thorsson V, Shmulevich I, Reynolds SM, Miller M, Bernard B, et al. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014;513:202–9.
- Blair VR, McLeod M, Carneiro F, Coit DG, D'Addario JL, van Dieren JM et al. Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 2020;21(8):e386-e397.
- Bonnot PE, Piessen G, Kepenekian V, Decullier E, Pocard M, Meunier B, et al. Cytoreductive Surgery With or Without Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer With Peritoneal Metastases (CYTO-CHIP study): A Propensity Score Analysis. J Clin Oncol 2019;37(23):2028-2040.
- Brenner H, Arndt V, Stürmer T, Stegmaier C, Ziegler H, Dhom G. Individual and joint contribution of family history and Helicobacter pylori infection to the risk of gastric carcinoma. Cancer 2000;88:274-9.
- Cats A, Jansen E, van Grieken N, Sikorska K, Lind P, Nordsmark M et al. Chemotherapy versus chemoradiotherapy after surgery and preoperative chemotherapy for resectable gastric cancer (CRITICS): an international, open-label, randomised phase 3 trial. Lancet Oncol 2018;19(5):616-628.
- Chao J, Fuchs CS, Shitara K, Tabernero J, Muro K, Van Cutsem E, et al. Assessment of Pembrolizumab Therapy for the Treatment of Microsatellite Instability-High Gastric or Gastroesophageal Junction Cancer Among Patients in the KEYNOTE-059, KEYNOTE-061, and KEYNOTE-062 Clinical Trials. JAMA Oncol 2021;7(6):895-902.
- Chapelle N, Bouvier A-M, Manfredi S, Drouillard A, Lepage C, Faivre J, et al. Early Gastric Cancer: Trends in Incidence, Management, and Survival in a Well-Defined French Population. Ann Surg Oncol 2016;23:3677–83.
- Chen CY, Hsu JS, Wu DC, Kang WY, Hsieh JS, Jaw TS et al. Gastric cancer: preoperative local staging with 3D multi-detector row CT--correlation with surgical and histopathologic results. Radiology 2007;242:472-82.
- Choi IJ, Kook MC, Kim YI, Cho SJ, Lee JY, Kim CG, et al. Helicobacter pylori Therapy for the Prevention of Metachronous Gastric Cancer. N Engl J Med 2018;378(12):1085-1095.
- Cunningham D, Allum W, Stenning S, Thompson J, Van de Velde C, Nicholson M et al. Perioperative Chemotherapy versus Surgery Alone for Resectable Gastroesophageal Cancer. N Engl J Med 2006; 355:11-20.
- Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F et al. Upper Gastrointestinal Clinical Studies Group of the National Cancer Research Institute of the United Kingdom. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med 2008; 358:36-46.
- Dahan L, Atlan D, Bouche O, Mitry E, Ries P, Artru P et al. Postoperative radiochemotherapy after surgical resection of adenocarcinoma of the stomach: can we reduce the toxic effects of Mac Donald regimen by using LV5FU2? Gastroenterol Clin Biol 2005; 29:11-5.
- Defossez G, Le Guyader‑Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Étude à partir des registres des cancers du réseau Francim (www.santepubliquefrance.fr). Juillet 2019.
- Ford HE, Marshall A, Bridgewater JA, Janowitz T, Coxon FY et al. Docetaxel versus active symptom control for refractory oesophagogastric adenocarcinoma (COUGAR-02): an open-label, phase 3 randomised controlled trial. Lancet Oncol 2014;15:78-86.
- Fuchs CS, Tomasek J, Yang CJ, Dumitru F, Passalacqua R, Goswami C et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2014;383:31-9.
- Fujitani K, Yang HK, Mizusawa J, Kim YW, Terashima M, Han SU et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial. Lancet Oncol 2016;17(3):309-318.
- GASTRIC Group. Benefit of adjuvant chemotherapy for resectable gastric cancer.A meta-analysis. JAMA 2010;303: 1729-37.
- GASTRIC (Global Advanced/Adjuvant Stomach Tumor Research International Collaboration) Group. Role of chemotherapy for advanced/recurrent gastric cancer: an individual-patient-data meta-analysis. Eur J Cancer 2013;49:1565-77.
- Gertsen EC, Brenkman H, van Hillegersberg R, van Sandick JW, van Berge Henegouwen MI, Gisbertz SS et al. 18F-Fludeoxyglucose-Positron Emission Tomography/Computed Tomography and Laparoscopy for Staging of Locally Advanced Gastric Cancer: A Multicenter Prospective Dutch Cohort Study (PLASTIC). JAMA Surg 2021;156(12):e215340.
- Gong J, Liu T, Fan Q, Bai L, Bi F, Qin S, Wang J, Xu N, Cheng Y, Bai Y, Liu W, Wang L, Shen L. Optimal regimen of trstuzumab in combination with oxaliplatin/capecitabine in first-line treatment of HER2-positive advanced gastric cancer (CGOG 1001): a multicenter, phase II trial. BMC Cancer 2016 ;16 :68
- Guimbaud R, Louvet C, Ries P, Ychou M, Maillard E, André T et al. Prospective, randomized, multicenter, phase III study of fluorouracil, leucovorin, and irinotecan versus epirubicin, cisplatin, and capecitabine in advanced gastric adenocarcinoma: a French intergroup (Fédération Francophone de Cancérologie Digestive, Fédération Nationale des Centres de Lutte Contre le Cancer and Groupe Coopérateur Multidisciplinaire en Oncologie) study. J Clin Oncol 2014;32:3520-6.
- Hansford S, Kaurah P, Li-Chang H, Woo M, Senz J, Pinheiro H, et al. Hereditary Diffuse Gastric Cancer Syndrome: CDH1 Mutations and Beyond. JAMA Oncol 2015;1(1):23-32.
- Hatta W, Gotoda T, Oyama T, Kawata N, Takahashi A, Yoshifuku Y et al. A Scoring System to Stratify Curability after Endoscopic Submucosal Dissection for Early Gastric Cancer: "eCura system". Am J Gastroenterol 2017;112(6):874-881.
- Hartgrink HH, Van de Velde CJH, Putter H, Bonenkamp JJ, Klein Kranenbarg E, Songun I et al. Extended lymph node dissection for gastric cancer: who may benefit? Final results of the randomized Dutch Gastric Cancer Group Trial.J Clin Oncol 2004; 22: 2069-77.
- Hecht JR, Bang YJ, Qin S, Chung HC, Xu JM, Park JO, et al. Lapatinib in combination with capecitabine plus oxaliplatin (CapeOx) in HER2-positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma (AC): the TRIO-013/LOGIC Trial. A randomized phase III trial. J Clin Oncol 2016;34:443-51.
- Hironaka S, Ueda S, Yasui H, Nishina T, Tsuda M, Tsumura T et al. Randomized, open-label, phase III study comparing irinotecan with paclitaxel in patients with advanced gastric cancer without severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus platinum: WJOG 4007 trial. J Clin Oncol 2013;31:4438-44.
- Hofheinz RD, Merx K, Haag GM, Springfeld C, Ettrich T, Borchert K, et al. FLOT Versus FLOT/Trastuzumab/Pertuzumab Perioperative Therapy of Human Epidermal Growth Factor Receptor 2-Positive Resectable Esophagogastric Adenocarcinoma: A Randomized Phase II Trial of the AIO EGA Study Group. J Clin Oncol 2022;40:3750-3761.
- Hyung WJ, Yang HK, Park YK, Lee HJ, An JY, Wook Kim W, et al. Long-Term Outcomes of Laparoscopic Distal Gastrectomy for Locally Advanced Gastric Cancer: The KLASS-02-RCT Randomized Clinical Trial. J Clin Oncol 2020;38(28):3304-3313.
- Jamel S, Markar SR, Malietzis G, Acharya A, Athanasiou T, Hanna GB. Prognostic significance of peritoneal lavage cytology in staging gastric cancer: systematic review and meta-analysis. Gastric cancer 2018;21(1):10-18.
- Janjigian YY, Shitara K, Moehler M, Garrido M, Salman P, Shen L et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 2021;398(10294):27-40.
- Janjigian YY, Kawazoe A, Bai Y, Xu J, Lonardi S, Metges JP, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet 2023;402:2197-2208.
- Janjigian YY, Kawazoe A, Bai Y, Xu J, Lonardi S, Metges JP, et al. Pembrolizumab in HER2-Positive Gastric Cancer. N Engl J Med 2024;391(14):1360-1362.
- Kim HH, Han SU, Kim MC, Kim W, Lee HJ, Ryu SW, et al. Effect of Laparoscopic Distal Gastrectomy vs Open Distal Gastrectomy on Long-term Survival Among Patients With Stage I Gastric Cancer: The KLASS-01 Randomized Clinical Trial. JAMA Oncol 2019;5(4):506-513.
- Kim HJ, Kim YJ, Seo SI, Shin WG, Park CH. Impact of the timing of Helicobacter pylori eradication on the risk of development of metachronous lesions after treatment of early gastric cancer: a population-based cohort study. Gastrointest Endosc 2020 Sep;92(3):613-622.e1.
- Kumano S, Murakami T, Kim T, Hori M, Iannaccone R, Nakata S et al. T staging of gastric cancer: role of multi-detector row CT. Radiology 2005;237: 961-6.
- Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015;372(26):2509-20.
- Le DT, Durham JN, Smith KN, Wang H,Bartlett BR, Aulakh LK, et al. Mismatch-repair deficiency predicts response of solid tumors to PD-1 blockade. Science. 2017; 357(6349): 409–413.
- Lee J, Lim DH, Kim S, Park SH, Park JO, Park YS, et al. Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial. J Clin Oncol 2012;30(3):268-73.
- Lee KW, Maeng CH, Kim TY, Zang DY, Kim YH, Hwang IG, et al. A Phase III Study to Compare the Efficacy and Safety of Paclitaxel Versus Irinotecan in Patients with Metastatic or Recurrent Gastric Cancer Who Failed in First-line Therapy (KCSG ST10-01). Oncologist 2019;24:18-e24.
- Leong T, Smithers B-M, Michael M, Haustermans K, Wong R, Gebski V, et al. Preoperative Chemoradiotherapy for Resectable Gastric Cancer. N Engl J Med 2024;391(19):1810-1821.
- Li J, Woods SL, Healey S, Beesley J, Chen X, Lee JS, et al. Point Mutations in Exon 1B of APC Reveal Gastric Adenocarcinoma and Proximal Polyposis of the Stomach as a Familial Adenomatous Polyposis Variant. Am J Hum Genet 2016;98(5):830-842.
- Libânio D, Braga V, Ferraz S, Castro R, Lage J, Pita I, et al. Prospective comparative study of endoscopic submucosal dissection and gastrectomy for early neoplastic lesions including patients' perspectives. Endoscopy 2019;51(1):30-39.
- Lorenzen S, Götze TO, Thuss-Patience P, Biebl M, Homann N, Schenk M,et al; AIO and SAKK Study Working Groups. Perioperative Atezolizumab Plus Fluorouracil, Leucovorin, Oxaliplatin, and Docetaxel for Resectable Esophagogastric Cancer: Interim Results From the Randomized, Multicenter, Phase II/III DANTE/IKF-s633 Trial. J Clin Oncol. 2024;42(4):410-420.
- Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345: 725-33
- Makiyama A, Sukawa Y, Kashiwada T, Kawada J, Hosokawa A, Horie Y, et al. Randomized, Phase II Study of Trastuzumab Beyond Progression in Patients With HER2-Positive Advanced Gastric or Gastroesophageal Junction Cancer: WJOG7112G (T-ACT Study). J Clin Oncol 2020;38:1919-1927.
- Marabelle A, Le DT, Ascierto PA, Di Giacomo AM, De Jesus-Acosta A, Delord JP, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol 2020;38(1):1-10.
- Mariette C, Bruyere E, Messager M, Pichot-Delahaye V, Paye F, Dumont F et al. Palliative resection for advanced gastric and junctional adenocarcinoma : which patients will benefit from surgery ? Ann Surg Oncol 2013 ;20 :1240-9
- Mary F, Zaanan A, Boige V, Artru P, Samalin E, Coriat R et al. Perioperative chemotherapy with FOLFOX in resectable gastroesophageal adenocarcinoma in real life practice: An AGEO multicenter retrospective study. Dig Liver Dis 2016;48:1498-1502
- Meng F-S, Zhang Z-H, Wang Y-M, Lu L, Zhu J-Z, Ji F. Comparison of endoscopic resection and gastrectomy for the treatment of early gastric cancer: a meta-analysis. Surg Endosc 2016;30:3673–83.
- Muscaritoli, M., Arends, J., Bachmann, P., Baracos, V., Barthelemy, N., Bertz, H., et al. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutrition 2021, 40(5), 2898–2913.
- Noh SH, Park SR, Yang HK, Chung HC, Chung IJ, Kim SW, et al. Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15(12):1389-96.
- Norton JA, Ham CM, Van Dam J, Jeffrey RB, Longacre TA, Huntsman DG, et al. CDH1 truncating mutations in the E-cadherin gene: an indication for total gastrectomy to treat hereditary diffuse gastric cancer. Ann Surg 2007;245:873-9.
- Ono H, Yao K, Fujishiro M, Oda I, Uedo N, Nimura S, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer. Dig Endosc 2021;33(1):4-20.
- Park SH, Lim DH, Sohn TS, Lee J, Zang DY, Kim ST et al. A randomized phase III trial comparing adjuvant single-agent S1, S-1 with oxaliplatin, and postoperative chemoradiation with S-1 and oxaliplatin in patients with node-positive gastric cancer after D2 resection: the ARTIST 2 trial. Ann Oncol 2021;32(3):368-374.
- Pietrantonio F, Miceli R, Raimondi A, Kim YW, Kang WK, Langley RE et al. Individual Patient Data Meta-Analysis of the Value of Microsatellite Instability As a Biomarker in Gastric Cancer. J Clin Oncol 2019;37(35):3392-3400.
- Pietrantonio F, Randon G, Di Bartolomeo M, Luciani A, Chao J, Smyth EC, et al. Predictive role of microsatellite instability for PD-1 blockade in patients with advanced gastric cancer: a meta-analysis of randomized clinical trials. ESMO Open 2021;6(1):100036.
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, Repici A, Vieth M, De Ceglie A, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015;47(9):829-54.
- Pimentel-Nunes P, Libânio D, Bastiaansen BA, Bhandari P, Bisschops R, Bourke MJ et al. Endoscopic submucosal dissection for superficial gastrointestinal lesions: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2022;54(6):591-622.
- Pouw RE, Barret M, Biermann K, Bisschops R, Czakó L, Gecse KB, et al. Endoscopic tissue sampling-Part 1: Upper gastrointestinal and hepatopancreatobiliary tracts. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2021 Nov;53(11):1174-1188.
- Qiu M-Z, Oh D-Y, Kato K, Arkenau T, Tabernero J, Correa M-C , et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first line treatment for advanced gastric or gastro-oesophageal junction adenocarcinoma: RATIONALE-305 randomised, double blind, phase 3 trial. BMJ 2024 May 28:385:e078876.
- Quan Y, Huang A, Ye M, Xu M, Zhuang B, Zhang P, Yu B, Min Z. Comparison of laparoscopic versus open gastrectomy for advanced gastric cancer: an updated meta-analysis. Gastric Cancer 2016;19:939-50.
- Raimondi A, Lonardi S, Murgioni S, Cardellino G, Tamberi S, Strippoli A, et al. Tremelimumab and durvalumab as neoadjuvant or non-operative management strategy of patients with microsatellite instability-high resectable gastric or gastroesophageal junction adenocarcinoma: the INFINITY study by GONO. Ann Oncol 2025;36(3):285-296.
- Ramos RF, Scalon FM, Scalon MM, Dias DI. Staging laparoscopy in gastric cancer to detect peritoneal metastases: A systematic review and meta-analysis. Eur J Surg Oncol 2016 Sep;42(9):1315-21.
- Rau B, Lang H, Königsrainer A, Gockel I, Rau H, Seeliger H, et al. Effect of Hyperthermic Intraperitoneal Chemotherapy on Cytoreductive Surgery in Gastric Cancer With Synchronous Peritoneal Metastases: The Phase III GASTRIPEC-I Trial. J Clin Oncol 2023:JCO2202867. doi: 10.1200/JCO.22.02867.
- Rha SY, Oh DY, Yañez P, Bai Y, Ryu MH, Lee J, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2023 doi.org/10.1016/S1470-2045(23)00515-6
- Rokkas T. A systematic review and meta-analysis of the role of Helicobacter pylori eradication in preventing gastric cancer. Ann Gastroenterol 2017;30:414-23.
- Ryu MH, Yoo C, Kim JG, Ryoo BY, Park YS, Park SR, Han HS, Chung IJ, Song EK, Lee KH, Kang SY, Kang YK. Multicenter phase II study of trastuzumab in combination with capecitabine and oxaliplatin for advanced gastric cancer. Eur J Cancer 2015;51:482-8.
- Sakuramoto S, Sasako M, Yamaguchi T, Kinoshita T, Fujii M, Nashimoto A, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med 2007;357(18):1810-20.
- Shah MA, Janjigian YY, Stoller RG, Shibata S, Kemeny M, Krishnamurthi SS, Su YB et al. Randomized multicenter phase II of modified docetaxel, cisplatin, fluoroucil (mDCF) versus DCF plus growth factor support in patients with metastatic gastric adenocarcinoma: a study of the US gastric cancer consortium. J Clin Oncol 2015;33:3874-9.
- Shah MA, Shitara K, Ajani JA, Bang YJ, Enzinger P, Ilson D, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nature Medicine 2023; 29:2133–2141.
- Shitara K, Doi T, Dvorkin M, Mansoor W, Arkenau HT, Prokharau A, et al. Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2018;19:1437-1448.
- Shitara K, Bang YJ, Iwasa S, Sugimoto N, Ryu MH, Sakai D, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med 2020;382(25):2419-2430.
- Shitara K, Lordick F, Bang YJ, Enzinger P, Ilson D, Shah MA, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2023;401:1655-1668.
- Shitara K, Rha SY, Wyrwicz LS, Oshima T, Karaseva N, Osipov M, et al; KEYNOTE-585 investigators. Neoadjuvant and adjuvant pembrolizumab plus chemotherapy in locally advanced gastric or gastro-oesophageal cancer (KEYNOTE-585): an interim analysis of the multicentre, double-blind, randomised phase 3 study. Lancet Oncol. 2024 Feb;25(2):212-224.
- Smalley SR, Benedetti JK, Haller DG, Hundahl SA, Estes NC, Ajani JA, et al. Updated analysis of SWOG-directed Intergroup 0116: A phase III trial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection. J Clin Oncol 2012;30:2327-33.
- Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet 2020;396(10251):635-648.
- Son SY, Hur H, Hyung WJ, Park YK, Lee HJ, An JY, et al. Laparoscopic vs Open Distal Gastrectomy for Locally Advanced Gastric Cancer5-Year Outcomes of the KLASS-02 Randomized Clinical Trial. JAMA Surg. 2022 Jul 20:e222749.
- Songun I, Putter H, Kranenberg EM, Sasako M, van de Velde CJ. Surgical treatment of gastric cancer : 15-year follow-up results of therandomisednationwide Dutch DID2 trial. Lancet Oncology 2010 ;11 :439-49.
- Soularue É, Cohen R, Tournigand C, Zaanan A, Louvet C, Bachet JB, Hentic O, Samalin E, Chibaudel B, de Gramont A, André T. Efficacy and safety of trastuzumab in combination with oxaliplatin and fluorouracil-based chemotherapy for patients with HER2-positive metastatic gastric and gastro-oesophageal junction adenocarcinoma patients: a retrospective study. Bull Cancer 2015;102:324-31
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021 May;71(3):209-249.
- Tabernero J, Hoff PM, Shen L, Pertuzumabplus trastuzumab and chemotherapy for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (JACOB): final analysis of a double-blind, randomised, placebo-controlled phase 3 study. Lancet Oncol 2018;19:1372-1384.
- Teoh AYB, Lakhtakia S, Tarantino I, Perez-Miranda M, Kunda R, Maluf-Filho F, et al. Endoscopic ultrasonography-guided gastroenterostomy versus uncovered duodenal metal stenting for unresectable malignant gastric outlet obstruction (DRA-GOO): a multicentre randomised controlled trial. Lancet Gastroenterol Hepatol 2023 Dec 4:S2468-1253(23)00242-X. doi: 10.1016/S2468-1253(23)00242-X.
- Tey J, Soon YY, Koh WY, Leong CN, Choo BA, Ho F, et al. Palliative radiotherapy for gastric cancer: a systematic review and meta-analysis. Oncotarget. 2017; 8:25797-25805.
- Thuss-Patience PC, Kretzschmar A, Bichev D, Deist T, Hinke A, Breithaupt K et al. Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer- A randomised phase III study of the Arbeitsgemeinschaft internistische onkologie (AIO). Eur J Cancer 2011;47:2306-14.
- Van Cutsem E, Moiseyenko VM, Tjulandin S et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol 2006;24:4991-7.
- Van Cutsem E, Boni C, Tabernero J, Massuti B, Middleton G, Dane F et al. Docetaxel plus oxaliplatin with or without fluorouracil or capecitabine in metastatic or locally recurrent gastric cancer: a randomized phase II study. Ann Oncol 2015;26:149-56.
- Van Cutsem E, Di Bartolomeo M, Smyth E, Chau I, Park H, Siena S, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol 2023;24:744-756.
- van der Veen A, Brenkman HJ, Seesing MF, Haverkamp L, Luyer MD, Nieuwenhuijzen GA et al. Laparoscopic Versus Open Gastrectomy for Gastric Cancer (LOGICA): A Multicenter Randomized Clinical Trial. J Clin Oncol 2021;39(9):978-989.
- van der Wielen N, Straatman J, Daams F, Rosati R, Parise P, Weitz J et al. Open versus minimally invasive total gastrectomy after neoadjuvant chemotherapy: results of a European randomized trial. Gastric Cancer 2021;24(1):258-271.
- Waddell T, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D. Gastric cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Eur J Surg Oncol 2014;40:584-591.
- Waters JS, Norman A, Cunningham D, Scarffe JH, Webb A, Harper P et al. Long-term survival after Epitubicin, Cisplatin and Fluorouracil for gastric cancer: results of a randomized trial. Br J Cancer 1999; 80: 269-72.
- Webb A, Cunningham D, Scarffe JH, Harper P, Norman A, Joffe JK et al. Randomized trial comparing epirubicin, cisplatin and fluorouracil versus fluorouracil, doxorubicin and methothrexate in advanced esophagogastric cancer. J Clin Oncol 1997;15:261-7.
- Weimann A, Braga M, Carli F, Higashiguchi T, Hübner M, Klek S, et al. ESPEN practical guideline: Clinical nutrition in surgery. Clin Nutr 2021;40(7):4745-4761.
- Wilke H, K Muro, Van Cutsem E, Oh SC, Bodoky G, Shimada Y, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel I patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomized phase 3 trial. Lancet Oncol 2014;15:1224-35.
- Ychou M, Boige V, Pignon JP., Conroy T., Bouché O., Lebreton G et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: An FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011;29:1715-21.
- Zaanan A, Bouché O, de la Fouchardière C, Le Malicot K, Pernot S, Louvet C, et al. TFOX versus FOLFOX in first-line treatment of patients with advanced HER2-negative gastric or gastro-oesophageal junction adenocarcinoma (PRODIGE 51- FFCD-GASTFOX): an open-label, multicentre, randomised, phase 3 trial. Lancet Oncol 2025 ; 23:S1470-2045(25)00130-5.
- Zhu XD, Huang MZ, Wang YS, Feng WJ, Chen ZY, He YF et al. XELOX doublet regimen versus EOX triplet regimen as first‐line treatment for advanced gastric cancer: An open‐labeled, multicenter, randomized, prospective phase III trial (EXELOX). Cancer Commun (Lond). 2022; 42(4): 314–326

